책임저자:오창권, 경기도 수원시 영통구 원천동 산 5 아주대학교 의과대학 외과학교실, 443-721 Tel: 031-219-5199, Fax: 031-219-5755 E-mail: ohck@ajou.ac.kr
접수일 : 2009년 8월 21일, 심사일 : 2009년 11월 6일 게재승인일 : 2009년 11월 23일
신이식 수술 전후 예방적 항생제 투여의 효용성에 대한 연구
아주대학교 의과대학 외과학교실
1, 신장내과학교실
2, 비뇨기과학교실
3최성욱1ㆍ오창권1ㆍ김지혜1ㆍ신규태2ㆍ김흥수2ㆍ김세중3ㆍ김선일3
Routine Perioperative Antibiotic Prophylaxis in Renal Transplantation:
It Makes No Difference for Bacterial Infections
Seong-Uk Choi, M.D.
1, Chang-Kwon Oh, M.D.
1, Ji-Hye Kim, R.N.
1, Gyu-Tae Shin, M.D.
2, Heungsoo Kim, M.D.
2, Se-Jung Kim, M.D.
3and Sun Il Kim, M.D.
3Departments of Surgery, Division of transplantation
1, Nephrology
2and Urology
3, Ajou University School of Medicine, Suwon, Korea
Background: Although it has been a popular practice to use preventative antibiotics for the kidney recipients, it could increase the cost, encourage the growth of resistant micro-organism and have adverse effects. There has been no reported concrete evidence about the benefits and risks of using peri-operative prophylactic antibiotics for an immunosuppressed population.
Therefore, we retrospectively evaluated the differences in the incidences of bacterial infection and adverse events after transplant surgery according to using peri-operative prophylactic antibiotics.
Methods: We reviewed retrospectively 106 cases of renal transplantations (cadaver donor: 42 cases, living donor: 64 cases) that were performed at Ajou University Hospital, Korea from January, 2006 to December, 2008. We divided the cases into two groups: Group A (n=41; 38.7%) included the patients who did not receive prophylactic antibiotics and Group B (n= 65;
61.3%) included the patients who did receive prophylactic antibiotics. We analyzed the infectious complications that occurred within 1 month after renal transplantation.
Results: In Group A, most patients (62 cases, 95.3%) used a 1
stgeneration cephalosporin. The incidence of wound infection after kidney transplant for the 65 patients who received prophylactic antibiotics was 1.5%, compared to 2.5% for the 41 patients who did not receive prophylactic antibiotics.
Conclusions: This retrospective study could not demonstrate a statistically significant difference in the rates of infectious complications between the two groups, although renal transplantation is considered to be a clean-contaminated surgery.
But in order to obtain a definite conclusion, we need a bigger cohort in a prospective study.
Key Words: Kidney transplantation, Infection, Antibiotic prophylaxis 중심 단어: 신장이식, 감염, 항생제
서 론
새로운 면역억제제의 개발, 수술 기술 및 이식 후 환자 관리 발달, 예방적 항생제와 치료제의 발달로 이식신 생 존율과 환자의 생존율이 향상되어 신장이식은 말기 신질 환의 효율적인 신 대체 요법이 되었다. 보다 강력한 면역
억제제의 등장으로 거부반응의 빈도는 감소하였으나 이식 환자의 기회감염의 가능성은 높아지게 되었다. 따라서 거 부반응과 감염은 이식신의 성공여부를 결정하는 두 가지 장애요소로 서로 밀접한 관계를 보여주고 있다(1,2). 1980 년 이전의 신이식 환자들의 수술 후 1년 동안 약 60%의 환자에서 심각한 감염이 발생하였고 사망률은 50%에 이 르렀다. 현재 이식 후 1년간 감염에 의한 사망률은 5% 이 하지만 감염은 여전히 중요한 고려의 대상이다(3). 현재 많은 기관에서 이식 후 발생하는 세균성 감염을 예방하는 목적으로 항생제 사용을 보편화하고 있다(4,5). 하지만 항 생제 사용은 비용의 증가, 내성균 출현 및 부작용을 유발 할 수 있다. 신이식은 clean-contaminated 수술로 예방적
항생제 사용에 관하여 연구한 논문이 많이 발표되었다.
하지만 예방적 항생제를 사용하지 않은 환자군에서의 감 염 발생률에 대한 연구는 적은 편이다. 따라서 본원에서 시행한 신이식 환자 중 예방적 항생제를 사용하지 않은 환자군과 사용한 환자군을 비교하여 감염 발생의 차이 및 항생제의 역할에 대하여 후향적 연구를 하였다.
재료 및 방법 1) 대상
2006년 1월부터 2008년 12월까지 아주대학교 병원에 서 신장이식을 시행한 환자 중 최소 1개월 이상의 추적 관찰이 가능하였던 106명의 환자를 대상으로 의무기록, 방사선 검사 결과, 균 배양 검사를 후향적으로 검토하고 자료를 분석하였다. 수술 후 1개월 이내의 세균성 감염 양상을 분석하였고 바이러스 또는 진균 감염은 대상에서 제외하였다. 환자의 연령, 성별, 공여자의 유형, 당뇨 및 이식 전 투석 방법, 사용한 면역억제제의 종류, 수술 전 항생제 사용 여부, 수술시간, 요-방광 역류, body mass index (BMI)와 감염발생을 비교하였다.
본원에서는 다음과 같이 표준화된 수술방식을 사용하였 다. 수술 직전 shaving을 시행하였고 betadine (10 g/L)으로 먼저 skin prep을 시행하였고 ethanol (83 mg/L)로 skin prep을 시행하였다. 충분히 건조시킨 후 betadine (10 g/L) 으로 prep하였다. 환자 마취 후 3-way foley 카테터를 삽 입 후 방광을 betadine solution으로 세척하였다. 상처 봉 합 시 국소적 항생제 사용은 없었다. 106명의 환자를 예방 적 항생제 투여군과 투여하지 않은 군으로 분류하였고 항 생제는 수술 직전 1세대 세팔로스포린 항생제(cefazolin) 1 g 정주 투여하였다(6). 수술 후 항생제는 수술당일부터 약 3∼4일간 1세대 세팔로스포린 항생제(cefazolin) 1 g을 1일 3회 정주하였고 추가 감염이 확인된 경우 또는 기증자 의 감염이 확인되었을 경우 항생제 변경 또는 추가하였다.
모든 환자에게 Pneumocystis carinii를 예방하기 위해 수술 후부터 trimethoprim 80 mg/sulfamethoxazole 400 mg을 일 2회, 주 2일 경구로 투여하였다. 수술 시 중심정맥관 및 도뇨관 삽입을 하였고 각각 수술 후 각각 4일과 5일에 제거하였다.
2) 면역억제제의 사용
주 면역억제제는 기본적으로 calcineurin inhibitor (CNI) 인 cyclosporine 또는 tacrolimus를 사용하였다. 106명 중 96.2%의 환자(102명)에게 3제 요법을 기본으로 하여 CNI, mycophenolate mofetil (MMF), steroid를 사용하였고 2제
요법을 사용 시 CNI, steroid를 사용하였다(4명, 3.8%).
95명의 환자에서(89.6%) basiliximab (SimulectⓇ)을 수술 당일 및 수술 후 4일에 각각 20mg IV 투여하였다.
Steroid는 수술 2일 전부터 prednisolone 20 mg을 경구 복용하였고 수술 당일 methyl-prednisolone 500 mg, 수 술 후 1일 250 mg, 2일 125 mg, 3일 60 mg으로 감량 후 4일부터 prednisolone 30 mg을 경구 복용하였다. 3일에 prednisolone 2.5 mg씩 감량하였고 외래에서 지속적으로 추적 관찰 하였다.
3) 감염의 정의
감염을 크게 창상 감염, 저류액 감염, 요로 감염, 중심 정맥관 및 수술 시 사용한 배액관 감염, 호흡기 감염 및 균혈증으로 구분하였다. 감기 등 상기도 감염과 경한 피 부질환은 연구대상에서 제외되었다.
발열의 정의를 겨드랑이 체온이 38.3oC 이상, 1시간 이상 지속된 경우로 정의하였고 수혈, 약물, 거부반응 등 의 원인으로 인한 발열은 제외하였다. 발열 시 감염원을 확인하기 위해 흉부 방사선 검사, 혈액 배양 검사 2회, 객담 검사 및 요 배양 검사를 시행하였다. 세부적 감염의 정의는 다음과 같다.
창상 감염은 수술 후 30일 이내에 수술 부위의 피부, 피하, 근막과 근육을 포함한 피부 연조직에 발생한 감염 으로 절개부위에 농성 분비물이 있거나 감염이 의심되는 부위에서 시행한 배양 검사에서 균이 자란 경우, 또는 의 료진의 이학검사상 통증, 압통, 부종, 발적, 발열 등 감염 소견을 1가지 이상 보이는 경우로 정의하였다.
요로 감염은 발열, 절박뇨, 빈뇨, 배뇨통, 치골 위 방광 압통 중 한 가지의 증상 또는 징후와 함께 요 배양 검사에 서 균 집락 수가 105/mL 이상인 경우 또는 위에 열거한 2가지 이상의 증상 또는 징후와 함께 소변에서 leukocyte esterase 또는 nitrate가 보이거나 농뇨(≥10 WBC/mm3) 가 있는 경우로 정의하였다. 호흡기 감염은 발열 또는 백 혈구 증가증 또는 감소를 보이면서 흉부 방사선 음영이 지속적으로 남아 있거나 진행한 경우 또는 객담의 양상변 화, 호흡기 증상, 폐음의 변화, 가스 교환의 이상 중 2가지 이상이 동반될 경우로 정의하였다. 균혈증은 1회 이상 혈 액 배양에서 균이 검출된 경우로 정의하였다. 카테터 관 련 감염은 카테터 말단부 배양 검사와 혈액 배양 검사에 서 같은 균이 동정된 경우로 정의하였다. 저류액 감염은 임상적으로 발열을 동반하면서 영상학적 검사와 함께 천 자 및 흡인하여 시행한 검사상 균이 동정된 경우로 정의 하였다.
Table 1. Demographic characteristics of renal transplant reci- pients (n=106)
No PAP (n=41)
PAP
(n=65)
PGender Male (n=66) Female (n=40) Recipient age (yrs) Donor type Living donor Cadaver donor ESRD duration (months) Mode of dialysis HD
PD None Diabetes VUR VUR (+) VUR (−) Undetermined BMI(kg/m
2) <20 <20∼25 >25
Cyclosporine based +MMF+steroid +sirolimus+steroid +steroid0
Tacrolimus based +MMF+steroid +sirolimus+steroid +steroid
22 (33.3%)/66 19 (47.5%)/40 39.9±11.1 23 (35.9%)/64 18 (42.9%)/42 31.3±31.3 23 (33.8%)/68 12 (50.0%)/24 6 (42.9%)/14 5 (27.8%)/18 8 (42.1%)/19 23 (37.7%)/61 10 (38.5%)/26 13 (43.3%)/30 21 (32.3%)/65 7 (63.6%)/11 16 (20.8%)/77
16 0 2 25 (86.2%)/29
23 0 2
44 (66.7%)/66 21 (52.5%)/40 42.8±10.5 41 (64.1%)/64 24 (57.1%)/42 32.2±38.8 45 (66.2%)/68 12 (50.0%)/24 8 (57.1%)/14 13 (72.2%)/18 11 (57.9%)/19 38 (62.3%)/61 16 (61.5%)/26 17 (56.7%)/30 44 (67.7%)/65 4 (36.4%)/11 61 (79.2%)/77
54 5 4 (13.8%)/29
4 0 0
0.147 0.459
0.474 0.906
0.354 0.427
0.942
0.118
0.000
Abbreviations: PAP, perioperative antibiotic prophylaxis; ESRD, end stage renal disease; HD, hemodialysis; PD, peritoneal dialysis;
VUR, vesico-ureteral reflux; BMI, body mass index; MMF, myco- phenolate mofetil.
4) 통계분석
자료는 숫자와 백분율(%) 및 평균 ± 표준편차로 표시 하였다. 환자군의 특성을 분석하기 위해 기증자 성별 및 연령, 수여자 성별 및 연령, 기증자의 형태(생체 공여, 뇌 사자 공여), 요-방광 역류 유무, 수여자 당뇨 유무, body mass index, 말기 신부전 기간, 거부반응 유무, 수술 시 간, 이식 전 투석 방식, 면역억제제 종류를 항생제 사용 군과 사용하지 않은 군으로 구분하여 t-검정을 사용하였 다. 예방적 항생제 사용 유무, 기증자 성별 및 연령, 수여 자 성별 및 연령, 기증자의 형태(생체 공여, 뇌사자 공 여), 요-방광 역류 유무, 수여자 당뇨 유무, BMI, end stage renal disease (ESRD) 기간, 거부반응 유무, 수술 시간, 이식 전 투석 방식, 면역억제제 종류와 창상 및 요 로 감염, 균혈증, 폐렴, 도관 관련 감염 등과 비교하였고 Chi-square 및 Cochran-Mantel-Haenszel statistics를 이용 하여 분석하였다. 통계분석을 위하여 영문판 SPSS 12.0 (SPSS Inc., Chicago, IL, USA)을 사용하였고, 통계적 유 의 수준은 P<0.05로 하였다.
결 과 1) 대상
106명의 이식 환자가 연구의 대상이 되었으며 환자의 역학적 특징은 Table 1과 같다. 106명의 환자 중 41명의 환자에서 예방적 항생제를 사용하지 않았으며 65명의 환 자에서 예방적 항생제를 사용하였고 신-췌장 동시 이식을 시행한 경우는 2예로 모두 예방적 항생제를 사용하였다.
생체 공여 신장이식은 64예(60.4%) 시행하였으며 뇌사 자 공여는 42예(39.4%) 시행하였다. 남자 환자는 66명, 여 자 환자는 40명으로 남녀 비는 1.65:1, 평균 연령은 41.7±10.8세였다. 예방적 항생제 투여군은 65명이며 평 균 연령은 42.8±10.5세, 예방적 항생제를 투여하지 않은 군은 41명으로 평균연령은 39.9±11.1세로 두 군의 차이는 없었다. 말기 신부전으로 신이식을 시행하게 된 원인 질환 은 원인 미상의 경우가 60예로 가장 많았으며 다음으로 I g A nephropathy 18예, diabetic nephropathy 15예로 확 인 되었다. 이식 전 투석 방식으로는 혈액투석이 68명 (64.1%), 복막 투석이 24명(22.6%)으로 혈액투석이 더 선 호되었으며 예방적 항생제 사용하지 않은 군에서는 혈액 투석 23명(21.7%), 복막투석 12명(11.3%)으로 확인되었고 예방적 항생제 사용군에서는 혈액 투석 45명(42.5%), 복막 투석 12명(11.3%)으로 확인되었다. 당뇨 진단을 받은 환자 는 18명(16.9%)으로 예방적 항생제 사용군은 13명, 사용하
지 않은 군에서는 5명이었으며 통계적인 의미는 없었다.
예방적 항생제 사용군에서 BMI에 따른 분포는 20 미만 17 명(16.0%), 20∼25 미만 44명(41.5%), 25 이상 4명(3.8%), 예방적 항생제를 사용하지 않은 군에서는 20 미만 13명 (12.3%), 20∼25 미만 21명(19.8%), 25 이상 7명(6.6%)으 로 두 군간의 차이는 없었다. 예방적 항생제 사용군에서 요-방광 역류가 있는 경우는 11명(10.4%), 없는 경우는 38 명(35.8%), 예방적 항생제 사용하지 않은 군에서 요-방광 역류가 있는 경우는 8명(7.5%), 없는 경우는 23명(21.7%) 으로 두 군간의 차이는 없었다.
면역억제제 사용은 기본적으로 CNI를 기본으로 하는 3 제 요법 및 basiliximab (SimulectⓇ) induction therapy를 시행하였고 환자의 분포는 Table 1과 같다. Cyclosporine 을 주 면역억제제로 사용한 환자군은 77명(72.6%), tacro-
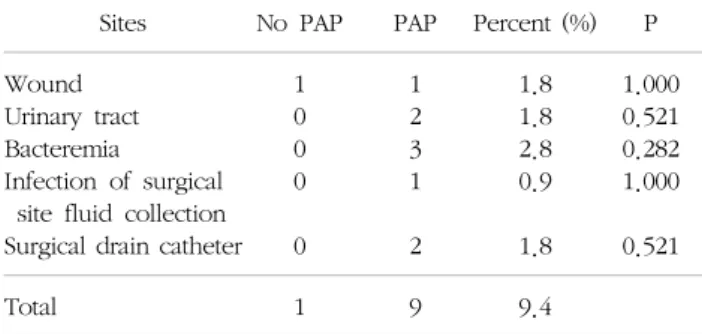
Table 2. Sites of infection after kidney transplantation (n= 106) Sites No PAP PAP Percent (%) P Wound
Urinary tract Bacteremia
Infection of surgical site fluid collection Surgical drain catheter
1 0 0 0 0
1 2 3 1 2
1.8 1.8 2.8 0.9 1.8
1.000 0.521 0.282 1.000 0.521
Total 1 9 9.4
limus를 주 면역억제제로 사용한 군은 29명(27.4%)이었 다. MMF 대신 sirolimus를 사용한 환자는 5명(4.7%)이었 다. 항생제 사용 여부와 면역억제제의 상관관계에서 예방 적 항생제 사용군 중 cyclosporine을 사용한 환자는 61명 (93.8%), tacrolimus를 사용한 환자는 4명(6.2%) 이며 예 방적 항생제를 사용하지 않은 군에서 cyclosporine을 사 용한 환자는 16명(39.0%), tacrolimus를 사용한 환자는 25 명(61.0%)으로 통계적으로 의미 있는 분포를 보였다. (P=
0.000). 하지만 tacrolimus와 cyclosporine의 창상 감염의 발생을 비교하였을 때 cyclosporine 사용군에서 2예의 창 상 감염이 발생하였으나 P=0.526으로 주면역억제제에 따 른 감염 발생빈도는 차이가 없었다.
Foley 카테터의 제거시기는 평균 5.2±1.8 (days)으로 항생제 사용군은 5.2±1.3 (days), 항생제 사용하지 않은 군은 5.3±2.5 (days)로 두 군간의 통계적으로 유의한 차 이는 없었다(P=0.660). Foley 카테터의 제거시기와 요로 감염의 상관 관계를 분석하였고 요로감염이 발생한 환자 군에서는 평균 4일 만에 foley 카테터 제거를 시행하였고 발생하지 않은 군에서는 평균 5.3±1.8일 만에 제거하였 고 두 군 간의 통계적 유의한 차이는 없었다(P=0.332).
중심정맥관 제거는 평균 3.8±0.8일에 시행하였고 감염 의 발생은 없었다.
2) 감염양상
106명의 환자 중 10명(9.4%)에서 감염이 발생하였고 감염 양상은 Table 2와 같다. 균혈증이 3명(2.8%)으로 가장 많았으며 창상감염, 폐렴, 배액관 관련 감염은 각각 2명씩, 수술 부위 저류액에 의한 감염은 1명이 발생하였 다. 창상 감염은 항생제 사용군과 사용하지 않은 군에서 각각 1예 발생하였고 그 외 감염은 모두 항생제 사용군 에서 발생하였지만 통계적인 의미는 없었다. 즉 예방적 항생제 사용이 수술 후 1개월 내 발생하는 창상 감염, 요 로 감염, 폐렴, 도관 관련 감염, 균혈증 등의 예방에 효과
가 없음을 보여주었다. 감염이 발생한 환자는 특별한 부 작용없이 치료되었다.
예방적 항생제 사용 외 수술 후 감염에 영향을 줄 수 있는 요인으로 수여자의 성별, 기증자의 형태(생체 또는 뇌사자 공여), 기증자의 성별, ESRD 기간, 수여자 당뇨 유무, 비만 정도, 수술시간, 요-방광 역류 유무, 면역억제 제 종류, 감염과의 관계를 분석하였고 통계적으로 유의한 차이는 없었다.
고 찰
신이식 후 발생하는 초기 사망의 원인으로 감염은 가 장 흔한 원인이다(7). 신이식 환자에게서 감염은 이식 신 및 환자의 장기 생존을 위협하는 심각한 합병증이다(8).
이식 환자들은 감염에 노출되기 쉬우며 감염 시 발현되 는 증상이 경하거나 거부반응 또는 약물 부작용과 혼동 되기도 한다. 감염의 발생은 환자의 감염에 대한 감수성 을 증가시키는 요인, 감염원에 대한 노출 정도 및 침습적 술기에 따라 결정된다(9). 감염의 위험 인자로 당뇨, 면 역억제제 용량, sirolimus 사용, 만성 신부전, 빈혈, 영양 부족, 요독증, 중심정맥관, 도뇨관, 이식 전 투석 방식, 뇌사자 공여 이식 등으로 알려져 있다(9,10).
약 50%의 신장이식 환자에서 세균성 감염이 발생하며 감염 발생 부위에 따라 요로 감염, 창상 감염, 균혈증, 폐 렴 등으로 구분할 수 있다. 요로 감염은 가장 흔한 형태로 약 35%에서 79%를 차지하며 주된 원인은 유치 도뇨관에 의한 감염이다. Warren 등의 발표에 의하면 도뇨관 유치 시 균혈증 발생률이 매일 5∼10% 증가하는 것으로 보고 하고 있다(11). 폐렴은 4.5% 에서 16% 발생하는 것으로 보고 되고 있다(10). 신장이식에 의한 창상 감염률은 현저 한 감소양상을 보이고 있으며 약 2%에서 4%의 환자에게 서 발생한다. 이것은 일반적인 clean-contaminated 수술 의 창상 감염률과 큰 차이를 보이지 않는다(12-16). 이식 후 발생하는 감염을 시간에 따라 3단계로 구분 할 수 있 으며 첫 1개월에 발생하는 감염은 기회감염이 드물며 주 로 수술과 관련된 감염으로 창상 감염, 폐렴, 도관 관련 감염, 수술 부위 농양 형성, 요로 감염 등으로 약 95% 이 상이 세균과 진균 감염이 원인이다(17,18). 따라서 이식 환자에게서 수술 후 발생하는 상처 감염 및 요로 감염을 예방하기 위해 수술 전후 항생제 사용에 대한 연구에서 유의하게 감염률을 감소시키는 효과가 있음이 보고되었고 항생제 사용을 권고하고 있다(19,20). 예방적 항생제의 투 여 시기는 수술 창 절개 직전이 가장 효과가 좋은 것으로 보고되었으며 본 연구에서도 수술 직전 투여하였다(21).
하지만 예방적 항생제의 투여는 의료 비용의 증가, 내성 균 출현을 유발할 수 있다. 특히 신이식 환자에게 있어서 는 항생제와 환자가 복용하고 있는 면역억제제의 상호 관 계도 고려하여야 한다. 항생제 사용에 따른 면역억제제의 약물 농도의 변화 및 면역억제제와 더불어 신독성의 상승 효과를 보이는 경우가 있다. 그리고 기회감염은 신장이식 1개월 내 발생하는 경우는 드물다. 이론적으로 신장이식 술이 다른 수술에 비해서 예방적 항생제 사용의 필요성이 증가하는 것은 아니며 수술 술기의 변화, 수술 후 관리 등 이 상처 감염률의 감소를 가져 왔다. 따라서 예방적 항생 제 사용이 감염예방에 미치는 영향에 대하여 적절한 연구 가 필요하며 현재와 같은 예방적 항생제 사용의 필요성에 대하여 검토가 필요하다.
Midtvedt 등은 448명의 신장이식 환자 중 377명의 예 방적 항생제를 사용하지 않은 군과 예방적 항생제를 사 용한 71명의 환자를 비교연구하여 수술 후 감염에 차이 가 없음을 확인하였다(5). Ramos 등은 신이식 환자의 창 상 감염에 대하여 연구하였으며 3.9%의 낮은 감염률을 보였으며 예후도 비교적 양호하였음을 발표하였다. 그리 고 예방적 항생제 사용이 상처 감염 발생에 있어서 중요 한 위험인자가 아니며 실제 상처 감염에서 확인된 원인 균주 중 다수에게서 항균력을 가지지 못함을 밝혔다(15).
Stephan 등은 신장이식 환자를 대상으로 예방적 전신 항 생제 사용을 하지 않을 경우 창상 감염에 미치는 영향에 대한 연구를 102명의 환자를 대상으로 시행하였으며 모 든 환자는 예방적 전신 항생제 투여는 받지 않았으며 수 술 중 항생제(cefazolin)를 이용한 국소 상처 세척 및 방 광 세척을 시행하였다. 결과적으로 2%의 상처 감염이 발 생하였고 이는 다른 외과 수술의 감염률과 차이를 보이 지 않았다. 따라서 Stephan 등은 예방적 항생제 투여의 감량 또는 중단이 적절함을 주장하였다(14). 본 연구에서 는 예방적 수술 전후 항생제 사용을 하지 않은 환자군과 예방적 항생제를 사용한 군의 창상 감염은 통계적으로 유의한 차이를 보이지 않았으며 감염률은 1.8%로 다른 연구 결과와 다르지 않았고, Stephan 등의 연구 결과와 비교해서 수술 중 항생제를 이용한 상처 및 방광 세척을 시행 하지 않았음에도 불구하고 상처 감염률에 차이를 보이지 않았다. 따라서 본 연구 결과는 예방적 항생제 사 용이 신장이식 수술 후 발생하는 창상 감염의 예방 효과 에 큰 차이가 없음을 보여주고 있다. 현재 본원에서 시행 하는 신장이식 수술(생체 공여와 뇌사자 공여 포함)에서 는 이러한 임상경험을 토대로 예방적 항생제는 사용하고 않는다.
García 등은 SeptrinⓇ을 예방적 항생제로 투여한 군이
수술 후 첫 1개월 동안 요로 감염의 발생률이 통계적으 로 유의하게 감소함을 보고하였다(22). 본원에서는 tri- methoprim/sulfamethoxazole을 Pneumocystis carinii 예 방을 위해 주 2회만 투여하고 있으며 요로감염의 발생률 은 1.8%이다. 따라서 요로 감염의 예방을 위해 trimetho- prim/sulfamethoxazole 투여의 적절성에 대한 연구도 필 요할 것으로 사료된다. 요로 감염은 도뇨관 유치 기간과 유의하게 관련이 있는데 Rabkin 등은 수술 후 조기 도뇨 관 제거 시(수술 후 3일 내) 합병증의 증가없이 요로 감 염률을 의의있게 감소시킬 수 있음을 보고 하였다(23).
본원에서는 도뇨관 제거시기를 수술 후 5일에 제거하는 것을 원칙으로 하고 있으며 평균 5.2±1.8 (days)에 제거 하였다. 도뇨관 제거시기는 기관마다 차이가 있을 수 있 으므로 합병증이 발생하지 않는 범위에서 요로 감염을 예방할 수 있는 적절한 제거시기에 대해서는 각 기관의 경험 및 연구에 따른 합의가 필요할 것으로 사료된다.
본 연구에서는 일반적으로 알고 있는 감염의 위험요인 (당뇨, 비만, 수술 시간, ESRD 기간 등)과 감염과의 상관 관계 및 항생제 사용 여부와 감염 발생률의 상관 관계를 비교하였고 통계적으로 유의한 결과를 보이지 않았다.
또한 생체 공여자와 뇌사자 공여 신장이식에서의 감염이 큰 차이가 없음을 보이고 있다. 따라서 뇌사자 공여에 있 어서 균혈증이 없으며 이식될 장기와 상관이 없는 국소 감염은 예방적 항생제 사용이 필요없을 것으로 사료된다 (24).
결 론
신장이식에 있어서 감염과 거부반응은 이식의 성공을 결정하는 요인으로 특히 감염은 이식 후 환자의 생존에 영향을 주는 요인이다. 항생제의 사용과 수술 술기의 발 달, 수술 후 관리의 발달은 수술 후 발생하는 감염의 현 저한 감소를 가져왔다. 따라서 예방적 항생제 사용이 권 고되어 왔다. 이에 반하여 예방적 항생제 사용의 효용성 에 대한 의문을 제기하는 여러 연구가 진행되었고 본 연 구에서도 신장이식이 clean-contaminated 수술이지만 예 방적 전신 항생제 사용이 수술 후 발생하는 세균성 감염 의 예방 효과에 큰 차이가 없음을 보여주고 있다. 본 연 구는 비교적 적은 수의 환자를 대상으로 후향적으로 연 구가 진행되었으며 비교적 낮은 창상 감염 발생빈도를 보였다. 따라서 예방적 항생제 사용이 필요없다는 결론 을 얻기 위해서는 더 많은 환자군에서 전향적 연구가 필 요할 것으로 사료된다.
REFERENCES