DOI 10.17480/psk.2016.60.4.173
고분자 전달체를 이용한 경폐 약물전달시스템
이우림 · 이은아 · 장다솜 · 조여진 · 차지현 · 이혁진# 이화여자대학교 약학대학
(Received August 1, 2016; Revised August 29, 2016; Accepted August 30, 2016)
Polymeric Carriers for Pulmonary Drug Delivery
Woo-lim Lee, Eun-a Lee, Da-som Jang, Yeo-jin Cho, Ji-hyeon Cha and Hyukjin Lee# College of pharmacy, Ewha womans university, 52, Ewhayeodae-gil, Seodaemun-gu, Seoul 03760, Korea
Abstract — Pulmonary delivery is a preferred administration route for treating lung (local) or other systemic diseases, since it allows easy, effective, and non-invasive drug delivery, which greatly increases patient compliance. The purpose of studying pulmonary drug delivery is to find optimized chemical and physical properties of inhalable particles for more effi- cient drug delivery. Polymeric carriers are often utilized to achieve this goal. In this review, we address various char- acteristics of pulmonary drug delivery systems and compare advantages of different polymeric carriers. Furthermore, we introduce current studies of pulmonary drug delivery, for example, inhalable anti-tubercular agents (for topical application) and inhalable insulin (for systemic application). This studies highlight the advantages of polymeric carrier system for drug delivery. At last, we discuss current limitations of polymeric carrier systems for pulmonary drug delivery and possible solu- tions for overcoming these problems.
Keywords □ pulmonary drug delivery, polymeric carriers
연구자들은 이전부터 폐를 약물 전달의 주요 경로로서 연구해 왔다. 폐를 통해서 약물을 전달하는 것은 다른 경로를 통한 약물 전달에 비해 여러 장점을 나타내게 되는데, 이는 폐의 생물학적 특성에 기인한다. 폐는 1) 표면적이 커서 약물의 흡수에 유리하 며, 2) 혈관 분포가 많고 3) blood-air barrier가 얇기 때문에 (0.45µm) 약물의 순환계 진입 확률을 높일 수 있다. 또한 폐를 통해 순환계로 들어온 약물은 4) 간의 초회통과효과를 피할 수 있어 생체이용률이 증가되며, 폐를 통한 약물의 투여는 5) 비침 습적인 방법이기 때문에 주사와 같이 침습적인 방법을 두려워하 는 환자들의 치료에 도움을 줄 수 있다. 이런 장점들을 바탕으로 경폐 투여용 약물(inhalable drug; 흡입제)이 개발되었으며 치료 에 널리 사용되고 있다. 환자들은 nebulizer 또는 inhaler(Fig. 1)
를 이용하여 흡입제를 흡입하게 된다.1)
대부분의 초기 흡입제들은 반감기가 짧고 생체이용률이 낮아 서 약물을 여러 번 복용해야 한다는 단점이 있었다. 또한 급격한 혈중 약물 농도 상승을 야기하거나 표적 세포가 아닌 곳에 약물 을 방출시켜 부작용을 나타내기도 했다. 연구를 통해 이러한 단 점들은 개선되었지만 더 큰 치료 효과를 얻고 부작용을 감소시 키기 위해서는 한층 진보된 controlled pulmonary drug delivery system의 구축이 필요하다. 현재 제약 시장에서는 controlled pulmonary drug delivery system의 실현을 위해 고분자를 이용 하여 약물 방출을 조절하는 micro/nano-scale 흡입제의 연구 및 개발이 활발하게 이루어지고 있다.1) 이에, 이 글에서는 고분자전 달체를 이용한 경폐 약물 전달의 장점, 사용되고 있는 고분자의 종류, 적용의 실제 사례와 그 한계점에 대해 다루고자 한다.
본 론
폐를 통한 약물전달에서 약물의 축적(deposition)과 생체이용 률(bioavailability)에 영향을 주는 3가지 요인은 약물 입자의 1)
#Corresponding Author Hyukjin Lee
Collage of Pharmacy, Ewha Womans University, 52 Ewhayeodae- gil, Seodaemun-gu 120-750, Seoul, Republic of Korea
Tel.: 02-3277-3026 Fax.: 02-3277-2851 E-mail: hyukjin@ewha.ac.kr
Review종설
크기와 모양, 2) 체내 도달 위치, 3) 식세포작용 회피 능력이다.
적절한 고분자의 선택과 변형은 이 요인들을 약물 전달에 최적 화시키는 데 도움을 준다.
폐에서의 약물 동태 Drug deposition
Nebulizer나 inhaler를 통해 흡입된 제제는 관성감입(inertial impaction; 들어가서 박힘), 중력침강(gravitational sedimentation), 브라운확산(Brownian diffusion)을 통해 폐에 쌓이게 된다.2)흡 입제가 폐포 표면에 쌓이고 뭉치게 하는 주된 작용은 감입과 침 강작용이지만, 입자들의 움직임 자체는 브라운 확산에 의해 일 어난다. 폐포에 도달한 흡입제는 carrier degradation 또는 약물 확산으로 약을 방출하게 된다. 만약 고분자 matrix 에 약물을 넣 은 형태의 흡입제 를 흡입한다면 분산, 감입, 침강을 통해 입자 들이 폐포에 쌓이게 되고 폐의 lining fluid에 노출된 고분자 matrix는 용해되어 약물을 방출한다. 방출된 약물은 폐포 표면의 보호 장벽들; mucus film, mucocilia, 상피세포의 tight junction 을 통과하여 능동수송(active absorption)이나 수동확산(passive diffusion)에 의해 폐포로 이동하게 되는데(Fig. 2) 폐포로 흡수된 약물은 국소에서, 또는 전신순환계로 진입하여 약물 효과를 나 타내게 된다.3,4)
흡입제는 입자의 크기에 따라 폐에서 축적되는 위치가 달라진 다(Table I). 작은 입자일수록 허파꽈리(alveoli)까지 도달할 수 있 는데, 이러한 특성 때문에 흡입제의 입자 크기는 5 µm이하인 것 이 대부분이다. 입자가 작을수록 흡입 시의 관성이 작으므로, 흡
입제가 폐에 일정량 이상 축적되기 위해서는 호흡을 천천히 하 여 밖으로 다시 나오는 약물의 양을 최소화 시키는 것이 좋다.
Clearance mechanisms
폐에 들어간 흡입제는 축적되기도 하지만 여러 기전들에 의해 제거되기도 한다. 흡입제의 제거 속도가 빠를 수록 약물의 반감 기는 짧아지고 생체이용률이 감소하게 되는데, 이는 약물 치료 의 실패로 이어질 수 있다. 폐에서 일어나는 3가지의 약물 제거 메커니즘들을 살펴보면 다음과 같다.4)
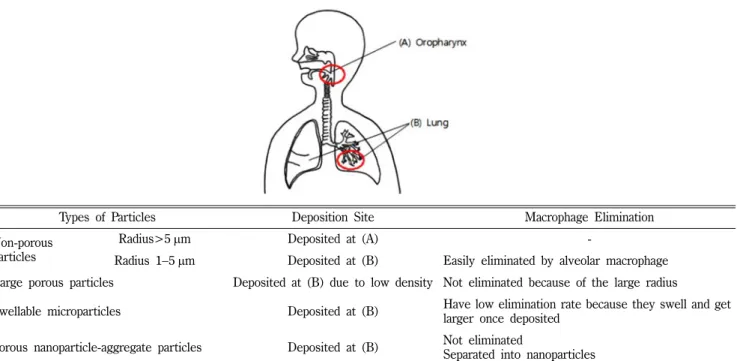
(1) Mucociliary clearance and alveolar macrophages 첫 번째 메커니즘은 폐 점막섬모(muco-ciliary)와 대식세포에 의한 약물 제거이다. 외부 입자가 호흡계로 들어왔을 때 일차적 으로 방어하는 기전에 해당한다. 흡입제가 투여되면 호흡계는 이 것을 외부 입자로 인식하여 폐 세포와 상호작용하는 것을 막기 위해 제거하려 한다. 흡입된 입자가 폐의 어느 부분에 위치하느 냐에 따라 제거 기전이 결정되는데, 기관과 기관지에 도달한 입 자는 폐 점막섬모 상승(mucociliary escalator)에 의해 제거되고 폐포에 도달한 입자는 대식세포에 의해 제거된다. Table I을 참 고하여 보면, 직경 1~5 µm인 입자는 기관과 기관지에 도달하므 로 mucociliary escalator에 의해 제거되며, 직경 0.5~1 µm인 입 자는 폐포에서 대식세포에 의해 제거될 것임을 알 수 있다. 직경 0.26µm 이하의 입자는 대식세포에 의한 식세포 작용을 피할 수 있지만, 흡입된 후 관성의 부족으로 숨을 내쉴 때 쉽게 빠져 나 오게 되는 단점이 있다. Table II에 흡입 후 일어나는 식세포 작 용이 나타나있다.
(2) Enzymatic degradation
두 번째 메커니즘은 효소에 의한 제거이다. 흡입제가 폐포 표 면에 도달하면 표면에 존재하고 있던 cytochrome P450 (CYP) families가 약물을 대사한다. 이 때 작용하는 효소는 주로 CYP1B1, CYP2B6, CYP2E1, CYP2J2, CYP3A5, CYP1A1이고, 이들에 의해서 폐로 흡입되어 들어간 약물들(예: budesonide, ciclesonide, salmeterol, theophylline, 인슐린 등)이 대사되어 사 라진다. 따라서 흡입제로 만드는 약물들은 효소 작용으로부터 적 절한 보호를 해야 한다.
(3) Rapid systemic adsorption
세 번째 메커니즘으로는 순환계로의 약물 진입에 의한 약물 제 Fig. 1 − Nebulizer (left) and Inhaler (right).
Fig. 2 − The migration of inhaled drugs3).
Table I − Mechanisms and locations of deposition of particles in the lung due to particle size3)
Location Size Mechanism
Primary Bronchi 5−10 µm Impaction
Secondary Bronchi 1−5 µm Sedimentation
Bronchioles 1−3 µm Sedimentation
Alveoli 0.5−1 µm Brownian motion
거가 있다. 폐에서 국소 작용해야 하는 약물의 경우, 혈관을 통해 전신순환계로 들어가면 폐 조직에서 원하는 효과를 더 이상 나타 낼 수 없다. 표면적이 넓고 혈관이 많이 분포된 폐의 특성상 약물 은 비교적 빠른 속도로 전신 순환계로 진입하게 된다. 폐 세포를 타겟으로 하는 흡입제의 경우에는 약물의 소수성과 친수성, 입자 크기를 적절히 조절하여 약물 입자가 다른 곳으로 이동하지 않고 원하는 장소에서 작용하도록 해야 한다.
고분자 전달체를 통한 경폐 약물전달
앞에서 살펴본 것처럼 흡입된 약물이 원하는 곳에서 원하는 작 용을 나타내기 위해서는 그에 적합한 화학적, 물리적 성질을 가져 야 한다. 약물 입자 자체가 그런 특성들을 모두 가질 수는 없으므 로 고분자입자(polymeric micro/nanoparticle)를 이용하여 적합한 특성을 갖도록 가공한 뒤에 흡입제로 사용한다. 고분자 이외에도 liposomes, solid-lipid nanoparticles, micelles, cyclodextrins 등을 이용하여 입자의 물리화학적 성질을 변형시킬 수 있다(Table III).
이렇게 전달체(carrier)를 이용하여 약물전달을 할 때의 장점들을 나열해 보면 다음과 같다.5,6,7)
• 효소에 의한 약물 분해를 막음
• 폐 대식세포에 의한 제거로부터 회피 가능
• 약물의 세포 내 흡수 속도를 조절
• 폐의 표적위치에 선택적 약물 전달률을 높임
• 약물 방출 속도를 조절
• 환자의 약물 복용 빈도를 줄임
• 치료 효율을 극대화 시킬 수 있음
• 약물 부작용을 최소화 시킬 수 있음
특히 고분자 운반체는 다른 운반체들과 비교하여 1) 높은 안 정성을 가지고, 2) 약물 수용량이 크며, 3) 약물 방출 속도를 느 리게 해 약효를 오래 지속시킬 수 있고, 4) 형태, 크기, 공극률 (porosity)을 쉽게 변화시킬 수 있어, 약물 전달에 매우 유용하다.
여러 가지 약물 운반체들의 장점과 단점을 Table IV에서 비교해 볼 수 있는데, 고분자 운반체가 다른 운반체들에 비해 부작용이 적다는 것도 알 수 있다. 고분자를 사용한 경폐약물전달은 DDS 의 목표인 약효 상승과 부작용 감소를 효과적으로 이룰 수 있으 Table II − Inhalable drugs and phagocytosis5)
Types of Particles Deposition Site Macrophage Elimination
Non-porous particles
Radius>5µm Deposited at (A) -
Radius 1−5 µm Deposited at (B) Easily eliminated by alveolar macrophage Large porous particles Deposited at (B) due to low density Not eliminated because of the large radius
Swellable microparticles Deposited at (B) Have low elimination rate because they swell and get larger once deposited
Porous nanoparticle-aggregate particles Deposited at (B) Not eliminated
Separated into nanoparticles
Table III − Control of properties of drug particles by using carriers8) Particle property Achieved by
Increased aerodynamic diameter
i) Decreasing the volume-equivalent particle diameter (dV)
ii) Reducing the particle density by making hollow particles
iii) Increasing the particle dynamic shape factor Decreased
aggregate strength
i) Making porous or hollow particles ii) Loose and weak aggregates (low powder bulk
density)
iii) Irregular particles (reduced contact reduces force)
Improved particle dispersion
Decrease particle surface energy Making nano in micro particles Evade phagocytic
clearance
Increased particle size
Add long polymer chain on surface Make liposome
Longer half-life Particle coating with polymers or lipids Mucus penetrating Particle coating with polymers or lipids
므로 여러 질병의 치료에 사용되고 있다.6,9,10)
흡입제에 사용되는 고분자의 종류
흡입제에 쓰이는 고분자는 천연 고분자(natural polymers), 합 성 고분자(synthetic polymers), 혼성 중합체(copolymer)가 있다.
천연 고분자의 대표적인 물질은 알부민, 키토산, 히알루론산, 그 리고 카라기난 등이 있다. 합성 고분자는 인공적으로 합성하여 만든 탄소화합물로 이에 속하는 물질에는 PLA, PVA, PEG, MPEG등의 polymer들이 있다. 혼성 중합체는 두 종류 이상의 단위체를 중합하여 한 분자 내에 각 성분을 모두 품은 고분자 화 합물로 정의되며, PLGA, NPHC가 이에 해당한다(Table V). 이 외에도 다양한 고분자들이 흡입제 전달에 사용되고 있다. 가장 많이 사용되는 고분자는 키토산, PLGA, 히알루론산이다.5)기존 에는 한 흡입제에 한 가지 종류의 고분자를 사용했었지만 최근 에는 2가지 이상의 고분자를 섞어서 운반체를 만듦으로써 약물 방출을 더욱 효과적으로 조절하려는 시도가 계속되고 있다.11,12)
고분자 운반체를 사용한 흡입제의 적용
경폐형 고분자-약물 전달시스템은 주로 천식, 독감, 만성폐쇄 성폐질환(COPD) 등 호흡기 질환 치료제로서 사용되어왔다. 하 지만 최근에는 경폐형 고분자-약물 전달시스템의 활용 범위가 전 신으로까지 확장되면서 당뇨나 혈전증 같은 병을 치료하는 데도 사용되고 있다. 앞에서 살펴보았듯이 이상적인 국소 치료작용을
나타내기 위해서, 흡입된 약물은 폐에 쌓이고 전신 순환계로 들 어가지 않아야 한다. 반대로 이상적인 전신 치료작용을 나타내 기 위해서는 흡입된 약물은 전신 순환계로 들어가서 약효를 나 타내야 한다. 각각의 경우에 경폐형 고분자-약물 전달시스템이 이상적인 결과를 위해 적용되는 예를 결핵치료제와 인슐린제제 를 통해 살펴보겠다.
국소 적용: 결핵
결핵(Tuberculosis, TB)은 Mycobacterium tuberculosis 와 M. bovis에 의해 발병하는 세균성 질환이다. 결핵은 공기로 전 염되기 때문에 결핵 환자들은 주로 기침과 가슴통증을 동반한 폐 결핵 증상을 나타낸다. 결핵균은 폐 대식세포 안에 살면서 질병 을 유발하므로 폐 대식세포를 타겟으로 하는 국소 약물 전달이 요 구된다. 결핵 치료 시에 사용되는 일차 선택 약물은 Ethambutol (EMB), Isoniazid(INH), Rifampicin(RIF), Pyrazinamide(PZA)인 데, 최근에 전세계적으로 INH와 RIF에 대한 내성을 지닌 다제 내성 결핵균(MDR-TB; multi drug resistant TB)과 광범위 약제 내성 결핵균(XDR-TB; Extensively drug related TB)들이 관찰 되며 결핵 치료에 난항을 겪고 있다. 약물 내성이 나타나는 이유 는 Mycobacterium 세포벽의 mycolic acid가 방수, 불투과성의 특성을 나타내어 항생제나 포식용해소체 융합(phagolysosomal fusion)에 의한 세포사멸을 방지하기 때문이다. 이러한 약물 내성 은 약물의 유효성과 강도의 소실 없이 특정 구역에만 전달하도 록 하는 효율적인 약물전달시스템으로 극복할 수 있다. 고분자 를 이용한 nano/micro-particulated 약물 수송은 항결핵 약물 (ATD; Antitubercular drug)을 특이적인 장소로 수송할 수 있도 록 도울 뿐만 아니라, 약물 방출을 조절하여 ATD의 투여 빈도 를 줄임으로써 환자들의 복약순응도를 높이고 치료 성공률을 증 가시킬 수 있다. Table VI은 각 free ATD drug의 IV 투여 시와 PLG(PLGA)-nanoparticle(NP)-based ATD drug의 경폐 전달 시 PK를 free ATD drug의 경구 투여 시 PK와 비교하여 그 비율 을 구한 것이다. PLG는 생분해성(biodegradable)이고 생체적합 성(biocompatible)이 우수해서 경폐형 고분자-약물 전달시스템에 흔하게 사용되며, 이 연구는 nebulized PLG-NP-based ATD delivery system의 효능을 평가하기 위해 설계되었다. PLG- Table IV − Merits and weak points of drug carriers for controlled pulmonary release5)
Type of delivery systems Strong point Weak point
Conventional microparticles Simple and practical production process Can be swallowed up by alveolar macrophages Large porous particles Decreased clearance by phagocytosis less aggregation
of the particles increased aerosolization efficiency
Increased tendency of a substance to be break due to porosity hard to manufacture in large scale Swellable microparticles Decreased clearance by phagocytosis Disadvantageous fluidization and dispersibility
Polymeric nanoparticles
Increased targeting decreased alveolar macrophage clearance and transepithelial transport increased dosing interval
Controversy over the toxicity of nanoparticles in the lung
Liposomes Solubilization of insoluble drugs Expensive production cost
Table V − Representative polymers used in pulmonary drug delivery5) Natural
Polymers Albumin Carrageenan, Chitosan (CS), Gelatin, Hyaluronic Acid (HA)
Synthetic Polymers
Poly(lactic acid), Oligo(lactic acid), Poly(vinyl alcohol)(PVA)
Acrylic acid derivatives, Poly(ethylene glycol)(PEG) Methoxy poly(ethylene glycol)(MPEG)
1,2-dilauroul-sn-glycero-3-phosphocholine(DLPC) Vitamin E D-alpha-succinated polyethylene glycol 1000(vitamin E TPGS)
Copolymers Poly(lactic-co-glycolide acid)(PLGA) PEG-grafted N-phthaloyl chitosan(NPHC)
nanoparticles를 3개의 ATD(rifampicin, isoniazid, and pyrazinamide) 의 운반체로 하여 경폐전달 시, 다른 투여 경로에 비해 생체이용 률과 AUC0–∞수치가 높은 것을 볼 수 있다. Cmax는 경구 투여 시와 비슷하고 Tmax와 t1/2가 월등히 높다는 것을 볼 때, PLG- nanoparticle을 운반체로 한 경우에 약물 방출 조절이 훨씬 용이 하며 약효가 오래 지속될 수 있음을 알 수 있다. 이와 비슷하게 alginate-nanoparticles를 3개의 ATD(rifampicin, isoniazid, and pyrazinamide)의 운반체로 하여 경폐전달 했을 때와 각 약물의 free drug oral제제 복용 시에 PK의 비를 비교한 결과가 표에 나 타나있다. Alginate 운반체를 이용한 경폐약물 전달의 Cmax, Tmax, AUC0–∞, 상대적 생체이용률이 free drug에 비해 모두 높았다. 이 들 결과에서 볼 수 있듯이 rifampicin, isoniazid, pyrazinamide와 polymeric nanoparticle을 결합시킨 약물 전달시스템이 현재 효 과적인 결핵균 감염 치료를 위해 사용되고 있으며, 더 좋은 치료 결과를 얻기 위해 다양한 고분자 운반체에 대한 연구가 진행되 고 있다.11) 따라서 polymeric nanoparticle을 통한 약물 전달을 이용하여 미래에는 결핵을 더욱 효과적으로 치료할 수 있을 것 으로 기대된다.14)
전신 적용: 인슐린
인슐린은 당뇨병 환자의 혈당조절을 위해 투여되는 약물이다.
현재 주로 쓰이고 있는 인슐린 제제는 피하주사인데, 이러한 방 식의 문제는 저혈당이나 산화스트레스를 유발할 위험이 있다는 점이다. 또한 자가항체를 생성할 수 있고 대사에 의한 변화가 있 으며 환자가 스스로 투여해야 하는 불편함이 있다. 이를 보완하 기 위해 폐를 통한 인슐린 전달에 대한 연구가 진행되고 있다.
그러나 인슐린 같은 거대분자가 단독으로 폐에 투여 되면 낮은
용해도와 빠른 제거기전으로 인해 작용시간이 짧아지게 되고, 심 각한 부작용을 초래할 수도 있어서 문제가 된다. 때문에 최근 각 광받고 있는 것이 nanoparticle을 이용한 인슐린 전달이다.
Nanoparticle은 작은 입자 크기로 인해 큰 표면적을 가지고 phagocytosis를 피할 수 있고, 표면을 변형할 수 있는 성질 때문 에 다른 약물 전달시스템에 비해 이점이 있다. 특히 polymeric nanoparticle은 약물전달체로서의 역할을 하면서 약물이 분해되 는 것을 막고, 약물방출을 조절하기도 한다.
현재 연구 중인 인슐린의 polymeric nanoparticle은 고분자로 써 gelatin을 이용한다.15) Gelatin은 생체적합성이 우수하고, 분 해된 후에도 독성이 없으며 분해 산물이 쉽게 배설되기 때문에 약물전달체로 사용하기 좋은 고분자이다. Gelatin은 전기적으로 음성을 띄는 soluble polymer이기 때문에 안정한 nanoparticle을 형성하기 위해 D,L-glyceraldehyde를 non-toxic linking agent로 사용한다. 또한, poloxamer 188(polyoxyethylene(EO)+polyoxy- propylene(PO))은 non-ionic sulfactant로 durg-holding ability와 penetration ability를 개선시키는 작용을 하므로 nanoparticle에 첨가한다.
정상 혈당의 rat에 insulin-loaded, unloaded in nanoparticle formulation을 intratracheal delivery(IT) 하거나, insulin solution 을 subcutaneous injection(SC)하여 얻은 혈당강하율을 관찰했을 때, 혈당 강하율은 SC일 때가 가장 강했다. 하지만 이 방식은 저 혈당의 위험성이 있다. 인슐린 단독으로 IT 투여했을 때는 혈당 강하가 거의 일어나지 않는 것으로 나타났는데, 이는 인슐린 단 독일 때는 폐를 통해서 전신 흡수가 되지 않는다는 것을 뜻한다.
이에 반해 전달체를 사용해서 인슐린을 IT 투여했을 때는 SC보 Table VI − (i) Ratio of PK parameters of ATDs in intra-vascular(IV) and PLG(PLGA)-nanoparticle(NP) based pulmonary delivery to parameters of oral administration4) (ii) Ratio of PK parameters of nebulized antitubercular drug-loaded alginate nanoparticles to parameters of oral free drugs in guinea pigs13)
Rifampicin Isoniazid Pyrazinamide
Oral IV Nebulized
PLG-NP Oral IV Nebulized
PLG-NP Oral IV Nebulized
PLG-NP Cmax(mg/L)
Tmax(h) T1/2(h)
AUC0→∞(mg h/L) Relative bioavailability
1.00 1.00 1.00 1.00 1.00
21.06±3.36 0.01±0.00 0.42±0.43 1.96±2.72
-
1.06±0.67 12.00±0.00 16.12±5.71 12.74±7.45
12.70
1.00 1.00 1.00 1.00 1.00
16.67±10.33 0.01±0.00 0.48±0.43 1.72±1.61
-
3.27±2.67 48.00±0.00
6.60±2.86 32.94±12.22
32.80
1.00 1.00 1.00 1.00 1.00
2.99±1.90 0.09±0.00 0.93±1.17 1.09±1.25
-
1.08±1.33 48.00±0.00 13.02±2.40 15.68±20.46
14.70
Absolute bioavailability 0.51 1.00 6.50 0.58 1.00 19.10 0.92 1.00 13.40
Rifampicin Isoniazid Pyrazinamide
Free drugs (Oral)
Alginate nanoparticles (aerosol)
Free drugs (Oral)
Alginate nanoparticles (aerosol)
Free drugs (Oral)
Alginate nanoparticles (aerosol) Cmax(mg/mL)
Tmax(h) T1/2(h)
AUC0→∞(µg h/mL) Relative bioavailability
1.00 1.00 1.00 1.00 1.00
1.40±0.11 96 0.98±0.11 16.54±4.84
16.54
1.00 1.00 1.00 1.00 1.00
1.96±2.31 168 0.38±0.57 47.71±17.05
47.71
1.00 1.00 1.00 1.00 1.00
1.59±0.67 288 0.02±0.01 42.03±5.03
42.02
다는 낮지만 어느 정도의 혈당 강하를 보였다. 이를 통해 전달체 를 사용하는 방식이 경폐 전달 경로에서 인슐린의 전신 흡수를 증가시킨다는 것을 알 수 있다.
이 연구에서 인슐린의 폐 distribution 정도를 보기 위해 FITC- insulin solution과 insulin-loaded nanoparticle suspension을 각각 intrapulmonary administration(IT) 한 후 ELISA로 형광강도를 측 정했다. 그 결과로 nanoparticle을 사용했을 때가 단독투여보다 폐 에서 더 높고 지속적인 FITC-insulin level을 나타내었다. 즉 nanoparticle이 인슐린의 폐 distribution을 증가시키고, 인슐린의 효과를 지속시키는 데 영향을 준다는 것이다 이와 같이 Polymeric nanoparticle을 이용한 인슐린의 경폐 전달은 흡수율이 좋고 빠 른 혈당강하효과를 보이며, 약효를 오래 지속시키면서 전달체는 생분해 되어 안전성도 확보할 수 있는 등 여러 가지 이점을 가 지고 있지만 현재 임상에서 쓰이기에는 데이터가 부족하다. 이 기술이 실현되기 위해서는 더 큰 동물들을 이용하여 임상시험을 하는 것이 필요하고, 폐를 제외한 다른 기관에서의 long-term toxicity도 평가되어야 할 것이다.6,15)
Polymeric inhalable drug의 한계점과 극복 방안
약물을 흡입했을 때 숨을 들이 쉰 상태로 오래 유지해야 하며, 그렇다 하더라도 호기에 의해 약물이 빠져 나와 약물 전달의 효 율이 감소할 수 있다. 또한 연구 중인 많은 제제들의 임상실험이 쥐와 같은 작은 동물들로만 진행되었기 때문에 사람에 적용했을 때 문제가 생길 가능성이 존재한다. 호흡기의 형태학적 특성(다 중분기, multiple bifurcation)이나 생리학적 특성(선천성 면역반 응 등)이 약물 전달을 방해할 수도 있다. 가장 크게 문제될 수 있는 점은 고분자로 인해 나타나는 독성반응이다. 폐로 전달된 후 일부 nanoparticle은 폐 외의 장소(extrapulmonary site)로 이 동하여 세포내 섭취(cellular endocytosis), 통과세포외 배출 (transcytosis), 신경과 상피, 순환계로의 이동(neuronal, epithelial, circulatory translocation) 그리고 분포(distribution)에 의해 다른 기관에 도달할 수 있다. 이러한 현상이 진단 응용이나 의학적 치 료에 쓰일 수도 있지만 독성에 노출될 수도 있다.
폐포에 축적된 nanoparticle은 폐포 대식세포의 식세포작용을 통해 제거된다. 대식세포가 축적된 nanoparticle을 인식하고, 식 세포작용 후에는 nanoparticle을 내부에 가진 대식세포가 폐 점 막섬모 상승(mucociliary escalator)을 통해 점진적으로 이동하면 서 제거 과정이 시작된다. 이 메커니즘에 기반하여 폐포에서 고 형 입자가 머무를 때의 반감기는 사람에서 700일까지로 매우 느 리다. 몇몇 연구에서는 폐포 대식세포의 나노입자에 대한 식세 포작용이 큰 입자와는 달리 비효율적임을 보였다. Ultrafine nanoparticle의 경우는 식세포작용이 잘 일어나지 않아서 폐포에 서 잘 제거되지 않는다. 이러한 현상은 오랜 기간 폐에서의 축적 을 일으켜 독성 문제를 야기한다.11,16)
생분해성 고분자를 이용하는 것은 독성 문제를 해결하는 하나 의 방법이 될 수 있다. 생분해성 고분자는 흡수성과 비흡수성 고 분자로 나뉘는데, 독성측면에서는 생분해성 비흡수성 고분자의 경우는 생체 내에서 분해가 일어나서 형태는 완전히 사라지지만 분해물이 장기간 생체 내에 잔류하면서 독성을 일으킬 확률이 있 기 때문에, 체내에서 완전히 소화되어 잔류하거나 축적이 생기 지 않는 생분해 흡수성 고분자가 상대적으로 더 적합할 것이다.
결 론
폐를 통해 약물을 전달하는 방법은 약물동력학적으로 여러 장 점을 지닌다. 특히 고분자 운반체를 이용했을 때에는 특정 조직 이나 세포를 표적으로 하거나 약물 방출 속도를 조절할 수 있다.
또한 약물이 체내에서 빠르게 분해되는 것을 막는 동시에 약물 독성으로부터 인체를 보호할 수 있으며, 비침습적인 방법이므로 주사 제제로 투여될 때 보다 환자의 불편함을 감소시킬 수 있다.
물론 호기에 의해 약물 전달의 효율이 감소한다는 점이나 고 분자가 폐나 다른 기관에 축적되어 나타나는 독성 반응은 아직 까지 경폐 전달의 한계점으로 남아있다. 전신으로 전달하는 약 물을 경폐 흡수 제제로 개발할 때 임상시험이 작은 동물들에만 국한되어 있다는 점도 고려 해야 한다. 그러나 약물 전달 시스템 의 궁극적인 목표인 약효의 극대화와 부작용 최소화를 실현할 수 있다는 점에서 계속해서 연구할 가치는 충분할 것이다.
References
1) d’Angelo, I., Conte, C., Miro, A., Quaglia, F. and Ungaro, F. : Pulmonary drug delivery: a role for polymeric nanoparticles?.
Curr. Top. Med. Chem. 15, 386 (2015).
2) Patton, J. S. and Byron, P. R. : Inhaling medicines: delivering drugs to the body through the lungs. Nat. Rev. Drug. Discov. 6, 67 (2007).
3) Paranjpe, M. and Müller-Goymann, C. C. : Nanoparticle-mediated pulmonary drug delivery: a review. Int. J. Mol. Sci. 15, 5852 (2014).
4) Pandey, R., Sharma, A., Zahoor, A., Sharma, S., Khuller, G. K.
and Prasad, B. : Poly (DL-lactide-co-glycolide) nanoparticle- based inhalable sustained drug delivery system for experimental tuberculosis. J. Antimicrob. Chemother. 52, 981 (2003).
5) Liang, Z., Ni, R., Zhou, J. and Mao, S. : Recent advances in controlled pulmonary drug deliver. Drug Discov. Today 20, 380 (2015).
6) El-Sherbiny, I. M., El-Baz, N. M. and Yacoub, M. H. : Inhaled nano- and microparticles for drug delivery. Glob. Cardiol. Sci.
Pract. 2 http://dx.doi.org/10/5339/gcsp.2015.2 (2015).
7) Andrade, F., das Neves, J., Gener, P., Schwartz, S. Jr., Ferreira,
D., Oliva M., and Sarmento, B. : Biological assessment of self- assembled polymeric micelles for pulmonary administration of insulin. Nanomedicine 11, 1621 (2015).
8) Muralidharan, P., Malapit, M., Mallory, E., Hayes D. Jr. and Mansour, H. M. : Inhalable nanoparticulate powders for respiratory delivery. Nanomedicine 11, 1189 (2015).
9) Menon, J. U., Ravikumar, P., Pise, A., Gyawali, D., Hsia, C. C.
and Nguyen, K. T. : Polymeric nanoparticles for pulmonary protein and DNA delivery. Acta Biomater. 10, 2643 (2014).
10) Verma, R. K., Kaur, J., Kumar, K., Yadav, A. B. and Misra, A. : Intracellular Time Course, Pharmacokinetics, and Biodistribu- tion of Isoniazid and Rifabutin following Pulmonary Delivery of Inhalable Microparticles to Mice. Antimicrob. Agents Chemother.
52, 3195 (2008).
11) Mansour, H. M., Rhee, Y. S., and Wu, X. : Nanomedicine in pulmonary delivery. Int. J. Nanomedicine 4, 299 (2009).
12) Sung, J. C., Pulliam, B. L. and Edwards, D. A. : Nanoparticles
for drug delivery to the lungs. Trends Biotechnol. 25, 563 (2007).
13) Zahoor, A., Sharma, S. and Khuller, G. K. : Inhalable alginate nanoparticles as antitubercular drug carriers against experimental tuberculosis. Int. J. Antimicrob. Agents 26, 298 (2005).
14) Kataria, M., Sethi, M., Kaur, J., Punia, S. and Kumar, K. : Formulation of nanoparticles against TB - A Review. Recent Pat. Inflamm. Allergy Drug Discov. 9, 120 (2015).
15) Zhao, Y. Z., Li, X., Lu, C. T., Xu, Y. Y., Lv, H. F., Dai, D. D., Zhang, L., Sun, C. Z., Yang, W., Li, X. K., Zhao, Y. P., Fu, H. X., Cai, L., Lin, M., Chen, L. J. and Zhang, M. : Experiment on the feasibility of using modified gelatin nanoparticles as insulin pulmonary administration system for diabetes therapy. Acta Diabetol. 49, 315 (2012).
16) Al-Tabakha, M. M. : Future prospect of insulin inhalation for diabetic patients: The case of Afrezza versus Exubera. J.
Control. Release 215, 25 (2015).