석사학위 논문
β-glucosidase 처리에 의한 된장의 Genistein 함량변화 및 물리적 성질 의 변화
국민대학교 대학원 화학과 생화학 전공
오 지 환
2003
β-glucosidase 처리에 의한 된장의 Genistein 함량변화 및 물리적 성질 의 변화
지도교수 이 인 형
이 논문을 석사학위 청구 논문으로 제출함
2003년 월 일
국민대학교 대학원 화학과 생화학 전공
오 지 환
2003
오지환의
석사학위 청구논문을 인준함
2003년 월 일
심사위원장 인 심사위원 인 심사위원 인
국민대학교 대학원
감사의 글
그렇게 길게만 느껴졌던 2년을 보내고 나니 아쉬움이 듭니다.
아무것도 모르던 저는 2년 동안 많은 것을 배웠고 서툴고 모자랐던 부분은 주위 분들의 도움 덕분에 2년을 무사히 마칠 수 있었습니다.
여기에 보답하는 마음으로 석사과정을 기반으로 하여 앞으로도 계 속 학문에 성실히 임할 것입니다.
아직까지도 모자람이 많은 저를 지금까지 이끌어주시고 여러 교훈 과 아낌없는 격려로 돌봐주신 이인형 교수님께 먼저 진심으로 감사 하다는 말을 전해드리고 싶습니다. 제가 이 분야를 공부할 수 있는 계기를 마련해 주신 곽현태 교수님, 처음 대학원에 와서 관심을 가 져주셨던 김석찬, 박규순, 박찬량 교수님, 제가 실험을 터득할 수 있 도록 도와주신 명지대 서주원 교수님, 그리고 여러가지 도움을 주신 김선희 교수님, 임지영 교수님께 감사를 드립니다. 실험실에 처음 들어와서 오늘의 제가 있기까지 성장할 수 있는 계기를 만들어주었 고 실험에 대해 많은 것을 가르쳐주신 명지대 용균이형, 승수형, 동 진이형 그리고 저와 같이 실험실 생활을 같이해서 기쁜 정 슬픈 정 모두 들은 석호형이 기억에 남네요. 그리고 명지대 미생물 실험실 가족들 모두에게 감사하다는 말 전해드립니다. 우리 식품 미생물 실 험실 가족들 귀염둥이 선영이, 내 실험을 힘들지만 열심히 도와준 유경이 지금까지 내 말 잘 들어줘서 너무 고맙고 앞으로도 열심히 하는 모습 보여주길 바랄게. 그리고 이제부터 우리 실험실을 이끌고 나가야 할 주형이형도 열심히 해서 항상 좋은 결과 있기를 바랄께 요. 제 옆에서 저를 친 동생과 같이 보살펴주시고 조언해주신 남혜 경 선생님께 너무 감사합니다. 덕분에 실험실 생활을 편하게 할 수 있었습니다. 그리고 과의 살림을 도맡아 하며 제 대학원 생활을 지 켜봐 주신 은주씨 고마워요.
그리고 맏아들 잘 되기만을 바라며 뒤에서 아낌없는 지원과 격려 를 해주신 어머니 아버지 너무나 감사합니다. 앞으로도 더욱더 노력 하는 지환이가 될 것을 약속드립니다. 내 동생 두환아 경환아 너희 들이 이세상에 있다는 것 자체가 나에게 힘이 된다. 앞으로 계속 공 부하는 나를 지켜 봐주고 나로 인해 너희들이 더 큰 꿈을 펼칠 수 있게 항상 열심히 하는 형이 될게.
힘들 때 마다 항상 옆에서 힘이 되어준 미령아 앞으로 더 열심히 하는 모습 보여줄게.
마지막으로 석사 2년간 부족한 저의 능력을 이끌어 주시고 모든 일을 믿고 맡겨주신 이인형 교수님께 다시금 감사 드리며 앞으로는 기대에 부응하는 학자로서, 인간으로서 성숙한 지환이가 되겠습니다.
이 모든 분들께 감사드립니다.
목 차
List of Tables………. iii
List of Figures……… iv
국문 요지……….. v
I. 서 론………... 1
II. 실험 재료 및 방법……….. 9
1. Chemicals………... 9
2. Materials………. 9
3. β-glucosidase 추출………. 9
4. β-glucosidase 활성 측정……… 10
5. 옥수수 β-glucosidase 활성..………. 13
6. 된장에 β-glucosidase 처리 ……….. 12
7. 된장의 HPLC 분석……… 15
1) 된장의 isoflavone 추출………. 15
2) HPLC 정성, 정량분석………. 16
8. 된장의 물성 측정……….. 18
1) pH………. 18
2) 점도………..……….. 18
3) 항산화가………. 18
4) 색도………. 19
III. 결 과 1. β-glucosidase 활성 ……… 20
1) 콩과 식물의 β-glucosidase 활성……….. 20
2) 생 옥수수의 β-glucosidase 활성……….. 22
3) 건 옥수수의 β-glucosidase 활성……….. 24
2. β-glucosidase처리 후 된장 genistin의
genistein으로의 전환……… 29
1) 전통 된장에서의 genistein 및 genistin의 정성, 정량분석과 효소전환……….. 28
2) 시판용 된장에서의 genistein 및 genistin의 정성, 정량분석과 효소전환……….. 31
3. 옥수수 β-glucosidase처리 후 된장의 물성변화……… 33
1) pH 변화……….……….…….……… 35
2) 점도 변화……… 35
3) 항산화가 변화………. 35
4) 색도 변화……….. ……….. 36
IV. Disscussion……….. 40
V. 결 론………... 44
VI. References……… 45
VII. Abstract………. 52
List of Tables
Table 1. 작용기에 따른 isoflavone structures……… 7 Table 2. HPLC condition……… 17 Table 3. β-glucosidase 처리 전, 후 된장에서의 genistin과
genistein의 함량변화……….. 32
List of Figures
Fig. 1. β-glucosidase에 의한 genistin의 genistein으로의
전환……… 8
Fig. 2. β-glucosidase 활성 측정……… 11
Fig. 3. 된장 중의 genistin의 genistein으로의 전환 개요……. 14
Fig. 4. 건 옥수수, 생땅콩, 흑서리, 백태, 강낭콩, 옥수수의 씨눈의 β-glucosidase 활성…….………... 21
Fig. 5. 생 옥수수의 β-glucosidase 활성……….. 23
Fig. 6. 옥수수 발아 사진……….….. 25
Fig. 7. 건 옥수수의 β-glucosidase 활성……….. 26
Fig. 8. 옥수수 발아 시간별 배아(씨눈)의 무게……… 27
Fig. 9. HPLC peak 비교 ……….. 30
Fig. 10. β-glucosidase 처리 후 된장의 pH 변화………. 34
Fig. 11. β-glucosidase 처리 후 된장의 점도 변화……….. 37
Fig. 12. β-glucosidase 처리 후 된장의 TBA value 변화…….. 38
Fig. 13. β-glucosidase 처리 후 된장의 색도 변화……….. 39
Fig. 14. Genistein 보강 된장 제조 공정……….………. 43
국문요지
최근 estrogen관련 질환을 예방하고 estrogen제제의 부작용을 대 체하기 위한 여러 가지 기능성 물질들 중에서 isoflavone계 물질들 이 각광을 받고 있다. 특히 genistein (4,5,7-trihydroxyisoflavone, M.W. 270)은 된장에 포함된 isoflavone중의 하나로서 일반적으로 각종 암의 유발 억제 및 골다공증, 백혈병, 심장질환, 콜레스테롤 수 치 조절, 항산화 기능성 등 여러 가지 측면에서 효과가 있다. 그러 나 전통된장과 상업용 시판된장에서의 genistein함량은 HPLC분석 결과 된장 1kg 중 각각 5.8mg과 10mg으로 비교적 낮았고 glycon 구조를 하고 있는 genistin의 함량은 각각 375mg/kg, 296mg/kg으 로 genistein함량보다 훨씬 높은 비율로 존재하는 것으로 나타났다.
된장에 포함된 genisin은 함량이 높은 편이지만 생체 내 이용률 및 기능성이 genistein보다 떨어지기 때문에 된장에서 genistin을 ge- nistein으로 전환시키면 기능성이 향상된 된장을 개발할 수 있다.
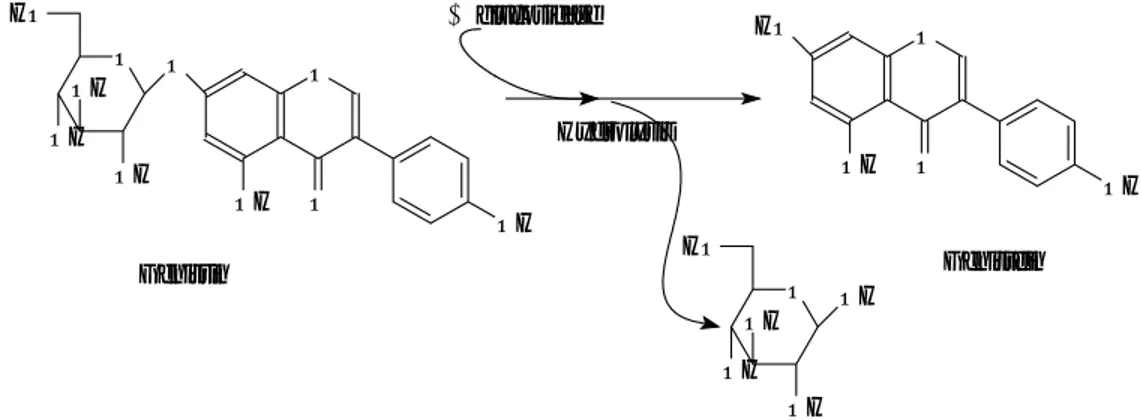
Genistin은 genistein과 glucose가 β-1,4 glucoside 결합으로 이 루어진 형태로 β-glucosidase에 의해 genistein으로 전환될 수 있 다.
식물성 β-glucosidase의 genistin에 대한 기질 특이성을 시험하
기 위해서 전통된장에 아몬드에서 분리 정제된 β-glucosidase를 처 리한 결과 95%의 genistin이 genistein으로 전환 되었다. 경제적인 β-glucosidase 대체원을 찾기 위해서 몇 가지 식물들의 β-glucosi- dase 활성을 측정한 결과 옥수수에서 가장 높게 측정되었으며 생 옥수수를 2일간 발아시킨 것과 건 옥수수를 4일간 발아시킨 것의 효소 활성이 그 중에서도 가장 높게 측정되었다. 시판용 된장에 옥 수수 β-glucosidase를 이용하여 genistin을 genistein으로 69%까지 전환할 수 있었다.
pH, viscosity, TBA value, 색도 등은 시간이 지나도 크게 변하지 않아 genistin이 효소전환 될 때 된장에 포함된 화학물질과 물리적 성질에는 크게 영향을 미치지 못하는 것으로 판단 되었다.
따라서 이번 실험의 결과로 옥수수의 β-glucosidase를 처리하여 genistein이 보강된 된장의 제조가 가능하다는 것을 보여줄 수 있었 고, 이는 기능성 된장 제조 기술의 발전에 기여를 할 것이라고 생각 되어 진다.
I. 서 론
우리나라에서 주로 애용되는 된장은 우수한 단백질 및 지방의 공급 원이 되고 있으며 각종 기능성을 가지고 있는 콩 기반 발효식품이다.
된장은 발효식품 가운데 항암효과가 매우 뛰어나며 간 기능 회복 및 항산화 기능, 고혈압, 노인성 치매, 골다공증 등의 예방효과가 있는 것으로 알려져 있다(Park et al. 2001). 또한, 식이섬유소에 의한 비만 과 변비예방, 심장병 및 뇌졸증 예방, 기미, 주근께 제거에 효과적이 라고 알려져 있다(Su et al. 1979).
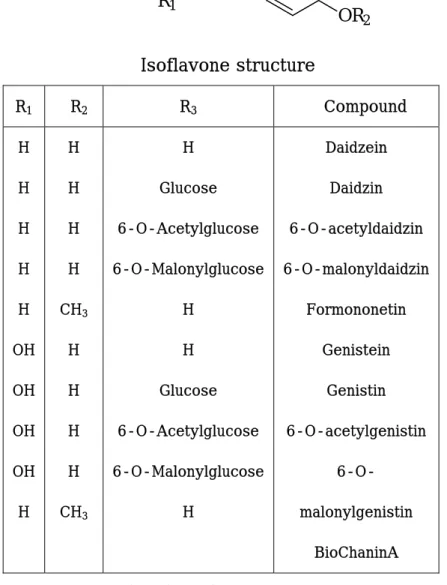
이렇게 많은 효능을 가지고 있는 된장은 isoflavone류에 의해 기능 성을 나타내는데, isoflavone은 식물체에 들어 있는 색소의 일종으로 페놀계 화합물의 배당체(glycon)로 발견되며 대두에 주로 존재하며 발효과정 중 비배당체(aglycon) 형태의 흡수되기 쉬운 genistein, da- idzein으로 변하는 phytochemical로서 phytoestrogen으로 작용하여 estrogen과 같은 생리활성을 갖는다. 콩의 배축이나 배엽에는 isofl- avone을 비교적 많이 함유하고 있으며, 기본적으로 세가지 형태로 분 류되며 화학구조로는 4가지 형이 존재한다(Table 1). 즉, aglycon인 daizein, genistein, glycitein과 glycon형인 daidzin, genistin, glycitin 과 이의 acetyl과 malonyl glycon 각각 3가지씩, 총 12가지 구조로
존재하고 있다(Jeon et al. 1999).
Glycon 형태를 가지고있는 genistin 과 같은 isoflavone 은 위산과 장 내 미생물 효소인 β-glucosidase 에 의해 genistein 등으로 전환되어 (Fig.1) 장에서 흡수되고 지용성이므로 다른 지용성 영양소처럼 chy- lomicron 에 포함되어 림프관을 따라 혈액으로 운반되어 모든 세포에 전달된다. Estrogen 과 유사한 구조를 가지고 있는 isoflavone 은 es- trogen 수용체를 가지고 있는 생식세포에 가장 큰 영향을 미치며 특히 이들 isoflavone 중 genistein 은 genistin 의 aglycon 형으로 in- vitro 에서 유방암, 폐암, 결장암, 전립선암, 피부암을 유발 시키는 세 포의 성장을 저해하며 암세포가 정상화되는 것을 유도 시킨다.
암세포의 증식은 세포막에 도달한 각종 호르몬이나 세포성장인자에 의한 자극이 세포 내 신호전달 물질들의 인산화와 탈인산화 반응의 연속된 신호에 의하여 핵으로 전달되고 핵분열과 세포질분열이 시작 되면서 진행된다. 여기에 관여하는 단백질이 tyrosine kinase, protein kinase C 등으로 세포 내 신호전달 단백질들을 인산화 시키고 세포증 식 신호를 핵에 도달시킨다. Genistein은 이러한 kinase의 기능을 억 제 시키는 기능을 가지고 있어 암세포의 성장을 저해시킨다. 게다가 세포분열을 유도하는 핵단백질로 cyclin과 CDK라는 단백질 복합체에 의한 RB(retinoblastoma) protein의 인산화가 필수적인 과정인데, cyclin CDK 복합체의 기능을 억제 시키는 CDK inhibitor의 발현을
genistein이 촉진시키기 때문에 RB protein의 인산화를 방해하여 DNA합성을 저해시켜 암세포 증식을 방해하게 된다(Kim et al. 1999 ).
또한 in vivo에서 angiogenesis를 억제 시켜 산소 및 영양분의 공급 을 조절하여 종기의 발달을 저해 시키기도 한다(Bae et al. 1997). 서 양여성을 대상으로 한 실험에서는 월경주기를 변화시켜 유방암 발병 비율을 낮추었고 estrogen과 입체적 구조가 유사하여 여성의 폐경기 이후 나타날 수 있는 폐경기 증후군을 약화시키며 뼈의 재흡수를 유 발시키는 osteoclast acid의 분비를 억제 시켜 골다공증 및 백혈병을 억제 시키는 효과를 가지고 있다고 하였다(Anderson et al. 1998).
Plasma cholesterol reduction 기능에 의해 혈당 콜레스테롤을 35%
까지 낮출 수 있다고 보고되고 있으며(Oh et al. 2002), 이외에도 photo damage방지, 주름방지 효과가 있다고 알려져 있고 free radi- cal scavenger로서 vitamine E, C와 같은 항산화능을 가지고 있어 각 종 지방산의 과산화를 방지하여 cyclooxygenase의 합성을 억제하며 PGDH(prostaglandin dehydrogenase)활성을 증가시킴으로써 prost- aglandin의 합성을 억제 시켜 대장암 발병비율을 낮추는 것으로 알려 져 있다. 그러나 생체 내에서 작용하여 나타날 수 있는 부작용이 아 직까지는 알려져 있지 않은 이점 때문에 많은 연구가 이루어지고 있 다(Record et al. 1999).
이와 같이 생리적 유용성을 갖는 isoflavone은 콩에 0.1~0.3% 함
유되어 있어 주 isoflavone공급원으로 사용되고 있다(Iowa State university isoflavone DB, 1999). 아시아인이 하루에 20~80g 콩 식 품을 섭취함으로써 20~50mg의 isoflavone을 섭취하는 반면 미국인 들은 하루에 약 1~3g의 콩 기반 식품을 섭취하여 1mg이하의 isofl- avone을 섭취 하는 것으로 나타났다(Hakkak et al. 2001).
일반적으로 20~30mg의 isoflavone을 섭취해야 암 발병 비율이 떨 어지는 것으로 나타났으며 50~100mg의 genistein을 섭취할 경우에 보다 나은 효과를 기대할 수 있다. Genistein이 phytoestrogen이라 할지라도 estrogen보다는 즉각적인 효과가 떨어지므로 지속적으로 섭 취를 해야 효과가 있다는 것을 염두해야하며 이를 토대로 isoflavone 의 항산화 능력을 본 결과 soy isoflavone 56mg을 2주간 섭취한 후 산화에 의한 DNA의 damage가 93fg/ng에서 49fg/ng으로 줄었으며 (Djuric et al. 2001) 실험용 쥐에 genistein을 1~5mg/kg body wei- ght/day를 섭취 시킨 결과 출생 후 sexual development를 증가시키 는 것으로 나타났다(Kang et al.1998).
Genestein의 과량 섭취에 따른 신체내에서의 악 영향을 알아보기 위하여 37.5~75mg/100g body weight/day를 섭취 시킨 결과 1~5 m g/100g body weight/day의 genistein을 섭취 시킨 것과 차이가 없다 는 것을 알 수 있었으며 자궁의 크기, 수컷 정액의 수 및 활성도 또 한 차이가 없었고 다른 악영향은 발견되지 않아 genistein의 과량 섭
취가 생체 내에서 다른 부작용을 초래하지 않는다는 사실을 확인할 수 있었다(Strauss et al. 2000). 항암효과를 가지고있는 isoflavone의 섭취량을 비교해보았을 때도 알 수 있듯이 동양인은 미국인에 비해 대장암, 전립선암, 대장암 진단 비율이 4~10배 적은 것으로 보고되었 다(American Cancer Society, 1994).
특히 isoflavone 중에서도 비배당체가 배당체 형태로 존재할 때 보 다 체내 흡수율이 높다고 알려졌고, 20mg/kg body weight의 genistin 과 genistein을 쥐에게 섭취시킨 결과 plasma에서의 genistein의 농 도를 비교해 보았을 때 genistein을 섭취했을 경우의 농도가 가장 높 았으며 체내 이용률은 genistein > daidzein > genistin > daidzin 순 으로 나타났다(Toru et al. 2000). Isoflavone의 LDL항산화 기능을 봤 을 때도 섭취율과 비교해서 genistein > genistin > daidzein 순으로 측정 되었으며 free radical 소거제로서 암세포에 대한 효과를 측정해 본 결과 genistien이 암세포 저해 작용에 있어 주요 기능을 하는 것 으로 밝혀졌다(Kapiotis et al. 1997).
지금까지 입증된 genistein의 효과를 나타내기에는 음식물로부터 섭취하는 isoflavone 특히 genistein의 양이 너무 적기 때문에 isofl- avone이 함유된 음식물을 과량 섭취해야 기능성을 나타낼 것이다. 하 지만 실제로 섭취해야 할 음식의 양은 한정되어있기 때문에 geniste- in이 많이 함유되어 있는 식품의 개발이 필요한 실정이다.
콩 기반 식품 중 우리나라에서 주로 섭취하는 발효 식품인 된장에 도 isoflavone이 125~401mg/kg 함유되어 있다. 된장의 전체 isofla- vone중 약 57.4%가 genistin과 genistein으로 존재하고 있다. 특히 된장에 존재하는 genistin과 genistein의 비율은 80%이상이 glucose 가 결합된 isoflavone인 genistin 형태로 존재하고 있다(Jeong et al, 1998). 된장의 기능성을 나타내는 물질로 genistin보다 생체 이용률 이 높은 genistein의 함량에 밀접한 관계가 있다고 할 수 있겠다. 기 존 된장은 몸에 좋다는 사실을 알지만 기능성 건강 식품으로서는 아 직 까지 일반인들에게 인식되지 못하고 있는 실정이며 제품 개발도 미흡하다. 따라서 genistein의 함량이 증가된 된장이 개발되고 상품화 가 이루어진다면 우리나라 전통 식품에 대한 인지도 상승, 여러 질병 의 예방 및 전통 장류 식품의 수출 등으로 시장 규모를 늘릴 수 있을 것이다. 여기에 따른 시장 전망도 밝은 편이어서 응용 식품 및 기타 기능성 제제의 개발도 가능할 전망이다.
본 연구에서는 옥수수로부터 얻은 β-glucosidase를 이용하여 된장 의 genistin을 genistein으로 효소 전환시켰으며 전환된 genistein을 HPLC를 통하여 확인 하였다. β-glucosidase처리 후 pH, 점도, 색도, TBA항산화가 등은 큰 변화를 보이지 않았다. 따라서, genistein의 함 량을 높이면서 물성에 영향을 미치지 않는 genistein이 보강된 된장 을 제조할 수 있다는 것을 보여주고 있다.
O
OR
2R
3O
R
1A B
C
Isoflavone structure
R1 R2 R3 Compound
H
H
H
H
H
OH
OH
OH
OH
H H
H
H
H
CH3
H
H
H
H
CH3
H
Glucose
6-O-Acetylglucose
6-O-Malonylglucose
H
H
Glucose
6-O-Acetylglucose
6-O-Malonylglucose
H
Daidzein
Daidzin
6-O-acetyldaidzin
6-O-malonyldaidzin
Formononetin
Genistein
Genistin
6-O-acetylgenistin
6-O-
malonylgenistin
BioChaninA
Table 1. 작용기에 따른 isoflavone structure
O HO
OH OH
OH
O O
OH O OH
β−glucosidase
Hydrolysis
O HO
OH OH
OH OH
O
OH O OH HO
Genistin Genistein
Fig. 1. β-glucosidase에 의한 genistin의 genistein으로의 전환
II. 실험 재료 및 방법
1. Chemicals
용매는 HPLC-grade 시약을 사용하였으며(덕산 이화학 Co. Ltd), g- enistein (4’,5,7-trihydroxyisoflavone Mw= 270.2)과 genistin은 Sigma(St. Louis, MO, USA) 에서 구입하여 사용하였다.
2. Materials
강낭콩, 생땅콩, 백태, 흑태 등은 국내산으로 서울 농협(하나로)에서 구입 하였고 옥수수(검정 찰 옥수수, 찰 옥수수)는 강원도 철원산을 구입하여 사용하였다. 된장은 양평 지제 농협에서 구입하였고, 대조군 으로 직접 재래식으로 담근 된장을 사용하였다.
3. β-glucosidase 추출
콩과 식물의 씨앗 및 옥수수의 β-glucosidase를 추출하기 위하여 0.1M potassium phosphate buffer, pH 6.0를 1 gram당 4ml buffer
비율로 희석하여 막자 사발에 넣고 입자가 고루게 될 때 까지 분쇄 시킨 후 분쇄 시킨 추출물을 1.5ml E-tube에 분취하였다. 1차 추출물 을 4oC에서 9,700 x g로 2분간 원심분리 하여 상층액을 분리하여 효 소액으로 사용하였다.
4. β-glucosidase 활성 측정
각각의 식물체에서 분리하여 얻은 β-glucosidase 추출액을 0.2ml 취 하여 25oC에서 10분간 preactivation시킨 후 5mM p-Nitrophenol β -D-glucopyranoside가 포함된 50mM potassium phosphate buffer, pH6.0(PNPG solution) 0.5ml과 혼합한 후 25oC에서 1시간 반응 시 켰다. 효소 반응 1시간 후 효소와 기질의 반응을 중지시키기 위해 s- odium tetraborate(BORAX) 포화용액을 1ml씩 첨가하였다. 효소 반 응 전에 1ml BORAX를 첨가해서 반응이 일어나지 못하게 하여 흡광 도 측정 시 대조구로 사용하였다. 효소 활성은 PNPG에 β-glucosid- ase가 작용하여 glucoside의 hydrolysis에 의해 생성된 p-nitrophe- nol의 양을 O.D405에서 측정하였다.
β-glucosidase 1unit는 시간당 1µmol p-nitrophenol을 생성하는 것으로 정의하였다(Fig. 2).
β-glucosidase extraction potassium phosphate buffer, pH 6.0
Preactivation of β-glucosidase extract
Enzyme reaction
0.5ml 5mM p-nitrophenyl-β-D-glucopyranoside in 50mM potassium phosphate buffer, pH6.0
25
oC, 1hour
Termination reaction 1ml saturated sodium
Detection of p-nitrophenol from PNPG O.D
405nmDefinition of 1unit β-glucosidase
: amount that produce 1µmol of p-nitrophenol from PNPG in one hour
Fig. 2. β-glucosidase활성 측정 5. 옥수수 β-glucosidase 활성 측정
옥수수는 β-glucosidase를 함유하고 있고 배아에 가장 많이 존재 하는 것으로 알려져 있다(Esen et al. 2000). 옥수수가 성장하면서 β- glucosidase양에 어떠한 변화가 있는지를 확인하기 위해서 옥수수를 6일 간 발아시켜 효소활성의 변화를 측정하였다. 1L 삼각 플라스크에 약 30개의 건 옥수수 낱알을 세척하여 넣고 멸균된 증류수를 옥수수 가 살짝 잠길 정도로 채운 후 직사광선이 직접 닿지 않는 장소에서 배양을 시작하였다. 1일 간격으로 효소활성은 PNPG를 기질로 하여 생성된 p-nitrophenol의 양을 O.D405에서 측정하였고 3회 반복 실험 하여 최고 활성을 띄는 시간을 측정하였다.
6. 된장에 β-glucosidase처리
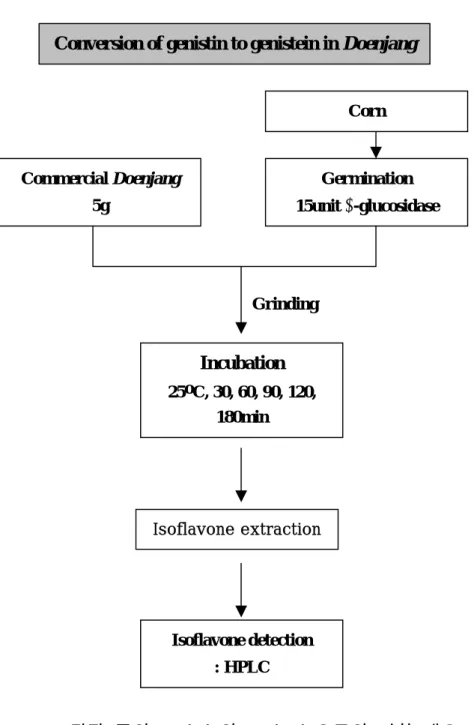
된장의 genistin이 식물성 β-glucosidase에 대해 기질 특이성을 가 져 genistin의 glucoside 가수분해에 의해 genistein이 생성되는지의 여부를 알아보고 genistin의 genistein으로의 전환율을 보기 위해 al- mond로부터 분리, 추출 및 정제된 β-glucosidase를 Sigma(St. Louis, MO, USA)사로부터 구입하여 된장 5g에 5unit를 처리하였다. 옥수수 β-glucosidase의 된장 처리는 활성이 가장 높은 시간대에 취한 옥수 수를 된장 5g과 함께 β-glucosidase가 15unit 첨가되게끔 혼합한 후
막자 사발에 넣고 마쇄시켜 효소가 된장의 genistin과 고루 반응할 수 있게 처리 시켜주었다. 된장에 β-glucosidase를 처리하지 않은 것 을 대조군으로 하고 각각 25oC에서 3시간 반응시켰다(Fig. 3).
Fig. 3.
된장 중의 genistin의 genistein으로의 전환 개요 Conversion of genistin to genistein in Doenjang
Commercial Doenjang 5g
Incubation
25oC, 30, 60, 90, 120,180min
Isoflavone extraction
Isoflavone detection : HPLC
Germination 15unit β-glucosidase
Grinding
Corn
7. 된장의 HPLC분석
1)된장의 isoflavone 추출
동결 건조된 된장을 50ml tube 에 2g 을 취하여 2ml 의 0.1N HCl 과 10ml 의 acetonitrile 을 섞은 후 상온에서 3 시간 교반 시켜 추출 하였고 4oC 에서 6700 x g 에서 3 분 간 원심분리 시킨 후 상등액을 취하여 0.2μm pore size 의 nylon membrane(Sartorius AG, Germa- ny)을 사용하여 여과시키고 얻은 시료를 증발시켜 용매를 제거 시켰 다. 된장 추출물을 80% HPLC 용 methanol 에 녹인 후 0.2μm syrin- ge filter(Sartorius AG, Germany)에서 걸러 HPLC 분석 용 시료로 제조하였다. Almond 로부터 분리, 정제 된 β-glucosidase 를 처리한 된장도 위와 같은 방법으로 처리하여 isoflavone 을 추출하였다.
옥수수에서 분리한 β-glucosidase 를 처리한 된장은 동결건조 하지 않고 반응 후 바로 된장 5g 에 0.1M HCl 5ml 와 acetonitrile 25ml 를 첨가 시켜 3 시간 동안 isoflavone 을 추출 하였다. 이를 8750 x g 에서 3 분간 원심분리 시킨 후 상층액을 취하여 0.2μm pore size 의 nylon membrane 을 사용하여 여과하고 얻은 상층액 시료를 증발 시켜 용매를 제거한 후 냉동보관 하였다.
냉동 보관된 시료의 분석은 400µl 80% HPLC 용 methanol 에 녹인 후 0.2μm syringe filter 로 거른 후 사용하였다.
2) HPLC 정성, 정량분석
준비된 HPLC 분석용 시료를 각각 10µl 주입하여 이동상을 aceto- nitrile 과 H2O 를 gradient 로 분당 1ml 의 유속으로 pump 를 통해 흘려주었다(Table 2). 정성분석을 하기 위해 우선 genistin 과 genis- tein 의 standard peak 와 된장의 peak 를 비교하였으며 실제로 된장 에 genistein, genistin standard 를 첨가하여 spike 되는 peak 를 확 인 하는 방법을 사용하였다(Table 2).
정량분석을 하기 위해 HPLC 에 genistein, genistin 을 각각 100µg /ml, 50µg/ml, 25µg/ml, 10µg/ml, 5µg/ml 의 농도로 standard 를 제조 하여 적분면적을 구한 후 standard curve 를 만들어 된장에서 얻은 HPLC peak 의 적분면적과 비교하여 양을 계산하였다.
HPLC analyses
1) Instrument: Waters 748 Pump Waters U6k injector
Waters 486 UV/VIS Detector
2) Mobile phase; Gradient loading
Initial=> acetonitrile : water(1% acetic acid) = 15 : 85 0min=> acetonitrile : water(1% acetic acid) = 15 : 85 26min=> acetonitrile : water(1% acetic acid) = 35 : 65 27min=> acetonitrile : water(1% acetic acid) = 15 : 85 30min=> acetonitrile : water(1% acetic acid) = 15 : 85
3) Column: Novapak C18 4µm 3.9 x 300mm Column 4) Condition: 10ul injection, 254nm, and 1.0ml/min
Solvent A 0.1% Acetic acid in dH
2O Solvent B 0.1% Acetic acid in acetonitrile
Table 2. HPLC condition
8. 된장의 물성 측정 1) pH
β-glucosidase 처리 전, 후 된장을 각각 증류수와 1:1의 비율로 혼 합한 후 pH meter(Istek, 735P model)를 사용하여 측정하였다.
2) 점도
점도는 No.7 spindle을 장착시킨 BROOKFIELD Digital Viscometer DV-1+(Brookfield engineering Lab. Inc.)를 사용하여 0.1rpm 에서 30초간 작동시켜 점도를 측정하였다.
3) 항산화가
일반된장은 항 산화 효과를 어느 정도 가지고 있으므로 효소 처리된 된장의 항산화가(TBA value)를 측정하여 옥수수 β-glucosidase를 처 리한 후에 된장의 항산화가에 어떤 영향을 미치는지 알아보았다.
된장 3g을 삼각 플라스크에 취하고 benzene 10ml를 혼합하여 용해 시킨 후 TBA혼합액 10ml을 가하고 4분간 반응시켰다. 이 액을 분액 깔때기에 옮겨 정치 시켜 2개 층으로 분리 시켰다. 층 분리를 시켰을 때 된장의 수용성 혼탁액이 완전히 제거되지 않아 6,700 x g에서 5분 동안 원심분리 하여 아래 층을 순수하게 분리하였고 100oC로 가열된 물에서 30분간 가열하고 다시 상온으로 냉각시켜 530nm에서 흡광도
를 측정하여 TBA value를 계산하였다(Zuccarello et al. 2002).
4) 색도
된장에 1 gram당 β-glucosidase 3unit를 처리하여 1일, 2일, 4일, 6일 간 25OC에서 반응시키면서 색도를 측정하였다. 색도를 측정하기 위해 Minolta CL300 색도계를 이용하였고 β-glucosidase를 처리하지 않 은 control과 비교하여 Hunter value(L, a, b) 값을 결정하였다.
III. 결과
2. β-glucosidase 활성 측정
1) 콩과 식물의 β-glucosidase 활성
된장의 genistin 의 genistein 으로의 전환에 식물체의 β-glucosida- se 를 이용하기 위하여 β-glucosidase 활성을 가지고 있는 것으로 알 려진 여러 콩과 식물의 β-glucosidase 활성을 비교해 보았다(Fig. 4).
건 옥수수에서의 β-glucosidase 활성이 5.02 unit/g로 비교적 높게 측정 되었지만 생땅콩 1.31 unit/g, 흑서리 0.97 unit/g, 백태 3.94 unit/g, 강낭콩 0.12 unit/g으로 효소활성이 낮게 나타났다. 흰 찰옥수 수와 검정 찰옥수수에서 분리한 씨눈에서의 효소활성이 6.24 unit/g, 5.56unit/g으로 매우 높았다. 그래서 옥수수 β-glucosidase를 된장에 서 genistin을 genistein으로 전환시키기 위해서 선택하였다.
Fig. 4. 건 옥수수(건조), 생땅콩, 흑서리, 백태, 강낭콩, 옥수수의 씨눈(수분포함)의 β-glucosidase activity(단위: unit/1g)
0 1 2 3 4 5 6 7
Dried white corn
Raw peanut
Black soybean
White soybean
Kidney bean
Raw white corn embryo
Raw Black
corn embryo
unit/g
2) 생 옥수수의 β-glucosidase 활성
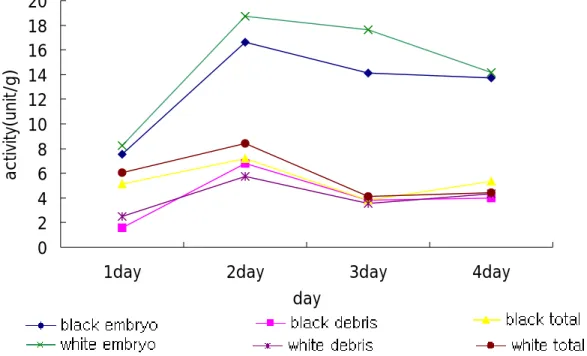
1 gram당 β-glucosidase의 활성이 높은 생 옥수수를 발아시키면서 β-glucosidase 활성을 측정한 결과는 Fig.5 와 같다.
씨눈과 debris를 직접 분리하여 실험한 결과 씨눈의 β-glucosida- se 활성이 높음을 알 수 있었다. 미리 침지시켜놓은 생 옥수수의 경 우 상온(약 25oC)에서 2일째 음지에서 배양시켜 발아하기 시작한 후 가 가장 활성이 높았으며 3일, 4일째 β-glucosidase 활성이 조금씩 감소하는 경향을 나타냈다.
Fig 5. 생 옥수수의 β-glucosidase 활성 0
2 4 6 8 10 12 14 16 18 20
1day 2day 3day 4day
day
activity(unit/g)
3) 건 옥수수의 β-glucosidase 활성
실제로 β-glucosidase 활성을 된장에 적용시켜 isoflavone을 전환 시키려고 할 때 대량 생산을 목적으로 실험을 생각해 본다면 매번 된 장을 제조할 때 마다 생 옥수수를 구해 처리해주는 것 자체가 보관 비용이나, 재료 수급 등의 문제점이 많기 때문에 건 옥수수를 이용하 는 계기가 되었다. 건조되어 냉장 저장된 옥수수를 배양시키며 씨눈 을 발아시켰다(Fig. 6). 씨눈과 debris를 분리시키지 않은 것을 사용 하여 β-glucosidase 활성을 측정한 결과 4일째 가장 높은 3.03unit/g 이 나왔다(Fig. 7). 생 옥수수와 건 옥수수의 씨눈이 발아하여 β- glucosidase 의 활성이 증가하는 시간이 차이가 났으며 이 차이는 건 옥수수 내부의 수분을 공급해주는 시간이 씨눈의 성장(Fig. 8)에 영향 을 미쳤기 때문이며, β-glucosidase 의 활성은 옥수수의 줄기세포가 배아로부터 성장하면서 감소하는 것으로 나타났다(Fig. 6, 7).
1일 2일 3일 4일 5일 7일
Fig. 6. 옥수수 발아 사진
1 1.3 1.6 1.9 2.2 2.5 2.8 3.1 3.4
0 1 2 3 4 5 6 7
Day
Unit/g
Fig 7. 건 옥수수의 β-glucosidase 활성
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
1day 2day 3day 4day 5day 6day 7day
Day
Weight ,g
debris 씨눈
Fig. 8. 옥수수 발아 시간별 배아(씨눈)의 무게
2. β-glucosidase 처리 후 된장 genistin의 genistein으로의 전환
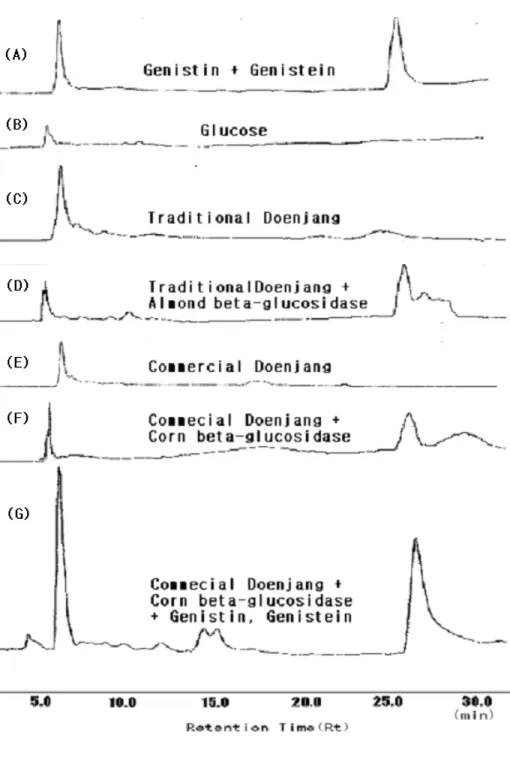
1) 전통 된장에서의 genistein 및 genistin 정성, 정량 및 효소 전환 된장에 β-glucosidase 를 직접 처리하여 된장에 다량 함유된 gen- istin 을 genistein 으로 변환시킬 수 있는지를 확인하기 위해 almond β-glucosidase 를 사용하였다. 우선 전통된장의 isoflavone 추출액을 HPLC 로 분석한 결과 주 peak 는 하나였으며 retention time 이 7.05 분 으로(Fig. 9C) genistin standard peak 와 일치하였다(Fig 9A).
Genistein peak 는 명확히 관찰되지 않았으나 genistein standard peak 와 비교하여 (Fig. 9A) retention time 이 26.5 분인 작은 peak 로 추정되었다.
HPLC peak 의 적분면적을 이용하여 정량 분석한 결과는 된장 1kg 중 genistin 의 함량은 375mg 이 존재하고 있으며 genistein 은 10mg 이 들어있다는 것으로 계산되었다.
Sigma 사로부터 구입한 정제된 almond β-glucosidase 를 전통된장 과 1:3 의 비율로 처리한 후 HPLC 로 분석한 결과 전통된장에서 보 였던 retention time 7.05 분대의 genistin peak 가 거의 소멸된 것을 확인할 수 있었고 5 분 51 초의 retention time 을 가진 새로운 peak 가 관찰 되었다. 또한 26.5 분의 genistein peak 는 증가하였다 (Fig.
9D). 이렇게 7.05 분대의 peak 가 소멸된 것을 보면 genistin 의 β-
glucoside 결합이 β-glucosidase 에 의해 분해된 것을 의미하고, ret- ention time 5 분 51 초의 새로 생긴 peak 는 glucose standard 와 일치하여 β-glucoside 결합이 끊어지면서 생기 는 glucose 라는 것을 확인할 수 있었다(Fig. 9B, D).
정량분석결과 genistein 19mg/kg, genistein 379mg/kg 으로 94.9%의 genistin 이 genistein 으로 전환된 것을 확인할 수 있었다(Table 3).
Fig. 9. HPLC peak 비교
2) 시판용 된장에서의 genistein 및 genistin 정성,정량 및 효소 전환
시판 된장의 HPLC peak 는 전통된장과 비슷한 형태로 genistin 의 peak 가 7 분대에 검출되었으며 genistien 은 극소량으로 peak 로 검출되지 않은 것을 볼 수 있었다(Fig. 9E). 시판 된장은 된장 1kg 중 genistin 296mg 을 함유하고 있었으며 5.8mg 의 genistein 이 들어 있는 것으로 나타났다(Table 3).
옥수수 β-glucosidase 를 처리한 후 시판된장의 peak 를 살펴보면 genistin peak 가 소멸되고 5 분대의 glucose peak 와 25 분대의 ge- nistein peak 가 성장하는 것을 확인할 수 있었다. 실제로 peak 가 g- enistin 과 genistein 의 peak 인지 확인하기 위해서 효소 전환시킨 된장시료에 genistin, genistein 표준시료를 첨가하여 얻은 peak 를 살펴보았을 때 genistin 과 genistein 의 peak 가 성장하였다(Fig. 9G).
β-glucosidase 를 처리해준 peak 를 살펴본 결과 효소 전환된 된장에 genistin 이 92mg/kg 과 genistein 은 209.8mg/kg 이 함유되어 있었다.
따라서, genistin 의 69%가 genistein 으로 전환된 것을 확인할 수 있 었다(Fig. 9F, Table 3).
Genistin content
Genistein content
Conversion ratio
Enzyme used/
Doenjang Traditional
Doenjang 375 mg/kg 10 mg/kg Purified Almond β-
glucosidase treated Doenjang
19 mg/kg 379 mg/kg 95% 1unit/g
Commercial Doenjang
296 mg/kg 5.8 mg/kg
Corn β-glucosidase treated Doenjang
92 mg/kg 209.8mg/kg 69% 3unit/g
Table 3. β-glucosidase 처리 전, 후 된장에서의 genistin과 genistein의 함량변화
3. 옥수수 β-glucosidase처리 후 된장의 물성 변화
된장에 주로 포함되어 있는 isoflavone인 genistin은 옥수수 β-gl- ucosidase의 기질로서 작용하기 때문에 genistein으로 전환시킬 수 있다. 그러나 genistin외에 β-glucosidase의 활성이 다른 화학물질에 관여를 하여 된장의 품질에 영향을 미칠 가능성이 있으므로 물성 실 험을 수행 하였으며 기본적으로 β-glucosidase 처리에 따른 pH 변화, 점도 변화를 측정하였다. 또한, TBA 항산화가, 색도변화를 측정하여 된장 내 기능성 물질들의 분해 및 전환이 일어나는지를 알아보았다.
(1) pH 변화
일반적인 된장의 pH는 4.9~5.3정도로 산성을 나타내고 있다. pH를 결 정하는 주된 인자는 곰팡이이다.
Aspergillus
속,Penicillium
속,Mucor
속,Rhizopus
속들이 된장의 발효에 관여하고 특히 호염성인Pedioc- occus halophilus
는 증식할 때 젖산을 생성하여 된장을 pH 5.0 정도 로 떨어뜨리며, pH 5.0부근이 되면 증식을 중지하게 된다. 15unit 옥 수수 β-glucosidase를 된장 5g에 처리하여 실제로 pH의 변화가 있 는지 10, 30, 60, 90, 120, 150, 180분 동안 배양시켜 실험하였다(Fig.10). β-glucosidase처리 후에도 pH는 4.9로 변화가 거의 없었다.
3 3.5 4 4.5 5 5.5 6
0 50 100 150 200
Time(min)
pH
Fig. 10. β-glucosidase 처리 후의 pH 변화
(2) 점도 변화
β-glucosidase처리 후 된장의 점도는 처리 전 보다 약 0.7*106cp 높게 측정 되었다(Fig. 11). 이러한 원인은 β-glucosidase를 처리해 줄 때 β-glucosidase를 정제해서 처리한 것이 아니라 옥수수 debris 와 같이 처리하였기 때문에 된장 중의 수분 함량이 약간 감소하면서 생긴 결과로 추정된다. 그러나 0.7* 106cp차이는 실제 된장의 품질에 있어서 점도가 높아져 품질 저하를 초래할 정도의 수치는 아니다.
(3) 항산화가 변화
된장 중에 항산화 활성을 가지는 물질들은 우선적으로 된장 내에 존 재하는 산화 가능한 지질류의 산화를 막아 된장이 안전한 식품으로서 가치를 지니도록 하고 있다. β-glucosidase처리 전, 후 된장의 산화물 량을 계산하여 항산화 활성물질의 활성을 TBA value로 나타내었다 (Fig. 12). 25oC에서 배양 0시간부터 5시간 까지 시간별로 sampling 하여 530nm에서 산화물량을 측정하고 항산화가를 결정한 결과 β-g- lucosidase를 처리 시킨 후에도 항산화 활성이 그대로 유지된다는 것 을 알 수 있었다(Fig. 12). 된장에서 항산화 작용을 하는 물질은 콩에 함유된 황색소인 daidzein 및 daidzin을 비롯한 genistein 과 같은 i- soflavone 류 이며 이들은 polyphenol류에 속하는 물질들이다. 된장 중의 또 다른 하나의 항산화 물질은 아미노산류와 당류의 반응으로
생성된 melanoidin상의 물질로서 이러한 물질들이 β-glucosidase의 처리에 의한 반응에 안정하다는 것을 알 수 있었다.
(4) 색도 변화
장류의 갈변은 영양성분인 단백질로부터 유래한 아미노산과 탄수화 물로부터 유래한 당류가 서로 반응하여 형성하는 갈색의 멜라노이딘 (melanoidin, 갈색색소)으로 인하여 발생한다. 멜라노이딘은 인체 내 내당성을 개선하고 트립신 저해작용 등으로 당뇨병의 예방이나 개선 에 이바지 할 것으로 기대되며 위암발생, 니트로소 아민의 생성 감소 및 유산균 증식효과, 과잉 섭취된 철 성분과 체내결합방지, 유리기 발 생에 의한 세포막 확산 방지 등의 효과를 가지고 있어 여러 가지 기 능성을 나타내고 있다. 이와 같은 기능성 물질에 있어서 β-glucosi- dase가 된장 색소와 반응하여 분해산물을 나타내는지 아니면 안정한 지를 알아보기 위해 된장의 색도를 1일부터 6일간 측정한 결과 β-g- lucosidase를 처리하지 않은 대조구는 Hunter value가 L: 30.44, a:
7.1, b: 11.39였으며 β-glucosidase처리 후의 Hunter value는 L:34.2, a:6.84, b:12.39로 측정되어 된장의 색도 변화에는 그렇게 영향을 미 치지 못함을 알 수 있었다(Fig. 13).
0 1 2 3 4 5 6
0 50 100 150 200
시간(min)
cp(x10^6) cp(처리전)
cp(enzyme 처리 후)
Fig. 11. β-glucosidase 처리 후 된장의 점도 변화
100 200 300 400 500 600 700
0 50 100 150 200 250 300 350
시간(min)
TBA value
Fig. 12. β-glucosidase 처리 전, 후 된장의 TBA value 변화
Fig. 13. β-glucosidase처리 전, 후 된장의 색도 변화(Hunter value) 0
5 10 15 20 25 30 35 40
- + - + - +
L a b
chromaticity
0day 1day 2day 4day 6day
IV. Discussion
1. 된장에서의 genistein 전환
1) Genistein으로 전환 시킴으로써 얻는 이점
배당체인 genistin이 비배당체인 genistein으로 전환 되었을 때 체내 이용률이 증가하는 등 여러 가지 이점이 따른다. 특히 항암 활 성 및 항산화 효과를 비교하였을 때도 체내에서 genistein의 형태가 다른 isoflavone류와 비교하여 가장 활성이 높아 기능성이 더욱 좋은 것으로 알려졌다. 또한, genistein이 보강된 식품을 개발한다면 섭취 해야 할 식품의 양이 줄어들어 요즘 들어 서구화되고 간편화된 우리 식생활 문화를 개선 할 수 있을 것이다. 또한 전통 식품의 소비 증대 및 여러 질병에 효과를 나타낼 수 있어 앞으로의 응용 범위가 넓다.
2) 95% 전환시킨 된장의 genistein함량
전통된장 및 시판된장에 포함되어 있는 genistein의 양은 각각 5.8, 10mg/kg 으로 소량으로 존재하였다. 이는 1Kg의 된장 중에 genistein 6.0mg이 함유 되었다는 보고(Choi et al. 1999)와 유사한 결과이다.
이렇게 소량 존재하고 있는 genistein을 효소전환 시켜 69%~95%의 genistin이 전환되는 것을 확인하였다. 따라서 genistein 보강 된장의 경우 209.8mg/kg~379mg/kg의 genistein이 함유되어 있는 것으로 나타났으며, 일반적으로 genistein의 효능을 보기위해서 20~30mg/
day를 섭취해야 하기 때문에 95% 전환률을 기준으로 genistein 보강 된장 약 50g 을 섭취해야 한다.
효소 전환된 된장의 섭취해야 할 양이 상당히 줄어든 것을 볼 수 있 었으며 실제로 된장과 함께 두부 및 콩 기반 식품과 같이 섭취를 한 다면 하루에 섭취 가능한 양이며 기존 된장보다 기능성이 배로 증가 될 것이라고 생각된다.
3) Genistin의 섭취 전 전환의 필요성
Genistin과 같은 배당체의 isoflavone은 신체에 흡수되기 전 위와 장에서 미생물에 의해 비배당체로 분해 될 수 있다는 사실이 알려졌 다(Kim et al., 1999). 하지만 genistein이 장내 미생물에 의해 genis- tein으로 전환될 경우 기본 isoflavone구조의 작용기(R1)에 methyl기 와 같은 기존 isoflavone과 다른 작용기가 붙게 될 확률이 높기 때문 에 genistein이 장내 효소에 의해 가수분해가 되더라도 genistein으로 만 전환되는 것이 아니다.
따라서 isoflavone 배당체 섭취 전에 genistin에 기질 특이성을 갖는 β-glucosidase를 처리하여 전환시키는 것이 중요하다고 할 수 있겠 다.
2. Genistein이 보강된 기능성 된장의 생산
기존의 된장 제조공정은 우선 소맥분, 대두, 밀쌀을 스팀을 이용하여 증자시킨 후 제국실로 이동시켜 증자된 소맥분에 종국(황국균)을 접종하여 약 42 시간 동안 증식시켜 단백질 및 탄수화물을 분해하는 효소를 생산한다. 제국된 소맥분과 증자된 밀쌀, 대두에 식염, 정수를 일정비율로 혼합하여 숙성탱크로 이송하고 숙성탱크에서 일정한 발효기간을 거쳐 잘 숙성된 반제품을 메주 및 기타 첨가물을 첨가하 여 열처리한 다음 냉각시켜 마쇄기로 갈은 후 완제품 서비스 탱크로 이송한다. 이 과정에서 β-glucosidase 를 처리하여 된장중의 genist- ein 함량을 높이려면 우선 원료를 배합하여 숙성 후 바로 β-glucos- idase 를 처리해야 한다. 25oC 에서 약 3 시간 교반시켜 genistin 을 효소전환 시킨 후 식염, 정수를 혼합한다면 genistein 보강 된장을 생산할 수 있을 것이라고 본다(Fig. 14).
원료증자 과정 소맥분 제국과정
옥수수 β-glucosidase 첨가
incubation (25oC)
원료혼합(소맥분,밀,쌀,식염,정수) 원료배합
포장제품 완성
Fig.14. Genistein보강 된장 제조 공정
V. 결 론
옥수수 β-glucosidase 를 이용하여 된장 중의 genistin 을 체내 흡 수율 및 건강 기능성이 높은 genistein 으로 69% 전환된 genistein 이 보강된 된장을 개발하는데 성공하였다.
이번 실험을 바탕으로 효소 처리량이나 배양시간 등을 조절 한다면 된장의 genistin 전환율을 더 높일 수 있을 것이라고 예상되어지며 g- enistein 이 보강된 기능성 된장의 제조에 적용될 수 있을 것이다.
VI. References
1. Anderson, K., (1998). Sex and long-term soy diets affect the metabolism and excretion of soy isoflavones in humans. Am. J.
Clin. Nutr. 68: 1500~1504.
2. Bae, E. A., Kwon, T. W. (1997). Isoflavone contents and antio- xidative effects of soybeans, soybean curd and their byproducts.
J. Korean Soc. Food Sci. Nutr. 26: 371~375.
3. Carrao, P. M., Kitamura, K. (1995). Isoflavone content in Braz- ilian soybean cultivars. Breeding Sci. 45: 295~300.
4. Choi, C., Choi, K. S. (1996). Characteristics and action pattern of protease from
Bacillus subtillis
CCKS-111 in Korean traditio- nal soy source. J. Korean Soc. Food Sci. Nutr. 25: 915~921.5. Choi, S. Y., Cheigh, M. J. (1999). Growth suppression effect of traditional fermented soybean paste(
Doenjang
) on the various t- umer cells. J. Korean Soc. Food Sci. Nutr. 28: 458~463.6. Choi, U. K., Ji, W. D. (1998). Characteristics of Chunggugjang produced by
Bacillus subtillis
DC-2. J. Korean Soc. Food Sci. Nutr.27: 846~851.
7. Decker, C. H., Visser, J. (2001). β-glucosidase multiplicity fr- om
Aspergillus tubingensis
CBS 643.92: Purification and charac- terization of four β-glucosidases and their differentiation with r- espect to substrate specificity, glucose inhibition and acid toler-ence. Appl. Microbiol. Biotechnol. 55: 157~163.
8. Djuric, Z., Chen, G., Doerge, D. R., Heilbrun, L. K., Kucuk, O., (2001). Effect of soy isoflavone supplementation on markers of oxidative stress in men and women. Cancer Lett. 172: 1~6.
9. Freer, S. N. (1985). Purification and characterization of the e- xtracellular β-glucosidase produced by
Candida wickerhamii
. Arch. Biochem. Biophy. 243: 515~522.10. Freer, S. N. (1993). Kinetic characterization of a β-glucosid- ase from a yeast,
Candida wickerhamii
. J. Biol. Chem. 268:9337~9342.
11. Hakkak, R., Korourian, S., Shelnutt, S. R., Lensing, S., Ronis, M.
J., Badger, T. M., (2000). Diets containing whey proteins or soy protein isolate protect against 7, 12-dimethylbenz(a)anthracene- induced mammary tumors in female rats. Cancer Epidemiol. Bio- markers Prev. 9: 113~117.
12. Hernandez, L. F., Espinosa, J. C. (2002). β-glucosidase acti- vity in a
Saccharomyces cerevisiae
wine strain. Int. J. Food Mic- robiol. 10: 2471.13. Hsieh, M. C., Graham, T. L. (2001). Partial purification and c- haracterization of a soy bean β-glucosidase with high specific activity towards isoflavone conjugates. Phytochemistry 58: 995
~1005.
14. Hessler, P. E., Constantinou, A. I. (1997). Isolation of isoflav- ones from soybased fermentations of the erythromycin produci- ng bacterium
Saccharopolyspora erythraea
. Appl. Microbiol. Bio- technol. 47: 398~404.15. Jeong, J. H., Kim, J. S. (1998). Studies on the contents of free aminoacids, organic acids and isoflavones in commercial soybe- an paste. J. Korean Soc. Food Sci. Nutr. 27: 10~15.
16. Kim, J. S. Yoon S. (1999). Isoflavone contents and β-glucos- idase activity of soybean, Meju, and
Doenjang.
Korean J. Food Nutr. 31: 1405~1409.17. Kim, S. H., Lee, Y. J. (1999). Isolation of angiotensin conver- ting enzyme inhibition from
Doenjang
. Korean J. Food Nutr. 31:848~854.
18. Kim, S. H., Yang, J. L. (1999). Physiological functions of Chon- gkukjang. Food Ind. Nutr. 4: 40~46.
19. Kil, J. O., Kim, G. N. (1998). Production and characterization of fibrinolytic enzyme: Optimal condition for production of the e- nzyme from
Bacillus
sp. KP-6408 isolated from Chungkookjang.J. Korean Soc. Food Sci. Nutr. 27: 51~56.
20. Ko, H. S., Cho, D. H. (1999). The effect of quality improvem- ent by Chungkukjang's proceeding methods. Korean J. Food Nutr.
12: 1~6.
21. Krishinan, H. B. (1998). Identification of genistein, an antica- rcinogenic compound, in the edible tubers of the American grou- ndnut(Apios americana Medikus). Crop Sci. 38: 1998.
22. Lamartiniere, C. A., Moore, J. (1995). Neonatal genistein che- moprevents mammary cancer. P.S.E.B.M. 208: 43843.
23. Lamartiniere, C. A., Moore, J. B. (1995). Genistein suppresses mammary cancer in rats. Carcinogenesis 16: 2833~2840.
24. Lee, J. S., Cheigh, H. S. (1997). Composition and antioxidati- ve characteristics of phenolic fractions isolated from soybean f- ermented food. J. Korean Soc. Food Sci. Nutr. 26: 383 ~389.
25. Lee, K. H., Kim, N. D. (1997). Survey on manufacturing pro- cess of traditional
Meju
for and ofKanjang
(Korean Soy source).J. Korean Soc. Food Sci. Nutr. 26: 390~396.
26. Lee, M. H., Park, Y. H. (2002). Isoflavone content in soybean and its processed products. Korean J. Food Sci. Technol. 34:
365~369.
27. Lee, S. K., Kim, N. D. (2002). Development of traditional
Doe- njang
improvement in color. Korean J. Food Sci. Technol. 34:400~406.
28. Lee, S. S., Han, J. S., Lee, I. H., Yang, Y. Y, Suh, J. W. (2002).
Stable secretion vector derived from the RCR(rolling circle repl- ication)plasmid of
Bacillus mesentericus
. J. Microbiol. 40:140~145.
29. Mullner, C., Sontag, G. (1999). Determination of some phytoe- strogens in soybeans and their processed products with HPLC and coulometric electrode array detection. Fresenius J. Anal. C- hem. 364: 261~265.
30. Oh, H. S., Park, Y. H. (2002). Isoflavone contents, antioxidat- ive and fibrinolytic activities of some commercial cooking with rice soybean. Korean J. Food Sci. Technol. 34: 498-504.
31. Painbeni, E., Valles, S. (1992). Purification and characterizat- ion of a
Bacillus polymyxa
β-glucosidase expressed inEscheri- chia coli
. J. Bacteriol. 23: 3087~3091.32. Pandiaitan, N., Hettiarachchy, N. (2000). Enrichment of geni- stein in soy protein concentrate with β-glucosidase. Inst. Food Technol. 65: 403.
33. Park, B. J., Jang, K. S. (2002). Changes of microbiological and physiochemical characteristics of
Doenjang
prepared with low s- alt content and gamma irradiation. Korean J. Food Sci. Technol.34: 79~84.
34. Peralta, R. M., Kadowaki, M. K. , Terenzi, H. F. and Jorge, J. A.
(1997). A highly thermostable β-glucosidase activity from the thermophilic fungus
Humicola grisea var
.thermopedia
: purifica- tion and biochemical characterization. FEMS Microbiol. Lett.146: 291~295.
35. Park, S. K., Seo, K. I. (2000). Quality assesment of commer- cial
Doenjang
prepared by traditional method. J. Korean Soc. F- ood Sci. Nutr. 29: 211~217.36. Park, Y. H., Yoon, S. (2001). The effect of isoflavone supplem- entation on bone metabolism in ovariectomized SD rats. J. Kore- an Soc. Food Sci. Nutr. 30: 657~661.
37. Record, I.R., Broadbent, J.L., King, R.A., Dreosti, I.E., Head, R.
J. and Tonkin, A. L. (1997). Genistein inhibits growth of B16 me- lanoma cells in vivo and in vitro and promotes differentiation in vitro. Int. J. Cancer 72: 860~864.
38. Skory, C. D., Freer, S. N., (1996). Properties of an intracellular β-glucosidase purified from the cellobiose fermenting yeast
Ca- ndida wickerhamii
. Appl. Microbiol. Biotechnol. 46: 353 ~359.39. Son, J. Y. (2001). Antioxidant and synergistic effect of sesa- me oil cake extract treated from β-glucosidase. Korean J. Food Nutr. 14: 591~595.
40. Strauss, L., Makela, S., Joshi, S., Huhtaniemi, I., Santti, R.
(1998). Genistein exerts estrogen-like effects in male mouse reproductive tract. Mol. Cell Endocrinol. 144: 83~93.
41. Su, Y., Kim, H., Xu, J., Xia, H. Peterson, G. (2001). Action of the soybean phytoestrogen genistein in models of human chronic disease: potential involvement of transforming growth factor β.
Biochem. Soc. 29: 216~223.
42. Turner, B. L. (2002). β-glucosidase activity in pasture soils.
Appl. Soil Ecol. 20: 157~162.
43. Wang, H. J., Murphy, P. A. (1994). Isoflavone composition of American and Japanese soybean in Iowa: Effects of variety, crop year, and location. J. Agric. Food Chem. 42: 1674~1677.
44. USDA-Iowa state university database on the isoflavone conte- nts of foods(1999).
VII. Abstract
The effects of β-glucosidase addition on Genistein Contents and Physicochemical Characteristics in Doenjang
Jee-Hwan Oh
Department of Chemistry, Kookmin University, Seoul 136-702
Genistein, one of the isoflavones in
Doenjang,
is generally kno- wn to prevent various cancer, osteoporosis, climacterium, and m- enopause symptom. While the contents of genistein were about 5.8 and 10mg/kg in traditional and commercialDoenjang
, which is too low to exert full beneficial effects, those of genistin were 375 and 296mg/kg, respectively. To increase genistein content inDoenjang
, several sources of β-glucosidases were tried to convert genistin to genistein. After treatment of traditionalDoenjang
with β-gluco- sidase purified from Almond, 95% of genistin was converted to g-enistein, suggesting that plant β-glucosidase can be useful. The c- orn β-glucosidase among several plant β-glucosidases tested showed the highest activity after 2 day germination. With corn β- glucosidase, up to 69% of genistin in commercial
Doenjang
could be converted to genistein.However, physiochemical characteristics such as pH, viscosity, and TBA value were not changed. Therefore, this study shows that the improved