3차원 배양기술
3차원 배양기술은 다양한 기술이 개발되어 있지만, 현 재 크게 세 가지 기술로 나눌 수 있다. 첫 번째는 Spheroid 기술이고, 두 번째는 membrane 배양 기술이고, 마지막으 로는 hydrogel 기술이다.
Spheroid는 암세포의 특성과 같은 과학적 근거들을 도 출해 낼 수 있는, 단세포 배양의 단점을 극복한 기술이다.
Spheroid는 3차원적으로 세포가 군집해 있는 시스템이며 spheroid 디자인은 한 종류의 세포가 존재하느냐 혹은 두 종류의 세포가 조재하느냐에 달려 있고, 그 중 다른 두 종 류의 세포가 존재하는 spheroid의 예는 암 세포와 혈관세
백 창 윤 중앙대학교 융합공학부 바이오메디컬 전공 박사과정 ㅣ e-mail : cybaek@cau.ac.kr 민 준 홍 중앙대학교 융합공학부 바이오메디컬 전공 부교수 ㅣ e-mail : junmin@cau.ac.kr
인공장기 등 다양한 세포관련 연구를 수행할 때 요구되는 세포공배양에서 세포를 2D/3D 패터닝하는 기술은 장기를 모사하기 위한 필수적인 공정 중의 하나로 간주된다. 그러므로 이 글에서는 가장 간단하게 세포 및 표면을 이용하여 세포를 패턴화하고, 공배양할 수 있는 방법들에 대하여 설명하고자 한다.
선택적 세포 패터닝 기술
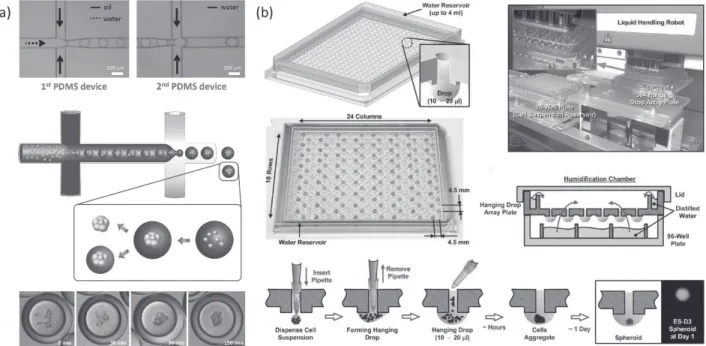
그림 1다양한 spheroid 배양을 위한 기술: (a) 미세유체 시스템인 이중 에멀젼 물방울 형태를 이용한 다중 spheroid 형성 기술 (H.F.Chan et al, Sci. Reports, 1, 3, 2013); (b) 384 well에서의 hanging drop 시스템을 이용한 spheroid 배양 방법 과정(Y-C. Tung et al, Analyst, 473, 136, 2011)
포의 구성으로서 단층으로 자라는 세포보다 임상적으로 나타나는 특징이 유사한 결과를 나타내기에 주목받고 있 는 기술 중 하나이다. 암세포는 실제 사람 조직 내에 spheroid 상태로 존재하며, 주변의 혈관을 끌어들여 성장 하고 이동한다. 이렇게 생체 내 연관성이 더 높은 spheroid 배양 기술은 암이 생성되는 과정부터 혈관 밖으 로 빠져나와 전이되는 과정 등의 메커니즘을 밝혀내는 데 에 이용되고 있다. 뿐만 아니라 이러한 spheroid가 가지는 장점 중의 하나는 효과적인 약물 처리를 확인 할 수 있는 모델이라는 점이다. 기존 2차원 환경에서 세포를 배양하 여 약물의 효과를 확인하는 경우에 비해 약물이 암세포까 지 투과되는 시간, 암세포가 약물에 저항하는 양상까지 판이한 결과가 나타남으로써 spheroid 배양 시스템이 절 실히 요구되고 있다.
Spheroid를 만드는 방법에는 간단하게 세포가 붙지 않 는 플레이트 및 플라스크 안에서 세포를 배양하는 방법부 터 미세유체 칩을 이용하여 구형의 세포구조물을 만드는 등 다양한 방법들이 개발되고 있다. 기존의 액적 기반의 미세유체기술을 응용하여 spheroid를 만들기도 하며(그 림 1(a)), 최근에는 Hanging drop 시스템이 개발되었는데
(그림 1(b)), 이는 물방울 안에 세포가 존재하게 되면 중력 에 의해 아래로 내려가게 되고 물방울의 표면장력에 따라 자연스럽게 spheroid 형태로 배양이 가능한 시스템으로 써, 384 well까지 적은 비용으로 대량의 세포 군집을 배양 할 수 있다는 장점을 가지고 있다. 그러나 3차원에서 세포 와 세포 사이의 상호작용을 연구할 수 있는 일정한 크기 의 spheroid를 만드는 것에는 어려움이 있으며 미세유체 시스템을 이용하여 작은 크기를 만들어도 이들을 추출하 거나 제어하기에도 한계가 있다.
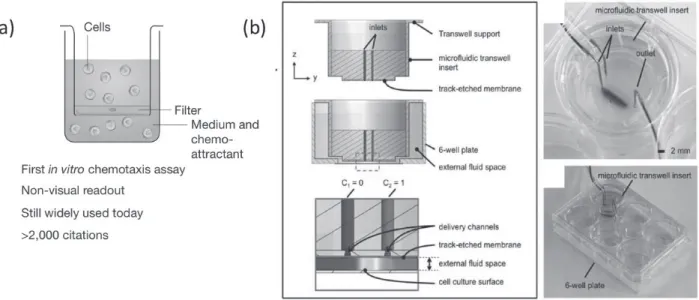
두 번째로는 membrane을 이용한 방법으로, 지름 약 0.4 ㎛에서 약 8 ㎛의 구멍이 뚫려 있는 두께 10 ~ 20 ㎛의 얇은 막의 위 또는 아래에 세포가 배양되고 이 얇은 막을 사이에 두고 세포가 통과하기도 하고 다른 세포와의 상호 작용도 가능한 시스템이다. 보편적으로 상용화되어 많이 사용되는 것은 Boyden chamber로서 그림 2(a)에서 보듯 이 얇은 막 사이로 세포와 다른 세포의 상호작용에 따른 세포 이동성과 성장을 비교하기도 하며 화학적인 변화에 의한 세포 이동 및 침투와 관련된 특성 변화를 간접적으 로 관찰할 수 있는 시스템이다. Membrane을 이용한 3차 원 배양 시스템은 주로 membrane 위와 아래에 암세포와
그림 2Membrane을 이용한 3차원 세포 배양 방법: (a) 전통적으로 이용되는 Boyden chamber에 세포를 배양하는 방법(E.K.
Sackmann et al, Nature, 181, 13, 2014); (b) membrane에 미세유체 시스템을 도입하여 농도구배를 형성함으로써 다 양한 생물학적 분자들의 역할을 파악 가능할 수 있는 시스템(C.G. Sip et al, Lab chip, 302, 14, 2014)
선택적 세포 패터닝 기술
혈관세포를 배양함으로써 암조직이 혈관을 끌어들이는 초기 단계에 일어나는 특성을 파악할 때 이용되거나, membrane 위와 아래 성장 배지의 성분을 다르게 함으로 써 어떤 화학적 인자가 암을 성장시키고 전이시키는지 밝 혀내는 데 많이 사용되고 있다. 최근에는 membrane 안에 미세유체 시스템을 도입함으로써 생물학적 인자의 농도 구배에 따른 세포의 성장, 형태 및 움직임을 관찰한 연구 가 있었다(그림 2(b)). 이러한 시스템들은 spheroid 배양 시스템에 비해 배양 조건을 원활히 조절할 수 있는 장점 이 있으나 membrane을 제작하는데 많은 비용과 시간이 필요하다는 점과 membrane 위에서 변화된 세포나 혹은 membrane을 뚫고 이동한 세포의 정확한 정량적 측정에 한계 있으며 궁극적으로는 세포와 세포의 상호 작용 및 특성을 간접적으로 파악하는 단점이 있다.
마지막으로 hydrogel을 이용한 3차원 세포 배양은 세포
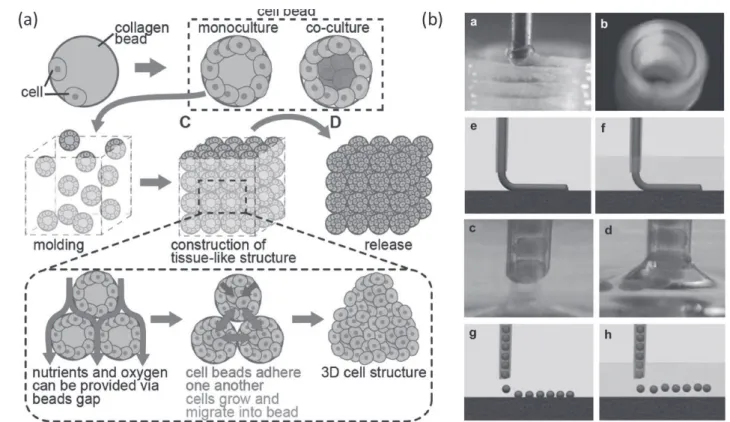
와 세포사이에 존재하여 조직을 구성하는 물질과 유사한 성분을 이용하여 생체 내 환경을 형성해 주는 것과 동시 에 hydrogel이 가지고 있는 물리적 특징을 이용해 세포를 3차원으로 배양하는 기술이다. 가장 많이 이용되는 재료 중의 하나는 세포와 세포 사이를 구성하는 세포외기질 (ECM: Extracellular matirx)을 이용하여 세포를 배양하는 방법이다. ECM은 다양한 형태의 단백질과 다당류 등으로 이루어져 있으며 가장 상용화된 matrigel은 성장인자가 포 함되어 있으며 온도에 따라 고체 상태로 존재할 수 있기 때문에 손쉽게 3차원 세포 배양을 가능하게 하여 많이 사 용되고 있다. 그러나 matrigel은 비용 측면에서 대량 실험 이 어렵기 때문에 대체 가능한 agarose나 alignate와 같은 천연 hydrogel인 생체적합한 매트릭스를 이용하여 생체 내 환경을 재연하여 세포를 배양할 수 있는 연구가 활발 히 진행되고 있다(그림 3(a)). 또한 그림 3(b)에서 나타나
그림 3Hydrogel을 이용한 3차원 세포 배양 방법: (a) hydrogel bead 기반 3차원 세포 배양 몰드 구성(Y. Morimoto et al, Biomater. Sci., 257, 1, 2013); (b) hydrogel을 이용한 바이오 프린팅 기술(V. Mironov et al, Biomaterials, 2164, 30, 2009)
듯이, 3D 프린터 기술과 접목하여 기계적 강도가 있는 hydrogel을 이용함으로써 원하는 모양으로 세포를 배양 할 수 있기 때문에 향후 장기 배양에 긍정적인 측면을 제 시하고 있다.
공배양기술
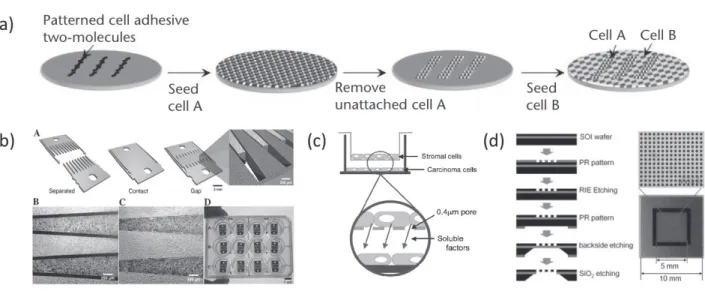
공배양기술의 핵심은 원하는 곳에 원하는 세포를 위치 시키는 기술로써, 생물학적인 방법, 기계적인 방법, 공간 적인 방법, 화학적인 방법으로 크게 나눌 수 있다. 생물학 적인 방법은 원하는 세포가 특이한 항원을 가지고 있는 경우에 사용된다. 세포를 위치하고자 하는 부분에 원하는 세포에 특이적인 항체를 고정화시키는 방법이 있다(그림 4(a)). 하지만, 이 방법은 단백질 칩을 제작할 때 사용하는 spotter를 이용하여 세포를 고정화시킬 수 있는 장점이 있 지만, 특이 세포에만 적용되는 단점이 존재한다. 또한 대 부분의 상피세포는 표면에 접합되어 성장하므로, 조건이 매우 제한적이다. 기계적인 방법으로는 두종류의 세포를 각각 표면에 성장시킨 후, 이를 기계적으로 접합하여 세
포들의 연결를 시도할 수 있는 방법이다(그림 4(b)). 이 경 우, 비교적 간단하게 세포 간 interface를 증가시킬 수 있는 장점이 있지만, 세포를 각각 배양/성장시켜야 하므로, 세 포 배양조건이 동일하다고 말하기 어려운 단점이 존재한 다. 그러므로 보통 공배양을 위해서, 가장 효율적인 방법 은 membrane을 이용하는 공간적 공배양 법이다(그림 4(c)). 보통 trans well이라고 불리는 membrane을 사용하 는 이 방법은 0.4 ~ 8 마이크론 크기의 마이크로포어가 있 는 필터(그림 4(d))를 이용하여 상부와 하부에 각각 다른 세포를 키우는 방법이다. 비정형의 미세구멍이 있는 멤브 레인보다, 실리콘 웨이퍼를 이용하여 정확한 크기와 개수 를 얻을 수 있다는 장점이 있는 반면에, 광패턴과 DRIE 식 각 공정이 요구되기 때문에, 가격이 상승하는 단점이 있 다.
그러므로 단일표면에 형광 등 광학적인 방법을 이용하 여 세포의 특성을 파악하기 위해서는 이차원의 표면에 DNA칩 및 단백질칩과 같이 패턴이 되어 있는 세포칩의 요구가 증가하고 있다. 이를 위하여 세포를 원하는 곳에 고정화하는 방법이 지속적으로 개발되어 왔고, 그 중 가
그림 4여러 가지 공배양 기술: (a) 세포 특이적 항체 고정화를 이용한 세포 공배양 기술(S.N. Bhatia et al, J. Biomed. Mater.
Res., 189, 34, 1997); (b) 기계적 접합을 도입한 세포 공배양 기술(C.A. Goubko et al, Mat. Sci. Eng. C, 1855, 29, 2009); (c) membrane을 이용한 공간적 공배양 기술(Y. Miki et al, J. Steroid Biochem., 68, 131, 2012); (d) 마이크로 포어로 구성된 세포 분석용 필터(H.J. Lee et al, Angew. Chem. Int. Ed., 8337, 52, 2013)
선택적 세포 패터닝 기술
장 간단한 방법이 표면의 wetabillity를 이용하는 방법이 다. 세포는 세포 자신이 선호하는 wetting angle이 있으므 로, 원하는 부분의 표면만 특성을 변화시켜, 세포를 패턴 배양하는 것이다. 표면을 선택적으로 개질하기 위해서는 크게 화학적인 방법, 물리적인 방법으로 구분할 수 있다.
화 학 적 인 방 법 은 다 양 한 링 커 화 합 물 (APTES(3- aminopropyl)triethoxysilane), n-Butyl trimethoxysilane 등) 을 이용하여 표면의 친수성/소수성을 조절할 수 있다. 하 지만, 화학물질을 다시 패턴화하기 위하여 spotter 등을 이 용해야 하는 불편함이 있고, 세포가 표면전하에 따라 거 동특성이 변화할 수 있기 때문에 물리적인 방법이 더 선
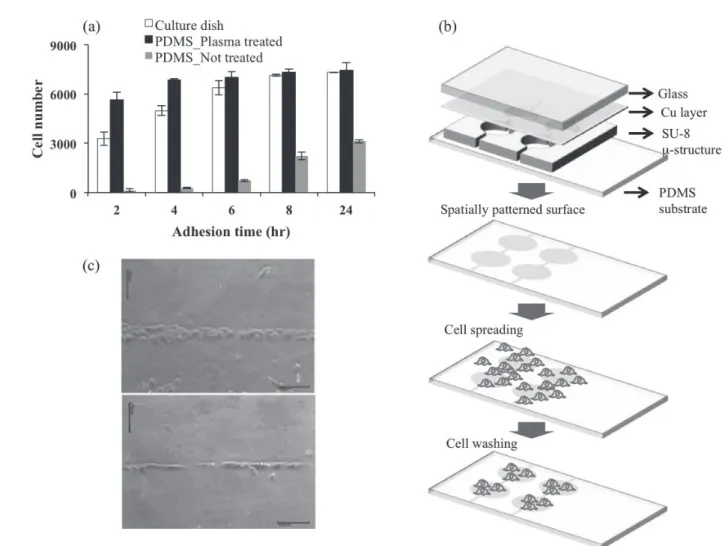
호되기도 한다. 표면의 wettability를 물리적으로 조절하기 위한 방법으로는 표면의 종류에 따라, 플라즈마를 이용하 거나 나노구조체를 이용하기도 한다. 그림 5(a)는 PDMS 표면을 산소 플라즈마를 이용하여 친수화시킨 후 세포를 배양한 경우, 세포증식 속도가 상업적 culture dish와 유사 함을 보여주었다. 이는 대부분의 상피세포가 물접촉각 40~80° 에서 잘 성장한다는 결과와 잘 부합된다. 표면의 원하는 지점만을 플라즈마를 가하기 위하여 미세유체 기 술을 이용하기도 한다(그림 5(b)). 그림과 같이, 미세유체 채널의 상부면을 금속으로 대체하고 이를 SU8 등 부도체 로 패턴화하고, 플라즈마를 미세채널 내에서 생성시킨다.
그림 5마이크로플라즈마챔버를 이용한 세포패너닝 기술(J.-H. Kim et al, J. Biotechnol., 308, 155, 2011).
플라즈마에 노출된 표면은 친수성으로 바뀌게 된다. 특이 할 만한 점은 친수화된 부분의 너비가 5 ㎛ 미만인 경우는 상피세포가 붙지 않아, 미세유체채널의 디자인에 따라 세
포를 패턴화할 수 있게 된다(그림 5(c)). 그러므로 상기와 같은 특성을 이용하여 세포를 일차원적으로 패턴화할 수 있다.
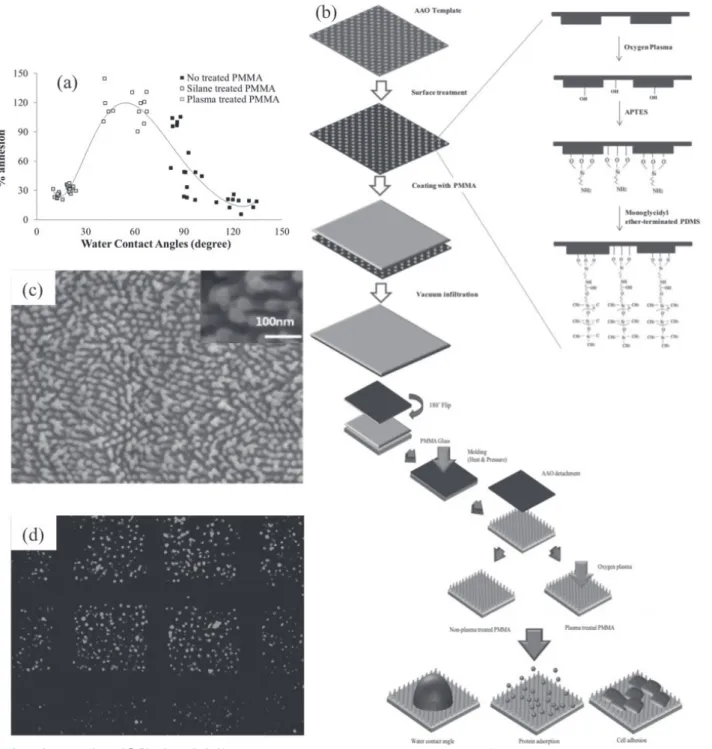
그림 6나노구조체를 이용한 세포 패턴화(J. Ahn et al, J. Biotechonol. 543, 164, 2013).