1. 서론
화석연료의 과도한 사용으로 인한 대기오염 문제 가 심각해짐에 따라 신재생에너지의 중요성이 그 어 느 때보다 부각되고 있다. 특히 풍력이나 태양력을 이용하여 물을 전기 분해하면 수소와 산소를 친환경 적으로 생산할 수 있고, 이렇게 얻은 수소를 저장했 다가 연료전지의 연료로 사용하면 적시 적소에 필요 한 전기에너지를 사용할 수 있다는 장점이 있어 수 전해(물의 전기 분해) 기술개발 연구가 활발히 진행 되고 있다[1-5].
수전해 전지의 환원극에서는 수소발생반응(hydrogen evolution reaction, HER)이, 산화극에서는 산소발생 반응(oxygen evolution reaction, OER)이 각각 일어나 며, 이를 통해서 수소와 산소를 획득할 수 있다. 4전 자 반응인 산소발생반응은 2전자 반응인 수소발생반 응 보다 느린 반응이기 때문에 수전해 전지의 전체 적인 효율을 높이기 위해선 고성능 산소발생반응용 촉매 개발이 필요하다[6-8]. 현재까지 성능이 가장 좋다고 알려져 있는 산소발생반응용 촉매는 RuO2 및 IrO2 이다. 하지만 이들 촉매는 모두 귀금속 기반이기 에 가격이 비싸고 대량 생산 및 상용화가 어렵다는 단점이 있다. 따라서 이들 촉매를 대신할 고성능 산 소발생반응용 촉매 개발이 필수적이다.
최근 들어 ABO3 (A = 알칼리 토금속, B = 전이 금 속, O = 산소) 구조를 갖는(그림 1) 페로브스카이트 물 질이 상대적으로 저렴한 원소들로 이루어져 있으면 서도 높은 촉매 활성을 가지는 사례들이 보고가 되면
서 주목을 받고 있다[9-13]. 예를 들어 Pr0.5Ba0.5CoO3- δ(PBCO) 및 Ba0.5Sr0.5Co0.8Fe0.2O3-δ(BSCF) 물질의 경우 기존 IrO2 촉매보다 산소발생반응 활성이 더 높은 것 으로 보고된 바 있으며[14, 15], LaNiO3 물질 또한 기 존 백금 촉매보다 성능이 더 좋은 것으로 보고되었다 [16]. 하지만 일반적인 금속 촉매와는 달리 페로브스 카이트 촉매의 경우 표면에 금속 사이트뿐 아니라 격 자산소 사이트도 존재하기 때문에 오직 금속 사이트 만 고려한 기존 메커니즘과는 다른 완전히 새로운 메 커니즘으로 산소발생반응이 진행될 수 있다.
따라서 본 기고문에서는 페로브스카이트의 격자 산소가 실제로 산소발생반응에 직접적으로 참여할 수 있는지, 만약에 참여한다면 어떠한 조건일 때 어 떠한 경로로 참여하는지, 그리고 격자산소가 반응에
격자산소 참여 메커니즘에 기반한 고성능 산소 발생반응용 페로브스카이트 촉매의 합리적 설계
유종석
서울시립대학교 화학공학과 jsyoo84@uos.ac.kr
그림 1. 페로브스카이트 구조[17] 모식도.
참여하는 근본적인 원인은 무엇인지에 대한 Density Functional Theory(DFT) 기반 연구 결과를 소개하고 자 한다. 그리고 이를 바탕으로 산소발생반응에 최 적화된 페로브스카이트 물질을 예측하는 연구 결과 에 대해 소개하고자 한다.
2. 본론
2.1. 기존 산소발생반응 메커니즘 vs 새로운 격 자산소 참여 메커니즘
일반적으로 산소발생반응은 Adsorbate Evolution Mechanism(AEM)[18, 19]에 의해(그림 2) 일어난다고 알려져 있다. 만약 페로브스카이트의 격자산소가 반 응에 직접적으로 참여한다면 산소발생반응은 Lattice Oxygen Mechanism, LOM)[20-24]에 의해(그림 2) 일 어날 수도 있다. 이 두 메커니즘의 차이는, AEM의 경우 금속 사이트에 붙어있던 OH가 O 및 OOH로 점 진적으로 환원되면서 O2를 형성하는 반면, LOM의 경우 금속 사이트에 붙어있던 OH가 O으로 환원된 이후 페로브스카이트의 격자산소와 결합하여 궁극 적으로 O2와 기존 격자산소 자리에 빈자리(vacancy) 를 형성한다. 따라서 산소발생반응은 AEM 혹은 LOM에 의해 일어날 수 있고, 어떤 메커니즘이 더 우 세한지는 페로브스카이트 촉매 물질의 종류에 따라 달라질 것이다.
2.2. LaCoO
3
vs LaNiO3
vs LaCuO3
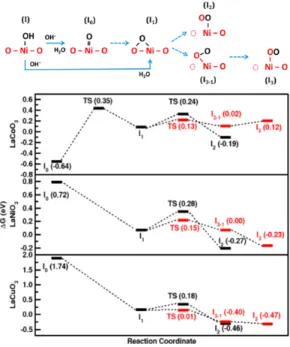
촉매의 격 자산소 참여 가능성LaCoO3 vs LaNiO3 vs LaCuO3 촉매의 격자산소 참 여 가능성을 좀 더 자세히 알아보기 위해 그림 3에 나
와있는 세부적인 반응경로에 대해 에너지 계산을 진 행하였다. LaCuO3, LaNiO3의 경우 최종 상태(I2 or I3) 가 초기 상태(I0)보다 더 안정하며 모든 반응 단계가 발열 반응임을 알 수 있다. 반면 LaCoO3의 경우 최 종 상태의 에너지가 초기 상태보다 더 높으며 특히 I0
에서 I1으로 진행되는 반응이 흡열 반응임을 알 수 있 다. 즉 LaCuO3, LaNiO3 촉매의 경우 격자산소가 산소 발생반응에 참여하는 것이 열역학적으로 유리하며, LaCoO3 촉매의 경우 그렇지 않다는 것을 알 수 있다.
한편 세 촉매 모두 I1에서 I2 및 I3로 진행되는 반응 은 활성화에너지가 매우 낮은 발열 반응임을 알 수 있다. 이는 I0에서 I1으로 진행되는 반응이 발열 반응 인지 흡열 반응인지에 따라 격자산소가 산소발생반 응에 참여하는지에 대한 여부를 판단할 수 있다는 뜻이다. 즉, 금속 사이트에 흡착한 산소 원자가 격자 산소 사이트로 얼마나 쉽게 이동할 수 있는지를 지 표 삼아 격자산소가 산소발생반응에 참여할 수 있는 가에 대한 여부를 판단할 수 있는 것이다.
그렇다면 I0에서 I1으로 진행되는 반응은 일반적으 로 어떤 촉매에서는 발열 반응이고 어떤 촉매에서는
그림 2. 알칼리성 조건 산소발생반응에 있어 AEM과 LOM간의 경쟁[26].
그림 3. 격자산소 반응 참여 경로 및 LaCoO3 , LaNiO3 , LaCuO3 촉매에서의 에너지 계산결과.
흡열 반응일까? Density of states 및 Bader charge 분 석 결과 I0에서 I1으로 반응이 진행됨에 따라 전이금속 사이트의 산화상태가 (3+α)+에서 3.0+로 낮아짐을 알 수 있었고, Ni 및 Cu의 경우 전자구조적으로 주로 2+
이하의 산화상태가 가능한 반면, Co의 경우 3+라는 상대적으로 높은 산화상태까지 가능하기기 때문에 I0
에서 I1으로 진행되는 반응은 LaNiO3 및 LaCuO3 촉매 에서는 발열 반응이고 LaCoO3 촉매에서는 흡열 반응 인 것이다[25]. 즉 란타넘 기반 페로브스카이트 물질 의 경우 그 물질을 구성하는 전이금속이 주기율표 상 에서 Co보다 오른편에 위치한 금속일 때 LOM을 통 한 산소발생반응이 가능해지는 것이다[25].
2.3. 페로브스카이트 종류에 따른 산소발생반응 메커니즘 판단
페로브스카이트의 종류에 따라 산소발생반응 메 커니즘이 어떻게 바뀌는지를 파악하기 위해 다양한 란타넘 기반 페로브스카이트 촉매들에 대해 AEM vs LOM을 비교해보았다(그림 4). 앞서 예상한대로 산 소와의 결합력이 다소 강한 LaCrO3와 같은 물질은 AEM이 더 선호되었고, 산소와의 결합력이 다소 약 한 LaCuO3와 같은 물질은 LOM이 더 선호되었다. 한 편, 산소와의 결합력이 적당한 LaNiO3 물질의 경우 AEM과 LOM이 비슷하지만 LOM이 약간 더 우세한
것으로 드러났으며, 표면에 흡착한 다른 흡착물들의 표면 덮힘율 및 implicit solvation model을 활용한 수 용액 영향까지 고려하여 계산을 진행해도 같은 결과 가 나오는 것을 알 수 있다[23].
그림 4a,b,c를 살펴보면 흥미롭게도 페로브스카이 트의 종류와 무관하게 OOH*와 OH*의 깁스에너지 차이가 약 3.1eV로 항상 일정함을 알 수 있다. 이는 금속 사이트에 붙은 OH와 OOH의 흡착 특성이 매우 비슷해서 나온 결과로, 수전해의 평형전압이 1.23V 인 것을 고려했을 때, AEM에서 생길 수 있는 이론 적 과전압의 최소값은 [3.1 eV – (2 x 1.23 eV)]/2e = 0.32 V임을 알 수 있다. 반면 그림 4d,e,f를 살펴보면 흥미롭게도 페로브스카이트의 종류와 무관하게 OH 와 OO의 깁스에너지 차이가 약 1.4 eV로 항상 일정 함을 알 수 있다. 이는 격자산소 빈자리 옆의 금속사 이트에 붙은 OH와 OO의 흡착 특성이 매우 비슷해 서 나온 결과로, LOM에서 생길 수 있는 이론적 과전 압의 최소값은 [1.4 eV – (1 x 1.23 eV)]/e = 0.17 V임 을 알 수 있다. 따라서 란타넘 기반 페로브스카이트 촉매의 경우 AEM보다는 LOM을 통해서 산소발생반 응이 진행될 때 과전압이 없는 이상적인 촉매와 가 장 비슷한 것을 알 수 있다.
앞서 내린 결론들은 AEM 및 LOM에 대한 volcano plot을 각각 그려 비교해 봄으로써 다시 한 번 확인
그림 4. 다양한 페로브스카이트의 촉매에서의 AEM vs LOM 비교[26].
해볼 수 있다. 그림 5에서 volcano 상에 위치한 촉매 가(산소발생반응의 평형전압 값인 -1.23 V를 나타내 는) 점선과 가까울수록 그 촉매의 이론적 과전압은 더 작다는 뜻으로, volcano의 정점에 가깝게 위치한 촉매일수록 산소발생반응 활성이 더 좋은 촉매인 것 이다. AEM volcano보다는 LOM volcano의 정점이 더 높은 것으로 보아 이상적인 촉매와 가장 비슷하기 위해서는 AEM보다는 LOM을 통해서 산소발생반응 이 일어나야 함을 알 수 있다. 또한 앞서 논의한 대로 LaCrO3 물질처럼 volcano의 왼편에 위치한 산소와의 결합력이 상대적으로 강한 촉매들의 경우 AEM을, LaCuO3 물질처럼 volcano의 오른편에 위치한 산소와 의 결합력이 상대적으로 약한 촉매들의 경우 LOM 을 더 선호하는 것을 알 수 있다. 이론적으로 가장 이 상적인 페로브스카이트 촉매 물질은 산소와의 결합 력이 3.3~3.4 eV 정도인 물질로, volcano plot 상에서 LaNiO3보다 약간 오른편에 위치한 물질이어야 함을 알 수 있고, 살짝 팽창시킨 LaNiO3 촉매가 가장 이상 적임을 알 수 있다.
2.4. 페로브스카이트의 구조적 안정성과 산소발 생반응 메커니즘간의 상관성
페로브스카이트의 산소와의 결합 세기에 따라 산 소발생반응 메커니즘이 달라질 수 있다면, 페로브스 카이트의 내부 결합력, 즉 구조적 안정성과 산소발 생반응 메커니즘간의 상관성 또한 생각해볼 수 있 다. 페로브스카이트의 내부 결합력이 강할 경우 격
자산소가 빈자리를 형성하면서 반응에 참여하러 표 면의 금속사이트로 이동하는 일은 어려워지므로 LOM보다는 AEM이 더 우세할 것이다. 페로브스카 이트의 내부 결합력, 즉 구조적 안정성은 전이금속 과 격자산소가 서로 얼마나 많이 전자를 공유하는지 에 달려있다. 전이금속과 격자산소가 전자를 많이 공유하지 않는다면 격자산소는 원래의 위치에서 벗 어나 다른 원자와 결합하려고 할 것이다. 다시 말해 페로브스카이트의 구조적 안정성은 전이금속의 전 기음성도와 관련이 있다는 뜻이다. 앞서 2.2절에서 비교했던 LaCoO3, LaNiO3, LaCuO3에서 니켈, 구리의 전기음성도는 각각 1.91, 1.90로 코발트의 1.88에 비 해 큰 것을 알 수 있다. 즉, 니켈과 구리는 코발트보 다 격자 산소와 전자를 적게 공유한다. 따라서 니켈, 구리는 격자산소의 이동이 상대적으로 용이하며 앞 서 논의한 대로 LOM이 더 우세하게 되는 것이다.
페로브스카이트의 구조적 안정성과 격자산소의 반응 참여 가능성 간의 구체적인 상관성은 그림 6을 통해 알 수 있다. 그림 6의 왼쪽 그래프에 의하면 페 로브스카이트의 격자산소 빈자리 형성 에너지와 A0 에서 A1으로 가는(격자산소가 산소발생반응에 참여 하러 표면 금속사이트로 이동하는) 반응에너지 사이 에 선형관계가 형성됨을 알 수 있다. 뿐만 아니라 격 자산소 빈자리를 잘 형성하는 페로브스카이트 물질 일수록 ΔG가 0보다 작아서 LOM이 더욱 잘 일어나 는 것을 알 수 있다. 그래프에 도시한 촉매들을 기 준으로 LaMnO3부터 LaCoO3까지는 AEM이 우세하
그림 5. (a) AEM과 LOM에 대한 volcano plot. (b) (a)에 있는 사각형 부분을 확대한 것으로 가로 안의 “+” 혹은 “–“는 압축 혹은 팽창된 정도를 나타낸다[26].
게 일어나고, La0.5Sr0.5CoO3부터 SrNiO3까지는 LOM 이 우세하게 일어난다. 그림 6의 오른쪽 그래프는 페 로브스카이트 내 N-V(전이금속의 비공유 전자쌍 수 – 전이금속의 전하량) 값 변화에 따른 A0에서 A1으 로의 반응에너지 변화를 도시한 그래프이다. N은 전 이금속의 전기음성도와 직접적인 관련이 있으며 V 는 전이금속과 격자산소간에 서로 공유하는 전자의 수와 직접적인 관련이 있다. 즉 N-V 값은 전이금속 과 격자산소간의 결합력에 대한 직접적인 지표가 될 수 있으며 N-V와 ΔG사이에도 뚜렷한 선형관계가 성립하는 것을 알 수 있다. 이를 통해 각 페로브스카 이트의 격자산소가 산소발생반응에 참여할 수 있는 지 유추할 수 있다. 결론적으로, 이 두 그래프를 통해 구조가 안정한 페로브스카이트 물질일수록 AEM이, 불안정한 물질일수록 LOM이 우세하다는 것을 확인 할 수 있다.
결론 및 전망
본 기고문에서는 페로브스카이트 물질의 종류
에 따라 격자산소가 산소발생반응에 직접적으로 참 여할 수 있음에 대해 알아보았다. 그 결과 전이금속 과 산소 간의 결합세기가 상대적으로 약해서 구조 적 안정성이 다소 떨어지는 물질일수록 AEM보다는 LOM을 선호하는 것을 알 수 있었고, 이상적인 촉매 와 비슷해지기 위해서는 AEM보다는 LOM을 통해 산소발생반응이 진행되어야 함을 알 수 있었다. 이 후 volcano 분석을 통해 살짝 팽창시킨 LaNiO3 물질 이 가장 효율적인 산소발생반응 촉매임을 알 수 있 었다. 스트론튬, 바리움 등 다른 희토류 금속 기반 페 로브스카이트 물질에 대해서도 같은 방식의 연구를 진행하여 또 다른 고활성 페로브스카이트 촉매를 발 굴할 필요가 있다.
끝으로 본 기고문에서 소개한 계산화학에 기반한 새로운 전기촉매 물질 발굴 방법은 오직 열역학적인 측면에만 근거를 두고 있음을 밝힌다. 전기촉매의 과전압 뿐 아니라 반응속도, 이를테면 전위에 따른 전류의 변화까지 직접적으로 예측하기 위해서는 전 기화학 반응의 활성화에너지를 계산할 수 있어야 한 다. 그래야 kinetic modeling을 바탕으로 pH 및 전위 에 따라 달라질 수 있는 전기촉매의 활성 및 선택도 를 직접적으로 예측할 수 있기 때문이다. 하지만 안 타깝게도 전기화학 반응의 활성화에너지를 계산하 는 일은 쉽지만은 않아 왔다. 이는 전하 운반체가 전 해질에서부터 전극표면으로 이동하는 현상이, 실험 적으로는 일정한 전위 환경에서 일어나는 반면 계산 에서는 일정한 전하 환경을 가정할 수밖에 없어 왔 기 때문이다. 하지만 최근 들어 이러한 어려움을 극 복할 다양한 방법들이 개발되고 있기에 앞으로 계산 에 기반한 새로운 전기촉매 물질 발굴은 더욱 정교 해질 전망이다.
참고문헌
1. Bard, A. J.; Fox, M. A., Artificial Photosynthesis: Solar Splitting of Water to Hydrogen and Oxygen. Accounts of
Chemical Research 1995, 28 (3), 141-145.
2. Khan, S. U. M.; Al-Shahry, M.; Ingler, W. B., Efficient Photochemical Water Splitting by a Chemically Modified 그림 6. 좌측: 페로브스카이트의 격자산소 빈자리 형성 에너지에
따른 A0에서 A1으로의 깁스에너지 변화, 우측: 페로브스 카이트 내 N-V(전이금속의 비공유 전자쌍의 수 - 전이금 속의 전하량) 값 변화에 따른 A0에서 A1으로의 깁스에너 지 변화[23].
n-TiO<sub>2</sub>. Science
2002, 297
(5590), 2243.3. Kudo, A.; Miseki, Y., Heterogeneous photocatalyst materials for water splitting. Chemical Society Reviews
2009, 38 (1), 253-278.
4. Meyer, T. J., The art of splitting water. Nature 2008, 451 (7180), 778-779.
5. Walter, M. G.; Warren, E. L.; McKone, J. R.; Boettcher, S. W.; Mi, Q.; Santori, E. A.; Lewis, N. S., Solar Water Splitting Cells. Chemical Reviews 2010, 110 (11), 6446- 6473.
6. Burke, M. S.; Enman, L. J.; Batchellor, A. S.; Zou, S.; Boettcher, S. W., Oxygen Evolution Reaction Electrocatalysis on Transition Metal Oxides and (Oxy) hydroxides: Activity Trends and Design Principles.
Chemistry of Materials 2015, 27 (22), 7549-7558.
7. McCrory, C. C. L.; Jung, S.; Peters, J. C.; Jaramillo, T. F., Benchmarking Heterogeneous Electrocatalysts for the Oxygen Evolution Reaction. Journal of the American
Chemical Society 2013, 135 (45), 16977-16987.
8. Reier, T.; Oezaslan, M.; Strasser, P., Electrocatalytic Oxygen Evolution Reaction (OER) on Ru, Ir, and Pt Catalysts: A Comparative Study of Nanoparticles and Bulk Materials. ACS Catalysis 2012, 2 (8), 1765-1772.
9. Bockris, J. O. M., Otagawa, T, The Electrocatalysis of Oxygen Evolution on Perovskites. Journal of The
Electrochemical Society 1984, 131 (2), 290.
10. Fierro, S.; Nagel, T.; Baltruschat, H.; Comninellis, C., Investigation of the oxygen evolution reaction on Ti/IrO2 electrodes using isotope labelling and on-line mass spectrometry. Electrochemistry
Communications 2007, 9 (8), 1969-1974.
11. Hong, W. T.; Risch, M.; Stoerzinger, K. A.; Grimaud, A.;
Suntivich, J.; Shao-Horn, Y., Toward the rational design of non-precious transition metal oxides for oxygen electrocatalysis. Energy & Environmental Science
2015, 8 (5), 1404-1427.
12. Wohlfahrt-Mehrens, M.; Heitbaum, J., Oxygen evolution on Ru and RuO2 electrodes studied using isotope labelling and on-line mass spectrometry.
Journal of Electroanalytical Chemistry and Interfacial Electrochemistry 1987, 237 (2), 251-260.
13. Yagi, S.; Yamada, I.; Tsukasaki, H.; Seno, A.;
Murakami, M.; Fujii, H.; Chen, H.; Umezawa, N.;
Abe, H.; Nishiyama, N.; Mori, S., Covalency- reinforced oxygen evolution reaction catalyst. Nature
Communications 2015, 6 (1), 8249.
14. Grimaud, A.; May, K. J.; Carlton, C. E.; Lee, Y. L.;
Risch, M.; Hong, W. T.; Zhou, J.; Shao-Horn, Y., Double perovskites as a family of highly active catalysts for oxygen evolution in alkaline solution. Nat Commun
2013, 4, 2439.
15. Suntivich, J.; May, K. J.; Gasteiger, H. A.; Goodenough, J. B.; Shao-Horn, Y., A Perovskite Oxide Optimized
for Oxygen Evolution Catalysis from Molecular Orbital Principles. Science 2011, 334 (6061), 1383.
16. Petrie, J. R.; Cooper, V. R.; Freeland, J. W.; Meyer, T.
L.; Zhang, Z.; Lutterman, D. A.; Lee, H. N., Enhanced Bifunctional Oxygen Catalysis in Strained LaNiO3 Perovskites. Journal of the American Chemical
Society 2016, 138 (8), 2488-2491.
17. Yang, G.; Jung, W.; Ahn, S.-J.; Lee, D., Controlling the Oxygen Electrocatalysis on Perovskite and Layered Oxide Thin Films for Solid Oxide Fuel Cell Cathodes.
Applied Sciences 2019, 9 (5).
18. Man, I. C.; Su, H.-Y.; Calle-Vallejo, F.; Hansen, H. A.;
Martínez, J. I.; Inoglu, N. G.; Kitchin, J.; Jaramillo, T. F.; Nørskov, J. K.; Rossmeisl, J., Universality in Oxygen Evolution Electrocatalysis on Oxide Surfaces.
ChemCatChem 2011, 3 (7), 1159-1165.
19. Rossmeisl, J.; Qu, Z. W.; Zhu, H.; Kroes, G. J.;
Nørskov, J. K., Electrolysis of water on oxide surfaces.
Journal of Electroanalytical Chemistry 2007, 607 (1),
83-89.20. Grimaud, A.; Diaz-Morales, O.; Han, B.; Hong, W. T.;
Lee, Y.-L.; Giordano, L.; Stoerzinger, K. A.; Koper, M.
T. M.; Shao-Horn, Y., Activating lattice oxygen redox reactions in metal oxides to catalyse oxygen evolution.
Nature Chemistry 2017, 9 (5), 457-465.
21. Hardin, W. G.; Mefford, J. T.; Slanac, D. A.; Patel, B.
B.; Wang, X.; Dai, S.; Zhao, X.; Ruoff, R. S.; Johnston, K. P.; Stevenson, K. J., Tuning the Electrocatalytic Activity of Perovskites through Active Site Variation and Support Interactions. Chemistry of Materials 2014,
26 (11), 3368-3376.
22. Hardin, W. G.; Slanac, D. A.; Wang, X.; Dai, S.;
Johnston, K. P.; Stevenson, K. J., Highly Active, Nonprecious Metal Perovskite Electrocatalysts for Bifunctional Metal–Air Battery Electrodes. The Journal
of Physical Chemistry Letters 2013, 4 (8), 1254-1259.
23. Rong, X.; Parolin, J.; Kolpak, A. M., A Fundamental Relationship between Reaction Mechanism and Stability in Metal Oxide Catalysts for Oxygen Evolution. ACS Catalysis 2016, 6 (2), 1153-1158.
24. Mefford, J. T.; Rong, X.; Abakumov, A. M.; Hardin, W.
G.; Dai, S.; Kolpak, A. M.; Johnston, K. P.; Stevenson, K. J., Water electrolysis on La1−xSrxCoO3−δ perovskite electrocatalysts. Nature Communications
2016, 7 (1), 11053.
25. Yoo, J. S.; Liu, Y.; Rong, X.; Kolpak, A. M., Electronic Origin and Kinetic Feasibility of the Lattice Oxygen Participation During the Oxygen Evolution Reaction on Perovskites. The Journal of Physical Chemistry
Letters 2018, 9 (7), 1473-1479.
26. Yoo, J. S.; Rong, X.; Liu, Y.; Kolpak, A. M., Role of Lattice Oxygen Participation in Understanding Trends in the Oxygen Evolution Reaction on Perovskites. ACS
![그림 4. 다양한 페로브스카이트의 촉매에서의 AEM vs LOM 비교[26].](https://thumb-ap.123doks.com/thumbv2/123dokinfo/4937307.297034/3.799.99.677.123.388/그림-다양한-페로브스카이트의-촉매에서의-aem-vs-lom-비교.webp)
![그림 5. (a) AEM과 LOM에 대한 volcano plot. (b) (a)에 있는 사각형 부분을 확대한 것으로 가로 안의 “+” 혹은 “–“는 압축 혹은 팽창된 정도를 나타낸다[26].](https://thumb-ap.123doks.com/thumbv2/123dokinfo/4937307.297034/4.799.154.668.127.287/aem과-사각형-부분을-확대한-것으로-팽창된-정도를-나타낸다.webp)