접수: 2013년 6월 13일, 승인: 2013년 7월 16일 연락처: 박병주, 110-750, 서울시 종로구 창경궁로 136
보령빌딩 5층
한국의약품안전관리원
Tel: (02) 2172-6710, Fax: (02) 2172-6701 E-mail: bjpark@drugsafe.or.kr
Correspondence to: Byung-Joo Park, MD, MPH, PhD Korea Institute of Drug Safety and Risk Management, 136 Changgyeonggung-ro, Jongno-gu, Seoul 110-750, Korea Tel: +82-2-2172-6710, Fax: +82-2-2172-6701
E-mail: bjpark@drugsafe.or.kr
미국 연방정부 CMS의 DUR제도추진방향
한국의약품안전관리원1, 서울대학교 의과대학 예방의학교실2
신주영1ㆍ신선미1ㆍ박병주1,2
Policy Directions for the CMS DUR System in the USA
Ju-Young Shin, PhD
1, Sun-Mi Shin, MSc
1and Byung-Joo Park, MD, MPH, PhD
1,21
Korea Institute of Drug Safety and Risk Management,
2Department of Preventive Medicine, Seoul National University College of Medicine, Seoul, Korea
Drug Utilization Review (DUR) has been introduced in 1960s in the United States and mandated to be performed in all states of the USA from 1993 by the Omnibus Budget Reconciliation Act of 1990 (OBRA ‘90). The Centers for Medicare and Medicaid Services (CMS) regulates the all states in the USA and develop the DUR program systematically and independently based on the basic requirements of OBRA ‘90. In this paper we de- scribed the DUR criteria and prospective/retrospective DUR to introduce advanced DUR system in the USA.
(JPERM 2013;6:87-92)
Key Words: Drug utilization review (DUR); Centers for Medicare and Medicaid Services (CMS); Prospective
DUR, DUR criteria, retrospective DUR; E-prescribing서 론
미국에서는 1960년대부터 DUR의 개념이 도입되어 발전해 왔는데, 1990년 총괄예산조정법인 Omnibus Budget Reconcilia- tion Act of 1990 (이하, OBRA`90) 이후, 모든 주에서 시행하 고 있는 메디케이드(Medicaid)에 대하여 1993년부터 DUR적 용을 의무화하도록 명시하였고, 이것은 전산 DUR프로그램이 구축되며 모든 외래환자로 확대되었다.
1)미국 보건부(Depart- ment of Health)에서 가장 중요한 역할을 하는 2개 기관은 미 국식품의약품국(Food and Drug Administration, FDA)과 메디 케어(Medicare) 및 메디케이드 관리센터(Centers for Medicare and Medicaid Services, CMS)로, CMS에서는 DUR제도운영에 대한 책임을 지고, 각 50개 주 메디케이드의 DUR운영을 관 리ㆍ감독하는 역할을 담당하고 있다.
2)미국은 저소득층 및 65세 이상 노인에 대해서는 국가에서 건강보험제도를 운영하고 있는데, CMS에서는 저소득층에 대한 진료비 및 처방약 보조제도인 메디케이드와 65세 이상 노인을 위한 메디케어를 운영하고 있으며, 이들 환자에 대 한 DUR제도 운영에 대한 책임도 함께 지고 있는 것이다.
미국 50개주의 메디케이드가 DUR수행을 위한 예산을 담당 하고 운영을 한다면, CMS에서는 DUR정책에 대한 방향을 제시하여 법안을 개정하고, 새로운 제도를 만드는 역할을 담당하고 있다.
CMS에서는 전향적 약물사용평가(Prospective DUR), DUR
기준개발(DUR Criteria), 후향적 약물사용평가(Retrospective
DUR)에 대한 지침을 제공하여, 미국 50개 주와 사보험회사
등에서 DUR운영을 효율적으로 하기 위한 법률적 기반마련
및 사후관리를 하고 있으며, 특히 최근에는 E-prescribing 제
Table 1. 메디케어와 메디케이드 운영시스템 비교
구분 운영총괄 운영방식 환자정보 관리
메디케어 (Medicare)
연방정부 (CMS)
ㆍCMS에서 총괄하며, 운영에 대한 책임도 가 짐, 민간회사에 운영을 위탁.
ㆍ전미지역에서 통합된 자료관리 (한개의 통합 데이터베이스).
ㆍ환자 1인당 하나의 ID 발급.
ㆍ환자가 주를 이동하더라도 ID는 바뀌지 않음.
메디케이드 (Medicaid)
연방정부 (CMS)
ㆍCMS가 총괄하나, 주정부가 책임을 지고 각 주정부 독립된 예산으로 시스템 운영.
ㆍ각 주마다 개별자료관리
(50개 주별로 데이터베이스 보유).
ㆍ각 주에 가입된 메디케이드 환자에게 개별 ID 부여.
ㆍ환자가 주를 이동시 메디케이드에 새로 가입, 신규 ID 발급.
도를 시행하여 처방단계에서도 자동화, 전산화 시스템을 도 입하고, 중앙의 자료저장뱅크를 구축하였다. 또한 오남용약 물에 대한 관리를 위해서 집중관리프로그램을 시행하여 약 물쇼핑 의심행위를 자동으로 감지하는 등 처방, 조제 및 의 약품사용에 있어 포괄적인 관리를 위한 다양한 노력을 기울 이고 있다.
3,4)우리나라의 DUR제도는 1980년대 후반 처음 그 개념이 소개된 이후로, 2004년 최초로 병용, 연령금기 약물이 고시 되었으며, 2010년 12월에 전국 의료기관 및 약국에 실시간 처방조제지원시스템이 구축되는 등 10년여 넘는 시간동안 급속하게 발전하여 왔다.
5)미국의 경우, 1960년대부터 DUR 에 대한 개념이 소개된 이후로, 1980년대 후반에 본격적으 로 발전하기 시작하여, 우리나라보다 약 30년 앞서 DUR 제 도를 정착시킨 모델국가라고 볼 수 있다.
6)이에 본 논문에 서는 미국 연방정부의 DUR제도 추진방향을 소개하기 위하 여, 2013년 1월부터 5월까지 5개월동안, CMS관련 홈페이지 및 학술논문 등을 통하여 공개된 DUR 표준업무수행지침과 각 주에서 CMS에 제출하는 DUR 성과보고서 등을 수집하 였고, 2013년 6월 3일-7일에 걸쳐 직접 미국 CMS 및 병ㆍ의 원, 약국을 방문하여 DUR수행현황을 시찰한 결과를 바탕으 로, 미국의 DUR제도를 소개하고자 한다. 구체적으로는, 전 향적 DUR의 필수 DUR기준개발 및 적용, 그리고 후향적 DUR정보제공에 있어서 미국 CMS의 역할을 중심으로 기술 하고, 최근 대두되고 있는 e-prescribing제도 등 새로운 정책 방향에 대하여 알리는 것을 목적으로 한다.
본 론
1. 전향적 약물사용평가(DUR) 수행체계
미국 메디케이드 DUR제도운영에 있어 중앙정부의 역할 을 하는 CMS는 미국 50개 주의 DUR프로그램을 관리하는 기관이다.
3,4)미국의 DUR제도는 공공보험 및 사보험, 병ㆍ 의원과 약국, 공공분야뿐만 아니라 민간약제비심사기구,
DUR정보개발 및 운영담당 민간회사 등이 함께 수행하는 매우 복잡한 형태로 수행되고 있다. 공공보험인 메디케어와 메디케이드의 운영형태에는 일부 차이점이 있는데, 메디케 어는 CMS에서 모든 것을 책임지고 있으며, 민간회사에 운 영을 위탁하여 관리하고 있어, 전미지역에서 통합된 자료를 보유하고 있다. 반면, 메디케이드의 경우에는, 각 주별로 별 개의 시스템이며 각 주에서 가입된 메디케이드 환자에게 개 별 ID를 부여한다. 즉, 메디케이드의 경우 개별 주 정부 단 위에서 자료를 관리하고 있었으며, 환자가 다른 주에서 약 을 처방받을 경우 병용금기 등이 발생하더라도 정보를 통합 적으로 분석하지는 못하는 것이다. 예를 들어, 메디케이드 환자가 뉴욕주에서 캘리포니아주로 이동하면, 별개의 ID를 발급받으며 시스템도 같지 않은 것이다. 하지만, 메디케어 에서는 가입환자에게 하나의 고정된 ID를 발급하여 주를 이동하더라도 ID는 바뀌지 않으며, 거주 지역에 상관없이 통합하여 관리한다. 메디케이드 가입 환자는 65세가 넘으 면, 메디케이드에서 메디케어로 자동으로 가입이 이동하게 된다(표 1).
7,8)현재 CMS에서 중점적으로 추진하고 있는 정책은 ‘E-pre-
scribing 제도’로, 처방과 조제를 자동화된 전산프로그램을
이용하여 자료전송 및 청구하고, 중앙에 데이터를 연계하는
허브 역할의 자료저장은행(Web portal Rx Hub)을 구축하여
통합된 정보를 열람할 수 있도록 하는 것이다.
9,10)만약 의사
가 특정 환자의 진료정보 및 약물처방내역을 열람하고 싶다
면, 이 중앙 자료저장은행에 접속하여 필요시에 조회할 수
있다(그림 1).
11,12)그러나 현재 E-prescribing 제도의 참여율
은 10-20% 수준에 그치고 있다. 아직도 미국에서는 수기로
처방이 많이 이루어지고 있다는 것을 감안하면, 이미 처방,
조제, 청구 단계가 자동화되어 있고, 이에 더 나아가서 처방
단계와 조제단계에서 동시에 DUR을 진행하는 한국의 DUR
시스템이 오히려 의사/약사의 동시참여와 전산인프라 측면
에서는 향후 더 나은 시스템으로 발전하기 위한 기반을 마
련하고 있다고 볼 수 있겠다.
Figure 1. 미국 E-prescribing 운영체계 흐름도 (MMIS, Medi- caid Management Information System; POS, Point of Service;
Rx, Prescription).
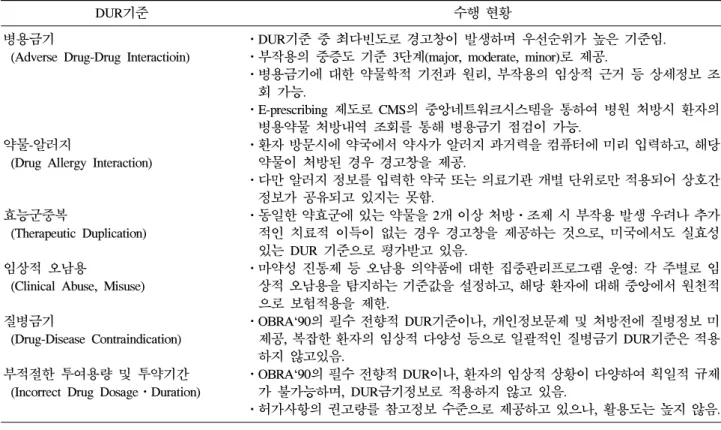
Table 2. 전향적 DUR에 적용하는 DUR기준 적용현황
DUR기준 수행 현황
병용금기
(Adverse Drug-Drug Interactioin)
ㆍDUR기준 중 최다빈도로 경고창이 발생하며 우선순위가 높은 기준임.
ㆍ부작용의 중증도 기준 3단계(major, moderate, minor)로 제공.
ㆍ병용금기에 대한 약물학적 기전과 원리, 부작용의 임상적 근거 등 상세정보 조 회 가능.
ㆍE-prescribing 제도로 CMS의 중앙네트워크시스템을 통하여 병원 처방시 환자의 병용약물 처방내역 조회를 통해 병용금기 점검이 가능.
약물-알러지
(Drug Allergy Interaction)
ㆍ환자 방문시에 약국에서 약사가 알러지 과거력을 컴퓨터에 미리 입력하고, 해당 약물이 처방된 경우 경고창을 제공.
ㆍ다만 알러지 정보를 입력한 약국 또는 의료기관 개별 단위로만 적용되어 상호간 정보가 공유되고 있지는 못함.
효능군중복
(Therapeutic Duplication)
ㆍ동일한 약효군에 있는 약물을 2개 이상 처방ㆍ조제 시 부작용 발생 우려나 추가 적인 치료적 이득이 없는 경우 경고창을 제공하는 것으로, 미국에서도 실효성 있는 DUR 기준으로 평가받고 있음.
임상적 오남용
(Clinical Abuse, Misuse)
ㆍ마약성 진통제 등 오남용 의약품에 대한 집중관리프로그램 운영: 각 주별로 임 상적 오남용을 탐지하는 기준값을 설정하고, 해당 환자에 대해 중앙에서 원천적 으로 보험적용을 제한.
질병금기
(Drug-Disease Contraindication)
ㆍOBRA`90의 필수 전향적 DUR기준이나, 개인정보문제 및 처방전에 질병정보 미 제공, 복잡한 환자의 임상적 다양성 등으로 일괄적인 질병금기 DUR기준은 적용 하지 않고있음.
부적절한 투여용량 및 투약기간 (Incorrect Drug DosageㆍDuration)
ㆍOBRA`90의 필수 전향적 DUR이나, 환자의 임상적 상황이 다양하여 획일적 규제 가 불가능하며, DUR금기정보로 적용하지 않고 있음.
ㆍ허가사항의 권고량를 참고정보 수준으로 제공하고 있으나, 활용도는 높지 않음.
2. DUR정보개발 및 운영
미국 DUR정보개발 및 운영업무는 대부분 민간회사에 위 탁하여 수행하고 있다. 연방정부인 CMS에서는 법안 개발, 관리ㆍ감독 업무만을 수행하고, 각 주정부의 메디케이드와 블루스크립트(BlueScript)같은 사보험회사에서 다시 DUR적용 에 대한 책임을 가지고 있다. 이러한 보험기구에서는 약제비심 사업무를 Medco와 같은 Pharmacy Benefit Management (PBM)에
위탁하여 관리하며, PBM에서는 다시 DUR정보를 민간회사 에서 구매하고, DUR시스템 운영 역시 민간회사에 위탁하여 수행하고 있었다.
13,14)이중, DUR기준 데이터베이스는 민간회 사에서 구매하는 경우가 전체의 90% 이상 차지하고 있었으 며, 약학대학 및 병원 등에서 전문연구진이 개발하여 적용하 는 경우가 10% 정도 차지하는 것으로 나타났다.
DUR정보개발 시에는 미국 허가사항 뿐만 아니라 다양한 정보원을 바탕으로 해서 광범위한 DUR정보를 개발하여 적 용하고 있는데, 미국 Omnibus Budget Reconciliation Act of 1990 (이하, OBRA`90)에 필수 DUR정보로 규정하고 있는 7 가지 기준 외에도, 각 주별로 추가적인 DUR정보를 개발하 여 운영하고 있다.
6,15,16)DUR정보를 개발할 때에는 동일한 약물이라고 하더라도 적응증이 다양하고 용법ㆍ용량이 상 이하므로 다양한 환자의 임상적 상황을 고려하는 것을 원칙 으로 하고 있으며, 이에 따라, 미국 DUR정보제공은 포괄적 으로 많은 정보를 제공하는 방향으로 추진되어 왔다.
그러나, 미국에서는 너무 많은 DUR정보를 포괄적으로 제
공함에 따라서 지나치게 많은 DUR경고창이 제공되는 문제
가 발생하고 있었는데, 이에 최근에는 중대한 금기정보를 단
순하게 제공하는데 주력하고 있다. DUR정보개발 시에는 중
대한 부작용을 우선으로 개발하고(high risk), 실제 임상에 적
용했을 때, 처방 및 조제행태를 바꿀 수 있을 만한 영향이 있
는, 즉 부적절하게 약물사용이 되고 있는 문제에 대한 중재를
목적으로 해야 하며(high alert), 마지막으로 다빈도로 발생하 는 질병으로 많은 환자에게 보건학적 이득을 미칠 수 있는 (high impact) 정보를 중점에 둔다.
17)미국에서는 OBRA`90에 서 규정하고 있는 필수 DUR정보인 병용금기, 약물-알러지, 효능군중복 등을 다음과 같이 규정하여 운영하고 있다(표 2).
1) 병용금기(Adverse Drug-Drug Interaction) 병용금기 정보의 경우에는 가장 다빈도로 DUR경고창이 발생하고, 중대한 부작용을 야기하는 조합도 많이 포함되어 있어, 미국에서 적용하고 있는 DUR정보 중 우선순위가 높 은 기준이다. 미국 DUR시스템에서는 병용금기 정보를 부작 용 중증도 측면에서 3단계(major, moderate, minor)로 구분하 여 제공하고 있다.
18)또한 병용금기 경고창이 제공된 경우, 상세정보를 볼 수 있어, 병용금기 기전과 약물학적 원리, 중 대한 부작용의 상세내용과 근거 등 세부적인 정보도 제공하 고 있다. 그러나 너무 많은 경고창이 제공됨에 따라서, 중대 한 정보만 선택적으로 참고하게 되고, 그 외의 정보는 효용 가치가 떨어지며 무시되는 경향이 강하다고 한다.
19,20)미국의 DUR은 주로 약국에서 조제 단계시에 점검이 이 루어지고 있는데, 환자마다 가입된 보험사가 달라 다른 약 국에서 조제된 약은 해당 보험사에 청구된 경우에만 병용금 기 점검이 가능하다. 하지만 최근 중점적으로 추진되고 있 는 E-prescribing 제도의 시행으로 CMS의 중앙네트워크시스 템을 구축하여 병원에서 약물 처방시 환자의 병용약물 처방 내역 정보를 열람하여 병용금기 점검이 가능하도록 하고 있 다. 우리나라가 이미 처방전내 DUR점검뿐만 아니라, 처방 전간 DUR점검체계도 구축하여 의료기관 간 및 약국 간 병 용금기 점검을 이미 수행하고 있는 것을 고려하면, 단일 건 강보험체계인 우리나라의 특성상 전산인프라 측면에서의 기반마련은 미국에 비하여 비교적 빠른 시간안에 잘 갖추어 졌다고 볼 수 있다.
2) 약물-알러지(Drug Allergy Interaction)
미국 OBRA`90에 의무사항으로 명시하고 있는 약물-알러 지 기준의 경우에는 환자 방문시에 약국에서 약사가 해당 알러지 과거력을 컴퓨터에 미리 입력하고, 알러지가 있는 약물이 처방된 경우 경고창을 제공하고 형태로 적용하고 있 다. 예를 들어, 페니실린 알러지가 있는 환자가 방문시에 전 산프로그램에 알러지 DUR기준항목에 페니실린을 검색하여 표식자를 기록해두면, 추후 환자에게 페니실린이 처방되었 을 때, 약물-알러지 정보를 제공하여 사전에 약물알러지에 의한 부작용을 예방할 수 있는 것이다. 그러나 개별 약국단 위 혹은 의원단위로 전산프로그램에 알러지 과거력을 입력 하지 않으면, 이미 입력된 정보라고 할지라도 상호간에 서 로 정보를 공유할 수는 없다. 현재 CMS가 추진하고 있는
E-prescribing을 통한 DUR시스템 역시 약물에 관한 정보는 공유하지만. 환자의 과거력이나 약물-알러지 등에 관한 정 보는 공유가 되지 않고 있다.
3) 효능군중복(Therapeutic Duplication)
효능군중복 DUR기준은 동일한 약효군에 있는 약물을 2 개 이상 처방ㆍ조제함으로써 부작용이 발생하거나 추가적 인 치료적 이득이 없는 경우 DUR경고창을 제공하는 것으 로, 우리나라는 2013년 1월, 처음 해열진통소염제 4개 약효 군에 대하여 DUR 주의정보 제공이 도입되었다. 효능군중복 DUR기준은 미국에서도 실효성 있는 DUR 정보로 평가받고 있었으며, 광범위한 약효군에 대해서 모두 개발되어 적용되 고 있어, 우리나라도 향후 중복약물사용이 광범위하게 발생 하는 것으로 알려진 위장관계용제, 항생제, 순환기계용제 등 다양한 약효군으로 정보범위를 확대해나가야 할 것이다.
4) 오남용약물주의(Clinical Abuse, Misuse)
미국 CMS에서는 마약성진통제 등 오남용의약품에 대한 관리를 위해서 집중관리프로그램을 운영하고 있었는데, 각 주별로 임상적 오남용을 탐지할 수 있는 기준값을 설정하 고, 기준값을 넘어서는 환자에 대해서 중앙에서 탐지하여 원천적으로 보험적용을 차단하는 시스템이 그것이다.
11,12)예를 들어, 미국 메디케이드 및 메디케어에서는 주치의사 한명, 주치 약국 한 곳을 지정하는 것을 원칙으로 하는데, 만약 환자가 주치의사가 아닌 다른 의사들로부터 오남용 우 려약물을 여러번 처방받았다면, 컴퓨터가 자동으로 의심가 는 환자를 감지하여 보험에 제한을 두게 된다. 우리나라에 서도 프로포폴, 미다졸람 등 전신마취제의 오남용이 사회적 문제가 되고 있는데, 중앙에서 자료를 통합으로 감지할 수 있는 시스템이 감지된다면, 이러 오남용 문제를 사전에 감 지할 수 있는 체계를 구축할 수 있을 것이다.
임상적 오남용 정보는 효능군중복, 성분중복이 확장된 형 태로 제공되며, 각 주별로 ‘부적절 기준’ 임계값을 설정하여 정보를 제공하고 있었다. 의약품안전관리 측면에서 중대한 기준임에는 분명하나, 우리나라에서는 효능군중복 등의 기 준이 더 정착되고 난 후 시행되어야 하는 정보일 것으로 판 단되며, 부적절 기준에 대한 임계값을 설정하기 위한 연구 수행 등이 선행되어야 할 것이다.
5) 질병금기(Drug-Disease Contraindication)
질병금기 정보의 경우에는 미국 OBRA`90에 전향적 DUR
을 위한 필수정보로 규정되어 있었으나, 실제 미국에서 약
국조제단계에서 DUR기준으로 적용하지는 않고 있다. 이는
처방전에 질병정보가 제공되지 않고 환자 개인정보보호문
제 등으로 원천적으로 힘들기도 할 뿐만 아니라, 환자의 임
상적 상황이 복잡하고 다양하기 때문에 허가사항에 기재된 적응증 및 주의사항 정보만으로 일괄적인 전향적 DUR기준 을 개발하여 실제 임상현장에 적용할 수 없기 때문이다.
이러한 이유로, 미국에서도 질병금기 등의 DUR기준은 보 험심사를 목적으로 하는 규제수단으로는 적용되지 않고 있 었다. 대신 간질환자, 신질환자 또는 노인, 소아, 임산부와 같은 취약환자군을 대상으로는 후향적 DUR을 적극적으로 수행하여, 계도와 홍보의 방식으로 적절한 처방을 도모하는 것을 권고하고 있다. 이는 우리나라 향후 DUR정보개발 방 향에 있어서도 참고할 수 있을 것이다.
6) 부적절한 투여용량 및 투약기간(Incorrect Drug DosageㆍIncorrect Duration of Drug Treatment) 부적절한 투여용량 및 투약기간정보의 경우에도 미국 OBRA'90에 전향적 DUR을 위한 필수정보로 규정되어 있었 으나, 실제 미국에서는 조제단계에서 DUR로 적용되기 힘든 상황인 것으로 나타났다. 예를 들어 암환자 등에서 진통제 최대용량 등을 획일적으로 규제하는 것은 처방권을 침해하 는 소지가 있으며, 허가사항과 임상진료지침 등에 실제 사 용용량에 대한 근거가 불일치하는 경우도 많아 기준개발에 있어서도 불확실성이 큰 부분이다. 다만, 개별 성분에 대하 여 허가사항에 기재된 상용량 정보를 금기정보가 아닌 적정 사용을 위한 참고정보 수준으로 제공하고 있으나, 활용도는 높지 않은 것으로 나타났다.
3. 후향적 약물사용평가(DUR) 수행
전향적 DUR이 강제적이고 문책을 하는 시스템이라고 한 다면, 후향적 DUR은 결과를 보고하고 배우게 하는 자율적 계몽 시스템이라고 할 수 있다. CMS에서는 후향적 DUR은 전향적 DUR의 항목과 추가적으로 전향적 DUR에서 일괄적 으로 적용할 수 없는 질병금기, 부적절한 투여용량 및 기간 등의 기준에 대하여도 수행할 것을 권고하고 있다. 주로 각 주의 DUR위원회에 참여하고 있는 의사 또는 약사가 수행 하여 처방 및 조제행태를 평가하게 되며, 학회 등을 통해서 직접 의사를 만나서 학술적인 설명(academic detailing)을 실 시하거나, 이메일, 서면을 통해서 평가결과를 제공하고 있 었다. 후향적 DUR수행 시 모든 평가는 평가받는 주체와 동 등한 사람이 평가하는 것을 원칙으로 하고 있다.
21,22)또한 후향적 DUR수행 시 중점적으로 추진되는 사항은 금기 및 주의정보 제공 시행 전후의 처방양상 차이에 대한 평가를 적극적으로 진행하는 것이다.
23)프로그램이 처방양 상에 미친 효과는 반드시 평가되지만, 긍정적 효과가 없다 고 할지라도 문제점을 일부 개선하여 지속적으로 후향적 DUR을 수행하는 것이 CMS의 방침이며, 모든 주에서 일년 에 최소 4번 후향적 DUR결과를 발표하여 널리 알리도록 하
고 있다. 후향적 DUR결과는 각종 다양한 학회, 세미나, 편 지 등을 통하여 통합적인 정보를 제공하는 것을 우선으로 하며, 경고를 주거나 보험삭감 등의 강제적인 조치는 가장 최후의 단계로 보류되는 조치이다.
결 론
우리나라는 단일건강보험체계를 가지고 있고, 국가에서 DUR정보개발 및 운영까지 주관하고 있으며, 의사와 약사가 동시에 DUR에 참여하고, 전국 의료기관 및 약국간에 DUR 점검을 할 수 있는 통합된 IT인프라를 갖추고 있다. 미국은 특유의 다원주의 문화에 기반하여 DUR정보제공에 있어 공 공부분에서는 최소한의 규제만을 담당하고 여러 민간회사 들이 공존하여 DUR정보를 제공하고 있다.
특히, 우리나라는 허가사항을 관장하고 의약품안전관리 를 담당하는 식품의약품안전처에서 DUR정보에 대한 책임 을 지고 고시의 형태로 제공하는 것은 정보의 완결성과 책 임성 측면에서 합리적인 체계라고 볼 수 있다. 또한 국가에 서 직접 DUR정보개발에 개입하고 있어 상대적으로 저비용- 고효율적이며, 이득에 목적을 두지 않고 공공의 것으로 모 두에게 공개되어 모든 국민에게 의약품안전사용을 위한 기 준으로 제공되고 있다. 게다가 우리나라의 시판허가된 약 중 30% 이상이 미국이 아닌 일본, 유럽 등에서 수입된 것임 을 고려하면, 독자적으로 DUR기준을 개발하고 시스템을 운 영하는 우리나라의 특수한 상황이 잘 반영된 것이라고 볼 수 있겠다.
지난 수십년간 미국의 DUR수행경험으로부터 너무나 많 은 DUR정보가 제공됨에 따라 경고창을 무시하는(override) 문제가 심각하다는 보고가 많다는 점은 향후 DUR정보개발 에 있어서도 고려해야 할 부분이다.
24,25)우리나라의 DUR기 준개발에 있어서도 금기ㆍ주의정보 등을 양적으로 많이 생 산하기 보다는, 적은 양의 정보라도 부작용이 중대하고 현 재 처방행태를 바꿀 수 있는 실용적인 정보만을 제공하는 방향으로 추진되어야 할 것이다. 우리보다 몇십년 앞서 DUR을 경험한 미국에서 너무 많은 정보가 남발됨에 따라 습관적인 경고창의 무시로 중대한 부작용을 예방하지 못할 우려가 발생하고 있다는 점을 고려하여, 이러한 실패의 경 험을 되풀이하지 않도록 해야 할 것이다.
최근 미국에서는 DUR제도 수행에 있어 절대로 약제비
절감을 목적으로 제도를 무리하게 시행해서는 안된다는 목
소리가 높다. DUR의 궁극적인 목적을 근거에 기반하여
(Evidence-based) 적절하게 가치를 측정하고(Value-based), 궁
극적인 환자보건의 개선 결과(Quality of Outcome)를 측정하
는 방향으로 패러다임이 변화하고 있다. 미국의 DUR관련
전문가들은 궁극적인 DUR시스템의 방향성을 잃어버렸을
때, 의사, 약사들의 거부감을 불러일으키고 실패하는 제도 가 되었음을 강조한다. 미국의 실패한 경험을 답습하지 말 고, 성공적 경험을 우리나라 상황에 맞게 취사선택하여 배 우는 것이 중요한 부분임을 명심하며, 이를 통해서 우리 국 민들을 중대한 부작용 위험으로부터 보호하는데 기여할 수 있게 될 것이다.
참고문헌
1. Park BJ. Drug Utilization Review. JPERM 2008;1:13-9.
2. Omnibus Budget Reconcilliation Act of 1990. Public Law 1990;101-508.
3. Center for Medicare and medicaid Service [cited 2013 June 2].
Available from: http://www.cms.gov/ [assessed 2013 June 11].
4. Medicaid Drug Utilization Review (DUR) Program [cited 2013 July 8]. Available from: http://www.medicaid.gov/Medi- caid-CHIP-Program-Information/By-Topics/Benefits/Prescriptio n-Drugs/Drug-Utilization-Review.html [assessed 2013 July 5].
5. Center for Medicare and medicaid Service [cited 2013 June 2].
Available from: http://www.cms.gov/ [assessed 2013 June 11].
6. Kim Y, Shin JY, Park BJ. Current Status of Medicaid DUR System in the USA and its implication to Korea. JPERM 2013;6:10-6.
7. CMS. Additional Guidance Related to Improving DUR Con- trols in Part D (2012, draft) [cited 2013 July 8]. Available from: http://www.cms.gov/Medicare/Prescription-Drug- Coverage/PrescriptionDrugCovContra/Downloads/Overutilization FurtherGuidance2013.pdf [assessed 2013 July 5].
8. Medicaid Drug Utilization Review Annual Report [cited 2013 July 8]. Available from: http://www.medicaid.gov/Medicaid- CHIP-Program-Information/By-Topics/Benefits/Prescription- Drugs/Downloads/DURSurvey.pdf [assessed 2013 July 5].
9. Bell DS, Friedman MA. E-prescribing and the medicare mod- ernization act of 2003. Health Aff 2005;24:1159-69.
10. Centers for Medicare & Medicaid Services (CMS), HHS.
Medicare program; e-prescribing and the prescription drug program. Final rule. Fed Regist 2005;70:67567-95.
11. Center for Medicare and medicaid Service, E-prescribing [cited 2013 July 5]. Available from: http://www.cms.gov/
Medicare/E-Health/Eprescribing/index.html?redirect=/eprescrib- ing/ [assessed 2013 July 5].
12. Grossman JM, Gerland A, Reed MC, Fahlman C. Physi- cians' experiences using commercial e-prescribing systems.
Health Aff 2007;26:393-404.
13. Fulda TR, Lyles A, Pugh MC, Christensen DB. Current status of prospective drug utilization review. J Manag Care Pharm
2004;10:433-41.
14. Monane M, Matthias DM, Nagle BA, Kelly MA. Improving prescribing patterns for the elderly through an online drug utilization review intervention. JAMA 1998;280:1249-52.
15. New York State Medicaid Fee-for-service Pharmacy Programs [cited 2013 July 8]. Available from: http://www.health.ny.gov/
health_care/medicaid/program/pharmacy.htm [assessed 2013 July 5].
16. Annual Report of the New York State Medicaid Drug Utilization Review Board (2011) [cited 2013 July 8]. Available from:
http://www.health.ny.gov/health_care/medicaid/program/
dur/docs/2011_dur_ann_gover_legi.pdf [assessed 2013 July 5].
17. Lyles A, Zuckerman IH, DeSipip SM, Fulda TR. When warn- ings are not enough: primary prevention through drug use review. Health Affairs 1998:17:175-83.
18. Indermitte J, Beutler M, Bruppacher R, Meier CR, Hersberg- er KE. Management of drug-interaction alerts in community.
J Clin Pharm Ther 2007;32:133-42.
19. Malone DC, Abarca J, Hansten PD, Grizzle AJ, Armstrong EP, Van Bergen RC, Duncan-Edgar BS, Solomon SL, Lipton RB. Identification of serious drug-drug interactions: results of the partnership to prevent drug-drug interactions. J Am Pharm Assoc 2004;44:142-51.
20. Mutebi A, Warholak TL, Hines LE, Plummer R, Malone DC.
Assessing patients’ information needs regarding drug- drug interactions. J Am Pharm Assoc 2003;53:39-45.
21. Maryland Medicaid Pharmacy Program: Peer Review Program for Mental Health Medications [cited 2013 July 8]. Available from: https://mmcp.dhmh.maryland.gov/pap/SitePages/Peer%20- Review%20Program.aspx [assessed 2013 July].
22. Maryland Medicaid Pharmacy Program: Clinical Criteria for Antipsychotic Use in Children Less Than Ten Years of Age [cited 2013 July 8]. Available from: https://mmcp.dhmh.
maryland.gov/pap/docs/P2P_Review_criteria_1.pdf [assessed 2013 July 5].
23. Hennessy S, Bilker W, Zhou L, Weber A, Brensinger C, Wang Y, Strom B. Retrospective drug utilization review, pre- scribing, errors, and clinical outcome. JAMA 2003;290:1494- 99.
24. Sus VDH, Aarts J, Vulto A, Berg M. Overding of drug safe- ty alerts in computerized physician order entry. J Am Med Inform Assoc 2006;13:138-47.
25. Galanter WL, Didomengo RJ, Polikaitis A. A trial of auto- mated decision support alerts for contraindicated medication using computerized physicain order entry. J Am Med Inform Assoc 2005;12:269-74.