LPS Stimulated B Lymphocytes Inhibit the Differentiation of Th1 Lymphocytes
Ha-Jeong Kim*
Department of Physiology, School of Medicine, Kyungpook National University, Daegu 41944, Korea Received September 20, 2015 /Revised September 24, 2015 /Accepted October 20, 2015
The lymphocyte component of the immune system is divided into B lymphocytes and T lymphocytes.
B lymphocytes produce antibodies (humoral immunity) via maturation into plasma cells, and T lym- phocytes kill other cells or organisms (cellular immunity). A traditional immunological paradigm is that B lymphocyte and T lymphocyte interactions are a one-way phenomenon, with T lymphocytes helping to induce the terminal differentiation of B lymphocytes into immunoglobulin class-switched plasma cells. A deficiency of T lymphocytes was reported to result in defective B lymphocyte function.
However, evidence for a reciprocal interaction between B and T lymphocytes is emerging, with B lym- phocytes influencing the differentiation and effector function of T lymphocytes. For example, B lym- phocytes have been shown to induce direct tolerance of antigen-specific CD8+ T lymphocytes and in- duce T lymphocytes anergy via transforming growth factor-beta (TGF-β) production. The present study showed that LPS-stimulated B lymphocytes inhibited the differentiation of Th1 lymphocytes by inhibiting the production of interleukin-12 (IL-12) from dendritic cells. An interaction between the B lymphocytes and dendritic cells was not needed for this inhibition, and the B lymphocytes did not alter dendritic cell maturation. B lymphocyte-derived soluble factor (BDSF) suppressed the LPS-in- duced IL-12p35 transcription in the dendritic cells. Overall, these results point to a novel B lympho- cyte-mediated immune suppressive mechanism. The findings cast doubt on the traditional paradigm of immunological interactions involving B lymphocyte and T lymphocyte interactions.
Key words : B lymphocytes, Th1 lymphocytes, IL-12, immune regulation
*Corresponding author
*Tel : +82-53-420-4811, Fax : +82-53-424-3349
*E-mail : kimhajeong@knu.ac.kr
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Journal of Life Science 2015 Vol. 25. No. 12. 1425~1431 DOI : http://dx.doi.org/10.5352/JLS.2015.25.12.1425
서 론
면역반응은 선천면역(innate immune)과 후천면역(adap- tive immune)으로 나뉘어 진다. 면역반응은 보통 innate im- mune system에서 병원체를 인식하는 것에서 시작하며, 병원 체를 인식한 innate immune system이 adaptive immune sys- tem을 활성화 시키는 방향으로 진행된다. 병원체를 인식하는 innate immune system은 호중성구, 대식세포, 그리고 수지상 세포가 담당한다[19].
수지상세포가 체내에 침입하는 감염성 병원체를 인지하면 IL-12, IL-10, 그리고 TGF-β 같은 cytokine을 분비하여 T 림프 구의 분화와 활성을 조절하여 adaptive immune을 활성화시 킨다. 그리고 수지상세포에 의해 활성화 된 T 림프구 중 T helper 림프구는 IFN-γ, IL-4 등의 cytokine 을 분비하여 B 림 프구의 분화와 면역글로불린 class-switch를 조절한다. 이러한 cascade가 일반적으로 알려진 면역반응의 활성화 작용이다[5, 20].
수지상세포-T 림프구의 작용은 세포-세포 interaction 뿐만 아니라 cytokine을 매개로 서로가 서로의 작용을 조절함과 수 지상세포와 T 림프구에 의해 활성화되는 B 림프구의 작용은 잘 알려져 있으나 B 림프구에 의한 수지상세포와 T 림프구의 활성 조절은 일부만 알려져 있다[15].
B 림프구는 TGF-β를 분비하여 항원특이 CD8+ T 세포의 tolerance를 유도할 수 있다는 것이 보고되어 있다[7]. B 림프 구의 작용을 제거한 마우스에서 T 림프구 매개의 면역 반응이 저해되어 있음이 보고되었으나 그 기전은 잘 알려져 있지 않 다. 또한 B 림프구의 작용을 제거한 실험 동물 모델에서 암 성장 촉진, experimental autoimmune encephalitis (EAE), 그 리고 류마티스성 관절염 등 T 림프구 매개 면역의 작용이 강화 되는 것이 보고 되었으나 그 기전은 알려져 있지 않다[1, 3, 4, 8, 10, 14, 16, 17, 18].
본 연구는 LPS에 의해 자극된 B 림프구가 분비한 물질이 수지상세포의 IL-12 분비를 억제하여 Th1 림프구의 분화를 억 제함을 보여준다. 이는 고전적으로 알려진 T 림프구에 의한 B 림프구의 활성 조절뿐만 아니라 B 림프구에 의한 T 림프구 의 분화 조절도 존재함을 보여준다.
재료 및 방법 세포 배양
B 림프구와 T 림프구는 는 C57BL/6 마우스의 비장에서 분
A
B
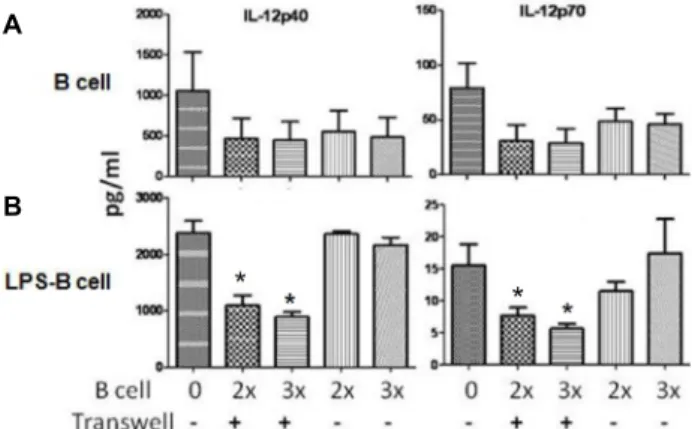
Fig 1. A novel IL-12-inhibiting activity secreted by LPS stimu- lated B lymphocytes. Dendritic cells and unstimuated B lymphocytes (A, B-cell) and LPS stimulated B lympho- cytes (B, LPS-B cell) were co-cultured for 24 hr, and IL-12p35 and IL-12p70 production were measured by ELISA. Dendritic cells (DCs) were generated from mouse bone marrow heamaropoietic stem cell, by GM-CSF and IL-4 treatment for 7 days. DCs were greater than 95%
pure that expressed the appropriate markers such as CD11c, CD86, and MHC Class II.(data not shown) B lym- phocytes were isolated with anti-CD19 microbead (Miltenyi) from mouse spleen. DCs (0.3×106) and B lymphocytes were co-cultured or separated in a transwell chamber de- vice with B lymphocytes in the upper chamber and mDCs in the lower chamber, in ratios of DC:B of 1:2 (2x) or 1:3 (3x), for 24 hr in the presence or absence of LPS (1 μg/ml) in both chambers. Cell-free culture supernatant was analyzed for cytokines by specific ELISAs. Unstimu- lated and LPS stimulated B lymphocytes did not produce any detectable IL-12p40 and p70 (not shown). Data repre- sent summary of three donors each with SD. *<0.05.
리하여 사용하였다. 비장에서 CD19 bead (Miltenyl Biotec)를 이용하여 B 림프구를 제조사의 프로토콜에 따라 먼저 분리한 다음, B 림프구가 제거된 비장세포를 이용 naïve CD4+ T 림프 구 분리 kit (Miltenyl Biotec)를 이용하여 역시 제조사의 프로 토콜에 따라 T 림프구를 분리하였다. B 림프구는 15%의 FBS 와 1%의 penicillin 와 sterptomycin이 포함된 RPMI1640 me- dia를 사용하여 배양하였다. Naïve CD4+ T 림프구는 10%
FBS와 1%의 penicillin 와 sterptomycin이 포함된 RPMI1640 media에 IL-2 (10 ng/ml)을 첨가하여 배양하였다. 수지상세포 는 마우스의 골수에서 조혈모세포를 분리하여, DMEM media (10%의 FBS와 1%의 penicillin 와 sterptomycin 포함)에서 배 양하면서, GM-CSF (250 ng/ml)와 IL-4 (100 ng/ml)를 7일간 처리하여 수지상세포로 분화시켜 사용하였다. luciferase as- say에 이용한 세포는 마우스 대식세포주인 RAW264.7이다.
RAW264.7은 RPMI1640 (10%의 FBS와 1%의 penicillin 와 sterptomycin 포함)으로 배양하였다. Apoptotic cell은 마우스 의 thymus에서 thymocyte를 분리한 후 500 nM dexameth- asone을 6시간 처리하여 apoptosis를 유도한 후 사용하였다.
사용한 C57BL/3 마우스는 경북대학교 동물실험윤리위원 회 규정에 따라 허가받은 시설에서 실험을 하였다(승인번호 2014-0121-1).
ELISA
세포 성분을 제거한 세포배양액에서 IL-12p40, IL-12p35, IFN-γ cytokine 은 R&D bioscience에서 제공되는 kit를 이용 하여 제조사 프로토콜에 따라 측정하였다.
Luciferase Assay
Human IL-12p35 promoter (-1082/+61) 또는 IL-12p40 promoter (-3300/+10)에 firefly luciferase reporter gene이 cloning 된 construct는 Weil Cornell Medical School의 Xiaojing Ma에게 받아서 사용하였다[11]. 각각의 promoter-re- porter construct를 RAW264.7세포에 electroporator (Bio-Rad) 를 이용하여 주입하고, IFN-γ/LPS, 그리고 apoptotic cells, 그 리고 B 림프구 -세포배양액을 6시간 처리한 후, luciferase ac- tivity를 cell lysate에서 측정하였다. 측정은 luciferase assay kit (promega)를 이용하여 제조자 프로토콜에 따라 하였다.
Flow cytometry analysis
골수에서 분리하여 분화시킨 1×106개의 수지상 세포에 LPS 또는 B 림프구 세포배양액을 24시간 처리한 후 CD11c, MHC class II, CD86의 발현을 측정하였다. 수지상세포는 PBS로 세 척한 후 0.05% trypsin/EDTA를 처리하여 세포를 수집한 다음 FITC로 표지 된 각각의 항체(BD biosciences, NJ)와 ice에서 30분간 반응 시킨 다음 PBS로 두 번 세척하고 flow cytometry (FACS Calibur; BD biosciences, NJ)를 이용하여 항원을 발현
하고 있는 세포의 비율을 측정하여 나타내었다.
통계처리
모든 실험은 3회 반복 시행하였으며, 결과는 평균 ± 표준편 차로 나타내었다. 각 실험 결과의 유의성 검토는 시료가 포함 되지 않은 대조군과 비교하여 student’s t-test에 의해 판정하 였으며 p값이 0.05 미만일 때 유의성이 있다고 판단하였다.
결과 및 고찰
A soluble IL-12-inhibiting factor(s) is(are) derived from LPS-activated B lymphocytes.
마우스 골수 조혈모세포를 분리하여 GM-CSF와 IL-4를 7일 간 처리하여 수지상세포로 분화시킨 후 LPS를 처리하면 IL-12 와 IL-10같은 cytokine이 증가한다[2]. B 세포가 수지상세포의 IL-12 분비에 미치는 영향을 알아보기 위해 비장에서 분리한 B 림프구(Fig. 1A) 또는 LPS에 의해 자극 된 B 림프구(Fig.
A B
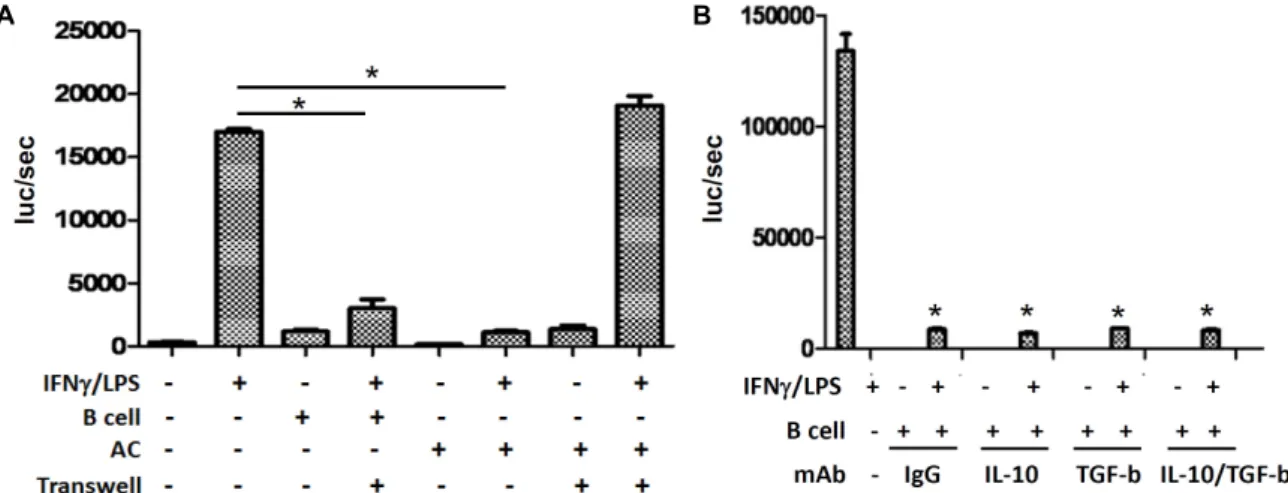
Fig. 2. IL-12 transcription was inhibited by LPS stimulated B lymphocytes. (A) The human IL-12p35 promoter (-1082/+61) linked to the firefly luciferase reporter gene was transiently transfected into RAW264.7 cells. Cells were treated with IFN-γ and LPS for 6 h with or without exposure to apoptotic thymocytes (AC) or LPS treated B lymphocytes. Luciferase activities were measured from cell lysate. (B) IL-12p35 promoter-reporter activity was measured following treatment of anti-mouse IL-10 and anti-mouse TGF-β (5 μg/ml), which were added 1h before the addition of the B lymphocytes. Results represent the mean +SD of three individual experiments. *<0.05
1B)를 함께 배양 한 후, IL-12의 발현을 ELISA로 측정하였다.
IL-12는 p35와 p40의 heterodimeric dimer로 이루어진 cyto- kine이므로[6, 7, 9, 21, 22] IL-12p40와 IL-12p70의 양을 각각 측정하였다. B 림프구와 수지상세포의 직접적인 interaction이 IL-12의 분비에 중요하게 작용하는 지 B 림프구에서 분비되는 soluble factor가 중요한 지를 확인하기 위하여 transwell sys- tem을 이용하였다. Fig. 1A에서 보는 것과 같이 LPS에 의해 수지상세포에서 증가한 IL-12p40과 IL-12p70은 자극되지 않 은 B 림프구에 의해서는 줄어들거나 늘어나지 않는 것을 알 수 있었다. 그러나 Fig. 1B에서 보는 것과 같이 LPS에 의해 활성화 된 B림프구에서 분비된 soluble factor는 LPS에 의해 수지상세포에서 증가된 IL-12p40과 IL-12p70의 발현을 감소 시킨다. 다만 LPS에의해 활성화된 B림프구와 수지상세포가 직접적인 interaction을 하는 경우(transwell로 분리하지 않은 경우)에서는 발현 억제 효과가 보이지 않는다. 이는 LPS에 의 해 활성화 된 B 림프구에서 수지상세포의 IL-12발현을 감소시 키는 soluble한 물질이 분비됨을 의미함과 동시에 활성화 된 B림프구 표면에 수지상세포에 직접 작용하여 그러한 억제 신 호를 줄이는 반대 신호가 존재함을 의미한다.
LPS-activated B lymphocytes derived a soluble IL-12-inhibiting factor(s) strongly inhibits IL-12p35 transcriptional activity in a manner independently of TGF-γ and IL-10.
B 림프구에서 분비되는 물질에 의한 IL-12의 발현 감소가 transcription 조절에 의한 것인지를 확인하기 위해 luciferase assay를 시행하였다. Apoptotic cell (AC)에 의해 IL-12p35의 발현이 감소됨이 알려져 있기에[11] AC를 실험에 대한 대조군
으로 사용하였다. Fig. 2A에서 보는 것 처럼 IL-12p35 pro- moter는 IFN-γ/LPS의 자극이 있을 때 증가한다. 이 증가는 AC과 함께 배양했을 때 억제 된다. 이와 유사하게 LPS로 자극 한 B 림프구와 함께 배양한 경우에도 IL-12p35 promoter ac- tivity는 억제된다. 알려진 대로 AC에 의한 억제는 세포-세포 의 직접적인 작용에 의한 것이기 때문에 transwell을 이용하여 분리 배양한 경우 억제가 나타나지 않는다. 그러나 B 림프구에 의한 억제는 transwell을 이용하여 분리 배양한 경우에도 나타 난다. 오히려 이전 Fig. 1B에서 보듯이 LPS에의해 활성화된 B림프구와 수지상세포가 직접적인 interaction을 하는 경우 (transwell로 분리하지 않은 경우)에서는 억제 효과가 보이지 않는다. 이들 실험 결과로 LPS에 의해 활성화 된 B 림프구에서 수지상세포의 IL-12를 감소시키는 soluble한 물질이 분비됨을 다시 한번 확인 할 수 있고 활성화 된 B림프구 표면에 수지상 세포에 직접 작용하여 그러한 억제 신호를 줄이는 반대 신호 가 존재한다고 생각할 수 있다.
IL-12의 분비를 억제하는 cytokine으로 잘 알려진 것은 TGF-γ나 IL-10이다[2, 12, 13]. B 림프구를 LPS로 자극한 경우 에 TGF-γ와 IL-10가 역시 분비된다. 따라서 LPS에 의해 자극 된 B 림프구에 의해 억제되는 IL-12의 분비가 TGF-γ나 IL-10에 의한 것인지를 알아보기 위해서, TGF-γ와 IL-10에 대한 기능 억제 항체를 이용하여 IL-12 생성 억제가 사라지는 지를 확인 하였다. Fig. 2B에서 보는 것 처럼 LPS에의해 자극된 B 림프구 에서 분비되는 수지상세포의 IL-12 생성 억제는 TGF-γ나 IL-10에 대한 기능 억제 항체에 의해 사라지지 않는다. 이는 수지상세포에서 나타나는 IL-12의 생성 억제가 TGF-γ나 IL-10 에 의한 이차 효과가 아니라 LPS에 의해 B 림프구에서 분비되 는 무언가에 의해 나타나는 것임을 알 수 있다. 이에 우리는
A
B
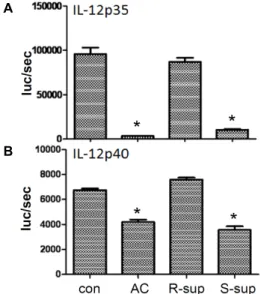
Fig. 3. IL-12 transcription was inhibited by the soluble factor from LPS stimulated B lymphocytes. The human IL-12 p35 promoter (-1,082/+61) (A) or the p40 promoter (-3,300/+10) (B) linked to the firefly luciferase reporter gene were transiently transfected into RAW264.7 cells.
Isolated B lymphocytes were stimulated with or without LPS in culture for 24 hr. Supernatant was harvested and added to RAW264.7 cells transiently transfected with the IL-12p35, p40 reporter. Cells were treated with IFN-γ and LPS for 6 hr with or without exposure to apoptotic thymocytes (AC) or normal culture supernatant from resting B lymphocytes (R-sup) or LPS-stimulated B lym- phocytes (S-sup). Luciferase activities were measured from cell lysate. Results represent the mean +SD of three individual experiments. Note that transfer of the B lym- phocytes supernatant was done at a 1:1 ratio (v/v) with respect to the RAW264.7 cell culture, i.e., 1 ml of the supernatant was added to 1 ml of RAW cell culture.
For the control cultures (the first column), 1 ml of fresh medium was added instead. *<0.05.
그 인자를 B 림프구 유래 인자(B cell derived soluble factor;
BDSF)라 명명하였다.
B 림프구 유래 세포 배양액을 이용하여 IL-12 발현 억제가 B 림프구 자체가 아닌 BDSF에 의한 것임을 확인하기 위하여, B 림프구 또는 LPS를 처리한 B 림프구의 배양액으로 pro- moter assay를 하였다. 또한 IL-12는 p35와 p45의 hetero- dimeric dimer로 이루어진 cytokine이므로[6, 7, 9, 21, 22]
BDSF에 의한 IL-12 발현 억제가 p40 promoter의 조절에 의해 서도 일어나는 지를 보기 위하여 p40 promoter activity도 측 정하였다. Fig. 3에서 보는 것과 같이 LPS에 의해 증가된 대식 세포의 p35 promoter activity는 apoptotic cell과 LPS로 자극 한 B 림프구 유래 세포 배양액(BDSF) (S-sup)에 의해 억제됨을 알 수 있다. LPS로 자극되지 않은 B 림프구 유래 세포배양액 (R-sup)은 p35 promoter activity를 억제하지 못한다. 그리고
p40 promoter역시 정도는 약하지만 p35 promoter의 조절과 비슷한 양상을 보인다. 이에 우리는 apoptotic cell이나 LPS로 자극된 B 림프구유래 세포배양액에 대식세포나 수지상세포 에서 분비되는 IL-12의 발현을 억제하는 물질(BDSF)이 존재함 을 확인할 수 있다.
BDSF inhibits Th1 lymphocytes differentiation, but little DC maturation
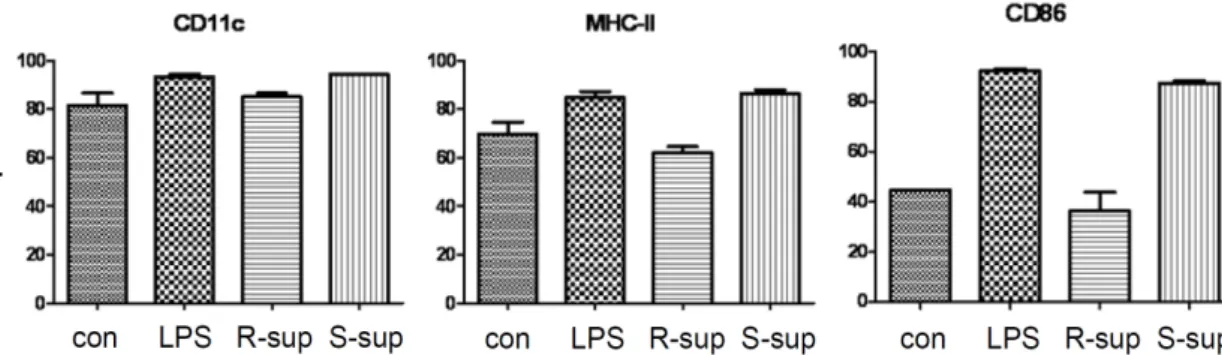
B 림프구에 의한 수지상세포 기능 조절을 확인하기 위하여 B 림프구가 수지상세포의 성숙에 미치는 영향을 수지상세포 표현의 마커를 이용하여 확인하였다. Fig. 4에서 보는 것과 같 이 B 림프구에서 분비된 물질은 수지상세포의 CD11c, MHC class II, CD86의 발현에는 변화를 주지 않음을 알 수 있다.
즉 활성화 된 B림프구유래 세포 배양액은 수지상세포의 성숙 에는 별다른 영향을 미치지 않는다.
수지상세포는 T 림프구와의 직접적인 interaction에 의해 T 림프구를 활성화 시키기도 하지만 분비하는 cytokine의 종 류와 양을 변화시켜 T 림프구의 분화를 조절한다. 특히 수지상 세포에서 분비하는 IL-12는 Th1림프구의 분화를 촉진하여 B 림프구의 활성에 영향을 준다. BDSF에 의한 수지상세포의 IL-12 발현 억제가 Th1림프구의 분화를 조절하는 지를 확인하 기 위해 골수 유래 수지상 세포를 LPS로 자극하고 BDSF로 IL-12의 발현을 억제시킨 다음, 마우스 비장에서 분리한 naïve CD4+ T 림프구를 함께 배양한 다음 IFN-γ의 분비를 측정하였 다. naïve CD4+ T 림프구가 Th1 림프구로 분화하고 활성화되 면 IFN-γ의 분비가 증가한다[21]. Fig. 5에서 보는 것과 같이 수지상세포를 LPS로 자극하면 T 림프구에서 IFN-γ의 분비가 증가한다. 그러나 BDSF (R-sup)를 함께 처리하면 T 림프구에 서 분비하는 IFN-γ는 감소한다. ConA는 수지상세포가 아닌 T 림프구를 단독으로 자극하여 T 림프구의 IFN-γ의 분비를 증가시킨다. 그러나 ConA에 의해 증가한 IFN-γ의 분비는 BDSF에 의해 억제되지 않는다. 이는 BDSF의 작용이 T 림프구 에 직접 작용하는 것은 아니라는 것을 간접적으로 보여준다.
LPS를 수지상세포에, ConA를 T 림프구에 같이 자극하면 T 림프구에서 IFN-γ의 분비가 더욱 증가한다. 이때 LPS와 ConA 의 자극에 의해 증가한 IFN-γ의 분비는 BDSF를 함께 처리한 경우 ConA 단독으로 T 림프구를 자극하였을 때 수준의 IFN-γ 분비를 보인다. 이 역시 BDSF는 수지상세포의 IL-12 발현을 조절하여 T 림프구의 IFN-γ 분비를 조절하나, T 림프구 단독 자극에 의한 IFN-γ 분비는 조절하지 않는다는 것을 보여준다.
본 연구는 고전적인 T 림프구에 의한 B 림프구 분화 조절이 아닌 B 림프구에 의한 Th1 림프구 분화가 조절된다는 기전을 보여준다. LPS에 의해 자극된 B 림프구가 분비하는 물질 (BDSF)에 의해 수지상세포의 IL-12의 발현이 억제되어 Th1 림프구의 분화를 억제하는 기전이 존재한다. 이는 septic shock 같은 과도한 면역반응이 인체 질환을 유발하지 않도록 neg-
Fig. 4. Phenotypic analysis of dendritic cells. Mouse bone marrow-derived dendritic cells were cultured in the presence of apoptotic thymocytes (AC) or normal culture supernatant from resting B lymphocytes (R-sup) or LPS-stimulated B lymphocytes (S-sup) for 24 hr and followed by analysis of cell surface molecules as indicated by flow cytometry. Data show the percentage of positive cells. Results represent the mean +SD of three individual experiments.
Fig. 5. BDSF inhibits IFN-γ production from Th1 lymphocytes.
Mouse bone marrow-derived dendritic cells were cul- tured with naïve CD4+ T lymphocytes in the presence of culture supernatant from LPS-stimulated B lympho- cytes (S-sup) for 24 hr and followed by analysis of IFN-γ production was measured by ELISA. Dendritic cells (DCs) were generated from mouse bone marrow heama- topoietic stem cell, by GM-CSF and IL-4 treatment for 7 days. B lymphocytes and naïve CD4+ T lymphocytes were isolated from mice spleen by micro bead as men- tioned in material and methods. DCs were stimulated by LPS with or without culture supernatant from LPS- stimulated B lymphocytes (S-sup) for 6 hr, and isolated naïve CD4+ T lymphocytes were cultured with DCs for 24 hr. IFN-γ production was measured from supernatant.
ConA was used as T lymphocyte stimulants. Results rep- resent the mean +SD of three individual experiments.
*<0.0.
ative regulation 기전이 존재함을 보여준다. 이러한 기전을 이 용하면 염증성 질환에 대한 치료가 가능할 것으로 생각된다.
따라서 염증성 질환에 대한 치료제로 사용할 수 있는 물질 개발을 위해 BDSF가 어떤 물질인지를 규명해 내는 후속 연구 가 필요할 것이다.
감사의 글
이 논문은 2014학년도 경북대학교 신임교수정착연구비에 의하여 연구되었습니다.
Refernces
1. Agarwal, A., Verma, S., Burra, U., Murthy, N. S., Mohanty, N. K. and Saxena, S. 2006. Flow cytometric analysis of Th1 and Th2 cytokines in PBMCs as a parameter of immuno- logical dysfunction in patients of superficial transitional cell carcinoma of bladder. Cancer Immunol. Immunother. 55, 734- 743.
2. Aste-Amezaga, M., Ma, X., Sartori, A. and Trinchieri, G., 1998. Molecular mechanisms of the induction of IL-12 and its inhibition by IL-10. J. Immunol. 160, 5936-5944.
3. Barbera-Guillem, E., Nelson, M. B., Barr, B., Nyhus, J. K., May, K. F. Jr, Feng, L. and Sampsel, J. W. 2000. B lympho- cyte pathology in human colorectal cancer. Experimental and clinical therapeutic effects of partial B cell depletion.
Cancer Immunol. Immunother. 48, 541-549.
4. Chapoval, A. I., Fuller, J. A., Kremlev, S. G., Kamdar, S.
J. and Evans, R. 1998. Combination chemotherapy and IL-15 administration induce permanent tumor regression in a mouse lung tumor model: NK and T cell-mediated effects antagonized by B cells. J. Immunol. 161, 6977-6984.
5. Chung, C. Y., Ysebaert, D., Berneman, Z. N. and Cools, N.
2013. Dendritic cells: cellular mediators for immunological tolerance. Clin. Dev. Immunol. 2013, 972865.
6. Del Vecchio, M., Bajetta, E., Canova, S., Lotze, M. T., Wesa, A., Parminani, G. and Anichini, A. 2007. Interleukin-12: bio- logical properties and clinical application. Clin. Cancer Res.
13, 4677-4685.
7. Galon, J., Costes, A., Sanchez-Cabo, F., Kirilovsky, A., Mlecnik, B., Lagorce-Pages, C., Tosolini, M., Camus, M., Berger, A., Wind, P., Zinzindohoue, F., Bruneval, P., Cugnenc, P. H., Trajanoski, Z., Fridman, W. H. and Pages, F. 2006. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science
313, 1960-1964.
8. Houbiers, J. G., van der Burg, S. H., van de Watering, L.
M., Tollenaar, R. A., Rrand, A., van de Velde, C. J. and Melief, C. J. 1995. Antibodies against p53 are associated with poor prognosis of colorectal cancer. Br. J. Cancer 72, 637-641.
9. Hung, K., Hayashi, R., Lafond-Walker, A., Lowenstein, C., Pardoll, D. and Levitsky, H. 1998. The central role of CD4(+) T cells in the antitumor immune response. J. Exp. Med. 188, 2357-2368.
10. Kanazawa, M., Yoshihara, K., Abe, H., Iwadate, M., Watanabe, K., Suzuki, S., Endoh, Y., Takita, K., Sekikawa, K., Takenochita, S., Ogata, T. and Ohto, H. 2005. Effects of PSK on T and dendritic cells differentiation in gastric or colorectal cancer patients. Anticancer Res. 25, 443-449.
11. Kim, S., Elkon, K. B. and Ma, X. 2004. Transcriptional sup- pression of interleukin-12 gene expression following phag- ocytosis of apoptotic cells. Immunity 21, 643-653.
12. Ma, X., Sun, J., Papasavvas, E., Riemann, H., Robertson, S., Marchall, J., Bailer, R. T., Moore, A., Donnelly, R. P., Trinchieri, G. and Montaner, L. J. 2000. Inhibition of IL-12 production in human monocyte-derived macrophages by TNF. J. Immunol. 164, 1722-1729.
13. Mitsuhashi, M., Liu, J., Cao, S., Shi, X. and Ma, X. 2004.
Regulation of interleukin-12 gene expression and its anti-tu- mor activities by prostaglandin E2 derived from mammary carcinomas. J. Leukoc. Biol. 76, 322-332
14. Perricone, M. A., Smith, K. A., Claussen, K. A., Plog, M.
S., Hempel, D. M., Roberts, B. L., St George, J. A. and Kaplan, J. M. 2004. Enhanced efficacy of melanoma vaccines in the absence of B lymphocytes. J. Immunother. 27, 273-281.
15. Rosser, E. C. and Mauri, C. 2015. Regulatory B cells: origin, phenotype, and function. Immunity 42, 607-612.
16. Rowley, D. A. and Stach, R. M. 1998. B lymphocytes secret-
ing IgG linked to latent transforming growth factor-beta prevent primary cytolytic T lymphocyte responses. Int.
Immunol. 10, 355-363.
17. Shah, S., Divekar, A. A., Hilchey, S. P., Cho, H. M., Newman, C. L., Shin, S. U., Nechustan, H., Challita-Eid, P.
M., Segal, B. M., Yi, K. H. and Rosenblatt, J. D. 2005.
Increased rejection of primary tumors in mice lacking B cells: inhibition of anti-tumor CTL and TH1 cytokine re- sponses by B cells. Int. J. Cancer 117, 574-586.
18. Sheu, B. C., Lin, R. H., Lien, H. C., Ho, H. N., Hsu, S. M.
and Huang, S. C. 2001. Predominant Th2/Tc2 polarity of tumor-infiltrating lymphocytes in human cervical cancer. J.
Immunol. 167, 2972-2978.
19. Silverstein, A. M. 2003. Cellular versus humoral immunol- ogy: a century-long dispute. Nat. Immunol. 4, 425-428.
20. Tangye, S. G., Ma, C. S., Brink, R. and Deenick, E. K. 2013.
The good, the bad and the ugly - TFH cells in human health and disease. Nat. Rev. Immunol. 13, 412-426.
21. Tatsumi, T., Huang, J., Gooding, W. E., Gambotto, A., Robbins, P. D., Vujuanovic, N. L., Alber, S. M., Watkins, S. C., Okada, H. and Storkus, W. J. 2003. Intratumoral deliv- ery of dendritic cells engineered to secrete both interleukin (IL)-12 and IL-18 effectively treats local and distant disease in association with broadly reactive Tc1-type immunity.
Cancer Res. 63, 6378-6386.
22. van Herpen, C. M., Looman, M., Zonneveld, M., Scharen- borg, N., de Wilde, P. C., van de Locht, L., Merkx, M. A., Adema, G. J. and de Mulder, P. H. 2004. Intratumoral ad- ministration of recombinant human interleukin 12 in head and neck squamous cell carcinoma patients elicits a T-helper 1 profile in the locoregional lymph nodes. Clin. Cancer Res.
10, 2626-2635.
초록:LPS에 의해 자극된 B 림프구에 의한 Th1 림프구 분화 억제
김하정*
(경북대학교 의학전문대학원 생리학교실)
면역 시스템의 림프구는 B 림프구와 T 림프구 두 종류로 나눌 수 있다. B 림프구는 플라즈마 세포로 분화하여 항체를 생성하는 체액성 면역을 담당하며, T 림프구는 다른 세포나 세균을 죽이는 세포성 면역을 담당한다. 고전 적으로 B 림프구와 T 림프구의 작용은 한 방향으로 이뤄졌다. T 림프구는 B 림프구의 분화를 촉진하고 면역글로 불린종류의 전환을 조절한다. T 림프구가 부족한 경우 B 림프구의 부족을 초래함이 보고되어 있다. 그러나 최근에 역으로 B 림프구가 T 림프구의 분화와 활성을 조절할 수 있다는 보고가 있다. 예를 들어, B 림프구는 CD8+ T 림프구의 tolerance를 직접 조절할 수 있고, TGF-β의 분비를 통해 T 림프구의 anergy를 유도할 수 있다. 본 연구는 LPS에 의해 자극된 B 림프구가 수지상세포에서 IL-12의 분비를 억제하여 Th1 림프구의 분화를 억제할 수 있음을 보여준다. 이 억제는 B 림프구와 수지상세포의 직접적인 interaction에 의해 일어나는 것이 아니며 B 림프구가 수 지상세포의 성숙을 조절하여 일어나는 것도 아니다. B 림프구에서 분비되는 soluble factor가 LPS에 의해 증가되 는 수지상세포의 IL-12p35 transcription을 억제한다. 이 결과들은 B 림프구가 매개하는 새로운 면역억제 기전이 존재함을 보여준다. 이것은 고전적인 방향성을 가진 T 림프구에 의한 B 림프구 작용조절로 면역반응이 결정되는 것이 아니라 T 림프구와 B 림프구가 서로 작용을 하여 면역평형을 결정하는 기전이 존재함을 보여준다.