Korean J Clin Pharm, Vol. 29, No. 2, 2019
109
Original Article Korean College of Clinical Pharmacy
pISSN 1226-6051 eISSN 2508-786X https://doi.org/10.24304/kjcp.2019.29.2.109 Korean journal of clinical pharmacy (Online) URL: http://www.ekjcp.org
류마티스관절염 환자의 심혈관 질환 및 당뇨병 위험분석: a propensity score analysis
유기연
*
동덕여자대학교약학대학
(2019년 4월 27일접수 · 2019년 6월 6일수정 · 2019년 6월 8일승인)
The Risk of Cardiovascular Disease and Diabetes in Rheumatoid Arthritis Patients:
A Propensity Score Analysis
Kiyon Rhew*
College of Pharmacy, Dongduk Women’s University, Seoul 02751, Republic of Korea (Received April 27, 2019 · Revised June 6, 2019 · Accepted June 8, 2019)
류마티스관절염(rheumatoid arthritis, RA)은 관절 활막의 지 속적인 염증반응을 통해 관절손상이나 운동능력 장애를 나타 내는 염증성 전신질환으로,1) 일반적으로 약 1% 정도의 유병 율로 발병한다고 알려져있다.2,3)환자의 특성으로 분류하였을 때는 여성에서 보다 빈번하게 나타나며, 연령과 상관없이 발 병할 수 있으나 고령이 될 수록 성별에 따른 발병 빈도차이는 감소한다.4)또한 환자의 신체적 특징 외에도 사회경제적 여건 이 낮은 계층에서 더 많이 발병한다.5)
류마티스관절염 환자에서는 심혈관 질환(cardiovascular disease, CVD)의 위험도 증가한다고 보고되었으며,6)환자 특 성에 따른 비뚤림(bias)을 최소화 하고자 성별과 나이를 매칭
시킨 미국의 연구에서도 RA환자에서 CVD 위험이 약 1.5배에 서 2배 가량 증가한 것으로 나타났다.7)류마티스 관절염과 심 혈관 질환의 상관성의 기전이 명확하게 밝혀지진 않았지만, 최근 두 질환이 염증 매개 공유, 산화 스트레스 증가, 지단백 구 성 및 기능 변형 등에 의한 것이 연관이 있다는 연구 결과가 발 표되었다.8)
추가적으로 다양한 측면에서 류마티스 관절염과 심혈관 질 환의 상관성에 대한 연구가 진행되었다. 류마티스 관절염의 심각도와 심혈관계 질환과의 상관성을 제시하거나9) 류마티 스 관절염의 적절한 치료가 심혈관 질환의 위험을 감소시킬 수 있다는 연구도 발표되었다.10) Ljung et al.에서는 TNF-α ABSTRACT
Background: Rheumatoid arthritis (RA) is a systemic inflammatory disease that manifests as joint damage or athletic disability via sustained inflammation of the synovial membrane. The risk of cardiovascular disease (CVD) is higher in RA patients. This study aimed at evaluating the association between CVD comorbidities and RA by comparing a pharmacotherapy group with a non- pharmacotherapy group. Methods: Patient sample data from the Health Insurance Review and Assessment Service (HIRA-NPS- 2016) were used. Inverse probability of treatment weighting (IPTW) using the propensity score was used to minimize the differences in patient characteristics. Logistic regression analysis was used to evaluate the risk of CVD comorbidities. Results: The analyses included 1,207,213 patients, of which 33,122 (2.8%) had RA. The odds ratios (OR) of CVD comorbidities were increased in RA patients; ischemic heart disease (IHD: OR 1.75; 95% CI 1.73, 1.77), cerebral infarction (CERI: OR 1.28; 95% CI 1.26, 1.30), hypertension (HTN: OR 1.44; 95% CI 1.43, 1.45), diabetes mellitus (DM: OR 2.04; 95% CI 2.03, 2.06), and dyslipidemia (DL: OR 3.49; 95% CI 3.47, 3.51). The ORs of IHD, CERI, HTN, and DM in the traditional DMARD and biologic treatment groups were decreased, compared with those in the non-pharmacotherapy group. Conclusions: Thus, CVD risk was higher in RA patients, considering age, sex, and socioeconomic status. Appropriate pharmacotherapy could decrease the risk of CVD comorbidities in RA patients.
KEY WORDS: Rheumatoid arthritis, cardiovascular disease, DMARD, biologic agents
*Correspondence to: Kiyon Rhew, College of Pharmacy, Dongduk Women’s University, 60 Hwarang-ro 13-gil, Seongbuk-gu, Seoul 02751, Republic of Korea
Tel: 82-2-940-4519, Fax: 82-2-940-4159 E-mail: kiyon@dongduk.ac.kr
(tumor necrosis factor-α) 저해제에 류마티스 관절염의 치료가 잘 반응하는 군에서 그렇지 않은 군에 비해 CVD 위험이 감소 한다는 것을 보고하였다.11)개별 치료제에 대한 연구로는, RA 환자에서 hydroxychloroquine 치료가 총콜레스테롤(total cholesterol, TC), LDL-콜레스테롤(low-density lipoprotein cholesterol, LDL-C), HDL-콜레스테롤(high-density lipoprotein cholesterol, HDL-C), triglyceride (TG) 모두에 긍정적으로 나 타났고, 당뇨 유병율 역시 감소시켰다.12)또한 여러 가이드라 인에서 류마티스 관절염의 1차 선택 치료제로 제시하고 있는13-15) methotrexate 역시 CVD 위험을 감소시켰으며, 이는 HDL-C 의 항염증 기능을 향상 시켰을 것으로 추정하였다.16,17)
그러므로 유럽 류마티스 학회(European League Against Rheumatism, EULAR)의 치료지침에서는 모든 초기 진단된 류마티스관절염 환자에서 심혈관 질환의 위험성을 평가하고, 적어도 5년마다 또는 약물치료를 변경하였을 때마다 심혈관 질환의 위험성을 재평가 하도록 권고하고 있다.18)그러나 최 근 국내에서 시행된 류마티스관절염 환자에서 심혈관 질환의 인지도 및 인식 평가에서 약 20%의 류마티스관절염 환자에서 자신의 심혈관 질환의 위험을 과소평가하고 있으며, 특히 고 위험군의 96.6% 정도가 본인의 심혈관 질환의 위험요인을 과 소평가하는 것으로 나타났다.19)
그러므로, 국내 류마티스관절염 환자에서 심혈관 질환의 위 험도와 약물치료에 따른 심혈관 질환 유병율 차이가 있는지 확인할 필요가 있다. 본 연구에서는 국내 류마티스관절염 환 자의 CVD 위험을 비류마티스관절염 환자와 비교분석하고, 류마티스관절염환자군 내에서 약물치료군에 따른 CVD 유병 율을 비약물치료군의 CVD 유병율과 비교하고자 한다.
연구 방법 분석 자료
본 연구는 동덕여자대학교의 기관생명윤리위원회 승인을 받 아 진행하였고, 건강보험심사평가원 (이하 심평원)에서 2016년, 1년 동안 1회 이상 의료기관을 이용한 환자를 대상으로 구축 한 표본자료(HIRA-NPS-2016-0114)를 활용하였다.20) 대상 환자 및 대조군 정의
본 연구에서는 만 18세 이상의 성인환자만을 대상으로 분석 하였다. 류마티스관절염환자는 혈청검사양성 류마티스관절염 (M05), 기타 류마티스관절염(M06), 연소성 류마티스관절염 (M08.0), 척추의 류마티스관절염(M45)을 1년 중 1회이상 진단 받은 환자로 정의하였고, 위 상병코드를 진단받지 않은 모든
환자를 비류마티스관절염환자로 정의하였다.
류마티스 관절염 치료제 분류
류마티스 관절염의 치료제는 전형적인 DMARD (traditional disease-modifying antirheumatic drugs, tDMARD)제와 생물 학적 제제(biologic agents, BioA)의 이상반응의 양상이 다르 기 때문에, tDMARD제제와 생물학적 제제로 분류하였다.
tDMARD제에는 methotrexate, leflunomide, hydroxychloro- quine, sulfasalazine을 포함하였고, abatacept, adalimumab, anakinra, baricitinib, certolizumab, etanercept, golimumab, infliximab, rituximab, tocilizumab, tofacitinib를 류마티스관 절염 치료제로 쓰이는 생물학적 제제로 분류하였다.
심혈관 질환 유병율 평가
다음과 같이 결과변수에서 사용할 CVD를 분류하였으며, 이 는 아래의 상병코드를 1회 이상 진단받은 환자로 정의하였다;
1) 허혈성 심질환 (ischemic heart disease, IHD; I20, I21, I22, I25), 2) 뇌경색증 (cerebral infarction, CERI; I63), 3) 고혈압 (hypertension, HTN; I10, I11, I12, I13, I14, I15), 4) 이상지질 혈증 (dyslipidemia, DL; E78), 5) 당뇨병 (diabetes mellitus, DM; E10, E11, E12, E13, E14)
류마티스관절염을 진단받은 환자와 그렇지 않은 환자에서 위에서 정의한 5가지의 심혈관 질환 (IHD, CERI, HTN, DL, DM)의 유병율을 분석하였다. 류마티스관절염 환자군 내에서 는 tDMARD 또는 생물학제 제제로 치료받은 환자를 분류하 여 비약물치료군과 비교하여 심혈관 질환의 유병율을 분석하 였다. 이 때 tDMARD제제와 생물학적 제제를 1년 중 모두 투 약받은 환자는 제외하였으며, 각 약물군과 비약물치료군과의 심혈관 질환의 위험만을 평가하였다.
통계 분석
류마티스관절염 환자와 비류마티스관절염 환자의 기본 특성 의 차이에 대한 영향을 최소화하기 위해서 환자의 성별, 나이, 의료급여종(의료보험, 의료보호, 보훈)을 요인으로 propensity score를 활용한 inverse probability of treatment weighting (IPTW)을 적용하여 각 군의 환자의 특성을 비슷하게 조정하 였다. CVD 유병율은 로지스틱 회귀분석 결과로 평가하였고, 95% 신뢰구간(confidence interval, CI)을 함께 제시하여 통계 적 유의미성을 판단하였다(p < 0.05). 모든 자료 분석은 SAS 9.4 (SAS Institute Inc., Cary, North Carolina, USA)를 사용하 여 분석하였다.
연구결과 환자 특성
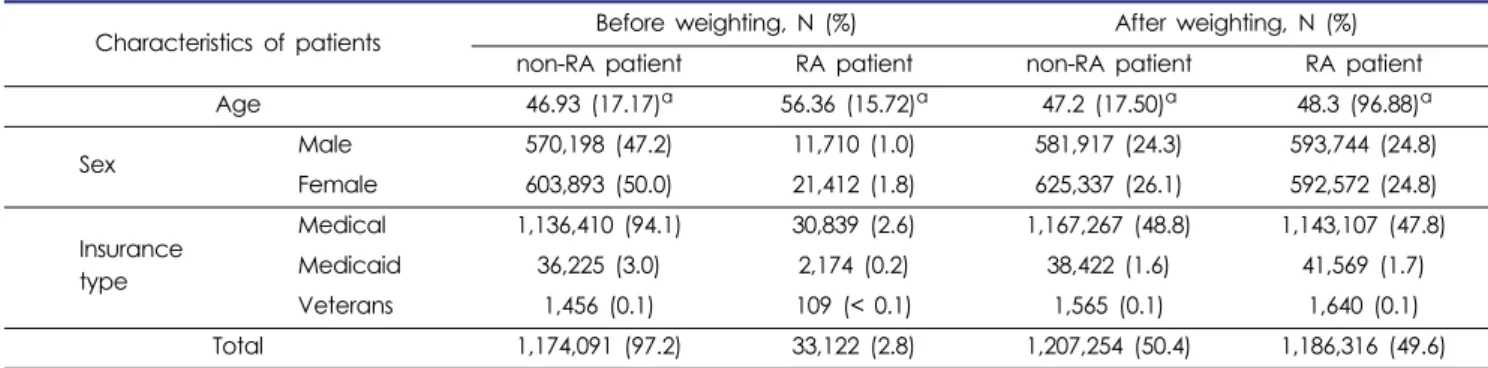
만 18세 이상 환자는 1,207,213명으로, 이 중 33,122명(2.8%) 의 환자가 류마티스관절염을 1회 이상 진단받았다. 류마티스 관절염 환자는 비류마티스관절염 환자보다 평균 나이가 약 10세 가량 높게 분석되었고, 류마티스관절염 환자 중에서는 남자가 11,710명(1.0%)으로 여자환자 21,412명(1.8%)보다 낮 게 분석되었다. 의료급여종에 따른 분류로 확인한 결과는, 상 대적으로 비류마티스관절염 환자와 비교하여 류마티스관절 염 환자에서 의료보험으로 가입된 환자보다 의료보호로 가입 된 환자나 보훈 환자가 높은 비율로 나타났다(Table 1).
두 군에서 환자군과 대조군을 1:1로 IPTW를 적용한 후 비교 하였을 때, 연령, 성별, 의료급여종 모두 유사하게 나타났다.
류마티스관절염 환자의 심혈관 질환 유병율 평가
류마티스관절염 환자와 비류마티스관절염 환자의 기본 특 성을 IPTW 적용한 후 심혈관 질환의 유병율을 분석한 결과, 평가하고자 했던 5가지 CVD 유병율이 높게 나타났다. 심혈관 질환 중 이상지질혈증의 유병율이 비류마티스질환자와 비교 하였을 때 약 3.49배 (95% CI 3.47, 3.51) 높게 분석되었다. 또 한 당뇨병의 OR값은 2.04 (95% CI 2.03, 2.06)으로 두번째로 높게 분석되었고, 허혈성 심질환(OR 1.75, 95%CI 1.73, 1.77), 고혈압(OR 1.44, 95%CI 1.43, 1.45), 뇌경색증(OR 1.28 95%CI 1.26, 1.30)순으로 유병율이 증가한 것으로 나타났다 (Table 2).
류마티스관절염 환자에서 약물치료여부에 따른 심혈관 질 환 유병율 평가
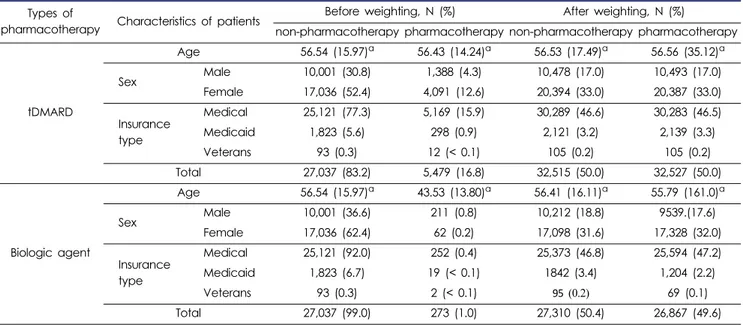
류마티스관절염으로 진단받은 33,122명의 환자에서 비약물 치료군은 27,037명 (83.2%)로 분석되었고, 333명(1.0%)은 1년 중 tDMARD제와 생물학적 치료제 모두를 투약하여 제외되었 다. tDMARD 제만을 사용한 환자는 5,479명으로 전체 류마티
스관절염 환자 중 약 16.8%에 해당하였다. 류마티스관절염 환 자에서 tDMARD제제와 비약물치료군의 환자 기본 특성을 분 석하였을 때, 여성과 의료 보험적용 대상군에서 tDMARD를 투약한 환자가 많은 것으로 나타났다(Table 3).
CVD 유병율을 평가한 결과, tDMARD로 치료한 류마티스 관절염 환자가 아무런 약물을 투여받지 않은 환자와 비교하여 허혈성 심질환(OR 0.80, 95% CI 0.76, 0.84), 뇌경색증(OR 0.70, 95% CI 0.65, 0.76), 당뇨병(OR 0.76, 95% CI 0.73, 0.78) 의 유병율이 통계적으로 유의미하게 낮게 나타났다. 고혈압은 tDMARD 치료군과 비약물치료군에서 차이가 없었으며, 이상 지질혈증은 비약물치료군과 비교하였을 때 더 높게 나타났다 (OR 1.64, 95% CI 1.58, 1.69)(Table 4).
류마티스관절염 환자 중에서 생물학적 제제만으로 투약받 은 환자는 273명으로 약 1%의 류마티스관절염 환자가 생물학 적 제제만으로 치료받았다. 류마티스관절염 환자에서 비약물 치료군과 생물학적제제를 투약받은 군을 비교 분석한 결과, 남성과 젊은 연령에서 더 많이 투약되었고, 보훈환자에서 가 장 적게 투약되었다(Table 3).
CVD 유병율 분석 결과는 생물학적 제제 투약군에서 허혈 성 심질환(OR 0.64, 95% CI 0.61, 0.68), 뇌경색(OR 0.79, 95% CI 0.73, 0.86), 당뇨병의 유병율(OR 0.93, 95% CI 0.90, 0.97)이 낮게 나타났다. 그러나 고혈압(OR 1.09; 95% CI 1.06, Table 1. Characteristics of subjects before and after inverse probability of treatment weighting (IPTW)
Characteristics of patients Before weighting, N (%) After weighting, N (%)
non-RA patient RA patient non-RA patient RA patient
Age 46.93 (17.17)a 56.36 (15.72)a 47.2 (17.50)a 48.3 (96.88)a
Sex Male 570,198 (47.2) 11,710 (1.0) 581,917 (24.3) 593,744 (24.8)
Female 603,893 (50.0) 21,412 (1.8) 625,337 (26.1) 592,572 (24.8)
Insurance type
Medical 1,136,410 (94.1) 30,839 (2.6) 1,167,267 (48.8) 1,143,107 (47.8)
Medicaid 36,225 (3.0) 2,174 (0.2) 38,422 (1.6) 41,569 (1.7)
Veterans 1,456 (0.1) 109 (< 0.1) 1,565 (0.1) 1,640 (0.1)
Total 1,174,091 (97.2) 33,122 (2.8) 1,207,254 (50.4) 1,186,316 (49.6)
a mean (standard deviation) RA: rheumatoid arthritis
Table 2. Risk of cardiovascular comorbidity in rheumatoid arthri- tis patients
CV comorbidities OR (95% CI)
IHD 1.75 (1.73, 1.77)
CERI 1.28 (1.26, 1.30)
HTN 1.44 (1.43, 1.45)
DL 3.49 (3.47, 3.51)
DM 2.04 (2.03, 2.06)
CV: cardiovascular, IHD: ischemic heart disease, CERI: cerebral infarction, HTN: hypertension, DL: dyslipidemia, DM: diabetes mellitus
1.13)과 이상지질혈증(OR 1.42; 95% CI 1.37, 1.47)의 OR값은 높게 나타났다(Table 4).
고찰 및 결론
세계적으로 약 1% 내외로 유병율이 나타나는 것과 비교하 였을 때, 국내의 성인 환자에서 류마티스관절염으로 진단받은 환자는 약 2.8%로 다소 높게 분석되었다. 그러나 본 연구 대상 자는 1년 중 1회이상 의료기관을 이용하는 환자를 대상으로
추출한 자료로 분석하였으며, 소아환자는 본 분석에서 제외하 였기 때문에 일반적 유병율보다 높게 나타났을 것으로 생각된 다. 또한 여성환자와 사회경제적 지표로 반영한 의료급여종에 서 의료보험대상 환자에 비해 의료급여환자에서 류마티스관 절염의 유병율이 높다는 것을 확인하였다. 이는 기존의 연구 결과와 동일한 결과로 국내 류마티스관절염 환자의 역학도 세 계적인 분석결과와 크게 다르지 않음을 알 수 있다.4,5)
본 연구결과로 분석된 류마티스관절염 환자에서 CVD 유병 율은 기존 연구에서 제시한 1.5~2배 정도의 위험도 상승한 것 과 비슷하게 나타났다. 다만 이상지질혈증 OR값이 3.485로 비 교적 높게 분석되었다. 또한 류마티스관절염 환자에서 약물치 료군에서의 CVD 유병율은 일반적으로 감소하거나 영향이 없었던 점에 비교하여 이상지질혈증에 대한 긍정적인 효과가 나타나진 않았다. 류마티스관절염 환자의 만성 염증상태는 TC, HDL-C, LDL-C를 모두 감소시키기 때문에,21) RA환자에 서 항염증 치료가 오히려 TC, HDL-C, LDL-C를 증가시기키 도 한다.22)그러나 이러한 지질의 상승이 CVD 위험을 상승시 키는 것과는 무관하거나, tDMARD제 또는 생물학적 제제의 약물치료군에서 지질 수치가 상승하였더라도 CVD 위험도를 감소시킨다고 보고되었다.23-25) 본 연구결과는 흥미롭게도 이 러한 기존의 여러 연구를 종합한 결과와 유사하게 나타났다.
류마티스관절염 환자에서 류마티스관절염이 없는 환자보다 모든 CVD 유병율은 증가하였으나, RA환자 내에서서 약물치 료군이 비약물치료군과 비교하여 이상지질혈증의 유병율은 높게 나타났고, 허혈성 심질환, 뇌경색증, 당뇨병 유병율은 낮 게 나타났다. 이는 류마티스관절염 환자군의 적절한 약물치료 Table 3. Characteristics of RA patients by pharmacotherapy group before and after inverse probability of treatment weighting (IPTW)
Types of
pharmacotherapy Characteristics of patients Before weighting, N (%) After weighting, N (%)
non-pharmacotherapy pharmacotherapy non-pharmacotherapy pharmacotherapy
tDMARD
Age 56.54 (15.97)a 56.43 (14.24)a 56.53 (17.49)a 56.56 (35.12)a
Sex Male 10,001 (30.8) 1,388 (4.3) 10,478 (17.0) 10,493 (17.0)
Female 17,036 (52.4) 4,091 (12.6) 20,394 (33.0) 20,387 (33.0)
Insurance type
Medical 25,121 (77.3) 5,169 (15.9) 30,289 (46.6) 30,283 (46.5)
Medicaid 1,823 (5.6) 298 (0.9) 2,121 (3.2) 2,139 (3.3)
Veterans 93 (0.3) 12 (< 0.1) 105 (0.2) 105 (0.2)
Total 27,037 (83.2) 5,479 (16.8) 32,515 (50.0) 32,527 (50.0)
Biologic agent
Age 56.54 (15.97)a 43.53 (13.80)a 56.41 (16.11)a 55.79 (161.0)a
Sex Male 10,001 (36.6) 211 (0.8) 10,212 (18.8) 9539.(17.6)
Female 17,036 (62.4) 62 (0.2) 17,098 (31.6) 17,328 (32.0)
Insurance type
Medical 25,121 (92.0) 252 (0.4) 25,373 (46.8) 25,594 (47.2)
Medicaid 1,823 (6.7) 19 (< 0.1) 1842 (3.4) 1,204 (2.2)
Veterans 93 (0.3) 2 (< 0.1) 95 (0.2) 69 (0.1)
Total 27,037 (99.0) 273 (1.0) 27,310 (50.4) 26,867 (49.6)
a mean (standard deviation)
RA: rheumatoid arthritis, tDMARD: traditional disease-modifying antirheumatic drugs
Table 4. Risk of cardiovascular comorbidity by pharmacother- apy group (vs non-pharmacotherapy group) in RA patients
Types of
pharmacotherapy CV comorbidities OR (95% CI)
tDMARD
IHD 0.80 (0.76, 0.84) CERI 0.70 (0.65, 0.76) HTN 0.99 (0.96, 1.02) DL 1.64 (1.58, 1.69) DM 0.76 (0.73, 0.78)
Biologic agent
IHD 0.64 (0.61, 0.68) CERI 0.79 (0.73, 0.86) HTN 1.09 (1.06, 1.13) DL 1.42 (1.37, 1.47) DM 0.93 (0.90, 0.97) RA: rheumatoid arthritis, CV: cardiovascular, tDMARD: traditional dis- ease-modifying antirheumatic drugs, IHD: ischemic heart disease, CERI: cerebral infarction, HTN: hypertension, DL: dyslipidemia, DM:
diabetes mellitus
가 비록 콜레스테롤 수치에서는 긍정적인 효과로 이어지지 않 더라도 CVD에서는 긍정적으로 분석되었다고 할 수 있다.
개별 약물 연구에서도, methotrexate가 고호모시스테인증을 야기하거나 혈관 내피세포를 손상시키기도 하지만,26,27) methotrexate 로의 치료가 오히려 CVD 위험도, 심부전으로 인한 입원율 등 을 감소시켰다는 것이 입증되었다.23) 본 연구결과에서도 tDMARD제제를 사용한 군에서 비약물치료군과 비교한 결과, 허혈성 심질환, 뇌경색증, 당뇨병의 유병율이 낮게 나타났다.
이는 류마티스관절염의 치료가 적절하게 이루어졌을 때 CVD 위험도가 낮아진다고 보고한 이전 연구들과 비슷한 결과라고 할 수 있다. 또한 TNF-α 저해제를 투여한 군에서 비약물치료 군에 비해 모든 CV event 발생율, 심근경색, 뇌졸중 모두 감소 하였던 기존의 연구 결과와도 비슷하게,28) 생물학적 제제로 치료한 군 역시 허혈성 심질환, 뇌경색, 당뇨병의 유병율이 감 소한 것을 볼 수 있다.
일반적으로 국내외 허가사항에서 생물학적 제제의 CVD 이 상반응의 빈도는 tDMARD제제와 비교하였을 때 높게 제시되 었다; 고혈압(abatacept, etanercept, golimumab, infliximab, rituximab, tocilizumab, tofacitinib), 허혈성 심질환(abatacept, etanercept, rituximab), 뇌경색증(etanercept), 혈중 콜레스테 롤 상승(abatacept, anakinra, baricitinib, tocilizumab, tofacitinib), 고혈당(rituximab). 본 연구 결과에서 약물치료군 과 비약물치료군의 RA환자에서 허혈성 심질환, 뇌경색증, 당 뇨병의유병율 값은 생물학적 제제보다 tDMARD제제에서 더 낮게 분석되었다. 또한 고혈압 유병율은 비약물치료군과 비교 하였을 때 생물학적 제제치료군에서 높게 나타났다. 이는 생 물학적 제제 자체의 CVD 이상반응이 나타났기 때문일 수 있 다. 또는 대부분의 가이드라인에서 tDMARD제제로 반응이 충분히 나타나지 않은 경우에서 생물학적 제제를 투약하도록 권고하기 때문에 tDMARD 치료군보다 생물학적 제제 치료 군이 보다 RA 중증도가 심각하거나 tDMARD에서 반응하지 않은 것으로 추정할 수 있고, 이러한 요인이 CVD 예방을 감소 시킨다는 기존의 연구 결과로 해석할 수도 있다.9,11)
류마티스관절염 환자에서의 CVD 위험도 증가는 사망률의 증가도 가져온다.29,30) 그러므로 적절한 류마티스관절염의 치 료로 CVD 위험을 감소시키거나, CVD 위험도를 적절하게 평 가하여 CVD를 예방하는 것이 중요하다. 그러나 국외 연구에 서도 류마티스관절염 환자에서 당뇨병검사 시행 여부를 분석 한 결과 여전히 가이드라인에서 제시하는 것과 비교하였을 때 여전히 부족하다고 보고하였다.31)특히 국내 류마티스관절염 환자에서 CVD 위험도를 과소평가하고 있다는 연구 결과를 비추어 볼 때,19) RA환자에게 CVD 위험을 교육하고 적절한 운동이나 금연 등의 생활습관 개선을 조언할 수 있다.
본 연구는 류마티스관절염 환자에서 CVD 발생(incidence) 에 대한 위험도를 평가하기 보다는 동반질환으로서 CVD 유
병율을 평가한 것이다. 또한 류마티스관절염 상병코드를 가진 모든 환자를 대상으로 분석하였기 때문에, 현재 류마티스관절 염이 활성화 된 상태인지는 확인할 수는 없었고, 류마티스관 절염의 심각도 등을 분류하여 결과를 제시하지 못했다. 또한, 약물마다 투약빈도 차이가 크고, 약물 변경 등을 모두 고려하 였을 때 적절한 통계 분석이 어려워져 약물치료군을 tDMARD 제제와 생물학적 제제, 두 군으로만 범주화하여 분석하였기 때문에 개별 약물의 CVD 유병율 감소 효과를 확인하는데는 어려움이 있다. 마지막으로 환자의 동반질환이나 약물 사용 등 CVD의 위험인자를 고려하지 않은 부분이 제한점이라고 할 수 있다.
그럼에도 불구하고 본 연구는 심평원에서 성별과 연령을 변 수로 층화추출하여 구축한 빅데이터를 활용하여 분석하였으 며, 특히 환자의 연령이나 성별, 의료급여종과 같은 사회경제 적 요건의 영향을 최소화하기 위한 inverse propensity score weighting (IPTW)을 활용하여 두 집단을 비슷한 인구학적 특 성을 갖도록 한 후 분석하였다. IPTW을 적용하여 분석하는 방 법은 관찰연구에서 두 집단의 원인요인 이외의 다른 요인 (confounder)에 의한 결과변수의 영향을 최소화기 위해 적용 되는 방법이다.32,33) 이는 낮은 유병율의 질환을 대상으로 시 행된 빅데이터 분석의 비뚤림(bias)을 최소화한 결과라는 점에 서 의미가 있다. 또한 류마티스관절염의 약물치료군 자체에서 CVD 관련 이상반응이 보고되었음에도 불구하고 비약물치료 군 대비 CVD 유병여부와의 연관성이 유의미하게 감소하였다.
결론적으로 류마티스관절염 환자에서 연령, 성별, 의료급여 종과 상관없이, 허혈성 심질환, 고혈압, 뇌경색증, 이상지질혈 증, 당뇨병의 유병율이 높게 나타났으며, 류마티스관절염의 tDMARD제제나 생물학적 제제의 약물치료가 비약물치료군 과 비교하였을 때 CVD의 유병율을 감소시켰다.
감사의 말씀
이 논문은 2017년도 동덕여자대학교 연구비 지원에 의하여 수행된 것으로 이에 감사드립니다
참고문헌
1. Scott DL, Wolfe F, Huizinga TW. Rheumatoid arthritis. Lancet 2010;376:1094-108.
2. Silman AJ and Pearson JE. Epidemiology and genetics of rheumatoid arthritis. Arthritis Res 2002;4(suppl):S265-72.
3. Hunter TM, Boytsov NN, Zhang X, et al. Prevalence of rheumatoid arthritis in the United States adult population in healthcare claims databases, 2004-2014. Rheumatol Int 2017;37(9):1551-7.
4. Minichiello E, Semerano L, Boissier MC. Time trends in the incidence, prevalence, and severity of rheumatoid arthritis: A systematic literature review. Joint Bone Spine 2016;83(6):625-30.
5. Naqvi AA, Hassali MA, Aftab MT. Epidemiology of rheumatoid
arthritis, clinical aspects and socio-economic determinants in Pakistani patients: A systematic review and meta-analysis. J Pak Med Assoc 2019;69:389-98.
6. Sandoo A, Chanchlani N, Hodson J, et al. Classical cardiovascular disease risk factors associate with vascular function and morphology in rheumatoid arthritis: a six-year prospective study. Arthritis Res Ther 2013;15:R203. doi:10.1186/ar4396 pmid:24289091
7. Liao KP. Cardiovascular disease in patients with rheumatoid arthritis. Trends Cardiovasc Med 2017;27:136-40.
8. England BR, Thiele GM, Anderson DR, et al. Increased cardiovascular risk in rheumatoid arthritis: mechanisms and implications. BMJ 2018 Apr 23;361:k1036. doi: 10.1136/bmj.k1036 9. Arts EE, Fransen J, Den Broeder AA, et al. Low disease activity (DAS28≤3.2) reduces the risk of first cardiovascular event in rheumatoid arthritis: a time-dependent Cox regression analysis in a large cohort study. Ann Rheum Dis 2017;76:1693-9. doi: 10.1136/
annrheumdis-2016-210997.
10. Solomon DH, Reed GW, Kremer JM, et al. Disease activity in rheumatoid arthritis and the risk of cardiovascular events. Arthritis Rheumatol 2015;67:1449-55.
11. Ljung L, Rantapää-Dahlqvist S, Jacobsson LT, et al. Response to biological treatment and subsequent risk of coronary events in rheumatoid arthritis. Ann Rheum Dis 2016;75:2087-94.
12. Rempenault C, Combe B, Barnetche T, et al. Metabolic and cardiovascular benefits of hydroxychloroquine in patients with rheumatoid arthritis: a systematic review and meta-analysis. Ann Rheum Dis 2018;77(1):98-103.
13. Saag KG, Teng GG, Patkar NM, et al. American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis. Arthritis Rheum 2008;59:762-84.
14. Singh JA, Saag KG, Bridges SL, et al. 2015 American College of Rheumatology Guideline for the treatment of rheumatoid arthritis.
Arthritis Care Res (Hoboken) 2016;68(1):1-25.
15. Singh JA, Furst DE, Bharat A, et al. 2012 Update of the 2008 American College of Rheumatology recommendations for the use of disease-modifying antirheumatic drugs and biologic agents in the treatment of rheumatoid arthritis. Arthritis Care Res 2012;64:625- 39.
16. Micha R, Imamura F, Wyler von Ballmoos M, et al. Systematic review and meta-analysis of methotrexate use and risk of cardiovascular disease. Am J Cardiol 2011;108(9):1362-70.
17. O'Neill F, Charakida M, Topham E, et al. Anti-inflammatory treatment improves high-density lipoprotein function in rheumatoid arthritis. Heart 2017;103:766-73.
18. Agca R, Heslinga SC, Rollefstad S, et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders:
2015/2016 update. Ann Rheum Dis 2017;76:17-28.
19. Boo S, Oh H, Froelicher ES, et al. Knowledge and perception of cardiovascular disease risk among patients with rheumatoid arthritis.
PLoS One 2017;12:e0176291
20. Kim L, Kim JA, Kim S. A guide for the utilization of Health Insurance Review and Assessment Service National Patient Samples. Epidemiol Health 2014;36:e2014008.
21. Robertson J, Peters MJ, McInnes IB, et al. Changes in lipid levels with inflammation and therapy in RA: a maturing paradigm. Nat Rev Rheumatol 2013;9:513-23.
22. van Sijl AM, Peters MJ, Knol DL, et al. The effect of TNF-alpha blocking therapy on lipid levels in rheumatoid arthritis: a meta- analysis. Semin Arthritis Rheum 2011;41:393-400.
23. Choi HK, Hernán MA, Seeger JD, et al . Methotrexate and mortality in patients with rheumatoid arthritis: a prospective study. Lancet 2002;359:1173-7.
24. Greenberg JD, Kremer JM, Curtis JR, et al. Tumour necrosis factor antagonist use and associated risk reduction of cardiovascular events among patients with rheumatoid arthritis. Ann Rheum Dis 2011;70:576-82.
25. Barnabe C, Martin BJ, Ghali WA. Systematic review and meta- analysis: anti-tumor necrosis factor α therapy and cardiovascular events in rheumatoid arthritis. Arthritis Care Res (Hoboken) 2011;63:522-9.
26. Dierkes J and Westphal S. Effect of drugs on homocysteine concentrations. Semin Vasc Med 2005;5:124-39.
27. Merkle CJ, Moore IM, Penton BS, et al. Methotrexate causes apoptosis in postmitotic endothelial cells. Biol Res Nurs 2000;2:5- 14.
28. Lim DT, Cannella AC, Michaud KD, et al. Cardiovascular risk and the use of biologic agents in rheumatoid arthritis. Curr Rheumatol Rep 2014;16:459.
29. Aviña-Zubieta JA, Choi HK, Sadatsafavi M, et al. Risk of cardiovascular mortality in patients with rheumatoid arthritis: a meta-analysis of observational studies. Arthritis Rheum 2008;
59:1690-7.
30. Nicola PJ, Crowson CS, Maradit-Kremers H, et al. Contribution of congestive heart failure and ischemic heart disease to excess mortality in rheumatoid arthritis. Arthritis Rheum 2006;54:60-7.
31. Schmidt TJ, Aviña-Zubieta JA, Sayre EC, et al. Cardiovascular Disease Prevention in Rheumatoid Arthritis: Compliance with Diabetes Screening Guidelines. J Rheumatol 2018;45:1367-74.
32. Austin PC and Stuart EA. Moving towards best practice when using inverse probability of treatment weighting (IPTW) using the propensity score to estimate causal treatment effects in observational studies. Stat Med 2015;34(28):3661-79.
33. Glynn RJ, Schneeweiss S, Stürmer T. Indications for propensity scores and review of their use in pharmacoepidemiology. Basic Clin Pharmacol Toxicol 2006;98(3):253-9.