접수: 2012년 7월 23일, 승인: 2012년 11월 7일 연락처: 박병주, 110-799, 서울시 종로구 대학로 103
서울대학교 의과대학 예방의학교실 Tel: (02) 740-8325, Fax: (02) 747-4830 E-mail: bjpark@snu.ac.kr
Correspondence to: Byung-Joo Park, MD, MPH, PhD Department of Preventive Medicine, Seoul National University College of Medicine, 103 Daehak-no, Chongro-gu, Seoul 110- 799, Korea
Tel: +82-2-740-8325, Fax: +82-2-747-4830 E-mail: bjpark@snu.ac.kr
중국의 약물안전관리체계
서울대학교 의과대학 예방의학교실1, 서울대학교병원 의학연구협력센터2, 한국의약품안전관리원3
김설매1ㆍ이중엽2ㆍ최남경2ㆍ박병주1,2,3
An Overview of the Drug Safety Surveillance System in China
Xue-Mei Jin, MD, MSc
1, Joongyub Lee, MD
2, Nam-Kyong Choi, PhD
2and Byung-Joo Park, MD, MPH, PhD
1,2,31
Department of Preventive Medicine, Seoul National University College of Medicine,
2Medical Research Collaborating Center, Seoul National University Hospital,
3Korea Institute of Drug Safety and Risk Management, Seoul, Korea
China’s National Center for Adverse Drug Reaction (ADR) Monitoring was established both for western and Traditional Chinese Medicine (TCM) in 1988. In 1998, nearly a decade later, China joined the World Health Organization’s (WHO) Program for International Drug Monitoring. During 2011, China formally promulgated the upgrade version of the “Adverse Drug Reaction Reporting and Monitoring Provision”. This publication clarified the local and provincial level of ADR monitoring bodies, thus, four-level monitoring system has been established.
The ADR reporting in China is growing at a rapid rate. Total 852,799 ADRs reported to National ADR monitor- ing center in 2011, much higher than 692,904 in 2010. By the end of 2011, 46 issues of ADR information bul- letin had been published listing 85 ADR Alerts. There also have several big safety issues like Longdan Xiegan (Guanmutong) had withdrawn, Yu Xing Cao injection and clindamycin suspended for the major causes of the se- rious ADRs. These procedures for decision making did not take long time. The Twelfth Five-Year Plan for drug safety that the first national special plan of drug safety also had been announced in 2012. While postmarketing surveillance guidelines are not yet available in China, the system shows considerable progress and promising fu- ture, especially in ADR reporting procedure awareness continues to grow among China’s Healthcare professionals and public. (JPERM 2012;5:103-112)
Key Words: China; Adverse drug reaction; Drug safety; Surveillance; Adverse drug reaction monitoring
빠른 경제성장과 더불어 세계의약품시장에서의 중국의 성 장도 놀라울 정도이다. 2009년 세계제약원료중국전에서의 발표자료에 의하면 중국에는 6,700여개의 제약회사가 있고 그 중 GMP (Good Manufacturing Practice) 인증 제약회사만 4,000여개나 되며 국가식품의약품감독관리국(State Food and Drug Administration, SFDA)에 등록된 원료생산기업만 1,000
여개가 넘으며 2008년 수출금도 175.8억달러에 달해 세계에
서 가장 큰 원료생산 및 수출국가로 성장하였다.
1)최근 중
국의 의약공업총생산액 및 의약품무역도 크게 성장하였는
데 의약공업총생산액은 1998년 1,371억위안(215억달러)에서
2007년 6,679억위안(1,048억달러)으로 증가하였고, 의약품무
역수출금액도 1998년 34억위안(5억달러)에서 2007년 246억
위안(38억달러)으로 증가하였다.
2)또한 한방치료는 유구한 중국의 역사와 함께 중화민족문화의 중요한 구성부분이기 도 하며 중국의학의 특징이다. 이러한 특징 때문에 화학의 약품의 증가에 따라 한약재시장도 빠른 속도로 성장하고 있 는데 중국에서 시판 허가된 한약제제는 무려 9,000여종이며 2007년 생산총액도 1,772억위안(278억달러)에 달하여 의약 공업생산총액의 26.5%에 달하였다.
2)중국에서의 신약개발 은 대부분 제네릭의약품 위주이고 지금까지 개발된 1부류 신약(국내외에서 시판되지 않은 의약품)은 20개 정도이다.
3)의약품 생산의 증가는 의약품 처방 및 사용의 증가도 이 어지게 되는데 시판 전 임상시험에서 약물의 효능과 안전성 에 대하여 입증을 받았다 할지라도 시판 후 실제 임상에서 사용할 때는 예기치 못했던 약물유해반응들이 발생할 수 있 다. 2004년 영국에서 시행된 18,820명의 입원환자들을 대상 으로 한 전향적 연구에 따르면 약물유해반응과 관련이 있는 환자는 6.5%이고 그 중 직접 약물유해반응으로 인하여 입 원한 환자는 무려 80%에 달했으며 병원 총 침상수의 4%를 차지하였다. 여기에 대한 영국보건의료체계(National Health System, NHS)의 예산은 매년 8.47억달러에 달하며 총 사망 률은 0.15%에 달하였다.
4)1998-2005년까지 미국FDA에 보고 된 중대한 유해사례 및 의료과오에 대한 분석에 따르면 중 대한 유해사례는 34,966건에서 98,842건으로 증가하였고 그 중 사망사례는 5,519건에서 15,107건에 달하였으며 중대한 유해사례의 증가속도는 전체 외래환자의 총 처방증가속도 의 4배에 상응하였다.
5)이와 같이 처방의 증가에 따라 유해 사례 발생도 빠른 속도로 증가하게 되며 중대한 약물유해반 응으로 인한 건강악화 및 사망에까지 이르게 되면 거대한 경제적 손실을 동반하게 된다.
중국정부도 최근 약물안전사용에 대한 관심이 커지고 있 다. 2011년 “중화인민공화국 국민경제와 사회발전 제12차 5 개년(2011-2015년)계획” (The Twelfth Five-Year Plan for National Economic and Social Development of the People's Republic of China)에서는 의약품안전에 대한 내용을 명확하 게 제시하고 있는데, 제41장 ‘공공안전체계건설’부분에서 가장 우선적인 임무로는 ‘식품의약품안전의 보장’이라고 의 약품안전의 중요성을 제시했다.
6)또한 2011년 12월 7일 국 무원 제184차 상무회의에서 “국가약품안전 제12차 5개년계 획” (The Twelfth Five-Year Plan for Drug Safety)이 심사 통 과되었는데 이것은 국무원에서 공표한 국가의약품안전영역 에서의 첫 번째 전문적이고 독립적인 계획이며 중국에서의 의약품안전영역에 대한 국가의 관심과 의약품안전영역에서 의 안전수준을 제고하기 위한 국가차원에서의 노력이라고 도 볼 수 있다.
7)본 논문에서는 최근 약물유해반응의 보고 와 모니터링 및 약물안전관련제도 등에서 빠른 속도로 발전 하고 있는 중국 약물안전관리체계의 현황에 대하여 전반적
으로 소개하고자 한다.
약물안전관리체계에 대한 법적 근거 및 관련 규정
중국에서의 약물감시는 1960년대에 시작된 북미 및 유럽 국가들에 비해 많이 늦은 1988년 1월 위생국(Ministry of Health, MOH)에서 약품불량반응감찰보고제도를 수립하면서 시작되었고, 세계보건기구 국제모니터링프로그램에 참여하 기 위해 베이징, 상하이, 후베이 등 14개 지역 의료기관에서 먼저 시범사업을 시행하였다. 1년 동안 시범사업을 통하여 큰 진척을 보였으며, 1989년 11월 최초의 국가불량반응감측 기관인 위생부약품불량반응감찰센터(卫生部药品不良应监察 中心)가 설립되었다. 1998년 국가식품약품감독관리국(State Food and Drug Administration, SFDA)이 설립되면서 행정관 리에서 감독관리로 역할이 변화하였으며, 1998년 3월부터 세계보건기구 국제모니터링프로그램(World Health Organiza- tion’s Collaboration Center for International Drug Monitoring) 즉 웁살라모니터링센터(Uppsala Monitoring Center)에 참여하 고 있다.
8,9)1999년 1월 6일 국가약품관리국에서는 의약품안 전의 모니터링과 관리의 수요 및 국제적인 관례에 따라 국 가약품감독관리국약품평가센터(Center for Drug Reevaluation, CDR)를 설립하기로 결정하였다.
10)1999년 11월 25일 “약품불량반응감측관리방법(시행)” (Ad- verse Drug Reaction Reporting and Monitoring Provision, trial implementation)이라는 규범화된 문건이 제정되었고, 2004년 3월 MOH에서 “약품불량반응보고와감측관리방법” (Adverse Drug Reaction Reporting and Monitoring Provision)이 정식으 로 시행되었으며, 2011년 7월 1일부터는 수정된 “약품불량 반응보고제도와감측관리방법”이 시행되면서 기존의 방법은 폐지되었다. 관리방법에서는 의약품부작용의 보고에서부터 모니터링 및 평가 전반에 대한 자세한 설명을 포함하고 있 으며 각급 모니터링센터의 직능 및 책임에 대해서도 명확하 게 제시하고 있다.
11)2007년 12월 SFDA에서 제정한 “의약품리콜관리방법”(Pro-
vision for Drug Recall)에서는 생산기업들에게 문제의약품
즉 안전성문제가 존재하는 이미 시판되고 있는 의약품들에
대하여 관련 규정 및 절차에 따라 리콜 조치를 취할 것을
요구하고 있으며 규정을 어길 시 벌금 및 의약품허가를 취
소한다고 규정하고 있다. 이는 중국의약품모니터링체계가
성숙된 단계로 한걸음 진입했음을 의미하기도 한다.
12)2011년 3월 1일부터 시행하게 된 “의약품생산질량관리규
범” (Good manufacturing practice for drugs 2010 revision)에서
도 한국 제약회사의 의무와 유사하게 “제269조 약물유해반
응보고와 모니터링제도를 구축해야 하고 전문기구 및 전문
인원을 배치하여 관리하여야 한다”, “제270조 주동적으로
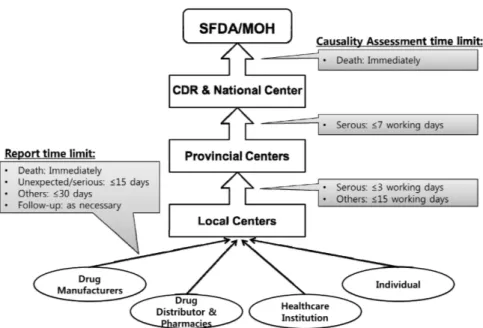
Figure 1. The current flow-chart
for adverse drug reaction reporting in China.15,16) CDR: Center for Drug Reevaluation, SFDA: State Food and Drug Administration;MOH: Ministry of Health.
약물유해반응을 수집하고 자세하게 기록, 평가, 조사와 처 리, 발생 가능한 위해에 대한 신속한 공제 및 규정에 따라 의약품감독관리부문에 보고해야 한다” 등 제약회사들의 의 무를 규범화하여 명시하고 있다.
13)약물안전체계 관련 용어의 정의
중국의 부작용보고시스템에서는 ‘약물유해반응’ (Adverse Drug Reaction, ADR) 및 ‘약물유해사례’ (Adverse Drug Event, ADE)에 대한 보고를 받고 있으며 이 두 가지 용어에 대해서는 국제조화회의(International Conference on Harmoni- zation, ICH) 가이드라인을 따르고 있으며 ‘중대한 유해사례’
(Serious Adverse Event, SAE), ‘새로운 약물유해반응’ (New adverse drug reaction), ‘집단약물유해사례’ (Group adverse drug events) 및 ‘특정의약품집중모니터링’ (Special drug monitoring) 등에 대해서는 “약품불량반응보고와 감측관리방 법”에서 명확하게 정의하고 있다.
11,14)약물감시에 관련된 용 어의 정의는 아래와 같이 정리할 수 있다.
1. ‘약물유해반응’은 허가의약품이 정상적인 사용 하에 발 생한 의약품의 사용목적 이외의 유해반응을 말한다.
2. ‘약물유해사례’는 의약품으로 치료하는 과정 중에 나타 난 유해한 임상사건을 말하며 해당 의약품의 사용과는 반드시 인과관계가 있어야 하는 것은 아니다.
3. ‘중대한 유해사례’는 아래와 같은 6가지 중 한 가지 이 상 해당되는 경우를 말한다.
① 사망 ② 생명위협
③ 암, 기형이나 선천성기형을 일으킴
④ 심각하거나 영구적인 인체손상 또는 기관의 기능손상 ⑤ 입원 또는 입원기간 연장
⑥ 기타 의학적으로 중요한 사건, 예를 들어 치료하지 않으면 위의 다섯 가지 경우가 발생할 가능성이 있 는 경우
4. ‘새로운 약물유해반응’은 의약품사용설명서에 기입되 지 않은 약물유해반응을 말하며 의약품사용설명서에 해당 유해반응에 대한 설명이 있더라도 그 유해반응의 성질, 심각도, 결과 및 발생빈도 등이 일치하지 않거나 더 심각한 경우를 말한다.
5. ‘집단약물유해사례’란 동일한 제약회사에서 생산한 동 일한 의약품, 동일 제형, 동일 규격의 제품을 사용하는 과정 중 상대적으로 집중된 시간, 지역 내에서 일정한 규모의 집단인구들의 건강 또는 생명에 손상 또는 위 협을 일으켜 긴급하게 처리하여야 하는 사건을 말한다.
6. ‘특정의약품집중모니터링’이란 특정 의약품의 임상사 용 및 유해반응의 발생상황에 대하여 조사하고, 유해 반응의 발생특징, 심각도, 발생빈도 등에 대하여 더 자 세히 연구하기 위하여 의약품안전성모니터링을 실시 하는 것을 말한다.
약물유해반응모니터링체계
1. 4단계 모니터링체계
2011년 7월 1일부터 새로이 수정된 “약품불량반응보고제
도와감측관리방법”에서는 추가로 시, 현급 약품모니터링센
터를 지정하면서 국가-성-시-현 단위의 4단계 행정관리체계
가 형성되었으며 1개의 국가모니터링센터, 34개의 성급 모
니터링센터 및 333개의 시ㆍ현급 모니터링센터로 구성되어 있다. 부작용의 보고 및 평가는 4단계 행정체계에 따라 하 급에서 상급으로 단계별로 보고 및 평가하고 있는데 부작용 보고 및 평가의 기한이 기존의 ‘관리방법’에 비해 한층 더 엄격해졌고 각 행정기관의 의무와 책임에 대해서도 명확하 게 제시하였다(그림 1).
10)구체적인 내용은 아래와 같다.
1) 단일의약품부작용보고
신약모니터링기간에 있는 국산 의약품은 모든 부작용을 보고해야 되고 그 외 기타 의약품들은 새로이 발견되거나 심각한 부작용만 보고한다. 수입의약품은 수입일로부터 5년 이내에 모든 부작용을 보고하고 만 5년이 지난 수입의약품 은 새로이 발견되거나 심각한 부작용만 보고한다. 제약회사 나 판매기업 및 의료기관에서 의약품부작용을 발견 혹은 보 고받았을 경우, 사망사례는 즉시보고, 새로운/심각한 부작용 은 15일내로, 기타 부작용은 30일 이내로 보고해야 된다. 소 비자도 부작용을 주치의나, 제약회사, 또는 직접 해당 부작 용모니터링센터에 보고할 수 있다.
제약회사에서는 사망사례의 경우 역학조사를 진행하고 사망원인, 의약품사용사항, 부작용발생 및 치료과정에 대하 여 15일 이내에 보고서를 작성하여 해당의약품을 생산한 제 약회사가 소속되어 있는 성급 모니터링센터에 보고해야 한 다. 시, 현급 모니터링센터에 보고된 부작용보고건은 심각 한 유해사례의 경우는 3일 이내, 기타 보고건은 15일 이내 에 보고건에 대한 평가를 완료해야 하고 사망사례에 대해서 는 조사를 진행하고 사망원인, 의약품사용사항, 부작용발생 및 치료과정에 대하여 15일 이내에 보고서를 작성하여 동급 의 감독관리국과 위생관리부문 및 그 상위(성급) 모니터링 센터에 보고해야 한다. 성급 모니터링센터에서는 하위 모니 터링센터에서 보고받은 심각한 유해사례에 대한 평가의견 에 대하여 7일 이내에 평가를 완성해야 되며, 사망사례에 대해서는 사건발생지역 모니터링센터 및 해당 제약회사가 소속해있는 성급 모니터링센터에서 보고받은 조사결과에 대하여 분석, 평가 및 필요 시 현장조사를 진행하며 또한 그 평가결과에 대하여 성급 감독관리국과 위생관리부분 및 국 가모니터링센터에 보고해야 한다. 국가모니터링센터에서는 사망사례에 대하여 빠른 시일 내에 분석, 평가를 진행하고 그 평가결과를 국가 SFDA와 MOH에 보고해야 된다.
2) 집단의약품부작용보고
집단의약품부작용사건의 경우 시, 현급 감독관리국에서 부작용보고를 받았으면 그 즉시 동급의 위생관리부분과 연 합하여 현장조사를 진행하고 성급 감독관리국과 위생관리 부분에 보고한다. 제약회사에서는 집단의약품부작용사건이 발생 시 즉시 조사를 진행하고 7일 이내에 자세한 조사보고
를 소속되어 있는 성급 감독관리국과 모니터링센터에 보고 하고 동시에 자체적으로 사건발생의 원인에 대한 역학조사 를 착수하고 필요 시 해당 의약품에 대한 생산, 판매 및 사 용을 중지하거나 해당 의약품을 소환하는 조치를 취하고 성 급 감독관리국에 보고한다. 의약품판매업체나 의료기관에 서도 집단의약품부작용사건이 일어났을 경우 필요한 경우 에는 해당 의약품의 판매를 중지하거나 의약품의 사용을 중 지하는 등 긴급조치를 취할 수 있다. SFDA에서는 해당 의 약품의 생산, 판매 및 사용을 중단시키거나 해당의약품을 소환하는 조치를 취할 수 있고 MOH에서는 환자들을 치료 하는데 전력을 다해야 한다.
집단의약품부작용사건으로는 2006년 4월 광동성의 한 병 원에서 치치하얼제2제약회사에서 생산한 Armillarisni A 주 사제 사용 후 9명이 사망하게 된 사건을 들 수 있다. 4월 19 일 해당 병원에서 치치하얼제2제약회사의 Armillarisni A 주 사제를 사용하기 시작하면서 주사제를 사용한 환자들 중 급 성신부전을 일으키는 사례가 발생하기 시작하였고 4월 30 일까지 총 6명이 유사한 증상을 보이게 되었다. 5월 3일 SFDA에서는 해당 의약품에 대하여 생산을 중단시켰고 광 동성약품감독관리부분에서는 전문가들을 소집하여 조사를 진행하였으며 약물 성분 중 프로필렌글리콜(propylene glycol) 대신에 디글라이콜(diglycol), 즉 독성이 있는 가짜 성분을 구입하여 생산에 사용한 것으로 드러났다. 해당 주사제는 총 64명이 사용한 것으로 확인되었고 그 중 약물사용에 의 한 사망자수는 9명에 달하였다. 이러한 조사결과에 근거하 여 5월 21일 SFDA에서는 치치하얼제2제약회사의 의약품생 산허가증을 취소하였다.
17-19)3) 해외에서 발생한 심각한 유해사례
수입의약품이나 국산의약품이 해외에서 심각한 유해사례 가 발생했을 경우(자발적 보고, 시판 후임상시험, 문헌보고), 제약회사에서는 <해외에서 발생한 약품유해반응/사례보고 표>를 작성하여 30일 이내에 국가의약품부작용모니터링센 터에 보고해야 한다. 국가의약품부작용모니터링센터에서는 접수한 의약품부작용에 대하여 분석, 평가를 진행하고 6개 월마다 SFDA와 MOH에 보고해야 하며 안전성위험의 존재 가능성이 있는 실마리정보가 검색되었을 경우는 즉시 보고 해야 한다. 수입의약품과 국산의약품이 해외에서 의약품부 작용 때문에 판매와 사용중지 및 시장에서 퇴출되었을 시 제약회사에서는 24시간 이내에 서면으로 SFDA와 국가모니 터링센터에 보고해야 한다.
4) 정기안전성정보업데이트보고(Periodic Safety Up- date Report, PSUR)
제약회사에서는 본 회사의 의약품에 관한 부작용보고와
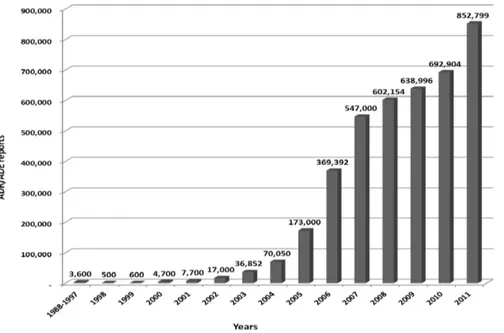
Figure 2. Adverse drug reaction
and adverse drug event reports collected by the national ADR monitoring center from 1988 to 2011. Source: Center for Drug Reevaluation, SFDA.모니터링자료에 대하여 정기적으로 분석하고 국내외 안전 성정보를 수집하여 위험-이익분석을 진행하고 정기적으로 안전성정보에 대하여 업데이트 해야 한다. 신약모니터링기 간에 있는 국산의약품 및 해외 의약품은 품목허가를 받은 후부터 재허가를 받기 전까지 매년마다 정기적인 안전성보 고를 업데이트해야 하며 초기 재허가를 받은 후부터는 5년 에 한번씩 업데이트 한다. 기타 의약품은 5년에 한번씩 안 전성보고를 업데이트 해야 한다. 이러한 안전성 보고는 각 성급 모니터링센터에 모이게 되며 성급모니터링센터에서는 수집한 안전성보고들을 분석 및 평가하여 매년 4월 1일 그 전년도의 정기안전성보고에 대한 통계, 분석 및 평가결과를 성급 감독관리국과 국가모니터링센터에 보고한다. 국가모 니터링센터에서는 정기안전성업데이트보고에 대하여 취합, 분석 및 평가하여 매년 7월 1일 그 전년도의 국산의약품과 수입의약품에 대한 정기안전성업데이트보고에 대하여 통 계, 분석 및 평가하여 SFDA와 MOH에 보고한다.
5) 특정의약품집중모니터링
특정의약품집중모니터링의 대상은 국가모니터링센터에 서 지정하게 되는데 실마리정보(signal)로 검색된 새로운 또 는 심각한 약물유해반응을 일으킨 약물; 약물에 의한 유해 반응이 이미 알려지더라도 그 발생률, 발생빈도, 발생인구 특징 등이 갑자기 변화한 경우; 집단의약품유해사례가 발생 한 경우; 국외에서 안전성경고 또는 조치를 취한 의약품, 국 내 안전성속보에서 보고된 약물 등이 포함되게 된다.
20)집 중모니터링은 특정 의약품들의 임상사용과 유해반응의 발 생상황을 조사하고, 유해반응의 특징, 심각도, 발생률 등에 대하여 연구하며, 해당 의약품에 대한 안전성모니터링활동
을 전개하는 것을 말하는데 이러한 집중 모니터링을 실행하 는 주체는 제약회사이며 신약감시기에 있는 의약품과 첫 수 입 5년 이내의 수입의약품에 대하여도 의무적으로 집중모 니터링을 실시해야 한다. 성급이상의 의약품부작용모니터 링센터에서는 임상에서의 의약품 사용과 부작용모니터링결 과에 근거하여 제약회사에 특정의약품에 대한 집중모니터 링을 요구할 수 있으며 필요할 경우 직접 의약품부작용모니 터링기관, 의료기관 및 연구기관을 구성하여 집중모니터링 을 실행할 수도 있다. 이러한 제도는 한국의 재심사제도와 유사한 특징을 가지고 있지만 집중모니터링의 대상이나 기 간 등에서 차이를 보이고 있다.
6) 법적 책임
“약품불량반응보고제도와감측관리방법”에서는 부작용 보 고 및 평가 등을 해당 관리방법의 규정에 따라 진행하지 않 은 경우에는 제약회사, 의약품판매업체 및 의료기관 등 기 관들에 법적 책임을 물으며 5,000-30,000위안(784-4,708달러) 상당의 벌금을 가한다고 명확히 제시하고 있다. 주요하게는 규정에 따른 의약품부작용보고제도와 모니터링제도를 설립 하지 않고 전문기구와 전문직을 두지 않을 경우; 의약품부 작용모니터링데이터를 구축 및 보존하지 않은 경우; 규정에 따라 의약품부작용 또는 단체의약품부작용에 대한 보고, 조 사, 평가 및 처리를 하지 않은 경우; 심각한 유해사례나 집 단부작용발생사건에 대한 역학조사에 협조하지 않은 경우 등 내용을 포함하고 있다.
2. 부작용보고
중국의 의약품 부작용은 국가의약품모니터링센터 웹페이
지를 통해 보고하거나 서면보고양식을 다운로드하여 전자 메일, 팩스 및 우편으로 보고할 수 있으며, 소비자도 직접 보고할 수 있다.
11,21)의약품부작용보고건수는 놀라울 정도 로 빠른 증가를 보여주고 있다. 중국식품의약품감독관리국 에 따르면 1988-1997년까지 약물유해반응/유해사례 보고건 수는 10년간 총 3,600건밖에 안되었는데 2004년 7만여건, 2007년에는 50여만건, 2010년에는 거의 70만건에 달하였다.
최근 발표한 자료에 의하면 2011년 보고건수는 85만 2천여 건으로 놀라운 속도로 증가하고 있다(그림 2). 그 중 새로운 및 심각한 약물유해사례/유해반응의 경우는 145,769건이었 고 전체 보고건의 17.1%를 차지하였다.
16)중국은 유럽이나 미국과 달리 80% 이상의 보고건은 병원이나 의료기관에서 직접 보고를 하고 있는데 이는 “약품불량반응보고제도와감 측관리방법”에서 명확하게 의료기관도 보고의 주체 중 하 나로서 의무화하였고 상대적으로 환자와 접촉할 수 있는 기 회가 제약회사에 비해 많으며 또한 유럽이나 미국에서는 제 약회사에서 부작용을 숨기고 보고하지 않을 경우 수십억달 러에 상당한 거액의 벌금을 부담해야 하는 반면에 중국은 5,000달러 미만으로 그 액수가 많이 작아 강제력이 부족한 상황이다.
22)2011년의 통계에 따르면 의료기관에서의 보고 는 83.1%로 여전히 보고의 주체를 차지하고 있으며 예년에 비해 크게 변하지는 않았다. 이것은 한국의 보고주체가 병원 이나 의료기관 위주인 것과 비슷한 특성을 보이고 있다.
9,23)의약품재등록제도
2007년 10월 1일부터 시행된 의약품등록관리방법(Provi- sions for Drug Registration. SFDA Order 28)에서는 의약품의 재등록신청(Re-registration application)이란 의약품허가증의 유효기간이 만료된 후 그 의약품에 대하여 지속적으로 생산 하거나 수입을 하기 위한 등록신청을 말한다고 정의하였다.
즉 2007년부터 의약품허가 후 만 5년된 의약품은 생산을 지 속하기 위해서는 재등록신청을 해야 한다. 그 목적은 생산 조건을 구비하지 못하고 품질을 보증할 수 없고 안전위험성 이 높은 의약품에 대하여 시장에서 퇴출시키는 것이다. 국 산의약품의 경우는 성, 자치구, 직할시 의약품감독관리부문 에서 신청을 접수하고 6개월 이내에 재등록신청을 해주며 수입의약품의 경우는 SFDA에서 신청을 접수하고 6개월이 내에 재등록신청을 해준다.
24)한국에서도 이와 유사한 제도 인 “품목갱신제도”를 도입할 예정인데 2013년 이후 허가된 제품에 대해서는 매 품목마다 5년 이내에 품목갱신신청자 료를 제출하도록 의무적으로 허가조건으로 적용하기로 하 였다.
25)의약품특별심사절차
돌발적인 의료사건이 발생한 경우 필요한 의약품의 빠른 사용을 위하여 해당 의약품에 대하여 신속히 허가를 주는
“의약품특별심사절차”를 도입하게 되었다. 2005년 11월 18 일 심사 통과한 이 특별심사절차에서는 돌발적인 응급의료 사건의 대처에 필요한 의약품들에 대하여 허가요청을 신청 한 후 24시간 내에 서류심사를 진행해야 하며 동시에 해당 지역의 성, 자치구, 직할시 의약품감독관리부문에 공지하여 의약품생산상황 및 생산조건들에 대하여 현장조사를 진행 하고 표본시제들에 대하여 샘플링 및 검사를 실시하며 5일 이내에 그 결과를 SFDA에 보고해야 하고 또한 의약품검연 기관에서는 해당 샘플들에 대하여 테스트를 진행하고 테스 트 완료 후 2일 내에 보고서를 작성하여 SFDA에 보고해야 하며 SFDA에서는 기술심사를 마친 후 3일 이내에 행정심 사 및 심사평가를 마치고 그 결과를 신청인에게 피드백해주 어야 한다. 이런 특별심사절차로 하여 응급의료현장에서 필 요한 의약품들은 번거로운 의약품허가절차를 대폭 줄여 신 속히 임상에서 사용하고 사건의 확산을 줄이는데 기여를 하 게 된다. 의약품부작용모니터링기구들에서는 또한 이러한 돌발응급의료사건에 필요한 특별허가 받은 의약품들을 집 중모니터링 대상으로 간주하고 집중모니터링의약품에 대한 관련규정에 따라 부작용을 보고하고 분석을 진행해야 하며 동시에 성, 자치구, 직할시 의약품감독관리부문 및 SFDA에 보고하도록 요구하고 있다.
26)의약품재평가제도
의약품재평가제도란 SFDA에서 의약품부작용모니터링결 과와 연구자료에 대하여 분석, 평가 및 그 평가결과에 따라 위해관리와 사후조치를 취하는 과정이다. 2007년 10월 23일
“의약품재평가제도”에 대한 초안이 만들어졌는데 한국에서
의 재평가제도랑 다르게 일반재평가, 원인재평가 및 기타재
평가 등 세가지 범주로 정의하였다. 일반재평가는 신청인이
신청 후 규정에 따라 반드시 시행하여야 하는 시판 후 연구
및 기타 모니터링 관리, 4상 임상시험과 그 결과에 대한 평
가 및 모니터링기간 동안의 의약품정기보고 및 그 결과에
대한 평가를 말한다. 원인재평가는 의약품모니터링센터에
서 의약품부작용 모니터링결과 및 기타 안전성이슈의 수요
에 근거하여 제약회사에 요구하는 시판 후 조사 및 그 결과
에 대한 평가결과에 근거하여 시행한 위해관리 및 사후처리
를 말한다. 기타재평가는 제약회사나 제3자가 자주적으로
진행한 시판 후 조사 및 평가를 말한다. 기타재평가는 재평
가제도를 완성하는 중요한 소스이기도 하다. SFDA에서는
의약품재평가결과에 따라 의약품라벨의 수정, 의약품의 생
산, 판매 및 사용의 중단, 심각한 약물유해반응이나 건강을 위협하는 인과관계가 밝혀졌을 경우 해당 의약품에 대한 허 가를 취소할 수도 있다고 제시하고 있다.
27)중국에서의 의 약품 시판 후 연구에 관한 문헌들은 아직 낙관적이지 못하 다. 1985-2002년까지 중국어로 된 문헌들에 대하여 조사한 결과 의약품에 대한 재평가문헌이 4,030편이었는데 그 중 대부분은 임상연구(90%)였다. 의약품평가의 표본크기는 대 부분 50-100예(모든 문헌 중 40%), 5,000예 이상의 문헌은 18편(0.45%)밖에 안되었다.
28)아직 의약품재평가제도에 대 한 공식적인 규범은 출범하지 않았지만 ‘국가약품안전 제 12차 5개년계획’에 시판 후 건전한 의약품재평가제도의 설 립이 하나의 조항으로 포함되어 있어 빠른 시일 내에 규범 화된 제도가 출범할 수 있을 것으로 예상된다.
7)한약(Traditional Chinese Medicine, TCM) 관련 제도
중국은 영토가 넓고 다양한 토양을 가지고 있으므로 각종 약초들의 원산지이기도 하다. 오랜 역사를 가지고 있는 한 방치료는 지금까지도 중국의료현장에서 널리 활용된다.
1992년 한약제제의 품질 제고 및 한약생산의 합법적인 권익 을 보호하고 한약사업의 발전을 목적으로 “한약보호조례”
를 제정하게 되었으며 국가약품표준품종에 포함되어 있는 한약제제에 대해서는 한약보호신청을 제출할 수 있다.
29)하 지만 동일한 품종의 한약재라고 해도 그 재배지역이 다름에 따라 다른 효능 및 독성을 가질 수도 있다. 또한 농약이나 중금속, 방사능오염물질의 노출여부에 따라 안전성에 영향 을 미칠 수도 있다. 한약의 경우 그 자체의 비활성화 특징에 의하여 알코올, 오일, 산, 꿀 등 물질을 첨가하여 사용하게 되는데 특히 제품을 가공할 때 사용하는 첨가물들도 그 약 물의 독성을 야기시킬 수 있다. 따라서 한약은 그 품질을 보 장하기 위해서는 생산초기부터 제작과정까지 엄격한 생산 기준에 따라 생산되어야 한다.
15)이러한 한약재의 특징때문 에 2002년에 제정된 “한약재생산질량관리규범(시행)” (Good Agricultural Practice for Chinese Crude Drugs Interim)에서는 한약제제에 필요한 한약재의 재배생태환경에서부터 재배방 법, 가공, 포장까지 전 과정에 대하여 표준화된 기준을 제시 하고 있으며 또한 의약품생산질량관리규범” (Good manufac- turing practice for drugs 2010 revision)에서도 생산 또는 품질 관리를 위한 엄격한 기준을 제시하고 있다.
13,30)위해 평가와 위해 관리
시판 전 안전성 연구의 부족 및 그 한계점 때문에 시판 후의 의약품 사용에서도 예기치 못한 약물유해반응들이 일
어날 수 있다. 중국의 현재 상황을 보게 되면 특히 한약의 경우는 치료 가이드라인이나 제품의 포장 및 설명서에 사용 방법, 부작용 등의 정보가 아주 부족하다. 예를 들면 익모초 (益母草)의 경우에는 사용설명서에 “자궁축소 약물, 지혈 및 월경조절 의약품”으로만 적혀있다. 여기에는 의약품의 임상 적응증에 대한 진단명에 관한 정보라든지 이상반응에 대한 정보 등이 거의 기재되어 있지 않다. 또한 한약재에 대한 임 상시험은 주로 중국 국내에서 이루어지고 있으며 외국에서 는 4,000-5,000명에 대상으로 임상시험을 진행하는 반면에 중국에서는 한약제제생산기업들이 대부분 작은 규모이고 경제적으로도 거액의 자금확보가 어려운 실정이어서 500명 규모에 대한 임상시험만으로도 허가를 받을 수 있다.
31)이 러한 실정때문에 중국의 시판 후 의약품안전성관리는 큰 어 려움이 존재하고 있다.
2001년 11월부터 SFDA에서는 소비자들에게 유익한 정보 를 제공하기 위하여 홈페이지에 ADR 안전성속보(Bulletin Press release)를 발행하고 주기적으로 업데이트하고 있다.
2012년 4월까지 총 46기가 발행되었고 총 85개의 ADR 안전 성경보(Alert)를 포함하고 있으며 그 중 화학의약품은 70건, 한약에 관련된 것은 15건이었다.
32)최근 중국에서는 몇 가지 의약품에 대한 안전성이슈가 있 었다. 발행된 안전성경보 중 안전성 평가를 거쳐 이미 시판 중지된 약물 중 하나는 LongdanXiegan (주성분: Guanmutong) 이었다. 1998-2001년까지 58예의 Guanmutong으로 인한 신독 성 사례에 관한 연구가 진행된 바 있고 2003년 4월 1일 국 가ADR센터에서는 Guanmutong의 신장독성 및 그 부작용에 따라 약품표준을 취소하고 Longdanxiegan환, 캡슐, 과립, 정 등을 생산하는 제약회사들에서는 2003년 4월 30일 전까지 처방 중에 있던 Guanmutong을 <중국약전>에 있는 Mutong 으로 전부 대체하라는 공지를 하였다.
33,34)경구용으로 2,000여년동안 사용해온 어성초(鱼腥草)라는
한약은 1980년대 주사제로 개발되어 사용하게 되었으며
SFDA에서 시판허가를 받게 되었다. 저렴한 가격과 빠른 효
과로 하여 감염성질환의 치료제로 임상에서 광범위하게 사
용하게 되었는데 1988-2003년까지 국가ADR모니터링센터에
서는 272건의 어성초주사제에 관한 부작용보고를 접수하였
고 그 중 심각한 유해사례만 52건이었다. 따라서 2003년 국
가ADR모니터링센터에서는 어성초주사제에 대한 안전성경
보를 발행하게 되었다.
35)2006년 어성초주사제에 의한 심각
한 부작용이 또 다시 이슈화되었는데 중국 절강성의 4세 여
아가 호흡기감염 치료제로 어성초주사제를 정맥투여하는
과정에서 경련 및 혼수를 일으켰으며 3개월 넘게 혼수상태
가 지속되었고 호북성 3세 여아도 정맥으로 어성초주사제
를 투여하는 과정 중 과민성 쇽을 일으켜 사망에까지 이르
는 등 심각한 부작용이 보고되면서 국가ADR센터에서는
1988-2006년 4월 13일까지 어성초주사제에 관한 부작용보고 건을 분석하였는데 총 5,000여건이 보고되었으며 그 중 심 각한 유해사례는 222건이었다.
31)2006년 6월 1일 국가ADR 센터에서는 약물사용 후 사망 또는 과민성 쇽, 전신알레르 기반응, 호흡곤란, 중증의 두드러기 등 심각한 약물유해반 응을 일으킨 어성초주사제를 포함한 7가지 제품에 대하여 생산과 판매를 중단시키는 조치를 취하였다.
36)그 후 3개월 동안 전문가들에 의하여 재평가과정을 거쳤으며 임상에서 광범위하게 사용하는 약임을 고려하여 근육주사제로 쓰이 는 제품에 대해서는 의약품 라벨을 수정한 경우에는 생산을 회복하고 그 외의 정맥주사제는 이후의 추가 연구를 진행하 고 그 결과에 따라 생산여부를 결정하기로 하였다.
36-38)또 하나의 안전성 이슈로는 항생제인 클린다마이신 포스 페이트 글루코스(clindamycin phosphate glucose)주사제에 관 한 것이다. 2006년 7월 27일 SFDA에서는 청해성환자들에서
“안휘화원”에서 생산한 클린다마이신 포스페이트 글루코스 주사제 사용 후 흉통, 신장통증, 복통, 설사, 오심, 구토, 과 민성 쇽, 신기능손상 등 부작용이 보고되었다는 청해성식품 의약품안전청의 보고를 받게 되었고 8월 3일까지의 통계결 과 국가ADR모니터링센터에서는 전국 범위에서 동종 의약 품 주사 후 비슷한 증상의 부작용 38건이 보고되었다.
SFDA에서는 즉시 안전성경보를 발행하고 현장조사 결과 부작용은 “안휘화원”에서 생산한 신푸(欣弗) 주사제의 생산 과정에서 박테리아감염으로 인한 것으로 밝혀졌고 8월 4일 전국 범위에서 해당 의약품에 대하여 긴급소환조치를 취하 였다.
39)최근 상하이에서는 자발적부작용보고데이터베이스를 이 용하여 실마리정보검색에 관한 연구를 진행하고 있으며 실 마리정보검색지표로는 보고분율비(Proportional Reporting Ra- tion, PRR)를 이용하여 연구하였다.
40)또한 광동성 자발적부 작용보고데이터베이스를 이용하여 실마리정보검색지표인 보고분율비(Proportional Reporting Ratio, PRR), 보고오즈비 (Reporting Odds Ratio, ROR) 및 베이지안신뢰전달신경망 (Bayesian Confidence Propagation Neural Network, BCPNN)의 결과를 비교하는 등 다양한 연구들이 활발히 진행되고 있 다.
41)맺 는 말
중국은 시판 후 약물감시에 대한 가이드라인이 아직 구체 적으로 겸비되어 있지 않지만, 부작용보고건수의 급속한 증 가, 어성초나 신푸사건에 대한 신속한 대응이나 역학조사 진행속도 등을 볼 때 놀라운 발전을 이룩하고 있다. 또한 약 물유해반응 실마리정보검색에 관한 연구도 선진국 못지 않 게 진행되고 있다. 이러한 결과들은 최근 중국의 각종 의약
품안전관리체계에 관한 법률 및 규제제도의 강화, 교육 및 홍보 등의 노력과 갈라놓을 수 없다. 더욱이 국가 차원에서 의 의약품안전관리에 대한 고도의 관심과 의약품안전관리 제도 구축을 위한 적극적인 노력을 감안할 때 중국의약품안 전성분야는 미래가 밝아 보인다.
참고문헌
1. China Chamber of Commerce for Import & Export of Medicines & Health Products (CCCMHPIE). Current Status and Development Trend of China's Pharmaceutical Raw Material Industry. Released at 2009 International Exhibition of Pharmaceutical Raw Materials, China. [cited 2009 Aprial 17]; Available from: http://ybsh.mhpie.com.cn/cccmhpie/hydt/
html/?1370.html [cited 2012 July 18] (Chinese).
2. State Food and Drug Administration (SFDA). White Paper of Drug Safety Supervision Situation in China. [cited 2008 July 18]; Available from: http://www.sda.gov.cn/WS01/CL0027/
31372.html [accessed 2012 July 18] (Chinese).
3. China News. China maily produce generic drugs. 2011.
Available from: http://www.sdyyzs.cn/news/11/0916/18347_1.
shtml [accessed 2012 July 18].
4. Pirmohamed M, James S, Meakin S, Green C, Scott AK, Walley TJ, Farrar K, Park BK, Breckenridge AM. Adverse drug reactions as cause of admission to hospital: prospective analysis of 18 820 patients. BMJ 2004;329:15-9.
5. Moore TJ, Cohen MR, Furberg CD. Serious adverse drug events reported to the Food and Drug Administration, 1998-2005. Arch Intern Med 2007;167:1752-9.
6. Xinhuanet. News. The Twelfth Five-Year Plan for National Economic and Social Development of the People's Republic of China. [cited 2011 March 16]; Available from: http://news.
xinhuanet.com/politics/2011-03/16/c_121193916.htm [accessed 2012 July 18] (Chinese).
7. The Twelfth Five-Year Plan for Drug Safety. [cited 2012 January 20]; Available from: http://www.gov.cn/zwgk/2012- 02/13/content_2065197.htm [accessed 2012 July 18] (Chinese).
8. Zhou Y, Miller V, Hogan M, Callahan L. An overview of adverse drug reaction monitoring in China. Intern J Pharm Med 2006;20:79-85.
9. Jin XM, Kim YJ, Yang BR, Song HJ, Choi NK, Park BJ.
The role of consumers in the spontaneous adverse drug events reporting. JPERM 2010;3:101-12.
10. State Food and Drug Administration (SFDA). The notice on the establishment of the State Drug Administration Center for Drug Reevaluation. Available from: http://www.sda.gov.cn/WS01/
CL0055/9464.html [accessed 2012 July 18] (Chinese).
11. Center for Drug Reevaluation, SFDA & National Center for ADR Monitoring, China. Law & Regulations. Adverse Drug Reaction Reporting and Monitoring Provision. SFDA Order No. 81. 2011. [cited 2011 Jul 11]; Available from:
http://www.cdr.gov.cn/zcfg/yp/201107/t20110711_2957.html [accessed 2012 July 18] (Chinese).
12. State Food and Drug Administration (SFDA). Laws and Regulations. Provision for Drug Recall. SFDA Order No. 29.
2007. [cited 2007 December 10]; Available from: http://www.
sfda.gov.cn/WS01/CL0053/26913.html [accessed 2012 July 18]
(Chinese).
13. State Food and Drug Administration (SFDA). Laws and Regulations. Good Manufacturing practice for drugs (2010 re- vision). MOH Decree No. 79. 2011. [cited 2011 January 17];
Available from: http://eng.sfda.gov.cn/WS03/CL0768/65113.html [accessed 2012 July 18].
14. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH). ICH Guidelines. Clinical safety data management:
Definition and standards for expedited reporting. Available from: http://www.ich.org/products/guidelines/efficacy/efficacy- single/article/clinical-safety-data-management-definitions- and-standards-for-expedited-reporting.html [acceessed 2012 July 18].
15. Zhang L, Yan JB, Liu XM, Ye ZG, Yang XH, Meyboom R, Chan K, Shaw D, Duez P. Pharmacovigilance practice and risk control of Traditional Chinese Medicine drugs in China:
Current status and future perspective. J Ethnopharm 2012;
140:519-25.
16. Du W, Guo JJ, Jing Y, Li X, Kelton CML. Drug safety sur- veillance in China and other countries: a review and com- parison. Value in Health 2008;11:S130-S6.
17. Xinhua News. Nine people have died from using fake drug made by a Chinese pharmaceutical company in Northeast China's Heilongjiang Province. Available from: http://news.
xinhuanet.com/english/2006-05/22/content_4582672.htm [accessed 2012 July 18].
18. Enorth News. A lot of people Kidney failure suspected to be caused by Qiqihar fake drugs in Guangdong province. 2006.
Available from: http://news.enorth.com.cn/system/2006/05/13/
001302770.shtml [accessed July 18] (Chinese).
19. Sina News. Life-threating event caused by Qiqihar fake drugs. Available from: http://news.sina.com.cn/o/2006-05-23/
09089000126s.shtml [accessed 2012 July 18] (Chinese).
20. National Center for Adverse Drug Reaction Monitoring. Laws and Regulations. Practice for special drug monitoring, trial implementation. 2008. Available from: http://www.docin.com/
p-46958541.html [accessed 2012 July 18] (Chinese).
21. Center for Drug Reevaluation, SFDA & National Center for ADR Monitoring, China. Adverse drug reaction monitoring system. Available from: http://www.cdr.gov.cn/ [accessed 2011 July 18] (Chinese).
22. Yao YB, Chen YF, Shao R. Analysis on the reasons for do- mestic pharmaceutical enterprises for relatively lower report- ing proportion of adverse drug reaction. 2009;30:225-7.
23. State Food and Drug Administration (SFDA). SFDA releases 2011 annual report for adverse drug reaction monitoring.
[cited 2012 May 31]; Available from: http://www.sda.gov.cn/
WS01/CL0051/72190.html [accessed 2012 July 18] (Chinese).
24. State Food and Drug Administration (SFDA). Laws and Regulations. Provisions for Drug Registraion (SFDA Order No. 28). [cited 2007 July 10]; Available from: http://eng.sfda.
gov.cn/WS03/CL0768/61645.html [accessed 2012 July 18].
25. Korea Food and Drug Administration (KFDA). News. [cited 2010 September 3]; Availabel from: http://www.kfda.go.kr/
index.kfda?mid=56&seq=13069&cmd=v [accessed July 18]
(Korean).
26. State Food and Administration (SFDA). Laws and Regula- tions. Special Review and Approval Procedure for Drug Regi- stration of the State Food and Drug Administration (SFDA Order No. 21). [cited 2005 November 18]; Available from:
http://eng.sfda.gov.cn/WS03/CL0768/61646.html [accessed 2012 July 18].
27. State Food and Drug Administration (SFDA). Provisions for Drug Reexamination (Rraft). [cited 2009 December 2]; Avai- lable from: http://www2.tjutcm.edu.cn/tcmic/bencandy.php?fid=
68&id=243 [accessed 2012 July 18] (Chinese).
28. Yan M, Wu H, Guo XX, Ren JT, Cao LY, Li SL, Cao FD, Li Q, Lai SL, Wang Q, Wen HZ. A study of the regulations of the re-evaluation skills and evaluation modes for drugs sold on the market. Chin J Pharmacoepidemiol 2003;12:286-9 (Chinese).
29. State of Food and Drug Administration (SFDA). Laws and Regulations. Regulations on the Protection of Traditional Chinese Medicines. [cited 1992 October 14]; Available from:
http://www.sda.gov.cn/WS01/CL0784/25226.html [accessed 2012 July 18] (Chinese).
30. State Food and Drug Administration, SFDA. Law and regu- lations. good agricultural practice for Chinese crude drugs (Interim). Available from: http://eng.sfda.gov.cn/WS03/CL0768/
61642.html [accessed 2012 July 18].
31. Mei QX, Zeng CY. On the event of “Exigent withdrawal of houttuynia cordata injection”. China Pharmacy 2006;17:
1124-6.
32. Center for Drug Reevaluation, SFDA & National Center for ADR Monitoring, China. Adverse Drug Reaction (ADR) in- formation bulletin. Available from: http://www.cdr.gov.cn/xxtb_
255/ [accessed 2012 July 18] (Chinese).
33. State Food and Drug Administration (SFDA). Notice on the termination of the medicinal use of Guan Mutong. SFDA- Registration No. 121. 2003. [cited 2003 April 1]; Available from: http://former.sfda.gov.cn/cmsweb/webportal/W945325/A2 6250348.html [accessed 2012 July 18] (Chinese).
34. Chen W, Chen y, Li A, Cheng H. The clinical and patho- logical manifestations of aristolochic acid nephropath- the re- port of 58 cases. Natl Med J China 2001;81:1101-5 (Chinese).
35. Center for Drug Reevaluation, SFDA & National Center for ADR Monitoring, China. Adverse Drug Reaction (ADR) in- formation bulletin. Warning about the ADRs related to hout- tuynia herb injections. 2003. [cited 2008 August 26]; Availab- le from: http://www.cdr.gov.cn/xxtb_255/ypblfyxxtb/200806/
t20080626_2809.html [accessed 2012 July 18] (Chinese).
36. State Food and Drug Administration (SFDA). Notice on sus- pension of the manufacturing approval applications and clin- ical use of houttuynia herb injection and 7 other related injections. SFDA-SAFETY No. 218. 2006. [cited 2006 June 1]; Available from: http://www.sda.gov.cn/WS01/CL0087/14804.
html [accessed 2012 July 18] (Chinese).
37. State Food and Drug Administration (SFDA). The notice
about change drug label of houttuynia herb injections (intra- muscular injection). SFDA-REGISTRATION No. 561. 2003.
[cited 2006 September 5]; Available from: http://www.sda.
gov.cn/WS01/CL0175/10609.html [assecced 2012 July 18]
(Chinese).
38. State Food and Drug Administration (SFDA). The notice about the regulations of the seven houttuynia herb injections.
2006. [cited 2006 September 5]; Available from: http://www.
sda.gov.cn/WS01/CL0844/10594.html [assecced 2012 July 18]
(Chinese).
39. Center for Drug Reevaluation, SFDA & National Center for ADR Monitoring, China. Adverse Drug Reaction (ADR) in- formation bulletin. Warning about the ADRs related to clinda- mycin phosphate glucose injections. 2003. [cited 2008 June 26]; Available from: http://www.cdr.gov.cn/xxtb_255/ypbl- fyxxtb/200806/t20080626_2812.html [accessed 2012 July 18]
(Chinese).
40. Liu Y, Cheng NN, Du WM, Wang YM. Signal detection of nervous system from Shanghai spontaneous ADR reporting system reports. Chinese J Clinic Pharmacy 2010;19:85-8.
41. Li C, Xia J, Deng J, Jiang J. A comparison of measures of disproportionality for signal detection on adverse drug re- action spontaneous reporting database of Guangdong province in China. Pharmacoepidemiol Drug Saf 2008;17:593-600.