783
통신저자:양 준 영
대전시 중구 대사동 640
충남대학교 의과대학 정형외과학교실 TEL: 042-280-7351ㆍFAX: 042-252-7098 E-mail: jyyang@cnu.ac.kr
Address reprint requests to Jun-Young Yang, M.D.
Department of Orthopedic Surgery, Chungnam National University School of Medicine, 640, Daesa-Dong, Jung-Gu, Daejeon 301-721, Korea Tel: +82.42-280-7351, Fax: +82.42-252-7098
E-mail: jyyang@cnu.ac.kr
쥐의 척수 손상후 메틸프레드니솔론과 Riluzole의 투여가 축색 재생에 미치는 영향
홍창화*ㆍ양준영ㆍ이준규ㆍ송호섭
순천향대학교 의과대학 정형외과학교실*, 충남대학교 의과대학 정형외과학교실, 충남대학교 의학연구소
The Effect of Methylprednisolone and Riluzole on Axonal Growth after Acute Spinal Cord Injury in Rats
Chang-Hwa Hong, M.D.*, Jun-Young Yang, M.D., June-Kyu Lee, M.D., and Ho-Sup Song, M.D.
Department of Orthopedic Surgery, Soonchunhyang University College of Medicine*, Cheonan, Department of Orthopedic Surgery, Chungnam National University School of Medicine,
Research Institute for Medical Science, Daejeon, Korea
Purpose: To determine the effect of methylprednisolone (MP) and riluzole administration on axonal growth after spinal cord injury (SCI) in rats.
Materials and Methods: Three Sprague Dawley rats (SD rat) served as controls (average 24 weeks of age) and 24 SCI SD rats scoring below 7 points on on Basso, Beattie, and Bresnahan open field test served as test subjects (total 27 SD rats; mean weight 581 g, range=427-613 g). Test subjects were divided into two groups of 12 subjects each. Group I was injected with saline (1 ml/kg) and group II was injected with MP (300 mg/kg) and riluzole (5 mg/kg) intraperitoneally. Four SD rats were sacrificed in each group at the following time points after SCI: days 1, 4, and 7. We completed behavioral testing, immunohistochemical staining and RT-PCR for chondroitin sulfate proteoglycans (CSPG), and microarrays for c-JUN, ATF-2, p53, and Elk-1.
Results: On behavioral testing, group II showed superior results at only day 4 after SCI (p<0.05). On RT-PCR for CSPG, optical densities were 2.06 (ratio=Group I/Group II) and 2.11 at days 4 and 7, respectively. Microarray showed that lower expression of c-JUN in group II during the entire period (p<
0.05). ATF-2 showed lower expression in group II at days 4 and 7 (p<0.05). p53 showed lower expression in group I at day 1 (p<0.05). Elk-1 showed lower expression in group I at day 1 (p<0.05) and in group II at day 7 (p<0.05).
Conclusion: Simultaneous administration of MP and riluzole led to various changes in the MAPK pathway, and decreased CSPG. Therefore, this method has a protective effect on axonal regeneration after SCI in an SD rat model.
Key Words: Spinal cord injury, Methylprednisolone, Riluzole
서 론
외상성 척수 손상은 환자의 영구적 장애 및 사회 경제 적 손실이 크므로 급성 척수 손상 후 유용한 신경보호 물 질의 개발에 연구가 진행 중이며 이와 동시에 신경재생 의 기전과 치료법을 개발하기 위한 연구가 시행되고 있
다1,4,5,10-12,14-16,19,21,22,26)
. 손상된 신경세포는 시간이 경 과할수록 세포사멸(apoptosis)이 진행되어 척수 손상 치 료에 장애가 발생한다. 척수 손상의 이차 손상은 세포사 멸의 과정으로 다양한 세포가 변성되어 괴사를 일으키고, 백색질이 제한되며, 희소돌기아교세포와 미세아교세포
Table 1. Data of Experimental Group
Numbers Medication and dosage Route
Control 3 None None
Group I 12 (4/4/4)* Saline (1 ml/kg) Intra-peritoneal
Group II 12 (4/4/4)* Methylprednisolon (300 mg/kg)+Riluzole (5 mg/kg) Intra-peritoneal
*Sacrifice numbers at postoperative 1st, 4th and 7th day.
등의 변화가 발생된다27,28). 따라서 저자들은 이차 손상 을 중재하기 위하여 척수 손상 급성기에 척수 공동의 억 제 또는 최소화를 위한 치료가 중요하다고 하였고 다양한 신경 보호물질과 세포사멸 조절의 관계에 대한 연구 결과 를 보고한 바 있다16,26).
척수 손상후 회복시 가장 중요한 기전은 축색의 재생이 지만, 중추신경계가 손상되면 수초에서 유도된 단백질, 반응성 성상세포에서 유도된 황산 콘드로이틴 단백다당 (Chondroitin Sulfate Proteoglycans, CSPG), 비 아교 반흔 조직에서 유도된 Semaphorin 등과 같은 억제 물질 이 분비된다15,20,21). 세포사멸의 신호전달체계 중 MAPK 경로는 c-JUN, ATF-2, p53, ELK-1 등이 중재하는 데, c-JUN은 JNK에 작용하여 신경세포의 분화에 관여
한다18,25,29). ATF-2는 p38과 JNK에 작용하여 세포사
멸에 직접적으로 작용하는 인자이고, p53은 종양억제 유 전자로 역시 JNK에 작용하여 세포사멸에 관여하며, ELK-1은 세포의 생존에 관여하는 조절인자이다. 본 연 구는 신경보호 작용 및 세포 사멸을 조절하는 것으로 알 려진 메틸프레드니솔론과 riluzole의 투여1,4,21,22,26)
가 아 교 반흔에 어떠한 영향을 주는지에 관하여 아교 반흔에서 확인되는 CSPG의 변화를 살펴보고자 하였다. 또한 두 가지 다른 환경에서 발현되는 독특한 유전자를 분석하는 데 도움을 줄 수 있는 microarray 실험 방법을 이용하여, MAPK 신호전달체계에 관계된 조절인자들 중 c-JUN, ATF-2, p53, ELK-1에 대하여 실험을 시행하였다.
대상 및 방법
1. 실험 동물
이 실험은 본 대학의 실험 동물 관리 위원회의 승인 후 시행되었다. 실험에 사용된 동물은 평균 24주된 수컷 Sprague Dawley rat (SD rat) 30마리로, 수술시 케타 민을 복강내 주입하여 마취를 유도후 제 9-10흉추에 후 궁절제를 시행하여 변형된 NYU 신경 충격기(10 g/20
mm/Ø 3 mm)로 신경손상을 유도하였다. SD rat 30마 리 중 손상을 가하지 않은 3마리를 대조군으로 하였으며, 척수 손상후 Basso, Beattie, Bresnahan (BBB) open- field test3)에서 7점 이하인 동물 24마리를 대상으로 하 였다(총 27마리, 평균 체중 581 g, 범위 427-613 g).
각각 12마리씩 두 개의 군으로 분류하여 I군은 생리식염 수(1 ml/kg)를, II군은 methylprednisolone (300 mg/
kg)과 riluzole (5 mg/kg)을 복강내로 동시 투여하였다 (Table 1). 각 군에서 사용된 약물의 용량은 기존의 연구 를 참고로 하였고26), 모든 동물은 실험 동물 관리에 대한 NIH 지침서에 따라 관리하였다.
2. 운동이상 측정
척수 손상후 뒷다리의 운동 능력은 BBB 점수를 이용 하여 평가하였다3).
3. 조직준비
척추 손상후 1일, 4일 및 7일에 각 군에서 4마리씩 쥐 를 희생시켜 관류고정을 실시하였으며, 조직 절취는 횡 단면으로 손상 부위의 위 아래 조직을 약 1 cm 정도 포함 하여 절취하였다. 적출한 조직은 후고정 후, 30μm 두께 로 냉동절편하여 24-well plate에 모았다. 희생된 쥐의 일부 손상된 척수 조직은 RT-PCR을 위하여 적출 즉시 RNA purification을 시도하였다.
4. CSPG에 대한 RT-PCR과 in situ hybridization 척수 손상 부위를 적출하여 급냉한 후 TRIzol 시약을 이용하여 total RNA를 추출하고, 역전사과정을 거쳐 cDNA를 획득하였다. 그 후 primer를 사용하여 PCR을 실시하여 얻은 PCR product를 얻고, 전사과정을 거쳐 probe를 제작한 후, 역전사 효소 등을 이용하여 tem- plate cDNA를 제작하였다. Thermocycler (Biometra) 를 이용하여 94oC에서 5분간 1주기를 시행한 후 94oC에
Fig. 1. Open field score of the hind limbs after spinal cord injury in each groups. An open field score of 0 means no observable hind limb movement; an open field score 21 means normal hind limb movement.
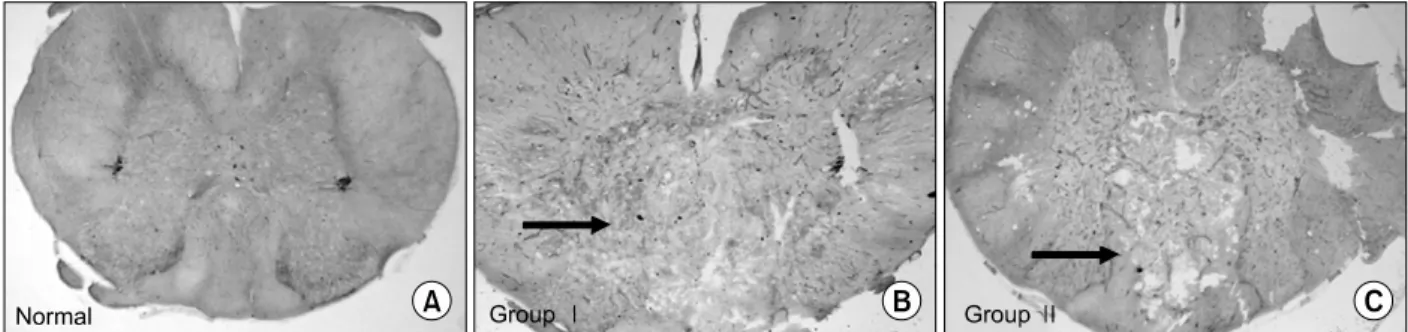
Fig. 2. The immunohistochemical staining result; Noted differences of cavity size and the expression of CSPG (arrow); A (normal), B (group I) and C (group II) at 7th day.
Table 2. DNA Sequence of Transcription Factors
Genes Primer sequences
c-Jun 5'-TTCCGGCTGACTCATCAAGCG-3'
3'-AAGGCCGACTGAGTAGTTCGC-5'
ATF-2 5'-ATTGCCTGACGTCAGAGAGCTAG-3'
3'-TAACGGACTGCAGTCTCTCGATC-5'
p53 5'-TTGGACATGCCCGGGCATGTCCCT-3'
3'-AACCTGTACGGGCCCGTACAGGGA-5'
ELK-1 5'-ACACAGGATGTCCATATTAGGACA-3'
3'-TGTGTCCTACAGGTATAATCCTGT-5' 서 1분, 60oC에서 1분, 72oC에서 1분씩 25주기(증폭된 DNA의 양에 따라 각 유전자마다 주기 조정)를 반복 수행 하여 DNA를 증폭하였다. 증폭된 DNA를 회수하여 2%
agarose gel에 전기영동 한 후 사진을 찍어 정량분석 하 였다. 정량 분석은 β-actin을 대조군으로 하여 비교 분 석하였다.
In situ hybridization 염색은 재수화 과정과 10 ug/ml proteinase K와 PBS를 이용하여 단백질 제거 과 정을 실시하였다. 이후 아세틸화 과정과 전수화 과정을 시행한 후 hybridization buffer와 digoxigenin-labeld cRNA probe를 이용하여 hybridization을 시행하였다.
5. MAPK 경로의 각 조절 인자에 대한 Microarray 현재까지 세포사멸과 관계된 인자로 알려진 tran- scription factor 중 c-Jun, ATF-2, p53, 그리고 Elk- 1에 대한 microarray를 TF chip MAPK kit을 이용하여 실시하였다(Table 2).
Nuclear extract preparation을 실시한 후, 상층의 nuclear extract를 분리하여 영하 80도에서 보관하였다.
Silverquant detection 방법을 이용하여 비교 실험을 계 획하였다. Blocking, incubation, 그리고 binding 과정 을 거친 후 일차항체칵테일을 첨가하였다. 그 후 hybri- dization frame을 제거한 후 biotinylated 2차 항체를 첨가하여 10분간 incubation 시켰다. 그후 silverquant detection을 50분간 시행하여 최종 결과를 관찰한다. 결 과 분석을 위하여 silverquant microarray scanner와 소 프트웨어 프로그램을 이용하였다. 이로써 얻어진 영상을 저장한 후 결과는 각 인자에 대한 발현 상태와 이를 정량화 하여 비교 가능한 corrected value (+SD)을 얻었다.
6. 통계 처리
Student t-test를 사용하여 각 군의 차이를 비교하였 으며, p<0.05 이하이면 유의한 것으로 하였다.
Fig. 3. This picture shows the differences of the expression of CSPG by RT-PCR in each group; more expression of CSPG in group I at 4th and 7th day.
Fig. 4. The results of c-JUN, ATF-2, p53 and ELK-1 by microarray: The changes of c-JUN was on the increase immediately and then drop and increment in group I, but increased with the lapse of time in group II. The degree of c-JUN in group II at 7th day was less than in group I at 1st day. The expression of ATF-2 was increased with the lapse of time but group II was less expressed than group I with statistical differences. In p53, down-regulation with the lapse of time in group I. In group II, down-regulation was noted at 4th day. In ElK-1, up-regulation in group I and II at 4th day, and then plateau in group I, but down-regulation at 7th day in group II.
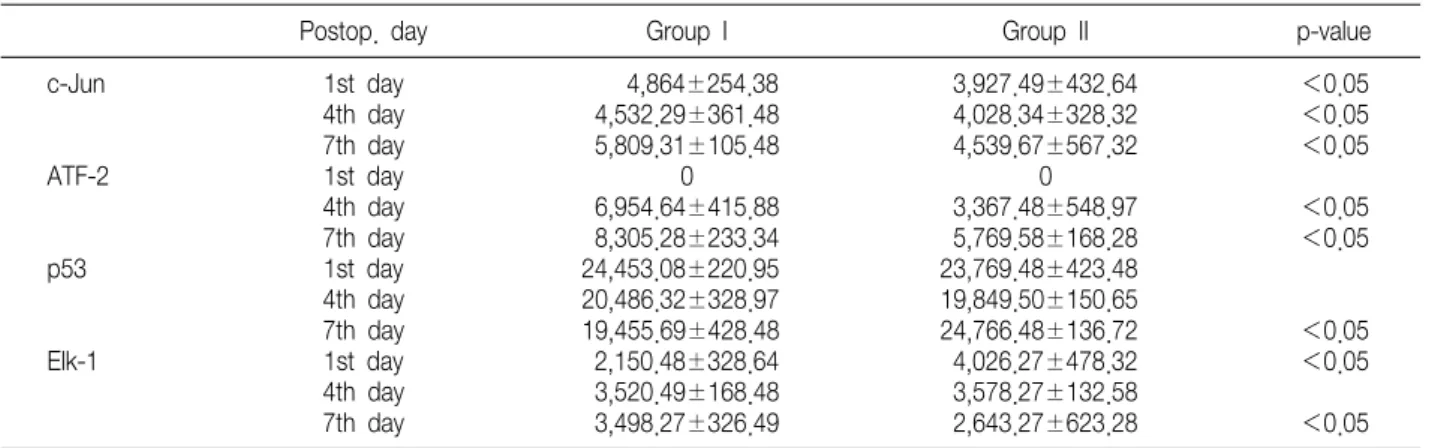
Table 3. Corrected Values of Each Gene Using Microarray Technique
Postop. day Group I Group II p-value
c-Jun 1st day 4,864±254.38 3,927.49±432.64 <0.05
4th day 4,532.29±361.48 4,028.34±328.32 <0.05
7th day 5,809.31±105.48 4,539.67±567.32 <0.05
ATF-2 1st day 0 0
4th day 6,954.64±415.88 3,367.48±548.97 <0.05
7th day 8,305.28±233.34 5,769.58±168.28 <0.05
p53 1st day 24,453.08±220.95 23,769.48±423.48
4th day 20,486.32±328.97 19,849.50±150.65
7th day 19,455.69±428.48 24,766.48±136.72 <0.05
Elk-1 1st day 2,150.48±328.64 4,026.27±478.32 <0.05
4th day 3,520.49±168.48 3,578.27±132.58
7th day 3,498.27±326.49 2,643.27±623.28 <0.05
결 과
1. 각 군의 행동학적 변화
척수 손상 후 1, 4, 7일째의 변화는 I군에서는 6.6, 5.4, 7.8이었으며, II군에서는 7.4, 8.6, 그리고 9.4로 4 일째에서는 두 군간에 통계학적 차이를 보였으나(p<
0.05) 1일째와 7일째에서는 차이가 없었다(Fig. 1).
2. CSPG에 대한 면역조직화학 검사
정상 군에서 CSPG의 발현은 볼 수 없었다. 7일째의 조직 사진만을 비교하여 보면 I군에서는 백색질과 일부 회백질을 포함하는 척수 공동이 형성되었으며 CSPG의 발현을 의미하는 갈색으로 염색되는 부분이 다수 발견되 었다. II군에서는 비교적 회백질이 보존됨을 알 수 있고 CSPG도 척수 공동의 후외측 일부에서 발현되었다(Fig. 2)
3. CSPG에 대한 RT-PCR
각 시기에서 대조군 β-actin의 양은 정확히 발현되었 으며, 총 2 ug의 RNA를 분석하였다. 4일째와 7일째의
RT-PCR 결과에서 분명한 두 군간의 차이를 볼 수 있었 다. 이를 정량화한 OD determination결과에서는 4일째 에는 2.06 (ratie=Group I/Group II), 7일째에서는 2.11 (ratio=Group I/Group II)로 나타났다(Fig. 3).
4. Microarray에 의한 각 조절 인자의 변화 1) c-Jun의 변화
수상 후 1일, 4일, 7일째에 I군에서는 수상 후 즉시 증
가하고 일정시간 감소 후 다시 증가하는 양상을 보였다.
II군은 모든 시기에서 I군보다 적게 발현되었다(p<
0.05). II군에서 시간의 경과에 따라 발현이 증가되는 양 상을 보였으나 7일째에도 I군보다 적게 발현되었다 (Table 3, Fig. 4).
2) ATF-2의 변화
다른 인자와 달리 1일째 두 군 모두에서 발현되지 않았 다. 이는 조절인자는 척수 손상후 일정 기간 경과된 후 반응하는 것으로 해석되나 본 연구에서는 1일과 4일, 즉 72시간의 간격이 있기에 정확한 발현 시기를 알 수는 없 었다. 시간이 경과할수록 두 군에서 발현이 모두 up- regulation되는 양상을 보였다. 4일째와 7일째는 II군이 I군보다 적게 발현되었다(p<0.05, Table 3, Fig. 4).
3) p53의 변화
I군에서는 시간이 경과할 수록 down-regulation되는 양상을 보였으나, II군에서는 4일째 감소하고 7일째 증가 하는 양상을 보였다(Fig. 4). 7일째는 I군이 II군보다 적 게 발현되었다(p<0.05, Table 3).
4) Elk-1의 변화
I군에서는 4일째 up-regualtion되고 그 이후는 pla- teau양상을 보였으나, II군에서는 4일째 up-regula- tion, 7일째 down-regulation 양상을 보였다(Fig. 4).
1일째는 I군에서 적게 발현되었으며(p<0.05), 7일째는 II군에서 적게 발현되었다(p<0.05, Table 3).
고 찰
척수 손상의 치료로 현재 임상에서 쓰이고 있는 방법은 스테로이드의 대량 투여이다. 유럽 경추 학회의 보고에 따르면 75%가 NASCIS II와 NASCIS III의 방법으로 외 상성 척수 손상시 스테로이드를 투여하며4), 이들 중 1/3 은 효능에 대하여 확실한 입증을 할 수는 없지만, 스테로 이드의 투여가 위험성 보다 잠재적인 효과가 더 가치가 있다고 판단하고 있다19). 스테로이드는 항산화 및 항염 증 효과를 가지며, 손상 직후에 유발되는 일련의 조직 파 괴를 예방하지만, 그 효과에 대한 의문 및 고용량 투여로 인한 전신적 문제가 발생할 수 있다. 따라서 최근에는 부 작용을 최소화하고 스테로이드와 유사한 효능을 가진 신
경보호 물질의 개발 및 약제의 병용투여 방법이 개발되고 있다2,26).
Riluzole은 Na/Ca 통로 차단제로 급성 및 아급성기 척수 손상 치료에 유효한 결과를 보이는 것으로 알려져
있다1,22). 작용기전으로는 Na 통로를 차단하며, 특히 손
상되어 있는 신경의 Na 통로에 더욱 잘 결합하여 신경 시냅스 말단에서 glutamate 분비를 억제한다. 또한 신경 보호 활성을 갖는 high voltage-gated N-type과 P/Q type의 Ca 통로를 차단하며, Ca 통로가 시냅스 말단에서 신경 전달 물질의 분비를 조절하기 때문에 riluzole의 Ca 통로 차단은 glutamate 분비를 감소시킨다10,26). 양 등의 다양한 신경 보호 물질과 세포 사멸과의 관계를 알아본 실험에서도 메틸프레드니솔론과 riluzole이 세포사멸에 대한 효과가 우수함을 발표한 바 있다26). 따라서 본 연구 는 메틸프레드니솔론과 riluzole의 동시 투여가 척수 손 상 치료시 어떠한 효과가 있는지 연구를 계획하였으며, 특히 축색 재생에 관하여 신경 조절 인자의 변화를 살펴 보고자 하였다.
중추신경계 재생을 방해하는 원인은 주로 손상 부위에 밀집된 아교 반흔 때문이라 하며8,24), 신경 반흔은 세포분 자적 장애물(molecular barrier)로 여겨지고 있다. 신경 손상 부위에서 합성된 프로테오글리칸(proteglycan) 중 CSPG는 주요 억제성 단백다당으로, 하위 그룹에는 NG2, 뉴로칸, 버지칸, 브레비칸, 포스포칸이 있는데 이것들은 성장촉진 물질인 라미닌(laminin)에 결합하여 신경 돌기 가 밖으로 성장하는 것을 막는다고 한다5,9,12,13,17,21,23)
. 프로테오글리칸 중 일부는 축색 재생을 억제하거나 촉진 시킬 수 있는데, tenascin은 신경돌기의 생성을 억제하 는 것뿐만 아니라 CSPG에 결합할 수 있고6,9), 네트린과 세마포린(semaphorins)은 발현하는 동안 축색의 안내 자 역할을 해주는 물질이다14). 최근 연구는 아교 반흔에 서 신경 재생을 방해하는 물질로 CSPG를 주목하였으며, 반복된 chondroitinase ABC 투여로 CSPG를 제거하면 중추신경계 손상 부위에서 축색이 재생된다고 하였다5,11). 본 연구에서 메틸프레드니솔론/riluzole 동시 투여로 척 수 손상후 4일째와 7일째 CSPG의 발현이 대조군에 비해 2 배 이상 감소된 것을 알 수 있었다. 또한 동시 투여로 척수공동의 크기가 대조군에 비해 감소되었으며, CSPG 로 염색된 수도 감소하였다. 이것은 행동학적 결과와 일 부 일치하는 소견으로 사료된다. 다만 이상의 결과가 두
약제의 상승 효과인지, 아니면 각각의 효과 및 기능이 합 쳐진 것인지에 관하여는 약물 역동학적 연구가 추가로 필 요할 것이며 또한 축색 재생을 방해하는 물질 중 CSPG 하나만을 실험한 것이기에 추후 NogoA/MAG/OMgp경 로7)와 semaphorin 3A14)와 연관된 경로에 이들 약제가 어떠한 효과가 있는지에 관한 추가 연구가 필요할 것이 다.
MAPK 경로와 세포사멸의 관계는 척수 손상후 중추신 경계의 TNF α 농축과 밀접한 관련이 있다18,23). TNF α는 TNFR1에 결합하면 세포사멸이 진행하며, 이 전달 경로는 어댑터 단백질인 TNFR-associated factor 2 (TRAF2)가 TNFR-associated death domain (TRADD) 에 결합되면서 시작된다. TRAF2가 결합되면 결과적으 로 MAPK인 apoptosis-stimulated kinase 1 (ASK1) 가 활성된다. 그 후 ASK1이 MAPK의 전달경로를 경유 하는데, 이것은 Ras가 pro-apoptotic MAP kinase JNK 와 p38을 활성화하는 것과 유사하다. 개개의 JNK는 부 세포예정사(pro-apoptotic) 집단인 Bcl-2 family와의 발현을 조절하고, 이로써 세포사멸을 야기시킨다. 따라 서 JNK와 연관된 조절인자의 발현을 제어할 수 있다면 척수 손상후 이차손상의 중심인 세포사멸의 정도를 줄일 수 있을 것이다.
p53은 최근의 연구에서는 발현의 증가가 JNK 경로를 활성화 시켜 세포 사멸과 관계가 있다고 한다18). 본 실험 결과에서는 생리식염수 투여 군에서는 시간이 경과할수 록 down-regulation되는 양상을 보였다. 반면에 동시 투여 군에서는 4일째 감소하고 7일째 증가하였다. 이는 척수 손상후 p53의 최대 발현시기가 어느 시점인가에 따 라 두 약제의 유용성을 평가 할 수 있을 것인데 이에 대하 여는 추가적인 연구가 필요하다.
c-JUN은 JNK 경로에 작용하는데, c-JUN의 발현 증 가는 이차적으로 세포사멸과 관련 있다18,25,29). 본 연구 에서 시간이 경과할수록 c-Jun발현의 증가를 볼 수 있 다. 그러나 동시투여 군은 모두 대조군과 비교시 유의하 게 적게 발현되었는데 이 조절 인자만을 볼 때 두 약제의 동시 투여가 더 우수한 결과를 기대할 수 있을 것이다.
MAPK 경로와 관계되어 세포의 생존과 관계된 ATF-2 의 변화는 감소 양상을 보여야 세포 생존과 관련이 있는 것으로 본 실험에서는 다른 인자와 달리 1일째 두 군 모 두에서 발현이 되지 않아, 척수 손상후 일정 기간 경과된
후 반응하는 것으로 해석되나 본 연구에서는 척수 손상후 정확한 발현 시기를 알 수는 없었다. 이 인자는 두 군에서 모두 시간이 경과함에 따라 그 발현 정도가 up-regu- lation되는 양상을 보였으나 동시 투여 군에서 그 발현 정도가 감소되었다는 점이 의미가 있을 것이다. Elk-1 는 ERK1/2, JNK, 그리고 p38과 연관된 조절 인자로 이 는 세포의 분화와 생존에 관계된 인자이다. 본 연구 결과 는 생리식염수 투여 군에서는 up-regualtion 후 plateau를 이루는 양상이었으나, 동시 투여 군에서는 증 가 후 감소의 양상으로 이 부분의 해석에 어려움이 있었 다. 즉, 1일째는 II군에서 많이 발현되었고, 7일째에는 I 군이 많이 발현되었다. 그러나 본 연구는 동시 투여에 따 른 인자의 변화 양상을 살펴 본 것에만 의미를 두기로 하 였으며 ElK의 다양한 변화가 신경 보호적인 면에서 어떠 한 의미가 있는지에 관하여는 추후 연구가 필요하다.
행동학적 결과와 일부 면역조직화학검사, RT-PCR, 그리고 microarray의 결과가 일치하는 점도 있고 또한 기존의 연구 결과와 본 실험의 연구 결과를 종합해 볼 때 7일 째 행동학적 평가가 차이가 나지 않은 점은 또 다른 축색 재생 방해 인자의 존재 또는 본 실험 동물이 설치류 라는 점도 생각해 볼 수 있을 것이다. 또한 양과 Riew의 연구 결과26)와 본 실험 결과와 비교 분석은 실험 방법의 차이, 즉 본 실험에서는 CSPG의 변화와 microarray 검 사를 통한 조절 인자의 변화로 세포사멸과의 관계를 분석 한 점 등으로 정확히 단독 투여와 병용 투여의 차이를 비 교할 수 없었다. 그러나 본 실험에 사용된 메틸프레드니 솔론과 riluzole이 다양한 MAPK 조절 인자의 변화를 보 였고, 또한 아교 반흔에서 생성되는 CSPG를 감소시킬 수 있다는 결과만으로도 추후 급성 척수 손상의 급성기 치료에서 두 약제의 추가적인 신경 보호 물질로서의 임상 적 유용성에 관한 연구의 기초 자료로 본 연구에 의의가 있다고 생각된다. 또한 microarray 실험 방법이 향후 척 수 손상 후 다양한 유전자의 변화 관찰에 시간적, 그리고 보다 정량화된 연구 결과 제시에 유용하리라 사료된다.
결 론
메틸프레드니솔론과 riluzole의 동시 투여가 다양한 MAPK 조절 인자의 변화를 보였고, 또한 아교 반흔에서 생성되는 CSPG를 감소시킬 수 있었다. 따라서 추후 척 수 손상의 급성기 치료에 두 약제가 신경 보호 물질로서
임상적 유용성이 있을 것으로 사료된다.
참고문헌
1. Ates O, Cayli SR, Gurses I, et al: Comparative neuro- protective effect of sodium channel blockers after experimental spinal cord injury. J Clin Neurosci, 14: 658-665, 2007.
2. Baptiste DC, Fehlings MG: Pharmacological approaches to repair the injured spinal cord. J Neurotrauma, 23: 318-334, 2006.
3. Basso DM, Beattie MS, Bresnahan JC: Graded histological and locomotor outcomes after spinal cord contusion using the NYU weight-drop device versus transection. Exp Neurol, 139:
244-256, 1996.
4. Bracken MB, Shepard MJ, Collins WF, et al: A rando- mized, controlled trial of methylprednisolone or naloxone in the treatment of acute spinal-cord injury. Results of the Second National Acute Spinal Cord Injury Study. N Engl J Med, 322:
1405-1411, 1990.
5. Bradbury EJ, Moon LD, Popat RJ, et al: Chondroitinase ABC promotes functional recovery after spinal cord injury.
Nature, 416: 636-640, 2002.
6. Deckner M, Lindholm T, Cullheim S, Risling M:
Differential expression of tenascin-C, tenascin-R, tenascin/J1, and tenascin-X in spinal cord scar tissue and in the olfactory system. Exp Neurol, 166: 350-362, 2000.
7. Domeniconi M, Cao Z, Spencer T, et al: Myelin-associated glycoprotein interacts with the Nogo66 receptor to inhibit neurite outgrowth. Neuron, 35: 283-290, 2002.
8. Fawcett JW, Asher RA: The glial scar and central nervous system repair. Brain Res Bull, 49: 377-391, 1999.
9. Frisén J, Haegerstrand A, Risling M, et al: Spinal axons in central nervous system scar tissue are closely related to laminin-immunoreactive astrocytes. Neuroscience, 65: 293-304, 1995.
10. Huang CS, Song JH, Nagata K, Yeh JZ, Narahashi T:
Effects of the neuroprotective agent riluzole on the high voltage-activated calcium channels of rat dorsal root ganglion neurons. J Pharmacol Exp Ther, 282: 1280-1290, 1997.
11. Ikegami T, Nakamura M, Yamane J, et al: Chondroitinase ABC combined with neural stem/progenitor cell transplanta-
tion enhances graft cell migration and outgrowth of growth- associated protein-43-positive fibers after rat spinal cord injury.
Eur J Neurosci, 22: 3036-3046, 2005.
12. Jones LL, Margolis RU, Tuszynski MH: The chondroitin sulfate proteoglycans neurocan, brevican, phosphacan, and ver- sican are differentially regulated following spinal cord injury.
Exp Neurol, 182: 399-411, 2003.
13. Jones LL, Sajed D, Tuszynski MH: Axonal regeneration through regions of chondroitin sulfate proteoglycan deposition after spinal cord injury: a balance of permissiveness and inhibition. J Neurosci, 23: 9276-9288, 2003.
14. Kaneko S, Iwanami A, Nakamura M, et al: A selective Sema3A inhibitor enhances regenerative responses and func- tional recovery of the injured spinal cord. Nat Med, 12: 1380- 1389, 2006.
15. Kikuchi K, Kishino A, Konishi O, et al: In vitro and in vivo characterization of a novel semaphorin 3A inhibitor, SM-216289 or xanthofulvin. J Biol Chem, 278: 42985-42991, 2003.
16. Lee HH, Yang JY, Lee JK: The impact of combined treat- ments with aminoguanidine and methylprednisolone on neu- rological recovery after spinal cord injury. J Korean Orthop Assoc, 42: 444-452, 2007.
17. Lemons ML, Howland DR, Anderson DK: Chondroitin sulfate proteoglycan immunoreactivity increases following spinal cord injury and transplantation. Exp Neurol, 160:
51-65, 1999.
18. Liou AK, Clark RS, Henshall DC, Yin XM, Chen J: To die or not to die for neurons in ischemia, traumatic brain injury and epilepsy: a review on the stress-activated signaling pathways and apoptotic pathways. Prog Neurobiol, 69: 103- 142, 2003.
19. Matsumoto T, Tamaki T, Kawakami M, Yoshida M, Ando M, Yamada H: Early complications of high-dose methylprednisolone sodium succinate treatment in the follow- up of acute cervical spinal cord injury. Spine, 26: 426-430, 2001.
20. Morgenstern DA, Asher RA, Fawcett JW: Chondroitin sulphate proteoglycans in the CNS injury response. Prog Brain Res, 137: 313-332, 2002.
21. Mu X, Azbill RD, Springer JE: Riluzole improves measures of oxidative stress following traumatic spinal cord injury.
Brain Res, 870: 66-72, 2000.
22. Nógrádi A, Szabó A, Pintér S, Vrbová G: Delayed riluzole treatment is able to rescue I njured rat spinal motoneurons.
Neuroscience, 144: 431-438, 2007.
23. Plant GW, Bates ML, Bunge MB: Inhibitory proteoglycan immunoreactivity is higher at the caudal than the rostral Schwann cell graft-transected spinal cord interface. Mol Cell Neurosci, 17: 471-487, 2001.
24. Silver J, Miller JH: Regeneration beyond the glial scar. Nat Rev Neurosci, 5: 146-156, 2004.
25. Sun W, Gould TW, Newbern J, et al: Phosphorylation of c-Jun in avian and mammalian motoneurons in vivo during programmed cell death: an early reversible event in the apop- totic cascade. J Neurosci, 25: 5595-5603, 2005.
26. Yang JY, Daniel RK: Agonist for the control of apoptosis through the study of cytokine expression after spinal cord injury in Rats. J Korean Orthop Assoc, 42: 106-114, 2007.
27. Yang JY, Kim HS, Lee JK: Changes in nitric oxide synthase expression in young and adult rats after spinal cord injury.
Spinal Cord, 45: 731-738, 2007.
28. Yang JY, Lee JK, Kim KT, Lee HH, Byun BN, Ahn SH:
The expression and function of the tumor necrosis factor receptor I (TNFRI), TNFRII, and X-linked inhibitor of apop- tosis genes after spinal cord injury in rats. J Korean Soc Spine Surg, 11: 14-23, 2004.
29. Yin KJ, Kim GM, Lee JM, He YY, Xu J, Hsu CY: JNK activation contributes to DP5 induction and apoptosis follow- ing traumatic spinal cord injury. Neurobiol Dis, 20: 881-889, 2005.
= 국문초록=
목 적: 척수 손상후 메틸프레드니솔론(MP)과 riluzole의 동시 투여가 축색 재생에 미치는 영향을 알아보고자 하였다.
대상 및 방법: 24주된 수컷 Sprague Dawley rat 30마리 중 척수 손상후 BBB점수에서 7점 이하인 동물 24 마리를 실험군, 3마리를 대조군으로 하였다. I군(12마리)은 생리식염수(1 ml/kg)를, II군(12마리)은 MP (300 mg/kg)와 riluzole (5 mg/kg)을 복강내로 동시 투여하였다. 손상후 1일, 4일 및 7일에 4마리씩 쥐를 희생시켜, 행동 검사, 황산 콘드로이틴 단백다당(CSPG)에 대한 면역조직화학 검사, RT-PCR, 그리고 c-JUN, ATF-2, p53, Elk-1에 대한 microarray를 시행하였다.
결 과: 행동 평가는 4일째만 II군이 더 우수한 결과를 보였다(p<0.05). CSPG는 RT-PCR결과 4일과 7일째 I군에 서 두배 이상의 발현을 보였다. Microarray에서 c-JUN은 II군이 모든 시기에서 I군보다 적게 발현되었고, ATF-2 는 4일과 7일째 II군이 I군보다 적게 발현되었으며, p53은 7일째 I군이 II군보다 적게 발현되었다(p<0.05).
Elk-1은 1일째 I군에서 적게 발현되었으며, 7일째는 II군에서 적게 발현되었다(p<0.05).
결 론: MP와 riluzole의 동시 투여가 다양한 MAPK 조절 인자의 변화와 CSPG를 감소시킬 수 있었으며, 따라서 이 방법이 축색 재생에 도움을 줄 수 있을 것이다.
색인 단어: 척수 손상, 메틸프레드니솔론, Riluzole