DOI 10.17480/psk.2015.59.1.29
생리학 기반 약물동태(PBPK, Physiologically Based Pharmacokinetic) 모델링을 이용한 소아 약물 동태 예측 연구
신나영 · 박민호 · 신영근# 충남대학교 약학대학
(Received January 21, 2015; Revised February 27, 2015; Accepted February 27, 2015)
Application of Physiologically Based Pharmacokinetic (PBPK) Modeling in Prediction of Pediatric Pharmacokinetics
Na-Young Shin, Minho Park and Young Geun Shin#
College of Pharmacy, Chungnam National University, Daejeon 305-764, Korea
Abstract — In recent years, physiologically based pharmacokinetic (PBPK) modeling has been widely used in phar- maceutical industries as well as regulatory health authorities for drug discovery and development. Several application areas of PBPK have been introduced so far including drug-drug interaction prediction, transporter-mediated interaction prediction, and pediatric PK prediction. The purpose of this review is to introduce PBPK and illustrates one of its application areas, particularly pediatric PK prediction by utilizing existing adult PK data and in vitro data. The evaluation of the initial PBPK for adult was done by comparing with experimental PK profiles and the scaling from adult to pediatric was conducted using age-related changes in size such as tissue compartments, and protein binding etc. Sotalol and lorazepam were selected in this review as model drugs for this purpose and were re-evaluated using the PBPK models by GastroPlus®. The challenges and strategies of PBPK models using adult PK data as well as appropriate in vitro assay data for extrapolating pediatric PK at various ages were also discussed in this paper.
Keywords □ physiologically based pharmacokinetic (PBPK) models, pediatric PK, GastroPlus®
생리학 기반 약물동태(PBPK, physiologically based phar- macokinetic) 모델링은 최근 신약검색 및 개발과정에 있어서 다 국적 제약사 및 US FDA(food and drug administration), EMA (european medicines agency), MHLW(ministry of health labor and welfare) 등을 중심으로 널리 사용되고 있다. 이러한 생리학 기반 약물동태 모델링은 다양한 동물 실험을 통하여 개 발된 PBPK 모델에 사람의 생리학적인 특성을 적용하여 사람의 PBPK 모델을 개발해 사람의 혈중과 표적장기에서 약물의 농도
를 예측할 수 있어 다른 어떠한 PK 모델보다 유용한 점이 많 다. 이러한 이유 등으로 인해 PBPK 모델은 현재 미국 FDA, 유럽 EMA, 일본 MHLW 등지에서 약물-약물 상호 작용 등 일 부 임상시험에서는 실제 임상 결과를 보다 효율적으로 예측할 수 있는 좋은 방법으로 소개되고 있고, 해당 가이드라인에 평가 방법의 하나로도 소개되고 있다.
본 논문은 국내에서는 관련 자료나 연구가 다소 미흡한 PBPK 모델을 소개하고, GastroPlus®라는 in silico 프로그램과 여러 논문들로부터 구한 in vitro 결과를 이용하여 PBPK 모델 을 검증하고, 이를 토대로 수행한 소아 PBPK 모델링 및 시뮬레 이션 사례를 소개하고자 한다. 이를 위해 문헌에 보고된 바 있는 sotalol 및 lorazepam의 성인의 PK를 재검증하고, 이를 통한 소 아 PBPK 모델링 및 시뮬레이션 응용, 아울러 PBPK에 대한 장 점과 앞으로 개선하여야 할 부분에 대해서 고찰하고자 한다.
#
Corresponding Author Young Geun Shin
College of Pharmacy, Chungnam National University, Daejeon 305-764, Korea
Tel.: 042-821-5931 Fax.: 042-823-6566 E-mail: yshin@cnu.ac.kr
Short Report
종설본 론
PBPK란 무엇인가?
생리학 기반 약물동태(PBPK, physiologically based phar- macokinetic) 모델링은 1937년 Teorell에 의해 개념이 소개된 이후 1960년대 컴퓨터 기술의 도입으로 주목 받아 오다가 최근 에는 신약개발, 특히 초기 약물 개발, 환자 개별적 치료 연구에 전반적으로 활용되고 있다.1) PBPK 모델을 간단히 정의하면, 생 리학적인 특성을 고려한 약물동태학으로, 약물의 체내 동태를 파악하기 위하여 단순한 수학적인 모델(compartment model)을 이용하는 약물동태학과 달리, 약물의 체내 동태를 정확하게 예 측하기 위하여 생리학적 특성을 고려하여 생체를 구성하는 각 조직 및 장기를 혈류와 연결하여 모델링 하는 것을 말한다.2) 최근의 활발한 PBPK 연구는 세가지 요인에 기인한다. 첫째는 연구자들이 쉽게 활용 가능한 in silico와 in vitro 데이터가 많 이 만들어짐에 따라 이러한 in silico 와 in vitro 데이터는 기 존의 in vivo 흡수, 분포, 대사, 배설(ADME) 과정과 관련된 데이터를 대체하여 PBPK 모델링을 가능하게 한다. 일례로, 미 국의 경우에는 PubMed(http://www.ncbi.nlm.nih.gov/pubmed)에 1974년 이래로 1257건의 “PBPK” 모델 관련 참고 문헌이 공 개되어 있다. 둘째는 전임상 시험 연구자, PBPK 모델링 연구 자, 임상 약리학자, 임상의, 통계학자 간의 협업 연구를 통해서 보다 완벽한 인체 내 약물 동태를 예측할 수 있게 되었다. 셋째 는 미국 FDA, 유럽 EMA, 일본 MHLW 에서 신약 승인 과정 에 PBPK 모델링 및 시뮬레이션 결과를 포함시키는 것을 추천 하고 있는 등 인허가 관련 정부 기관들에서 많은 관심을 가지 고 있기 때문이다.3)
PBPK 모델의 가장 큰 장점은 생리학적인 특징과 약물의 특 징, 약물과 생체 반응의 특징(대사, 조직과 혈중 분배) 등을 모 델링에 도입 가능하므로, 다양한 조건에 따른 혈중 농도 및 표 적 장기에서 약물 또는 독성 물질의 농도를 예측할 수 있고, 다 양한 동물 실험을 통하여 개발된 PBPK 모델과 사람의 생리학 적인 특성을 이용하여 사람의 PBPK 모델을 개발하여 혈액과 표적 장기에서 약물의 농도를 예측할 수 있다는 것이다. 또한 다른 동물종간의 예측, 투여경로 변경에 의한 예측, 투여 간격 등 투여 계획 변화에 따른 약물의 혈중 및 조직 분포 예측 등 이 가능하다는 장점도 있다.
PBPK 모델은 3가지 주요 구성요소(system-specific properties, drug properties, and structural properties)로 이루어져 있다.4) 그 중 시스템 특이적 성질(system-specific properties)은 조직 이나 장기의 부피, 혈류, 조직 구성을 포함한다. 약물 특성(drug properties)은 조직 친화성, 혈장 단백 결합력, 세포막 투과성, 효소 안정성, 약물 수송 활성을 포함한다. 마지막으로 구조적 특 성(structural properties)은 혈액 관류에 의해 연결된 체내 조
직과 장기의 해부학적 배열을 포함한다.4)
PBPK 모델링을 활용하는 전략은 “Bottom-up” 방식과
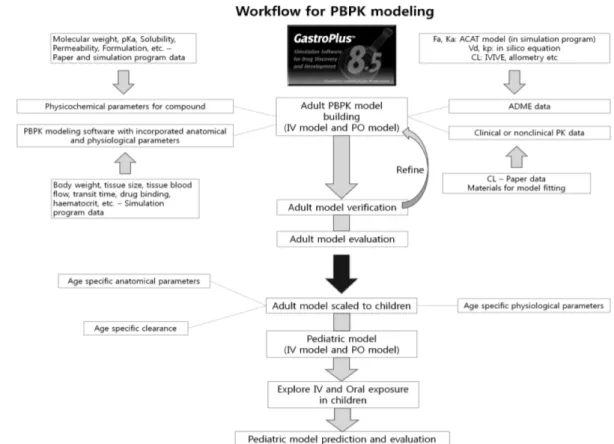
“Middle-out” 방식이 주로 사용된다. “Bottom-up” 방식은 신약 개발 초기에 주로 사용되는 것으로, in silico와 in vitro 단계 데이터를 근간으로 신약 화학물질 특성이 집계되어 pre-clinical 단계의 in vivo 결과를 예상하는데 활용된다. 이 과정에서 PBPK 모델링의 주요 입력 인자에 대한 검증이 중요하며, PBPK 모델링 시뮬레이션 결과값과 in vivo 실험값의 비교를 통해서 검증이 이루어진다. 시뮬레이션 결과값과 in vivo 실험 값 간의 차이가 크다면, PBPK 모델링에 중요한 약물동태 과정 이 간과되거나 주요 입력 인자에 오류가 있을 수 있다는 것을 의미한다. 예를 들면, 동물과 사람과의 대사경로에 있어서의 차 이가 고려되지 않았거나 또는 in vitro 실험에서 제대로 반영이 되지 않은 경우가 해당된다. 특히 in vitro 실험 결과의 유효성 이 전체 PBPK 모델링 정확도에 큰 영향을 준다. PBPK 모델 링의 신뢰성은 Biopharmaceutics Classification System(BCS) class 1과 2에 해당되는 약물이 높다고 알려져 있다.4) “Middle- out” 방식은 임상 데이터가 존재하고 PBPK 입력 인자 예측을 통해서 PBPK 모델링의 정확도가 향상된 이후에 사용 가능한 것으로서, 환자의 특성 변화에 따른 영향을 시뮬레이션 하는데 사용된다. 임상 데이터가 존재하는 경우이므로 시뮬레이션 결과 값과 실험값 간의 차이가 발생하는 것이 일반적이며, 스케일링 (scaling)값을 최적화하는 것이 필요하다. 즉, PBPK 모델링 입 력 인자를 변화시켜 실험값 간의 차이를 줄이는 최적화 단계가 필수적이다. 대사경로에 대한 명확한 이해를 목적으로 추가적인 연구 및 실험을 실시하고, 최적화 단계에서 수정된 PBPK 모델 링 입력 인자를 검증하는 반복적인 활동을 통해서, 궁극적으로 PBPK 모델링은 모든 실험 데이터와 일치해야 한다. 이러한 과 정에서 매개변수 민감도 분석(PSA, parameter sensitivity analysis)이 효과적으로 활용될 수 있다. 관측된 실험 데이터와 시뮬레이션 값과의 차이에 영향을 크게 주는 입력 인자가 무엇 인지 알아냄으로써 어떤 인자에 관심을 두고 검증을 해야 할지 알게 된다.4) PBPK 모델에 의한 신약 개발 과정은 Fig. 1에 자세히 표현되어 있다.5)
구체적인 PBPK 모델링 응용은 (1) 전임상/임상 약물동태 예 측에 사용되는데, 수동적 분포나 흡수 과정에는 정확도가 높으 나, 능동 수송에 의한 흡수와 청소율(clearance) 예측에는 활성 스케일링 인자(activity scaling factor)에 대한 정보가 부족하여 정확도가 낮다. (2) 약물간 상호작용 예측에서, 가역적인 CYPs 단독 억제나 유도의 경우, 예측에 대한 정확성이 중등에서 중상 범위를 가지나 가역적인 시간 의존성 CYPs 억제나 유도 경우 에는 제한된 임상 데이터로 인해 메카니즘 검증에 어려움이 있 어 정확도가 낮다. (3) 특수한 환자 집단 약물동태 예측 측면에 서, 신장이나 간장 질환 환자의 약물동태 예측은 검증에 유효한
임상 데이터 부족으로 현재까지 PBPK 정확도가 낮은 편이다.
한편, 소아 환자 약물동태 예측의 정확도는 중하에서 중등도의 범위를 가지는데 그 원인은 영 · 유아 때의 비CYP 대사 기전과 수송체 매개에 의한 배설 등에 관한 기전, 영 · 유아가 성장하면 서 생성되거나 사라지는 효소나 수송체에 대해 아직 많은 것이 밝혀지지 않은 것으로 유추된다.4)
현재 국내에는 모델을 기반으로 하는 약물동태학(PK, phar- macokinetic)이나 약물동력학(PD, pharmacodynamic) 모델링에 대한 자료는 있었으나 PBPK 모델링에 대한 구체적인 시뮬레이 션을 적용한 논문 사례가 없었다.6,7) 윤휘열은 PK/PD 모델링 과정을 소개하고 활용에 필요한 실제적인 정보뿐 만 아니라 이 론적 PK/PD 모델링 구조 및 지배 방정식 등 심도 있는 분석 을 다루었다.6)오정미는 국내의 모델 기반 약물개발 연구를 포
함하는 pharmacometrics의 적용 범위와 활용 방법을 해외 사 례에 대한 분석을 통해, 국내 의약품 평가의 효율성 증대를 위 한 pharmacometrics 도입 3단계 로드맵을 제시하였고, 국내 의 료 정책 및 관리감독기관의 역할에 대한 전략적이고 실행 가능 한 비전을 소개한 바 있다.7)
PBPK 모델링 과정 및 자료 수집 방법
성인과 소아 PBPK 모델링 개발 과정은 Fig. 2와 같다. 먼저 약물에 대해 기존에 나와있는 논문들의 성인에 대한 sotalol과 lorazepam의 PBPK 모델링을 검증 후 조직이나 기관의 혈류나 부피, 효소 활성 성숙도와 같은 나이에 따른 해부학적, 생리학 적 기능을 고려하여 소아 PBPK 모델을 만들어 시뮬레이션 후 소아 모델을 평가했다.
Fig. 1 − PBPK modeling strategy in drug discovery and development. Initially, the PBPK simulation is performed in animals using animal
PBPK models. If this simulation in animals is reasonable then the healthy volunteer simulation is performed using a human PBPK
model. These simulations can then be extended to various patient or special populations.
성인 PBPK model 개발 − Sotalol과 lorazepam의 PBPK 모델링은 Gastroplus®simulator v8.5라는 프로그램을 이용하여 분석했다.8)이 프로그램은 15개의 장기에 있어서 약물의 흡수, 분포, 대사, 배설 과정과 나이에 따른 해부학적, 생리학적 방대
한 데이터를 가지고 PBPK 모델링을 한다.2)성인 모델 파라미 터에 사용된 sotalol과 lorazepam의 자료는 Table I, II에 나와 있다. 프로그램에 사용된 값과 참고 논문의 값을 비교해서 표기 하였는데 거의 유사했다. 특히 sotalol의 경우 청소율값은 간에
Table I − Input parameters for sotalol PBPK models
Parameter Software value Reference
11,13)value
Molecular weight (g/mol) 272.37 (predicted) 272.37
LogP
(o/w)0.42 (predicted) 0.24
Ionization constant (pKa) 8.33 (acid) (predicted), 9.54 (base) (predicted) 8.38 (acid), 9.47 (base)
Unbound fraction (fu) (%) 48.03 (predicted) 69
Blood/plasma ratio 1.06 (predicted) 0.89
Clearance (CL) (L/h) 9.03 (fixed)
Permeability measure (cm/s*10
−4) 0.97 (predicted) 0.9687
Solubility (mg/m l) 15.84 (pH 8.94) (predicted) 16.25 (pH 8.935)
Table II − Input parameters for lorazepam PBPK models
Parameter Software value Reference value
Molecular weight (g/mol) 321.16 (predicted) 321.16
27)LogP
(o/w)2.6 (predicted) 2.39
21)Ionization constant (pKa) 10.99 (acid) (predicted), 0.9 (base) (predicted) 11.5 (acid)
21), 1.3 (base)
21)Unbound fraction (fu) (%) 6.94 (predicted) 11
21)Blood/plasma ratio 0.74 (predicted) 0.642
21)Clearance (CL) (L/h) 4.3 (fixed) 1.68~7.43
19)Permeability measure (cm/s*10
−4) 2.33 (predicted)
Solubility (mg/m l) 0.024 (pH 6.98)(predicted)
Fig. 2 − Proposed workflow for scaling adult PBPK models toward children.
서 대사되지 않고 거의 신장으로 배설되기 때문에 신장 청소율 (renal clearance) 값을 사용했다. 약물의 흡수는 Gastroplus®내 ACAT®모델을 사용하여 예측했다.8,9)
약물동태학적 자료 − 1) Sotalol
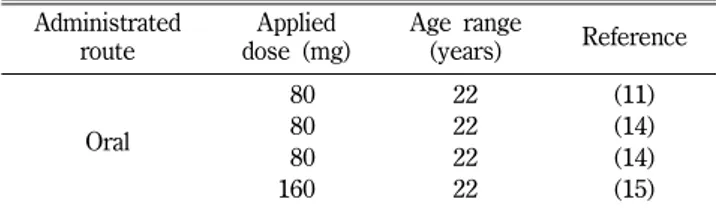
성인의 경우 4개의 경구투여에 대한 PK 연구로부터 얻은 데 이터를 모델 개발에 이용했다11,14,15)(Table III).혈중농도-시간 프로파일은 평균값을 사용하여 자료 중 대표하는 그래프를 나 타내었고, 각 PK 연구로부터의 얻은 농도와 시뮬레이션한 농도 를 비교하였다. 소아의 경우 상심실성 빈맥으로 sotalol를 투여 받고 있는 80명 환아의 나이, 성별, 키, 몸무게, 투여용량, 혈중 농도를 소아 나이그룹별로 나누어 그 실험치를 사용했고 이는 논문에서 얻은 값이다.16)이 소아 데이터는 WHO(world health organization) 분류에 따라 6개의 나이 그룹별로 나누어 평가했 다. 이는 다음과 같다.
㉠ 신생아(neonates): 0~28일
㉡ 영아(infants): 1~11개월
㉢ 유아(toddlers): 12~23개월
㉣ 미취학아동(preschool-aged): 2~5세
㉤ 학령기 아동(school-aged): 6~11세
㉥ 청소년(adolescents): 12~18세 2) Lorazepam
성인의 경우 2개의 PK 연구로부터 얻은 데이터를 모델 개발 에 이용했다(Table IV).17,18)혈중농도-시간 프로파일은 평균값을 사용하여 대표하는 그래프를 나타내었고, 각 PK 연구로부터의 얻은 농도와 시뮬레이션한 농도를 비교했다.
소아의 경우도 2개의 PK 연구로부터 얻은 데이터를 모델개 발에 이용했고, 용량별(0.05 mg/kg, 0.1 mg/kg), 평균 나이별(2.7 세, 7세)로 나누어 분석했다.19,20)
PK simulation − Sotalol과 lorazepam의 모델 개발 시 사용 된 예측 데이터는 100명의 가상 집단으로 분석했고, 각각의 실 측 데이터에 따라 성별, 나이, 인종, 용량을 동등하게 하여 분석 했다. Simulation에 사용된 청소율 값은 sotalol의 경우 J.
Poirier 등의 논문을 기준으로 사용했고, 이를 기준으로 몸무게 와 나이 등에 따른 PBPK 모델에 따라 자동 조정되는 청소율 값을 사용했다.12) Sotalol은 간에서 대사가 거의 안되고 신장으 로 배설되어 간 청소율이 아닌 신장 청소율 만을 사용했다.
Lorazepam의 청소율 값은 Maharaj 등의 논문을 기준으로 사용 했고, 이를 기준으로 몸무게와 나이 등에 따른 PBPK 모델에 따라 자동 조정되는 청소율 값을 사용했다.21)모델링에 사용된 파라미터는 실측치와 예측치의 차이를 최소화하기 위해 다소 조 정되었다. Table I, II에 시뮬레이션에 사용된 파라미터가 표로 나와있다.
소아 PBPK model 개발 − 성인모델 검증 후 나이에 따른 소아의 해부학적 · 생리학적 파라미터와 청소율 값을 고려하여 소아모델이 시뮬레이션 되었다. 성인의 청소율 값을 소아에 스 케일링하기 위해 소아의 나이에 따라 체중, 배설 장기의 중량과 혈류, 혈장단백 등에 차이를 software 내에서 분석하여 자동 조 정되었다. 소아모델에서도 예측 데이터는 100명의 가상 집단으 로 분석되었고 각각의 실측데이터에 따라 성별, 나이, 인종, 용 량을 동등하게 하여 분석되었다.
모델 정확도 평가 − 예측 혈중농도-시간 프로파일과 실측 혈 중농도-시간을 같은 그래프에 표시하여 실측치와 예측치의 일치 정도를 육안으로 평가했다. 또한 예측치의 5 percentile과 95 percentile로 분석하여 실험치와 비교 평가했다. 그리고 약물 농 도의 예측 · 실측치 비를 계산하여 구한 후 성인 데이터 시뮬레 이션에 대한 정확도를 비교 평가했다. 이론적으로는 실측치와 예측치가 일치하는 것이 가장 이상적이나 임상적으로 유의한 의 미가 있는 실측치를 기준으로 2배 오차 범위(two-fold error range(0.5~2)) 내에서 모델 검증 및 평가 했다.10,21) 또한 모델의 정확도를 수치적으로 표현하기 위해 average fold error (AFE) 를 사용했고 그 공식은 다음과 같다. AFE 방식으로 데이터를 분석했을 때 2배 오차 범위(two-fold error range)는 ±0.3이다.
(1)
예시 1. Sotalol에 대한 성인 PK 검증과 소아 PBPK 모델 링 및 시뮬레이션 결과
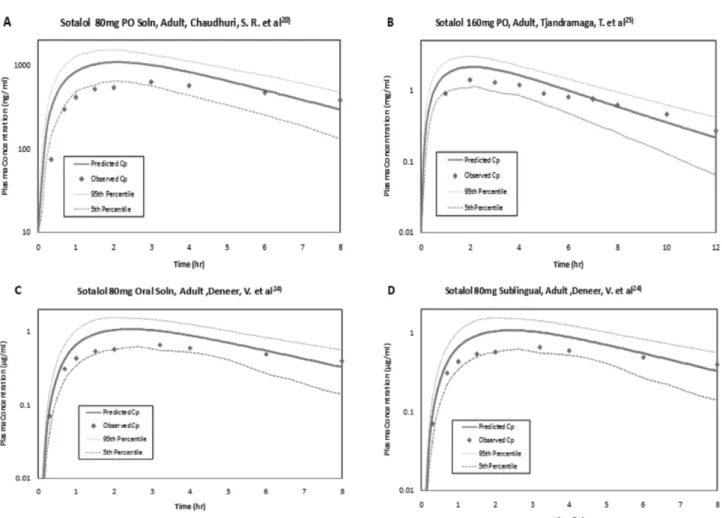
Sotalol에 대한 성인의 PK 검증 − 4개의 PK 연구로부터 얻 은 데이터를 각각 평균 예측 혈중농도-시간 프로파일과 평균 실 측 혈중농도-시간 프로파일로 같은 그래프 안에 나타내었고, Fig. 3에 대표하는 그래프가 나와있다.
Fig 3은 sotalol을 경구 투여했을 때 혈중농도-시간 프로파일 AFE=1
n--- Cpredicted Cobserved ---
⎝ ⎠
⎛ ⎞
∑
logTable III − Population characteristics and dosing information of the
pharmacokinetic studies used in the development and validation of the sotalol adult PBPK model
Administrated route
Applied dose (mg)
Age range
(years) Reference
Oral
080
22 (11)
080
22 (14)
080
22 (14)
160 22 (15)
Table IV − Population characteristics and dosing information of the pharmacokinetic studies used in the development and validation of the lorazepam adult PBPK model Administrated
route
Applied dose (mg)
Mean age
(years) References
Intravenous 2 22 (18)
2 39 (17)
이다. Fig 3에서 볼 수 있듯이, 성인 PK 연구 4가지 모두 5~
95 percentile 예측치 범위 내에 있다. 하지만 전체적으로 Cmax 이전의 농도가 5 percentile 예측치 부근에 있는 것을 확인할
수 있다. Software의 약물 흡수도 예측이 실제 약물 흡수도보다 적은 것으로 추측된다. 이것은 시뮬레이션 software의 흡수에 관한 예측 요소가 좀 더 개선 또는 최적화 될 필요가 있다는 것을 보여준다.
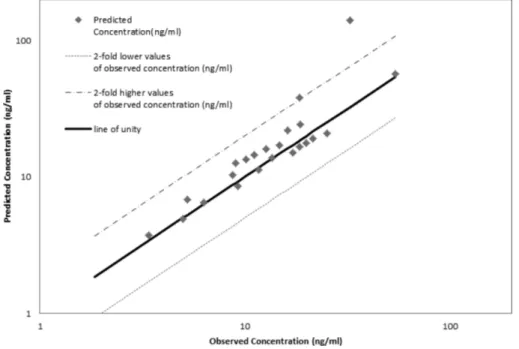
4개의 PK 연구 자료를 분석하여 예측한 혈중농도와 실측 혈 중농도를 Fig. 4에서 비교했다. 시뮬레이션 모델의 정확도를 수 치적으로 표현하기 위해 사용한 AFE 값은 0.06이다. 대부분의 데이터가 2배의 오차 범위 내에 있다.
Sotalol의 소아 PBPK 모델링 및 시뮬레이션 − 성인모델 분석 검증 후 나이에 따른 소아의 해부학적 · 생리학적 파라미터와 청 소율값을 고려하여 PK 연구로부터 얻은 데이터를 소아의 연령 별로 구분하여 성인과 같은 방법으로 각각 평균 예측 혈중농도- 시간 프로파일과 평균 실측 혈중농도-시간 프로파일로 같은 그 래프 안에 나타내었다. Fig. 5는 11일에서 17.7세 사이의 80명 의 환아에게 sotalol을 경구로 1.0~9.9 mg/kg/day 투여했을 때 WHO의 소아 연령 분류에 따라 6개로 분류하여 구한 실측값과 예측값의 혈중농도-시간 그래프다. Fig. 5A~C는 실측치 그래프 가 예측치 그래프의 2배 오차범위 내에 있다. Fig. 5D~F는 약
Fig. 3 − Concentration-time profile for predicted (lines mean, 5-95th percentiles, min/max) and mean observed (dots) data for adult data of
sotalol.
Fig. 4 − Comparison of predicted concentrations and mean observed
concentrations for adult data of sotalol.
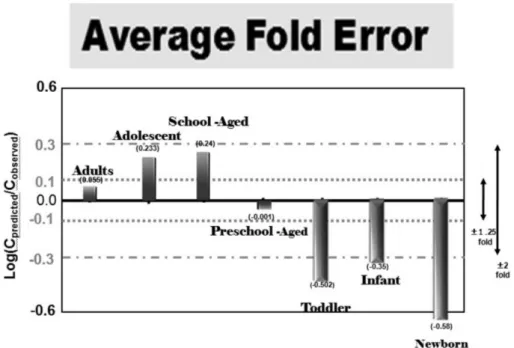
물 투여 후 3시간 전에는 예측치 그래프의 2배 오차범위 내에 있었지만, 그 이후 시간에서는 실측치가 예측치보다 높게 나타 났다. 시뮬레이션 모델의 정확도를 수치적으로 표현하기 위해 사용한 AFE 값은 청소년, 학령기 아동, 미취학 아동, 유아, 영아, 신생아 각각 0.23, 0.24, −0.001, −0.50, −0.35, −0.58이었다.
Fig. 6는 성인과 연령별로 구분한 소아의 AFE값을 비교하여 나타냈는데 그래프에서와 같이 2세 이하인 유아, 영아, 신생아 는 2배 오차 범위에서 벗어남을 확연히 알 수가 있다. 일반적으 로 소아의 약물 흡수과정은 성인의 약물 흡수와 비교할 때 위 장관 부피와 혈류, pH, GET(gastirc empty time), SITT(small
intestinal transit time), 대사 효소, 수송체, 용해도, pKa, 장내 투과성 등에 있어서 다소 차이가 있다고 알려져 있고 따라서 이 에 기인하기 때문인 것으로 보여진다.22)따라서 2세 이하의 소 아에 대한 연구가 미흡하여 문헌으로부터 많은 정보를 얻을 수 없고 이런 다양한 요소가 소아 PBPK 모델링에 포함되지 않아 2배 오차 범위를 벗어난 것으로 생각된다. 또한 sotalol은 특이 한 투과 패턴을 나타내는데 원위 소장부에서는 투과성이 높고 근위 소장부에서는 투과성이 낮아 소장의 분획에 따라 투과성 이 달리 나타나는 경향을 보인다.23) 그리고 영아들의 경우 이런 세포수송시스템이 성인에 비해 더 높게 나온다는 연구 결과도
Fig. 5 − Concentration-time profile for predicted (lines mean, 5-95th percentiles, min/max) and mean observed (dots) pediatric patients data
after various dosing of oral sotalol.
있다.24) 따라서 이런 특이적인 투과 패턴을 모델링에 적용한다 면 보다 더 향상된 모델링이 가능하다고 사료된다.
예시 2. Lorazepam에 대한 성인 PK 검증과 소아 PBPK 모델링 및 시뮬레이션
Lorazepam에 대한 성인의 PK 검증 − 2개의 PK 연구로부 터 얻은 데이터를 각각 평균 예측 혈중농도-시간 프로파일과 평 균 실측 혈중농도-시간 프로파일로 같은 그래프 안에 나타내었 고, Fig. 7에 나와있다. Fig. 7A는 평균나이 22세의 11명의 건 강한 지원자를 대상으로 lorazepam 2 mg을 정맥주사 투여 했 을 때 실측값과 예측값의 혈중농도-시간 그래프로 실측치가 5- 95 percentile 예측치 범위 내에 있다. Fig. 7B는 39세 건강한
남성 지원자에게 2 mg을 정맥 주사 투여 했을 때 실측값과 예 측값의 혈중농도-시간 그래프로 실측치가 5-95 percentile 예측 치 범위 내에 있다. 2개의 PK 연구 자료를 분석하여 예측 혈 중농도와 실측 혈중농도 비교는 Fig. 8에 제시했다. 시뮬레이션 모델의 정확도를 수치적으로 표현하기 위해 사용한 AFE 값은 0.07이었다. 대부분의 데이터가 2배의 오차 범위 내에 있었다.
Lorazepam의 소아 PBPK 모델링 및 시뮬레이션 − 성인모델 분석 검증 후 나이에 따른 소아의 해부적 · 생리학적 파라미터 와 청소율 값을 고려하여 2개의 PK 연구로부터 얻은 데이터를 성인과 같은 방법으로 각각 평균 예측 혈중농도-시간 프로파일 과 평균 실측 혈중농도-시간 프로파일로 같은 그래프 안에 나타 내었다. Fig. 9A는 5개월에서 17세 사이의 63명의 환아를 대상
Fig. 6 − Comparison of average fold error (AFE) in adults oral sotalol studies and children studies from adolescents to neonates.
Fig. 7 − Concentration-time profile for predicted (lines mean, 5-95th percentiles, min/max) and mean observed (dots) data for adult data of
lorazepam.
으로 lorazepam 0.05 mg/kg을 정맥 주사 투여했을 때 실측값 과 예측값의 혈중농도-시간 그래프로 약물 투여 후 5시간 전에 는 예측치 그래프의 2배 오차범위 내에 있었지만, 그 이후 시간 에서는 실측치가 예측치보다 높게 나타났다. Fig. 9B는 6개월에 서 76개월 사이의 환아를 대상으로 lorazepam 0.1 mg/kg을 정 맥 주사 투여 했을 때 실측값과 예측값의 혈중농도-시간 그래프 로 약물 투여 후 5시간 전에는 예측치 그래프의 2배 오차범위 내에 있었지만, 그 이후 시간에서는 실측치가 예측치보다 높게 나타났다. 시뮬레이션 모델의 정확도를 수치적으로 표현하기 위 해 사용한 AFE 값은 −0.86이었다.
PBPK 모델링으로 나이와 몸무게에 따라 예측된 청소율값을 사용하지 않고 논문19,20)에서 구해진 청소율값으로 수정하여 예
측한 결과, Fig. 10과 같은 혈중농도-시간 프로파일을 얻을 수 있었다. 그 결과 실측치가 예측치의 2배 오차 범위 내에 모두 들어왔다. 또한 시뮬레이션 모델의 정확도를 수치적으로 표현하 기 위해 사용한 AFE 값은 0.11이었다.
소아모델의 AFE 값은 −0.86이고, 혈중 농도의 실측치와 예 측치는 2배 오차 범위를 벗어남을 볼 수 있었다. Lorazepam의 대사는 glucuronidation에 의해 이루어지는데, 이 반응은 주로 uridine-5-diphosphate glucuronosyltransferase(UGT) 효소에 의해 이루어진다. 태아의 경우 이 효소의 활성은 성인의 1% 미 만에 달하고 성인 수준에 미치려면 적어도 생후 3년이 지나야 한다.25)그러나 효소활성이 점차 증가하여 생후 1년 동안은 이 효소 활성의 증가로 lorazepam의 청소율이 증가하고, 1~3세
Fig. 9 − Concentration-time profile for predicted (lines mean, 5-95th percentiles, min/max) and mean observed (dots) pediatric patients data
after various dosing of intravenous lorazepam (using scaling CL in GastroPlus).
Fig. 8 − Comparison of predicted concentrations and mean observed concentrations for adult data of lorazepam.
사이의 소아는 평균 나이에 따른 청소율이 성인에 비해 증가한 다. 이러한 이유는 UGT 효소가 성숙되고 성인에 비해 간의 무 게가 증가하여 나타나는 것으로 보여진다.21) 이렇듯 소아의 lorazepam의 대사는 나이에 따라 차이가 있고 복잡하나 이런 특징을 가진 소아의 대사과정이 본 연구에서 시뮬레이션한 소 아 PBPK 모델에 적용되지 않아 오차 범위를 벗어난 것으로 생각된다. 소아의 청소율을 성인모델의 스케일링에 의한 값이 아닌 논문19,20)의 청소율로 수정하여 예측한 결과 Fig. 10에서와 같이 혈중농도-시간 프로파일을 얻을 수 있었다. AFE 값은 0.11이었고, 혈중 농도의 실측치와 예측치는 2배 오차 범위 내에 있음을 보여줬다. 이러한 사실을 토대로 볼 때, lorazepam의 경 우에 있어서 정확한 소아 PBPK 모델링을 위해서는 lorazepam 의 소아 연령별 특징적인 대사 과정을 포함하는 데이터를 구축 하여 모델링을 보완해야 할 필요가 있다.
결 론
현재 국내에서 사용되는 많은 약물은 소아에 대한 안전성 및 유효성에 대한 정보가 부족한 실정이다. 또한 국내외 많은 관련 기관이나 제약사들은 의약품 개발 과정에 소아 관련 평가를 포 함시켜야 할 필요성이 있음을 강조하며 여러 가지 지침을 발표 하고 있다.26)본 연구는 PBPK 모델의 전반적인 소개와 그 응 용 사례를 소개하고, 특히 검증된 성인 PBPK 모델을 통한 소 아 약물 농도 예측에 대한 응용 가능성을 제시하고자 하였다.
PBPK 모델은 성인 데이터가 유용하다면 소아 약물 농도-시간 프로파일을 예측하는데 널리 사용될 수 있으며, 이를 통해 소아 임상시험을 보다 효율적으로 수행하는데 있어서 간접적으로 뒷 받침할 수 있다. 또한 임상시험을 대신하여 시간과 노력, 자본 을 절약할 수 있게 되고 잠재적으로 소아약물 용량 결정에도 이 용될 수 있다. 그러나 PBPK 모델은 어떤 생리학적, 해부학적 과정의 특징이나 정보에 차이를 나타낼 수 있으며 또한 복잡한
약물동태를 나타내는 약물에 대해서는 그 한계가 있다. 특히 소 아 약물 개발에 있어서는 성인과 다른 약물의 흡수, 분포, 대사, 배설 과정에 대한 예측 연구가 보강된다면 보다 예측도가 높은 연구가 가능할 것으로 사료된다.
감사의 말씀
이 연구는 충남대학교 학술연구비에 의해 지원되었으며 이에 감사를 드립니다. 또한 Simulations-Plus사의 Mr. John DiBella 에게도 본 논문에 대한 좋은 논의에 감사를 드립니다.
References
1) Teorell, T. : Kinetics of distribution of substances administered to the body I : The extravascular modes of administration.
Arch. Int. Pharmacodyn. Ther. 57, 205 (1937).
2) Malcolm, R., Carl, P. and Geoffrey. T. : Physiologically-based pharmacokinetics in drug development and regulatory science.
Annu. Rev. Pharmacol. Toxicol. 51, 45 (2011).
3) Hannah, M. J., Maurice, D., Kuresh, Y., James, R. G., Neil, J. A., Tanya, L. H., Ian, K. G., Raj, L., Peter, J. B., Barry, C. J. and Iain, B. G. : Application of PBPK modelling in drug discovery and development at Pfizer. Xenobiotica. 42, 94 (2012).
4) Jones, H., Chen, Y., Gibson, C., Heimbach, T., Parrott, N., Peters, S., Snoeys, J., Upreti, V., Zheng, M. and Hall, S. : Physiologically based pharmacokinetic modelling in drug discovery and development : A pharmaceutical industry perspective. Clin. Pharmacol. Ther. 97, 3 (2015).
5) Jones, H. and Rowland, Y. K. : Basic concepts in physiologically based pharmacokinetic modeling in drug discovery and development. CPT Pharmacometrics Syst. Pharmacol. 2, e63 (2013).
6) 윤휘열, 백인환, 서정원, 배경진, 이만형, 강원구, 권광일 : 모델
Fig. 10 − Concentration-time profile for predicted (lines mean, 5-95th percentiles, min/max) and mean observed (dots) data (using observed CL).
기반학 적 신약개발에서 약동/약력학 모델링 및 시뮬레이션의 역 할. Korean J. Clin. Pharm. 18, 84 (2008).
7) 이상민, 최보윤, 윤휘열, 전다혜, 김명규, 하지혜, 김영훈, 지은희, 강원구, 한나영 : 효율적인 의약품 평가를 위한 약물계량학 분석 법 도입의 전략 방안. Korean J. Clin. Pharm. 21, 339 (2011).
8) GastroPlus http://www.simulations?plus.com/Products.aspx?
grpID=3&cID=16&pID= 11 (Accessed2013).
9) Rodgers, T. and Rowland, M. : Physiologically based pharmacokinetic modelling 2 : predicting the tissue distribution of acids, very weak bases, neutrals and zwitterions. J. Pharm.
Sci. 95, 1238 (2006).
10) Khalil, F. and Läer, S. : Physiologically based pharmacokinetic models in the prediction of oral drug exposure over the entire pediatric age range— Sotalol as a model drug. AAPS J. 16, 226 (2014).
11) Siladitya, R. C., Viera, L. and Walter, S. W. : Modeling disposition of sotalol following Intravenous and oral administration in healthy adult subjects. Abstract #T3075, AAPS Annual Meeting and Exposition. October 23~27 Washington Convention Center, Washington, D.C. (2011).
12) Poirier, J. M., Jaillon, P., Lecocq, B., Lecocq, V., Ferry, A. and Cheymol, G. : The pharmacokinetics of d-sotalol and d, l- sotalol in healthy volunteers. Eur. J. Clin. Pharmacol. 38, 579 (1990).
13) James, J. H. : Clinical pharmacokinetics of sotalol. Am. J.
Cardiol. 72, 19a (1993).
14) Deneer, V. H., Lie, A. H. L., Kingma, J. H., Proost, J. H., Kelder, J. C. and Brouwers, J. R. : Absorption kinetics of oral sotalol combined with cisapride and sublingual sotalol in healthy subjects. Br. J. Clin. Pharmacol. 45, 485(1998).
15) Tjandramaga, T. B., Verbeeck, R., Thomas, J., Verbesselt, R., Verberckmoes, R. and Schepper, P. J. : The effect of end?stage renal failure and haemodialysis on the elimination kinetics of sotalol. Br. J. Clin. Pharmacol. 3, 259 (1976).
16) Läer, S., Elshoff, J. P., Meibohm, B., Weil, J., Mir, T. S., Zhang, W. and Hulpke, W. M. : Development of a safe and effective pediatric dosing regimen for sotalol based on population pharmacokinetics and pharmacodynamics in children with supraventricular tachycardia. J. Am. Coll. Cardiol. 46, 1322 (2005).
17) Egan, J. M. and Abernethy, D. R. : Lorazepam analysis using
liquid chromatography : improved sensitivity for single-dose pharmacokinetic studies. J. Chromatogr. 380, 196 (1986).
18) Greenblatt, D. J., Comer, W. H., Elliott, H. W., Shader, R. I., Knowles, J. A. and Ruelius, H. W. : Clinical pharmacokinetics of lorazepam. III. Intravenous injection. Preliminary results. J.
Clin. Pharmacol. 17, 490 (1977).
19) Muchohi, S. N., Obiero, K., Newton, C. R., Ogutu, B. R., Edwards, G. and Kokwaro, G. O. : Pharmacokinetics and clinical efficacy of lorazepam in children with severe malaria and convulsions. Br. J. Clin. Pharmacol. 65, 12 (2008).
20) Chamberlain, J. M., Capparelli, E. V., Brown, K. M., Vance, C. W., Lillis, K., Mahajan, P., Lichenstein, R., Stanley, R. M., Davis, C. O., Gordon, S., Baren, J. M. and van den Anker, J. N. : Pharmacokinetics of intravenous lorazepam in pediatric patients with and without status epilepticus. J. Pediatr. 160, 667 (2012).
21) Maharaj, A. R., Barrett, J. S. and Edginton, A. N. : A workflow example of PBPK modeling to support pediatric research and development : case study with lorazepam. AAPS J. 15, 455 (2013).
22) Yang, Y., Faustino, P. J., Volpe, D. A., Ellison, C. D., Lyon, R. C.
and Yu, L. X. : Biopharmaceutics classification of selected β- blockers : Solubility and permeability class membership. Mol.
Pharm. 4, 608 (2007).
23) Dahan, A., Miller, J. M., Hilfinger, J. M., Yamashita, S., Yu, L. X., Lennernäs, H. and Amidon, G. L. : High-permeability criterion for BCS classification: segmental/pH dependent permeability considerations. Mol. Pharm. 7, 1827 (2010).
24) Andrea, N. Edginton and Nikoletta, Fotaki : Oral drug absorption in pediatric populations, Oral drug absorption : prediction and assessment. 2nd ed. New York : Informa healthcare, 108 (2010).
25) Fernandez, E., Perez, R., Hernandez, A., Tejada, P., Arteta, M. and Ramos, J. T. : Factors and mechanisms for pharmacokinetic differences between pediatric population and adults. Pharmaceutics. 3, 53 (2011).
26) Zhao, P., Rowland, M. and Huang, S. M. : Best practice in the use of physiologically based pharmacokinetic modeling and simulation to address clinical pharmacology regulatory questions. Clin. Pharmacol. Ther. 92, 17 (2012).
27) DrugBank http://www.drugbank.ca/drugs/DB00186 (Accessed 2013-09-16).