자동요침사 분석기 UF-100의 평가 및 참고범위 설정
정채림1․김승구1․문희원2․이미애1․정화순1
이화여자대학교 의학전문대학원 진단검사의학교실1, 서울의과학연구소2
Evaluation and Establishment of Reference Range of Automated Urine Cell Analyzer UF-100
Chae Limg Jung1, Seung Goo Kim1, Hee Won Moon2, Mi Ae Lee1, and Wha Soon Chung1
Department of Laboratory Medicine
1, School of Medicine, Ewha Womans University, Seoul; Seoul Medical Science Institute
2, Seoul, Korea
Background: The automated urine cell analyzer UF-100 (Syxmex co., Japan), flow cytometer-based instrument, has enabled to perform rapid and efficient work. We evaluated the UF-100 by comparing performance in urine sediment testing with counting chamber, standardized method, and traditional manual microscopy widely used in laboratories, and established reference ranges in our hospital.
Methods: Urine samples were obtained from patients in their 20s to 60s who visited hospital for regular check-up between March and April 2007 at Ewha Womans University Mokdong Hospital. We selected randomly a total of 261 samples (male 130, female 131) and evaluated correlations of red blood cell (RBC) and white blood cell (WBC) counts of UF-100 with counting chamber, and manual microscopy. Moreover, we established reference ranges of UF-100 and counting chamber according to CLSI guideline, using 156 urine samples (male 93, female 63) with normal dipstick (strip) test results.
Results: The RBC correlation coefficients between UF-100 and counting chamber, UF-100 and manual microscopy, counting chamber and manual microscopy were 0.538, 0.873, and 0.619, respectively. The WBC correlation coefficients between UF-100 and counting chamber, UF-100 and manual microscopy, counting chamber and manual microscopy were 0.992, 0.902, and 0.893, respectively and showed good correlations. The results of UF-100 were higher than counting chamber and manual microscopy. The RBC reference ranges of UF-100 and counting chamber were 0.5-24.9/L (male 0.4-12.2/L, female 0.9-38.8/L) and 0-4/L (male 0-4/L, female 0-5/
L), and the WBC reference ranges of those were 0.9-21.8/L (male 0.8-12.6/L, female 2.0-23.4/L) and 0-7/L (male 0-7/L, female 0-9/L).
Conclusions: The fully automated analyzer UF-100 could be useful to enhance efficiency by labor-saving, turnaround time reduction and improving throughput and to enable standardization.
But it is needed for further study including clinical evaluation, because the results and reference ranges between UF-100 and counting chamber or manual microscopy showed considerable differences.
Key Words:UF-100, Automated urine cell analyzer, Reference range
교신저자:문희원
우) 140-809 서울시 용산구 동빙고동 7-14 서울의과학연구소 SCL
전화:02)790-6500(332), FAX:02)790-6031 E-mail: hannasis@hanmail.net
서 론
요검사는 신장과 비뇨기 계통의 이상을 진단하고 감시하
는 데에 중요하고 간편한 검사로 검사실에서 가장 흔히 시
행되는 기본 검사이다. 요침사 분석은 요검사의 중요한 부
분으로 원심분리한 요검체를 현미경으로 검경하는 방법이 수십 년 동안 널리 시행되어 왔다. 그러나 전통적인 요침사 현미경법(manual microscopy)은 수작업이 많이 요구되고 정밀도가 떨어지며 검사시간이 오래 걸리는 등의 단점이 많 다[1]. 특히 검사법의 특성상 검사자간 차이가 있고 결과 해석이 주관적이어서 표준화와 정도관리가 어렵다는 문제점 이 있다[2].
이러한 문제들을 해결하기 위하여 CLSI[3]와 ECLM (European Confederation of Laboratory Medicine)[4]
등의 국제지침은 표준화된 혈구계산판(chamber)을 이용하는 방법이나 자동화기기 사용을 권고하고 있다. 요검사 중 요 침사를 측정하는 정확한 기준검사법은 아직 없으나[4-5], 현 재 가장 기준에 가까운 검사법은 원심분리하지 않은 요검체 를 그대로 사용하는 혈구계산판법(counting chamber)이다 [5-6]. 그러나 혈구계산판법도 기술적인 면이나 혈구계산판 에서 세포 분포가 일정하지 않은 경우, 관찰자변이 등과 관 련하여 오류가 발생할 수 있다[5].
요검사 자동화기기는 요침사 현미경법에 비해 수작업을 감소시키고 검사시간을 단축할 수 있다. 또한 정확도와 정 밀도가 우수하고 처리량이 증대되는 장점이 있다[1]. Yellow IRIS (International Remote Imaging Systems, Chatsworth, CA, USA)는 1980년대 초에 통상적으로 이용 가능한 자동 화기기로 처음 개발된 장치로, 그 원리는 비디오카메라로 입자를 관찰하여 얻은 영상을 분석하여 입자를 식별하는 것 이다. 이 방법은 요침사 현미경법에 비해 정밀도와 민감도 가 향상되었으나 입자 농도와 검사자에 따라 작업량과 식별 정도가 불안정했다[6-7]. 1990년에는 영상 유세포 분석기인 UA-1000 (Sysmex co., Kobe, Japan)과 UA-2000 (Sysmex co., Kobe, Japan)이 도입되었는데, color CCD (charge- coupled device) 카메라를 이용하여 Yellow IRIS에 비해 해 상도가 향상되었으나 역시 처리속도가 느리고 영상을 판독 하기 위해 훈련된 검사자가 필요했다[6-7].
완전 자동화된 대용량 분석기가 필요해지면서 1995년에 이전과는 완전히 다른 개념에 기반한 2세대 자동분석기인 UF-100 (Sysmex co., Kobe, Japan)이 개발되었다. UF-100 은 유세포분석 기술을 이용한 완전 자동분석기로 대용량을 신속하게 처리할 수 있고 객관적인 정보를 제공할 수 있게 되었으나[6-7], 정확도가 향상되고 민감도가 높아지면서 이 전에 쓰던 참고치와는 차이가 있다[8]. 일반적으로 문헌에 기록된 값이나 다른 검사실에서 쓰는 정상치를 그대로 적용 하는 검사실이 많은데 그러한 경우에 정상치가 정확하지 않 을 수 있으므로 평가가 필요하다[9]. 저자들은 UF-100 자동 요침사 분석기를 현재 가장 많이 사용되고 있는 요침사 현 미경법 및 표준화 방법인 혈구계산판법과 비교하여 요세포 측정능을 평가하고, UF-100을 이용한 요검사의 본원 참고 치를 직접 설정해 보고자 하였다.
대상 및 방법
2007년 3월-4월 동안 이대목동병원에서 건강검진을 시 행한 20세-60세 환자들 중 261명(남자 130명, 여자 131 명)의 요검체를 무작위로 선택하여 환자들에게 요도구를 소 독한 후 중간뇨를 무균용기에 받도록 요청하였다. 신선뇨를 받은 즉시 요시험지 검사, UF-100, 혈구계산판법, 요침사 현미경법을 순서대로 시행하여 2시간 내에 모든 검사를 완 료하였다. 요시험지 검사는 Urysis-2400 (Roche diagnostic co., Indianapolis, IN, USA)을 이용하여 실 시하였다.
1. UF-100
약 800
L의 요검체를 흡인하여 희석한 후 2가지 형광 염료와 혼합한다. 페난트리딘(phenanthridine)은 핵산을 염색하고 카보시아닌(carbocyanine)은 세포막, 핵막, 미토 콘드리아 등을 염색한다. 요원소들(elements)은 전도도 (conductivity)가 먼저 측정되고 아르곤 광선(argon laser beam)을 통과하면서 전반산란광과 형광 신호를 방출한다.
전반산란도(forward scattered light intensity)는 세포 크기를 반영하고 전반산란광진동폭(forward scattered light pulse width)은 세포 길이를 반영하며, 형광강도 (fluorescence light intensity)는 염색 민감도를, 형광진 동폭(fluorescence light pulse width)은 염색된 부분의 길이를 반영한다. 입자에 대한 산란광, 형광, 전기저항 (impedance) 특성이 기록되고 전기 신호로 전환되어 화면 에 막대그래프(histogram)과 산점도(scattergram)로 분 포가 나타난다. 요입자들은 크기와 염색 민감도의 차이에 의하여 구별될 수 있으며, 적혈구, 백혈구, 상피 세포, 원 주, 세균 등은 정량적으로 측정되고 소원형세포, 병적인 원 주, 결정, 효모양 세포, 정자, 변형적혈구 등은 플래그 (flag)로 표시된다.
2. 혈구계산판법
원심분리하지 않은 요검체를 Neubauer chamber (Marienfeld, Germany)에 한 방울 떨어뜨린 후 광학현 미경으로 400배 고배율에서 4개 이상의 대구획을 관찰하여 얻은 적혈구와 백혈구의 평균수치에 보정계수 10을 곱하여
L 단위로 기록하였다.
3. 요침사 현미경법
요검체 10 mL를 1,500 rpm에서 5분 동안 원심분리한
후 상청액을 따라 버리고 남은 침전물을 잘 혼합한다. 슬라
이드에 요침사를 한 방울 떨어뜨리고 덮개 유리(cover
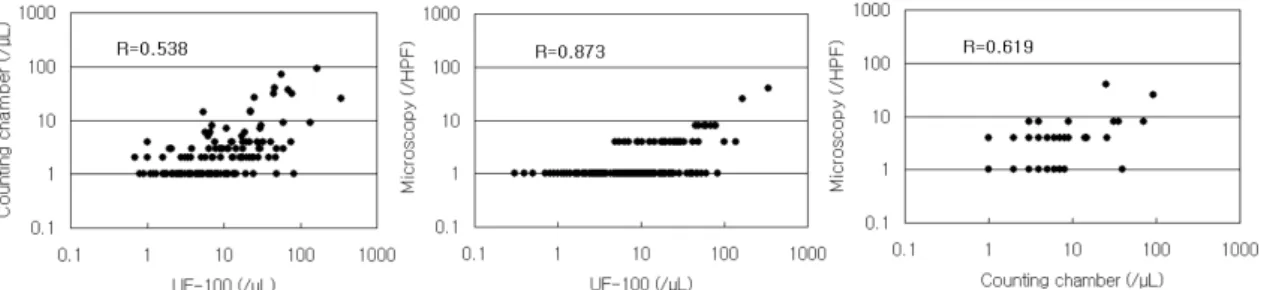
Fig. 1. Correlations between red blood cell (RBC) counts measured with UF-100 analyzer, counting chamber, and microscopy. (A) UF-100 vs counting chamber. (B) UF-100 vs microscopy. (C) Counting chamber vs microscopy.
Fig. 2. Correlations between white blood cell (WBC) counts measured with UF-100 analyzer, counting chamber, and microscopy. (A) UF-100 vs counting chamber. (B) UF-100 vs microscopy. (C) Counting chamber vs microscopy.
glass, 18 mm × 18 mm)를 덮은 후 광학현미경으로 400 배 고배율에서 10 시야 이상 관찰하여 적혈구와 백혈구의 평균수치를 기록하였다.
4. 검사법간 비교
UF-100과 혈구계산판법, UF-100과 요침사 현미경법, 혈구계산판법과 요침사 현미경법간의 적혈구와 백혈구에 대 한 상관관계를 Pearson 상관관계분석을 시행하여 각각 구 하였다. 요침사 현미경법의 경우 high power field (HPF)당 입자들의 범위를 표시하는 반정량법이므로 중위 수를 이용하여 상관관계를 구하였다. 분석에는 윈도우용 SPSS ver. 12를 이용하였다.
5. 참고범위
총 261명의 요검체 중 신요로계 질환이 없으며 요시험지 결과가 모두 정상인 156명(남자 93명, 여자 63명)의 검체 를 대상으로 UF-100과 혈구계산판법의 적혈구와 백혈구 참고범위를 CLSI 지침[10]에 따라 비모수적 방법을 사용하 여 산정하였다.
결 과
1. 검사법간 비교
적혈구 상관계수의 경우 UF-100과 혈구계산판법은 0.538, UF-100과 요침사 현미경법은 0.873, 혈구계산판 법과 요침사 현미경법은 0.619로 UF-100과 요침사 현미경 법간이 가장 좋은 상관성을 보였다(Fig. 1).
백혈구 상관계수의 경우, UF-100과 혈구계산판법은 0.992, UF-100과 요침사 현미경법은 0.902, 혈구계산판 법과 요침사 현미경법은 0.893으로 전반적으로 우수한 상 관관계를 보였다(Fig. 2).
그러나 요침사 현미경법의 등급(grade)에 따른 검사결과
의 분포를 보면 요침사 현미경법 결과를
L 단위로 환산한
결과와 혈구계산판법간의 결과는 비슷한 분포를 보였으나
UF-100 수치는 혈구계산판법과 요침사 현미경법보다 전반
적으로 높은 결과를 보였으며 결과의 범위도 넓게 나타났다
(Table 1, 2).
Table 1. Distribution of red blood cell (RBC) counts of UF-100 and counting chamber according to urine sediment grade
Microscopy (/HPF) (/
L*) (N)
UF-100 (/
L) Counting chamber (/
L)
Median Range Median Range
0-2 (0-16.5) (222) 5.5 0.3 - 83.4 1.0 0.0 - 40.0
3-5 (16.6-33.2) (30) 22.2 4.9 - 137.4 2.5 0.0 - 26.0
6-10 (33.3-61.0) (7) 60.8 45.4 - 78.5 31.0 3.0 - 70.0
>11 (>61.1) (2) 253.65 167.3 - 340.0 59.0 25.0 - 93.0
*Counts per high-power field (HPF) were converted into counts per microliter (
L) by CLSI guideline.
Table 2. Distribution of white blood cell (WBC) counts of UF-100 and counting chamber according to urine sediment grade
Microscopy (/HPF) (/
L*) (N)
UF-100 (/
L) Counting chamber (/
L)
Median Range Median Range
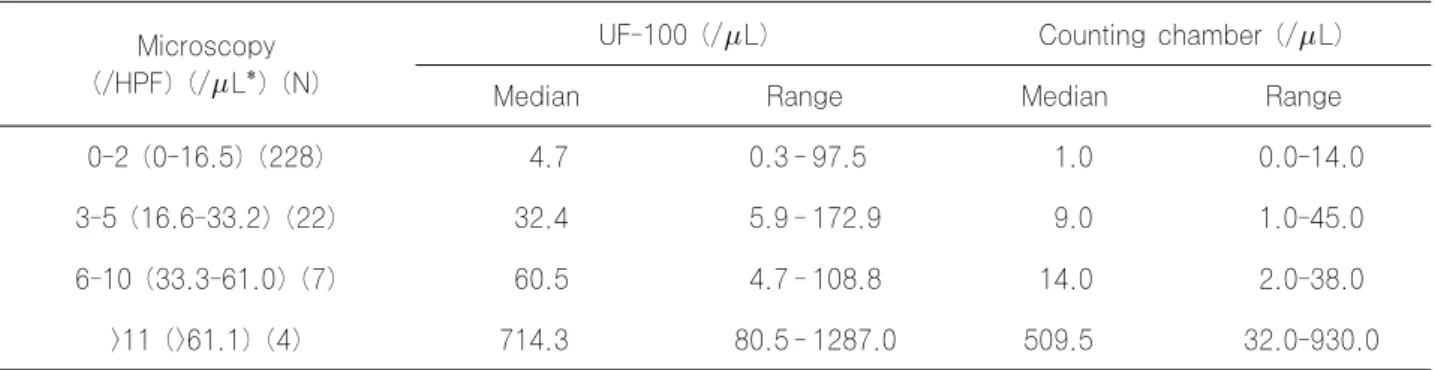
0-2 (0-16.5) (228) 4.7 0.3 - 97.5 1.0 0.0-14.0
3-5 (16.6-33.2) (22) 32.4 5.9 - 172.9 9.0 1.0-45.0
6-10 (33.3-61.0) (7) 60.5 4.7 - 108.8 14.0 2.0-38.0
>11 (>61.1) (4) 714.3 80.5 - 1287.0 509.5 32.0-930.0
*Counts per high-power field (HPF) were converted into counts per microliter (
L) by CLSI guideline.
Table 3. Reference ranges for urine red blood cell (RBC) and white blood cell (WBC) determined by UF-100 analyzer and counting chamber
RBC (/
L) WBC (/
L)
Total Males Females Total Males Females
UF-100 0.5-24.9 0.4-12.2 0.9-38.8 0.9-21.8 0.8-12.6 2.0-23.4
Counting chamber 0-4 0-4 0-5 0-7 0-7 0-9
2. 참고범위
적혈구 참고치는 UF-100에서 0.5-24.9/
L (남자 0.4-12.2/
L, 여자 0.9-38.8/
L), 혈구계산판법에서 0-4/
L (남자 0-4/
L, 여자 0-5/
L)였고, 백혈구 참고 치는 UF-100에서 0.9-21.8/
L (남자 0.8-12.6/
L, 여 자 2.0-23.4/
L), 혈구계산판법에서 0-7/
L (남자 0-7/
L, 여자 0-9/
L)로 UF-100이 혈구계산판법보다 높게 나타났다(Table 3, Fig. 3).
고 찰
요침사 현미경법에서는 원심분리의 시간과 속도, 검체분
주과정(decantation), 요검체의 양, 현미경 슬라이드와 덮
개 유리 사이의 공간, 검사자 개인차 등의 여러 요인이 검
사실간 차이를 초래할 수 있다[11]. UF-100은 오류를 일
으킬 수 있는 이러한 원심분리 등의 전처리와 슬라이드 준
비 과정이 필요하지 않고 검사자간 차이를 최소화하여, 객
관적인 결과를 제공하므로 요세포 검사를 표준화할 수 있다
[12-13]. 또한 미량으로도 검사가 가능하여 소아 검체에도
용이한 장점이 있고 단시간에 많은 검체를 처리할 수 있어
Fig. 3. Histogram of values measured by UF-100 analyzer. (A) Red blood cell (RBC) counts. (B) White blood cell (WBC) counts.
작업효율을 향상시킨다[12]. 반면에 기존 보고 방법 (/HPF)과 결과의 단위가 달라져(/
L) 새로운 환산법이 필요하고 현미경 재검을 해야 할 경우가 있을 수 있다는 단 점이 있다.
본 연구에서 UF-100, 혈구계산판법, 요침사 현미경법의 상관관계는 전반적으로 양호한 결과를 보였다. 특히 UF-100과 혈구계산판법의 백혈구 상관계수는 0.992로 아 주 우수한 관계를 보였고, 요침사 현미경법과의 백혈구 상 관계수도 0.902로 우수한 결과를 나타냈으며, 혈구계산판 법과 요침사 현미경법 사이의 백혈구 상관계수도 0.893으 로 양호했다. 그러나 적혈구는 백혈구보다 상관성이 낮았는 데, UF-100과 혈구계산판법과의 적혈구 상관계수는 0.538로 낮은 편이었고, 요침사 현미경법과의 적혈구 상관계수는 0.873, 혈구계산판법과 요침사 현미경법의 적혈구 상관계수 는 0.619이었다. 다른 연구들에서도 UF-100과 혈구계산판법 이나 요침사 현미경법간의 적혈구와 백혈구 상관성을 각각 0.833-0.980, 0.88-0.935 정도로 양호하다고 보고하고 있으며 [7,14-15], 적혈구의 경우 본 연구결과와 차이가 있었다. 본 연구에서 다른 연구에 비해 적혈구 상관성이 낮았던 것은 적혈구 수치가 낮은 환자가 많이 포함되어 있었던 것이 원 인으로 생각된다. 혈구계산판법은 자동화기기보다 정밀도가 좋지 않으며, 낮은 농도일수록 결과가 부정확하다[15-16].
다른 연구들이 환자를 대상으로 하여 비정상 검체를 많이 포함한 데 비해 본 연구에서는 건강 검진 환자를 대상으로 하여 적혈구 수치가 낮은 환자가 많이 포함되어 있었다.
또한 검사결과의 분포를 보면 UF-100이 혈구계산판법 및 요침사 현미경법보다 적혈구와 백혈구값이 높게 나타났 다. 요침사 현미경법의 경우 원심분리 동안 세포가 소실되 므로 UF-100이 세포를 더 많이 측정했을 가능성이 있다
[7,13]. 그러나 혈구계산판법은 원심분리 과정이 없는데도 UF-100이 더 높은 결과를 보였는데, 수기법의 경우 표준 화된 방법과 완전히 일치하게 작업을 수행하기 힘들며 세포 들의 분포가 고르지 않거나 검사자간 차이 등과 연관되어 오류가 유발될 수 있다[7]. 그밖에 세균, 결정, 효모 등이 많을 경우 UF-100에서 적혈구로 잘못 분류하여 과대평가 했을 가능성도 있으며[7,15,17] 상대적으로 UF-100이 더 많은 세포를 측정하기 때문에 예민도의 차이일 수도 있다.
다른 연구에서도 실제로 거의 일치한 결과를 보이는 보고도 있었으나 UF-100이 더 높은 수치를 기록한 경우가 많았다 [6,7,15]. 건강 검진 환자를 대상으로 하여 높은 값이 상 대적으로 적게 포함된 점과 요침사 현미경법의 경우 중위수 를 정해 연구를 시행한 점은 본 상관성 연구의 한계점이다.
본원에서 산정한 UF-100의 적혈구와 백혈구 참고범위는
다른 문헌에서 발표된 상한선[7-9,18]이 대략 10-30/
L
였던 것과 비교하여 큰 차이를 보이지 않았으나, 보고된 값
들 사이에서 적혈구와 백혈구, 성별 분포에 약간의 차이가
있었다. 본 연구에서는 UF-100의 적혈구 정상치가 백혈구
보다 높았으나 다른 문헌들에서는 적혈구 정상치가 높은 것
도 있었고 백혈구 정상치가 더 높은 것도 있었다. 또한 본
연구에서는 UF-100의 적혈구와 백혈구 참고치가 남자보다
여자에서 더 높아 성별에 따른 차이가 있는 것을 볼 수 있
었다. 다른 연구들에서도 남녀간에 차이가 있는 것을 볼 수
있는데, 백혈구 정상치는 두 연구에서 모두 여자가 더 높았
으며, 적혈구 정상치는 남자가 높은 경우[7]도 있었고, 여
자가 높은 경우[9]도 있었다. 남녀 구분 없이 참고치를 구
한 연구들도 많았는데, 성별에 따른 차이에 대하여 더 평가
해볼 필요가 있겠다. 혈구계산판법의 적혈구와 백혈구 참고
범위는 다른 문헌들[6,19]이 약 0-10/
L으로 보고한 것
에 비해 약간 낮았다. 차이를 보이는 이유로는 연령이나 정 상 기준 등 대상군 선정에서의 차이나 정상치 산정 방법, 검체 처리 과정 등이 검사실마다 각기 다르기 때문일 것으 로 생각된다. 참고치에 따라 진단의 민감도와 특이도에도 차이가 발생하므로 환자들의 특성이나 임상적 상황 등을 평 가하여 각 검사실의 실정에 맞는 정상치를 산정할 필요가 있어 추가적인 연구가 필요할 것으로 사료된다.
정상범위에 대한 경계치에 대하여, Koken 등[11]은 세 균 3,800/
L, 백혈구 25/
L가 경계치로서 가장 좋다고 하였고, Hanneman-Pohl 등[12]은 세균 3,300/
L, 백 혈구 30/
L를 경계치로 보고하였다. Ottiger 등은 세균 3,000/
L, 백혈구 20/
L 이하일 경우를 정상치로 정하 였고, 부적절한 검체나 항생제 치료 등 여러가지 원인으로 배양 검사에서 음성이어도 UF-100에서는 세균을 탐지할 수 있으므로 요로감염 진단에 유용하고 항생제 치료시 경과 관찰과 치료 실패시 원인 규명 등에도 도움이 된다고 하였 다[20]. 또한 UF-100은 혈뇨의 기원을 밝히는 데에도 유 용하고, 동형과 변형 적혈구도 구분 가능하다. Alperan 등 [21]에 따르면, UF-100은 혈뇨가 사구체성인지 비사구체 성인지 감별하는데 요침사 현미경법과 민감도와 특이도에서 차이가 없었으며 더 신속하고 객관적이므로 혈뇨를 감별하 는데 더 유용하다고 하였다.
UF-100은 요침사 부분에서 전통적인 요침사 현미경법 을 대신할 만한 좋은 검사이나 아직 완전히 대체할 수는 없 다. 플래그가 뜰 경우, 원주 등의 형태를 확인할 필요가 있 는 경우, 그밖에 임상적으로 필요한 경우에는 현미경으로 확인을 해야 한다. 이러한 상황에서 UF-100을 검사실에서 잘 활용하기 위한 알고리즘이 제안되어 있다[6,22]. 자동 화기기가 도입되면서 현재 가장 일반적인 방법은 요시험지 검사와 UF-100을 일차 검사로 함께 사용하는 것이다. 여 기에는 2가지 방법이 있는데, 항상 2가지 검사를 함께 사용 하는 방법과 요화학 검사가 필요하여 UF-100으로 검사하 기 적합하지 않은 경우에만 요시험지 검사를 하는 방법이 있다[6,14]. 알고리즘에 따라 검사를 진행하면 위음성과 위양성을 줄이고 현미경 재검율을 상당히 감소시킬 수 있다 [6,22]. 현재 우리 나라에서 요화학검사는 자동화가 상당 히 이루어진 반면 요침사검사는 기기의 높은 가격 때문에 자동화가 부족한 상태이나, 정도관리 등의 필요성 증가로 앞으로 도입이 점점 증가할 것이다[2].
결론적으로, UF-100은 자동화를 통해 수작업 감소, 검 사 소요시간 단축, 처리량 증가 등 업무의 효율성을 높이고 객관적인 결과를 제공하여 표준화가 가능하다는 장점이 있 어 앞으로 검사실에서 유용하게 사용될 수 있을 것이다. 그 러나 기존의 혈구계산판법이나 요침사 현미경법과 검사 결 과 및 참고치에 차이가 있으므로 임상적 평가를 포함한 추 가적인 연구가 필요할 것으로 사료된다.
요 약
배경: 유세포분석 기술을 이용한 자동요침사분석기 UF-100 (Sysmex co., Japan)의 도입으로 더 빠르고 효율적 인 업무를 수행할 수 있게 되었다. 이에 표준법인 혈구계산 판법(counting chamber)과 검사실에서 널리 이용되고 있는 요침사 현미경법(manual microscopy)과의 비교를 통해 요침 사 측정능을 평가하고 본원 참고범위를 설정하였다.
방법: 2007년 3-4월 이대목동병원을 방문하여 종합검진 을 실시한 20-60세 환자들의 요검체를 대상으로 하였다. 총 261 검체(남자 130, 여자 131)를 무작위로 선택하여 UF-100, 혈구계산판법, 요침사 현미경법들간의 적혈구와 백혈구 상 관관계를 비교하였고, 그 중 요시험지 결과가 정상인 156검 체(남자 93, 여자 63)를 이용하여 CLSI 지침에 따라 UF-100과 혈구계산판법의 참고범위를 설정하였다.
결과: 적혈구 상관계수는 UF-100과 혈구계산판법은 0.538, UF-100과 요침사 현미경법은 0.873, 혈구계산판법과 요침사 현미경법은 0.619였다. 백혈구 상관계수는 UF-100과 혈구계산판법은 0.992, UF-100과 요침사 현미경법은 0.902, 혈구계산판법과 요침사 현미경법은 0.893으로 대체적으로 양호한 상관성을 보였다. UF-100은 혈구계산판법과 요침사 현미경법보다 전반적으로 세포수를 높게 측정하였다. 적혈 구 참고범위는 UF-100에서 0.5-24.9/
L (여자 0.9- 38.8/
L, 남자 0.4-12.2/
L), 혈구계산판법에서 0-4/
L (여자 0-5/
L, 남자 0-4/
L)이었고, 백혈구 참고범위 는 각각 UF-100에서 0.9-21.8/
L (여자 2.0-23.4/
L, 남자 0.8-12.6/
L), 혈구계산판법에서 0-7/
L (여자 0-9/
L, 남자 0-7/
L)였다.
결론: UF-100은 수작업 절감, 시간 단축, 처리량 증가 등 업무의 효율성을 높이고 표준화가 가능하다는 장점이 있어 앞으로 검사실에서 유용할 것이다. 그러나 기존의 혈구계산 판법이나 요침사 현미경법과 검사 결과 및 참고치에 차이가 있으므로 임상적 평가를 포함한 추가적인 연구가 필요할 것 으로 사료된다.
참 고 문 헌