J Health Tech Assess 2015;3(1):4-16 ISSN 2288-5811
Copyright © 2015 The Korean Association for Health Technology AssessmentWhat Should We Consider for Establishing a National Patient Safety Reporting System?
Minsu Ock, MD, MPA
1, Sang-il Lee, MD, PhD, MPH
1, Jang Han Kim, MD, PhD
2, Jae-Ho Lee, MD, PhD
3, Jin Yong Lee, MD, PhD
4, Min-Woo Jo, MD, PhD
1, Mi Suk Lee, MD, PhD
5, Seon-Ha Kim, RN, PhD
6, Hyun Joo Kim, RN, MPH
7, and Woo-Seung Son, MPH
11
Departments of Preventive Medicine and
2Medical Humanities and Social Sciences, University of Ulsan College of Medicine, Seoul, Korea
3
Department of Emergency Medicine, Asan Medical Center, University of Ulsan College of Medicine, Department of Biomedical Informatics, Asan Medical Center, Seoul, Korea
4
Public Health Medical Service, Seoul National University Boramae Medical Center, Seoul, Korea
5
Department of Internal Medicine, Kyung Hee University School of Medicine, Seoul, Korea
6
Department of Nursing, Dankook University, Cheonan, Korea
7
Department of Public Health, The Graduate School of Konyang University, Daejeon, Korea
환자안전 보고 시스템의 구성 요소 및 그 현황 분석
울산대학교 의과대학 예방의학교실1, 인문사회의학교실2, 울산대학교 의과대학 서울아산병원 응급의학과, 서울아산병원 의생명정보학과3, 서울대학교 보라매병원 공공의료사업단4, 경희대학교 의학전문대학원 내과학교실5, 단국대학교 간호학과6, 건양대학교 일반대학원 보건학과7
옥민수1·이상일1·김장한2·이재호3·이진용4·조민우1·이미숙5·김선하6·김현주7·손우승1
Received April 15, 2015 Revised May 12, 2015 Accepted May 22, 2015 Address for Correspondence:
Sang-il Lee, MD, PhD, MPH Department of Preventive Medicine, University of Ulsan College of Medicine, 88 Olympic-ro 43-gil, Songpa-gu, Seoul 138-736, Korea Tel: +82-2-3010-4284 Fax: +82-2-477-2898 E-mail: sleemd@amc.seoul.kr
Objectives:
To propose future directions of patient safety reporting system (PSRS) in South Korea based on the analysis of current PSRSs in some developed countries.Methods:
We summarized the components of external PSRS in ten countries through literature review. Based on the same framework used in the literature review, we collected informations about three domestic external PSRSs. We also did e-mail interviews with those who are in charge of operating domestic PSRSs to collect additional information.Results:
The components of PSRS can be divided into three factors:reporting method (events to be reported, type of reporting system, reporter and means of report- ing); data analysis (organization in charge of analysis and dissemination of results for analysis); and confidentiality of data and reporter (independent patient safety law, confidentiality and privilege and organization dedicated to patient safety).
Conclusion:
In accordance with the components of PSRS, the following points should be considered for establishing a national PSRS in Korea: intro- ducing mandatory reporting for serious reportable events; expanding events to be reported, report- er and means of reporting; developing infrastructure for analysing reported data; disseminating analysis results; providing a confidentiality protection and legal privilege to reporters or reported data; and establishing a patient safety center which is in charge of managing PSRSs.Key Words
Patient safety · Patient safety reporting system · Patient safety law.Original Article
JoHTA
서 론
환자안전은 의료가 갖추어야 할 필수적인 요소의 하나이 다.1) 환자 및 그 보호자들은 의료를 이용할 때 안전하게 진료 받기를 기대한다. 그러나 유명인의 의료사고 소식이 언론에 보도되기도 하여2) 가끔씩 환자안전에 대한 일반인의 경각심 을 일깨우기도 한다. 의료오류(medical error) 및 위해사건
(adverse event)에 관한 현황 조사들을 종합한 체계적 문헌고 찰3)에 따르면 병원에서 환자들이 안전하게 진료를 받지 못 하고 있는 것으로 나타나고 있다.
사실 환자안전은 우리나라만의 문제가 아닌 전 세계적으 로 중요한 보건의료 정책 의제이다.4) 이러한 의제 설정 및 정 책적 변화에 대한 압력이 환자안전에 대한 관리의 문제로 이 어졌고, 이는 자연스럽게 환자안전의 수준을 어떻게 제고시
킬지에 대한 논의로 귀결되었다. 이 같은 변화의 원인으로는 의료 전문직 및 기구에 대한 신뢰의 약화, 전문직의 자율 규 제 실패, 의학 자체의 전문성 의미의 침식, 소비자 운동의 대 두 등을 들 수 있다.5) 세계 각국의 정부들이 환자안전의 관리 를 위하여 개입을 강화하기 시작하였고, 일정 부분 자율 규 제에 놓여 있었던 분야에 새로운 관리 체계가 도입되고 있 다. 그 예로는 환자안전 보고 시스템의 구축, 환자안전법의 제정, 인증제도의 강화, 의료인 자료은행 구축, 진실 말하기 의 장려 등을 들 수 있다.
환자안전 수준을 제고하기 위한 이러한 정책이나 제도들 의 공통점은 시스템 중심의 접근을 하고 있다는 사실이다.
의료오류를 예방하는 데에 있어서 개인 중심의 접근법은 크 게 효과가 없고, 근본적으로 의료오류의 문제는 의료 제공자 개인의 문제라기보다는 불완전한 의료 시스템 때문에 발생 하는 것으로 알려져 있다.6) 의료인들이 아무리 유능하다고 하더라도 안전한 시스템이 갖추어지지 않은 상태에서는 의 료오류가 계속해서 발생하기 마련이다. 모든 인간은 불완전 하기 때문에 실수를 할 수 있고, 오류의 예방 및 학습을 위해 서는 개인에 대한 비난을 하지 않는 것이 바람직하다. 즉, 시 스템 중심의 접근법에서는 불안전한 행위가 일어난 경우 동 일한 또는 유사한 사건의 재발을 방지하기 위한 대책을 마련 하기 위해서 ‘누가’ 잘못하였는지보다 ‘무엇’이 ‘어떻게’, 그리 고 ‘왜’ 잘못되게 하였는지를 파악하는 것을 중요시한다.
특히, 환자안전 보고 시스템은 시스템 중심의 접근법을 갖 는 제도들 중 핵심적인 것으로서 진료과정 전반에서 발생했 거나 발생할 수 있는 환자안전 사건으로부터 교훈을 얻어 이 를 한 의료기관 내 여러 부서에서뿐만 아니라 여러 의료기관 들이 공유하여 학습할 수 있는 기회를 제공하는 제도이다.
크게 기관 내부의 보고 시스템(internal reporting system)과 기관 외부로의 보고 시스템(external reporting system)으로 환자안전 보고 시스템을 구분할 수 있는데, 미국, 영국, 캐나 다, 일본 등 여러 국가들에서 다양한 형태의 기관 외부로의 환자안전 보고 시스템을 국가 또는 비정부기구에서 운영하 고 있다. 예를 들어 미국의 경우 27개 주에서 심각한 보고대 상 사건(serious reportable events)의 보고 및 분석을 의무화 하고 있고, 85개의 기관이 환자안전기관(Patient Safety Or- ganization)으로서 자발적인 환자안전 보고 시스템을 운영하 고 있다.7) 캐나다에서는 의료기구, 약물이상반응 등으로 발 생한 위해사건에 대해서는 보고를 의무화하고 있는데, 의료 기구와 관련 있는 환자의 사망이나 심각한 악화의 경우에는 10일 이내에, 사망이나 심각한 악화의 가능성이 있는 경우에 는 30일 이내에 예비 결론 및 조사 계획에 대한 중간 보고서 를 제출해야 한다. 그리고 가능한 모든 사건, 그 원인, 타당한
근거를 상세히 다룬 최종 보고서를 완성하는 대로 제출하도 록 하고 있다.5)
우리나라의 경우 미국이나 캐나다와 같이 진료과정 전반 에서 발생했거나 발생할 수 있는 환자안전 사건으로부터 교 훈을 얻어 여러 기관들이 이를 공유할 수 있는 기회를 제공 하는 외부 보고 시스템은 현재 없다. 2014년 기준으로 환자 안전과 관련이 있는 우리나라의 외부 보고 시스템으로는 한 국의약품안전관리원의 의약품 유해사례 보고관리 시스템, 한국혈액안전감시체계, 전국병원감염감시체계 등이 있으나, 환자안전 사건을 전반적으로 총괄하는 보고 시스템을 갖추 지 못하고 있다. 최근 환자안전법의 제정과 함께 환자안전 보고 시스템의 구축에 대한 논의가 진행되고 있는 바, 환자 안전 보고 시스템의 구성 요소를 이해하고 기존의 보고 시스 템들을 분석할 필요가 있다.
이 글에서는 환자안전 보고 시스템의 구축 배경 및 중요 성, 효과적인 보고 시스템의 요건들 등을 살펴보고, 문헌검 토를 통해 환자안전 보고 시스템의 구성 요소를 알아보았다.
또한 현재 우리나라에서 운영되고 있는 기관 외부로의 환자 안전 보고 시스템 구성 요소를 파악하여 비교하였다. 이러한 검토 결과를 바탕으로 우리나라 환자안전 보고 시스템 구축 및 발전을 위한 제언을 정리하였다.
환자안전 보고 시스템의 이론적 의미
환자안전 보고 시스템의 구축 배경 및 중요성
보건의료 영역에서 환자안전 보고 시스템을 구축하게 된 것은 다른 산업 분야, 특히 항공산업이나 원자력 산업에서부 터 얻은 경험을 참고로 한 것이다.8) 항공산업 분야에서의 안 전 수준을 크게 향상시킨 데에는 보고 시스템의 역할이 매우 컸다.9) 즉, 항공안전 보고 시스템을 갖춘 이후 항공 분야에서 치명적인 사고의 발생률이 크게 감소하였다. 가장 대표적인 예는 미국연방항공청(Federal Aviation Administration)에서 재정 지원을 하여 미국항공우주국(National Aeronautics and Space Administration, 이하 NASA)이 운영하고 있는 항공 안전 보고 시스템이다. 이는 조종사, 승무원, 관제사 및 그 외 다른 관련 업무 종사자들이 근접오류(near miss)를 자발적으 로 보고하고, 이를 분석하여 필요한 경우 위험한 사건의 발 생을 막을 수 있는 지침을 피드백해주고 있다. 이 보고체계 의 중요한 특성은 자발적 보고, 보고의 비밀 보장, 보고에 대 하여 문책하지 않음으로 요약할 수 있다. NASA의 항공안전 보고 시스템은 다른 나라의 항공산업에도 급속히 적용되었 다.9) 이러한 항공산업 분야의 보고 시스템을 벤치마킹하여 의료를 비롯한 소방, 철도 분야에서도 보고 시스템을 운영하
기 시작하였다.
항공산업 분야의 보고 시스템과 마찬가지로 의료 분야에 서의 환자안전 보고 시스템의 주목적은 오류에서 얻은 경험 을 함께 공유하는 데에 있다. 근접오류(near miss)와 경미한 사건 등에 대한 자발적 보고, 혹은 적신호사건(sentinel event) 등에 대한 의무적 보고를 통하여 오류의 위험성을 인지하고, 의료 시스템에 내재하는 취약점을 찾으며, 그 해결 방안에 대하여 의료기관들이 경험을 공유함으로써 환자안전을 증진 시킬 수 있다. 만약 의료오류가 보고되지 않는다면, 비슷하 거나 동일한 유형의 오류를 막을 수 있는 기회를 잃게 된다.
보고 시스템의 중요성은 학습 외에도 의료인들이 자신의 행위에 책임(accountability)을 지도록 하는 것에도 존재한 다. 어찌 보면 이는 학습을 목적으로 하는 보고 시스템과 상 충되는 것으로 보일 수 있고, 실제 학습과 책임이라는 두 가 지 목적을 동시에 만족시키는 것은 상당히 어려운 일이다.
그러나 보고 시스템을 구축하는 것, 특히 명백한 과실에 의 한 심각한 오류를 보고하게 하는 것은 의료 소비자인 일반 국민들에게 보호를 위한 최소한의 조치를 하고 있다는 인식 을 준다는 측면에서 필요하다. 즉, 중대한 오류가 일어난 것 은 안타까운 일이지만, 이것이 보고되고 분석되어 재발을 막 기 위한 적절한 조치가 취해졌다는 사실이 일반 국민들에게 알려진다면 미래에 대한 안심을 줄 수 있을 것이다. 결론적 으로 환자안전 보고 시스템은 학습과 책임이라는 두 가지 측 면에서 중요성이 있다. 아직 현재의 의료 환경에서 의료진 자신들의 실수를 밝히는 것이 쉬운 일은 아니기 때문에 보고 시스템이 학습에 우선적으로 초점을 두어야 하겠지만, 보고 시스템의 두 가지 중요성인 학습과 책임 사이의 균형을 맞추 는 것도 중요하다.
효과적인 환자안전 보고 시스템의 요건들
많은 의사들이 환자안전의 개선을 위해서 의료오류를 보 고하는 시스템이 필요하다는 것에 대해서는 공감하고 있지 만, 처벌적인 조직 문화, 피드백의 부재 등의 이유로 자신들 의 의료오류를 보고하지 않고 있으며, 의료오류로 인하여 환 자에게 발생한 위해의 정도에 따라 보고의 여부가 좌우되는 경향이 있다.10) 의료오류의 과소보고는 실제로도 확인되었는 데, 한 연구에서는 마취 과정을 130시간 동안 관찰하는 과정 에서 환자에게 직접적인 위협이 되지는 않는 109건의 사건 을 확인하였고, 이 중 일부 사건의 경우 마취 규정을 어긴 것 도 있었지만, 그 중에 단 한 건도 보고되지 않았다고 밝히고 있다.11) 만약 의료오류가 보고되지 않는다면, 실패의 경험으 로부터 교훈을 얻을 수 없기 때문에, 의료진들이 자발적으로 그들의 실수를 밝힐 수 있는 보고 시스템을 갖추는 것이 필
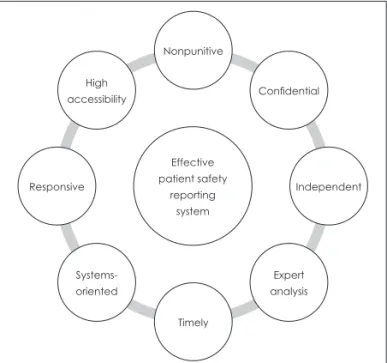
요하다. 성공적인 환자안전 보고 시스템을 위해서는 그림 1 과 같은 다음의 요건들이 필요하다.12-14)
첫째, 비처벌성(non-punitive)으로, 보고의 결과로 인하여 보고자 자신이나 그 외의 사람들이 처벌 받을 것이라는 두려 움이 없어야 한다는 점이다. 자신의 실수를 다른 이에게 말 하는 것에는 상당한 용기가 필요하며, 이는 수치심을 극복한 행동이다. 자신의 실수를 보고했다는 것에 대하여 비난을 하 고 대중적으로 망신을 주는 것뿐만 아니라 인사상의 불이익 을 주면 보고를 저해하게 된다.
둘째, 비밀 보장(confidentiality)으로, 보고에 있어 환자, 보고자, 의료 기관을 식별할 수 없게 해야 한다는 점이다. 보 고를 받을 때 보고자를 식별할 수 있게 할 것인지 아니면 식 별할 수 없게 할 것인지에 대해서는 논란의 여지가 있지만, 보고의 내용에 관하여 모두 공개하는 시스템은 그 성공 가능 성이 낮고, 비난 가능성과 개인이 오류를 숨길 가능성이 높 기 때문에 실제 이를 지지하는 경우가 거의 없다.15)
셋째, 독립성(independent)으로, 보고 시스템은 보고자 또 는 기관을 처벌할 권한을 가진 당국으로부터 독립적이어야 한다는 점이다. 보고의 목적이 처벌이 아닌 학습에 있다는 점을 고려한다면, 보고가 각종의 처벌권한을 가진 부서 및 기관이 아닌 독립적인 부서 및 기관으로 이루어져야 한다는 것도 중요하다.
넷째, 전문가 분석으로, 임상적 상황을 이해하고 시스템에 내재하고 있는 원인을 인식하는 훈련을 받은 전문가가 보고 된 자료를 분석해야 한다는 점이다.16) 여러 병원들이 내부 보 고 시스템을 구축하고 근접오류를 포함한 모든 종류의 오류 를 보고하도록 병원 직원들에게 요구하고 있지만, 정작 이를
Fig. 1. Requirements for effective patient safety reporting system.
Effective patient safety
reporting system Nonpunitive
Timely
Independent Responsive
High accessibility
Systems- oriented
Confidential
Expert analysis
활용하여 개선책을 만들기 쉽지 않은 경우가 많은데, 이는 결 국 전문가 분석의 부재로 인한 것이다.
다섯째, 적시성으로, 보고 내용을 신속하게 분석하여, 특히 심각한 위해인 경우에 권고안을 알아야 할 사람들에게 빨리 전파하여야 한다는 점이다. 의료오류에 자발적 보고 시스템 은 직원들의 협조에 의존하므로, 보고 이후의 피드백이 빠르 게 이루어지지 않아서 보고를 하든 그렇지 않든 별 차이가 없다고 느낀다면 업무에 바쁜 직원들이 보고의 의미를 느끼 지 못하여 보고를 하지 않을 가능성이 커진다.15) 또 의료 시 스템에 대하여 문제가 있음을 확인하였다면, 알 권리의 측면 에서 병원 직원들뿐만 아니라 일반 대중들에 대하여도 이 사 실을 신속히 알려야 할 것이다.16)
여섯째, 시스템 지향성으로, 보고를 취합하여 작성한 권고 안은 개인보다는 시스템의 변화에 초점을 맞추어야 한다는 점이다. 일반적으로 사건의 발생에 있어 시스템이 기여하는 부분은 80% 정도를 차지한다고 알려져 있다.17) 환자안전 향 상에 효과적인 방법은 시스템적 접근에 입각하여야 한다.
일곱째, 반응성으로, 보고를 받는 기관은 권고안을 전파할 능력을 갖추고 있어야 하며, 보고에 참여하는 기관들은 가능 한 경우에 언제나 권고안을 실행할 의지가 있어야 한다는 점 이다. 즉, 보고를 받는 기관의 경우 이를 분석하여 권고안을 작성하고, 이를 필요한 이들에게 배포할 수 있어야 하고, 보 고를 한 기관이나 부서, 개인은 보고 시스템의 운영 기관으 로부터 제공받은 권고안을 실제 진료 업무에 적용할 수 있어 야 한다.
여덟째, 접근 가능성으로, 보고를 할 수 있는 기관이나 개 인의 범위를 가급적 확대하는 것이 필요하다는 점이다. 많은 개인과 기관이 보고 시스템에 참여하면 드물게 발생하는 사 건의 보고 건수가 증가하여, 그 사건의 분석력을 개선하는 데에 기여할 수 있다.18) 즉, 보고 시스템에 접근할 수 있는 사 람을 최대한 넓게 설정한다면, 사건 발생의 경향을 파악하기 가 더 쉬워지게 된다.
방 법
환자안전 보고 시스템의 구성 요소를 분석하기 위하여 환 자안전 보고 시스템을 구축하여 운영하고 있는 국가들에서 발표한 문헌들을 검토하였다. 환자안전 보고 시스템을 오래 전부터 구축하여 운영하고 있는 미국, 영국, 캐나다, 일본, 호 주, 뉴질랜드, 덴마크, 프랑스, 싱가포르, 스웨덴을 연구 대상 국가로 선정하였다. 문헌검토를 위하여 세계보건기구(World Health Organization)의 보고서,19) 유럽연합 집행위원회(Eu- ropean Commission) 내 환자안전 및 의료 질 조사 위원회(Pa-
tient Safety and Quality of Care working group)의 보고 서,16) 캐나다 보건부(Health Canada)의 보고서5)를 주로 검토 하였다. 또 환자안전 관련 학술지에 발표된 환자안전 보고 시스템 관련 문헌 및 환자안전 관련 기관의 발간자료를 추가 적으로 검토하였다. 이 외에도 해외 방문을 통하여 환자안전 보고 시스템의 최신 자료를 수집하여 분석, 정리하였다.
해외의 환자안전 보고 시스템의 구성 요소를 검토한 결과 를 바탕으로 국내에서 운영하고 있는 외부 보고 시스템 현황 을 검토하였다. 2014년 기준으로 우리나라에서는 의료관련 감염(전국병원감염감시체계 등), 의약품(의약품 유해사례 보 고관리 시스템), 혈액(한국혈액안전감시체계)에 관한 환자안 전 사건의 보고를 받고 있다. 비록 이들이 환자안전 사건을 전반적으로 총괄하는 보고 시스템은 아니지만, 외부 보고 시 스템이라는 공통점을 가지고 있고, 최근 환자안전법의 제정 에 따라 환자안전 보고 시스템의 구축에 대한 논의가 진행될 것이기 때문에 기존의 보고 시스템을 검토해보는 작업은 중 요하다. 기존 보고 시스템의 검토를 위해서 각 보고 시스템 의 운영 관리자들과 접촉하여 현황을 파악하였고, 홈페이지 정보 검토를 통하여 필요한 자료를 수집하였다.
결 과
환자안전 보고 시스템의 구성 요소
환자안전 보고 시스템은 크게 보고 방법과 관련한 요소, 보고된 자료의 분석과 관련한 요소, 보고된 자료 및 보고자 의 보호와 관련한 요소로 나눌 수 있었다. 보고 방법과 관련 한 요소는 다시 보고 대상, 보고 시스템 유형, 보고자, 보고 수단으로 세분화할 수 있었다. 또 보고된 자료의 분석과 관 련한 요소는 보고된 자료의 분석 주체와 분석한 자료의 공개 로 나누어 살펴보았고, 보고된 자료 및 보고자의 보호와 관 련한 요소는 환자안전법의 유무, 비밀 보호 및 특권, 환자안 전 전담 기관의 유무로 세분화하였다. 이러한 틀에 따라 각 국가별 환자안전 보고 시스템의 구성 요소들을 좀 더 자세히 살펴보았다.
보고 방법과 관련한 요소
보고 대상
각국의 보고 시스템에서 보고 대상으로 하고 있는 사건은 크게 근접오류, 위해사건(adverse event), 적신호사건 혹은 심각한 위해사건(serious reportable event)으로 나누고 있다 (표 1). 특히 대부분의 보고 시스템에서는 적신호사건과 같이 위해의 정도가 심한 경우를 보고의 대상으로 하고 있다. 어
떤 보고 시스템에서도 근접오류만을 보고의 대상으로 삼고 있지 않은 것도 특기할만한 점이다.
보고 시스템의 유형
보고 시스템의 유형은 크게 자율보고 시스템과 의무보고 시스템으로 나뉜다(표 1). 영국, 호주, 스웨덴 등 대부분에서 의 보고 시스템은 이 두 가지 유형을 모두 병행하여 운영하 고 있지만, 일부 보고 시스템은 자율보고 시스템만을 운영하 기도 한다. 일반적으로 보고 대상과 관련해서 적신호사건에 는 의무보고 시스템을, 그 외의 사건에는 자율보고 시스템을 적용하고 있다.
프랑스에서는 2013년부터 심각한 위해사건에 대하여 의무 적 보고를 하게 하는 것과는 별도로 의사 보고 인증제도(cer- tification scheme for doctors)라는 독특한 제도를 운영하고 있다. 2007년 9월부터 도입된 이 제도는 고위험 진료 분야에 서의 근접오류를 기록 및 분석하여, 위험을 감소시키는 지침 을 개발 및 배포함으로써 진료와 관련된 위해사건의 발생 빈 도와 심각성을 낮추기 위한 목적으로 시작되었다. 승인 기구 (approved body)가 이 제도를 운영하고 있으며, 보통 관련 분야의 학회가 관여하고 있다. 19개 고위험 진료 분야의 병 원 근무 전문의 약 35000명을 제도 시행 대상으로 하며, 이들 이 전문의 인증을 받으려면 연간 일정 건수 이상의 근접오류 를 승인 기구에 보고해야 한다. 즉, 이 제도는 근접오류의 보 고 의무를 개별 의료인의 인증과 연관시킴으로써 간접적으 로 의무 보고의 형태를 띠게 된다.
표 1에는 제시하지 않았지만, 의무보고 시스템에서는 벌 칙에 관한 문제가 동반되는데, 법적인 의무를 다하지 않았을 경우에 이에 상응하는 처벌이 따르는 것이 일반적이기 때문 이다. 미국의 매사추세츠(Massachusetts) 주 같은 경우 보험 자(insurer) 혹은 보건의료 제공자들이 규정에 따라 사건을 적 절하게 보고하지 않을 경우 의료 질 및 비용 위원회(Health Care Quality and Cost Council)가 관련 사항의 해명을 요구 하는 서면의 통지를 하게 되고, 이들은 서면의 통지를 받은 1 주 혹은 2주 내에 관련 자료를 제출해야 하며, 만약 이들이 정당한 사유 없이 이 통지에 대하여 해명하지 않을 경우 정 해진 기한으로부터 늦어지는 1주일에 1000달러의 벌금(최대 50000달러)을 부과하고 있다. 벌금이나 과태료와 같은 직접 규제의 방법뿐만 아니라 인증, 자격부여, 감사와 같은 간접 적인 규제와 보고 의무를 결부시키는 경우도 있다.
보고자
캐나다, 프랑스 등 대부분의 보고 시스템에서는 보고를 해 야 하거나 할 수 있는 주체가 의료인 혹은 병원에 국한되어
있었고, 스웨덴, 덴마크 등 일부 보고 시스템에서는 환자 및 보호자까지 보고자의 범위에 포함되어 있었다(표 1).
보고 수단
각국의 보고 시스템들에서는 온라인, 전화, 우편, 팩스 등 다양한 보고 수단을 사용하고 있었는데, 이는 관련 인프라 및 기술 수준에 영향에 따른 것으로 생각된다(표 1). 특기할 점은 영국의 경우 온라인과 전화를 보고 수단으로 병행하다 가, 현재 온라인으로만 보고를 받고 있다는 것이다.
보고된 자료의 분석과 관련한 요소
보고된 자료의 분석 주체
각국의 보고 시스템들에서는 자료 분석을 수행하고 있었 고, 미국이나 싱가포르처럼 이를 강제한 보고 시스템도 있었 다. 또 뉴질랜드처럼 의료기관에 분석의 의무를 부여하기도 하지만, 대부분의 보고 시스템에서는 보고받은 기관 내지 다 른 기관에서 자료를 분석하고 있었다(표 2). 구체적으로 미국 에서는 보건복지부(Department of Health and Human Ser- vices)에 분석의 의무를 부여하고 있고, 실제 보고된 자료를 분석하여 의료오류의 경향 및 패턴을 확인하도록 하는 것에 는 보건의료 연구 및 질 연구소(Agency for Healthcare Re- search and Quality, 이하 AHRQ)가 관여하고 있다. 영국에서 도 개별 사건보다는 사건들의 전체적인 경향 등을 파악하는 데에 초점을 맞추고 있는데, 국가보건서비스(National Health Services, 이하 NHS) 내 환자안전(향상) 부서[Patient Safety (Improvement)]가 분석에 관여한다. 덴마크의 경우 위해사 건이 야기한 위해의 정도에 따라 분석을 달리하고 있는데, 상대적으로 경한 사건에 대해서는 병원 내에서 분석을 하여 그 분석 결과를 함께 보고하도록 하고 있고, 중간 정도의 사 건에 대해서는 자료를 모아서, 중대한 사건에 대해서는 개별 사건에 대하여 국가환자권익기구(National Agency for Pati- ents’ Rights and Complaints)에서 근본원인분석을 수행하여 그에 따른 조치를 취하고 있다. 2004년에 약 6000건의 위해 사건이 보고되었고, 그 결과 137건의 구체적인 개선안을 도 출하였으며, 보고받은 위해사건의 50%가 투약오류로 추정 되어 약물배분 방식을 변화시킴으로써 문제를 개선하였다.
분석한 자료의 공개
호주, 싱가포르와 같이 분석한 결과를 병원에만 알리는 경 우도 있었지만, 영국, 일본, 스웨덴 등 대부분의 나라들의 보 고 시스템에서는 이러한 결과 및 대책을 일반인들에게도 알 려 대중들의 알 권리를 보장하고 있었다.
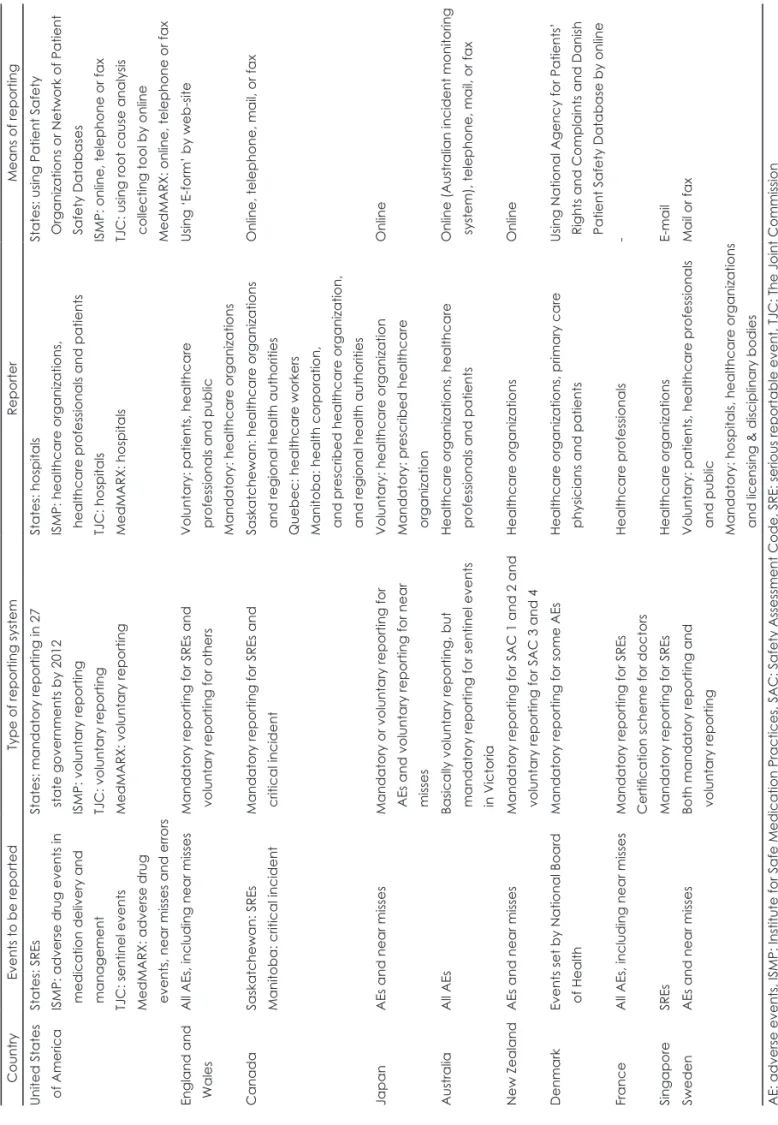
Table 1. Methods of reporting in patient safety reporting system Country Events to be reported Type of reporting system Reporter Means of reporting United States of America States: SREs ISMP: adverse drug events in medication delivery and management TJC: sentinel events MedMARX: adverse drug events, near misses and errors
States: mandatory reporting in 27 state governments by 2012 ISMP: voluntary reporting TJC: voluntary reporting MedMARX: voluntary reporting States: hospitals ISMP: healthcare organizations, healthcare professionals and patients TJC: hospitals MedMARX: hospitals
States: using Patient Safety Organizations or Network of Patient Safety Databases ISMP: online, telephone or fax TJC: using root cause analysis collecting tool by online MedMARX: online, telephone or fax England and Wales All AEs, including near misses Mandatory reporting for SREs and voluntary reporting for others Voluntary: patients, healthcare professionals and public Mandatory: healthcare organizations
Using ‘E-form’ by web-site Canada Saskatchewan: SREs Manitoba: critical incident Mandatory reporting for SREs and critical incident Saskatchewan: healthcare organizations and regional health authorities Quebec: healthcare workers Manitoba: health corporation, and prescribed healthcare organization, and regional health authorities
Online, telephone, mail, or fax Japan AEs and near misses Mandatory or voluntary reporting for AEs and voluntary reporting for near misses
Voluntary: healthcare organization Mandatory: prescribed healthcare organization
Online Australia All AEs Basically voluntary reporting, but mandatory reporting for sentinel events in Victoria
Healthcare organizations, healthcare professionals and patients Online (Australian incident monitoring system), telephone, mail, or fax New Zealand AEs and near misses Mandatory reporting for SAC 1 and 2 and voluntary reporting for SAC 3 and 4 Healthcare organizations Online Denmark Events set by National Board of Health Mandatory reporting for some AEs Healthcare organizations, primary care physicians and patients Using National Agency for Patients’ Rights and Complaints and Danish Patient Safety Database by online France All AEs, including near misses Mandatory reporting for SREs Certification scheme for doctors Healthcare professionals - Singapore SREs Mandatory reporting for SREs Healthcare organizations E-mail Sweden AEs and near misses Both mandatory reporting and voluntary reporting Voluntary: patients, healthcare professionals and public Mandatory: hospitals, healthcare organizations and licensing & disciplinary bodies
Mail or fax AE: adverse events, ISMP: Institute for Safe Medication Practices, SAC: Safety Assessment Code, SRE: serious reportable event, TJC: The Joint Commission
보고된 자료 및 보고자의 보호와 관련한 요소
환자안전법의 유무
나라별로 법체계가 달라 직접적인 비교는 힘들지만, 환자 안전 보고 시스템을 갖고 있는 나라들 중 미국, 스웨덴, 뉴질 랜드 등과 같이 국가(연방) 수준에서 독립적인 환자안전법을 제정한 경우도 있고, 호주와 캐나다와 같이 국가(연방) 수준 의 환자안전법은 없지만 개별 주에서 관련 법을 제정한 경우 도 있다(표 3). 또 일본과 같이 보고 시스템 및 의료안전지원 센터 등의 내용을 독립법 형태가 아닌 의료법 내에 규정하는 경우도 있고, 덴마크와 같이 독립법 형태로 관련 내용을 규정 하였다가 다른 법으로 포괄하여 환자안전법을 제정하는 경 우도 있다.
비밀 보호 및 특권
환자안전법에 포함시킬 수 있는 내용은 다양하지만, 환자 안전 보고 시스템을 갖는 나라들에서의 환자안전법은 기본 적으로 보고 시스템으로 보고된 자료에 대한 법적 보호 및 보 고자에 대한 보호를 담고 있었다. 의료기관이 수행한 의료오 류의 보고에 대하여 환자안전법이 부여하고 있는 법적 보호 에는 보고된 자료의 개인 정보에 대한 비밀유지와 보고된 자 료에 대한 증거법상의 특권이 있다. 또 의료오류의 보고자에
대한 법적 보호로는 보고자에 대한 인사상의 불이익 금지와 증언 거부가 있다. 살펴본 나라들에서는 미국과 같이 이러한 내용들을 모두 담은 경우도 있지만, 일본과 같이 그 일부만 규정한 경우도 있다. 또 스웨덴과 같이 위해사건에 대한 보 고를 의무화하였지만, 법적 보호에 대해서는 규정하지 않은 경우도 있으며, 최근에 환자안전법을 제정한 뉴질랜드와 같 이 보호의 선언적 규정만 제시한 경우도 있다.
한편 미국의 경우 인권국(The Office for Civil Rights)에서 는 환자안전 자료가 부적절하게 공개되었다고 주장하는 민 원이 있으면 이를 조사할 수 있고, 만약 법 위반이 확인되면 위반 건당 최대 11000달러의 벌금을 부과할 수 있게 하여 비 밀 보호에 대한 의지를 확실히 보여주고 있다.
환자안전 전담 기관의 유무
보고 시스템을 갖추고 있는 덴마크, 호주, 캐나다 등과 같 은 나라들은 환자안전 전담 기관도 함께 갖추고 있다. 덴마 크의 경우 보고 시스템을 전담하는 기관으로 국가환자인권 기구가 있는데, 2011년부터 설립된 이 기관은 환자의 법적 권리에 초점을 맞춘 독립된 정부의 조직으로 기능하고 있다.
주요 기능으로는 보건의료에 대한 환자 민원 제기의 단일 창 구의 운영, 환자보험협회의 환자 권리 무시 및 보상 결정에 대한 민원, 환자안전 보고 시스템 운영과 관련된 지식의 전
Table 2. Analysis of data in patient safety reporting system
Country Organization in charge of analysis Dissemination of analysis results United States
of America
States: United States Department of Health and Human Services and Agency for Healthcare Research and Quality ISMP: by itself with help of pharmaceutical company and other Patient Safety Organizations
TJC: by itself MedMARX: by itself
States: vary considerably ISMP: public disclosure occurs TJC: public disclosure occurs MedMARX: public disclosure occurs
England and Wales
Patient Safety (Improvement) within National Health Service
Public disclosure occurs
Canada Saskatchewan: healthcare organizations and regional health authorities
Manitoba: critical incident review committee within health corporation, organization and regional health authorities
Quebec: declare the right to know of public Manitoba: the right to know of public is prescribed Canada Vigilance Program: public disclosure occurs
Japan The Division of Adverse Event Prevention in Japan Council for Quality Health Care
Public disclosure occurs
Australia By itself Only open to hospitals
New Zealand Healthcare organizations Public disclosure occurs
Denmark SAC 1: hospitals
SAC 2, 3: National Agency for Patients’ Rights and Complaints
Public disclosure occurs
France Certification scheme for doctors Public disclosure occurs
Singapore SAC 1, 2: Quality Assurance Committee in Hospital Only open to hospitals
Sweden National Board of Health and Welfare Public disclosure occurs
SAC: Safety Assessment Code, ISMP: Institute for Safe Medication Practices, TJC: The Joint Commission
파, 해외여행 및 체류 중 보건의료 권리에 대한 지침 제공 등 이 있다.
영국의 경우에는 국가환자안전기구(National Patient Sa- fety Agency)에서 환자안전 전담 기관의 역할을 수행하였지 만, 2012년 3월 영국 국가보건서비스 기관 정비에 따라 국가 환자안전기구가 없어지고, 그 기관의 핵심 기능인 국가 보고 및 학습 시스템(National Reporting and Learning System)의 운영을 외부(Imperial College Healthcare NHS Trust)에 위 탁하였다. 이 보고체계의 운영 예산은 영국의 국가보건서비 스에서 여전히 지원하고 있다. 국가 보고 및 학습 시스템의 전체적인 운영에 대해서는 영국 국가보건서비스(NHS Eng- land)가 책임을 지고 있다.
미국의 경우, 미국 연방 정부의 보건복지부 산하 AHRQ가
환자안전 등에 대한 연구를 수행하고 있고, 인권국과 더불어 환자안전 및 질 향상에 관한 법(Patient Safety and Quality Improvement Act of 2005) 및 관련 규정의 집행에 있어 책 임을 지고 있다.
특히 미국에서는 환자안전기관(Patient Safety Organiza- tion)을 지정하여 의료 현장의 전문가들과 함께 환자안전 및 의료의 질 향상 활동을 전개하고 있는데, 환자안전기관은 보 고 시스템의 중간 단계에서 환자안전 자료를 검토하고 분석 하며, 이를 AHRQ의 환자안전 데이터베이스 네트워크(net- work of patient safety databases)에 전달하는 역할을 하고 있다. 환자안전기관은 미국의 환자안전 및 질 향상에 관한 법에서 규정한 조건을 충족시키면 되는데, 규제기관이나 보 험회사는 환자안전기관이 될 수 없다. 환자안전기관은 정부
Table 3. Confidentiality of data and reporter in patient safety reporting system
Country Independent patient safety law Confidentiality and privilege Organization dedicated to patient safety United States
of America
PSQIA of 2005 Recognition of confidentiality and privilege for Patient Safety Work Product and prohibition of disadvantage in personnel matters by PSQIA of 2005
ISMP: under PSQIA of 2005
TJC: no protection under PSQIA of 2005 MedMARX: no protection under PSQIA of 2005
Agency for Healthcare Research &
Quality is responsible for some tasks ISMP: PSO
TJC: not PSO MedMARX: not PSO
England and Wales
None Confidentiality assured NHS England outsourced tasks to
Imperial College Healthcare NHS Trust Canada Saskatchewan: The Regional
Health Services Act Manitoba: Regional Health Authorities Act, Manitoba Evidence Act
Saskatchewan: confidentiality and privilege assured
Manitoba: confidentiality and privilege assured
Canadian Patient Safety Institute
Japan Prescribed in medical law Confidentiality assured The Center for Medical Adverse Event Prevention in Japan Council for Quality Health Care
Australia None in federal level Victoria: confidentiality and privilege assured
Australian Patient Safety Foundation
New Zealand New Zealand Public Health &
Disability Amendment Act 2010
Declaratory provisions of protection for reports
Health Quality & Safety Commission
Denmark Prescribed in Danish Health Care Act
Confidentiality assured
Reporter is not punished due to reports by employer, National Board of Health and judiciary
National Agency for Patients’ Rights and Complaints and The Danish Society for Patient Safety
France None Confidentiality assured Haute Autorité de Santé
Singapore Regulation exists Not provided for in the law -
Sweden Patient Safety Act Not provided for in the law National Board of Health and Welfare is responsible for some tasks
PSO: Patient Safety Organization, PSQIA: Patient Safety and Quality Improvement Act, ISMP: Institute for Safe Medication Practic-
es, TJC: The Joint Commission, NHS: National Health Service
의 개입을 최소화하는 미국의 정치 및 행정의 맥락에서 기인 한 미국의 특유한 기관 형태로 볼 수 있다.
우리나라의 외부 보고 시스템
표 4는 앞서 외국에서 시행하고 있는 환자안전 보고 시스 템 검토를 통해 확인한 보고 시스템의 구성 요소 분류와 유 사하게, 우리나라에서 운영되고 있는 기관 외부로의 보고 시 스템의 특징을 정리한 것이다. 이하에서는 각 보고 시스템의 운영 현황을 조금 더 자세하게 기술하였다.
의료관련감염
2013년 현재 국내에서 운영 중인 대표적인 전국 규모의 의 료관련감염 및 항생제 내성균 감시체계로는 전국병원감염감 시체계(Korean Nosocomial Infection Surveillance, http://
konis.cdc.go.kr/konis/index.jsp)와 한국내성세균조사단 (Korean Nationwide Surveillance of Antimicrobial Resis- tance)이 있다. 최근에는 정부 주도로 시행되는 의료관련감 염병표본감시사업(National Infectious Disease Surveillance, http://is.cdc.go.kr)도 운영 중에 있다.
전국병원감염감시체계의 경우에는 2006년 대한병원감염 관리학회에서 질병관리본부의 학술용역연구 사업으로 이를 수행하기 시작하였고 중환자실 환자 감염과 수술부위 감염 감시에 대한 자율보고를 받고 있다. 총 300병상 이상인 종합 병원 중 한 개 이상의 중환자실을 운영하고 있는 병원 중 감 염관리 전담인이 근무하고, 감염관리실의 장이 지정하는 의
사가 의료관련감염에 대한 사례의 검토를 정기적으로 수행 하는 병원을 보고 참여 대상으로 한다. 보고는 주로 온라인 을 통해 받고 있고, 보고된 자료의 분석 내용을 보고서 형태 로 온라인에 공개하고 있지만, 이때 의료기관을 식별할 수 있는 자료는 배제하고 있다.
한국내성세균조사단은 민간(세브란스병원) 주도의 검사 실 기반 항생제 내성 감시체계로 세계보건기구의 권유로 1997년부터 자율보고 형태로 시작하여 참여 검사실에서 수 집된 흔한 균주에 대한 항생제 감수성 자료를 매년 분석 보 고하고, 특별히 문제가 되는 다제내성균에 대해서는 따로 항 생제 감수성 자료를 협력 검사실들로부터 수집하여 분석하 고 있다.
의료관련감염병표본감시사업의 경우에는 2010년 12월 30 일부터 전면 시행된 ‘감염병의 예방 및 관리에 관한 법률’에 의거한 표본감시 6종에 대해 정부에서 표본감시체계를 운영 하고 있는데, 의무보고 방식으로 운영되고 있다. 모든 보고 시스템들은 온라인, 팩스 등을 통해 자료를 수집하고 있었지 만, 자체 분석한 자료를 전파하고 있지는 않았고, 보고 시스 템 자체에서 비밀 보장을 하고 있는 상태이다. 하지만 의료 관련감염병표본감시사업을 비롯하여 의료관련감염의 감시 체계만을 전담하는 기관은 없는 실정이다.
의약품
한국의약품안전관리원(https://www.drugsafe.or.kr/ko/
index.do)에서 의약품 유해사례 보고관리 시스템의 운영을
Table 4. Overview of external reporting system related to healthcare in South Korea
Factors Healthcare-associated infection Drug Blood
Events to be reported
Designated infection cases Adverse drug reaction Adverse reaction related to transfusion
Type of reporting system
KONIS: voluntary reporting KONSAR: voluntary reporting NIDS: mandatory reporting
Basically voluntary reporting and mandatory reporting for safety supervisor of pharmaceutical company or importing firm
Voluntary reporting
Reporter Hospitals and healthcare professionals
Safety supervisor of pharmaceutical company or importing firm, patients, healthcare professionals, and public
Healthcare professionals
Means of reporting Online, fax, and so on Online, telephone, mail, or fax Online, fax, and so on Organization in
charge of analysis
By itself By itself By itself
Dissemination of analysis results
None Public disclosure occurs Public disclosure occurs
Confidentiality and privilege
Confidentiality assumed Confidentiality assumed Confidentiality assumed
Dedicated organization
None Korea Institute of Drug Safety and
Risk Management
None
KONIS: Korean Nosocomial Infection Surveillance, KONSAR: Korean Nationwide Surveillance of Antimicrobial Resistance, NIDS:
National Infectious Disease Surveillance
맡고 있다. 여기서의 유해사례란 의약품 등의 투여, 사용 중 발생한 바람직하지 않고 의도되지 않은 징후(sign), 증상 (symptom) 또는 질병을 의미한다. 의약품 유해사례 보고관 리 시스템은 기본적으로 자율보고이지만, 제약회사나 수입 업자의 경우 의무적으로 보고하도록 하고 있다. 보고는 온라 인, 전화, 우편, 팩스 등 다양한 방법을 통해 가능하다. 또 보 고된 자료를 축적한 유해사례 데이터베이스를 이용하여 약 물유해사례의 실마리정보를 분석하고, 특정 유해사례에 대 해서는 보다 체계적인 평가나 심층적인 약물역학연구를 수 행하고 있다. 이렇게 자체적으로 분석한 결과를 대중에게 리 플릿, 뉴스레터 형태로 알리고 있고, 온라인상으로도 공개하 고 있다. 한편 의약품 안전 관리활동을 원활히 진행하기 위하 여 지역별로 지역의약품안전센터를 두고 있다. 과거에 식품 의약품안전청에서 운영해오던 지역의약품안전센터를 2013 년부터 이관 받아 한국의약품안전관리원에서 운영하고 있다.
혈 액
2008년부터 한국혈액안전감시체계(Korean Hemovigi- lance system, http://www.kohevis.or.kr)를 구축하여 수혈 과 관련한 다양한 이상반응의 자율보고를 받기 시작하였다.
여기서 보고 대상으로 삼는 사건은 크게 시간적으로 혈액제 제의 주입과 연관되어 환자에게 발생한 바람직하지 않고 의 도되지 않은 사항인 수혈관련증상(adverse reaction)과 환자 의 부작용 발생과 관계없이 잘못된 수혈이나 부작용을 일으 킬 수 있는, 혹은 그럴 수 있었던 사항(incident)으로 나뉜다.
즉, 혈액관련 위해사건과 근접오류를 모두 보고의 대상으로 삼고 있다. 한국혈액안전감시체계 구축 이전에는 비교적 발 생률이 낮은 수혈전파 감염에 대해서만 관심을 가지거나 소 위 특정수혈부작용이라 분류된 중대한 수혈부작용만을 의무 적으로 보고하게 되어 있었는데, 한국혈액안전감시체계 구 축을 통해 수혈 후 이상반응에 관한 통계 생산 및 그 분석이 이루어지고 있고, 더불어 대중에게 이를 알리는 작업도 이루 어지고 있다.20) 하지만 보고자 및 보고기관에 대한 정보는 보 고 받을 때 폐기하기 때문에 이에 대한 정보는 공개되지 않는 다. 보고는 주로 온라인을 통해 이루어지지만 팩스 등도 보 고에 사용할 수 있고, 의료인이면 누구나 보고 가능하다. 한 국혈액안전감시체계를 전담하는 기관은 없는 실정이다.
고 찰
이 글에서는 환자안전 보고 시스템의 이론적 측면인 구축 배경 및 중요성, 효과적인 보고 시스템의 요건들 등을 살펴 보아 환자안전 보고 시스템의 설계에 있어 비처벌성, 비밀
보장, 독립성, 전문가 분석, 적시성, 시스템 지향성, 반응성, 접근성이 중요함을 확인하였다. 또 문헌검토 등을 통해 해외 에서 운영되고 있는 환자안전 보고 시스템의 구성 요소를 정 리하고, 현재 우리나라에서 운영되고 있는 기관 외부로의 환 자안전 보고 시스템을 구성 요소별로 분석, 비교하였다. 최 근 환자안전법이 제정됨에 따라 앞으로 환자안전 보고 시스 템이 구축될 것으로 예상되는 현 시점에서, 이번 연구의 결 과를 바탕으로 앞으로 구축해나가야 할 환자안전 보고 시스 템의 구체적인 모습을 위한 시사점들을 다음과 같이 확인할 수 있었다.
첫째, 환자안전 보고 시스템에서는 의무보고와 자율보고 를 병행할 필요가 있다. 외국의 대부분의 환자안전 보고 시 스템은 이 두 가지 형태의 보고 시스템을 병행하고 있다. 자 율보고 시스템과 의무보고 시스템은 모두 각각 중요한 역할 을 하는데, 전자의 경우는 오류가 일어날 수 있는 영역에서 교훈을 얻어 더 큰 사고의 발생을 미연에 방지할 수 있고, 후 자의 경우는 병원 내 혹은 병원 간 학습 경험의 공유라는 측 면뿐만 아니라 사회적 책임을 구현한다는 측면에서도 중요 하다.18) 특히, 일반인들도 불안전한 의료 사건들에 대한 알 권리를 가진다는 점을 고려했을 때, 적신호사건 등을 대상으 로 한 의무보고 시스템이 필요하겠다. 일각에서는 참여가 중 요한 보고 시스템의 특성상 의무보고 시스템에서의 과소보 고에 대한 우려가 있다. 물론 의무보고 시스템에서의 과소보 고 문제가 없는 것은 아니지만, 이것은 의무보고 시스템만의 문제는 아니다. 왜냐하면 보고 건수는 단순히 자율보고 시스 템이냐 의무보고 시스템이냐는 문제라기보다는 보고에 대한 비밀 보호, 보고자의 인식, 환자안전 문화와 같은 다른 여러 요인의 영향을 받고 있기 때문이다.18)
둘째, 근접오류부터 적신호사건까지 다양한 종류의 환자 안전 사건의 보고를 받을 필요가 있다. 이를 통해 학습과 보 고 시스템 향상을 위한 풍부한 자료를 수집할 수 있다. 특히 이는 의무보고 및 자율보고와도 연관되는데, 의무보고에서 적신호사건과 같은 위해의 정도가 심한 사건을 보고하게 하 는 것은 사건 자체의 심각성 때문이지만, 적신호사건이 드물 게 발생하는 사건임을 고려했을 때 의료기관 내의 보고 및 자체 분석으로는 사건의 유형 및 경향의 파악이 어렵기 때문 이기도 하다. 즉, 전국적 보고 시스템과 같이 보고 시스템의 규모를 크게 할 경우 유사한 사건 발생의 경향을 파악하기가 더 쉬워지고, 사건의 분석력을 개선할 수 있다.
특히, 현재 우리나라의 외부 보고 시스템의 경우에 위해 의 정도에 따른 보고 대상의 세분화가 없고, 의료오류 여부 를 거의 고려하지 않고 있기 때문에 앞으로 구축할 환자안전 보고 시스템은 보고 대상에 의료오류로 인한 사건을 포함시
켜야 할 것이다. 일례로 혈액 보고 시스템의 경우 2011, 2012 년 자료를 기준으로 증상이 있는 총 610건의 수혈 특이사항 보고 중 3건만이 오류가 있는 것으로 파악되었는데, 이는 의 료오류가 덜 보고되고 있기 때문인 것으로 보인다. 물론 의 료관련감염의 경우에는 다른 보고 대상에 비하여 의료오류 의 발생이 동반되었는지 밝히기 힘들고, 의약품 유해사례 보 고관리 시스템의 경우에는 보고 받은 자료에 대한 분석을 통 하여 중대한 유해사례 보고 건을 추출하여 대응하고 있지만, 처방, 조제 및 투약오류 등의 의료오류에 대한 자료를 수집 하지 않고 있다. 보고 시점에서부터 의료오류에 대한 자료 수집 방안을 강구할 필요가 있다.
셋째, 보고자의 범위도 가급적 넓게 하고, 다양한 보고 수 단을 이용하는 것이 필요하다. 의무보고 시스템의 경우에는 보고 의무자를 한정하는 것이 불가피하겠지만, 자율보고 시 스템의 경우 충분한 보고 건수를 얻기 위하여 보고자의 범위 를 확대하는 것이 바람직하다. 하지만 의무보고 시스템의 경 우에도 보고자를 굳이 의료인으로 한정할 필요는 없을 것으 로 보이는데, 모든 보고 의무자가 보고 대상을 보고하지 않 을 수도 있고, 관련 사실의 정확한 확인을 위해서는 굳이 보 고자의 범위를 제한할 필요는 없을 것으로 판단된다. 특히 환자 및 그 가족은 의료인들을 통해 보고되지 않는 환자안전 사건을 추가적으로 보고할 수 있는 대상으로 이들을 보고자 의 범위에 포함시키는 것은 환자안전 보고 시스템의 학습 능 력을 높여줄 수 있는 좋은 방안이 될 것이다.16)
더불어 다양한 보고 수단을 이용하는 것이 필요한데, 검토 한 외국의 보고 시스템에서 주로 사용하고 있는 보고 수단은 온라인 보고로, 이는 보고의 신속성 및 편의성을 위한 것으 로 보인다. 그러나 충분한 보고를 얻고 보고의 접근성을 높 이기 위해서는 온라인 이외의 보고 방식도 가능하게 할 필요 가 있겠다. 다만, 용이한 분석 작업을 위해서 자료 수집 단계 에서부터 표준화된 보고 양식을 사용하는 것이 중요한데, 보 고자의 눈높이에 맞추기 위하여 일반인과 의료인의 보고 양 식을 구분하여 만들 필요가 있다.
넷째, 보고된 자료를 분석할 적절한 도구, 지식, 전문가를 갖출 필요가 있다.16,21) 보고 시스템의 목적은 보고를 수집하 는 것에 그치는 것이 아니라 보고된 자료를 분석하여 활용하 고 적절한 도구, 전문지식, 자원을 이용하여 오류의 재발을 막는 것이다. 일반적으로 보고된 자료를 분석하는 것이 보고 를 받는 것보다 더 어렵고, 시간과 비용이 더 많이 든다.18) 특 히, 우리나라의 현행 보고 시스템을 검토한 결과, 보고된 자 료 분석이 미흡하거나 한계가 있었다. 즉, 각 시스템마다 보 고받은 자료에 대한 경향 등을 분석하고 있었지만, 기술적 분 석에 그치고 있다. 유사한 위해사건들의 재발을 막으려면, 근
본원인분석 등과 같이 관련 위험요인을 파악할 수 있는 분석 이 함께 이루어져야 할 것이다. 보고 시스템에서 보고된 자료 의 분석과 향후 대책에 대한 조치를 취하지 않는 것은 보고 하는 데에 투입된 자원, 시간 등을 낭비하는 것과 같기 때문 에 자료 분석에 대한 의무, 기한 등을 명문화할 필요가 있다.
다섯째, 분석한 결과를 바탕으로 수립한 환자안전 증진 대 책을 의료인 및 의료기관뿐만 아니라 일반인들에게도 알릴 필요가 있다. 특히 이는 환자안전에서의 환자의 역할을 강조 하는 것과 맥락을 같이 하게 되는데, 환자안전을 위해서는 환 자 스스로가 자신이 받는 진료의 위험성과 이를 줄이기 위한 대책에 대한 정보를 환자에게 제공할 필요가 있기 때문이다.22)
여섯째, 보고된 자료와 보고자에 대한 비밀유지를 철저하 게 해야 한다. 검토한 국가들에서는 효과적인 환자안전 보고 시스템 운영을 위해서 환자안전법을 제정하고 있었다. 즉, 환자안전법에서는 의료기관의 의료오류 및 위해사건의 보고 에 대한 철저한 비밀유지를 담보하여 의료기관의 의료오류 보고 및 환자안전 개선에 적극적으로 참여할 수 있도록 해야 할 것이다.23) 우리나라의 환자안전법에서는 보건복지부장관 이 운영하는 환자안전사고학습・보고시스템에 대한 자율보 고에 대해서 비밀을 보장하고 있으나, 의료기관이 운영하는 내부 보고체계 및 기존의 관련 보고체계는 환자안전법이 정 한 비밀 보장의 범위에 포함되어 있지 않아 앞으로 이에 대 한 보완이 필요하다.
일곱째, 환자안전 보고 시스템을 운영할 명확한 주체, 즉 환자안전을 위한 전담 기관의 설립이 필수적이다. 우리나라 의 기관 외부로의 보고 시스템의 경우 그 운영 주체에 대한 불안정성 문제가 존재하고 있다. 의약품 유해사례 보고관리 시스템의 경우 한국의약품안전관리원이라는 독립적인 기구 에서 이를 운영하고 있지만, 의료관련감염이나 혈액의 경우 에는 운영 주체가 다양하거나 학회에서 각각의 보고 시스템 을 운영하고 있어, 보고 시스템의 안정적인 운영이 문제될 수 있다. 만약 환자안전을 위한 전담 기관을 설립한다면 이 기관의 주된 역할은 보고 시스템의 관리 및 수집된 자료의 분석, 환류의 업무일 것이다. 또 기관의 위상의 경우 보건복 지부 산하가 될 가능성이 높아 보이지만, 기관의 독립성을 좀 더 높이기 위해서는 국무총리 산하에 두는 것도 고려해볼 필요가 있다. 나아가 보고 시스템의 운영 안정성을 위해서 환자안전을 전담할 수 있는 기관에서 이 같은 보고 시스템을 통합적으로 관리하는 것이 필요하다. 통합된 보고 시스템은 한국의료분쟁조정중재원에 수집된 자료, 의료기기에 대한 추적관리 자료, 의료 분야에 적용시킬 수 있는 다른 분야의 안전 자료 등과 같이 환자안전을 증진시킬 수 있는 자료 수 집의 범위를 가급적 확대하는 것이 필요하다. 환자안전과 관