파킨슨병의 조기진단과 치료
김 중 석
가톨릭대학교 의과대학
서 론
파킨슨병(Parkinson’s disease)의 임상적인 진단은 행동의 느려짐, 안정 떨림, 경직, 자세 및 보행 불안정 등의 주요한 운동 증상을 조합하여 이루어진다. 또한 레보도파(levodopa)나 도파민 효능제(dopamine agonist) 에 대한 장기적인 좋은 치료 반응은 진단에 상당한 도움을 된다. 이러한 진단 방법은 파킨슨병이 흑색질 (substantia nigra)에서 도파민 신경세포의 손실과 퇴행으로 인하여 선조체(striatum)에 도파민 공급이 부족해져 발생된다는 점을 근거로 한다.
1-5)그 동안 꾸준하게 파킨슨병의 조기진단의 필요성에 대해 제기되어 왔고 이를 위한 많은 노력들이 있어 왔다. 이는 적절한 치료와 예후, 병인론의 파악을 통한 신경 퇴행의 기전을 파악하기 위해 매우 중요하다.
게다가 최근 연구들에 의하면, 파킨슨병 환자를 대상으로 조기치료를 한 환자 군이 그렇지 않은 환자 군과 비교하였을 때 더 좋은 예후를 보인다는 결과도 있었다.
6,7)최근까지 연구된 임상적인 진단법, 신경영상을 통한 진단법 그리고 병리학적 진단법 등을 통하여 파킨슨 병의 전형적인 운동 증상이 나타나기 전에 짧게는 5년에서 길게는 20년까지 운동 증상 전 시기(premotor phase)가 있음이 보고되어 있다.
8-12)이를 이해하기 위해서는 Braak 등에 의해 제기된 파킨슨 병의 시누클레인 병리과정(synuclein pathology)에 대한 가설이 중요하다.
13)이 가설에 따르면, 루이체(Lewy bodies and neuritis)들 이 하부 뇌간(lower brainstem)에서 먼저 병리과정을 일으키기 시작하여서 위쪽과 아래쪽으로 퍼져나가고 뇌간의 대부분에서 병리과정이 일어난 후에 중간뇌(mesencephalon)와 흑색질을 침범하여 운동증상이 생긴다 는 것이다.
13)따라서 흑색질 침범 이전까지의 기간 동안 여러 비운동성 증상이 먼저 발생될 수 있고 이를 이용하여 조기진단에 사용할 수 있다는 가설을 설명할 수 있다. 결국 파킨슨병의 운동 증상이 나타나기 전에 오랜 기간의 취약한 신경 세포의 퇴행이 나타나며, 40∼60% 정도의 도파민 신경의 소실 후에 운동 증상이 보이게 된다(Fig. 1).
14-16)이러한 점들이 파킨슨병 진단 방법과 치료 과정에 많은 변화를 일으키고 있다. 여기서는 운동 증상 전
기간의 증상과 이의 임상적 가치, 그리고 파킨슨병의 약물 치료와 수술적 치료에 대하여 알아보겠다.
Figure 1. Natural history of Parkinson’s disease.
Table 1. PD‐related non motor signs and symptoms in relation to neuropathology Non-motor signs and symptoms Braak & Colleagues Extra-nigral pathology
Hyposmia Stage 1 Olfactory bulb, anterior olfactory nucleus
Dysphagia Dorsal motor glossopharyngeal nucleus
Constipation Dorsal motor vagal nucleus
Bladder dysfunction Postganglionic parasympathetic neurons*
Sexual dysfunction Preganglionic and postganglionic
Orthostatic hypotension Sympathetic neurons*
Pain, inattention State 2 Coeruleus‐subcoeruleus complex
Depression, sleep disorders Lower raphe nuclei
Executive dysfunction Gigantocellular reticular nucleus
Autonomic dysfunctions Stage 3 Central subnuclues of the amygdala
Executive dysfunction Ventral tegmental area
REM sleep behavior disorder Pedunculopontine nucleus
Inattention, drowsiness and Magnocellular cholinergic nuclei
cognitive dysfunction with of the basal forebrain
fluctuating consciousness Oral raphe nuclei
Executive dysfunction, apathy, Stage 4 Anteromedial temporal mesocortex mnemonic, and emotional problems Basolateral subnuclei of the amygdala Agnosia and apraxia Stage 5 Prefrontal and high order sensory association
fields of the neocortex
Sensorimotor dysfunction Stage 6 Premotor and first order sensory association fields of the neocortex, as well as primary areas of the neocortex
*awaits confirmation.
운동증상 전 기간(premotor phase)의 증상과 진단방법
현재까지 밝혀진 운동증상 전 기간에 관찰될 수 있는 비운동 증상들은 매우 다양하다. 후각 증상, 자율신 경계 이상, 기분 장애, 수면 장애, 인지 장애, 감각 이상 등이 이에 포함된다(Table 1).
17)1. 후각 소실
후각 소실(hyposmia)은 파킨슨병 환자의 90% 이상에서 관찰되며 냄새나 악취를 인식하지 못하거나 구별 하지 못하는 증상을 의미한다.
18)후각 소실은 파킨슨병이 새로 진단된 환자에서 너무 흔하게 보여 일부 연구자들은 진단 기준의 하나로 포함시키고자 하는 시도도 있다. 이 증상은 병의 유병기간이나 진행 정도와 는 독립적으로 나타난다.
19-21)따라서 후각 상실은 파킨슨병에서 운동 증상 전 기간의 비운동 증상으로 많은 연구들이 이루어져 왔다.
최근의 전향적인 한 연구에서 후각 상실과 파킨슨병의 발생 가능성과의 관계를 조사하였다. 파킨슨병이 나 치매가 없는 노인 2,267명을 대상으로 연구한 결과 후각기능이 떨어지는 하위 25% 집단에서 상위 75%의 집단보다 파킨슨병의 발생이 더 높았다. 특이한 점은 추적한지 4년 안에 대부분의 환자가 발생되었다는 것이다. 이는 후각 상실은 4년 안에 발생하는 파킨슨병의 예측 인자로써 작용될 수 있다는 가능성을 제시한 다.
22)다른 연구에서 파킨슨병 환자의 가족 250명을 대상으로 후각 검사를 시행하였을 때, 그 중에 25명의 환자에서 후각 저하를 보였고 그들의 도파민 수송체(dopamine transporter) 영상에서 4명에서 선조체의 도파 민이 감소되어 있었고, 그들 중에 2명이 12개월 이내에 임상적인 파킨슨병 증상이 나타났다.
23)이러한 연구 결과들은 후각 소실이 파킨슨병의 초기증상이 될 수 있으며, 운동증상이 발생되기 전에 관찰 될 수 있다는 것을 제안하고 있다. 또한 후각에 대한 검사는 간단하고 안전하다는 장점이 있다. 펜실베니아 대학에서 개발한 University of Pennsylvania Smell Identification Test (UPSIT) 후각 기능 검사법이 가장 많이 이용 되지만,
24)한국인에 바로 적용하기에는 문화적인 차이로 정형화하기는 힘들다. 또한 후각 소실은 Braak staging와 잘 일치되지 않는 부분이 있다는 것이 의문점이다.
2. 자율 신경계 이상
파킨슨병에서는 여러 가지 자율 신경계 이상소견이 자주 관찰되며
25)대개 운동증상보다 선행 할 수 있
다.
26,27)따라서 자율신경계 기능이상을 파킨슨병의 운동 증상 전 기간의 증상 또는 위험인자로 고려할 수
있다.
28-31)1) 위장계 이상: 중추신경계를 ‘큰 뇌(large brain)’라고 부를 수 있고 위장 신경계를 ‘작은 뇌(little brain)’라 고 할 수 있을 만큼, 위장 신경계(enteric nervous system)의 이상은 파킨슨병 진행의 표지로 생각할 수 있다.
위식도 역류 및 기능이상, 구역 상복부 팽만감과 같은 위장관의 운동 이상은 위장관의 자율신경계 이상과
관련이 있고 이러한 증상들은 파킨슨병의 운동증상의 발생 이전에 관찰될 수 있다.
32-35)또한 변비는 파킨슨
병의 운동 증상 전 기간의 증상들 중에 가장 강력하면서도 일관된 연구 결과를 보이는 자율 신경계 이상
증상 중 하나이다.
36,37)변비는 파킨슨병 환자의 60∼80%에서 관찰된다.
37-39)파킨슨병과 치매가 없는 노인을
대상으로 시행된 대규모 지역 주민 연구에서는 하루에 한번 이하의 장 운동이 있는 집단이 하루에 한번
이상의 장 운동이 있는 집단보다 파킨슨병의 위험이 2.7배 높다는 보고도 있다.
40)이러한 연구 결과들은
변비가 파킨슨병의 조기 증상으로써 의미가 있고 이는 파킨슨병의 병태생리학적 과정과 연관이 있다는
A B
C
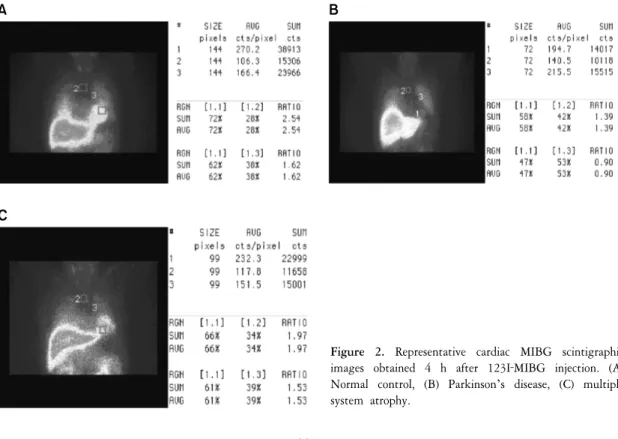
Figure 2. Representative cardiac MIBG scintigraphic images obtained 4 h after 123I‐MIBG injection. (A) Normal control, (B) Parkinson’s disease, (C) multiple system atrophy.
것을 의미한다. 최근에 파킨슨병에 관련된 병리학적 연구들에서 흑색질에 병리학적 변화가 발생되기 이전 에 미주신경의 등쪽 핵(dorsal nucleus of vagus nerve)과 창자신경총(enteric nervous plexus)에 알파 시누클레인의 침착이 관찰되는 것으로 알려져 있다.
13,41)2) 비뇨 생식기계: 비뇨 생식기계의 이상과 발기부전도 파킨슨병의 운동 증상 전 기간의 증상으로 연구되 어 왔다. 비록 변비와 같은 대규모 전향적 연구는 없지만 한 후향 코호트 연구에서 발기부전이 있는 환자가 3.8배의 파킨슨병 발병 위험성과 연관된다고 보고하였다.
42)또한 파킨슨병의 운동증상이 발생되기 전에 소변 장애가 발생된 환자에서 Onuf’s 핵에 루이체의 침착이 관찰되었다는 보고도 있다.
43)위장관계와 비뇨 생식기계 이상이 파킨슨병의 운동 증상 전 기간의 비운동성 증상으로 인지되면서 식도 압 검사(esophageal manometry), 항문압 검사(anorectal manometry), 항문 조임근 근전도(anal sphincter EMG) 등 많은 검사들이 시행되고 있다.
3) 심혈관계: 파킨슨병의 운동 증상 전 시기의 심혈관계 관련 자율 신경계 이상은 식후 저혈압과 기립성
저혈압을 임상적으로 자주 관찰 할 수 있다. 이는 시누클레인 병리 소견이 심장의 자율 신경계를 침범하여
나타난다고 판단되며 이에 따라 많은 임상적, 영상학적 연구들이 이루어졌다.
44,45)그러나 체위에 따른 혈압
검사 등을 이용한 연구에서 기립성 저혈압은 파킨슨병의 조기증상으로써 많은 의미를 갖지 못한다는 보고
도 있다.
44)이러한 사실을 바탕으로 파킨슨병 환자들을 대상으로 체위에 따른 혈압 검사, 24시간 혈압 검사,
기립경사 검사(head up tilt test) 등을 시행할 수 있다. 최근에 Metaiodobenzylguanidine (MIBG)를 이용한 심장의
교감신경의 손상을 이용한 연구는 파킨슨병과 다른 유사 질환의 감별에 도움이 된다(Fig. 2).
46)이는 심장의
교감신경에 시누클레인의 병리학적 침착에 의해 루이체가 쌓이면서 탈신경(denervation) 되어서 나타나는
현상으로 설명되고 있다.
47)3. 기분 장애와 수면장애 그리고 기타 정신 장애
우울증은 파킨슨병 환자에서 흔하게 발생된다. 최근 보고에 따르면 파킨슨병 환자에서 주요 우울장애 (major depressive disorder)의 평균 유병률은 17%, 경증 우울증(minor depressive disorder)은 22%, 기분 저하증 (dysthymia)은 13%였다.
48)우울증은 파킨슨병 초기에 27.6% 이상에서 발생될 수 있고,
49)몇몇 연구에서는 운동증상보다 선행 할 수 있다고 보고되어 있다.
50-52)최근에 경두개 초음파를 이용한 연구에 따르면 파킨슨 병의 특징적인 흑색질의 고에코(hyperechogenicity) 영상이 파킨슨병이 없는 우울증 환자에서 정상인보다 3배 나 많이 관찰이 되었다.
53)그러나 우울증과 파킨슨병과의 관계는 아직 밝혀지지 않은 부분이 많아 추후 대규모 연구가 필요하다.
수면장애는 정상인보다 파킨슨병에서 약 1.5∼3.5배정도 많이 관찰된다. 수면장애 중에 렘수면 장애(REM sleep behavior disorder, RBD)와 사건수면(parasomnia)은 파킨슨병의 운동증상보다 선행해서 관찰된다는 보고들 이 있다.
54,55)또한 비정상적인 수면은 가족성 파킨슨병의 초기 증상으로 발생되기도 하고,
56)주간 과다 졸림 (excessive daytime sleepiness)이 있는 집단이 정상인보다 파킨슨병 발생률이 높다는 보고도 있다.
57)따라서 최근 에는 파킨슨병 환자에서 수면 다윈검사를 통해 수면장애의 여부를 확인하는 것은 환자의 삶의 질 개선에 도움이 된다.
그 밖의 비운동 증상으로는 감각이상(통증, 이상감각), 충동 조절장애, 색깔 구별 능력 이상, 인지기능 장애, 하지 불안 증후군 등이 있지만 조기진단을 위한 전운동기간의 증상으로써 유용성 여부는 조금 더 많은 연구가 필요하다.
신경영상을 이용한 조기진단 방법 - 도파민 수송체 영상과 경두개 초음파 검사
흑색질-선조체(nigrostriatal)의 연접 전(presynaptic) 기능을 알아보기 위해 영상 표지자 검사법은 파킨슨병의 대리 표지자로 광범위하게 이용되어 왔다. 이는 도파민 세포의 탈신경화를 알기 위한 것이지만, 이러한 영상의 변화는 도파민 신경세포의 파괴와 같은 병리학적 변화를 잘 반영한다고 되어 있다.
58-62)이러한 도파 민 수송체나 F-DOPA의 섭취율은 파킨슨병의 운동 증상의 진행과 일치한다.
63-65)특히 이러한 영상 검사들에 서 도파민 섭취율이 비대칭적으로 떨어지는 소견과 꼬리핵(caudate nucleus)보다 조가비핵(putamen)에서 더욱 감소되는 소견은 다른 비전형적 파킨슨병과의 감별에 도움이 된다(Fig. 3).
66-68)파킨슨병에서 경두개 초음파(transcranial Doppler sonography)를 이용하여 중간뇌(midbrain)를 검사하면 흑색 질에서 고에코 소견이 관찰된다. 이러한 소견은 초기 파킨슨병에서도 관찰이 될 수 있어서 운동 증상 전 기간에 진단을 위한 도구로써의 가능성이 있다.
69)치 료
파킨슨병은 1960년대 후반부터 레보도파가 이용되면서 환자들의 삶의 질을 획기적으로 개선시킬 수 있
었다. 그러나 레보도파 사용 이후 6년 이상 경과하면 약 75%에서 운동변동(motor fluctuation), 이상운동증
등 다른 합병증들이 발생할 수 있다. 따라서 파킨슨병의 치료는 단순히 증상 조절에서 멈추는 게 아니라,
추후 발생된 합병증에 대한 가능성을 고려하면서 이루어져야 한다. 파킨슨병의 치료는 크게 약물치료, 수술
Figure 3. The positron emission tomography images using
18F‐N‐(3‐fluoropropyl)‐2beta‐carbon ethoxy‐3beta‐(4‐iodophenyl) nortropane (FP‐CIT). Bilateral decreased striatal binding uptake was found in a 65‐year‐old patient with Parkinson’s disease.
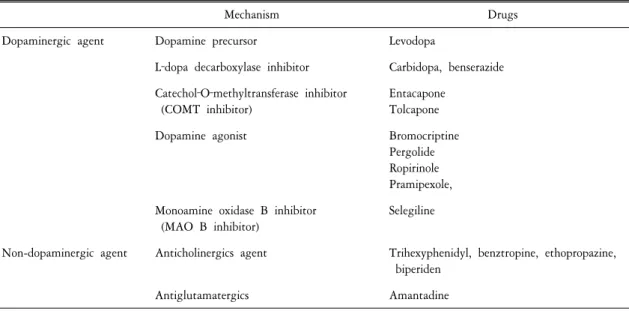
Table 2. Commonly used drugs in Parkinsonism
Mechanism Drugs
Dopaminergic agent Dopamine precursor Levodopa
L‐dopa decarboxylase inhibitor Carbidopa, benserazide Catechol‐O‐methyltransferase inhibitor
(COMT inhibitor)
Entacapone Tolcapone
Dopamine agonist Bromocriptine
Pergolide Ropirinole Pramipexole, Monoamine oxidase B inhibitor
(MAO B inhibitor)
Selegiline
Non-dopaminergic agent Anticholinergics agent Trihexyphenidyl, benztropine, ethopropazine, biperiden
Antiglutamatergics Amantadine
치료, 기타 치료들로 나누어지는데 여기서는 일반적인 약물치료와 수술치료에 관해서만 언급하였다.
1. 약물 치료
1) 파킨슨병에 쓰이는 약물들: 현재까지 많은 종류의 파킨슨병 치료 약물이 개발되었으며 이중 대부분의
약물이 우리 나라에서 사용되고 있다(Table 2). 환자에 따라 어떤 약물을 어느 정도의 용량으로 어느 시기에 시작할 것인가를 결정하는 것은 파킨슨병을 치료하는 의사의 입장에서는 매우 중요한 문제이다. 왜냐하면 파킨슨병은 만성퇴행성 질환이므로 평생 지속적인 치료를 필요로 하며, 경과에 따라 증상이 악화되고 약물 의 부작용이나 새로운 증상이 발생함에 따라 약물의 종류와 용량도 수시로 변화하기 때문이다.
70)대부분 파킨슨병의 주 증상은 선조체에서 도파민이 결핍되어 나타나는 현상이므로 도파민을 보충하고자 하는 것이 파킨슨병 치료의 주된 방법이다.
71)이중 가장 강력한 효과를 발휘하는 약물이 레보도파이다.
레보도파는 말초 L-dopa decaboxylase 억제제(이하, DCI)와 혼합되어 사용되고 있는데 우리나라에서는 carbidopa 혹은 benserazide와 혼합된 레보도파 제제가 시판되고 있다. Sinemet (carbidopa/levodopa), Madopar (benserizide/levodopa) 등의 표준형 제제와 Sinemet CR, Madopar HBS 등의 서방형 제제가 있으며, 흡수시간을 단축시킨 Madopar dispersible과 같은 확산정도 유용하다. 표준형 제제나 확산정 등은 약물 복용 후 약효를 빨리 발휘할 수 있는 반면에 서방형 제제는 혈중 반감기가 더 길지만 임상적 유용성은 적다. 말초 DCI를 레보도파와 혼합함으로써 레보도파 단독 투여 시보다 약 4분의 1의 레보도파 용량으로도 같은 효과를 얻을 수 있게 된다. 레보도파는 L-dopa decarboxylase뿐만 아니라 catechol-O-methyltransferase (COMT)에 의하여 대사 된다. 따라서 COMT 효소 억제제를 병용함으로써 레보도파의 생체이용률을 증가시킬 수 있는데 entacapone 이 이에 해당한다. COMT 효소 억제제는 레보도파의 최대혈중농도를 증가시키지는 않으나 반감기를 증가 시킴으로써 레보도파의 작용시간을 연장시킨다. Entacapone은 작용 시간이 짧아 레보도파 투여 시 매번 같이 복용해야 한다. 따라서 최근에는 Sinemet (levodopa/carbidopa)에 entacapone이 결합되어 있는 Stalevo라는 약제가 시판 중이다.
파킨슨병 증상 조절에 있어서 레보도파 다음으로 강력한 효과를 보이는 것이 도파민 효능제(dopamine agonist)이다. 현재 우리나라에서 사용 가능한 도파민 효능제는 ropirinole과 pramipexole이다. 다른 ergot 계통의 도파민 효능제는 치명적인 늑막, 심판막, 후복부의 섬유증 문제로 일부를 제외하고 사용되지 않는다. 각각 의 도파민 효능제는 도파민 수용체 아형(subtype)에 따라 다른 친화력을 보이며,
72-74)따라서 부작용도 다르게 나타날 수 있다. 도파민 효능제의 항파킨슨 효과는 D2 수용체에 작용하여 나타나며, D1 혹은 D3 수용체의 작용이 파킨슨병 증상에 어떠한 효과가 있는지는 아직 잘 알려져 있지 않다. 일반적으로 모든 도파민 효능 제는 레보도파와 비교할 때 이상운동증을 덜 유발한다.
75)도파민 효능제는 레보도파 치료의 보조요법으로 혹은 단독요법으로도 사용할 수 있다.
71,73)한 가지 고려할 사항은 고령 환자의 경우 혼동이나 환각을 잘 일으킬 수 있다는 점을 주의해야 하며, 일부 환자에서 하지의 부종이 나타날 수 있음을 알고 있어야 한다.
현재 우리나라에서 사용되고 있는 비 ergot계의 도파민 효능제는 갑작스런 수면(sleep attack)을 유발할 수 있는데 졸림 등의 전조 증상 없이 바로 잠들기 때문에 장시간 운전자의 경우 충분한 설명이 필요하다.
76-79)Amantadine은 몇 가지의 작용기전을 가지고 있다. 신경말단부에서 도파민 분비를 촉진시키며, 역시 신경 말단부에서 도파민의 재흡수를 차단하고 항콜린 작용(antimuscarinic effect) 및 glutamate 수용체를 차단시킨다.
약 3분의 2의 환자에서 도파민성 작용을 보여 증상 조절에 도움이 될 수 있으나 망상피반(livedo reticularis), 발목 부종, 환시, 혼동 등의 부작용을 보일 수 있다. 항글루탐산 작용(antiglutamatergic action)은 레보도파에 의한 이상운동증의 조절에 도움이 될 수 있다.
Monoamine oxidase (MAO) 억제제는 경미한 증상조절 효과를 가진다. MAO type B 억제제는 type A 억제제에
서 보이는 소위 ‘cheese effect’는 보이지 않는다. MAO 억제제 중 가장 많이 사용하는 Selegiline의 경우 파킨슨
병의 진행을 억제할 수 있다는 신경보호작용에 대한 논란이 있었으나 장기간 추적 연구 결과 현재는 진행
억제 효과보다는 증상 완화 효과가 주된 효과인 것으로 알려져 있다.
80,81)또한 Selegiline은 레보도파에 의한
경미한 ‘wearing-off’ 현상을 조절하는데 약간의 도움을 줄 수 있다.
82)항콜린제제(anticholinergics)는 1950년대부터 널리 사용되고 있으며 주로 진전을 경감시키는데 도움이 되지 만 다른 파킨슨병의 증상을 조절 하는 데는 상기한 도파민계 약물에 비하여 효과가 떨어진다. 또한 구갈, 배뇨장애, 발한 감소 및 기억력장애, 환각 등의 부작용으로 인하여 투여하는데 어려움이 있을 수 있다. 특히 기억력 장애과 환각은 고령층에서 호발하여 70세 이상의 환자에서는 피하는 것이 바람직하다.
2) 환자에 따른 약물치료: 파킨슨병의 증상이 처음 발생하더라도 실제 이로 인하여 생활에 지장이 있기까 지는 어느 정도 시간이 경과해야 한다. 따라서 레보도파를 장기 투여 시 합병증이 발생할 가능성이 많아지 고, 추후 운동합병증의 위험이 높아진다. 초기에 경미한 환자의 경우 한 가지 약으로 시작하는 것이 좋다.
이 때 가장 많이 고려되는 것이 나이이다. 60세를 기준으로 60세 이하라면 도파민 효능제 소량으로 시작하 는 것이 좋고 60세 이상일 경우 흔히 레보도파 제재를 사용한다. 파킨슨병이 진행되어 중기이상 진행될 시에는 여러 약제들이 조합되어야 하는데 이때부터는 신경과 전문의에게 의뢰하는 것이 좋다.
2. 수술치료
파킨슨병의 수술적 치료는 약물치료로 적절히 치료되지 않아 생활에 지장을 받는 파킨슨병 환자를 대상 으로 시행하게 된다. 이 때 약물로 적절히 치료되지 않는다는 것은 레보도파나 도파민 효능제에 반응이 없다는 것을 의미하는 것이 아니라 반응은 있으나 운동변동, 약물에 의한 이상운동증이 심하여 생활에 지장 을 주거나 이외의 약물 부작용 때문에 충분한 용량의 약물을 투여할 수 없는 경우를 의미한다. 오히려 초기 부터 도파민성 약물에 반응이 없는 환자는 파킨슨병이 아닐 가능성이 많으며 이 경우 수술치료에 의하여 호전되지 않으므로 수술적 치료의 대상이 될 수 없다. 정위적 수술치료의 표적이 되는 뇌 구조물은 복중간 시상핵(Vim; ventrointermediate thalamic nucleus), 후복부 내측 담창구(postroventral GPi; internal segment of glubus pallidus), 시상밑핵(subthalamic nucleus) 등이다. 수술 방법에 따라 열을 가하여 표적을 절제(ablation)하는 방법 과 심부뇌자극(deep brain stimulation) 방법이 시행되고 있다. 현재 시상부위의 수술은 진전을 조절하기 위한 목적으로만 시행되고 있는 반면에 담창구 및 시상밑핵 부위의 수술은 파킨슨병의 전반적인 증상 및 약물에 의한 이상운동증 조절을 목적으로 한다. 최근에는 여러 파킨슨병 수술 방법 중에 내측 담창구와 시상밑핵 심부자극술이 가장 많이 사용되고 있다.
결 론
파킨슨병에 접근 하는데 있어서 무엇보다도 중요한 것은 정확한 진단이 되어야 한다는 것이다. 소위 말하 는 파킨슨증상을 일으킬 수 있는 많은 질환이 있고 이들 중에서는 치료에 반응이 전혀 없는 질환부터 저절 로 호전되는 질환까지 다양하다. 따라서 진단에 있어서 매우 신중해야 하며 전문가와의 상담이 꼭 필요하 다. 최근에 많은 연구가 이루어지고 있는 조기진단을 위한 방법들을 적절히 사용하면 진단에 많은 도움을 줄 수 있다. 또한 현재까지의 많은 연구적 성과와 치료적 발전에도 불구하고 파킨슨병은 아직 완치가 불가 능한 병이다. 그러나 다른 퇴행성 질환과는 달리 약물 및 수술적 치료를 통해 증상 조절이 가능하며 치료적 선택도 다양하다. 따라서 환자 개개인의 나이, 배경 등을 고려한 개별화된 치료 방법을 선택하여야 한다.
그렇기에 정확한 진단과 치료의 발전을 위해서는 신경과, 신경외과 그리고 일차 진료 담당 의사들이 상호
협조적인 연구 및 진료가 절실히 요구된다.
참고문헌
1. Riederer P, Wuketich S. Time course of nigrostriatal degeneration in Parkinson’s disease. A detailed study of influential factors in human brain amine analysis J Neural Transm 1976;38:277-301.
2. Hornykiewicz O, Kish SJ. Biochemical pathophysiology of Parkinson’s disease. Adv Neurol 1987;45:19-34.
3. Fearnley JM, Lees AJ. Ageing and Parkinson’s disease: SN regional selectivity. Brain 1991;114:2283-301.
4. Morrish PK, Rakshi JS, Bailey DL, et al. Measuring the rate of progression and estimating the premotoral period of Parkinson’s disease with [18F]dopa PET. J Neurol Neurosurg Psychiatry 1998;64:314-9.
5. Marek K, Innis R, van Dyck C, et al. [123I]B-CIT SPECT imaging assessment of the rate of Parkinson’s disease progression.
Neurology 2001;57:2089-94.
6. The Parkinson Study Group. A controlled trial of rasagiline in early Parkinson disease: the TEMPO Study. Arch Neurol 2002;59:1937-43.
7. Fahn S, Oakes D, Shoulson I, et al. Levodopa and the progression of Parkinson’s disease. N Engl J Med 2004;351:2498-508.
8. Gonera EG, Van’t Hof M, Berger HJC, Van Weel C, Horstink MWIM. Symptoms and duration of the premotor phase in Parkinson’s disease. Mov Disord 1997;12:871-6.
9. Abbott RD, Ross GW, White LR, et al. Environmental, life-style, and physical precursors of clinical Parkinson’s disease: recent findings from the Honolulu-Asia Aging Study. J Neurol 2003;250:S30-9.
10. Iranzo A, Molinuevo JL, Santamaría J, et al. Rapid-eye movement sleep behaviour disorder as an early marker for a neurodegenerative disorder: a descriptive study. Lancet Neurol 2006;5:572-7.
11. Ross GW, Abbott RD, Petrovitch H, et al. Association of olfactory dysfunction with incidental Lewy bodies. Mov Disord 2006;21:2062-7.
12. Haehner A, Hummel T, Hummel C, Sommer U, Junghanns S, Reichmann H. Olfactory loss may be a first sign of idiopathic Parkinson’s disease. Mov Disord 2007;22:839-42.
13. Braak H, Del Tredici K, Rub U, de Vos RA, Jansen Steur EN, Braak E. Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiol Aging 2003;24:197-211.
14. Fearnley J, Lees A. Ageing and Parkinson’s disease: substantia nigra regional selectivity. Brain 1991;114:2283-301.
15. Marek K. Dopaminergic dysfunction in parkinsonism: new lessons from imaging. Neuroscientist 1999;5:333-9.
16. Morrish PK, Rakshi JS, Bailey DL, Sawle GV, Brooks DJ. Measuring the rate of progression and estimating the preclinical period of Parkinson’s disease with [18F]dopa PET. J Neurol Neurosurg Psychiatry 1998;64:314-9.
17. Tolosa E, Gaig C, Santamar?a J, Compta Y. Diagnosis and the premotor phase of Parkinson disease. Neurology 2009;72:S12-20.
18. Katzenschlager R, Lees AJ. Olfaction and Parkinson’s syndromes: its role in differential diagnosis. Curr Opin Neurol 2004;17:
417-23.
19. Doty RL, Stern MB, Pfeiffer C, et al. Bilateral olfactory dysfunction in early stage treated and untreated idiopathic Parkinson’s disease. J Neurol Neurosurg Psychiatry 1992;55:138-42.
20. Stern M, Doty RL, Dotti M, et al. Olfactory function in Parkinson’s disease subtypes. Neurology 1994;44:266-8.
21. Tissingh G, Berendse HW, Bergmans P, et al. Loss of olfaction in de novo and treated Parkinson’s disease: possible implications for early diagnosis. Mov Disord 2001;16:41-6.
22. Ross GW, Petrovitch H, Abbott RD, et al. Association of olfactory dysfunction with risk for future Parkinson’s disease. Ann Neurol 2008;63:167-73.
23. Berendse HW, Booij J, Francot GMJE, et al. Subclinical dopaminergic dysfunction in symptomatic Parkinson’s disease patients’
relatives with a decreased sense of smell. Ann Neurol 2001;50:34-41.
24. Stern MB. The preclinical detection of Parkinson’s disease: ready for prime time? Ann Neurol 2004;56:169-71.
25. Awerbuch GI, Sandyk R. Autonomic functions in the early stages of Parkinson’s disease. Int J Neurosci 1994;74:9-16.
26. Abbott RD, Petrovitch H, White LR, et al. Frequency of bowel movements and the future risk of Parkinson’s disease. Neurology 2001;57:456-62.
27. Gao X, Chen H, Schwarzschild M, et al. Erectile function and risk of Parkinson’s disease. Am J Epidemiol 2007;166:1446-50.
28. Becker G, Muller A, Braune S, et al. Early diagnosis of Parkinson’s disease. J Neurol 2002;249:S40-8.
29. Przuntek H, Muller T, Riederer P. Diagnostic staging of Parkinson’s disease: conceptual aspects. J Neural Transm 2004;111:201-16.
30. Chaudhuri KR, Daniel G, Healy DG, Schapira AHV. Non-motor symptoms of Parkinson’s disease: diagnosis and management.
Lancet Neurol 2006;5:235-45.
31. Tolosa E, Compta Y, Gaig C. The pre-motor phase of Parkinson disease. Parkinsonism Relat Disorders 2007;13:S2-7.
32. Edwards LL, Pfeiffer RF, Quigley EMM, Hofman R, Baluff M. Gastrointestinal symptoms in Parkinson’s disease. Mov Disord 1991;6:151-6.
33. Pfeiffer RF. Gastrointestinal dysfunction in Parkinson’s disease. Lancet Neurol 2003;2:107-16.
34. Camilleri M, Bharucha AE. Gastrointestinal dysfunction in neurologic disease. Semin Neurol 1996;16:203-16.
35. McCallum RW, Brown RL. Diabetic and nondiabetic gastroparesis. Curr Treat Options Gastroenterol 1998;1:1-7.
36. Ueki A, Otsuka M. Life style risks of Parkinson’s disease: association between decreased water intake and constipation. J Neurol 2004;251:S18-23.
37. Kaye J, Gage H, Kimber A, Storey L, Trend P. Excess burden of constipation in Parkinson’s disease: a pilotstudy. Mov Disord 2006;21:1270-3.
38. Ashraf W, Pfeiffer RF, Park F, Lof J, Quigley EM. Constipation in Parkinson’s disease: objective assessment and response to psyllium. Mov Disord 1997;12:946-51.
39. Siddiqui MF, Rast S, Lynn MJ, Auchus AP, Pfeiffer RF. Autonomic dysfunction in Parkinson’s disease: a comprehensive symptom survey. Parkinsonism Relat Disord 2002;8:277-84.
40. Abbott RD, Petrovitch H, White LR, et al. Frequency of bowel movements and the future risk of Parkinson’s disease. Neurology 2001;57:456-62.
41. Braak H, de Vos RA, Bohl J, Del Tredici K. Gastric alpha-synuclein immunoreactive inclusions in Meissner’s and Auerbach’s plexuses in cases staged for Parkinson’s disease-related brain pathology. Neurosci Lett 2006;396:67-72.
42. Gao X, Chen H, Schwarzschild M, et al. Erectile function and risk of Parkinson’s disease. Am J Epidemiol 2007;166:1446-50.
43. O’Sullivan SS, Holton JL, Massey LA, et al. Parkinson’s disease with Onuf’s nucleus involvement mimicking multiple system atrophy. J Neurol Neurosurg Psychiatry 2008;79:232-4.
44. Goldstein DS. Orthostatic hypotension as an early finding in Parkinson’s disease. Clin Auton Res 2006;16:46-54.
45. Orimo S, Uchihara T, Nakamura A, et al. Axonal alphasynuclein aggregates herald centripetal degeneration of cardiac sympathetic nerve in Parkinson’s disease. Brain 2008;131:642-50.
46. Takatsu H, Nishida H, Matsuo H, et al. Cardiac sympathetic denervation from the early stage of Parkinson’s disease: clinical and experimental studies with radiolabeled MIBG. J Nucl Med 2000;41:71-7.
47. Fujishiro H, Frigerio R, Burnett M, et al. Cardiac sympathetic denervation correlates with clinical and pathologic stages of Parkinson’s disease. Mov Disord 2008;23:1085-92.
48. Reijnders JS, Ehrt U, Weber WE, Aarsland D, Leentjens AF. A systematic review of prevalence studies of depression in Parkinson’s disease. Mov Disord 2008;23:183-9.
49. Ravina B, Camicioli R, Como PG, et al. The impact of depressive symptoms in early Parkinson disease. Neurology 2007;69:342-7.
50. Santamaria J, Tolosa E, Valles A. Parkinson’s disease with depression: a possible subgroup of idiopathic parkinsonism. Neurology 1986;36:1130-3.
51. Shiba M, Bower JH, Maraganore DM, et al. Anxiety disorders and depressive disorders preceding Parkinson’s disease: a case-control study. Mov Disord 2000;15:669-77.
52. Nilsson FM, Kessing LV, Bolwig TG. Increased risk of developing Parkinson’s disease for patients with major affective disorder:
a register study. Acta Psychiatr Scand 2001;104:380-6.
53. Walter U, Hoeppner J, Prudente-Morrissey L, Horowski S, Herpertz SC, Benecke R. Parkinson’s disease-like midbrain sonography abnormalities are frequent in depressive disorders. Brain 2007;130:1799-807.
54. Boeve BF, Silber MH, Ferman TJ, Lucas JA, Parisi JE. Association of REM sleep behavior disorder and neurodegenerative disease may reflect an underlying synucleopathy. Mov Disord 2001;16:622-30.
55. Schenck C, Mahowald MW. REM sleep behaviour disorder: clinical, developmental and neuroscience perspectives 16 years after its formal identification in SLEEP. Sleep 2002;55:281-8.
56. Zarranz JJ, Fernandez-Bedoya A, Lambarri I, et al. Abnormal sleep architecture is an early feature in the E46K familial
synucleinopathy. Mov Disord 2005;20:1310-5.
57. Abbot RD, Ross GW, White LR, et al. Excessive daytime sleepiness and subsequent development of Parkinson disease. Neurology 2005;65:1442-6.
58. Brooks DJ, Ibanez V, Sawle GV, et al. Differing patterns of striatal 18F-dopa uptake in Parkinson’s disease, multiple system atrophy, and progressive supranuclear palsy. Ann Neurol 1990;28:547-55.
59. Asenbaum S, Brucke T, Pirker W, et al. Imaging of dopamine transporters with iodine-123-beta-CIT and SPECT in Parkinson’s disease. J Nucl Med 1997;38:1-6.
60. Mozley PD, Schneider JS, Acton PD, et al. Binding of [99mTc]TRODAT-1 to dopamine transporters in patients with Parkinson’s disease and in healthy volunteers. J Nucl Med 2000;41:584-9.
61. Eidelberg D, Moeller J, Ishikawa M, et al. Early differential diagnosis of Parkinson’s disease with 18F-fluorodeoxyglucose and positron emission tomography. Neurology 1995;45:1995-2005.
62. Frey KA, Koeppe RA, Kilbourn MR, et al. Presynaptic monoaminergic vesicles in Parkinson’s disease and normal aging. Ann Neurol 1996;40:873-84.
63. Kaufman M, Madras B. Severe depletion of cocaine recognition sites associated with the dopamine transporter in Parkinson’s diseased striatum. Synapse 1991;9:43-9.
64. Niznik HB, Fogel EF, Fassos FF, Seeman P. The dopamine transporter is absent in Parkinsonian putamen and reduced in the caudate nucleus. J Neurochem 1991;56:192-8.
65. Wilson JM, Levey AI, Rajput A, et al. Differential changes in neurochemical markers of striatal dopamine nerve terminals in idiopathic Parkinson’s disease. Neurology 1996;47:718-26.
66. Huang WS, Lin SZ, Lin JC, Wey SP, Ting G, Liu RS. Evaluation of early-stage Parkinson’s disease with 99mTc-TRODAT-1 imaging. J Nucl Med 2001;42:1303-8.
67. Booij T, Tissingh G, Boer G. [123I]FP-SPECT shows a pronounced decline of striatal dopamine transporter labeling in early and advanced Parkinson’s disease. J Neurol Neurosurg Psychiatry 1997;62:133-40.
68. Fischman AJ, Bonab AA, Babich JW, et al. Rapid detection of Parkinson’s disease by SPECT with altropane: a selective ligand for dopamine transporters. Synapse 1998;29:128-41.
69. Berg D, Roggendorf W, Schroder U, et al. Echogenicity of the substantia nigra: association with increased iron content and marker for susceptibility to nigrostriatal injury. Arch Neurol 2002;59:999-1005.
70. Im JH, Kang JH, Lee MC. Treatment of Parkinson’s disease. J Korean Neurol Assoc 2001;19:315-36.
71. Hornykiewicz O. Dopamine (3-hydroxytyramine) and brain function. Pharmacol Rev 1966;18:925-64.
72. Perachon S, Schwartz JC, Sokoloff P. Functional potencies of new antiparkinsonian drugs at recombinant human dopamine D-1, D-2 and D-3 receptors. Eur J Pharmacol 1999;366:293-300.
73. Poewe W. Adjuncts to levodopa therapy; dopamine agonists. Neurology 1998;50:S23-6.
74. Watts RL. The role of dopamine agonists in early Parkinson’s disease. Neurology 1997;49:S34-48.
75. Schrag AE, Brooks DJ, Brunt E, Fuell D, Korczyn A, Poewe W et al. The safety of ropinirole, a selective nonergoline dopamine agonist, in patients with Parkinson’s disease. Clin Neuropharmacol 1998;21:169-75.
76. Frucht S, Rogers JD, Greene PE, Gordon MF, Fahn S. Falling asleep at the wheel: motor vehicle mishaps in persons taking pramipexole and ropinirole. Neurology1999;52:1908-90.
77. Hoehn MM. Falling asleep at the wheel: motor vehicle mishaps in people taking pramipexole and ropinirole. Neurology 2000;54:275.
78. Schapira AHV. Sleep attacks (sleep episodes) with pergolide. Lancet 2000;355:1332-3.
79. Ferreira JJ, Galitzky M, Montastruc JL, Rascol O. Sleep attacks and Parkinson’s disease treatment. Lancet 2000;355:1333-4.
80. Parkinson Study Group. Impact of deprenyl and tocopherol treatment on Parkinson’s disease in DATATOP subjects not requiring levodopa. Ann Neurol 1996;39:29-36.
81. Parkinson Study Group. Impact of deprenyl and tocopherol treatment on Parkinson’s disease in DATATOP patients requiring levodopa. Ann Neurol 1996;39:37-45.
82. Golbe LI, Lieberman AN, Muenter MD, Ahlskog JE, Gopinathan G, Neophytides AN, et al. Deprenyl in the treatment of symptom fluctuations in advanced Parkinson’s disease. Clin Neuropharmacol 1988;11:45-55.