단백질은 유전 정보에 따라 세포 내 소기관인 리보솜(Ribosome)에서 만들어진다. 현재 단백질 계 의약품은 유전자 조작을 통해 목적 단백질의 DNA를 숙주 세포(Host Cell)의 DNA에 도입한 뒤 이 세포를 배양시키는 방법으로 얻고 있다. 즉 세포가 성장하면서 유전 정보에 의해 수많은 단백 질이 만들어지는데 이들 중 하나인 목적 단백질을 분리하여 사용하는 것이다.
세포배양법을 통한 충분한 양의 단백질 확보에
는 여러 가지 제약이 따른다. 살아있는 세포이므 로 얻고자 하는 단백질만 우세하게 합성하도록 조 절할 수 없고, 세포가 성장하면서 생성되는 효소 에 의해 만들어진 단백질이 분해, 변형되기도 한 다. 합성하고자 하는 단백질이 그것을 합성하는 숙주 세포의 성장을 저해하는 물질로 작용할 경우 세포 배양을 통해서는 합성이 불가능하다. 이러한 살아있는 세포에서 기인된 문제를 극복하고자, 세 포 외 환경에서의 인위적인 단백질 발현을 유도하 최 차 용
서울대 응용화학부, choicy@snu.ac.kr
상의학 분야와의 공동연구가 필요하며, 바이오 컴퓨터 등 단백질 전자공학 분야의 연구개발에 는 IT분야와의 협조가 필요하다. 그러나 일반적 으로 단백질 제품의 연구개발 및 생산에는 단백 질화학, 단백질체학 등의 기초분야를 이해하고, 단백질 생산기술, 효소반응기술, 단백질칩 등 응 용분야의 교육을 받은 공학자(Biochemical
engineering)의 역할이 제일 중요할 것이다.
단백질이 BT산업에서 차지하는 비중은 제일 크다. 단백질 분자공학 분야에 종사는 우리나라 연구자는 개별적으로 세계최고 수준의 연구결 과를 발표하고 있지만, 절대적인 연구인력의 부 족으로 산업적인 파급효과가 크지 않아 산업적 인 기여로는 외국에 비하여 떨어지는 것으로 생 각된다.
이를 극복하기 위해서는 이 분야의 관련 교수 및 연구인력을 네트워킹화하고 산업적인 또는 학문적인 영향(impact)이 큰 분야에 그룹으로 노력을 집중할 수 있도록 지원이 필요하다. 국 가차원의 단백질 생산공학 연구센터, 효소공학 연구센터, 화학생물공학 연구센터 등과 같은 조 직적인 접근이 요구된다고 하겠다.
응용,
기초,
단백질 분자공학,
산 업 화,
단백질 생산기술, 효소공학, 단백질 전자공학, 화학공정공학,
단백질화학, 단백질체학,
약학, 임상의학,
전자공학, 컴퓨터공학, 동·식물 세포배양,
미생물배양, 무세포단백질합성, 생물분리정제,
효소개량기술, 효소반응공학, 효소반응기공학,
단백질칩 제조, 바이오 컴퓨터 기술,
단백질 특성, 단백질 구조분석,
단백질 구조 예측, 단백질 활성 예측,
< 단백질 분자공학 관련기술 >
여 생산성 향상을 시도한 것이 무세포 단백질 합 성 기술(Cell-free Protein Synthesis)이다.
오늘날의 효소들은 수백만년 동안의 생물학적 진화의 산물이라고 볼 수 있다. 이들 효소들은 보 통 주어진 반응을 높은 특이성과 입체 선택성을 갖고 촉매한다. 그러나 효소들은 그들의 생리학적 인 역할에 완전하게 적응되었기 때문에 활성이나 안정성은 종종 산업적으로 필요한 것과는 거리가 먼 경우가 있다. 이러한 경우는 유기용매들에 대 한 효소들의 안정성을 볼 때 실제로 나타나는 일 이며, 특히 산업적으로 중요한 성분들을 생산하는 반응들의 입체 선택성에 대해서도 나타난다. 방향 적 진화(directed evolution) 기술은 자연적으로 일어나는 진화 과정을 현대의 분자생물학적 방법 인 돌연변이와 재조합 기술을 이용하여 시험관 내 에서 모사하여 만들어진 방대한 biodiversity로부 터 신규 효소 유전자원을 쉽게 탐색할 수 있고, 이 들 유전자원으로부터 원하는 활성을 갖도록 유도 하는 기술이다.
그러나 원하는 효소나 단백질이 숙주세포에 성 장을 저해하거나 숙주세포의 생명 활동에 지장을 주는 것이라면 일반적인 재조합 기술로는 이를 극 복하기가 용이하지 않으므로 무세포 단백질 합성 시스템과 방향적 진화 기술을 융합하고자 하는 노 력이 시도되어지고 있다.
무세포 단백질 합성 시스템
무세포 단백질 합성 기술은 세포에서 단백질 생 산에 관련되는 세포 내 기구만을 추출하여 세포 외부에서 세포의 생리적 조절 기작이 배제된 상태 로 단백질의 합성과정만을 인위적으로 반복시켜 단기간에 대량으로 단백질을 생산하는 것이다.
무세포 단백질 생산 시스템을 구축하기 위해서 는 먼저 세포를 배양하고 그 세포를 파쇄해 단백 질 합성에 필요한 리보솜을 포함한 세포내 소 기
구를 추출한다. 이때 추출액을 만들기 위해 사용 되는 세포로는 대장균을 비롯해 밀 배아 또는 토 끼의 망상적혈구 등의 동물세포들이 있다. 배양 추출액과 함께 단백질 합성에 필요한 여러 구성성 분을 첨가하면 원하는 단백질 생산이 가능해진다.
여기에는 단백질 합성에 재료로 쓰이는 아미노산, 단백질 합성용 에너지원인 ATP, GTP를 비롯해 mRNA합성에 필요한 Ribonucleotide, 목적 단백 질의 유전자인 DNA나 mRNA가 포함되며 기타 생산성 향상을 위한 첨가물들이 추가된다. 또한 에너지원 고갈에 따른 조기 종결 문제를 해결하기 위해 ATP 재생 시스템이 필요하다. 이밖에도 생 산되는 단백질의 활성을 높이기 위해 GroEL/ES 와 같은 chaperone이나 계면활성제 등이 사용되 기도 한다[그림 2].
무세포 단백질 합성 기술은 현재 사용되고 있는 단백질 생산 방법 중 가장 효율적인 것이라 할 수
1st Step, 세포추출 단계,
2nd Step, 단백질 합성단계,
3rd Step, 분리/정제 단계,
단백질 합성관련 리보솜 포함 세포내 소기구의 추출, (대장균 배양 추출액)
-- 아미노산 : 단백질 원료,
-- 에너지원 : 단백질 합성용 에너지(ATP, GTP 등), -- 유전정보 : 목적 단백질의 유전자(DNA 또는 mRNA), -- 기타 생산성 향상용 첨가 물질,
-- 세포막 및 세포내 기관의 방해없이 분리, -- 엔도독신 등 오염 물질이 없으므로 분리/정제 설비 간단,
그림 1. 무세포 단백질 합성 기술의 종합적 조직도.
ATP regeneration system ATP regeneration system
NPs Or NDPs
New poly peptide mRNA
DNA NTPs
Amino acids
Translation factors
GTP GDP
ATP ADP
Transcription Translation
RNA poly- merase
Ribosome
그림 2. 무세포 단백질 합성 반응.
있다. 이 기술은 기존의 살아있는 세포를 이용한 방법과는 달리 생성 단백질 또는 세포 자체에 의 한 단백질 합성 억제 현상이 없고, 인위적인 반응 조건의 조절을 통해 단백질 생산량의 조절 가능하 다. 더불어 세포 성장과 관련된 모든 부반응을 원 천적으로 제거할 수 있어 불필요한 반응원료의 소 모가 배제되어 보다 경제적이다. 또한 연속식 공 정을 도입하면 손쉽게 양질의 단백질을 양산 할 수 있다.
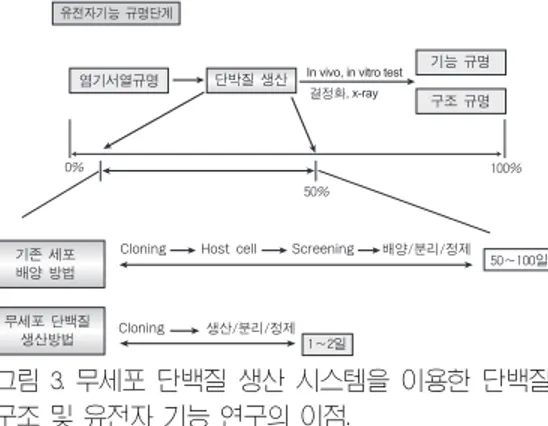
고 생산성과 더불어 무세포 단백질 생산 시스템 이 갖는 가장 중요한 특징은 수 시간 내에 원하는 단백질만을 선택적으로 합성하는 것이 가능하다 는 것이다. 이러한 특성은 생산된 단백질의 분리, 정제과정을 간소화시킴으로서 이 과정에서 비롯 되는 손실을 줄여주고 합성에서부터 순수한 단백 질을 얻기까지 드는 시간과 비용을 혁신적으로 절 감할 수 있게 해준다. 또한 백터와 같은 원형 DNA나 PCR을 이용해 만든 선형 DNA를 혼합 액에 첨가하기만 하면 원하는 단백질의 생산이 가 능하므로 다양한 유전자들을 한번에 대용량 고속 발현 및 스크리닝 해낼 수 있다. 최근 들어 이러한 무세포 생산 시스템의 신속, 정확한 생산력을 이 용하여 유전자로부터의 대용량 고속 단백질 발현 을 통해 단백질의 기능과 구조를 밝히는 연구가 크게 주목받고 있다[그림 3].
그밖에도 무세포 단백질 생산은 세포 생존과 무 관한 합성과정이므로 숙주 세포의 생장 저해나 독 성으로 인해 합성 불가능한 단백질의 제조가 가능 하다. 또한 비천연 아미노산의 위치선택적 도입을 이용해 기존 단백질의 생산 방법으로는 불가능한 인공 단백질 합성의 길이 열렸다.
무세포 단백질 합성 기술의 파급효과는 다음과 같이 예상된다.
고부가 단백질계 의약품의 양산 가능
새로운 인공 단백질의 합성이 용이하므로 단백질 계 신약 및 개량 신약 개발 속도의 획기적 증대 다품종 소량생산의 고부가 의약품 생산에 가장 적합한 경제적 생산 시스템
생물 정보학 연구 속도를 획기적으로 배가 단백질의 고속양산이 가능하여 유전자 기능분 석을 위한 가장 효과적인 방법
본 연구실에서는 대장균 유래의 무세포 단백질 합성 시스템에 관한 다양한 연구를 진행중이며 현 재 고효율/고생산성 무세포 단백질 합성 시스템 을 개발하여 최대 수 mg/ml의 단백질을 수 시간 내에 발현 및 분리 할 수 있다. 무세포 시스템을 실제 의약품(대표적으로 erythropoietin) 합성에 적용하여 기술의 산업적 효용성 검증하였으며, 당 단백질 제조를 위한 핵심 기술인 Glycosylation 기술 개발이 완성단계에 이르렀다. 기존의 화학적 인 방법과는 차별화된 비천연 아미노산을 이용한 위치 선택성과 외부제어 가능한 PEGylation 기술 을 의약용 단백질 제조에 응용하여 새로운 구조의 차세대 EPO 신약을 개발중이다.
한편, 무세포 단백질 생산 시스템을 이용하여 여 러 종류의 단백질을 고속으로 발현하고 분리할 수 있는 시스템을 개발 중이며 단백질을 고체 표면에 방향적으로 고정화시킬 수 있는 기술을 연구와 함 께 이를 단백질 칩에 적용하는 시도를 하고 있다.
Cloning Host cell Screening 배양/분리/정제, 유전자기능 규명단계,
염기서열규명, 단박질 생산,
기능 규명, 구조 규명,
기존 세포, 배양 방법,
무세포 단백질, 생산방법,
0%
50%
100%
50~100일,
1~2일, Cloning 생산/분리/정제,
In vivo, in vitro test 결정화, x-ray
그림 3. 무세포 단백질 생산 시스템을 이용한 단백질
구조 및 유전자 기능 연구의 이점.
방향적 진화를 통한 에폭사이드 가수분해 효소의 개량
광학적으로 순수한 성분들의 생산은 화학 및 제 약산업에 있어서 그 중요성이 계속 증가하고 있으 며, 광학 순수 정밀화학 제품, 제약, 농업 화학제 품, 향 성분 등의 세계시장이 급속도로 팽창하고 있다. 2000년도에 광학순수 화합물들에 대한 세계 시장은 처음으로 1,000억 달러가 넘었다. 키랄성 약물들에 대한 요구는 세표 표면의 수용체들이 키 랄성의 생물분자들이고, 효율적인 약물 분자들은 수용체의 비대칭성과 조합되어야 한다. 더구나 FDA(US Food and Drug Administration)는 이 러한 약물분자가 단일 이성질체로서 생산될 수 있 는지 또는 없는지에 대한 엄격한 평가를 요구하고 있다. 광학활성 성분들의 합성에 대한 이러한 요 구들에 어떻게 대처할 수 있는 방법으로는 기본적 으로 화학 촉매 또는 효소에 의한 두 가지 방법이 가능하다. 효소에 의한 방법의 경우 입체 선택성 반응을 촉매하는 능력을 갖는 많은 효소들이 광범 위한 스크리닝에 의해 밝혀졌다. 그러나 대부분의 경우 주어진 효소의 입체 선택성은 산업적으로 유 용한 반응에 충분치는 않다. 그래서 입체 선택성 효소들을 만들 수 있는 좋은 방법들을 개발하는 것이 요구되어져 왔다.
자연적인 진화는 돌연변이에 의해 수많은 변이 체를 만들어 내며, 이어서 적합한 변이체가 자연 선택되어진다. 이러한 과정을 현대의 분자생물학 적 방법인 돌연변이와 재조합 기술을 이용하여 시 험관 내에서 모사하여 수행될 수 있다. 이러한 방 법들을 방향적(directed) 또는 생체 외(in vitro) 진화라고 하며, 효소의 삼차원 구조나 반응 메카 니즘을 알지 못해도 산업적, 과학적으로 요구되는 특수한 성질들을 갖는 생체촉매들을 개발하기 위 한 강력한 도구로서 이용된다. 이러한 방향적 진 화는 변형된 기질 특이성, 유기용매에 대한 저항
성, 내열성, 향상된 반응성 등을 갖는 효소들을 생 산할 수 있다.
효소의 방향적 진화를 위한 일반적인 전략 방향적 진화에 의해 새로운 특성을 갖는 효소들 을 분리하는 일반적인 전략은 다음과 같다.
비재조합 또는 재조합 기술을 이용하여 무작위 돌연변이를 발생시켜 변이체 library들을 얻는다.
돌연변이 유전자들을 적절한 숙주로 하여 발현 시킨다.
효소 변이체들중 향상된 특성을 갖는 변이체를 선별하거나 스크리닝한다.
이러한 효소 변이체들을 인코딩하는 유전자들 을 다음 단계의 방향적 진화를 위해 template로 사용한다.
분자의 다양성은 목표 유전자 또는 일련의 관련 된 유전자들의 무작위 돌연변이나 재조합 기술에 의해 만들어진다. 더 향상된 변이체들을 스크리닝 하거나 선별하기 위해 높은 농도의 변이 단백질이
Process
Biocatalyst selection
Screening
Enzyme or cells?
Product recovery
Downstream
In situ recovery
Economics Reactants
Application
Biocatalyst engineering
Biocatalyst characterization
New reactions
Cell engineering Process engineering Enzyme engineering
Kinetics Reaction conditions Structural information Stability
Immobilization Cofactor regeneration
Multiphase systems
Products