대한소화기학회지 2003;42:274-282
서 론
1)CD40은 분자량이 45-50 kDa인 막통과 당단백(trans- membrane glycoprotein)으로서 종양괴사인자(tumor necrosis factor, 이하 TNF) 수용체족의 하나이다.1 CD40의 발현과
접수: 2003년 3월 20일, 승인: 2003년 8월 29일 연락처: 박두호, 137-040, 서울특별시 서초구 반포동 505
강남성모병원 내과
Tel: (02) 590-2471, Fax: (02) 590-2471 E-mail: dhpark@cmc.cuk.ac.kr
기능은 B세포에서 처음으로 확인되었으며,22)B세포의 생존, 증식 및 분화에 결정적인 역할을 하는 것으로 알려져 있 다.3,4 초기에는 B세포에서만 CD40이 나타나는 것으로 생 각되었으나, 근래에 상피 세포, 내피 세포, 항원 표현 세포, 조혈모 세포에서도 CD40이 발현되며 체액성 면역과 숙주
Correspondence to: Doo Ho Park, M.D.
Department of Internal Medicine, Kangnam St. Mary's Hospital 505 Banpo-dong, Seocho-gu, Seoul 137-040, Korea
Tel: +82-2-590-2471, Fax: +82-2-590-2471 E-mail: dhpark@cmc.cuk.ac.kr
위암에서 CD40의 발현 및 CD40이 위암 세포의 아포토시스에 미치는 영향
가톨릭대학교 의과대학 내과학교실, 소화기병연구소*
김상우․이학성*․윤승규․정우철․조영석․정정조 이인석․이강문․이동수․최명규․정인식․박두호
Expression of CD40 in Gastric Cancer and Its Effect on the Apoptosis of Gastric Cancer Cells
Sang Woo Kim, M.D., Hak Sung Lee, Ph.D.*, Seung Kew Yoon, M.D., Woo Chul Chung, M.D., Young Seok Cho, M.D., Jeong Jo Jeong, M.D., In Seok Lee, M.D., Kang Moon Lee, M.D., Dong Soo Lee, M.D., Myung-Gyu Choi, M.D., In-Sik Chung, M.D., and Doo Ho Park, M.D.
Department of Internal Medicine and Digestive Disease Research Institute*, The Catholic University of Korea College of Medicine, Seoul, Korea
Background/Aims: The expression of CD40 in gastric cancer has not been studied. The aims of this study were to determine the expression of CD40 in gastric cancer and to investigate the effect of CD40 on the apoptosis of gastric cancer cells. Methods: We examined the expression of CD40 by immunohistochemistry and flow cytometry. CD40 mRNA in 5 gastric cancer cell lines was analyzed by RT-PCR. To assess the effect of CD40 on the viability of gastric cancer cells, we performed MTT assay. The effect of CD40 signaling on the apoptosis of gastric cancer cells was examined by annexin V affinity assay. Results: Twelve of twenty human gastric cancer tissues demonstrated positive staining for CD40. Among 5 gastric cancer cell lines, AGS cell line expressed membrane-bound CD40 antigen and CD40 mRNA. In AGS cells, CD40 stimulation significantly reduced the cell viability. CD40 ligation significantly increased the apoptosis in AGS cells compared to the control. Conclusions:
CD40 is expressed in human gastric cancer tissues and gastric cancer cell line, and induces apoptosis in gastric cancer cells. These results suggest that CD40 expression in gastric cancer may play an important role in host defense mechanism against the gastric cancer. (Korean J Gastroenterol 2003;42:274-282)
Key Words: Antigens, CD40; Stomach neoplasms; Apoptosis
김상우 외 11인. 위암에서 CD40의 발현 275
방어에 중요한 역할을 한다는 연구 결과들이 보고되었다.5-8 또한 흑색종, 방광암, 유방암, 비인두암, 림프종과 같은 악성 종양에서도 CD40의 발현이 확인되었다.9-12 그러나 악 성 종양에서 발현되는 CD40의 정확한 역할에 대해서는 잘 알려지지 않고 있다. 아포토시스와 관련하여 어떠한 연구 들에서는 CD40이 Fas를 통한 아포토시스를 억제하는 것으 로 보고한 반면,13,14 또 다른 연구들에서는 CD40을 자극함 으로써 아포토시스가 증가된다고 보고하여15-17 아직 그 역 할에 대해 이론이 많다.
현재까지 소화기 악성 종양에서 CD40의 발현에 대한 연 구는 Sugimoto 등18이 간암 조직과 간암 세포주에서 CD40 이 발현됨을 관찰하였고, CD40이 Fas와 TNF 수용체를 통 한 아포토시스를 억제하는데 중요한 역할을 한다고 보고 하였다. 그러나 아직까지 위암 조직이나 위암 세포주에서 CD40이 발현되는지에 대한 연구는 없으며, CD40이 위암 의 아포토시스에 어떠한 영향을 미치는지에 대한 연구도 없는 실정이다.
이에 저자들은 위암 조직 및 위암 세포주에서 CD40이 발현되는지를 조사하고, CD40이 위암 세포의 아포토시스 에 미치는 영향을 알아보았다.
대상 및 방법
1. 대상 1) 위암 조직
외과적 절제술을 통해 얻어진 위암 조직 20예를 대상으 로 CD40에 대한 면역조직화학염색을 시행하였다. 또한 같 은 환자의 위암 주변 비종양 조직에도 CD40에 대한 면역 조직화학염색을 하였다. 절제된 조직은 10% 포르말린 완충 액으로 고정하고 파라핀 포매를 실시한 다음 H&E 염색 후, 병리조직학적으로 위암 및 비종양 조직임을 확진하였다.
2) 위암 세포주
AGS, Kato III, MKN-45, MKN-74 및 SNU-1 세포주를 대상으로 유식 세포측정기(flow cytometry)를 이용하여 CD40 발현을 조사하였고, LCL 세포주를 양성 대조군으로 하였다.
각각의 세포주는 37℃ 배양기(5% CO2, 포화 습도)에서 배양 하였다. 배지는 penicillin (100 units/mL), streptomycin (100 µg/mL), 10 mM의 HEPES (N-2-hydroxyethyl piperazine- N-2-ethanesulfonic acid)와 10% 소 태아 혈청이 함유된 RPMI 1640 세포배양액(GIBCO BRL, New York, NY, USA) 배지 를 이용하였다.
2. 방법
1) 면역조직화학 염색
위암 조직 및 위암 주변 비종양 조직에 labeled streptabidin- biotin 방법(DAKO Corp., Carpenteria, CA, USA)을 이용하 여 CD40에 대한 면역조직화학염색을 시행하였다. 항원의 재활성화를 위해 파라핀을 제거한 조직 절편을 100℃로 5분 간 가열하였다. 이후 내인성 페록시다제(endogenous peroxi- dase)의 활성을 제거하기 위하여 메탄올과 0.3% H2O2로 30 분간 처리하였다. 절편을 phosphate-buffered saline (PBS)이 첨가된 1% 염소 혈청으로 차단한 후, 1:100으로 희석한 토 끼 항CD40 다클론성 항체(rabbit anti-CD40 polyclonal antibody, C-20, Santa Cruz Biotechnology Inc. Santa Cruz, CA, USA)를 첨가하고 4℃에서 밤새 반응시켰다. 세척 후 bionylated antibody로 30분간 처리하고, peroxidase-labeled streptavidin과 함께 30분간 배양하였다. 이후 절편에 0.05%
diaminobenzidine/0.15% H2O2를 첨가하고 배양하였다. 대조 염색에는 10% hematoxylin을 이용하였다.
2) 유식 세포측정기를 이용한 CD40의 검출
각각의 위암 세포주 및 LCL 세포주 약 106개를 1% 소 태아 혈청-PBS로 2회 세척한 후 트립신을 처리하고 1,200 rpm에서 5분간 원심분리하였다. 모아진 세포를 현탁한 후 5 µg/mL의 인간 CD40에 대한 murine fluorescein isothio- cyanate (FITC)-conjugated mouse monoclonal antibody (Caltag Laboratories, Burlingame, CA, USA)를 첨가하고 얼 음에서 45분간 반응시켰다. 1% 파라포름알데히드 1 mL을 가하여 고정한 후 유식 세포측정기(Becton Dickinson, San Jose, CA)로 CD40의 발현을 조사하였다. 데이터의 분석은 CELLQuest software (Becton Dickinson, San Jose, CA, USA)를 이용하였다.
3) 위암 세포주에서 CD40 전사체의 확인
CD40 mRNA의 발현은 전체 RNA를 이용하여 RT-PCR 로 확인하였다. AGS, Kato III, MKN-45, MKN-74, SNU-1 세포주를 대상으로 전체 RNA를 추출하였다. 양성 대조군 으로는 LCL 세포주를 이용하였다. 추출 방법은 Easy Blue Kit (Intron Bio, Seoul, Korea)를 이용하였다. 추출된 RNA 는 정량하여 cDNA 합성에 2 µg씩 이용하였다. cDNA는 2 µg RNA에 200 단위의 SuperScript II 역전사효소(GIBCO BRL)를 첨가하고 37℃에서 60분간 반응시켜 합성하였다. 4 개의 dNTPs (각각 200 µmolol/L), 2.5 mmol/L MgCl2, 2.5 단위의 Taq 중합효소(Intron Bio, Seoul, Korea), 0.4 µmol/L 의 각 프라이머를 혼합하여 cDNA에 대한 PCR을 시행하였 다. 증폭은 94℃에서 1분, 55℃에서 1분, 72℃에서 1분간 35 cycle을 시행하였다. PCR 산물은 1.5% 한천 겔에서 전 기영동을 시행하고 ethidium bromide 염색을 하여 확인하였 다. βactin을 증폭하여 대조군으로 이용하였다. CD40 sense
The Korean Journal of Gastroenterology: Vol. 42, No. 4, 2003 276
프라이머의 염기서열은 뉴클레오티드 41-61에 해당하는 5‘-CCTCGCCATGGTTCGTCTGCC-3'이었고, antisense 프 라이머로는 뉴클레오티드 761-780에 해당하는 5’-AGCCA GGAAGATCGTC GGGA-3'를 이용하였다. β actin의 sense 프라이머의 염기서열은 뉴클레오티드 578-609에 해당하는 5‘-ATCTGGCACCACACCTTCTACAATGAGCT GCG-3' 이었고, antisense 프라이머로는 뉴클레오티드 1415-1384에 해당하는 5’-CGTCATACTCCTGCTTGCCTGA TCCACAT CTGC-3'를 이용하였다.
4) 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT) 분석
AGS 세포의 생육성을 평가하기 위하여 MTT 분석을 시 행하였다. 96-well flat bottom microtiter plate의 각 well에 5
×103개의 AGS 세포를 24시간 동안 배양한 후, 각각의 well에 1 ng/mL, 10 ng/mL, 100 ng/mL, 1,000 ng/mL의 항 Fas 단일클론성 항체(anti-Fas monoclonal antibody, CH-11, Medical and Biological Laboratories, Nagoya, Japan), TNF- α (Upstate, Lake Placid, NY, USA) 또는 항CD40 단일클론 성 항체(anti-CD40 antibody, Monosan, Am Uden, Nether- lands)를 처리하고 다시 48시간 동안 배양하였다. 이후 Cell Proliferation Reagent WST-1 kit (Boehringer-Mannheim GmbH, Mannheim, Germany)를 이용하여 살아있는 세포 수 를 분석하였다. 각 well의 흡광도는 450 nm에서 Micro- culture plate reader (Molecular Devices, Sunnyvale, CA, USA)를 이용하여 측정하였다. 생육성은 아무 처리도 하지 않은 세포주를 대조군으로 하여 상대적인 백분율로 나타내 었다.
5) 아포토시스의 확인
AGS 세포의 아포토시스는 Annexin V 친화성 검사로 확 인하였다. 약 104개의 AGS 세포를 24시간 동안 배양한 후, 각각 100 ng/mL의 항Fas 단일클론성 항체, TNF-α 또는 항 CD40 단일클론성 항체를 처리하고 다시 48시간 동안 배양 하였다. 또한 각각 100 ng/mL의 항Fas 단일클론성 항체 또 는 TNF-α를 처리하고 동시에 100 ng/mL의 항CD40 단일클 론성 항체를 함께 처리한 후 48시간 동안 배양하였다. 이후 AGS 세포 검체들을 Annexin V-FITC kit (Boehringer- Mannheim GmbH)로 제조자의 지시에 따라 염색하였다.
Annexin V-FITC와 propidium iodide (PI)에 염색된 세포들 을 FACScan (Becton Dickinson)으로 분석하였다. 유식 세 포측정 분석 중 Annexin V에 의한 녹색 FITC 형광은 530/
30-nm band pass filter 후에 모아졌고, PI에 의한 황색 형광 은 585/42-nm band pass filter 후에 모아졌다. Annexin V-FITC와 PI의 스펙트럼 중복(spectral overlap)을 최소화하
기 위해 형광 보상을 하였다. 데이터의 분석은 CELLQuest software (Becton Dickinson)를 이용하였다. 아포토시스 지 수(apoptotic index)는 Annexin V 양성이고 PI 음성인 세포 수를 선택한 영역의 전체 세포 수로 나누어 퍼센트로 계산 하였다.
6) 통계 분석
각 수치는 평균±SEM으로 표시하였다. 위암의 침윤도 및 조직학적인 분화도에 따른 CD40 발현 빈도의 차이는 Fisher's exact test로 검증하였고, 항CD40 단일클론성 항체 가 있을 때와 없을 때의 아포토시스 차이는 t test로 검증하 였다. 통계는 Windows용 통계 프로그램인 Jandel SigmaStat version 4.0을 이용하였다. 모든 통계는 p값이 0.05 미만일 때 의의가 있는 것으로 판정하였다.
결 과
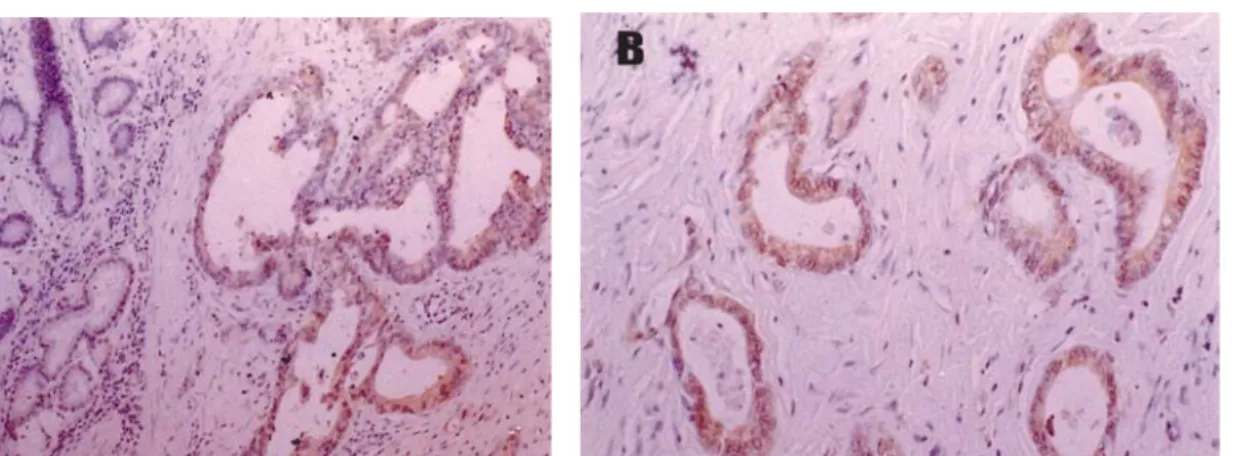
1. 위암 조직에서 CD40의 발현
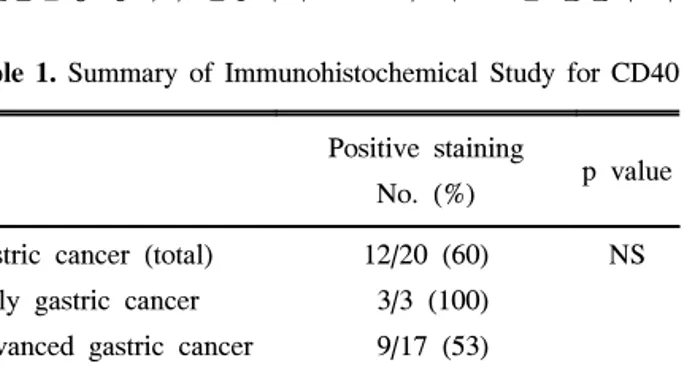
위암 조직 20예 중 60%인 12예에서 분명한 CD40 양성 소견이 관찰되었다(Fig. 1). CD40 발현은 종양 주변의 염증 세포 침윤 정도와는 관련이 없었다. 조기 위암과 고분화암 및 중등도분화암에서 CD40 양성률이 높았으나, 암의 침윤 도 및 조직학적인 분화도에 따른 유의한 차이는 없었다 (Table 1). 또한 위암 주변 비종양 조직의 일부(40%)에서도 강도는 약하지만 주로 세포의 저부에서 CD40의 발현이 관 찰되었다. CD40은 모든 예에서 세포질과 세포막에 미만성 으로 염색되었으며 세포막에만 염색된 경우는 없었다.
2. 위암 세포주에서 CD40의 발현
위암 세포주에서 CD40의 세포표면 발현을 알아보기 위 해 5개의 인간 위암 세포주를 검색하였고 B세포 세포주인 LCL 세포주를 양성 대조군으로 하여 유식 세포측정 분석 을 하였다. 5가지 위암 세포주 중 AGS 세포주만이 항CD40 단일클론성 항체와 반응하여 CD40의 세포표면 발현이 확
Table 1. Summary of Immunohistochemical Study for CD40 Positive staining
No. (%) p value Gastric cancer (total)
Early gastric cancer Advanced gastric cancer Well differentiated Moderately differentiated Poorly differentiated
12/20 (60) 3/3 (100) 9/17 (53) 2/2 (100) 6/8 (75) 4/10 (40)
NS
NS
Kim SW, et al. Expression of CD40 in Gastric Canter 277
인되었다. AGS 세포주에서 CD40 양성 세포의 비는 51%이 었다(Fig. 2).
3. 위암 세포주에서 CD40 mRNA의 발현
AGS 세포와 양성 대조군인 LCL 세포에서 740-bp의 CD40 mRNA가 검출되었다. 반면 유식 세포측정에서 CD40 이 발현되지 않았던 Kato III, MKN-45, MKN-74, SNU-1 세포주에서는 CD40 mRNA가 검출되지 않았다(Fig. 3).
4. Fas, TNF-α, CD40이 AGS 세포주의 세포 생육성 에 미치는 영향
위암 세포주에 대한 Fas, TNF-α, CD40의 영향을 평가하 기 위하여 유식 세포측정 분석에서 CD40의 세포표면 발현 이 확인된 AGS 세포주를 대상으로 MTT 분석을 하였다.
항Fas 항체, TNF-α로 Fas 및 TNF 수용체를 자극하였을 때 AGS 세포의 생육성은 농도에 비례하여 감소되었고 1,000 ng/mL의 농도에서는 살아있는 세포의 비율이 각각 73.9±
3.4%, 76.9±4.7%까지 감소하였다. 이러한 반응은 항CD40 항체를 넣었을 때에도 관찰되어 항CD40 항체의 농도에 따 라 생육성이 감소되었고 1,000 ng/mL의 농도에서는 살아있 는 세포의 비율이 68.1±3.3%로 감소되었다(Fig. 4).
Fig. 1. Immunohistochemical staining of human gastric cancer with anti-CD40 antibody. Gastric cancer cells are strongly stained for CD40.
Most gastric cancer cells show diffuse cytoplasmic and membrane patterns (A, ×100; B, ×200).
Fig. 2. Flow cytometric analysis of CD40 expression. (A) LCL. (positive control), (B) AGS, (C) Kato III, (D) MKN-45, (E) MKN-74, and (F) SNU-1. In each graph, the blue line indicates cells stained with FITC-conjugated irrelevant IgM (as control), the green line indicates positive cells stained with FITC-conjugated anti-CD40 antibody. Only AGS cell line is reactive with anti-CD40 monoclonal antibody.
A B C
D E F
대한소화기학회지: 제42권 제4호, 2003 278
Fig. 3. Expression of CD40 mRNA in AGS and LCL cell lines by RT-PCR. (A) LCL. (positive control), (B) Kato III, (C) MKN-45, (D) MKN-74, and (E) SNU-1, and (F) AGS. A 740-bp human CD40-specific sequence and 838-bp β-actin sequence were amplified by RT-PCR, separated by agaros gel electrophoresis, and visualized by ethidium bromide staining.
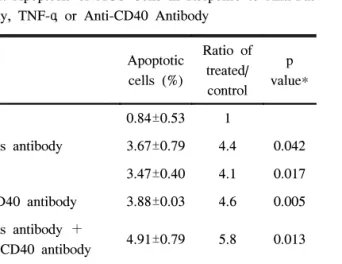
Table 2. Apoptosis of AGS Cells in Response to Anti-Fas Antibody, TNF-α, or Anti-CD40 Antibody
Apoptotic cells (%)
Ratio of treated/
control p value*
Control 0.84±0.53 1
Anti-Fas antibody 3.67±0.79 4.4 0.042
TNF-α 3.47±0.40 4.1 0.017
Anti-CD40 antibody 3.88±0.03 4.6 0.005 Anti-Fas antibody +
Anti-CD40 antibody 4.91±0.79 5.8 0.013 TNF-α+
Anti-CD40 antibody 6.06±0.80 7.2 0.006
*p values compared to control.
5. Fas, TNF-α, CD40이 AGS 세포주의 아포토시스 에 미치는 영향
Annexin V 친화성 검사로 AGS 세포주의 아포토시스를 평가한 결과 대조군에 비하여 각각 100 ng/mL의 항Fas 항 체, TNF-α 및 항CD40 항체를 처리한 경우 아포토시스가 유의하게 증가하였다. 또한 각각 100 ng/mL의 항Fas 항체 와 항CD40 항체를 같이 처리하였을 때, TNF-α와 항CD40 항체를 같이 처리하였을 때에도 대조군에 비하여 아포토시 스가 유의하게 증가하였다(Table 2). 항Fas 항체와 항CD40 항체를 동시에 처리한 경우 항Fas 항체만을 처리하였을 때 에 비하여 통계적으로 유의하지는 않으나 아포토시스가 증 가되는 경향을 보였다(4.91±0.79 vs. 3.67±0.79, p=0.331).
Fig. 4. Cell viability of AGS cells. After incubation with various concentrations of (A) anti-Fas antibody, (B) TNF-α, or (C) anti-CD40 antibody for 48 hours, cell viability was decreased in a dose-dependent manner. Values shown are mean±SEM of 3 independent experiments.
0 1 1 0 1 00 1 000
Cell viability
6 0 7 0 8 0 9 0 1 00 (% )
anti-F as antibod y ng/m L
A
0 1 1 0 1 00 1 000
Cell viability
6 0 7 0 8 0 9 0 1 00 (% )
anti-F as antibod y ng/m L
A
0 1 1 0 1 0 0 1 0 0 0 T N F -α ng /m L
Cell viability
(% )
6 0 7 0 8 0 9 0
1 0 0
B
0 1 1 0 1 0 0 1 0 0 0 T N F -α ng /m L
Cell viability
(% )
6 0 7 0 8 0 9 0
1 0 0
B
0 1 1 0 1 0 0 1 0 0 0 anti-C D 4 0 an tib od y ng /m L
Cell viability
(% )
6 0 7 0 8 0 9 0
1 0 0
C
0 1 1 0 1 0 0 1 0 0 0 anti-C D 4 0 an tib od y ng /m L
Cell viability
(% )
6 0 7 0 8 0 9 0
1 0 0
C
김상우 외 11인. 위암에서 CD40의 발현 279
TNF-α와 항CD40 항체를 같이 처리한 경우는 TNF-α만 처 리하였을 때에 비하여 아포토시스가 유의하게 증가하였다 (6.06±0.80 vs 3.47±0.40, p=0.045) (Fig. 5).
고 찰
CD40은 종양괴사인자 수용체족의 하나로서 다른 종양 괴사인자들과 유사하게 시스테인이 풍부한 세포외 영역 (cystein-rich extracellular domain)을 가지고 있으며, CD40 의 수용체 신호전달은 주로 활성화된 CD4+ T세포에 발현 되어 있는 CD40 리간드(ligand)와 결합함으로써 시작된 다.19 CD40의 기능은 B세포에서 많이 연구되었으며 B세 포의 증식, 분화 및 면역글로불린 생산, 동종 전환(isotype switching), 아포토시스로부터의 구출, 종자중심(germinal center) 형성 등에 중요한 역할을 한다.20-22 그 외에 여러 악 성 종양 세포에서도 CD40의 발현이 확인되었으나 그 기능 에 대하여는 아직까지 잘 알려져 있지 않다. 특히 소화기계 암에 대해서는 연구가 거의 없으며 현재까지 위암에 대해 서는 CD40에 관한 연구가 전혀 없었다.
본 연구에서 저자들은 위암에서 CD40이 발현됨을 확인 하였고 CD40이 위암 세포의 아포토시스에 미치는 영향을 제시하였다. 본 연구에서 20예의 위암 조직 중 60%인 12예 에서 CD40의 발현이 관찰되었다. 면역조직화학 염색으로 사람의 고형암 조직에서 CD40의 발현을 본 연구는 많지 않으나 악성 흑색종, 간세포암 등에서 보고하였다.18,23 본 연구에서 CD40은 세포질과 세포막에 미만성으로 염색되 었는데 이는 이전의 연구들18,23과 유사한 결과이다. 악성 흑 색종의 경우 CD40이 발현된 환자는 발현되지 않은 환자에
비해 무종양 생존기간(tumor-free survival time)이 현저히 짧아 CD40의 발현이 질환의 예후와 관련이 있다는 보고23 가 있었으나 본 연구에서는 암의 침윤도 및 조직학적인 분 화도 여부에 따른 유의한 차이는 관찰되지 않았다. 향후 좀 더 많은 조직을 대상으로 림프절 전이 또는 생존기간 등의 차이에 관한 연구가 필요할 것으로 생각한다.
저자들은 또한 유식 세포측정기를 이용하여 5가지의 위 암 세포주를 검색하였고 이중 AGS 세포주에서 CD40의 세포표면 발현을 확인하였다. 간암 세포주를 이용한 이전 연구18에서 실험에 사용되었던 6개 간암 세포주 모두에서 CD40이 발현된 것과는 달리 위암 세포주 중에서는 AGS 세포주에서만 CD40이 발현되었다. 위암 세포주는 특정 암 세포만을 분리 배양한 것이므로 각각의 세포주 특성에 따 라 이러한 결과가 나온 것으로 생각되지만, AGS 세포주만 이 CD40을 발현하는 데 관여하는 분명한 인자는 발견하지 못하였다. 적어도 2~3종 이상의 위암 세포주에서 CD40의 발현이 관찰되었다면 이를 생체내(in vivo) 환경에 적용하 는데 무리가 없을 것이지만 한 가지 위암 세포주를 이용한 실험 결과를 가지고 생체내 환경에 적용하는 데에는 무리 가 있을 것으로 생각한다. 그러나 본 연구에서 나타난 것처 럼 위암 조직에서의 발현율이 60%임을 고려하면 CD40 발 현이 위암에 있어 실제 임상적인 면에서도 의의가 있을 것 으로 생각되며 다른 위암 세포주를 대상으로 CD40의 발현 여부를 선별하는 것이 필요하다. CD40의 발현 정도는 여러 가지 사이토카인에 의해 조절되는 것으로 알려져 있다. 특 히 IFN-γ, IL-1β, IL-6, TNF-α 등의 사이토카인은 CD40의 발현을 증가시킨다.24,25 또한 CD40 양성인 여러 고형암 세 포주를 CD40 리간드나 항CD40 단일클론성 항체로 처리하 Fig. 5. Effect of CD40 stimulation on Fas- or TNFR-mediated apoptosis.
AGS cells were cultured with 100 ng/mL of anti-Fas antibody in the presence (■) or absence (□) of anti-CD40 antibody. AGS cells were also cultured with 100 ng/mL of TNF- α in the presence (■) or absence (□) of anti-CD40 antibody. Values are mean±SEM of 3 independent experi- ments.
Control 0
1 2 3 4 5 6 7 8
% apoptosis
(%)
Fas Fas+CD40 TNF-α TNF-α+CD40 p=0.045
p=0.331
Control 0
1 2 3 4 5 6 7 8
% apoptosis
(%)
Fas Fas+CD40 TNF-α TNF-α+CD40 p=0.045
p=0.331
The Korean Journal of Gastroenterology: Vol. 42, No. 4, 2003 280
였을 때 IL-6, IL-8, GROα와 같은 염증을 유발하는 사이토 카인(proinflammatory cytokine)의 분비를 증가시킨다는 보 고가 있다.16 이러한 사이토카인의 분비는 항종양 효과기세 포(anti-tumor effector cell)를 발생, 동원하거나 활성화하여 종양에 대한 숙주 방어 기전으로 작용할 것으로 생각한다.
아직까지 위암에 대한 이와 같은 연구가 없어 추가적인 연 구가 필요하다.
종양 세포의 아포토시스에 있어 CD40의 역할은 완전히 밝혀지지 않고 있다. 어떤 종양 세포에서는 CD40과 CD40 리간드의 결합에 의해 아포토시스를 유발하는 신호가 전달
되고,26-28 반면에 어떤 종양 세포에서는 아포토시스를 억제
하여 세포 생존을 증가12,13시키는 것으로 알려져 있다. 이러 한 상반된 소견은 CD40이 양성적인 또는 음성적인 조절 신호를 전달하는 데 여러 인자들이 작용하며, 따라서 CD40 신호가 세포의 특성이나 조건에 따라 세포 생존과 사멸의 이중적인 효과를 나타낸다는 것을 시사한다.
본 연구에서 저자들은 CD40 결합(CD40 ligation)이 위암 세포의 생육성을 감소시키고 아포토시스를 유발시키는 신 호를 전달한다는 것을 확인하였다. 즉 AGS 세포주를 항 CD40 항체와 함께 배양하였을 때 항CD40 항체의 농도에 따라 생육성이 감소되었고 또한 Annexin V 친화성 검사로 아무 처리도 하지 않은 대조군에 비해 CD40을 처리한 경 우 아포토시스가 유의하게 증가하였다. 본 연구에서는 아 포토시스의 정량을 위해 Annexin V 친화성 검사를 이용하 였다. 그러나 좀더 정확한 아포토시스의 정량을 위해 아포 토시스를 평가하는 다른 생화학적 방법을 이용한 검증이 필요하리라 생각한다. 이 연구에서 저자들은 CD40의 자극 을 위해 효능적 효과(agonistic effect)를 가진 IgM형의 항 CD40 단일클론성 항체를 사용하였는데, 이는 CD40의 trimerization이 CD40 신호를 전달하는 데 중요한 역할을 하 기 때문이다.29 현재까지 잘 알려져 있는 아포토시스의 경로 로는 Fas 수용체를 통한 것과 TNF 수용체를 통한 것을 들 수 있다.30,31 CD40이 종양 세포의 아포토시스를 유발하는 기전으로 CD40 결합이 Fas 발현을 상향 조절(upregulation) 하고 아포토시스에 대한 민감도를 증가시킨다는 보고가 있 다.32 Fas의 상향 조절 외에도 CD40 결합은 기능성 Fas 리 간드, TNF, TNF 연관 아포토시스 유발 리간드(TNF-related apoptosis- inducing ligand, TRAIL) 등을 유도하여 암 세포 의 아포토시스를 일으킨다는 보고17도 있다. 본 연구에서는 CD40이 위암세포의 아포토시스를 유발하는 기전에 대해서 는 실험을 하지 않았다. 향후 위암 세포에서 CD40 신호에 의한 아포토시스 유발 기전에 대해 추가적인 연구가 필요 할 것으로 생각한다. 항CD40 항체를 항Fas 항체와 함께 처 리하였을 때 항Fas 항체를 단독으로 처리하였을 때에 비해 아포토시스가 증가되는 경향을 보였다. 또한 항CD40 항체
를 TNF-α와 함께 처리하였을 때는 TNF-α만을 처리한 경 우에 비해 아포토시스가 유의하게 증가하였다. 이는 항Fas 항체와 항CD40 항체를 동시에 처리하였을 때 골수종 세포 의 아포토시스가 현저히 증가된다는 이전의 보고15와 유사 한 결과이다. 이러한 결과로 CD40에 의한 위암 세포의 아 포토시스는 Fas 또는 TNF-α를 통한 경로가 아닌 다른 기전 에 의해서 일어난다는 것을 추측할 수 있다. 또한 CD40에 의한 위암세포의 아포토시스는 Fas 또는 TNF-α 경로를 통 한 아포토시스와 부가 효과(additive effect)를 나타냄으로써 위암에 대한 숙주의 방어 기전에 중요한 역할을 할 것으로 생각한다.
결론적으로 CD40은 위암 조직과 위암 세포주에서 발현 되며 위암 세포의 아포토시스를 유발한다. CD40 신호에 의 해 위암 세포의 아포토시스가 유발된다는 것은 CD40이 위 암에 대한 숙주의 방어 기전에 중요한 역할을 한다는 것을 시사해 준다.
요 약
목적: CD40은 종양괴사인자 수용체족의 하나로서 B 세 포의 생존, 증식 및 분화에 중요한 역할을 하는 것으로 알 려져 있으며 여러 악성 종양에서도 CD40의 발현이 확인되 었다. 그러나 아직까지 위암 조직이나 위암 세포주에서 CD40이 발현되는지, CD40이 위암 세포의 아포토시스에 어떠한 영향을 미치는지에 대한 연구는 없다. 본 연구의 목 적은 위암 조직 및 위암 세포주에서 CD40이 발현되는지를 조사하고, CD40이 위암 세포의 아포토시스에 미치는 영향 을 알아보는 것이다. 대상 및 방법: 면역조직화학염색으로 위암 조직 20예에서 CD40의 발현을 조사하였고, 유식 세포 측정기를 이용하여 5개의 위암 세포주에서 CD40의 표면 발현을 분석하였다. CD40 mRNA는 RT-PCR로 확인하였 다. CD40이 위암 세포의 생육성에 미치는 영향을 평가하기 위하여 MTT 분석을 시행하였다. 위암 세포의 아포토시스 에 대한 영향은 Annexin V 친화성 검사로 평가하였다. 결 과: 위암 조직의 경우 20예 중 60%인 12예에서 CD40 양성 소견이 관찰되었으며, 5가지 위암 세포주 중 AGS 세포주 에서 CD40의 세포표면 발현과 CD40 mRNA가 확인되었 다. AGS 세포주에서 항CD40 항체로 CD40을 자극하였을 때 세포의 생육성이 현저히 감소되었고, AGS 세포의 아포 토시스가 대조군에 비하여 유의하게 증가되었다(0.84±
0.53% vs. 3.88±0.03%, p=0.005). 항Fas 항체와 항CD40 항체를 동시에 처리한 경우 항Fas 항체만을 처리하였을 때에 비하여 아포토시스가 증가되는 경향을 보였고(4.91
±0.79% vs. 3.67±0.79%, p=0.331), TNF-α와 항CD40 항 체를 같이 처리한 경우 TNF-α만 처리하였을 때에 비하여
Kim SW, et al. Expression of CD40 in Gastric Canter 281
아포토시스가 유의하게 증가하였다(6.06±0.80% vs 3.47±
0.40%, p=0.045). 결론: CD40은 위암 조직과 위암 세포주 에서 발현되며 위암 세포의 아포토시스를 유발한다. CD40 신호에 의해 위암 세포의 아포토시스가 유발된다는 것은 CD40이 위암에 대한 숙주의 방어 기전에 중요한 역할을 한다는 것을 시사해 준다.
색인단어: CD40 항원, 위암, 아포토시스
참 고 문 헌
1. Smith CA, Farrah T, Goodwin RG. The TNF receptor super- family of cellular and viral proteins: activation, costimulation, and death. Cell 1994;76:959-962.
2. Stamenkovik I, Clark EA, Seed B. A B-lymphocyte activation molecule related to the nerve growth factor receptor and induced cytokines in carcinoma. EMBO J 1989;8:1403-1410.
3. Banchereau J, Bazan F, Blanchard D, et al. The CD40 antigen and its ligand. Annu Rev Immunol 1994;12:881-922.
4. Clark LB, Foy TM, Noelle RJ. CD40 and its ligand. Adv Immunol 1996;63:43-78.
5. Galy AH, Spits H. CD40 is functionally expressed on human thymic epithelial cells. J Immunol 1992;149:775-782.
6. Karmann K, Hughes CC, Schechner J, Fanslow WC, Pober JS. CD40 on human endothelial cells: inducibility by cytokines and functional regulation of adhesion molecule expression.
Proc Natl Acad Sci U S A 1995;92:4342-4346.
7. Bjorck P, Banchereau J, Flores-Romo L. CD40 ligation counteracts Fas-induced apoptosis of human dendritic cells.
Int Immunol 1997;9:365-372.
8. van Kooten C, Bancherau J. Functional role of CD40 and its ligand. Int Arch Allergy Immunol 1997;113:393-399.
9. Thomas WD, Smith MJ, Si Z, Hersey P. Expression of the co-stimulatory molecule CD40 on melanoma cells. Int J Cancer 1996;68:795-801.
10. Cooke PW, James ND, Ganesan R, Wallace M, Burton A, Young LS. CD40 expression in bladder cancer. J Pathol 1999;188:38-43.
11. Hirano A, Longo DL, Taub DD, et al. Inhibition of human breast carcinoma growth by a soluble recombinant human CD40 ligand. Blood 1999;93:2999-3007.
12. Sbih-Lammali F, Clausse B, Ardila-Osorio H, et al. Control of apoptosis in Epstein Barr virus-positive nasopharyngeal carcinoma cells: opposite effects of CD95 and CD40 stimulation.
Cancer Res 1999;59:924-930.
13. Jakobson E, Jonsson G, Bjorck P, Paulie S. Stimulation of CD40 in human bladder carcinoma cells inhibits anti-Fas/
APO1 (CD95)-induced apoptosis. Int J Cancer 1998;77:849- 853.
14. Ghia BP, Boussiotis VA, Schultze JL, et al. Unbalanced expression of Bcl-2 family proteins in follicular lymphoma:
contribution of CD40 signaling in promoting survival. Blood 1998;91:244-251.
15. Bergamo A, Bataille R, Pellat-Deceunynck C. CD40 and CD95 induce programmed cell death in the human myeloma cell line XG2. Br J Haematol 1997;97:652-655.
16. Alexandroff AB, Jackson AM, Paterson T, et al. Role for CD40-CD40 ligand interactions in the immune response to solid tumours. Mol Immunol 2000;37:515-526.
17. Eliopoulos AG, Davies C, Knox PG, et al. CD40 induces apoptosis in carcinoma cells through activation of cytotoxic ligands of the tumor necrosis factor superfamily. Mol Cell Biol 2000;20:5503-5515.
18. Sugimoto K, Shiraki K, Ito T, et al. Expression of functional CD40 in human hepatocellular carcinoma. Hepatology 1999;
30:920-926.
19. Armitage RJ, Fanslow WC, Strockbine L, et al. Molecular and biological characterization of a murine ligand for CD40.
Nature 1992;357:80-82.
20. Marshall LS, Aruffo A, Ledbetter JA, Noelle RJ. The molecular basis for T cell help in humoral immunity: CD40 and its ligand, gp39. J Clin Immunol 1993;13:165-174.
21. Foy TM, Shepherd DM, Durie FH, Aruffo A, Ledbetter JA, Noelle RJ. In vivo CD40-gp39 interactions are essential for thymus-dependent humoral immunity. II. Prolonged suppres- sion of the humoral immune response by an antibody to the ligand for CD40, gp39. J Exp Med 1993;178:1567-1575.
22. Han S, Hathcock K, Zheng B, Kepler TB, Hodes R, Kelsoe G. Cellular interaction in germinal centers. Roles of CD40 ligand and B7-2 in established germinal centers. J Immunol 1995;155:556-567.
23. Van den Oord JJ, Maes A, Stas M, et al. CD40 is a prog- nostic marker in primary cutaneous malignant melanoma. Am J Pathol 1996;149:1953-1961.
24. Hollenbaugh D, Mischel-Petty N, Edwards CP, et al.
Expression of functional CD40 by vascular endothelial cells.
J Exp Med 1995;182:33-40.
25. Kluth B, Hess S, Engelmann H, Schafnitzel S, Reithmuller G, Feucht HE. Endothelial expression of CD40 in renal cell carcinoma. Cancer Res 1997;57:891-899.
26. Eliopoulos AG, Dawson CW, Mosialos G, et al. CD40- induced growth inhibition in epithelial cells is mimicked by Epstein-Barr Virus-encoded LMP1: involvement of TRAF3 as a common mediator. Oncogene 1996;13:2243-2254.
대한소화기학회지: 제42권 제4호, 2003 282
27. Lollini PL, Landuzzi L, Frabetti F, et al. Expression of functional CD40 on human osteosarcoma and Ewing's sarcoma cells. Clin Cancer Res 1998;4:1843-1849.
28. Afford SC, Randhawa S, Eliopoulos AG, Hubscher SG, Young LS, Adams DH. CD40 activation induces apoptosis in cultured human hepatocytes via induction of cell surface fas ligand expression and amplifies fas-mediated hepatocyte death during allograft rejection. J Exp Med 1999;189:441-446.
29. McWhirter SM, Pullen SS, Holton JM, Crute JJ, Kehry MR, Alber T. Crystallographic analysis of CD40 recognition and
signaling by human TRAF2. Proc Natl Acad Sci USA 1999;
96:8408-8413.
30. Nagata S. Apoptosis by death factor. Cell 1997;88:355-365.
31. Granville DJ, Carthy CM, Hunt DW, McManus BM.
Apoptosis: molecular aspects of cell death and disease. Lab Invest 1998;78:893-913.
32. Wang D, Freeman GJ, Levine H, Ritz J, Robertson MJ. Role of the CD40 and CD95 (APO-1/Fas) antigens in the apoptosis of human B-cell malignancies. Br J Haematol 1997;97:
409-417.