DOI 10.17480/psk.2016.60.4.200
GRIN3A가 과발현된 유전자 조작 마우스의 행동특성 연구
우태선 · 정재훈# 삼육대학교 약학대학
(Received June 15, 2016; Revised August 22, 2016; Accepted August 24, 2016)
Behavioral Characteristics of GRIN3A-overexpressing Transgenic Mice
Taeseon Woo and Jae Hoon Cheong#
College of Pharmacy, Sahmyook University, Hwarangro 815, Nowon-gu, Seoul 01795, Korea
Abstract — N-methyl-D-aspartate receptors (NMDARs) are glutamate-gated ion channels that play a significant role in synaptic plasticity, learning, memory, and other behaviors. NMDARs are composed of various subunits and display unique properties depending on their subunit composition. The GluN3A subunit is thought to suppress NMDAR activity, however its exact function has not been well studied. Thus, we designed a transgenic mice overexpressing GRIN3A to assess the role of this gene on various behaviors. GRIN3A-overexpressing mice were subjected to an array of behavioral experiments including locomotor activity test, rota-rod test, elevated plus-maze (EPM) test, and Y-maze test. GRIN3A-overexpressing mice displayed hypoactivity but no effects on the rota-rod test, EPM test and Y-maze test. The GRIN3A-overexpressing mice that we have created can be utilized in elucidating the role of the GRIN3A gene and its product, the GluN3A subunit of NMDARs, on various behaviors associated with neuropsychiatric disorders, such as ADHD, and in finding possible ther- apeutic targets for these disorders.
Keywords □ GRIN3A, hypoactivity, GluN3A, NMDA
N-methyl-D-aspartate(NMDA) 수용체는 중추신경계의 대표적 흥분성 신경전달물질인 glutamate의 수용체 중 하나로, NMDA 수용체 기본단위들의 발현 상태나 위치, 활동 정도에 따라서 수 많은 신경학적, 정신적인 상태가 결정 될 수 있다.1-3)많은 신경 정신 질환들은 시냅스의 결함, 특히 NMDA수용체의 기능 장애 가 그 원인으로 지목되고 있다.4) NMDA 수용체의 과잉활성뿐만 아니라 활동저하 역시 신경학적인 변화를 초래할 수 있기 때문 에 NMDA 수용체 길항제와 부분효능제가 중추신경계 관련 질환 의 치료제로 사용되고 있다.5)
Glutamate의 증가는 뇌 관련 질환을 일으키거나 신경세포의 사멸을 초래하기 때문에 NMDA 수용체의 길항제가 이와 관련 된 치료제가 될 가능성이 있다. 또한 지속적인 glutamate의 증가
는 파킨슨병이나 알츠하이머병과 같은 퇴행성 신경질환을 야기 하기도 한다.5)동물 실험에서 NMDA 수용체 길항제가 허혈성 뇌 손상이나 외상적인 손상에 대해 신경보호 효과를 보여주는 것 이 이를 뒷받침해준다.6-8)그러나 NMDA 수용체를 구성하는 기 본단위들에 대한 선택적인 약물들이 아닌 광범위한 길항제들은 부작용을 일으키고 치료효과가 높지 않다는 한계가 있다.5)따라 서 이러한 기본 단위들에 대한 선택적인 길항제에 대한 연구나 기본단위들의 발현 정도를 연구해야 할 필요성이 대두되고 있다.
NMDA 수용체의 기본 단위는 세 가지 종류로 GluN1, GluN2(GluN2A, GluN2B, GluN2C, GluN2D), GluN3(GluN3A, GluN3B)가 있으며, 전형적으로 GluN1과 GluN2의 결합으로 NMDA 수용체를 이룬다.4,5) NMDA 수용체 기본단위의 여러 조 합은 중추신경계의 수용체가 다양성을 이루게 해주며 이러한 기 본단위들의 조합과 발현 정도에 따라 NMDA 수용체의 기능이 결정 된다. 따라서 기본단위들의 조합이 NMDA 수용체의 조절 능력의 중요한 요인이 되며 기본단위의 발현상태가 달라지면 NMDA 수용체의 기능이상이 생길 수 있다.9-12)많은 중추신경계
#
Corresponding Author Jae Hoon Cheong
Saymyook University, 815 Hwarang-ro, Nowon-gu, Seoul, 139-742 Tel.: 02-3399-1605 Fax.: 02-3399-1617
E-mail: cheongjh@syu.ac.kr
Short Report
종설질환들에서 이러한 기본단위의 변화로 인한 NMDA 수용체의 기 능이상이 원인으로 지목되고 있다. 이러한 중추신경계 질환들에 대한 연구는 대부분 NMDA수용체의 기본단위 중 가장 많은 부 분을 차지 하는 GluN2의 변화에 초점이 맞춰져 있다.13) GluN3A 의 경우 조현병에 영향이 있다는 연구결과가 보고 되었으나, 신 경정신학적 질병들에 대한 연구가 GluN2에 비해 많이 진행되고 있지 않다.14-17)
GRIN3A는 GluN3A를 암호화하는 유전자로서 GluN3A는 다 른 NMDA 수용체의 기본단위들 보다 적은 부분을 차지하지만 시냅스의 발달에 관여하는 것으로 보고되고 있고,2,3,15) GluN3A 의 증가는 NMDA 수용체의 기능을 저하시키는 것으로 알려져 있다.4,5)본 연구진은 사전 연구에서 GRIN3A가 주의력 결핍 과 잉행동 장애 동물 모델인 본태성 고혈압 쥐에서 현저히 낮게 발 현되는 것을 확인하였다.18)이를 통해 GluN3A가 신경정신학적 관련 질병에 기여 할 수 있다고 예측되는바 본 연구에서는 GRIN3A의 유전자 조작 마우스를 사용하여 GluN3A가 신경정신 계에 어떤 영향을 미치는지 밝히고자 하였다.
실험방법
GRIN3A동물 모델 제작
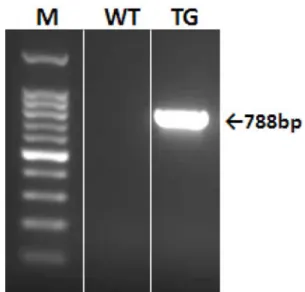
GRIN3A 과발현 마우스 모델 제작을 위해 mouse whole brain tissue cDNA에서 적합한 primer를 사용, PCR(95oC 5분, (95oC 30초-58oC 30초-72oC 1분) 30회, 72oC 5분)을 수행하여 GRIN3A 서열 정보를 확보하였다. 확보한 서열정보를 NCBI의 blast를 이 용하여 서열정보와 비교, 분석하였다. 서열정보를 비교, 분석한 GRIN3A insert를 gel-extraction을 이용하여 정제, 확보하였다.
pEGFP-N3-(P)NSE vector를 준비하고 EcoR1, Kpn1으로 잘라 내어 적절한 vector를 준비하였다. 준비된 insert와 vector를 ligation 시켜준 뒤 E. coli(Top10)를 준비하여 heat-shock으로 transformation 시켰다. LB-broth 100 ml에 kanamycin 100 µl를 넣고 transformation한 vector를 소량 넣은 후 12~15시간 동안 E. coli를 불려주었다. 불린 E. coli를 Mini-prep을 수행한 뒤 colony PCR을 수행하였다. 확보한 vector의 서열정보를 NCBI의 서열정보와 비교, 분석하였고, NB41A3 cell line에 Lipofectamine 을 이용하여 transfaction 시킨 뒤 realtime-PCR을 통하여 vector working을 확인하였다. 이식 유전자를 C57BL/6 마우스의 배아에 미세 주입하고, 이 배아를 pseudopregnant한 암컷 ICR마우스에 게 이식하였다.19)유전 형질분석을 위하여 형질 전환된 마우스의 꼬리를 잘라 추출하여 PCR을 수행하였다. 이때 사용된 primer는 다음과 같다. GRIN3A forward(5' - TGT CTG GGT TAG TAC CTG CCA - 3'), GRIN3A reverse(5' - CGA TGG CCA TCA CTA CTT CCA - 3')
실험동물과 처치 방법
대조군으로 사용된 C57BL/6 마우스는 3주령을 한림실험동물 센터(경기도 화성시)로부터 구입하여 1주간 안정화 시킨 후 사용 하였다. 모든 동물은 12시간의 명암주기가 유지되는 22±2oC 습 도 55±5%의 조건에서 사육되었다.
일반 운동 활성 측정
일반 운동 활성을 측정하기 위해 open-field test를 시행하였 다. 검은색 플라스틱 상자(42×42×47 cm)를 바닥에 고정시켜 놓 고, 상자 안의 빛의 세기는 30Lx 정도를 유지하였다. 상자 바닥 은 흰색 널빤지를 크기에 맞게 올려 두어 검은색 생쥐가 잘 감 지될 수 있도록 하였다. 5개의 상자 중앙에 생쥐를 각 1마리씩 넣은 후 10분간 자유롭게 움직이게 하고, 그 움직임을 Ethovision system(Noldus IT b.v., Netherlands)을 이용하여 컴퓨터로 측정 하였다. 10분간 움직이는 거리와 움직인 시간을 측정하였다. 이 실험을 통해 얻은 결과는 정신 운동 기능의 항진과 저하, 진정 흥분 정도의 자료로 활용하였다.20,21)
회전봉 시험
직경 3.5 cm, 36 rpm 속도의 회전판(UGO BASILE, Italy)에서 떨어질 때까지 견디는 시간과 10분 동안 떨어지는 횟수를 측정 하였다. 이 실험을 통해 실험동물의 운동 협응 능력, 균형감각을 평가하였다.
Elevated plus-maze test
Elevated plus-maze 상자와 장치는 2개의 열린 길(넓이 30×6 cm) 과 2개의 닫힌 길(20 cm의 벽으로 둘러싸여 있음)이 직각으로 교
Fig. 1 − PCR screening for GRIN3A-overexpressing transgenic mice.
차되고 중심에서 네 방향의 길로 뻗어나가도록 구성되어 있다.
전체 기구는 바닥에서 50 cm 높이에 설치되었다. 실험 동물을 중 심 정사각형 공간에 열린 길을 향해 두고, 5분 동안 자유롭게 움 직이도록 놓아둔 후 열린 공간과 닫힌 공간에 동물이 머무는 시 간과 서로 다른 공간으로 움직인 횟수를 측정하였다.22)
Y-maze test
실험동물들을 120o 각도로 세 갈래로 가지가 뻗은 Y-maze (42×3×12 cm)의 가지 끝에 두고 8분간 자유롭게 움직이도록 하였 다. 각 가지를 A, B, C로 정한 후 네 발이 모두 한 쪽 팔에 완전 히 들어가야 1회 출입횟수로 인정하였다. 세 개의 서로 다른 가 지에 차례로 들어간 경우를 spontaneous alternation behavior로 규정하였다. Alternation score (%)는 다음 수학식으로 계산하였 다. Alternation (%) = [(alternation 횟수) / (총 출입횟수-2)]×100
통계처리
데이터는 평균±S.E.M.으로 표시하였다. 통계처리를 위해 one- way ANOVA를 사용하였으며, 유의성 검정은 p<0.05를 기준으 로 하였다. Newman-Keuls test를 통해 모든 군의 유의성을 비 교하였다. 통계처리는 Prism 5.0(Graphpad software inc., San Diego, CA. USA)을 이용해 수행하였다.
실험결과
일반운동성
일반운동성은 open-field에서 총 이동거리와 이동한 시간으로 측정하였다. GRIN3A가 과발현된 마우스들은 대조군에 비해서 암 수 모두 일반운동성이 유의성 있게 감소하였다. 수컷의 경우 대조군은 10분간 3324 cm를 416초 동안 이동하였고 GRIN3A 과발현 마우스는 2694 cm를 339 초 동안 이동하여 총 이동거리
Fig. 2 − Locomotor activities of 4-week old C57BL/6 wild type mice and GRIN3A-overexpressing mice (n=9-10). Each bar represents the mean±S.E.M. of the moved distance (A) and the movement duration (B). *p<0.05, **p<0.01 compared to same sex wild type group
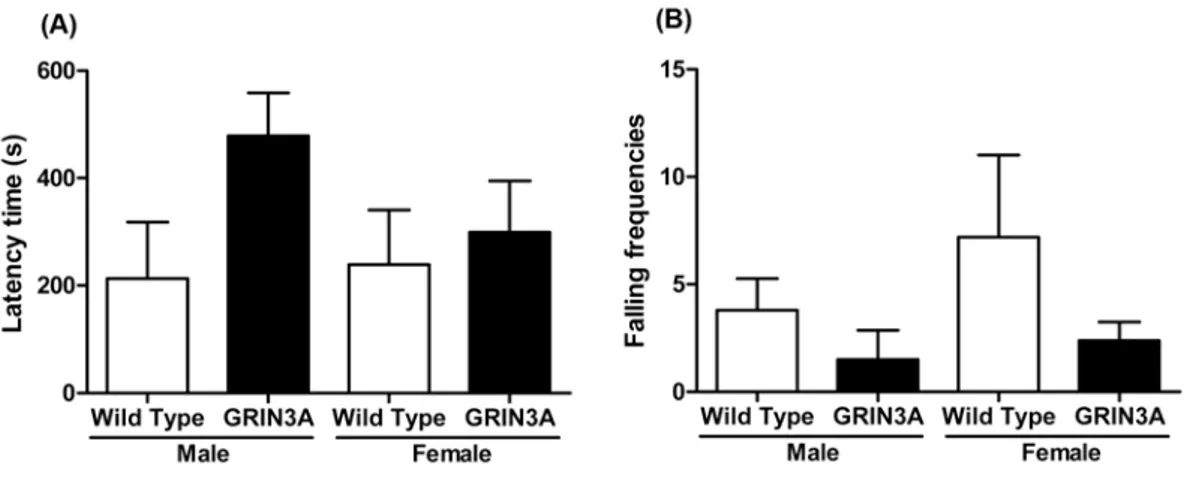
Fig. 3 − Activities of 4-week old C57BL/6 wild type mice and GRIN3A-overexpressing mice (n=9−10) on the rotating rod. Each bar represents
the mean±S.E.M. of latency time (A) and falling frequencies (B) on the rotating rod.
와 이동시간은 약 19%가 감소하였다(p<0.01). 암 컷의 경우 대 조군은 10분간 3310 cm를 400 초 동안 이동하였고, GRIN3A 과 발현 마우스는 2691 cm를 340 초 동안 이동하여서 총 이동거리 는 약 19%, 총 이동 시간은 15% 감소하였다(p<0.05). 암 수간 일반운동성의 차이는 유의성이 없었다(Fig. 2).
회전봉 시험
운동집중력과 조화능을 회전봉 시험을 통하여 확인하였다. 처 음 떨어지는 데 걸리는 시간과 총 떨어진 횟수를 측정하였는데 GRIN3A가 과발현된 마우스들은 대조군과 비교했을 때 암 수 모 두 유의성 있는 차이를 보이지 않았다(Fig. 3).
Elevated plus-maze (EPM) test
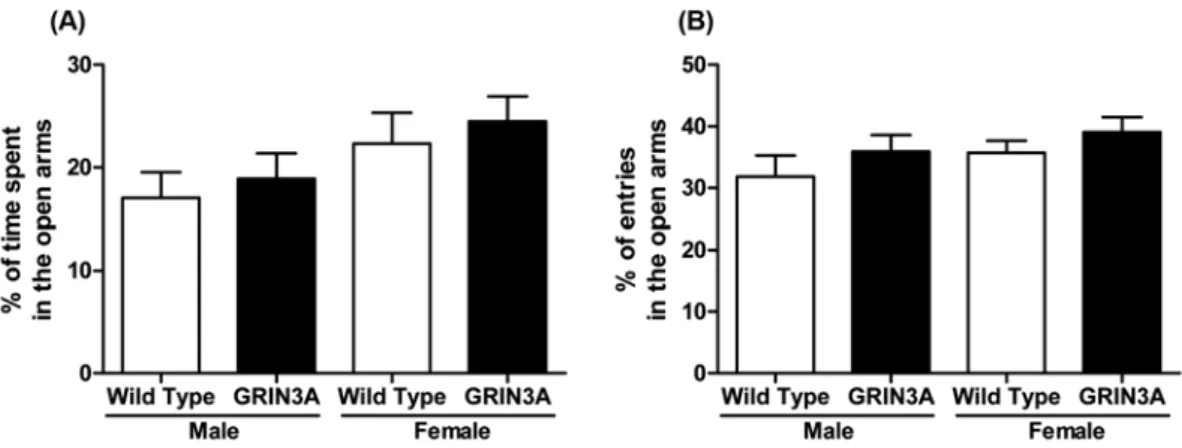
불안효과를 확인하기 위해 EPM test를 통해open-arm에 머무 는 시간과 출입한 횟수를 측정하였다. Open-arm에 머무는 시간 과 출입한 횟수가 암컷이 수컷에 비해서 증가하는 경향을 보였 으나 유의성은 없었고, GRIN3A 과발현 마우스가 대조군 보다
증가하는 경향을 보였으나 같은 성별간에는 유의성 있는 차이가 없었다(Fig. 4).
Y-maze test
기억력 및 주의 집중력을 확인하기 위해 Y-maze test를 수행 하였다. GRIN3A 과발현 마우스들은 총 이동한 횟수와 새로운 팔로 움직인 비율이 대조군에 비해서 유의성 있는 차이를 보이 지 않았다. 또한 암수 차이도 나타나지 않았다(Fig. 5).
고 찰
본 연구진은 N-methyl-D-asparatate(NMDA) 수용체의 기본단 위 중 GluN3A를 암호화하는 유전자인 GRIN3A를 과발현시킨 유전자조작 마우스를 통해서 GRIN3A가 중추신경계에 어떠한 영 향을 미치는지 확인하고자 하였다. GRIN3A가 과발현 된 마우스 들은 대조군들에 비해 유의성 있게 일반운동성이 떨어지는 것을 확인 할 수 있었는데, 이는 사전연구에서 Wistar rat에 비해 높
Fig. 4 − Elevated plus-maze task in 4-week old C57BL/6 wild type mice and GRIN3A-overexpressing mice (n=9−10). Each bar represents the mean±S.E.M. percentage of staying time in open arms (A) and percentage of entries in the open arms (B).
Fig. 5 − Y-maze task in 4-week old C57BL/6 wild type mice and GRIN3A-overexpressing mice (n=9−10). Each bar represents the mean
±S.E.M. of percentage of spontaneous alternation (A) and total arm entries (B).
은 일반운동성 경향을 보이는 본태성 고혈압쥐(spontaneously hypertensive rat, SHR)에서 GRIN3A가 유의성 있게 감소한 연 구 결과와 상응하는 결과였다.18)
GRIN3A 유전자는 NMDA 수용체의 기본단위인 GluN3A를 암 호화하는 유전자로 GluN3A는 NMDA 수용체의 활성을 억제하 는 것으로 보고되었다.4,23,24)그러나 비교적 최근에 밝혀진 GluN3A 는 NMDA 수용체의 다른 기본단위인 GluN2A와 GluN2B에 비 해서 신경정신학적 연구가 많이 진행되지 않았다.5,13,15) GluN3A 와 관련된 질환으로 가장 연구가 많이 된 것은 조현병이다.
NMDA 수용체의 기능저하는 조현병 원인의 하나로 알려져 있는 데, GluN3A의 증가가 NMDA 수용체의 기능저하를 유발할 수 있기 때문이다.14,16,25,26)또한 우울증이나 양극성 장애와도 관련 이 있다는 연구가 보고되었으나,10) GluN3A에 대한 더 많은 연 구가 필요한 상황이다.
SHR은 attention deficit hyperactivity disorder(ADHD)의 대 표적 지표인 과잉행동과 충동성을 보이며, 이를 억제할 수 있는 치료제를 찾아내는 데 적합한 동물 모델이다.27,28)이 SHR의 유 전적 차이를 정확히 파악하여 향후 ADHD연구에 필요한 정보를 찾아내는 것이 사전 연구의 목표였다. 여러 유전적인 차이를 확 인하던 중 GRIN3A가 SHR에서 Wistar rat에 비해 유의성 있는 차이를 보이는 것을 확인하였다. 하지만 GRIN3A 유전자는 다른 유전자에 비해 연구가 많이 진행되지 않아서, 후속연구를 진행 하기에 적합한 유전자라 판단하였다. GRIN3A의 변화가 NMDA 수용체의 기능 장애를 일으키고, 이것이 ADHD 발병의 원인 중 하나가 될 것으로 판단한 본 연구진은 이를 더 명확히 확인하기 위해 GRIN3A가 과발현된 유전자 조작 마우스를 설계하였고, 행 동 실험을 통하여 GRIN3A 유전자가 신경정신계에 미치는 영향 을 확인하였다.
GRIN3A를 과발현 시킨 마우스들은 암수 모두 대조군에 비해 서 일반운동성이 유의성 있게 감소하였다. 그러나 회전봉 시험 이나 불안감을 확인할 수 있는 elevated plus-maze(EPM) test, 주의 집중, 기억력을 확인할 수 있는 Y-maze test에서는 유의성 있는 차이를 보이지 않았다. 회전봉 시험과 EPM test에서 대조 군과 유의성 있는 차이가 나타나지 않았기 때문에 유전형질 조 작 마우스에서 운동부조화나 불안정서는 나타나지 않는 다는 것 을 알 수 있었다. 이러한 GRIN3A의 증가로 유도된 일반활동 저 하는 운동부조화나 불안정서를 일으키지 않고 과잉행동을 감소 시킬 수 있을 것으로 사료된다.
활동 저하가 나타나는 유전자 조작 동물모델들은 ADHD 발병 원리를 연구하는데 중요한 역할을 할 수 있다.29)보고에 의하면 세로토닌수송체 혹은 노르에피네프린 수송체를 knockout 시킨 마우스에서 활동저하가 뚜렷하게 나타났는데, 이는 이 수송체들 이 ADHD 발병에 주요한 원인이 된다는 것을 설명해 준다.30,31) 도파민, 세로토닌, 노르에피네프린의 불균형은 ADHD 발병의 원
인 중 한가지이며, 이 불균형으로 초래된 도파민의 증가는 과잉 행동을 유발하게 된다. 이 수송체들에 작용하는 정신약리활성 물 질이 이러한 과잉행동장애를 억제함으로써 ADHD 발병과 치료 원리를 이해하는데 도움을 준다.32)이와 마찬가지로 GRIN3A가 과발현된 마우스에서 활동저하가 나타난다는 것으로 유추해 볼 때, 이 GluN3A에 작용하는 약물이 ADHD의 치료제가 될 수도 있을 것이다. 더욱이 GluN3A에 직접적으로 작용하는 약물은 아 직까지 개발되지 않았기 때문에 이 기본단위를 치료목표로 하는 약물의 개발을 위한 연구가 필요하다.5)
그러나 GRIN3A의 증가가 ADHD의 치료목표가 될 수 있는지 는 후속연구가 더 필요하다. ADHD는 충동, 행동과잉, 주의력 부 족이 복합적으로 나타나는 질병이지만, GRIN3A의 증가는 행동 과잉만 억제하는 경향을 보였고, 집중력을 향상시키는 결과는 보 이지 않았기 때문이다. 또한 GluN3A의 증가는 조현병과 관련이 있을 수 있기 때문에 신중하게 접근할 필요가 있다. NMDA 수 용체의 기능저하는 조현병으로 이어질 수 있는데, GluN3A의 증 가는 NMDA 수용체의 구성을 바꾸어서 이 수용체의 기능을 방 해할 수 있기 때문이다.10)요컨대 GluN3A의 증가에 의한 NMDA 수용체의 기능저하는 ADHD의 치료목표가 될 수 있지만 조현병 을 일으키는 원인이 될 수도 있는 것이다. 흥미로운 점은 조현병 은 행동과잉을 유발하는데25,33)본 연구에서 GRIN3A를 과발현 시킨 마우스는 활동저하가 나타났다는 것이다. GRIN3A의 증가 가 조현병으로는 이어지지 않을 가능성도 있으며, GluN3A의 발 현량을 측정하여 GRIN3A와 GluN3A의 상관관계를 더욱 명확히 밝힐 필요가 있다.
본 연구를 통해서 GRIN3A를 과발현 시킨 동물모델에서 활동 저하가 수컷과 암컷 모두에게서 유의성 있게 나타나는 것을 확 인하였다. 이는 GRIN3A의 발현이 증가하면 과잉행동이 억제될 수 있음을 시사한다. 정신활성 약물들이 세로토닌 수송체와 노 르에피네프린 수송체에 작용하여 과잉행동을 억제하여 ADHD의 치료제로 활용되고 있듯이 GRIN3A를 표적 유전자로 하여 새로 운 ADHD 치료제가 개발 될 가능성이 있다. 뿐만 아니라 본 연 구에서 사용된 GRIN3A 과발현 마우스 모델은 NMDA 수용체와 신경정신학적 질병과의 관계를 규명하는 연구에 활용될 수 있다 고 사료된다.
감사의 말씀
본 연구는 2016년도 삼육대학교 교내 학술연구비지원에 의한 것이며, 이에 감사드립니다.
References
1) Cull-Candy, S., Brickley, S. and Farrant, M. : NMDA receptor
subunits: diversity, development and disease. Curr. Opin.
Neurobiol. 11, 327 (2001).
2) Perez-Otano, I. and Ehlers, M.D. : Learning from NMDA receptor trafficking: Clues to the development and maturation of glutamaterginc synapses. Neurosignals 13, 175 (2004).
3) Henson, M. A. , Roberts. A. C., Perez-Otano. I. and Philpot, B.
D. : Influence of the NR3A subunit on NMDA receptor functions. Prog. Neurobiol. 91, 23 (2010).
4) Traynelis, S. F., Wollmuth, L. P., Mcbrain, C. J., Menniti, F. S., Vance, K. M., Ogden, K. K., Hansen, K. B. Yan, H., Myers, S.
J. and Dingledine, R. : Glutamate receptor ion channels:
structures regulation and function. Pharmacol. Rev. 62, 405 (2010).
5) Paoletti, P., Bellone, C. and Zhou, Q. : NMDA recptor subunit diversity: impact on receptor properties, synaptic plasticity and disease. Nature Rev. Neurosci. 14, 383 (2013).
6) Lai, T. W., Shyu, W. C. and Wang, Y. T. : Stroke intervention pathways: NMDA receptors and beyond. Trends Mol. Med. 17, 266 (2011).
7) Aarts, M., Liu, Y., Liu, L., Besshoh, S., Arudine, M., Gurd, J.
W., Wang, Y. T., Salter, M. W. and Tymianski, M. : Treatment of ischemic brain damage by perturbing NMDA receptor-PSD-95 Protein interactions. Science 298, 846 (2002).
8) Tu, W., Xu, X., Peng, L., Zhong, X., Zhang, W., Soundarapnadian, M. M., Belal, C., Wang, M., Jia, N., Zhang, W., Lew, F., Chan, S. L., Chen, Y. and Lu, Y. : DAPK1 interaction with NMDA receptor NR2B subunits mediates brain damage in stroke. Cell 140, 222 (2010).
9) Lau, C. G. and Zukin, R. S. : NMDA receptor trafficking in synaptic plasticity and neuropsychiatric disorders. Nature Rev.
Neurosci. 8, 413 (2007).
10) Mueller, H. T. and Meador-Woodruff, J. H. : NR3A NMDA receptor subunit mRNA expression in schizophrenia, depression and dipolar disorder. Schizophr. Res. 71, 361 (2004).
11) Roberts, A. C., Diez-Garcia, J., Rodriguiz, R. M., Lopez, I. P., Lujan, R., Martinez-Turrillas, R., Pico, E., Henson, M. A., Bernardo, D. R., Jarrett, T. M. et al. : Downregulation of NR3A-containing NMDARs is required for synapse maturation and memory consolidation. Neuron 63, 342 (2009).
12) Mohamad, O., Song, M., Wei, L. and Yu, S.P. : Regulatory roles of the NMDA receptor GluN3A subunit in locomotion, pain perception and cognitive functions in adult mice. J. Physiol.
591(1) 149 (2013).
13) Mony, L., Kew, J. N. C., Gunthrope, M. J. and Paoletti, P. : Allosteric modulators of NR2B-containing NMDA receptors:
molecular mechanisms and therapeutic potential. Br. J.
Pharmacol. 157, 1301-1317 (2009).
14) Takata, A., Iwayama, Y., Fuuo, Y., Ikeda, M., Okochi, T., Maekawa, M., Toyota, T., Yamada, Kazuo., Hattori, E., Ohnishi,
T., Toyoshima, M., Ujike, H., et al. : A population-specific uncommon variant in GRIN3A associated with szhicophrenia.
Biol. Psychiatry 73, 532 (2013).
15) Pachernegg, S., Strutz-Seebohm, N. and Hollmann, M. : GluN3 subunit-containing NMDA recptors: not just one-trick ponies.
Trends Neurosci. 35, 240 (2012).
16) Olney, J. W., Newcomer, J. W. and Farber, N. B. : NMDA receptor hyofunction model of schizhophrenia. J. Psychiatr. Res.
33, 523 (1999).
17) Moghaddam, B. Bringing order to the glutamate chaos in schizophrenia. Neuron 40, 881 (2003).
18) dela Pena, I., Bang, M., Lee, J., dela Pena, J. B., Kim, B. N., Han, D. H., Noh, M., Shin, C. Y. and Cheong, J. H. : Common prefrontal cortical gene expression profiels between adolescent SHR/NCrl rats and WKY/NCrl which showed inattention behavior. Behav. Brain Res. 291, 268 (2015).
19) Hogan, B., Beddington, R., Constantin, F. and Lacy, E. : Manipulating the mouse embryo: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp497 (1994).
20) Kim, M. K., Yu, G. Y., Tan-Lee, B. S., Oh, H. J., Dong, K. W., Jeong, S. H., Han, S. W. and Cheong, J. H. : Anti-stress effect of Pyroligneous liquid in SD rats and ICR mice. J. Appl.
Pharmacol. 11, 249 (2003).
21) Noldus, L. P. J. J., Spink, A. J. and Tegelenbosch, A. J. : Ethovision: a versatile video tracking system for automation of behavioral experiments. Behav. Res. Method 33, 398 (2001).
22) Kim, W. K. , Jung, J. W., Ahn, N. Y., Oh, H. R., Lee, B. K., Oh, J. K., Cheong, J. H., Chun, H. S. and Ryu, J. H. : Anxiolytic-like effects of extracts from Albizzia julibrissin bark in the elevated plus-maze in rats. Life Sci. 75, 2787 (2004).
23) Al-Hallaq, R. A., Jarabek, B. R., Fu, Z., Vicini, S., Wolfe, B. and Yasuda, R. P. : Association of NR3A with the N-methyl-D- aspartate receptor NR1 and NR2 subunits. Mol. Pharmacol.
62, 1119 (2002).
24) Henson, M. A., Larsen, R. S., Lawson, S. N., Perez-Otano, I., Nakanish, N., Lipton, S. A. and Philpot, B.D. : Genetic deletion of NR3A accelerates glutamatergic synapse maturation. Plos ONE 7, 1 (2012).
25) Mohn, A. R., Gainetdinov, R. R., Caron, M. G. and Koller, B. H. : Mice with reduced NMDA receptor expression display behaviors related to schizophrenia. Cell 98, 427 (1999).
26) Moghadam B. and Jackson M. E. : Glutaminergic animal models of szhichophrenia. Ann. N. Y. Acad. Sci. 1003, 131 (2003).
27) Mill, J. : Rodents models: Utility for candidate genes studies in human attention-deficit hyperactivity disorder (ADHD). J.
Neurosci. Methods 166, 294 (2007).
28) Gainetdinov, R. R. : Strengths and limitations of genetic
models for ADHD. ADHD, 21 (2010).
29) Leo, D. and Gainetdinov, R. R. : Transgenic mouse models for ADHD. Cell Tissue Res. 354, 259 (2013).
30) Xu, F., Gainetdinov, R. R, Westel, W. C., Jones, S. R., Bohn, L.
M., Miller, G. W., Wang, Y. M. and Caron, M. G. : Mice lacking the norepinephrine transporter are supersensitive to psychostimulants. Nat. Neurosci. 3, 465 (2000).
31) Kalueff, A. V., Fox, M. A., Gallagher, P. S. and Murphy, D. L. : Hypolocomotion, anxiety and serotonin syndrome-like
behavior contributes to the complex phenotype of serotonin transporter knockout mice. Genes, Brain Behav. 6, 389 (2007).
32) Kalueff, A. V., Jensen, C. L., Murphy, D. L. : Locomotory patterns, spatiotemporal organization of exploration and spatial memory in serotonin transporter knockout mice. Brain Res.
1169, 87 (2007).
33) Rojas, P., Joodmardi, E., Perlmann, T. and Ogren, S. O. : Adult mice with reduced Nurr1 expression: an animal model for schizophrenia. Mol. Psychiatry 12, 756 (2007).