http ://d x.d o i.o rg /1 0 .4 0 78 /jrd .20 1 4.2 1.1 .4
4
<Received:February 4, 2014, Revised:February 17, 2014, Accepted:February 17, 2014>
Corresponding to:Ho Jin Kim, Department of Neurology, Research Institute and Hospital of National Cancer Center, 323, Ilsan-ro, Ilsandong-gu, Goyang 410-769, Korea. E-mail:hojinkim@ncc.re.kr
pISSN: 2093-940X, eISSN: 2233-4718
Copyright ⓒ 2014 by The Korean College of Rheumatology
This is a Free Access article, which permits unrestricted non-commerical use, distribution, and reproduction in any medium, provided the original work is properly cited.
전신 류마티스 질환과 시신경척수염
현재원ㆍ김수현ㆍ김호진 국립암센터 신경과
The Systemic Rheumatologic Disease and Neuromyelitis Optica
Jae-Won Hyun, Su-Hyun Kim, Ho Jin Kim
Department of Neurology, Research Institute and Hospital of National Cancer Center, Goyang, Korea
Neuromyelitis optica (NMO), an autoimmune in- flammatory disease of the central nervous system (CNS), is related with autoantibodies for aquaporin-4, which is the most abundant water channel in CNS. The clinical syndromes of NMO, such as longitudinally extensive trans- verse myelitis and optic neuritis, can occur in the context of systemic rheumatologic diseases, such as systemic lupus erythematosus and Sjögren syndrome. It is debatable as to whether NMO is a feature of genetic tendency toward
humoral autoimmunity or a CNS complication of systemic rheumatologic diseases. Current evidence suggests that NMO coexists with systemic rheumatologic diseases rather than a complication from them. Early immunosuppressive therapies should be considered in these patients since just one or two attacks can cause severe neurological disability.
Key Words. Systemic rheumatologic disease, Neuromyelitis optica, Comorbidity, Complication
서 론
시신경척수염(Neuromyelitis optica, NMO)은 중추신경계 염증성 질환으로 단안 또는 양안의 심한 시신경염(optic neuritis)과 척추 3분절 이상을 침범하는 긴 척수염 (longitudinally extensive myelitis)을 특징으로 한다 (1). 1894 년 Eugène Devic이 일측 혹은 양측 시력 상실과 양 하지 마비 또는 사지 마비, 감각 저하, 괄약근 조절 장애 등의 증상이 수 주 이내에 동시 발생한 환자들을 보고하면서
‘neuromyélite optique aigue’ (acute optic neuromyelitis)라는 용어를 처음 사용하였다. 이후 그러한 임상 증후군에 대하 여 데빅병(Devic’s disease) 또는 데빅 증후군(Devic’s syn- drome)이라는 명칭이 쓰였다 (2) 오랜 기간 동안 시신경척 수염은 시신경과 척수를 거의 동시에 또는 잇달아 침범하
는 단상(monophasic)질환으로 여겨왔다. 그러나 이후 대부 분의 환자에서 시신경과 척수 증상이 반복하여 나타나는 재발(relapsing)경과를 보인다는 것이 밝혀졌고 (3), 이러한 특징 때문에 다발성경화증의 한 아형으로 여겨지기도 했 다. 2004년 시신경척수염 환자의 혈액에서 질환특이 항체 인 NMO-IgG가 발견되고 (4), 2005년 이 NMO-IgG의 표적 항원이 아쿠아포린-4 (aquaporin-4, AQP4)라는 것이 밝혀 짐에 따라서 (5), 혈액에 NMO-IgG의 존재 여부에 의한 시 신경척수염의 진단 방법이 개발되었고, 2006년 개정된 진 단 기준이 발표되었다 (6). 현재는 여러 임상 및 실험실 증 거들에 의해 시신경척수염이 다발성경화증과는 발병기전 과 치료가 전혀 다른 별개의 질환임이 밝혀졌다 (7). 임상 에서 이 두 질환의 감별은 특히 중요하다. 이는 시신경척
수염이 단 한번의 재발로도 심한 신경학적 장애를 남길 수 있어, 재발을 막기 위한 조기 면역치료가 무엇보다 중요한 데, 다발성경화증의 대표적인 질환조절치료제인 인터페론 베타는 오히려 시신경척수염을 악화시킬 수 있기 때문이 다 (8).
AQP4는 시신경, 뇌, 척수의 별아교세포(astrocyte)에 발현 되는 수분 채널(water channel)로 특히 혈뇌장벽(blood brain barrier)의 내피세포와 인접하는 별아교세포의 발돌기(foot process)에 높게 발현하여 수분 항상성 유지에 기여한다 (9). 과거에는 시신경척수염이 시신경과 척수만을 침범하 고, 뇌는 침범하지 않는다고 알려졌으나, 시신경척수염이 항AQP4 항체에 의해 매개되는 병리를 가진 질환이라는 것 이 밝혀지면서, 이를 기반으로 보다 광범위한 중추신경계 AQP4 자가면역질환이라는 새로운 질환의 스펙트럼이 대 두되었다 (10). 시신경염과 척수염을 모두 발현하는 전형적 시신경척수염(definite NMO) 외에도 길게 확장된 횡단 척 수염, 양측 혹은 심한 시력장애를 동반하는 시신경염과 같 이 일부 특징적인 증상만 발현하는 제한적 시신경척수염 (limited form of NMO) 등 항AQP4 항체와 관련된 질환의 임상 발현은 다양하여 시신경척수염범주질환(NMO spec- trum disorder)으로 확장되어 지칭되고 있다 (11). 항AQP4 항체의 유무는 진단에 중요한 결정 요인이며 특히 제한적 시신경척수염의 임상 양상을 보이는 환자에서 항AQP4 항 체가 있는 경우 시신경척수염에 준하여 치료해야 한다 (6).
이전 연구들을 통하여 시신경척수염이 전신홍반루프스, 쇼그렌증후군과 같은 전신 류마티스 질환 혹은 기관 비특 이 자가항체(non-organ-specific autoantibodies)들과 동반될 수 있음이 밝혀져 왔다 (3,12). 이를 바탕으로 시신경척수 염과 전신 류마티스 질환과의 연관성은 크게 두 가지로 나 뉘어 설명된다 (13). 첫째는 체액 면역에 대한 유전적 경향 으로 인하여 다양한 자가면역상태에 대한 취약성이 발생 하여 귀결된 시신경척수염과 전신 류마티스 질환의 “병 발”로 설명하는 것이고, 둘째는 시신경척수염을 전신 류마 티스 질환의 “합병증” 혹은 “결과”로서 설명하는 것이다.
본 논문에서는 현재까지의 연구들을 통합적으로 살펴봄으 로써 위 질문에 대한 답을 고찰해 보고 이를 통하여 진단 및 치료 전략에 대해 알아보고자 한다.
본 론
시신경척수염과 전신 류마티스 질환의 관계를 규명하고 자 다양한 연구들이 진행되었다. 우선, 전신 류마티스 질 환과 시신경척수염의 인과 관계를 밝히기 위한 발병의 선 후 관계에 대한 연구가 있다 (14). 만약 시신경염이나 척수 염이 전신 류마티스 질환의 결과로서 발현한다면 전신 질 환이 먼저 발현할 가능성이 높다. Pittock 등의 보고에 의하 면 5명의 환자에서 2명은 시신경척수염 전에 전신홍반루 프스나 쇼그렌 증후군을 보였고, 세 명은 반대의 순서로 발현하였다. 더 많은 환자에서의 연구가 필요하나 이 연구
결과는 전신 류마티스 질환이 반드시 시신경염이나 척수 염에 선행하지는 않으며 두 질환이 병발할 가능성이 있음 을 시사한다. 다음으로 시신경척수염에 특이적이라고 밝 혀진 항AQP4 항체가 시신경척수염과 전신 류마티스 질환 관련 시신경염과 척수염에서 발견되는 비율에 차이가 있 는가에 대한 연구가 있다 (14-16). 이전의 세 연구에서 같 은 결론이 도출되었는데 시신경척수염과 전신 류마티스 질환과 연관된 시신경염, 척수염 모두에서 높은 빈도로 항 AQP4 항체가 발견된 반면, 시신경염이나 척수염 임상 증 상이 없는 전신 류마티스 질환 환자군에서는 항AQP4 항 체가 전혀 발견되지 않았다. 이 또한 두 질환이 병발함을 시사하는 소견이다. 세번째로 두 질환의 연관성을 밝히기 위하여 시신경척수염과 전신 류마티스 질환 관련 시신경 염, 척수염의 임상 발현이 유사한가에 대한 연구가 있다.
부검을 통한 면역병리학적 소견의 차이는 아직 뚜렷하게 보고된 바가 없으나 자기공명영상촬영상으로 시신경척수 염의 특징적인 소견인 세로로 광범위한 횡단척수염(longi- tudinally extensive transverse myelitis)이 쇼그렌증후군과 전 신홍반루프스 그리고 항인지질항체증후군의 일부 환자에 서 발현됨이 보고된 바 있다 (17-20). 그러나 전신 류마티 스 질환 환자의 일부 환자에서만 시신경척수염의 특징적 인 소견이 보이는 것으로 두 질환이 상호간의 합병증임에 대한 결론을 내리기에는 어려움이 있다. 마지막으로 두 질 환 간의 관계를 밝히기 위하여 논의의 중심이 된 중추신경 계 증상을 발현하는 전신 류마티스 질환과는 달리 중추신 경계 이상을 보이지 않는 다른 전신 염증 질환과 시신경척 수염의 관련성에 대한 연구가 있다. 시신경척수염과 큰 연 관성을 보여준 자가면역 질환은 자가면역 갑상선질환으로 일반적으로 중추신경계에 병리를 보이지 않는다. 시신경 척수염은 중증근무력증과 연관됨이 밝혀져 있는데 이 질 환 역시 혈관염이나 중추신경계 병리와 연관성이 낮다 (21,22). 시신경척수염은 celiac 병과도 관련이 있는 것으로 보고되어 있는데 이 질환 역시 중추신경계 병리를 보이는 가에 대하여서는 논쟁의 여지가 있다 (23,24). 이러한 결과 들을 종합하여 볼 때 전신 류마티스 질환과 중추신경계 병 태생리가 직접적인 연관성을 가질 가능성은 낮다. 이 역시 시신경척수염이 전신 류마티스 질환의 합병증일 가능성보 다 두 질환이 병발할 가능성을 지지한다.
이러한 이전 연구들을 바탕으로 시신경척수염과 전신 류 마티스 질환의 병발을 설명할 수 있는 기전에 대한 다양한 고찰도 있어 왔다. 우선 가장 유력한 주장으로 자가면역에 대한 공통의 유전적 경향과 환경적 요인으로 인할 가능성 이다. 이전 연구를 통하여 다양한 자가면역 질환들이 시신 경척수염과 연관성을 가진다는 것이 밝혀져 있으며 공통 의 유전적 기반을 가진다는 것이 보고되어 있다 (25). 공통 의 자가면역 유전자는 HLA과 non-HLA 유전자들을 포함 한다. Non-HLA 유전자는 류마티스 관절염, 전신홍반루프 스, 크론병, 제1형 당뇨와 연관된 tyrosine phosphatase와 연
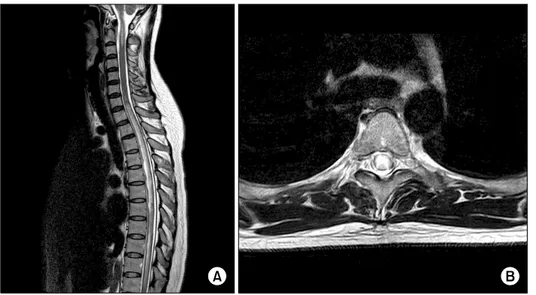
Figure 1. Spinal MRI of the patient with neuromyelitis optica (T2 weighted imaging). (A) Long- itudinally extensive cervico- tho- racic myelopathy in the sagittal view. (B) Central gray matter is preferentially involved in the axial view.
관된 PTPN22, 크론병, 건선, 전신홍반루프스와 연관 있는 IL23R, 류마티스관절염, 전신홍반루프스, 건선, 크론병과 연관되어 ubiquitination 조절에 관련되는 TNFAIP3가 있다.
이러한 자가면역 유전자들 사이의 상호작용에 대한 분자 적 기반은 완전히 이해되지 않았지만 이러한 유전자들이 면역 기능과 연관되어 있다는 것은 알려져 있다. 아직 시 신경척수염에 대한 환경적 요인의 영향에 대하여서는 많 이 알려진 바가 없다는 제한점이 있으나 현재까지의 연구 들을 종합하여 볼 때 두 질환이 공통의 유전적 경향을 바 탕으로 병발할 가능성이 있다. 이에 반하여 전신 류마티스 질환의 합병증으로서 시신경척수염이 생기는 기전에 대한 연구들도 진행되었는데 첫째로 전신 류마티스 질환이 시 신경척수염의 병리 기전을 촉진할 가능성에 대한 연구들 이 있다. 만약 혈뇌장벽(Blood brain barrier)의 손상에 전신 류마티스 질환의 자가항체들이 기여를 한다면 이는 항 AQP4 항체들의 중추신경계 진입을 도와 병리적 작용에 기여한다는 가정에서 제시된 가능성이나 전신 류마티스 질환이 시신경척수염에 선행하는 경향이 일관되지 않아 근거가 부족하다. 또한 중증근무력증은 자가면역기전을 보이나 주로 근신경접합부(neuromuscular junction)를 침범 하여 혈액뇌장벽의 손상이나 중추신경계질환과 연관성이 낮다 (21,22). 둘째로 혈관병리와 같은 공통의 면역 병리 기전을 공유할 가능성에 대한 연구들이 있다. 시신경척수 염에서 확인되는 병리소견은 심한 정도에 따라 다양하나, 공통적으로 혈관주변부의 면역글로불린(immunoglobulin) 과 보체의 침착, 그리고 항AQP4 항체에 대한 면역반응 소 실이다. 경벽성 혈관염(transmural vasculitis)은 보이지 않으 며 전신홍반루프스 연관 뇌염과 시신경척수염 환자의 뇌 병변에서 보이는 병리소견 간의 공통적인 소견은 뚜렷하 지 않았다 (26). 셋째로 항AQP4 항체가 다른 자가항원에 대한 자가면역의 감작으로 인하여 이차적으로 생성될 가 능성에 대한 연구들이 있다. 항AQP4 항체가 시신경척수
염의 병리적 잠재력을 가진 것이 밝혀짐에 따라 전신 류마 티스 질환의 부수현상으로서 시신경척수염을 설명하는 것 이 어려워졌다. 더욱이, 대부분의 시신경척수염 환자들이 전신 류마티스 질환을 가지고 있지 않은 것도 이러한 가능 성을 부인하는 하나의 요인이다 (27,28). 이를 종합하여 볼 때 시신경척수염이 전신 류마티스 질환의 합병증일 가능 성보다는 두 질환의 병발일 가능성이 높다.
상기 기술한 기존 연구를 기반으로 하여 시신경척수염과 전신 류마티스 질환의 관계를 “병발”일 가능성에 무게를 두고 진단적, 치료적 전략을 수립할 수 있다.
진단적 전략으로는 우선, 기존에 알고 있는 전신 류마티스 질환을 가진 환자에서 시신경염 혹은 척수염을 보인 환자 들, 특히 세로로 광범위한 횡단척수염(Figure 1) 등과 같은 시신경척수염에 특징적인 임상 양상을 보인 환자에서는 항 AQP4 항체를 포함한 시신경척수염에 대한 평가가 이루어 져야 한다. 항AQP4 항체의 특이도는 높기 때문에 이 검사 에서 항체 양성 소견을 보인 경우에는 시신경척수염을 진 단할 수 있으며 이 경우 시신경척수염이 전신 류마티스 질 환과 병발되어 있다고 평가할 수 있다. 항AQP4 항체의 민 감도는 아직 완전하지 않아 검사에서 음성 소견을 보였다 고 해도 시신경척수염을 배제하기는 어려우므로 임상적으 로 주의 깊은 추적 경과관찰 및 반복적인 항체 검사가 필요 하다. 그러나 단 한번의 시신경염 혹은 척수염만을 발현한 경우에는 추적 경과관찰을 할 수 있겠으나, 임상적으로 전 형적인 시신경척수염의 소견(재발성의 길게 확장된 횡단 척수염, 양측 혹은 심한 시력장애를 동반한 시신경염, 시신 경염과 척수염을 동시에 보이는 경우, 지속적인 구토나 딸 국질, 기면증 등 전형적인 뇌병변이 있는 경우)이 반복적으 로 생길 경우에는 항체 검사 결과와 상관없이 병발이 되었 다고 판단하고 치료해야 한다. 다음으로 기존에 알고 있는 전신 류마티스 질환의 임상적 발현은 없이 항핵항체 혹은 항SSA/SSB 항체와 같은 기관 비특이적인(non-organ specif-
ic) 자가 항체만 양성이면서 시신경염이나 척수염이 발현한 경우에는 루프스 척수염 혹은 쇼그렌증후군 관련 척수염보 다 시신경척수염이나 시신경척수염 범주 질환의 가능성이 항AQP4 항체 검사 결과와 상관없이 더 높다. 그러나 이러 한 경우 전신 류마티스 질환이 숨어 있는 것은 아닌지에 대 한 철저한 평가가 같이 이루어지는 것이 바람직하다. 요약 하자면, 항AQP4 항체가 양성인 경우는 시신경척수염이 자 가면역 질환이나 자가항체들과 병발했다고 평가해야 하고, 항AQP4 항체가 음성인 경우는 약간의 불확실성은 있으나 통계적으로는 같은 결론일 가능성이 높다. 특히 음성 결과 의 경우, 이미 전신 류마티스 질환이 있어 면역억제치료를 받고 있는 환자의 경우 이에 영향을 받아 음성 결과가 도출 된 것일 수도 있기 때문이다 (13).
치료적인 전략은 환자의 임상양상이나 항AQP4 항체 유 무에 따라 차이가 있을 수 있다. 예를 들어 환자가 길게 확 장된 횡단척수염을 첫 증상으로 보였을 경우 검사상에서 항핵항체가 있으나 전신 증상은 없을 경우 이러한 환자들 은 루프스 척수염으로 평가될 가능성이 높으며 이러한 환 자들의 치료 전략은 아직 정확히 수립되지 않았다. 그러나 같은 환자에서 항AQP4 항체가 양성으로 나온다면, 전향적 인 이전 연구를 통하여 항체가 있는 환자에서 1년 내 신경 학적인 재발이 있을 위험성(>60%)이 높으므로 조기에 면 역억제치료가 고려되어야 하며 경험적으로 5년 가량의 치 료가 추천된다 (29). 시신경척수염이나 시신경척수염 범주 질환 환자들에게는 B 세포 또는 항체 생성을 억제하는 면 역억제치료를 하며 azathioprine, rituximab, mycophenolate mofetil 등이 고려될 수 있다 (30-32). 시신경척수염과 전신 류마티스 질환의 치료는 중첩되는 경우가 많고 치료 전략 도 유사하다. 그러나 이러한 질환이 병발된 경우 류마티스 전문의와 신경과전문의의 긴밀한 협진이 요구된다. 류마티 스 질환에서 자주 사용되는 methotrexate는 시신경척수염의 치료에서도 좋은 결과를 보였으나, cyclophosphamide는 상 반된 결과를 보였다 (33,34). 무엇보다 중추신경계 탈수초 화를 유발할 수 있는 tumor necrosis factor-alpha 기능을 저 해하는 치료(infliximab, adalimumab, etanercept)는 병발 환 자에서는 사용을 피해야 할 것이다 (35).
결 론
시신경척수염과 전신 류마티스 질환 간의 관계를 확실하 게 결론내기에는 부검결과 등에서 일치된 소견 등이 보고 되지 않아 (36,37) 아직 이르다. 그러나 항AQP4 항체는 시 신경척수염에 매우 특이적으로 중추신경계 증상의 발현 없이 다른 자가면역질환에서 발견될 가능성이 낮다. 그러 므로 시신경염이나 척수염이 전신 류마티스 질환에서 발 현하였을 때, 항AQP4 항체 양성이라면 이러한 증상이 전 신 류마티스 질환의 이차 합병증이 아닌 중추신경계 AQP4 자가면역의 일환으로 발현하였으며, 전신 류마티스 질환이 동반되어 있다고 판단하고 조기에 시신경척수염 재발을
막기 위한 면역억제치료를 고려해야 한다. 또한 항AQP4 항체가 음성이라 해도 항체 검사의 민감도는 아직 다소 제 한적이므로 임상적 증상이 시신경척수염의 전형적인 양상 으로 발현하였을 때는, 특히 심한 신경학적 장애를 초래한 경우, 시신경척수염에 준해 치료하는 것을 고려해야 한다.
References
1. Kim W, Kim SH, Kim HJ. New insights into neuro- myelitis optica. J Clin Neurol 2011;7:115-27.
2. Devic E. Myelite subaigue compliquee de nevrite optique.
Bull Med 1894;8:1033-4.
3. Wingerchuk DM, Hogancamp WF, O'Brien PC, Weinshenker BG. The clinical course of neuromyelitis optica (Devic's syndrome). Neurology 1999;53:1107-14.
4. Lennon VA, Wingerchuk DM, Kryzer TJ, Pittock SJ, Lucchinetti CF, Fujihara K, et al. A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis. Lancet 2004;364:2106-12.
5. Lennon VA, Kryzer TJ, Pittock SJ, Verkman AS, Hinson SR. IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel. J Exp Med 2005;
202:473-7.
6. Wingerchuk DM, Lennon VA, Pittock SJ, Lucchinetti CF, Weinshenker BG. Revised diagnostic criteria for neuro- myelitis optica. Neurology 2006;66:1485-9.
7. Barnett MH, Sutton I. Neuromyelitis optica: not a multi- ple sclerosis variant. Curr Opin Neurol 2012;25:215-20.
8. Kim SH, Kim W, Li XF, Jung IJ, Kim HJ. Does interfer- on beta treatment exacerbate neuromyelitis optica spec- trum disorder? Mult Scler 2012;18:1480-3.
9. Rash JE, Yasumura T, Hudson CS, Agre P, Nielsen S.
Direct immunogold labeling of aquaporin-4 in square ar- rays of astrocyte and ependymocyte plasma membranes in rat brain and spinal cord. Proc Natl Acad Sci U S A 1998;95:11981-6.
10. Kim SH, Kim W, Li XF, Jung IJ, Kim HJ. Clinical spec- trum of CNS aquaporin-4 autoimmunity. Neurology 2012;78:1179-85.
11. Wingerchuk DM, Lennon VA, Lucchinetti CF, Pittock SJ, Weinshenker BG. The spectrum of neuromyelitis optica.
Lancet Neurol 2007;6:805-15.
12. O'Riordan JI, Gallagher HL, Thompson AJ, Howard RS, Kingsley DP, Thompson EJ, et al. Clinical, CSF, and MRI findings in Devic's neuromyelitis optica. J Neurol Neurosurg Psychiatry 1996;60:382-7.
13. Wingerchuk DM, Weinshenker BG. The emerging rela- tionship between neuromyelitis optica and systemic rheu- matologic autoimmune disease. Mult Scler 2012;18:5-10.
14. Pittock SJ, Lennon VA, de Seze J, Vermersch P, Homburger HA, Wingerchuk DM, et al. Neuromyelitis optica and non organ-specific autoimmunity. Arch Neurol 2008;65:78-83.
15. Wandinger KP, Stangel M, Witte T, Venables P, Charles P, Jarius S, et al. Autoantibodies against aquaporin-4 in patients with neuropsychiatric systemic lupus eryth- ematosus and primary Sjögren's syndrome. Arthritis
Rheum 2010;62:1198-200.
16. Jarius S, Jacobi C, de Seze J, Zephir H, Paul F, Franciotta D, et al. Frequency and syndrome specificity of antibodies to aquaporin-4 in neurological patients with rheumatic disorders. Mult Scler 2011;17:1067-73.
17. Kahlenberg JM. Neuromyelitis optica spectrum disorder as an initial presentation of primary Sjögren's syndrome.
Semin Arthritis Rheum 2011;40:343-8.
18. Kim SM, Waters P, Vincent A, Kim SY, Kim HJ, Hong YH, et al. Sjogren's syndrome myelopathy: spinal cord involvement in Sjogren's syndrome might be a manifes- tation of neuromyelitis optica. Mult Scler 2009;15:1062-8.
19. Espinosa G, Mendizábal A, Mínguez S, Ramo-Tello C, Capellades J, Olivé A, et al. Transverse myelitis affecting more than 4 spinal segments associated with systemic lu- pus erythematosus: clinical, immunological, and radio- logical characteristics of 22 patients. Semin Arthritis Rheum 2010;39:246-56.
20. Rodrigues CE, de Carvalho JF. Clinical, radiologic, and therapeutic analysis of 14 patients with transverse myelitis associated with antiphospholipid syndrome: report of 4 cases and review of the literature. Semin Arthritis Rheum 2011;40:349-57.
21. Kister I, Gulati S, Boz C, Bergamaschi R, Piccolo G, Oger J, et al. Neuromyelitis optica in patients with myas- thenia gravis who underwent thymectomy. Arch Neurol 2006;63:851-6.
22. McKeon A, Lennon VA, Jacob A, Matiello M, Lucchinetti CF, Kale N, et al. Coexistence of myasthenia gravis and serological markers of neurological auto- immunity in neuromyelitis optica. Muscle Nerve 2009;39:87-90.
23. Jacob S, Zarei M, Kenton A, Allroggen H. Gluten sensi- tivity and neuromyelitis optica: two case reports. J Neurol Neurosurg Psychiatry 2005;76:1028-30.
24. Jarius S, Jacob S, Waters P, Jacob A, Littleton E, Vincent A. Neuromyelitis optica in patients with gluten sensitivity associated with antibodies to aquaporin-4. J Neurol Neurosurg Psychiatry 2008;79:1084.
25. Cho JH, Gregersen PK. Genomics and the multifactorial nature of human autoimmune disease. N Engl J Med 2011;365:1612-23.
26. Johnson RT, Richardson EP. The neurological manifes- tations of systemic lupus erythematosus. Medicine (Baltimore) 1968;47:337-69.
27. Hinson SR, Pittock SJ, Lucchinetti CF, Roemer SF, Fryer JP, Kryzer TJ, et al. Pathogenic potential of IgG binding to water channel extracellular domain in neuromyelitis optica. Neurology 2007;69:2221-31.
28. Bradl M, Misu T, Takahashi T, Watanabe M, Mader S, Reindl M, et al. Neuromyelitis optica: pathogenicity of patient immunoglobulin in vivo. Ann Neurol 2009;66:
630-43.
29. Weinshenker BG, Wingerchuk DM, Vukusic S, Linbo L, Pittock SJ, Lucchinetti CF, et al. Neuromyelitis optica IgG predicts relapse after longitudinally extensive trans- verse myelitis. Ann Neurol 2006;59:566-9.
30. Costanzi C, Matiello M, Lucchinetti CF, Weinshenker BG, Pittock SJ, Mandrekar J, et al. Azathioprine: toler- ability, efficacy, and predictors of benefit in neuromyelitis optica. Neurology 2011;77:659-66.
31. Kim SH, Huh SY, Lee SJ, Joung A, Kim HJ. A 5-year follow-up of rituximab treatment in patients with neuro- myelitis optica spectrum disorder. JAMA Neurol 2013;70:1110-7.
32. Jacob A, Matiello M, Weinshenker BG, Wingerchuk DM, Lucchinetti C, Shuster E, et al. Treatment of neuro- myelitis optica with mycophenolate mofetil: retrospective analysis of 24 patients. Arch Neurol 2009;66:1128-33.
33. Kitley J, Elsone L, George J, Waters P, Woodhall M, Vincent A, et al. Methotrexate is an alternative to azathio- prine in neuromyelitis optica spectrum disorders with aquaporin-4 antibodies. J Neurol Neurosurg Psychiatry 2013;84:918-21.
34. Bichuetti DB, Oliveira EM, Boulos Fde C, Gabbai AA.
Lack of response to pulse cyclophosphamide in neuro- myelitis optica: evaluation of 7 patients. Arch Neurol 2012;69:938-9.
35. Bosch X, Saiz A, Ramos-Casals M; BIOGEAS Study Group. Monoclonal antibody therapy-associated neuro- logical disorders. Nat Rev Neurol 2011;7:165-72.
36. Ortiz de Zárate JC, Tamaroff L, Sica RE, Rodriguez JA.
Neuromyelitis optica versus subacute necrotic myelitis. II.
Anatomical study of two cases. J Neurol Neurosurg Psychiatry 1968;31:641-5.
37. Lucchinetti CF, Mandler RN, McGavern D, Bruck W, Gleich G, Ransohoff RM, et al. A role for humoral mech- anisms in the pathogenesis of Devic's neuromyelitis optica. Brain 2002;125:1450-61.