대한소화기학회지 2000;35:591 - 599
No. 2000-8 간세포 장기 보존을 위한 적정 동결법에 관한 연구- I
경희대학교 의과대학 내과학교실
동석호・김병호・성세라・김영일・박재경 김경진・김효종・장영운・이정일・장 린
Cry o p r e s e r v a t i o n o f P r i m a r y H e p a t o c y t e s fo r R e p e a t e d In v e s t i g a t i o n a l U s e s
Se ok Ho Don g, M.D., Byung-Ho Kim , M.D., Se Ra Su ng, Young Il Kim, M.S., J a i Ky u n g P a r k , M.S., Ky e o n g J in Ki m , M.D., H y o J o n g Ki m , M.D., Yo u n g Wo o n Ch a n g , M.D., J o u n g Il Le e , M.D. a n d R in Ch an g , M.D.
Department of Internal Medicine, Kyung Hee University College of Medicine, Seoul, Korea
Background/Aims: The cryopreservation of primary hepatocytes could avoid unnecessary isolation of hepatocytes and meet repeated investigational demands. We tried to find out an optimal cryopre- servation method of rat hepatocytes. Methods: Primary hepatocytes with more than 90% viability were cryopreserved with the manual or computer-programmable freezing method. We analyzed the effects of the composition (basal medium or fetal bovine serum, FBS) of cryopreservation media, cell concentration, and freezing method on cell viability. Results: Two-step addition of cryopre- servation medium (4%→16% DMSO) improved cell viability, compared to its one-step addition (82.7±2.5 vs 73.3±2.1%, p=0.008). In the manual method, the cell viability was about 60% and the culture attachment rate was less than 1%. They were not related with the composition of media used. These results showed that the manual method was not efficacious for cryopreservation. However, about 80% of the cell viability and 50% of the culture attachment rate could be obtained with an optimal computer-programmable method (-2℃ slow cooling rate with a shock cooling, 2×106/mL cell concentration, 10-20% FBS, 10% DMSO). Moreover, the culture attachment rate was increased up to 75% when Percoll density purification was applied. Conclusions: Primary hepatocytes can be effectively cryopreserved by an optimal computer-programmable freezing method and Percoll density purification, but not by the manual method. (Kor J Gastroenterol 2000;35:591 - 599)
Key Words: Cryopreservation, Primary hepatocytes, Computer-programmable freezing
접수: 2000년 1월 3일, 승인: 2000년 4월 5일
연락처: 김병호, 130-702, 서울시 동대문구 회기동 1번지, 경희의료원 내과 Tel: (02) 958-8145, Fax: (02) 968-1848
※ 본 연구는 대한소화기학회 1999년도 추계학술대회에서 발표되었으며, 1998년도 경희의료원 산학연구비의 일부 보조로 경희의료원 동서의학연구소 의과학연구부 실험실에서 이루어졌음.
592 대한소화기학회지 : 제 35 권 제 5 호 2000
서 론
정상 간세포 배양(primary hepatocyte culture)1은 세포 성장 및 분화기전, 대사 과정, 약제의 생화학적 변환 및 독성 유발, 발암기전 등의 여러 가지 기초 연구에 이용될 수 있다. 그러나 일단 분리된 간세포 는 배양하는 동안에 간세포 기능이 급격하게 소실 되면서 수주 내 미분화 상태에 빠지기 때문에2,3 지 속 배양은 곤란하다. 이를 극복하기 위해서는 실험 때마다 매번 간세포를 분리하여 신선한 세포를 사 용하거나 지속 배양이 가능한 간암세포주4를 대신 이용하여야 한다. 그러나 간세포 분리는 번거롭고 비용이 많이 드는 작업이며, 간암세포주를 이용한 연구는 그 결과를 정상 세포에 동일하게 적용하기 는 곤란하다.5 만일 정상 간세포를 장기간 동결보존 (cryopreservation)할 수 있다면, 1회의 간세포 분리 후 동결보존함으로써 필요할 때마다 반복 사용이 가능하기 때문에 이러한 문제점을 극복할 수 있을 것이다. 더구나 사람이나 영장류 등의 간세포는 획 득하기 어렵기 때문에 간세포 기능을 유지할 수 있 는 동결보존법의 개발이 필요한 실정이다.
또한 급성 간부전 환자의 치료를 위한 간세포이 식6,7이나 인공간8이 연구 단계를 넘어 이미 임상에 적용되기 시작하고 있으나, 우리 나라에서는 문화적 배경으로 인하여 공여간(donor liver)을 구하기 어려 울 뿐만 아니라, 공여간을 구한다 하더라도 인공간 을 제작하기 위하여 상당한 시간이 소요되기 때문 에 필요할 때 즉시 사용하기 어렵다는 문제점이 있 다. 일부 보고6에서는 공여간이 있을 때, 미리 간세 포를 분리하여 동결보존함으로써 환자 발생 즉시 치료에 사용할 수 있었다고 하며, 돼지 간세포는 약 6개월까지도 수동법에 의한 동결보존이 가능하다고 하였다.9
본 연구에서는 현재 여건하에서 비교적 간단하게 시행할 수 있는 수동 동결보존법의 간세포 동결보 존 효과를 알아보고자 하였으며, 이 결과를 비교적 고가의 장비가 필요한 컴퓨터 프로그램을 이용한 자동 동결보존법과 비교하기로 하였다.
대상 및 방법
1. 대 상
200 g 내외의 Sprague-Dawley계 수컷 쥐(SLC, Inc., Japan)를 사용하였다.
2. 방 법
1) 간세포 분리 및 일차배양
쥐의 간세포 분리는 Seglen의 방법10을 수정하여 시행하였다.11 분리 세포의 생존율이 90% 미만일 때 에는 Percoll을 이용한 밀도차 분리 방법으로 생존 간세포를 모아, trypan blue 염색법에서 세포 생존율 이 90%이상일 때 실험에 사용하였다.
간세포 배양은 10% 우태아 혈청(fetal calf serum) 및 1% 항생제가 포함된 alpha-minimum essential medium (α-MEM, Gibco-BRL, NY, USA)을 이용하 여, 콜라젠이 표면처리된 6 cm 배양접시(Primaria, Falcon, USA)에 1.2×106개의 세포를 넣어 95% air/
5% CO2의 37℃ 세포배양기에서 배양하였다.12
2) 동결보존액의 조성 및 동결법
동결보존 효과에 미치는 영향 인자로서 DMSO를 포함하는 동결보존액의 첨가 방법, 기저배양액의 종 류 및 혈청 농도 등의 동결보존액의 조성, 보존액 내 포함시키는 세포 농도, 동결 방법(수동 또는 자 동) 등을 분석하였다.
먼저 동결보존액의 종류는 도표 1과 같이 4가지 의 조성으로 하였다. 이와 같이 결정한 이유는 수동 동결보존법에 관한 기존의 보고9에서 수정 Chee배 양액이 우수한 동결보존액으로 작용한다고 하여 일 반 배양액과 비교하기로 하였으며, 우태아혈청의 역 할을 알아보기 위하여 10%, 20%, 90%의 다른 농도 에서 비교하였고, 동결 손상보호제인 dimethyl sul- foxide (DMSO)는 10%가 적정한 것으로 알려져 있 어9,13 한 가지 농도로 통일하였다(Table 1).
수동 동결은 간세포에 동결보존액을 3분 이상 동 안 천천히 첨가한 다음, isopropanol을 포함한 저속 냉각상자에 넣어 -80℃ 냉동기에서 하룻밤 동안 냉 각시킨 다음, 액체질소통으로 옮겨 보존하였다. 자
동석호 외 9인. 간세포 동결법 연구 593
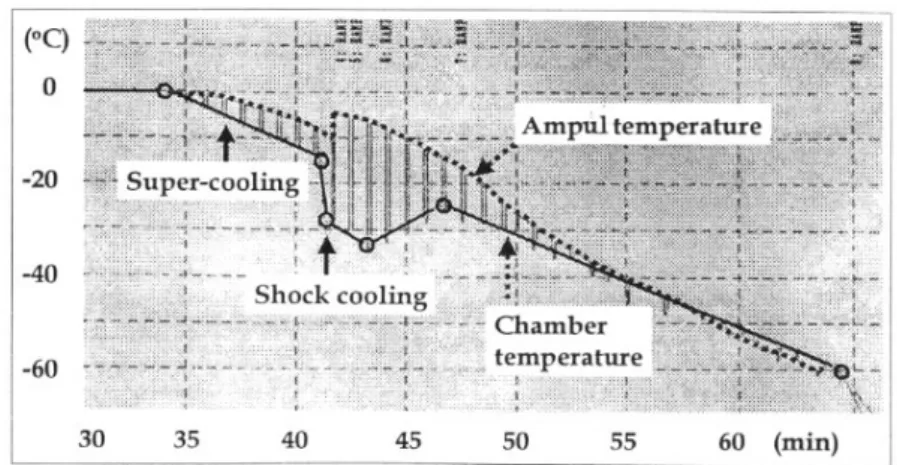
동 동결은 Controlled rate freezing system (Forma Scientific Inc., model 1010, OH, USA)을 이용하였 는데, 본 장비는 냉각기 내의 온도(Fig. 1의 실선)와 검체의 온도(Fig. 1의 점선)를 동시에 감지하여 냉각 온도를 조절한다. 먼저 분당 1℃씩 온도를 내려 보 존 검체가 0℃가 되면 8분 간 기다린 후, 검체가 -8℃
로 냉각될 때까지 분당 2℃씩 저하시켰다(super- cooling). 이어서 냉각기 내 온도가 -28℃로 떨어질 때까지 분당 100℃씩 급속 냉각(shock cooling)시켰 으며, 이어서 분당 2.5℃씩 -33℃까지 더욱 냉각시 킨 후 다시 -28℃로 올리고, 이후 분당 2℃씩 -60℃
까지 하강시켰다(Fig. 1). 마지막으로 분당 1℃씩 -100℃까지 하강시킨 후 액체질소통으로 옮겼다.13 이 모든 과정은 컴퓨터의 프로그램에 의하여 자동
조절되며 결과는 그래프로 산출되었다.
3) 동결 방법에 따른 세포 생존율 및 배양 부착률의 분석
(1) 세포 생존율 및 배양 부착률
세포 생존율은 trypan blue 염색법으로 산출하였 으며, 동결 방법에 따른 보존 효과는 동결시 사용한 생존 간세포 수를 고려하여 상대적 세포 생존율을 산정하여 비교하였다.
배양 부착률은 trypan blue 염색법에 의하여 산출 된 일정 수의 생존 간세포를 24시간 배양하여 부착 시킨 후, 부착된 세포를 trypsin 처리로 떼어내어 그 수를 산정하여 백분율로 계산하였다.
Table 1. Composition of Various Cryopreservation Solutions
Type of solution Basal medium FBS (%) DMSO (%) C1
C2 C3 C4
MCM MCM
- αMEM
10 20 90 20
10 10 10 10
FBS, fetal bovine serum; DMSO, dimethyl sulfoxide; MCM, modified Chee' s medium; α-MEM, alpha minimum essential medium.
Fig. 1. Temperature-time history of computer-controlled freezing program in the critical range (10-60℃). The lower line represents the temperature in the freezing chamber and the upper line is the temperature in the center of the cell suspension in a 2-mL cryo- ampul. Supercooling was interrupted at -14℃, at which temperature a shock cooling was started down to -28℃ measured in the freezing chamber.
594 The Korean Journal of Gastroenterology : Vol. 35, No. 5, 2000
(2) 동결 전 첨가하는 DMSO의 세포 손상에 대한 역할
DMSO의 세포 손상에 대한 역할을 알아보기 위 하여 동결 전 보존액을 세포에 첨가할 때, 10%
DMSO가 포함된 보존액(C2 조성액)을 단번에 첨가 하는 방법과 먼저 4% DMSO 보존액을 첨가하여 얼 음에 5분간 방치한 뒤 이어서 동량의 16% 보존액을 첨가하는 이단계 첨가법의 두 가지를 비교하였다.
이단계 첨가법에 사용한 조성액은 DMSO 농도를 제 외하고는 C2와 동일하였다. 세포 동결 전 보존액 첨 가 후의 시간 경과(1분, 30분, 60분, 120분)에 따른 세포 생존율 및 배양 부착률의 변화를 관찰하였다.
(3) 동결보존액의 조성 및 보존액 내 세포 농도에 따른 차이
동결보존액의 조성에 따른 세포 생존율 및 배양 부착률은 2×106/mL의 세포 농도를 사용하였으며, 수동법으로 한 달간 동결보존하여 해동 즉시 trypan blue 염색법으로 생존율을 산출하고, 즉시 배양하여 세포 부착률도 알아보았다.
또한 동결보존액에 포함되는 세포 농도에 따른 세포 생존율을 알아보기 위하여, 각각 0.5×106/mL, 2×106/mL, 10×106/mL 등의 세 가지 농도를 비교 하였다. 이때 동결보존은 10% DMSO 및 20% 우태 아혈청을 포함하는 일반적인 동결보존액(C2)을 이 용하여 수동법 및 자동법으로 동결하였다. 한 달간 의 동결보존 후, 세포 생존율 및 배양 부착률을 산 정하였다.
(4) 자동 동결 방법에 따른 차이 및 Percoll density purification의 효과
자동법에 의한 동결보존 효과는 C2 보존액 및 2
×106/mL 세포 농도를 이용하여 알아보았다. 자동 동결 방법은 상기에 기술한 프로그램을 이용하였으 며, 자동법으로 동결되었던 간세포를 해동한 후 세 포 생존율을 향상시키기 위하여 Percoll density purification의 효과를 알아보았다.
방법을 간략히 언급하면, 먼저 Percoll (Sigma Chemical Co., St. Louis, MO, USA)을 10x Hank' s
buffer (Sigma)와 1:10으로 섞은 다음, 세척액에 포 함된 4×106/mL의 농도의 분리 간세포와 1:1로 혼 합하여 50 g에서 10분간 원심분리한 후, 상부 세포 층을 조심스럽게 걷어 버리고 침전된 생존 간세포 만을 취하였다. 이를 1×HBSS (Hanks buffered salt solution)로 2회 세척하고 기저배양액으로 1회 세척 한 다음, 세포 생존율 및 배양 부착률을 산정하였다.
4) 통 계
모든 수치는 3회의 동일 실험으로부터 평균±표 준편차를 구하여 표기하였으며, 통계는 Student t- test를 이용하였고, p값 0.05 미만을 유의수준으로 하였다.
결 과
1. 동결 전 첨가하는 DM S O의 첨가 방법에 따른 세포 생존율 및 부착률
DMSO 첨가 전의 기저 세포 생존율은 91.0±
1.0%였다. 10% DMSO를 한 번에 즉시 첨가한 경우 의 세포 생존율은 73.3±2.1%, 이단계의 점진적인 첨가를 하였을 때에는 82.7±2.5%로 두 가지 모두 기저 생존율에 비하여 저하되었지만 이단계 첨가법 이 일단계 첨가법에 비하여 약 10%의 세포 생존율 향상을 보였다(p=0.008). 따라서 DMSO에 의한 세 포 손상을 피할 수는 없으나 낮은 농도에서 높은 농 도로 점진적 첨가를 함으로써 세포 손상을 줄일 수 있었다(Table 2).
동결보존액을 첨가한 후의 시간 경과에 따른 변 화를 보면, 일단계 첨가법에서는 약 한 시간이 지나 면서 세포 생존율이 60.3±8.3%로 감소하는 경향을 보였으며(p=0.059), 이단계 첨가법의 경우에는 세포 생존율의 변화 없이 두 시간까지도 80% 이상을 유 지하고 있었다.
세포 부착률에 있어서는 생존한 세포를 기준으로 하였을 때, 모두 80% 이상을 보여 차이는 없었다.
2. 동결보존액의 조성에 따른 수동 동결법에서의 세포 생존율 및 부착률
수동법으로 한 달간 동결보존한 간세포의 동결보
Dong, et al. Cryopreservation of Primary Hepatocytes 595
존액 조성에 따른 세포 생존율은 기저배양액의 종 류에 따라 차이는 없었으나 변형 Chee배양액을 사 용한 경우(C1, C2)에 α-MEM을 사용한 경우(C4)보 다 수치상으로 우세하였다. 우태아혈청만 사용한 경 우(C3)는 α-MEM을 사용한 경우(C4)보다 생존율이 유의하게 증가되었으나(p=0.023), 변형 Chee배양액 을 사용한 경우(C1, C2)와는 차이가 없는 것으로 확 인되었다(Table 3).
그러나 동결보존하였던 세포를 해동하여 배양을 하였을 때 4가지 조성액 모두에서 세포 생존율이 60% 내외임에도 불구하고 배양 부착률은 1% 미만 에 불과하여, 생존율 결과와는 많은 차이를 보였다 (Table 3, Fig. 2).
3. 동결보존액 내의 세포 농도에 따른 세포 생존율 및 부착률
세포 농도에 따른 동결보존의 차이는 상기의 결 과에서 동결보존액에 따른 차이가 거의 없었기 때
문에 C2 조성액만을 이용하여 수동 및 자동 동결법 에서 알아보았다. 한 달간 동결보존하여 해빙한 후 의 세포 생존율은 전반적으로 자동 동결법이 우수 하였으며, 특히 10×106/mL의 높은 세포 농도에서 는 수동 동결법의 20% 내외의 생존율에 비하여 자 동 동결법은 65% 내외의 생존율을 보여 월등한 차 이를 보였다(p=0.002, Table 4). 자동 동결법에서, 세 포 농도가 너무 낮거나 높은 경우 생존율은 65% 내 외로 2×106/mL 농도의 80%에 비하여 낮았다(Table 4, p=0.005).
세포 부착률에 있어서는 수동법에 의한 경우 세 포 농도에 관계없이 모두 1% 미만이었으며, 자동법 의 경우에 0.1×106/mL의 농도에서는 세포 수가 너 무 적어 부착률을 구할 수 없었으나, 2×106/mL 및 10×106/mL에서는 50%를 상회하는 부착률을 얻을 수 있었다(Table 5, Fig. 2).
Table 3. Hepatocyte Viability and Culture Attachment Rate according to the Composition of the Cryopreservation Solution in Manual Freezing Method
Type of cryoprotectant Hepatocyte viability (%) Culture attachment rate (%) C1
C2 C3 C4
58.6±4.2 56.7±7.9 62.6±2.0 48.0±6.7
<1%
<1%
<1%
<1%
Table 2. Hepatocyte Viability according to the Method of the Cryoprotectant Addition
Time* (min)
Hepatocyte viability (%)
p-value One-step Gradual
0 1 30 60 120
91.0±1.0 73.3±2.1 69.0±5.3 60.3±8.3 61.7±6.5
91.0±1.0 82.7±2.5 82.7±3.1 83.0±3.6 84.0±4.0
NS 0.008 0.018 0.012 0.007
* elapse time after the addition of the cryoprotectant.
NS, not significant.
One-step addition means that cryoprotectant containing 10% DMSO was directly added to the isolated hepatocytes, and gradual addition means that cryoprotectant containing 4% DMSO and the same volume of 16% cryoprotectant were added sequentially.
596 대한소화기학회지 : 제 35 권 제 5 호 2000
4. 자동 동결법에서 P er coll den s it y pur if i- ca t ion 효과
자동 동결법에서 세포 생존율 및 배양 부착률은
각각 77.8±1.7%, 50.6±6.1%였으며, Percoll density purification에 의한 해동 간세포의 생존율은 시행 전 후로 80% 내외로 차이가 없었지만 배양 부착률은 50%에서 75%까지 향상시킬 수 있었다(Fig. 3).
Table 5. The Culture Attachment Rate according to the Cell Concentration
Cell concentration
Cuture attachment rate (%)
p-value Manual freezing Computer-programmable
0.1×106/mL 2×106/mL 10×106/mL
N.D.
0.5±0.1 0.3±0.1
N.D.
50.6±6.1 54.3±5.2
-
<0.001
<0.001 N.D., the assay could not be done because of the small number of cells.
Table 4. Hepatocyte Viability according to the Cell Concentration
Cell concetration
Hepatocyte viability (%)
p-value Manual freezing Computer-programmable
0.1×106/mL 2×106/mL 10×106/mL
63.9±7.4 54.7±3.1 21.2±5.6
67.5±4.3 77.8±1.7 65.9±2.1
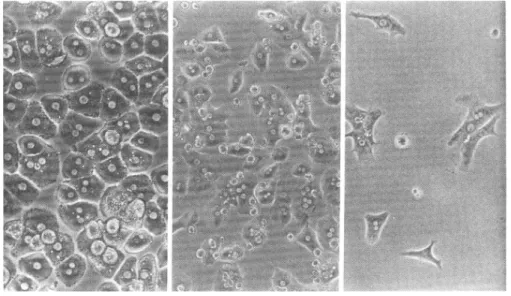
0.0051 0.0018 0.002 Fig. 2. The culture plating efficiency of hepatocytes. Pictures show the attachment state of primary hepatocytes on collagen coated dish after 24 hours of culture (the left panel, phase contrast microscope, ×200), cryopreserved hepatocytes that were frozen for 1 month using the computure- controlled freezing program (the center panel, ×100), and the manual freezing method (the right panel, ×100).
동석호 외 9인. 간세포 동결법 연구 597
고 찰
세포 동결시 사용하는 동결손상보호제는 빙점을 낮추어 세포로부터 탈수 시간을 연장시킴으로써 얼 음 결정체에 의한 세포 손상을 줄이는 역할을 한다.
동결손상보호제로는 DMSO, polyvinylpyrrolidone, glycerol 또는 dextran 등이 사용되는데, DMSO가 다 른 종류보다 좋은 결과를 보였다는 보고들14-16이 많 다. 농도는 10-20% 범위에서 사용되고 있지만,14,17,18 10%가 통상적으로 이용되고 있다.13,18 따라서 본 연 구에서는 10% DMSO를 사용하여 동결보존 효과를 관찰하였다. 그러나 DMSO는 삼투성이 있어서 10%
DMSO를 포함하는 보존액의 삼투압은 정상의 5배 이상이 되는 것으로 알려져 있다.13 그러므로 DMSO 는 동결손상 보호 효과도 있지만 그 자체에 의한 세 포 손상도 피할 수 없다. 본 연구에서는 DMSO에 의한 세포 손상을 줄이기 위하여 혼합시 먼저 저농 도의 보존액을 첨가하고 이어서 고농도액을 추가하 는 이단계 첨가법을 이용한 결과, 보존액을 단번에 직접 첨가한 경우보다 약 10% 이상의 세포 생존율 향상 효과를 거둘 수 있었다. 이는 저농도에서 세포
를 적응시킨 다음, 고농도에 노출시킴으로써 삼투압 변화에 대한 세포의 적응성을 향상시키기 때문인 것으로 추정된다. 따라서 해동시에도 이러한 논리를 적용한다면, 먼저 적은 양의 세척액으로 삼투압 변 화를 적게 하여 적응시킨 다음, 많은 양의 세척액으 로 DMSO를 완전히 제거하는 방법이 좋을 것으로 생각된다.19 물론 좀더 저농도부터 여러 차례에 걸쳐 첨가하거나 제거하는 방법이 더 효과적일 가능성이 있지만, 작업 효율을 고려할 때 이단계 첨가나 제거 가 적당할 것으로 생각된다. 아울러 본 연구에서는 보존액의 이단계 첨가 후 2시간까지도 세포 생존율 이 유지되는 것으로 보아 일단 간세포를 분리하여 보존액을 첨가한 후에는 시간적인 여유를 갖고 작 업하여도 무리가 없음을 알 수 있었다.
대부분의 실험실에서는 세포주를 동결할 때 수동 법을 사용하고 있다. 즉 세포를 거둔 다음, 보존액에 혼합하여 동결보존용 앰플에 넣고 스티로폼 박스 또는 isopropanol 냉각상자에 넣어 -70℃ 냉동기에 보관함으로써 -1℃/min의 속도로 냉각시키게 된다.
이를 수시간이 지난 후 액체질소통에 넣어 보관하 게 되는데, 일반 세포주는 이러한 방법을 사용하여 도 세포 손상이 그리 심하지 않다. 일부 보고9에서 는 DMSO, polyethyene glycol과 혈청을 Chee' s modified Eagle' s culture media에 혼합하여 동결보 존하면 약 75%에 가까운 세포 생존율을 얻을 수 있 었고, 6개월간의 동결보존 후에도 간세포 기능이 유 지된다고 하였다. 그러나 본 연구에서는 동일 기저 배양액과 DMSO 및 혈청을 포함시킨 유사한 방법 으로 동결하였을 때 생존율은 65% 정도 얻을 수 있 었지만 배양 부착률은 1%에도 못 미침으로써 상기 의 보고와 상이한 결과를 얻었다. 또한 기저배양액 을 다른 종류로 사용하여도 유사한 결과를 얻어 기 저배양액의 종류는 간세포 동결보존에 크게 중요하 지 않은 인자로 생각되었다. 또한 기저배양액을 사 용하지 않고 DMSO와 우태아혈청만을 사용한 경우 에도 유사한 결과를 보였다.
이러한 차이는 생존율을 판단하는 방법의 차이에 의한 결과로 생각된다. 일반적으로 세포 생존율을 관찰하기 위하여 trypan blue 염색법이 많이 사용되 고 있는데, 이 방법은 세포의 형질막의 보전 여부를 Fig. 3. The effect of Percoll density purification after
thawing cryopreserved hepatocytes on cell viability and the culture attachment rate. Percoll density purification could improve the culture plating efficiency about 25%, that is, from 50% up to 75%, without the change of cell viability. Shaded bar, cell viability; black bar, the culture attachment rate.
598 The Korean Journal of Gastroenterology : Vol. 35, No. 5, 2000
판단하게 된다. 그러나 본 연구 결과에 의하면 이 방법으로 60% 이상의 생존율을 보여도 배양에 사용 할 때 세포가 배양접시에 부착되지 않아, 상기 방법 에 의한 세포 생존율의 관찰은 부정확할 것으로 생 각되었다. 즉 trypan blue 염색법은 관찰 시간에 따 라 상당한 차이를 보일 수 있어 다소 주관적인데, 염색 즉시 관찰하면 세포 생존율이 과장될 수 있고 너무 늦게 관찰하면 생존율이 과소평가될 수 있다.
이 방법은 간세포를 분리한 즉시 적용할 경우에는 배양 부착률과 유사하게 일치하여, 생존 세포 수대 로 배양할 경우 대부분 부착된다. 그러나 본 연구 결과, 이 방법은 동결 간세포에 그대로 적용하기 곤 란한 것으로 판명되었다. 추정하건대 trypan blue 염 색법으로 염색되지 않는 세포도 회복하기 힘들 정 도로 생물학적 손상을 받아 배양시에도 부착되지 않는 것으로 생각된다. 이에 대해서는 추가 연구가 필요할 것으로 생각된다.
세포 동결보존시 동결 속도는 생존율에 중요한 영향을 미치게 된다. 액체질소통에 바로 집어 넣는 고속동결은 거의 생존을 기대하기 힘들며, 컴퓨터 프로그램을 이용한 자동 동결법에서도 고속보다는 저속(-2℃/min)동결이 비교적 좋은 효과를 보인다고 하였다.13 동결시 세포를 포함하는 보존액의 온도 변 화는 이를 냉각시키는 냉각기 내의 온도 변화와 차 이가 있다. 즉 냉각기의 온도를 일정 속도로 강하시 키면 세포를 포함한 동결보존액에서는 융합열이 발 생하게 되어 세포 손상이 일어난다(방법의 그림 참 조). 수동 동결법으로는 이러한 융합열의 발생을 외 부에서 조절할 수 없기 때문에 세포 손상은 불가피 한 것으로 생각된다. 그러나 컴퓨터 프로그램을 이 용한 자동법의 경우에는 냉각기의 온도 조절 외에 도 동결보존액 내 온도 변화를 감지하여 융합열이 발생하기 직전에 고속충격냉각(shock cooling)을 시 행함으로써 융합열을 줄일 수 있다. 본 연구에서도 이러한 고속충격냉각을 이용함으로써 동결 간세포 의 생존율은 약 80%까지, 배양 부착률은 약 50%까 지 향상시킬 수 있었다. 한편 Percoll density centrifugation을 이용하면 배양 부착률을 75%까지 향상되었으나, 단점으로는 일부 생존 세포까지 제거 되기 때문에 수적인 손실을 감수하여야 한다는 점
이다.
결론적으로 정상 간세포는 적정한 컴퓨터 프로그 램을 이용한 자동 동결법과 Percoll density purifi- cation을 이용함으로써 장기간 동결보존이 가능하였 다. 그러나 생존율을 좀더 향상시킬 수 있는 적정 프로그램의 개발이 지속적으로 이루어져야 하겠고, 세포 생존율의 향상이 간세포 기능 유지를 의미하 는지에 대하여는 추가 연구가 필요할 것으로 생각 한다.
요 약
목적: 정상 간세포를 동결보존하여 반복 사용할 수 있는 방법을 개발하고자, 현재 여건하에서 간단 히 시행할 수 있는 수동 동결법의 간세포 보존 효과 를 알아보고, 이를 고가의 장비가 필요한 컴퓨터 프 로그램을 이용한 자동 동결보존법과 비교하였다. 대 상 및 방법: 200 g 내외의 쥐에서 collagense 문맥관 류법으로 간세포를 분리하였으며, 생존율 90% 이상 인 경우에 본 연구에 사용하였다. 수동법은 현재 사 용하는 일반적인 방법으로, 자동 동결법은 융합열을 최소화하는 방법으로 시행하였다. 동결보존액의 조 성은 기저액으로 변형 Chee 배양액과 α-MEM을, 혈청은 10%, 20%, 90%를 비교하였으며, 동결손상 보호제인 DMSO는 10%를 사용하였다. 먼저 DMSO 가 포함된 보존액의 일단계(10%) 및 이단계(4→
16%) 첨가법의 차이와, 보존액의 조성, 보존액 내 포함되는 세포 농도 및 동결 방법 등에 따른 영향을 동결 한 달 후의 세포 생존율과 배양 부착률로 비교 하였으며, Percoll density purification의 효과도 알아 보았다. 결과: DMSO가 포함된 보존액을 이단계(4
→16%)로 첨가할 경우 세포 생존율은 82.7±2.5%로 단번에 첨가하는 경우의 73.3±2.1%보다 우수하였 다(p=0.008). 수동 동결에서 보존액 조성(기저액 및 혈청 농도의 차이)에 따른 차이는 거의 없었으며, 세포 생존율은 60% 내외, 배양 부착률은 1% 미만 에 불과하여 보존 효과가 거의 없었다. 자동법을 이 용한 동결보존에서 2×106/mL의 세포 농도를 사용 할 경우 세포 생존율은 77.8±1.7%로서 너무 낮거 나 높은 세포 농도 경우에 비하여 우수하였으며(p=
Dong, et al. Cryopreservation of Primary Hepatocytes 599
0.005), 배양 부착률은 모두 50%를 상회하였다. 동 결 간세포를 해동한 후 Percoll density purification을 시행하였을 때 배양 부착률은 50%에서 75%까지 향 상되었다. 결론: 수동법에 의한 간세포 동결은 어떠 한 보존액을 사용하더라도 거의 보존 효과를 기대 할 수 없었으나, 자동법의 경우는 적당 조건(DMSO 이단계 첨가, 10-20% 우태아 혈청, 2×106/mL 세포 농도, 융합열을 최소화하는 -2℃/min 저속동결)에서 동결한 후, Percoll density purification을 시행함으로 써 비교적 우수한 동결보존 효과를 얻을 수 있었다.
색인단어: 정상 간세포, 동결보존, Computer-pro- grammable freezing
참 고 문 헌
1. Bissell DM, Hammaker LE, Meyer UA. Paren- chymal cells from adult liver in nonproliferating monolayer culture. J Cell Biol 1973;59:722-734.
2. Clayton DF, Darnell JE Jr. Changes in liver- specific compared to common gene transcription during primary culture of mouse hepatocytes. Mol Cell Biol 1983;3:1552-1561.
3. Guguen-Guillouzo C, Guillouzo A. Modulation of functional activities in cultured rat hepatocytes. Mol Cell Biochem 1983;53/54:35-56.
4. Brown PC, Papaconstantinou J. Coordinated modulation of albumin synthesis and mRNA levels in cultured hepatoma cells by hydrocortisone and cyclic AMP analogs. J Biol Chem 1979;254:9379- 9384.
5. Clayton DF, Weiss M, Darnell JE Jr. Liver-specific RNA metabolism in hepatoma cells: variations in transcription rates and mRNA levels. Mol Cell Biol 1985;5:2633-2641.
6. Bilir BM, Durham JD, Kumpe DA, et al. Critical analysis of intra-splenic transplantation of cryopre- served human hepatocytes in a patient with acute liver failure. Hepatology 1995;22:203A.
7. Kim BH, Roy-Chowdhury N, Roy-Chowdhury J.
The future of hepatocyte transplantation. Transplan-
tology 1994;5:123-128.
8. Demetriou AA, Rozga J, Podesta L, et al. Early clinical experience with a hybrid bioartificial liver.
Scand J Gastroenterol 1995;30:111-117.
9. Naik S, Santangini HA, Trenkler DM, et al. Func- tional recovery of porcine hepatocytes after hypo- thermic or cryogenic preservation for liver support systems. Cell Transplant 1997;6:447-454.
10. Seglen PO. Preparation of rat liver cells. III.
Enzymatic requirements for tissue dispersion. Exp Cell Res 1973;82;391-398.
11. 김병호, 박재경, 김영일 등. 동계쥐의 비장내 이식된 온도조건부 불멸화 간세포의 생존기간. 대한간학회지 1997;3:142-153.
12. Waxman DJ, Morrissey JJ, Naik S, Jauregui HO.
Phenobarbital induction of cytochromes p450.
Biochem J 1990;271:113-119.
13. Diener B, Utesch D, Beer N, Dürk H, Oesch F. A method for the cryopreservation of liver paren- chymal cells for studies of xenobiotics. Cryobiology 1993;30:116-127.
14. Chesene C, Guillouzo A. Cryopreservation of iso- lated rat hepatocytes: a critical evaluation of freezing and thawing conditions. Cryobiology 1988;
25:323-330.
15. Loretz LJ, Wilson AGE, Li PA. Promutagen activa- tion by freshly isolated and cryopreserved rat hepa- tocytes. Environ Mol Mutagen 1988;12:335-341.
16. Novicki DL, Irons GP, Strom SC, Jirtle R, Micha- lopoulos G. Cryopreservation of isolated rat hepatocytes. In Vitro 1982;18:393-398.
17. Coundouris J, Hannah C, Grant H, Hawksworth G.
Cryopreservation of isolated rat hepatocytes. Bio- chem Soc Trans 1986;692-693.
18. Powis G, Santone KS, Melder DC, Thomas L, Moore DJ, Wilke TJ. Cryopreservation of rat and dog hepatocytes for studies fo xenobiotic metabo- lism and activation. Drug Metab Dispos 1987;15:
826-832.
19. Levin RL, Miller TW. An optimum method for the introductionor removal of permeable cryoprotec- tants: isolated cells. Cryobiology 1981;18:32-48.