섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 1 / 21 BRIC View 2019-T02
섹스 중독 및 사정 후 허탈감에 관련된
신경생리 메커니즘 연구 동향
김 주 현
Johns Hopkins University School of Medicine E-mail: juhyun.kim@jhmi.edu 요약문 섹스 중독은 조절하기 어려울 정도의 강한 성적 충동이 장기간 반복적으로 나타나는 증세를 의미하며, 개인적으로는 정서 및 신체를 병들게 하고, 사회적으로는 가정 문제 및 성범죄를 유발할 수도 있는 심각한 정신의학적 질병이다. 이러한 심각성에도 불구하고, 마약 및 알코올과 같은 약물 중독에 비해 섹스 중독은 아직 많은 연구가 이루어지지 않았으며, 그 기저 원리에 대한 이해 및 치료 재활 방안이 부족한 실정이다. 과도한 성적 욕구는 성행위에 대한 탐닉으로 섹스 중독을 초래하기도 하지만, 성적 욕구 자체는 종족 유지를 가능하게하는 생물학적 본능이며, 이러한 성적 본능을 시의적절하게 조절하기 위한 내재적 메커니즘으로서 사정 후 허탈감을 유도하는 post-ejaculatory refractory period가 자연적으로 존재한다. 이 동향 리포트에서는 섹스 중독이 어떤 신경생리 메커니즘을 통해 형성되는지, 그리고 우리 뇌 속에 자연적으로 존재하는 성적 욕구 억제 메커니즘이 어떻게 작동하는지에 대한 최신 연구 결과들을 살펴보고자 한다.
Key Words: 섹스 중독, 사정 후 허탈감, sex addiction, hypersexual disorder, sexual behavior, synaptic circuitry, post-ejaculatory refractory period, post-ejaculatory dysphoria
목 차
1. 서론 2. 본론 2.1 섹스 중독이란 무엇인가? 2.2 남성의 성행위에 관련된 신경생리 메커니즘 2.3 섹스 중독과 관련된 뇌 내 신경생리학적 변화 BRIC View 동향리포트섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 2 / 21 2.4 사정 후 허탈감이란 무엇인가? 2.5 사정 후 허탈감을 유도하는 신경생리 메커니즘 3. 결론 4. 참고문헌
1. 서론
최근 들어 우리 사회의 많은 유명 정치인, 경제인, 사회각계의 저명인사들이 부적절한, 또는 불법적인 성 문제로 인해 개인적으로 망신을 당하거나 또는 각자의 전문 분야에서 퇴출되는 사례들을 우리들은 자주 목도하고 있다. 굳이 이런 유명인들의 예를 들지 않아도 우리는 통제하기 어려운 성욕 때문에 청소년기 때부터 과도한 자위행위, 이성에 대한 집착, 부도덕하거나 불법적인 성행위에 대한 충동 및 유혹 등등에 시달리며 돈과 시간과 에너지를 낭비하는 경우들을 직간접적으로 경험한다. 성욕은 식욕, 수면욕과 더불어 인간의 3대 욕구로 알려져 있다. 먹지 않거나 자지 않으면 죽지만, 섹스를 못한다고 죽지는 않는다. 그래서 성욕은 식욕이나 수면욕에 비해 중요도가 떨어지는 욕구로 생각되기도 하지만, 막상 성욕이 솟구칠 때는 먹고 자는 것마저 잊어버리고 탐닉하게 되는 것이 현실이라, 어쩌면 인간이 지닌 기본 욕구 중 가장 강력한 욕구라 할 수도 있을 것이다. 또한 즐기기 위해서는 최소한의 금전이 필요한 마약, 알코올 등의 약물 중독, 특정 시설이나 장비가 필요한 도박, 게임, 인터넷 중독에 비해 섹스 중독은 가진 것이 없어도, 아무런 준비 없이도 자신의 몸만 있으면 즐길 수 있기 때문에 어찌 보면 진입장벽이 가장 낮은 중독이라 할 수 있을 것이다. 섹스 중독은 미국 정신의학 협회에서 출판하는 정신질환 진단 및 통계 편람(Diagnostic and Statistical Manual of Mental Disorders, DSM) 상의 정신질환으로 아직 정식 등재되지는 않았지만, 현재 의학계에서는 섹스 중독이 다른 마약 및 알코올 중독과 유사한 중독 메커니즘을 보이고, 이미 현존하는 문제이기 때문에, 정신 질환으로 인정된 다른 중독들과 같은 범주로 다루어야 한다는 의견을 가지고 있다 [1-4]. 실제로 우리 사회에서는 강박적 자위행위같은 개인적 섹스 중독에서부터 충동적, 계획적 성범죄와 같은 범법행위에까지 다양한 범주의 섹스 중독 문제들이 존재하고 있으며, 이들 섹스 중독자들을 위한 재활 프로그램까지 실제로 운영되고 있는 상황이다. 심각한 사회문제 중 하나로 인식되고 있는 섹스 중독의 기저 원리를 이해하기 위한 연구는 아직 초보적인 수준이지만, 설치류 동물 모델들을 이용한 최근의 생물학적 연구들은 섹스 중독과정에서 특정 뇌부위, 특정 뇌세포 집단에서 어떤 생화학적, 분자생물학적 변화들이 나타나는지에 대한 몇가지 단서들을 보여주고 있다. 과도한 성적 욕구의 지속적이고 반복적인 충동으로 인해 섹스 중독이 형성된다면, 이러한 성적 욕구를 억제하는 방법이 섹스 중독 치료의 가장 효과적인 방법이 될 것이다. 심리 상담 및 취미 활동 개발과 같은 다양한 재활 방법들이 제시되고 있지만 아직 그 실제적 치료 효과는 의문적이다. 인위적으로 성욕을 억제하는 방법 중 현재 가장 강력한 처방은 ‘화학적 거세’로 알려져 있는 남성호르몬 억제제 투여 방법이다. 하지만 이러한 호르몬 요법은 생체 내의 호르몬 체계를섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 3 / 21 교란시켜서 내분비계 부작용을 초래하고, 여성호르몬 수치를 상대적으로 증가시켜 몸의 여성화를 유도한다. 이러한 생물학적 문제뿐만 아니라 투여된 호르몬 제재는 한시적으로만 효력을 나타내기 때문에 지속적으로 반복 투여해야하는 기술적인 문제도 있다. 흥미로운 점은 인간이 약물과 같은 인위적인 방법으로 성욕을 낮추기 위해 노력하기 이전부터, 이미 자연계에는 (정확히 말하자면, 남성의 뇌에는) 성욕을 억제시키기 위한 내재적 메커니즘이 존재하고 있다는 것이다. 수컷들의 성행위는 대부분 사정(ejaculation)으로 끝나는데, 사정 직후 일정 기간 동안 성욕이 급격히 저하되며 발기 불능 상태가 된다. 이를 post-ejaculatory refractory period (PERT)라고 하며, 이 기간 동안의 성욕 억제를 post-ejaculatory depression (또는 inhibition, dysphoria) 등으로 표현한다. 일반적으로 ‘사정 후 허탈감’으로 알려져 있고 인터넷 용어로는 ‘현자(賢者) 타임’으로 불리기도 한다.
PERT는 거의 모든 포유류 종 수컷에서 공통적으로 발견되는 현상이며, 아주 오래전부터 사람들이 관심을 가져왔던 사항이기도 하다. 고대 그리스의 의사였던 클라우디우스 갈레노스(Claudius Galenus, 129-199)는 이를 “Every animal is sad after coitus (섹스가 끝나면 모든 동물은 슬프다)” 라고 표현했으며, 영어권에서는 Post-coital tristesse (PCT, 성교 후 우울감, 또는 post-ejaculatory dysphoria), 프랑스에서는 ‘la petit mort (the little death, 짧은 죽음)’으로 표현하기도 한다 [5]. 종을 막론하고 공통적으로 발견되는 이 PERT 기간 동안 어떤 신경생리학적 메커니즘을 통해 성욕의 급격한 저하가 이루어지는지에 대해서는 아직 연구가 많이 부족하다. PERT를 유도하는 신경생리학적 메커니즘에 대해 몇가지 가설들이 현재 제시되고 있으며, 이들 가설들을 확인해보기 위한 인간 및 동물에서의 연구 사례들이 있다. 본론에서는 상기에 언급한 섹스 중독의 정의 및 증상, 그리고 개인 및 사회에 미치는 영향에 대해 연구한 사례들, 섹스 중독을 유발하는 신경생리학적 변성에 대한 최근의 생물학 연구 사례들, 그리고 사정 후 허탈감의 기저 원리에 대한 여러가지 가설 및 연구 사례들을 소개하고자 한다.
2. 본론
2.1 섹스 중독이란 무엇인가?
‘중독’을 정의하는 일반적인 두가지 기준은 내성(tolerance)과 금단 증상(withdrawal)이다 [6, 7]. 하면 할수록 더 많이 (또는 더 강하게) 하고 싶어지고, 한동안 안하게(또는 못하게) 될 경우 초조하고 불안해지다가 신경질적으로 변하게 된다. 마약 및 알코올과 같은 약물 중독, 게임이나 도박과 같은 특정 행동 중독과 마찬가지로 섹스 중독 또한 이러한 중독의 전형적인 증세들을 보인다 [3, 8, 9]. 다른 형태의 중독들과 마찬가지로, 섹스(삽입 성교를 포함한 모든 종류의 성적 행위) 역시 하면 할수록 쾌감에 대한 내성이 생겨 횟수가 거듭될수록 초기만큼의 설레임과 흥분, 쾌감을 얻기가 힘들어진다. 처음에 느꼈던, 또는 더 높은 강도의 쾌감을 얻고자 하는 사람들의 욕망은 인간 특유의 창의성을 이용하여 갖가지 기상천외한 섹스 방법들을 고안해내기도 한다. 이러한 욕망이 극단으로 치닫다 보면, 목을 조르는 방법을 통해 뇌로 가는 산소의 농도를 줄여 성적 쾌감을 높이는 방법을 쓰려다 실수로 사람을 죽이는 erotic asphyxiation(섹스 중 교살)과 같은 웃기고도 슬픈 해프닝이 생기기도 한다 [10]. 성행위를 오랫동안 하지 못하는 경우, 금단 증상으로 인해 성적섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 4 / 21 긴장과 충동이 고조된다. 자위 행위 또는 섹스를 오랫동안 하지 못하면 초조해지면서 욕구불만 상태가 되는데, 이는 성범죄를 저질러 복역했던 전과자들이 출소 이후에도 높은 재범율을 보이는 사례들에서 그 금단 증상의 심각성을 확인할 수 있다 (성범죄의 경우, 최초 범죄의 유형, 출소 후 관찰기간, 재범시의 성범죄 유형 등의 조사 방법에 따라 조금씩 다른 결과를 보이지만, 일반적으로 10-50%의 높은 재범율을 보이는 것으로 알려져 있다 [11-13]).
섹스 중독은 영어로는 sex addiction 또는 sexual addiction으로 표기되며, 우리말로는 섹스 중독 또는 성 중독으로 불리운다. 이 리포트에서는 좀 더 직관적인 느낌을 주는 섹스 중독이라는 단어를 쓰고 있지만, 여기서 섹스는 단지 파트너와의 삽입 성교 행위를 가리키는 지엽적 의미가 아니라 자위 행위, 포르노 시청, 관음증, 노출증, 매춘 등 광범위한 스펙트럼에 속하는 모든 성적 행위를 포괄하는 개념이다. 섹스 중독은 sexual dependency(섹스 의존증), sexual compulsivity(성 충동장애), hypersexuality(이상 성욕) 등의 여러가지 조금씩 다른 이름으로 불리기도 하는데, 이들 모두의 공통점은 섹스와 관련된 충동이나 욕구가 중독자의 일상 생활을 지배할 정도로 강력하게 나타난다는 것이다. 섹스 중독자의 경우, 성적 충동 해소가 삶의 다른 가치들보다 항상 우선 순위에 있으며, 자신들의 성적 욕구 충족을 위해 자신의 건강을 해치거나 직장과 같은 사회 활동에서의 부적응, 또는 사회 법리에 위배되는 행동까지도 불사하는 경향을 보인다 [2]. 앞서 언급했듯이 섹스 중독은 현재 최신판 정신질환 진단 및 통계 편람인 DSM-5에서 정식 등재되어 있지 않다. DSM-5 최신판 개정 시에 섹스 중독을 addictive disorder의 한 종류로 정식 등재하기 위한 논의가 있었지만, 그 진단을 위한 실증적 증거를 확보하는 것이 기술적으로 어렵다는 이유로 최종적으로는 배제되었다. DSM 개정 시에 ‘hypersexual disorder’라는 항목으로 섹스 중독을 정의해보려는 논의도 있었는데, 아래의 표는 DSM-5에서 논의가 되었던 hypersexual disorder의 판단 기준을 보여준다 [1, 4]. 표 1. DSM-5에서 제안한 hypersexual disorder의 판단 기준 A. 최소 지난 6개월 동안, 반복적이면서도 강력한 성적 환상, 충동, 행위 때문에 아래 5가지 증세 중 4가지 이상의 증세가 계속되는 경우. 1. 성적 환상, 충동, 그리고 성행위를 생각하거나 실행하는데 일상 생활에서 지나치게 많은 시간을 소모하는 경우. 2. 우울하거나 불안, 또는 지루한 기분 상태가 되면 성적 환상, 충동, 행위에 반복적으로 빠져드는 경우. 3. 일상생활에서 스트레스를 받을 때 반복적으로 성적 환상, 충동, 행위에 빠져드는 경우. 4. 성적 환상, 충동, 행위를 줄여보기 위해 노력하지만 계속적으로 실패하는 경우. 5. 자신이나 타인의 건강, 정서에 좋지 않은 영향을 줄 것을 아는데도 불구하고 계속적으로 성적 환상, 충동, 행위에 빠져드는 경우. B. 이러한 성적 환상, 충동, 행위의 반복으로 인해 의학적으로 심각한 문제가 발생하거나, 사회 활동, 직업 활동에 심각한 지장을 초래하는 경우. C. 이러한 성적 환상, 충동, 행위들이 특정 외부 요인 (마약이나 의약품 등 특정 외부 물질이나 기타 다른 종류의 의학적 문제)에 기인한 것이 아닌 경우. D. 18세 이상의 성인일 것. (여기서 언급하는 성적 행위는 자위행위, 포르노 시청, 타인과의 직접 섹스, 사이버 섹스, 폰섹스, 스트립 클럽 등의 다양한 범주의 모든 성적 활동을 포괄하는 개념임)
섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 5 / 21 이러한 기준에 근거하여, 섹스 중독은 일반적으로 “성적 환상이나 각성, 충동의 빈도와 강도가 증가되고, 이에 따라 자신에게 이롭지 않은 결과를 가져오는데도 불구하고 성적 충동을 억제하지 못하여 특정 성행위에 집착하는 상태”로 정의된다 [14]. 섹스 중독은 강박적 자위행위, 야동 중독, 폰섹스 및 매춘 등의 여러가지 다양한 모습으로 나타날 수 있기 때문에 사회적 발생 빈도를 정확하게 조사하는데는 기술적인 어려움이 있다. 다양한 질문 방식의 여러 설문 조사 결과들을 종합적으로 고려해보면 전체 성인 인구의 2-18%에 해당하는 사람들이 섹스 중독의 특성을 보이는 것으로 추정된다 [15-18]. 이는 마약중독이나 알코올 중독, 도박 중독 등에 비해 월등히 더 높은 수치이며, 섹스 중독은 중독자 개인의 돈, 시간, 에너지의 낭비뿐 아니라, 원하지 않는 임신, 부부간의 성생활 갈등 같은 가정적 문제부터 성병이나 성범죄와 같은 사회적 비행까지 다양한 범주의 문제들을 일으킨다는 점에서 심각하게 고려되어야 할 문제이다. 이처럼 섹스 중독은 개개인의 삶의 질을 떨어뜨릴 뿐 아니라 대중의 안전을 위협하는 범법 행위로 이어질 수도 있는 심각한 사회적 문제이며, 동시에 종족 유지 및 번식과도 관계된 생물학적으로도 중요한 이슈이기 때문에, 섹스 행위가 어떤 생물학적 기전으로 이루어지는지, 그리고 정상적인 성행위가 어떤 과정을 통해서 섹스 중독으로 변질되는지에 대해 여러 각도에서 다양한 연구가 이루어지고 있다.
2.2 남성의 성행위에 관련된 신경생리 메커니즘
기본적으로 섹스 중독은 반복적이면서도 지속적인 성행위를 경험하는 과정이 필수 조건 중의 하나이다. 파트너가 필요 없는 자위행위, 파트너가 동반되는 삽입 성교 등 여러 가지 형태의 성 행위가 섹스 중독으로 이어질 수 있다. 여기서는 섹스 중독의 선결 조건인 남성의 성행위가 어떤 생물학적 기작을 통해 이루어지는지를 먼저 살펴보도록 하자. 남성의 성행위는 일련의 신경생리 회로가 단계적으로 진행되는 방식을 통해 이루어지며, 대부분의 성행위는 사정(ejaculation)으로 귀결된다. 사정 행위는 척수의 spinal ejaculation generator 에 의해 이루어지며, 이 과정에 이르기까지, 여러 단계의 ascending pathway (생식기→척수→뇌)와 descending pathway (뇌→척수→생식기)의 상호작용이 이루어진다. 생식기의 감각 정보는 척수를 통해 뇌로 전달되며, brain stem, forebrain, thalamus, hypothalamus, limbic area, 그리고 somatosensory cortex 등 에서 이러한 성적 자극들에 대한 정보 취합이 이루어지고, 이들 뇌 부위에서 합산된 성적 만족도는 이후 척수로 전달되어 사정을 유도한다 (그림 1) [19-28].섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 6 / 21
그림 1. 수컷쥐(male rat)에서의 사정 관련 뇌 네트워크. 성행위를 마친 뒤, 뇌세포의 활성도를 나타내는 c-Fos 염색을 통해 확인된 활성화된 뇌 부위들과 그들간의 연결관계를 보여주고 있다. BNSTpm, bed nucleus of the stria terminalis posteromedial; nGi, gigantocellular nucleus; MeApd, medial amygdala posterodorsal; PAG, periaqueductal gray; PD, posterodorsal preoptic [22].
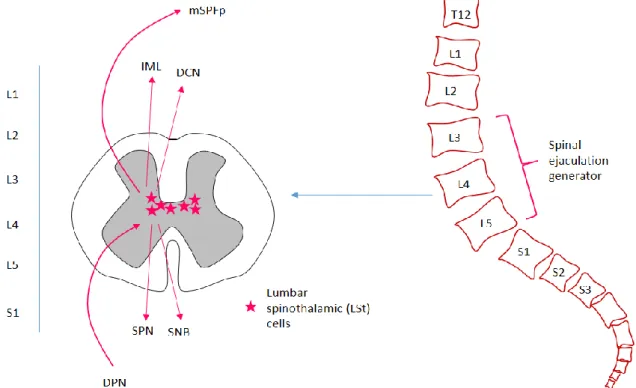
지속적인 생식기 자극으로 성적 흥분이 사정 임계점에 도달할 경우, 척수의 가장 아랫쪽인 lumbosacral spinal cord에 위치한 spinal ejaculation generator 에 의해 사정이 이루어진다 (그림 2).
그림 2. Spinal ejaculation generator 작용 기전. 생식기로부터 오는 신호인 dorsal penile nerve (DPN)가 lumbar spinal cord (L3-4)에 위치한 LSt cell을 자극하면 LSt cell이 사정 반사 (정액 분출) 작용을 일으키는 일련의 spinal cord nerve를 움직인다: intermediolateral cell column (IML)과 dorsal central nucleus (DCN)에 있는 sympathetic preganglionic cells, 그리고 sacral parasympathetic nucleus (SPN)에 있는 parasympathetic preganglionic cells, 그리고 sacral nucleus of the bulbocavernosus (SNB)에 있는 motor neuron. 또한 LSt cell은 medial subdivision of the parvocellular subparafascicular thalamic nucleus (mSPFp)로도 신호를 보내는데, 이 경로를 통해 사정 후의 쾌감 보상이 주어지고, 추가적인 성행위는 억제되는 것으로 생각되고 있다 [19].
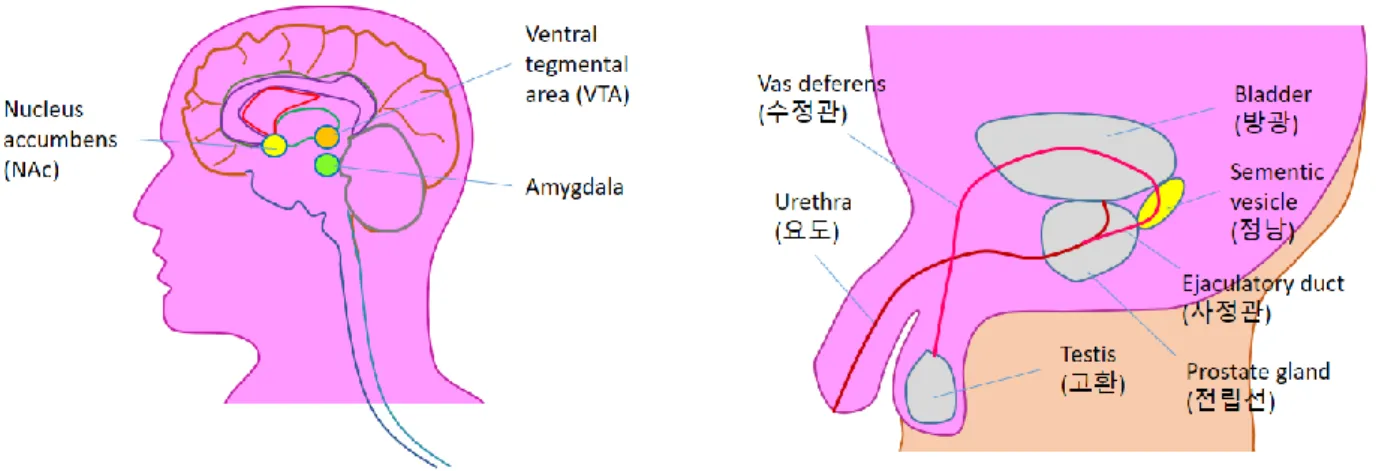
섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 7 / 21 사정은 emission(배출)과 expulsion(축출)의 두 가지 단계들로 이루어진다. 배출 과정에서는 부고환으로부터 정액이 분비되며, 정관의 근육이 수축되고, 외부요도괄약근의 수축을 통해 방광으로 가는 통로가 막힌다. 이후 오르가즘과 동시에 요도 근육의 리드미컬한 수축으로 인해 정액의 축출, 즉 사정이 이루어진다. 섹스 행위시에 뇌의 어떤 부분들이 활성화되는지를 알아보기 위해 실제 사람들을 대상으로 한 이미징 연구 결과들이 있다. 여성 파트너가 남성 실험 지원자들의 생식기를 자극해주는 조건에서 남성의 뇌를 positron emission tomography (PET)을 이용하여 촬영한 결과, 성적 흥분 및 사정 과정 동안, 쾌락을 담당하는 호르몬인 dopamine을 분비하는 VTA 부위가 활성화되는 반면, 불안 및 공포 증세와 관련된 amygdala의 활성도는 감소하는 것으로 나타났다 [25, 27, 29]. 흥미로운 점은, 인지, 논리적 사고 판단, 합리적 의사 결정 등에서 중요한 역할을 한다고 알려진 prefrontal cortex 영역이 성적 흥분 단계부터 사정 때까지 비활성화된다는 것이다 [25, 27]. 한창 섹스에 몰입하고 있을 때는 잠시 이성이 마비되었다가 사정 이후에 정신을 차리게 되는 데는 이러한 신경생리학적 기전이 어느 정도 영향을 미치는 것으로 생각된다.
2.3 섹스 중독과 관련된 뇌 내 신경생리학적 변화
상기한 바와 같이 남성의 성행위는 흥분으로 시작해 사정으로 끝나고, 사정은 반복되는 생식기 자극으로 인한 척수의 반사 반응으로 이루어진다. 따라서 뇌-척수 신경 연결이 완전히 손상된 환자의 경우에도 사정은 가능하다. 그러나 그림 1에서 나타난 바와 같이 생식기 자극으로 인한 성적 흥분은 척수의 사정 중추뿐 아니라 뇌의 여러 부분에 영향을 미치기 때문에 지속적인 성행위로 성적 흥분의 쾌감을 반복적으로 경험하게 될 경우, 뇌의 쾌감 회로를 구성하는 뇌세포들에 장기간 지속되는 생리적 변화, 그리고 이에 종속되는 행동의 변화, 즉 섹스 중독에 이를 수 있게 된다. 중독 연구 분야에서 지금까지 가장 많은 연구가 이루어지고 있는 분야는 마약이나 알코올과 같은 약물 중독이다. 약물 중독의 경우, 동물 실험에서 약물 투여를 정량적으로 조절하고 통제하는 것이 가능하기 때문에 다양한 생물학 연구 기법을 이용한 많은 연구 결과들이 축적되어 있다. 약물 중독에서는 ventral tegmental area (VTA)의 dopaminergic neuron이 nucleus accumbens (NAc)의 medium spiny neurons (MSNs)로 분비하는 dopamine이 핵심적인 역할을 하는 것으로 알려져 있다. 이 VTA-NAc dopamine 회로는 뇌 내의 쾌락 중추로 알려져 있는데, 섹스 중독도 약물 중독과 마찬가지로 이 VTA-NAc의 dopamine 분비 및 감수성의 변화가 핵심 기작일 것으로 생각되고 있다. 마약 중독이 섹스 중독과 같은 뇌 내 dopamine 신호 전달 체계를 공유하기 때문에, 실제로 두 중독 사이의 연관성을 보고한 연구 결과들도 있다. 예를 들어 마약 복용량의 증가가 성적 공격성(sexual aggression)의 증가와 상관관계를 보인다는 보고가 있고 [2, 30], 호주에서의 한 연구에서는 노상-매춘업 종사 여성(street-based female sex workers)의 코카인 중독 여부가 성적 일탈과 상관관계를 보인다는 보고가 있다 [31]. 마약 중독과 섹스 중독의 이러한 상호 작용은, dopamine 회로를 강화시키고, endocannabinoid나 serotonin 회로를 약화시키는 마약의 특성으로 인해 성적 욕구가 강화되었기 때문으로 추측되고 있다 [2]. 동물 실험에서의 결과들 역시, 약물 중독과 섹스 중독은섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 8 / 21
dopamine 신호 전달 회로(mesolimbic dopaminergic pathway)라는 같은 작용 기전을 공유하며 서로 영향을 주고 받을 수 있다는 사실을 보여준다 [32-41]. 사람을 대상으로 하는 성행동 연구에는 여러가지 심리적 환경적 변수들이 작용하기 때문에 적절하게 통제된 상황에서의 측정이 쉽지 않다. 또한 본능적으로 교미를 하는 동물과 다르게, 사람의 성적 흥분은 대부분 생후의 사회적 학습에 의한 반응으로 생각되기 때문에 (우리가 어떤 대상이 섹시하다고 말하는 것은 그것이 섹시한 것이라 들어왔기 때문이다), 성교 시에 나타나는 여러가지 성 행동 지표들을 정확히 정량화하기가 쉽지 않다. 사람을 대상으로 한 섹스 중독 연구의 이러한 기술적 문제점들을 감안할 때, 최근 수년간 동물 모델 (특히 mouse와 rat과 같은 설치류) 에서 이루어진 섹스 중독 연구의 결과들은, 인간에서의 섹스 중독 기전을 이해하는데 몇가지 힌트를 제시해준다. Lique M. Coolen 실험실에서는 설치류 동물 모델을 이용하여, 반복적인 섹스 경험이 설치류의 뇌를 어떻게 변화시키는지에 대한 연구 결과들을 지속적으로 발표해왔다. 이 실험실에서 발표한 최근 몇년간의 연구 결과들은 지속적이고 반복적인 성행위가 마치 마약을 반복적으로 투여한 것과 유사한 행동, 생화학, 구조적, 전기생리학적 변화들을 유도한다는 것을 보여준다. 섹스 경험이 전무한 수컷쥐에게 암컷쥐와의 교미 기회를 며칠간 반복해서 주게 되면, 횟수가 거듭될수록 수컷쥐가 암컷쥐에 올라타고 생식기를 삽입하는데 걸리는 시간이 점점 짧아지는 등 수컷쥐의 성적 능력이 원숙해진다 [42, 43]. 이런 과정을 통해 반복적 성경험을 쌓게 된(sexually experienced) 수컷쥐는 dopamine 쾌락 중추 관련 뇌 부위에서 다음과 같은 여러가지 변화를 보이게 된다. 암컷쥐와 지속적으로 교미를 한 수컷쥐의 경우, dopamine을 받는 주요 부위인 NAc 뇌세포에서의 ΔFosB의 양이 증가한다 (ΔFosB는 기존의 연구들에서 마약 중독으로 인한 뇌 세포 변성을 유도하는 핵심 전사 인자로 알려져있다). 흥미로운 점은, 지속적인 교미를 경험하고 난 뒤의 수컷쥐는 교미를 하지 않고 있는 상태에서도 ΔFosB 양이 높게 유지되고 있다는 것이다. 이는 반복적인 섹스 경험이 dopamine 신호를 받는 NAc 뇌세포들의 생화학적 특성을 장기적으로 변화시켰음을 의미한다. 또 하나 특기할 것은 뇌세포의 활성도를 나타내는 가장 대표적인 마커 중의 하나인 c-Fos의 경우, 생애 첫 섹스를 경험한 수컷쥐의 경우 교미 직후 c-Fos 발현 뇌세포의 수가 드라마틱하게 증가하는데 (섹스 무경험 쥐에 비해 약 7배 증가), 여러번의 섹스를 이미 경험한 쥐의 경우 섹스 후 c-Fos 발현 뇌세포 수 증가폭이 생애 첫 섹스 경험 쥐보다는 현저히 줄어든다는 것이다. 이는 섹스를 반복해서 할수록 점차적으로 dopamine 쾌락 중추를 담당하는 뇌세포의 반응 정도가 둔감해짐을 보여준다 [43]. 지속적인 성경험은 신경세포간의 신호 전달 핵심 인자인 N-methyl-D-aspartate (NMDA) 수용체와 α-amino-3-hydroxy-5-methylisoxazole-4-propionate (AMPA) 수용체의 양 및 활성도에도 영향을 준다. 5일간의 성경험 기간을 가진 쥐의 NAc 뇌세포를 생화학 및 전기생리학적 방법으로 측정한 결과, NMDA 및 AMPA 수용체의 세포막 안밖의 수가 섹스 경험 후에 달라지는 것을 확인하였고, 이런 이온 채널 발현양의 변화가 섹스 경험 후 1주일, 또는 한달의 금단 기간을 가졌을 경우에 각기 다른 glutamate receptor의 subunit들이 양적 변화를 보이는 것을 밝혀내었다 [44]. Whole-cell patch clamp 전기생리학 기법을 이용하여 NMDA/AMPA 수용체의 활성도를 측정하였을 경우, AMPA 수용체에 비해 NMDA 수용체를 통한 이온의 흐름이 증가한 것을 확인하였고, 이러한
섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 9 / 21
경향은 반복적인 성경험 직후, 그리고 일주일, 한달의 금단 기간 후에도 동일하게 유지된다는 것을 밝혀내었다. 이런 실험 결과들은 반복적인 성경험이 dopamine 쾌락 중추의 핵심 뇌세포들의 신호전달 체계를 바꾼다는 것을 의미한다 [44]. 후속연구에서 연구진들은 성행위 중에 NAc 뇌세포의 NMDA 수용체의 활성을 MK-801 약물로 억제할 경우, 성행위 후에 NAc 뇌세포의 ΔFosB 및 c-Fos 증가가 이루어지지 않는다는 사실을 확인하여, 성행위 과정에서의 NMDA 수용체 활성도 증가가 성행위로 인한 NAc 뇌세포 변성을 유도하는 시발점이라는 사실을 밝혀내었다 [36].
반복적인 성경험은 뇌세포의 형태와 구조에도 영향을 미친다. 흥분성 뇌세포의 신호 전달 물질인 glutamate는 presynaptic neuron의 axon terminal에서 분비되며 postsynaptic neuron의 dendritic spine에 위치한 glutamate 수용체들을 통해 다음 연결 세포를 흥분시키는 역할을 한다. 수일에 걸쳐 성행위를 경험한 쥐들의 경우, 섹스 바로 직후에는 dendritic spine 숫자에 변화가 없지만, 마지막 섹스 후 7일동안 교미 기회를 주지 않는 금단 기간을 거친 후에는 spine 숫자가 증가되었다. 흥미로운 점은 28일간의 금단 기간 후에 조사했을 경우, spine 숫자가 섹스를 경험하지 않은 쥐들이랑 비슷한 숫자를 보였다는 것이다 [32, 40]. 만일 쥐와 인간의 섹스 중독이 유사한 메커니즘을 통해 이루어진다면, 이러한 금단 기간 동안의 dendritic spine 숫자의 증가, 회복 결과는 섹스 중독의 극복 과정에 일종의 critical period가 있을 수 있음을 의미한다. 표 2. 반복적이고 지속적인 성경험이 수컷 쥐의 뇌에 일으키는 변화
생화학적 변화 Dopamine 회로와 관련된 뇌부위인 NAc, VTA, medial prefrontal cortex, caudate putamen 에서 ΔFosB 의 양 증가 [32, 43]
VTA 에서 TH(+) dopaminergic neuron 의 활성도 (c-Fos) 증가 [34, 35] NAc neuron 의 활성도 (c-Fos) 증가 [43] [34, 35]
NAc neuron 에서 NMDAR subunit 인 NR1, AMPAR subunit 인 GluA1, GluA2 발현양 증가 (NR1 의 경우 짧은 withdrawal, GluA1/2 의 경우 long withdrawal 후에 발현양 증가) [44]
전기생리학적 변화 NAc 뇌세포에서 NMDA 수용체를 통한 이온 유입 증가, AMPA/NMDA-receptor current ratio 감소 [44]
구조적 변화 NAc 뇌세포에서 흥분성 신경전달물질인 glutamate 의 신호를 받는 dendritic spine 수 증가 [32, 40]
2.4 사정 후 허탈감(Post-ejaculatory dysphoria)이란 무엇인가?
섹스는 인간 사회에서 동서고금을 통틀어 대중들의 가장 큰 개인 관심사 중의 하나였으며, 이를 반영하듯 이미 2000년전부터 소녀경이나 카마수트라와 같이 인간의 성 행동을 기술하는 책들이 나오기 시작했다. 음양오행설이나 종교적 관점에서 인간의 성행위를 바라보던 고전적 방법론에서 벗어나, 인간의 성행동을 체계적이고 과학적인 방법으로 연구하기 시작했던 것은 20세기 중반 여러 선구자적 성의학자들이 등장하고 나서부터였다. 킨제이 보고서로 유명한 Alfred C. Kinsey는 1940년대부터 18,000여명에 달하는 사람들을 인터뷰하여 그 자료들을 취합해 인간 성행동에 대한 보고서를 출판하였고 [45, 46], 1950년대 성의학 연구의 문을 본격적으로 열었던섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 10 / 21
William H. Masters, 그리고 그의 연구 파트너이자 아내가 된 Virginia E. Johnson은 대학 내 실험실에서 남녀간의 성행위를 실제로 관찰하면서 성행위의 각 단계에서 어떤 생리적 변화가 이루어지는지를 측정하고 기록하였다 [47]. 1966년에 출판된 그들의 책 “Human Sexual Response”은 섹스의 각 스텝에서 남성의 성반응이 어떻게 나타나는지를 아래의 그림 3과 같이 보여주고 있다 (Masters와 Johnson의 초기 연구 결과들은 각론에 있어 그 이후의 여러 다른 연구자들에 의해 몇몇 부분들이 조금씩 수정, 보완되어 왔으나, 아래의 ‘남성 성반응 주기 그래프’는 발표 당시부터 현재까지 이견없이 수용되고 있다). 남성과 여성의 성행위에서 가장 큰 차이를 보이는 부분은 refraction(굴절) 부분이다. 그림 3. 남성의 성반응 주기. 남성의 경우, 파트너를 동반한 성행위 또는 자위 행위 등등 성행위의 종류를 막론하고 모든 형태의 성행위에서 그 끝은 대부분 사정(ejaculation)으로 귀결된다. 사정이 이루어진 직후, 일정 시간 동안 성적 긴장이 완화되면서 성욕이 급감하고, 발기가 불가능해지는 post ejaculatory refractory period (PERP)를 겪게 된다 [48-51]. 이 기간 동안 남성의 생식기는 hypersensitive해지면서 생식기를 계속적으로 자극할 경우 쾌감은 커녕 오히려 불편함과 통증을 불러일으킬 정도이다. 이 PERP 기간은 종에 따라 큰 차이를 보이는데, Syrian hamsters와 같은 일부 설치류의 경우는 30초 미만의 짧은 억제 시간을 보이는데 반해, 포유류의 경우 수시간에서 수일, 인간 성인 남성의 경우는 나이에 따라 대략 30분에서 24시간 정도 걸리는 걸로 알려져 있다 [52][53] (아주 예외적인 경우이긴 하지만 인간 남성의 경우에도 refractory period를 보이지 않고, 멀티오르가즘을 경험하는 사례들도 있기는 하다 [54, 55]). PERP 기간 동안 나타나는 급격한 성욕 감소 현상은, 섹스 중독으로 일상의 불편함을 호소하는 개인, 또는 사회적 차원의 교정이 필요한 상습적 성범죄자의 재활 치료 방안을 강구하는데 있어 의미있는 힌트를 줄 수 있다. 현재 섹스 중독자들을 위한 치료 방안으로, 심리 상담, 정신 교육, 행동 교정, 새로운 일이나 취미 활동의 권장, 식단 및 운동 요법 등이 쓰이고 있긴 하지만, 이런 방법들이 다양한 형태의 섹스 중독, 다양한 스케일의 이상 성욕자들에게 얼마나 유효한 치료 효과를 보이는지에 대해서는 아직 체계적인 연구가 이루어져 있지 않다 [56][57]. 현재 미국과 유럽, 중동 등 여러 나라에서는 사회에 위해가 될 정도로 심각한 섹스 중독자들인 상습적 성범죄자들의 일부를 대상으로 약물을 이용한 화학적 거세(chemical castration)
섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 11 / 21
방법을 쓰고 있다. 화학적 거세에 이용되는 약물로는 주로 anti-depressant(항우울제), anti-androgens (남성호르몬 억제제), GnRHa (gonadotropin-releasing hormone analogues or agonists) 등이 쓰인다 [58-62]. 항우울제인 serotoninergic reuptake inhibitors (SSRIs)를 쓸 경우 serotonin 양이 증가하는데, 뇌 내에서의 serotonin 농도 증가는 성욕 감소 및 오르가즘/사정 능력을 감소시키는 역할을 한다 [63]. Testosterone과 같은 남성호르몬은 성적 충동에 관여하는 핵심 호르몬으로서, 이를 억제하기 위해서 medroxyprogesterone acetate (MPA)나 cyproterone acetate (CPA)와 같은 steroid 계열 anti-androgen를 쓰거나, 또는 pituitary의 GnRH 수용체에 작용하는 GnRHa를 쓴다 [61]. 최근 한국의 성범죄자들을 대상으로 GnRHa의 일종인 leuprolide acetate을 처방한 뒤 그 경과를 관찰한 연구 결과에 따르면, 약물 치료자들의 70-80%가 남성 호르몬인 testosterone의 농도가 줄어들고 성욕 감소 및 자위 행위 감소의 결과를 보였다 [64]. 하지만 이러한 화학치료제들의 경우, 체내 성호르몬의 교란을 일으켜, 안면 홍조, 체모 감소, 가슴 발달, 골다공증 및 심혈관 질환의 위험 증가 등의 신체 변화 부작용을 일으키며, 약물의 효과도 일시적이기 때문에 장기간 반복적으로 투여해야하는 기술적 문제점도 있다. 따라서 정상적 성행위 과정에서의 사정 후 급격한 성욕 저하 메커니즘이, 상기한 화학적 거세의 생물학적 기술적 문제점을 우회하는 과정으로 이루어진다면, 이상 성욕으로 일상 생활에 어려움을 겪는 사람들을 도와주고 우리 사회의 성일탈, 성범죄를 줄이는 방안을 강구하는데 도움이 될 수 있을 것이다.
2.5 사정 후 허탈감을 유도하는 신경생리 메커니즘
사정 후 허탈감은 섹스 시 일어나는 매우 흥미로운 현상으로서, 이 특이한 생리 현상을 과학적으로 이해해보려는 노력이 최근 여러 각도에서 진행중이다. 사정 직후의 성욕 저하 및 추가적 발기 불능은 지나친 성행위로 인한 남성의 에너지 소모를 줄이려는, 또는 지나친 성행위로 인한 여성의 상해 가능성을 줄이려는 진화적 결과일 수도 있다. 또한 동일 여성에게 짧은 시간 동안 반복적으로 사정하여 정자를 다 소모해버리는 것은 자손을 널리 번식시키려는 목적의 남성 입장에서는 좋은 생식 전략이 아니다. 수정의 효율 측면에서 바라본 또다른 가설도 있는데, Gallup 등의 연구 결과에 의하면, 사정 바로 직후 다시 성기의 삽입이 이루어질 경우, 이미 그 직전에 사정되어 여성의 질구로 들어가있던 정액들이 질구 바깥으로 빠져나올 확률이 높아진다는 것이다. 따라서 추가 삽입이 불가능한 PERT 기간은 이미 질구 안에 사정된 정액들의 수정 확률을 높이기 위한 메커니즘일 수도 있다 [49, 65]. 이상과 같이 PERT 또는 사정 후 허탈감 증상에는 여러가지 심리적, 행동학적, 진화적 설명들이 있는데, 그렇다면 이 현상을 실제로 가능하게 하는 신경생리학적인 메커니즘은 무엇일까? 사정 후 허탈감에 대한 지금까지의 가장 일반적이면서도 전통적인 설명은 뇌에서의 호르몬 분비량 변화였다. 성행위의 각 단계 (흥분-고조-사정-굴절)에 걸쳐 뇌 속의 호르몬들이 어떻게 변화하는지에 대한 연구가 많이 이루어졌고, 특히 dopamine, serotonin, prolactin 등이 집중적인 관심을 받았다.섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 12 / 21
줄어들며, refractory period 후반부에 서서히 회복되는 것으로 나타났다 [66]. 마찬가지로 수컷쥐의
NAc 뇌세포를 대상으로 한 in vivo sigle unit recording에서는 사정 후, NAc에서 delta-osciallation을
보이는 뇌세포의 수가 증가된 것을 확인하였다 [67]. Delta-osciallation은 slow-wave sleep에 관련되어 있기 때문에 사정 이후의 전반적인 뇌 활성도 감소 및 피로감 증가와 관련있을 것으로 생각된다. 또한, 사정 이후 뇌에서는 serotonin과 prolactin의 분비가 증가하여 dopamine 신호 전달 경로 및 생식기의 발기 및 사정 관련 신경회로를 조절한다고 알려져있다 [49, 68-70].
불안 및 공포를 담당하는 뇌 부위인 amygdala가 특이하게도 사정 전후에 활성도가 바뀌는 것으로 나타나, amygdala가 사정 후 허탈감에 중요한 역할을 할 것이라는 가설도 있다. 젊은 남성 지원자들을 대상으로 자위행위를 하게 한 후, 뇌에서 일어나는 변화를 functional MRI (fMRI)로 측정하였을 경우, amygdala, temporal lobe, septal areas가 사정 후 30분간에 걸쳐 활성도가 증가하는 것을 확인하였다 [51]. 이전의 다른 뇌 이미징 연구 결과들에서 amygdala가 성적 흥분 및 사정단계에서는 비활성화되는 것을 보였기 때문에 [27, 29, 71], 이들 결과를 종합할 경우, amygdala는 사정 전후에 걸쳐 rebound activation되는 것으로 보여진다. Amygdala가 불안 및 우울과 관련된 감정을 담당하는 뇌 구역임을 감안할 때, 성적 쾌감이 최고조로 이르는 단계까지는 amygdala 기능이 억제되며, 사정이 이루어지고 난 뒤 amygdala의 기능이 재활성되면서 사정 후의 허탈감, 우울감 등을 유도하는 것으로 생각할 수 있다. 하지만 성행위 후의 이런 serotonin과 prolactin 분비 증가, 그리고 성행위 기간 동안의 amygdala 활성도 감소 등은, 남성과 여성의 뇌에서 공통적으로 일어나는 현상이기 때문에, 남성에서만 특이적으로 일어나는 사정 후 성욕 저하 현상을 설명하기에는 충분하지 않다. 또한 prolactin의 경우 높은 호르몬 농도가 발기 능력에 영향을 준다는 보고들이 있지만, post-ejaculatory refractory period에서는 단지 발기 불능의 신체적 증상만 일어나는 것이 아니라 성욕의 급격한 저하도 동반된다는 점을 고려하면, prolactin의 증가만으로 사정 후 심신의 변화를 설명하기에는 부족하다 [72][73-75]. 또한 prolactin의 분비량 증가와 사정의 인과 관계 역시 아직 충분하게 밝혀지지 않았다. Prolactin의 증가로 인해 사정이 이루어지는지, 또는 사정 직후의 신경생리, 내분비 메커니즘이 prolactin의 증가를 유도하는지는 아직 명확하지 않다. Prolactin과 마찬가지로 serotonin 역시 성적 욕구를 조절한다고 알려져 있는데, 여러가지 조건에 따라(presynaptic vs. postsynaptic serotonin receptor type) 뇌세포들을 흥분 또는 억제시키는 상반된 효과를 낼 수 있어, serotonin의 분비량 변화 그 자체만으로는 사정 후에 일어나는 생리적 변화를 설명하기에 충분하지 않다 [76, 77]. 호르몬 가설이 가지는 이러한 몇가지 문제점들을 고려할 때, 사정 후 허탈감과 관련된 신경생리 메커니즘 가설에는 다음의 몇가지 사항들이 고려될 필요가 있다 [78]. 일부 남성의 경우 사정을 하지 않는 한 여러 번의 오르가즘을 연속적으로 경험할 수도 있기 때문에, ‘오르가즘’이 아닌 ‘성공적인 사정’이 refractory period로 들어가기 위한 필수 선결조건이 되어야한다. 두번째로 고려해야할 점은, 짧은 휴식기를 가진 반복적인 성행위는 약한 사정과 약한 오르가즘을 가져오지만, 장기간의 금단 기간 이후의 성행위는 강한 사정과 강한 오르가즘을 가져온다는 것이다. 사정 후 허탈감에 대한 가설은, 이같은 금단 기간의 길이와 사정/오르가즘의 강도 사이의 상관관계를 어느 정도 설명할 수 있어야할 것이다. 마지막으로 생각해볼 점은 성인 남성의 경우, 나이가 들수록 사정
섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 13 / 21
및 오르가즘의 강도가 낮아지고 PERP 기간이 길어진다는 것이다. 사정 후 허탈감을 설명하려는 가설은 이런 나이/생식능력의 상관관계를 어느 정도 설명할 수 있어야할 것이다.
그림 4. 사정 후 허탈감을 설명하는 생물학적 가설들. 뇌 속 호르몬 분비량 변화 가설은 dopamine, serotonin, prolactine 호르몬들의 사정 전후 분비량 변화에 초점을 맞추고 있다 (왼쪽 그림). 사정 후, dopamine 분비량 감소, serotonin, prolactin의 경우 분비량이 증가하는데, 이들이 뇌 내의 쾌감 중추 (VTA-NAc) 또는 발기 및 사정에 관계된 뇌 영역에서 작용한다고 생각된다. Amygdala의 경우 불안 및 공포와 관련된 감정 형성에 중요한 역할을 하는데, 성적으로 흥분하여 사정에 이르는 기간까지는 활성이 줄어들지만, 사정 이후 활성도가 증가하는 것으로 나타나 사정 이후의 허탈감, 우울함에 영향을 줄 수 있을 것으로 생각된다. 뇌 안에서의 생리현상에 초점을 맞춘 이런 가설들에 비해, brain-gut axis의 autonomic feeback에 초점을 맞춘 가설들은 생식기 주변의 말초 신경계에서의 생리현상 변화에 더 주목한다 (오른쪽 그림). 예를 들어, 정낭벽의 압력 변화가 직접적으로 중추신경계를 조절하거나, 요도를 지나는 정액에 포함된 물질들이 요도 내의 내분비계 세포들에 영향을 줘서 궁극적으로는 뇌와 척수의 신경계를 조절한다는 것이다.
상기한 몇가지 요소들을 고려하여, 최근 들어 뇌 속에서의 호르몬 분비량 변화보다는 몸 전체를 관장하는 cardiovascular (CV), 또는 gastrointestinal (GI) system의 autonomic feedback으로 PERP를 설명하려는 가설들이 제시되고 있다 [78]. 특히 심혈관계 (CV) 가설의 경우, 혈관계 내에서 압력를 감지하는 baroreceptor가 중요한 역할을 할 것으로 생각되고 있다. 성적 환상, 또는 생식기 자극으로 성적 흥분이 이루어지면 생식기 전반에 걸쳐 혈액 공급이 증가되는데, 이때 해면체의 울혈로 발기가 이루어지고, 정낭의 경우에도 주변부 혈관의 팽창으로 분비액이 늘어나 정낭 자체의 부피가 증가된다. 사정이 이루어지면 정액이 빠져나가면서 정낭의 부피가 급감하며 정낭벽의 압력이 떨어지게 되는데, 이러한 압력의 증가/감소가 baroreceptor에 의해 실시간으로 감지되어 PERP를 유도한다는 것이다. 이 경우, 사정과 동시에 부피가 급감했던 정낭에 서서히 정낭액이 채워지는 기간 동안이 PERP가 된다. 중년 남성들을 대상으로 정낭의 부피와 섹스 빈도를 조사한 최근의 한 연구 결과에 따르면, 정낭의 부피가 클수록 섹스 빈도수가 높은 것으로 밝혀졌다 [79]. 또한 나이가 들수록 정낭벽의 탄력도가 떨어지기 때문에 나이가 들수록 PERP기간이 늘어나는 현상도 어느 정도 설명이 된다. 정낭의 부피가 성욕에 영향을 준다는 사실은 동물 실험으로도 증명되었다. 정낭관을 폐색하는(occlusion) 수술을 통해 정낭의 부피를 인위적으로 크게 만든 생쥐들의 경우, 보통 크기의
섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 14 / 21 정낭을 지닌 대조군 생쥐나 정낭을 제거해버린 생쥐들에 비해, 암컷 생쥐들과의 교미 기회가 주어졌을 때 더 적극적으로 성행위를 시도하는 결과를 보였다 [80]. 정낭의 크기와 사정 후 생리현상과의 관계를 보여주는, 한 70살 노인의 이야기를 다룬 매우 흥미로운 사례 리포트가 하나 있다 [81]. 이 노인의 경우, 지난 10년동안 특이하게도 대변을 볼 때마다 오르가즘을 느꼈고, 오르가즘 직후에는 일상생활에 지장을 줄 정도로 극심한 피로가 뒤따르는 기이한 증세를 호소하였다. 병원에서의 방광경 검사 결과, 이 노인의 오른쪽 정낭 사정관 입구가 비정상적으로 열려 있어, 그곳으로 역류가 발생하여 정낭의 부피가 커지는 것이 확인되었다. 이 노인은 정낭 제거 수술을 받았는데 그 뒤로는 더 이상 배변시 오르가즘 증세가 나타나지 않았고, 오르가즘으로 인한 피로감에서 해방되어 정상적인 생활을 누릴 수 있게 되었다. 위에 기술한 정낭의 압력 변화 감지와 마찬가지로, 남성의 생식기에 초점을 맞춘 또다른 사정 후 허탈감 가설들도 있다. 사정이 임박해지면 정액은 요도를 통과하며 요도 내의 neuroendocrine 세포들과 상호 작용을 하게 된다. 요도 내에는 serotonin, somatostatin, chromogranin A, thyroid-stimulating hormone-like peptide 등 여러 신호 전달 물질을 분비하는 세포들이 존재한다고 알려져 있다 [82-84]. 뇌에서의 serotonin 작용은 대상 부위의 수용체 종류에 따라 흥분성 및 억제성의 서로 다른 효과를 내지만, 요도 내에서 국소적으로 분비되는 serotonin은 기본적으로 성적 흥분을 고조시키는 역할을 한다. 정액은 여러가지 종류의 신경 전달물질, 세포 신호 조절 물질들을 포함하고 있는데 [85, 86], 사정으로 인해 정액이 요도를 통해 빠져나갈 때, 정액 속에 포함된 특정 물질들이 serotonin을 분비하는 세포들을 억제하거나, 또는 이들 세포에서 다른 종류의 peptide messenger들의 분비를 유도하여, 요도 내의 neuroendocrine 세포들이 spinal cord 및 brain과의 연결관계에서 성적 흥분을 억제하는 방향으로 작용하게 할 가능성도 있다 [78]. 예를 들어, 정액은 많은 양의 somatostatin-64를 포함하고 있는데 [85], somatostatin은 기존 연구에서 위장관 분비세포에서의 serotonin 분비를 억제시킨다고 알려져 있다 [87, 88]. 또한 somatostatin agonist를 수컷 쥐에게 투여했을 때 발기가 억제되는 사례를 보아, 사정 시 분출되는 정액 속의 somatostatin(또는 다른 신경/신호 전달 물질들)이 요도 내에 존재하는 내분비세포들에 작용하고, 이들 요도 내분비세포들이 뇌와 척수의 신경세포들을 조절하여 성적 욕구 및 발기를 억제시키는 회로를 구동시킬 수도 있을 것이다 [89].
3. 결론
(우리는 어떻게 살아갈 것인가?) 지금까지 섹스 중독이 어떤 것이며, 뇌에 어떠한 변화를 가져오는지, 그리고 성욕의 증가 및 억제가 정상 상황과 중독 상황에서 어떤 과정을 통해 이루어지는지를 여러 연구 결과 및 가설들로 살펴보았다. 섹스 중독시 나타나는 과도한 성적 충동/집착은, 개인의 건강 및 행복한 가정 생활, 안전한 사회 유지에 심각한 위협이 될 수 있다. 실제로 많은 남성들이 유년기에는 과도한 자위행위나 야동 시청에 빠져 아까운 청소년기의 정력을 낭비하고, 청년기에는 성적 충동에 휩싸여서 인생의 잘못된 선택 또는 사회적 비행을 저지르기도 하며, 중년, 장년기에는 성적 일탈로 가정의 파탄 및 사회적섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 15 / 21 추락의 결말을 맞기도 한다. 섹스 중독은 언론의 사회면 기사에서만 볼 수 있는 현상이 아니라, 실제로 우리 주변에서도 쉽게 그 사례들을 찾아볼 수 있을 정도로 만연되어 있고, 우리들 또한 섹스 중독을 촉발하는 특정한 상황에 처하게 되면 은연중에 이 중독에 빠질 수 있는 여지가 항상 있다. 이상 성욕에 빠지지 않고 자유로운 영혼을 지키면서 건강한 삶을 유지하기 위해서는 어떻게 해야할까? 성욕에 휩싸이지 않겠다는 이유만으로 스스로 남성호르몬 억제제를 투여하거나, 또는 자신의 정낭을 잘라내고 싶어할 사람은 없으리라 생각한다. 그런 극단적인 방법이 아니더라도, 일상생활에서 우리가 쉽게 실천할 수 있는 몇가지 예를 여기 들어보고자 한다. 최근의 한 섹스 중독자에 대한 사례 보고는, 명상(meditation) 수련 방법이 성 충동을 제어할 수 있는 효과적인 방법 중 하나라는 것을 보여준다 [57]. 이 보고서는 영국의 한 30대 남자가 섹스 중독에 빠져서 삶이 망가져가는 과정 및 그 재활 과정을 매우 자세하게 기술하고 있다. 평범한 직장인이자 유부남이었던 이 남자는 진부하고 재미없던 부부 성관계에 흥미와 설레임을 불어넣고자 성관계 직전에 부부가 같이 포르노를 시청하자고 제안하였다. 그 부인은 얼마안가 포르노에 대한 흥미를 잃었지만, 남자는 점점 포르노에 탐닉하게 되었고, 일주일에 약 다섯번 정도씩 포르노를 보며 자위행위를 하게 되었다. 이 남자는 점점 더 자극적인 포르노를 찾게 되었고, 그러다 보니 남성들의 자위행위나 남성 동성애자들의 섹스를 보여주는 포르노까지 찾아보게 되었다. 어느날 게이 포르노를 집에서 몰래 보다가 부인에게 들킨 것을 계기로 이 남자는 급기야 이혼 당하게 되었고, 그 후에는 돈을 주고 여자들을 사는 방법으로 자신의 성욕을 채웠다. 일주일에 평균 여섯 번 정도씩 성 매수를 하다 보니 세일즈맨으로 얻는 수입만으로는 감당이 되지 않아 자신의 집마저 팔게 된다. 섹스 중독에 허우대던 이 남자는 재활을 결심하고 상담을 받게 되며, 치료사들이 권고하는 10주간의 명상 수련 과정에 들어가게 된다. 이 남자의 무분별했던 삶은 명상 수련을 마치고 난 뒤 상당히 호전되었는데, 포르노 시청을 끊었으며, 일주일에 5번씩 하던 성 매수가 2번으로 줄었고, 기존에 10명이었던 (돈을 안 받고 같이 섹스를 즐겼던) 섹스 파트너 수를 3명으로 줄였다. 명상은 20분간 자신의 호흡 및 현재 실시간으로 일어나고 있는 일들에 집중하는 방법으로 이루어졌는데, 이러한 정신 수련만으로도 일상에서의 성충동을 어느정도 효과적으로 제어할 수 있음을 보여준다. 식사 습관도 성 충동 조절에 어느 정도 영향을 줄 수 있다. 성인 남성을 대상으로 한 최근의 한 neuroimaging 연구 결과에 따르면 여성 누드 사진을 보여줄 경우 뇌에서 dopamine을 분비하는 VTA의 활성이 증가되는데, 혈관 내로 glucose를 투여할 경우, 여성 누드 사진을 보여주었을 때의 VTA의 활성도가 옷을 입은 여성의 사진을 보여주었을 때보다 오히려 활성도가 떨어지는 결과를 보였다 [90]. 이는 혈중 glucose 농도가 높은 상태에서는 성적 자극에 대한 뇌 내의 반응성이 떨어질 수 있음을 보여준다. 성 충동 억제를 위한 또다른 방법은 운동이다. 최소한의 즐거움도 없는 무료한 일상 생활이 계속되면 뇌 내의 dopamine 분비가 현저하게 떨어져서 우울감과 함께 불안, 초조해지며 이런 상황에서는 각종 중독에 취약하게 된다. 그래서 중독에 빠지지 않기 위해서는 일상 생활에서 최소 일정 수준 이상의 즐거움을 유지해야할 필요가 있다. 최근 생쥐를 대상으로 한 실험 결과에 따르면, running wheel위를 장시간 달린 쥐들은 그렇지 않은 쥐들에 비해 혈중 endocannabinoids 농도가 증가하며 불안 증세가 감소하고 고통에 대한 감각도 줄어든 것으로 나타났다 [91]. 이는 장거리 달리기를 즐기는 사람들이 경험하는 runner’s high의 생물학적 근거를 보여주는 것으로, 일정 시간,
섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 16 / 21 거리 이상을 달릴 경우, 뇌 속에서의 endocannabinoids 농도 증가로 즐거운 각성이 유도되며 동시에 불안감과 통증에 대한 반응성을 줄일 수 있음을 의미한다. 위에 예로 든 몇가지 사례들을 일상 생활에서 실천하는 것은 그렇게 어려운 일이 아니다. 말 그대로, 명상을 통해 자신의 마음을 다스리고, 규칙적으로 밥을 먹으며, 꾸준히 달리기같은 운동을 하면 되는 것이다. 자신의 일상 생활을 잘 관리하면서, 자신과 주변의 관계로부터 오는 소소한 행복들에 집중한다면, 성적 집착이나 충동으로부터 자신의 자유로운 영혼을 지켜낼 수 있을 것이고, 개인적으로는 건강한 심신, 사회적으로는 안전한 환경을 구축하는데 도움이 될 것이다.
4. 참고문헌
[1] Reid, R.C., How should severity be determined for the DSM-5 proposed classification of Hypersexual Disorder? J Behav Addict, 2015. 4(4): p. 221-5.
[2] Blum, K., T. Werner, S. Carnes, P. Carnes, A. Bowirrat, J. Giordano, M. Oscar-Berman, and M. Gold, Sex, drugs, and rock 'n' roll: hypothesizing common mesolimbic activation as a function of reward gene polymorphisms. J Psychoactive Drugs, 2012. 44(1): p. 38-55.
[3] Carnes, S. and T. Love, Separating Models Obscures the Scientific Underpinnings of Sex Addiction as a Disorder. Arch Sex Behav, 2017. 46(8): p. 2253-2256.
[4] Association, A.P., Diagnostic and Statistical Manual of Mental Disorders, 2013. fifth Edition. [5] Katchadourian, H.A., Fundamentals of human sexuality, 1985: p. 73.
[6] Koob, G.F. and N.D. Volkow, Neurocircuitry of addiction. Neuropsychopharmacology, 2010. 35(1): p. 217-38. [7] Volkow, N.D., G.J. Wang, J.S. Fowler, D. Tomasi, F. Telang, and R. Baler, Addiction: decreased reward sensitivity and increased expectation sensitivity conspire to overwhelm the brain's control circuit. Bioessays, 2010. 32(9): p. 748-55.
[8] Walton, M.T., J.M. Cantor, N. Bhullar, and A.D. Lykins, Hypersexuality: A Critical Review and Introduction to the "Sexhavior Cycle". Arch Sex Behav, 2017.
[9] Walton, M.T., J.M. Cantor, and A.D. Lykins, An Online Assessment of Personality, Psychological, and Sexuality Trait Variables Associated with Self-Reported Hypersexual Behavior. Arch Sex Behav, 2017. 46(3): p. 721-733. [10] Sendler, D.J., Lethal asphyxiation due to sadomasochistic sex training - How some sex partners avoid criminal responsibility even though their actions lead to someone's death. J Forensic Leg Med, 2018. 56: p. 59-65.
[11] Prentky, R.A. and A.F. Lee, Effect of age-at-release on long term sexual re-offense rates in civilly committed sexual offenders. Sex Abuse, 2007. 19(1): p. 43-59.
[12] Greenberg, D.M., Sexual recidivism in sex offenders. Can J Psychiatry, 1998. 43(5): p. 459-65.
[13] Prentky, R.A., A.F. Lee, R.A. Knight, and D. Cerce, Recidivism rates among child molesters and rapists: a methodological analysis. Law Hum Behav, 1997. 21(6): p. 635-59.
[14] Kafka, M.P., Hypersexual disorder: a proposed diagnosis for DSM-V. Arch Sex Behav, 2010. 39(2): p. 377-400. [15] Echeburua, E., [Does really sex addiction exist?]. Adicciones, 2012. 24(4): p. 281-5.
[16] Reid, R.C., J.M. Harper, and E.H. Anderson, Coping strategies used by hypersexual patients to defend against the painful effects of shame. Clin Psychol Psychother, 2009. 16(2): p. 125-38.
섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 17 / 21
minority? Eval Health Prof, 2011. 34(1): p. 3-56.
[18] Traeen, B., K. Spitznogle, and A. Beverfjord, Attitudes and use of pornography in the Norwegian population 2002. J Sex Res, 2004. 41(2): p. 193-200.
[19] Veening, J.G. and L.M. Coolen, Neural mechanisms of sexual behavior in the male rat: emphasis on ejaculation-related circuits. Pharmacol Biochem Behav, 2014. 121: p. 170-83.
[20] Sakamoto, H., Brain-spinal cord neural circuits controlling male sexual function and behavior. Neurosci Res, 2012. 72(2): p. 103-16.
[21] Truitt, W.A. and L.M. Coolen, Identification of a potential ejaculation generator in the spinal cord. Science, 2002. 297(5586): p. 1566-9.
[22] Giuliano, F. and P. Clement, Pharmacology for the treatment of premature ejaculation. Pharmacol Rev, 2012. 64(3): p. 621-44.
[23] Lenschow, C., S. Copley, J.M. Gardiner, Z.N. Talbot, A. Vitenzon, and M. Brecht, Sexually Monomorphic Maps and Dimorphic Responses in Rat Genital Cortex. Current biology: CB, 2016. 26(1): p. 106-13.
[24] Georgiadis, J.R., R. Kortekaas, R. Kuipers, A. Nieuwenburg, J. Pruim, A.A. Reinders, and G. Holstege, Regional cerebral blood flow changes associated with clitorally induced orgasm in healthy women. Eur J Neurosci, 2006. 24(11): p. 3305-16.
[25] Georgiadis, J.R. and M.L. Kringelbach, The human sexual response cycle: brain imaging evidence linking sex to other pleasures. Progress in neurobiology, 2012. 98(1): p. 49-81.
[26] Pfaus, J.G. and M.M. Heeb, Implications of immediate-early gene induction in the brain following sexual stimulation of female and male rodents. Brain Res Bull, 1997. 44(4): p. 397-407.
[27] Georgiadis, J.R., A.A. Reinders, A.M. Paans, R. Renken, and R. Kortekaas, Men versus women on sexual brain function: prominent differences during tactile genital stimulation, but not during orgasm. Hum Brain Mapp, 2009. 30(10): p. 3089-101.
[28] Kell, C.A., K. von Kriegstein, A. Rosler, A. Kleinschmidt, and H. Laufs, The sensory cortical representation of the human penis: revisiting somatotopy in the male homunculus. J Neurosci, 2005. 25(25): p. 5984-7.
[29] Holstege, G., J.R. Georgiadis, A.M. Paans, L.C. Meiners, F.H. van der Graaf, and A.A. Reinders, Brain activation during human male ejaculation. J Neurosci, 2003. 23(27): p. 9185-93.
[30] Swartout, K.M. and J.W. White, The relationship between drug use and sexual aggression in men across time. J Interpers Violence, 2010. 25(9): p. 1716-35.
[31] Roxburgh, A., L. Degenhardt, J. Copeland, and B. Larance, Drug dependence and associated risks among female street-based sex workers in the greater Sydney area, Australia. Subst Use Misuse, 2008. 43(8-9): p. 1202-17.
[32] Pitchers, K.K., V. Vialou, E.J. Nestler, S.R. Laviolette, M.N. Lehman, and L.M. Coolen, Natural and drug rewards act on common neural plasticity mechanisms with DeltaFosB as a key mediator. J Neurosci, 2013. 33(8): p. 3434-42.
[33] Pitchers, K.K., C.M. Coppens, L.N. Beloate, J. Fuller, S. Van, K.S. Frohmader, S.R. Laviolette, M.N. Lehman, and L.M. Coolen, Endogenous opioid-induced neuroplasticity of dopaminergic neurons in the ventral tegmental area influences natural and opiate reward. J Neurosci, 2014. 34(26): p. 8825-36.
[34] Balfour, M.E., L. Yu, and L.M. Coolen, Sexual behavior and sex-associated environmental cues activate the mesolimbic system in male rats. Neuropsychopharmacology, 2004. 29(4): p. 718-30.
섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 18 / 21
Activation during Male Rat Sexual Behavior Regulates Neuroplasticity and d-Amphetamine Cross-Sensitization following Sex Abstinence. J Neurosci, 2016. 36(38): p. 9949-61.
[36] Beloate, L.N., P.W. Weems, G.R. Casey, I.C. Webb, and L.M. Coolen, Nucleus accumbens NMDA receptor activation regulates amphetamine cross-sensitization and deltaFosB expression following sexual experience in male rats. Neuropharmacology, 2016. 101: p. 154-64.
[37] Frohmader, K.S., K.L. Bateman, M.N. Lehman, and L.M. Coolen, Effects of methamphetamine on sexual performance and compulsive sex behavior in male rats. Psychopharmacology (Berl), 2010. 212(1): p. 93-104. [38] Frohmader, K.S., K.K. Pitchers, M.E. Balfour, and L.M. Coolen, Mixing pleasures: review of the effects of drugs on sex behavior in humans and animal models. Horm Behav, 2010. 58(1): p. 149-62.
[39] Olivier, J.D., T.R. de Jong, P. Jos Dederen, R. van Oorschot, D. Heeren, T. Pattij, M.D. Waldinger, L.M. Coolen, A.R. Cools, B. Olivier, and J.G. Veening, Effects of acute and chronic apomorphine on sex behavior and copulation-induced neural activation in the male rat. Eur J Pharmacol, 2007. 576(1-3): p. 61-76.
[40] Pitchers, K.K., M.E. Balfour, M.N. Lehman, N.M. Richtand, L. Yu, and L.M. Coolen, Neuroplasticity in the mesolimbic system induced by natural reward and subsequent reward abstinence. Biol Psychiatry, 2010. 67(9): p. 872-9.
[41] Kuiper, L.B., L.N. Beloate, B.M. Dupuy, and L.M. Coolen, Drug-taking in a socio-sexual context enhances vulnerability for addiction in male rats. Neuropsychopharmacology, 2018.
[42] Agmo, A., Male rat sexual behavior. Brain Res Brain Res Protoc, 1997. 1(2): p. 203-9.
[43] Pitchers, K.K., K.S. Frohmader, V. Vialou, E. Mouzon, E.J. Nestler, M.N. Lehman, and L.M. Coolen, DeltaFosB in the nucleus accumbens is critical for reinforcing effects of sexual reward. Genes Brain Behav, 2010. 9(7): p. 831-40.
[44] Pitchers, K.K., S. Schmid, A.R. Di Sebastiano, X. Wang, S.R. Laviolette, M.N. Lehman, and L.M. Coolen, Natural reward experience alters AMPA and NMDA receptor distribution and function in the nucleus accumbens. PLoS One, 2012. 7(4): p. e34700.
[45] Kinsey, A., Sexual Behavior in the Human Male, 1948. [46] Kinsey, A., Sexual Behavior in the Human Female 1953.
[47] Masters, W.H. and V.E. Johnson, Human Sexual Response, 1966.
[48] Barfield, R.J., C. Wilson, and P.G. McDonald, Sexual behavior: Extreme reduction of postejaculatory refractory period by midbrain lesions in male rats. Science, 1975. 189(4197): p. 147-9.
[49] Levin, R.J., Revisiting post-ejaculation refractory time-what we know and what we do not know in males and in females. J Sex Med, 2009. 6(9): p. 2376-89.
[50] McIntosh, T.K. and R.J. Barfield, Brain monoaminergic control of male reproductive behavior. II. Dopamine and the post-ejaculatory refractory period. Behav Brain Res, 1984. 12(3): p. 267-73.
[51] Mallick, H.N., S. Tandon, N.R. Jagannathan, K.K. Gulia, and V.M. Kumar, Brain areas activated after ejaculation in healthy young human subjects. Indian J Physiol Pharmacol, 2007. 51(1): p. 81-5.
[52] Dewsbury, D.A., Patterns of copulatory behavior in male mammals. Q Rev Biol, 1972. 47(1): p. 1-33. [53] Rathus, S.A., J.S. Nevid, and F. Rathus, Human sexuality in a world of diversity, 2000.
[54] Wibowo, E. and R.J. Wassersug, Multiple Orgasms in Men-What We Know So Far. Sex Med Rev, 2016. 4(2): p. 136-148.
[55] Dunn, M.E. and J.E. Trost, Male multiple orgasms: a descriptive study. Arch Sex Behav, 1989. 18(5): p. 377-87.
섹스 중독 및 사정 후 허탈감에 관련된 신경생리 메커니즘 연구 동향 김주현 Page 19 / 21
[56] Rosenberg, K.P., P. Carnes, and S. O'Connor, Evaluation and treatment of sex addiction. J Sex Marital Ther, 2014. 40(2): p. 77-91.
[57] Van Gordon, W., E. Shonin, and M.D. Griffiths, Meditation Awareness Training for the Treatment of Sex Addiction: A Case Study. J Behav Addict, 2016. 5(2): p. 363-72.
[58] Assumpcao, A.A., F.D. Garcia, H.D. Garcia, J.M. Bradford, and F. Thibaut, Pharmacologic treatment of paraphilias. Psychiatr Clin North Am, 2014. 37(2): p. 173-81.
[59] Gooren, L.J., Clinical review: Ethical and medical considerations of androgen deprivation treatment of sex offenders. J Clin Endocrinol Metab, 2011. 96(12): p. 3628-37.
[60] Thibaut, F., J.M. Bradford, P. Briken, F. De La Barra, F. Hassler, P. Cosyns, and W.T.F.o.S. Disorders, The World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for the treatment of adolescent sexual offenders with paraphilic disorders. World J Biol Psychiatry, 2016. 17(1): p. 2-38.
[61] Thibaut, F., F. De La Barra, H. Gordon, P. Cosyns, J.M. Bradford, and W.T.F.o.S. Disorders, The World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for the biological treatment of paraphilias. World J Biol Psychiatry, 2010. 11(4): p. 604-55.
[62] Guay, D.R., Drug treatment of paraphilic and nonparaphilic sexual disorders. Clin Ther, 2009. 31(1): p. 1-31. [63] Meston, C.M. and P.F. Frohlich, The neurobiology of sexual function. Arch Gen Psychiatry, 2000. 57(11): p. 1012-30.
[64] Koo, K.C., J.H. Ahn, S.J. Hong, J.W. Lee, and B.H. Chung, Effects of chemical castration on sex offenders in relation to the kinetics of serum testosterone recovery: implications for dosing schedule. J Sex Med, 2014. 11(5): p. 1316-24.
[65] Gallup, G.G., R.L. Burch, and T.J. Mitchell, Semen displacement as a sperm competition strategy: Multiple mating, self-semen displacement, and timing of in-pair copulations. Hum Nat, 2006. 17(3): p. 253-64.
[66] Blackburn, J.R., J.G. Pfaus, and A.G. Phillips, Dopamine functions in appetitive and defensive behaviours. Prog Neurobiol, 1992. 39(3): p. 247-79.
[67] Matsumoto, J., S. Urakawa, E. Hori, M.F. de Araujo, Y. Sakuma, T. Ono, and H. Nishijo, Neuronal responses in the nucleus accumbens shell during sexual behavior in male rats. J Neurosci, 2012. 32(5): p. 1672-86.
[68] Marson, L. and K.E. McKenna, A role for 5-hydroxytryptamine in descending inhibition of spinal sexual reflexes. Exp Brain Res, 1992. 88(2): p. 313-20.
[69] Dean, R.C. and T.F. Lue, Physiology of penile erection and pathophysiology of erectile dysfunction. Urol Clin North Am, 2005. 32(4): p. 379-95, v.
[70] Rowland, D., C.G. McMahon, C. Abdo, J. Chen, E. Jannini, M.D. Waldinger, and T.Y. Ahn, Disorders of orgasm and ejaculation in men. J Sex Med, 2010. 7(4 Pt 2): p. 1668-86.
[71] Georgiadis, J.R., M.J. Farrell, R. Boessen, D.A. Denton, M. Gavrilescu, R. Kortekaas, R.J. Renken, J.M. Hoogduin, and G.F. Egan, Dynamic subcortical blood flow during male sexual activity with ecological validity: a perfusion fMRI study. Neuroimage, 2010. 50(1): p. 208-16.
[72] Kruger, T.H., P. Haake, J. Haverkamp, M. Kramer, M.S. Exton, B. Saller, N. Leygraf, U. Hartmann, and M. Schedlowski, Effects of acute prolactin manipulation on sexual drive and function in males. J Endocrinol, 2003. 179(3): p. 357-65.
[73] Franks, S. and H.S. Jacobs, Hyperprolactinaemia. Clin Endocrinol Metab, 1983. 12(3): p. 641-68.
[74] El-Sakka, A.I., H.M. Hassoba, H.M. Sayed, and K.A. Tayeb, Pattern of endocrinal changes in patients with sexual dysfunction. J Sex Med, 2005. 2(4): p. 551-8.