접수: 2014년 2월 21일, 승인: 2014년 5월 28일 연락처: 박병주, 110-750, 서울시 종로구 창경궁로 136
보령빌딩 5층 한국의약품안전관리원
Tel: (02) 2172-6710, Fax: (02) 2172-6701 E-mail: bjpark@drugsafe.or.kr
Correspondence to: Byung-Joo Park, MD, MPH, PhD Korea Institute of Drug Safety and Risk Management, 5th Fl., Boryung Building, 136, Changgyeunggung-ro, Jongro-gu, Seoul 110-750, Korea
Tel: +82-2-2172-6710, Fax: +82-2-2172-6701 E-mail: bjpark@drugsafe.or.kr
미국 FDA의 의약품안전관리체계 변화: 로페콕시브 안전성 사건 이후
한국의약품안전관리원1, 서울대학교 의과대학 예방의학교실2
최은미1ㆍ정현주1ㆍ정선영1ㆍ박병주1,2
Change in Drug Safety Management by U.S. FDA after Rofecoxib Safety Issue
Eunmi Choi, MPH
1, Hyun-Joo Jung, PhD
1, Sun-Young Jung, PhD
1and Byung-Joo Park, MD, MPH, PhD
1,21
Korea Institute of Drug Safety and Risk Management,
2Department of Preventive Medicine, Seoul National University College of Medicine, Seoul, Korea
Despite rigorous pre-marketing drug evaluation processes, safety issues about unsuspected adverse drug reactions are often raised in the post marketing phase. A notable example is a ‘rofecoxib’; pharmacoepidemiological studies confirmed that there was an association between the use of rofecoxib and the risk of cardiovascular events. After the withdrawal of rofecoxib from the market. In response to growing public concerns with the health threat posed by approved drugs, the U.S. Food and Drug Administration (FDA) asked the Institute of Medicine (IOM) to as- sess the post marketing surveillance system and provide how FDA can improve their drug safety management system. On September 2006, the IOM released a report entitled “The Future of Drug Safety - Promoting and Protecting the Health of the Public”. This report offered the suggestions to reinforce the FDA’s drug safety man- agement program. In response to the IOM report, the FDA released a statement entitled “The FDA’s responses”
in 2007 that included a plan of action to address the recommendations in the report. To transform drug safety system, the FDA planed to strengthen methods and tools of safety surveillance through the implementation of
‘Sentinel Initiative’ and issuing guidance on epidemiology best practices. As a result, FDA has operated the Mini- Sentinel and Observational Medical Outcomes Partnership (OMOP) from 2009 and developed a guideline for the Best Practices for Conducting and Reporting Pharmacoepidemiologic Safety Studies Using Electronic Healthcare Data in 2013. This review provides us with the insight on the US FDA’s recent changes in drug safety manage- ment system after the rofecoxib safety issue. (JPERM 2014;7:17-27)
Key Words: Drug safety management; Pharmacoepidemiology; Rofecoxib
서 론
의약품이 시판된 이후 다양한 인구 집단에서 오랜 기간 사용되면서, 시판 전 임상시험 과정에서 발견되지 않았던 중대한 부작용 발생으로 시장에서 퇴출되는 경우가 있다.
시판 전 임상시험자료는 소아, 노인, 특정질환자 등 취약한 인구집단을 배제하는 경우가 많고, 환자의 동반질환이나 병 용약물이 고려되지 않는 경우가 많으며, 제한적인 수의 피 험자를 대상으로 임상시험이 이루어지므로 일반적인 임상 상황을 충분히 반영하지 못하는 경우가 많기 때문이다.
1)따 라서 의약품 안전성 확보를 위하여 ‘시판 후 감시’의 중요 성이 부각되고 있다.
시판 후 감시 방법 중 하나로 자발적 부작용보고를 통한 조사가 있다. 국내 부작용보고제도는 1988년에 도입된 후 10년간 연간 총 보고건수가 100건이 되지 않았다. 식품의약 품안전청(현, 식품의약품안전처)의 여러 노력에도 불구하고 연간 부작용보고 건수는 2000년 264건, 2005년 1,400건으로 저조하였으나, 2006년 지역약물감시센터 지정사업을 시작 한 이후 2008년 12,796건, 2010년 64,143건, 2012년 92,615건 으로 꾸준히 증가하고 있으며, 2013년 상반기에 보고된 건 수는 2012년 같은 기간(43,028건)에 비해 98.8% 증가하여 85,529건이었다.
2)의약품 부작용에 대한 자발적 보고가 증 가하는 것은 바람직하지만, 자발적 부작용 보고만으로 의약 품안전성을 평가하는 데에는 많은 한계점이 존재한다. 실제 발생하는 유해사례 중 일부만 보고될 수 있는 한계가 있기 때문에 해당 의약품을 복용한 후 발생하는 전체 부작용의 양상을 파악할 수 없다. 즉, 부작용 보고 건과 해당 의약품 복용자를 완전히 파악할 수 없으므로 부작용의 발생률을 산 출할 수 없어, 실제 환자들에게서 발생한 위험정도 및 의약 품-부작용간 인과관계를 객관적으로 평가하기에는 어려움 이 있다. 또한 부작용 보고자료 자체의 신뢰도가 낮아 자료 의 질을 보장하기 어렵다.
의약품은 본질상 약효와 부작용을 필연적으로 동반한다.
실제로 시사프라이드(2000년 시판중지), 페닐프로파놀아민 (2004년 시판중지), 테가세로드(심장발작 부작용으로 2004년 시판중지 후 제한적 사용, 뇌졸중 부작용으로 2007년 시판 중지), 시부트라민(2010년 시판중지) 등이 부작용으로 인하 여 시판 철회 되었고, 미국에서만 50여 개 이상의 약물들이 시판후 예기치 않았던 중대한 부작용이 드러나 시장에서 철 회 되었다. 특히, 로페콕시브(rofecoxib)는 1999년 미국 식품 의약품안전국(FDA)에서 관절염치료제로 승인 후 많은 환자 들에게 널리 사용되다가 심근경색증 등 심장병을 일으키는 것으로 판정되어 결국 2004년에 시판철회 되었다.
3)철회되 기 전 5년 동안 전 세계적으로 8천만 명 이상이 복용하였던 신약으로서 그 피해는 상당하였다.
국내에서도 “로페콕시브제제(상품명: 바이옥스정)”는 1999 년 9월 2일에 골관절염의 증상 및 증후 완화, 급성 통증 완 화(수술 또는 발치 후 진통), 원발성 월경곤란증의 치료, 성 인의 류마티스성 관절염 증상 및 증후 완화에 복용하도록 허가되었으며 이후 짧은 기간 동안에 많은 처방이 이루어져 왔다. 식약청(현, 식약처)은 2004년 10월 1일 동 제제에 대하 여 “의약품안전성속보(Alert)”를 배포하였다. 동 제제의 복 용에 따라 심근경색증ㆍ심장발작ㆍ뇌졸중 등 심혈관계 부 작용의 발생이 증가한다는 미국의 FDA정보에 대하여, 2004 년 10월 1일 당해 품목을 자진 취하하고, 판매ㆍ공급을 자 발적으로 중단(recall)키로 하였다. 시중유통 중인 동 제품에 대하여는 2004년 11월 30일까지 회수 완료하고, 향후 동 제 제를 허가제한성분으로 관리하도록 하였다.
4)로페콕시브가 퇴출된 이후 의약품안전관리에 많은 관심 을 갖게 되었으며, 그 일환으로 대규모 자료원을 이용한 약 물역학연구가 활발히 수행되는 계기가 되었다. 오늘날에는
‘빅데이터’라는 시류에 발맞추어 의약품 안전과 관련된 대 규모 자료원을 체계적으로 분석하는 새로운 차원의 의약품 부작용 연구를 기대하고 있다. 여기서 대규모자료원은 행정 목적으로 개발되어 있는 생정통계자료 등의 데이터베이스, 의료보험단체에 청구된 진료명세서 데이터베이스, 의료기 관에서 환자에 대한 각종 임상검사, 진단, 수술, 약물처방 등의 진료내용을 담은 데이터베이스, 암등록자료와 같은 질 병등록 데이터베이스 등 기 구축된 데이터베이스로서, 의약 품안전성평가를 위한 약물사용, 부작용발생, 환자특성, 보정 변수 등의 정보가 포함되어 있는 자료원을 의미한다. 대규 모자료원은 대규모 인구집단을 대상으로 하므로, 드물게 발 생하는 약물부작용에 대한 약물역학연구를 가능하게 하며, 연구비용과 기간을 줄일 수 있다는 있다는 장점이 있다. 한 편, 내적ㆍ외적 타당도가 떨어지고, 중요한 교란변수에 대 한 정보가 부족하며, 약물처방 정보가 복용과 완전히 일치 하지 않을 수 있다는 제한점이 있다.
5)우리나라는 1989년부 터 전국민의료보험제도를 실시하여 모든 국민의 의료중재 와 질병진단에 관련된 데이터가 국민건강보험공단과 건강 보험심사평가원에 주민등록번호에 따라 개인별로 잘 수집 되어 있고, 사망원인통계자료도 통계청에서 체계적으로 잘 구축하고 있으며, 국립암센터를 주축으로 구축 운영하고 있 는 중앙암등록자료를 비롯하여 각 의료기관에는 전자의무 기록체계 역시 잘 갖추어져 있다.
따라서, 본 고에서는 의학과 약학을 포함한 보건학 전반
의 관련업무 종사자들에게 로페콕시브와 심장질환 발생을
규명하는 국외 약물역학연구 사례를 소개하고, 이로 인한
미국 FDA의 의약품안전관리체계 변화를 살펴봄으로써 우
리나라 의약품안전관리체계의 발전방향을 모색하여 보고자
한다.
본 론
1. 로페콕시브와 심혈관계질환 관련성에 대한 약물역학 연구
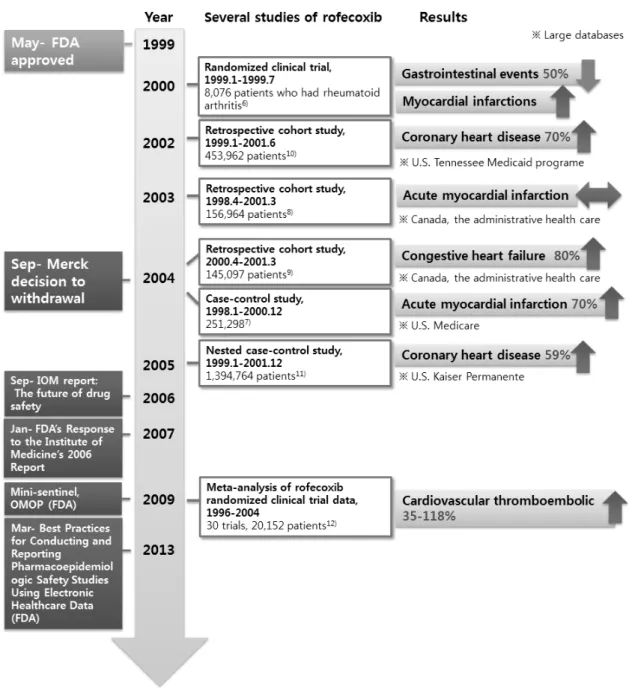
로페콕시브는 엄격한 시판 전 임상시험을 거쳐, 1999년 5 월 미국 FDA의 시판허가를 받은 진통제로서 골관절염, 생 리통 등에 사용되었다. 이 약은 선택적 COX-2 억제제(cyclo- oxygenase type 2 inhibitors)로서 COX-1 억제로 인한 위장관 계 부작용을 최소화 한다는 장점이 부각되며, 시판 후 5년 동안 전 세계적으로 8천만 명이 복용하였던 대중적인 신약 이었다. 그러나 2004년 심근경색증 등 심장병 발생위험이 밝혀지며 퇴출되었다(그림 1).
1999년 1월 대규모 무작위배정 임상시험인 VIGOR (Vioxx Gastrointestinal Outcomes Research) 연구가 로페콕시브 성분 의 약물인 바이옥스를 판매한 제약사 머크사에 의하여 착수 되었다. 같은 해 5월 FDA의 승인을 받고 미국 내에서 처방 이 시작되었으며, 11월과 12월에는 VIGOR 연구의 DSMB (Data and Safety Monitoring Board) 회의에서 바이옥스 복용 군에서 중대한 심장부작용 발생률이 나프록센 복용군에 비 하여 2배 높음을 확인하였다. 1999년 1월부터 7월까지의 VIGOR 연구결과가 NEJM (New England Journal of Medi- cine)에 게재되었다. 이 연구는 로페콕시브의 안전성에 대한 최초의 연구로서, 연구 결과 로페콕시브 복용환자에서 위장 및 십이지장 출혈 발생이 나프록센 복용군에 비하여 0.5배 유의하게 낮았고, 심근경색증 발생위험은 로페콕시브 복용 군에 비하여 나프록센 복용군이 0.2배로 낮았다고 보고하였 다(상대위험도, 0.2; 95% 신뢰구간, 0.1-0.7). 반면, 이 약에 의한 일부 심혈관계 부작용 결과는 누락되었다.
6)이어서 로 페콕시브와 심혈관계질환의 관련성에 대하여 환자-대조군 연구, 코호트연구, 코호트내 환자-대조군연구, 메타분석연구 등 연구결과가 발표되었다(표 1). 미국의 메디케어자료를 기 반으로 한 환자-대조군연구에서, 로페콕시브 현재 복용자는 셀레콕시브 복용자에 비해 급성심근경색증 발생위험이 1.24 배 높았고(대응위험도, 1.24; 95% CI, 1.05-1.46) 비스테로이 드성소염진통제(Non-steroidal anti-inflammatory drug, NSAIDs) 비복용자에 비해 1.14배 높았다는 결과를 보고하였다(대응 위험도, 1.14; 95% CI, 1.00-1.31).
7)2003년 캐나다 온타리오 주의 건강보험자료를 대상으로 수행된 코호트연구 결과, NSAIDs 처방력이 없는 사람에 비하여 급성심근경색증 발 생위험도는 셀레콕시브 복용자 0.9배(상대위험도, 0.9; 95%
CI, 0.7-1.2), 로페콕시브 복용자 1.0배(상대위험도, 95% CI, 0.8-1.4), 나프록센 복용자 1.0배(상대위험도, 95% CI, 0.6-1.7) 로 나타났다.
8)이어서 2004년 같은 자료원을 이용한 코호트 연구에서는 비선택적 NSAIDs 복용군과 비교시 로페콕시브 복용군에서 울혈성심부전증으로 인한 입원 위험이 1.5배 높
았다(상대위험도, 1.5; 95% 신뢰구간, 1.1-2.1).
9)또 다른 코 호트연구는 미국 테네시주 메디케이드자료를 이용하여 코 호트연구를 수행하였을 때, 당시 로페콕시브를 고용량으로 복용하고 있던 대상자는 비복용자에 비해 관상동맥질환 위 험이 1.7배(상대위험도, 1.7; 95% 신뢰구간, 1.0-3.0), 새롭게 로페콕시브를 고용량으로 복용하고 있던 대상자는 비복용 자에 비해 관상동맥질환 위험이 1.9배 높았고(상대위험도, 1.9; 95% 신뢰구간, 1.1-3.4), 셀레콕시브 복용자에 비해 2.2 배 높았다.
10)미국의 카이저퍼머넌트사 보험청구자료를 이 용한 2005년 코호트내 환자-대조군연구 결과에 따르면, 셀 레콕시브에 비하여, 로페콕시브 모든 용량에서 1.59배(대응 위험도, 1.59; 95% 신뢰구간, 1.10-2.32), 로페콕시브 25 mg/
day 이하에서 1.5배, 로페콕시브 25 mg/day 이상에서 3.58배 (대응위험도, 3.58; 신뢰구간, 1.27-10.11) 관상동맥질환 발생 위험이 높았다.
11)기존의 선행 임상시험연구들을 바탕으로 메타분석도 다수 이루어졌는데, 이 중 한 연구에 따르면 관 련된 30개 무작위배정 비교임상시험들을 통합분석한 결과, 위약군에 비하여 로페콕시브 복용군에서 허혈성심혈관계질 환 발생위험이 2.18배 높았다(상대위험도, 2.18; 95% 신뢰구 간, 0.93-2.18).
12)이와 같이, 다수의 약물역학연구를 통하여 로페콕시브 복용 이후 급성심근경색증, 울혈성심부전증, 관 상동맥질환, 허혈섬심혈관계 질환의 위험이 증가하며, 이는 용량-반응관계(dose-response relationship)를 보인다는 것이 지속적으로 보고되었고, 이러한 연구결과에 기반하여 FDA 에서는 로페콕시브의 시판철회를 결정하게 되었다.
로페콕시브의 안전성 이슈는 시판후 안전성관리체계를 재조명하게 되었다는 의의를 갖는다. 기존 의약품안전관리 체계는 자발적 유해사례 보고에 의존하고 있었으나, 유해사 례 보고건수가 불충분하고, 유해사례 보고 검토방법의 의견 이 충돌되며, 중앙집중 데이터의 보고 및 분석에 한계가 있 다는 등의 기존의 의약품안전관리체계의 문제점들이 제기 되었고, 따라서 보다 포괄적이고 능동적인 안전관리의 필요 성이 부각되었다. 이후 미국에서는 다음과 같은 의약품안전 관리체계에 변화가 이루어지게 되었다.
2. 미국 의약품 시판 후 안전관리체계 변화
1) 시판 후 안전관리체계 강화요구 증대에 따른 미국정 부의 대응
과학기술의 발전으로 인하여 효과적인 신약 개발이 활발 히 이루어졌으나 21세기에 들어서면서 의약품 안전성 이슈 가 새롭게 주목받게 되면서, FDA는 의약품 시판철회, 중대 한 위험에 대한 뒤늦은 경고, 안전성에 근거하지 않은 의약 품 승인 등으로 대중의 신뢰를 잃었다는 비판을 받았다.
FDA는 신약 승인 절차와 승인 후의 안전성 모니터링 수행
이 제대로 이루어지고 있지 못하다는 이유로 비난을 받게
Figure 1. The outline of withdrawal rofecoxib and some studies of cardiovascular risk associated with rofecoxib. <출처> Bombardier C, Laine L, Reicin A, et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. N Engl J Med. 2000;343:1520-8.6) Ray WA, Stein CM, Daugherty JR et al. COX-2 selective non-steroidal anti-inflammatory drugs and risk of serious coronary heart disease. Lancet 2002;360:1071-3.7) Mamdani M, Rochon P, Juurlink DN et al. Effect of Selective Cyclooxyge- nase 2 Inhibitors and Naproxen on Short-term Risk of Acute Myocardial Infarction in the Elderly. ARCH INTERN MED. 2003;163:
481-6.8) Mamdani, M, Juurlink, D. N, Lee, D. S. et al. Cyclo-oxygenase-2 inhibitors versus non-selective non-steroidal anti-inflammatory drugs and congestive heart failure outcomes in elderly patients: a population-based cohort study. Lancet 2004;363:1751-6.9) Solomon DH, Schneeweiss S, Glynn RJ et al. Relationship between selective cyclooxygenase-2 inhibitors and acute myocardial infarction in older adults. Circulation. 109(17):2068-73.10) Graham DJ, Campen D, Hui R. et al. Risk of acute myocardial infarction and sudden cardiac death in patients treated with cyclo-oxygenase 2 selective and non-selective non-steroidal anti-inflammatory drugs: nested case-control study. Lancet 2005;365:475-81.11) Ross JS, Madigan D, Hill KP. et al. Pooled Analysis of Rofecoxib Placebo-Controlled Clinical Trial Data Lessons for Postmarket Pharmaceutical Safety Surveillance. Arch Intern Med. 2009;169(21):1976-85.12)
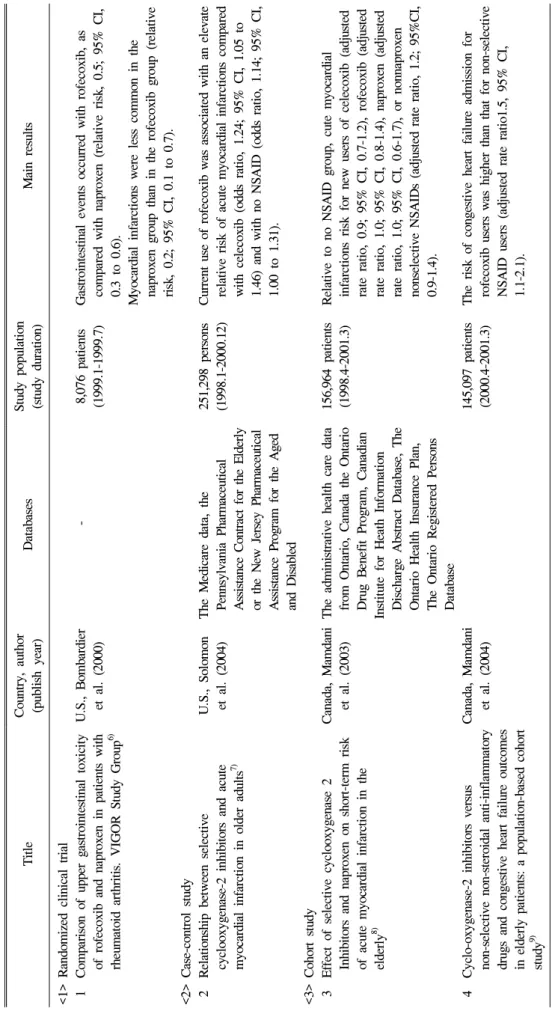
Ti tl e Co un tr y, a ut ho r (pub li sh ye ar ) Da ta ba se s St ud y popu la ti on (s tudy d ur at io n) M ai n res ults <1> R and om iz ed c li ni ca l tr ia l 1 C om pa ri so n of upp er g as tr oi nt est inal t oxi ci ty of r of ec ox ib a nd napr oxen in p at ie nt s w it h rh eu m at oi d ar thr it is . VI G O R St udy Gr ou p
6)U .S ., B om ba rd ier et a l. (20 00) - 8, 076 p at ie nt s (19 99. 1- 19 99. 7) Ga st ro in te st in al e ve nt s oc cu rr ed wi th r of ec ox ib , as com pa red w it h napr ox en ( re la ti ve ri sk, 0 .5 ; 95% C I, 0. 3 to 0. 6) . M yo car di al i nf ar ct io ns w er e le ss com m on in t he napr ox en gr ou p than in t he rof ec ox ib gr ou p (r el at ive ri sk, 0 .2 ; 95% C I, 0. 1 to 0. 7) . < 2> C ase-co nt ro l st ud y 2 R el at io ns hi p bet w een sel ect iv e cy cl oo xyg en as e- 2 inhi bi to rs a nd acut e m yo cardi al i nfar ct io n in o ld er a du lt s
7)U. S ., S ol omo n et a l. (20 04) T he M ed icar e da ta, t he P enn sy lv an ia P ha rm ac eut ical A ss is ta nc e C on tra ct fo r th e E ld erly or t he N ew J er sey Ph ar m ace ut ic al A ss is ta nc e P ro gr am f or t he A ge d and D is abl ed
251, 29 8 pe rs ons (1 998 .1 -2 000 .1 2) C urre nt u se o f rofec oxi b w as as soci at ed w it h an el evat e rela tiv e ris k of a cu te m yo ca rd ia l in farc tio ns co m pare d w it h cel ec ox ib ( odd s ra ti o, 1. 24; 9 5% C I, 1. 05 to 1. 46 ) and w it h no N S AI D ( odds rat io, 1. 14 ; 95% C I, 1. 00 t o 1. 31) . <3> C ohor t st ud y 3 E ff ec t of s el ec ti ve c yc lo ox yge na se 2 In hi bi to rs a nd napr ox en on s hor t- te rm r is k of a cu te m yo ca rd ia l i nf ar ct io n i n t he eld erl y
8)C anada, M am dani et a l. (20 03) T he ad m ini st ra ti ve he al th car e dat a fr om O nt ar io , C ana da t he O nt ar io Dr ug B en ef it P ro gr am , C ana di an In stitu te f or H eath In fo rm atio n D ischar ge A bst rac t D at abase , T he O nt ar io H ea lt h Insur ance P la n, T he O nt ari o R eg is te red P ers on s Da ta ba se
156, 96 4 pa ti en ts (19 98. 4- 20 01. 3) R el at iv e to no N SA ID g roup , cu te m yocar di al in fa rc ti on s ri sk for n ew u se rs o f ce le co xi b (a dj ust ed ra te r at io, 0. 9; 9 5% C I, 0. 7- 1. 2) , ro fecoxi b (a dj ust ed ra te r at io, 1. 0; 9 5% C I, 0. 8- 1. 4) , napr oxen (a dj ust ed ra te r at io, 1. 0; 9 5% C I, 0. 6- 1. 7) , or no nnapr ox en no nse lec ti ve N S A ID s (adj ust ed r at e rat io, 1 .2 ; 95 % C I, 0. 9- 1. 4) . 4 C ycl o- oxyg en as e- 2 inhi bi to rs v er sus no n-s el ec tiv e no n-s tero id al a nti-in flam m at ory dr ugs and co ngest iv e hear t fa il ur e out com es in el de rl y pa ti ent s: a p op ul at io n- ba se d co ho rt stu dy
9)C anada, M am dani et a l. (20 04) 145, 09 7 pa ti en ts (20 00. 4- 20 01. 3) T he ri sk o f con ges ti ve hear t fai lure adm iss io n for ro fe cox ib user s w as hi gher t han that f or no n- se le ct iv e NS AI D us er s (a dj us te d ra te r at io 1. 5, 9 5% C I, 1. 1- 2. 1) .
Ta b le 1 . A n ove rv ie w o f st ud ie s ab ou t ro fe co xi b sa fe ty is su e
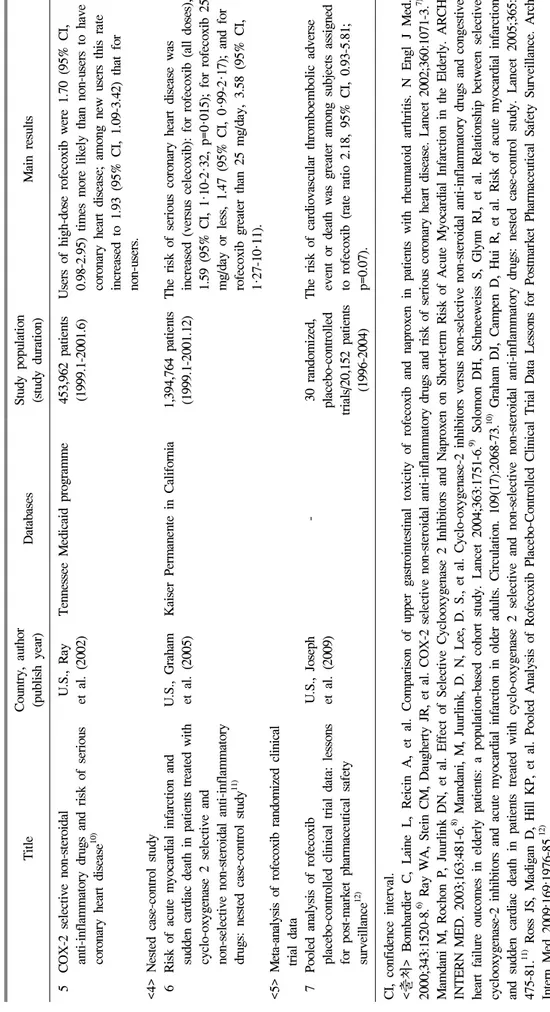
Ti tl e Co un tr y, a ut ho r (pub li sh ye ar ) Da ta ba se s St ud y popu la ti on (s tudy d ur at io n) M ai n res ults 5 C O X -2 sel ect iv e non-st eroi dal an ti -i nf la m m at or y d ru gs a nd r is k o f se ri ou s co ro na ry h ea rt di se as e
10)U .S ., R ay et a l. (20 02) Tenn esse e M ed icai d pr og ra m m e 453, 96 2 pa ti en ts (19 99. 1- 20 01. 6) User s of h igh- do se r of ec ox ib w er e 1. 70 ( 95 % C I, 0. 98 -2 .9 5) t im es m or e li kel y than non -u se rs t o have co ro na ry h eart d isease; am on g new u sers th is rat e in cr ea se d to 1. 93 (9 5% C I, 1 .0 9- 3. 42 ) th at f or no n- use rs. < 4> N es ted c as e- co nt ro l stu dy 6 R is k of ac ut e m yocar di al i nfa rct io n and su dden ca rd ia c deat h in p at ie nt s tr ea te d w it h cy cl o- ox ygenase 2 s el ect iv e and no n-s el ec tiv e no n-s tero id al a nti-in flam m at ory dr ugs: nest ed case -cont ro l st ud y
11)U. S ., Gr ah am et a l. (20 05) K ai se r P er m an en te in C al if or ni a 1, 394, 76 4 pa ti en ts (1 999 .1 -2 001 .1 2) T he ri sk o f ser iou s co ro nar y hear t di sea se w as in cr eas ed (v ersus ce lec ox ib ): f or r of ecoxi b (al l doses ), 1. 59 ( 95% C I, 1 ·10 -2 ·32, p =0 ·01 5) ; for r of ec oxi b 25 m g/ da y o r l es s, 1 .4 7 ( 95 % C I, 0 ·99 -2 ·17 ); a nd f or rof ecox ib gr ea te r th an 25 m g/ da y, 3. 58 (9 5% C I, 1· 27 -1 0· 11) . < 5> M et a- an al ys is of r of ecoxi b ra ndo m ized cl in ical t ri al d at a 7 P oo le d an al ysi s of r of ecox ib pl acebo- cont ro ll ed cl ini ca l tr ia l dat a: l es son s fo r post -m arket p ha rm ace ut ic al saf et y su rv ei ll ance
12)U .S ., Jo se ph et a l. (20 09) - 30 ra nd om iz ed , pl ac ebo -con trol le d tr ia ls /2 0, 152 pat ie nt s (19 96- 20 04)
T he ri sk o f car di ov as cul ar t hr om bo em bol ic a dv er se event or de at h w as g re at er am ong su bj ect s assi gn ed to r of ec ox ib ( ra te r at io 2 .1 8, 9 5% C I, 0 .9 3- 5. 81 ; p= 0. 07) . C I, co nf id en ce i nt er val. < 출처 > B om bar di er C , L ai ne L , R ei ci n A , et al . C om par is on of upp er gas tr oi nt es ti na l to xi ci ty of rof ec oxi b an d napr oxen in pat ie nt s w it h rheum at oi d ar th ri ti s. N En gl J M ed. 200 0; 343 :1 520 -8 .
6)R ay W A , S te in C M , D au gh er ty J R , et a l. C O X -2 s el ec ti ve n on -s te ro id al an ti-in fl am m ato ry d ru gs a nd r is k of s erio us co ro na ry h ea rt di seas e. L an ce t 20 02; 36 0: 107 1- 3.
7)M am da ni M , R oc ho n P , Ju url in k D N , et al. E ffec t of Se lec ti ve C yc loo xyg en as e 2 Inhi bi to rs a nd N apr ox en on S ho rt -t er m R isk of A cut e M yoca rdi al I nf ar ct ion in t he E ld er ly . A R C H IN TE R N M ED . 2003 ;1 63: 48 1- 6.
8)M am dani , M , Juu rl ink, D . N , L ee, D . S. , et a l. C ycl o- oxyg en as e- 2 inh ib it or s ver sus non -s el ect iv e no n- st er oi da l an ti -i nf la m m at or y dr ug s and con ges ti ve he art fa il ur e ou tc om es i n eld er ly p atien ts : a po pu la tio n- bas ed c ohor t st ud y. L an ce t 200 4; 363 :1 751 -6 .
9)S ol om on D H, S chn eew ei ss S , G lynn R J, e t al . R el at ionshi p be tw een se lec ti ve cy clo ox yg en as e- 2 in hib ito rs an d ac ute m yo ca rd ial in fa rc ti on in ol der a dul ts . C ir cu lat io n. 10 9( 17) :206 8- 73.
10)G ra ha m D J, C am pe n D , H ui R , e t al . R is k o f ac ut e m yo ca rd ia l in fa rctio n an d su dden ca rd ia c dea th in pa ti en ts tr ea te d w it h cycl o- oxyg en ase 2 se lec ti ve and no n-s el ect iv e no n-s ter oi da l ant i- in fl am m at or y dr ug s: nes te d ca se -c ont ro l st udy. L ance t 2005 ;3 65: 475 -8 1.
11)R os s J S , M ad ig an D , H il l K P , e t a l. P oo le d A na ly si s o f R of ec ox ib P lace bo -C on tr ol le d C li ni cal T ri al D at a L ess on s fo r P ost m ar ke t P har m aceut ical S af et y S urvei ll an ce. A rch In te rn M ed 20 09; 16 9: 197 6- 85.
12)Ta b le 1 . C on ti nu ed
되었고, 이는 FDA가 의약품 안전성 관련 제도를 재정비하게 되는 계기가 되었다.
13)특히 로페콕시브를 비롯하여 발데콕 시브, 트로글리타존, 프로펄시드, 세리바스타틴 등은 각각 2004년 9월, 2005년 4월, 2000년 3월, 2000년 3월, 2001년 8 월에 전면 시판 철회되었으며 셀레콕시브와 다른 비선택적 NSAIDs는 경고문을 삽입한 것이 촉진제 역할을 하였다.
이와 관련한 안전성 문제에 대한 관심이 증대되면서 2004 년과 2005년에 미국 FDA와 보건부는 의약품 안전성 대책을 발표하였다. 2005년 미국 학술원(National Academies)의 의학 분과에 해당하는 의학한림원(Institute of Medicine, IOM)은 FDA로부터 의약품 안전성 보장을 강화하기 위하여 미국의 의약품안전관리시스템을 평가하도록 임시 전문가패널을 구 성해달라는 요청을 받았고, 이에 따라 의약품의 위해평가, 감시 및 안전한 사용을 향상시키는데 필요한 연구를 의뢰받 았다.
2006년 9월 22일 IOM은 ‘의약품 안전의 미래: 공공의 건 강증진과 건강보호(The Future of Drug Safety - Promoting and Protecting Health of the Public)’라는 보고서를 발표하였 다. 이 보고서는 FDA의 요청에 따라 미국의 의약품 안전관 리 체계를 평가한 후 ‘FDA에서 취해야 할 안전성 향상 조 치 권고안’을 제시하였는데, 이에 대하여 FDA는 2007년 1 월 대응 조치에 대한 계획을 담은 보고서 ‘IOM 권고에 대 한 FDA의 대처(FDA’s Response to the Institute of Medicine’s 2006 Report)’을 발표하였다. FDA가 의약품 안전 프로그램 을 어떻게 개선하며 다른 정부기관이 의약품의 안전사용 시 스템을 위해 무엇을 해야 할 지에 대하여 실적적인 제언을 하였으며 총 7장으로 구성되어 있다.
13)후속조치로 센티넬 이니셔티브(Sentinel Initiative)의 일환인 미니센티넬과 OMOP (Observational Medical Outcomes Partnership), 전자보건의료 데이터를 이용한 약물역학연구 수행지침서 개발 및 배포 등 을 내세웠다. 특히, 대규모 자료원 활용을 적극적으로 권장 하였다는 점을 주목할 필요가 있다.
2) IOM 권고에 대한 FDA의 대처: FDA’s Response to the Institute of Medicine’s 2006 Report
14)‘FDA에서 취해야 할 안전성 향상 조치 권고안’을 담은 IOM 보고서(2006년 9월 발표)에 따라, FDA에서는 권고 대 응조치에 대한 계획을 발표하였다. 이는 IOM 권고가 FDA 의 의약품 안전성에 대한 의견과 일치한다고 판단하였기 때 문이다. FDA는 의약품안전관리시스템의 개혁을 위하여, IOM 권고안을 크게 아래와 같이 3가지로 구성하였다. 첫째, 의약품 안전성 관련 시스템을 지원하는 과학의 강화, 둘째, 의사소통 및 정보흐름 효율화, 셋째, 의약품 안전성 관련 시 스템의 운영 및 관리 향상 등이다.
(1) 의약품 안전성 관련 시스템을 지원하는 과학의 강
화: 의약품의 시판 전 임상시험이나 개발단계부터 시판 후 감시 및 위해관리까지, 제품개발 및 유통과 관련된 모든 단 계에서 의약품 안전관리시스템을 지원하는 과학을 강화하 고 있으며, 크게 세 가지로 나누어진다. 첫 번째는 위해-이 익 분석과 위해관리방법을 향상시키는 것, 두 번째는 안전 성 감시수단과 방법을 강화시키는 것, 세 번째는 유해사례 를 발견, 이해, 예측, 예방하기 위한 새로운 과학적 방법을 개발하는 것이다. 특히, 두 번째 제시 된 안전성 감시수단 및 방법의 일환으로 의약품의 개발부터 유통 등 전 과정에 걸쳐 유해사례정보를 수집하여 공중보건 이익을 극대화할 것이며, 유해사례 자발보고시스템(AERS II)를 발전시켜야 한다고 주장하였다. 안전성관리를 위한 데이터베이스를 확 장할 것과 센티넬 네트워크를 제안하였고, 약물역학연구 우 수사례에 대한 가이드라인을 개발하고, 배포할 것을 제안하 였다. 센티넬 네트워크는 치료 시점에서 의료 전문가와 환 자에게 의료 제품에 대한 안전성 정보의 수집, 분석, 보급을 가능하게 하기 위해, 기존에 있는 혹은 계획 단계의 데이터 베이스와 민간 및 공공 부문의 데이터베이스를 통합하는 시 스템이다.
(2) 의사소통 및 정보흐름 효율화: 의사소통 및 정보흐 름 향상은 의약품안전관리체계의 효율성을 증진시킬 수 있 다. 이를 위해 FDA는 다음과 같은 노력을 추진하기로 약속 하였다. 당시 사용되는 의사소통 도구의 광범위한 검토 및 평가 수행, 의사소통 정책과 수행을 향상시킬 수 있도록 자 문위원회 재설립, 안전성 문제 관련 각계 전문가 사이의 원 활한 의사소통을 위한 지속적인 재원 투자, 의약품 안전성 정보가이드라인 발표, 시판 후 의약품 안전성 검토에 대한 정기간행물 출판, 신약허가신청 보충자료 사후검토 및 시판 후 안전성을 평가하는 약물역학연구 실시 등이다.
(3) 의약품 안전성 관련 시스템의 운영 및 관리 향상: 미 국 의약품안전관리체계를 강화하기 위하여 검토, 분석, 자 문 및 의사소통 과정을 원활히 이행할 수 있도록 노력하였 다. CDER는 의약품안전관리체계 발전을 위하여 Office of Surveillance and Epidemiology (OSE) 및 Office of New Drug (OND) 등을 포함한 다양한 조직에 있는 직원들을 모아 팀 을 만들었다. CDER 내 각 OND 검토 부서에 안전성 규제 프로젝트 매니저(Safety Regulatory Project Manager) 및 안전 성 Associate Director를 신설하였다. FDA는 의약품안전관리 체계에 지속적으로 영향을 주기 위한 노력과 지원을 제공할 것이라고 밝혔다.
또한, CDER가 CDER/FDA의 조직 문화 향상을 위한 광범
위한 전략을 개발하는데 도움을 주기 위하여 외부 관리 자
문진들과도 협조하고 있다. FDA에서 안전성 문제를 담당하
는 개인을 조직이 어떻게 지원할 것인지를 향상시키기 위하
여 계속적으로 논의하고 있으며, 변화를 위한 추가적인 기
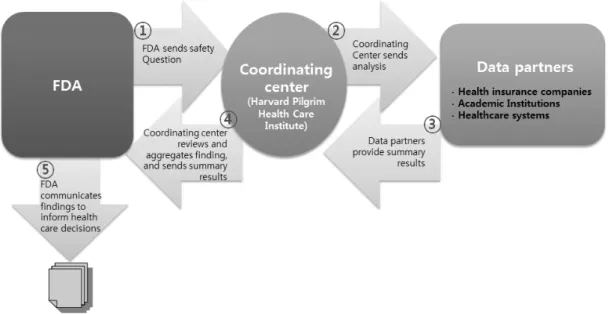
Figure 2. Figure overview of the mini-sentinel safety question evaluation process. Silver Spring: US Food and Drug Administration;
2011. <출처> 최남경, 이중엽, 박병주. 의약품 안전관리의 최신 국제동향. J Korean Med Assoc 2012;55(9):819-263). U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER), Best Practices for Conducting and Reporting Pharmacoepidemiologic Safety Studies Using Electronic Healthcare Data. 2013.20)
회를 확인하는데 도움을 주고 필요한 변화들을 수행하는데 도움을 주기 위하여 외부 전문가들의 도움을 받도록 하였 다.
3) FDA 대규모 자료원을 활용한 시판 후 안전관리체계 변화
(1) 센티넬 이니셔티브(Sentinel Initiative): FDA강화 법(FDA Amendments Act, FDAAA)이 2007년 제정, 통과된 이후 구체화되었다. 해당 법률은 국가 전자시스템인 센티넬 이니셔티브의 운영을 의무화하고, 의약품 시판 후 조사의 강화, 소비자의 보호를 위한 FDA 역할에 대해 명시하고 있 으며, 재정의 확보, 자료의 접근성 강화에 대한 내용으로 구 성되어있다. 2008년 5월 FDA는 센티넬 이니셔티브를 시작 하였다. 이는 기존의 감시체계를 극대화하고, 보험청구자료, 병원전자의무기록자료, 환자등록자료 등의 대규모 자료원 을 통합하여 신속하게 안전성 평가를 할 수 있는 재료로 활 용하는 장기적 프로젝트이다.
15)구체적으로는 2010년까지 2천 5백만 명의 환자에 대한 건 강자료를 활용한 능동적 감시시스템을 구축하고, 2012년까 지 1억 명에 대한 건강자료를 구축할 것을 제안하였다. 고 비용의 사업을 추진할 수 있도록 전문의약품 허가신청자 비 용부담법(Prescription Drug User Fee Act IV, PDUFA IV)을 하위법으로 제정하여 제약회사가 약물감시사업에 필요한 비용을 부담하도록 하였다. 또한, 미국 오바마 대통령이 “미 니센티넬 활동은 연구사업이 아닌 공중보건행위이다“라고
선언하면서 개인정보보호법에 의한 IRB 승인과 개인들로부 터 설명후 동의를 받는 것을 면제하는 예외조항을 미니센티 넬 규정집에 명시함으로써,
16)미국 보건국의 연구대상자보 호국(Health and Human Services (HHS) Office of Human Research Protections (OHRP))은 FDA의 센티넬 이니셔티브 (미니센티넬 포함)에는 인간대상 연구대상자 보호를 위한 조항(45 CFR Part 46)이 적용되지 않는다고 밝히고 있다. 게 다가 FDA는 미니센티넬 활동은 FDA의 공중보건 미션의 지 원을 받아 공중보건활동을 하는 것으로 결정하였으므로 협 력기관은 미니센티넬 활동의 일환으로서, 개별적으로 IRB 또는 개인정보위원회의 승인 등을 받아야할 필요가 없다(45 CFR §164.512(b)
17))고 명시하였다. 2009년 9월부터 2014년 9 월까지 시범사업인 미니센티넬과 민관합동연구체계인 OMOP 등을 통해 센티넬 시스템을 구축하기 위해 노력하고 있다.
① 미니센티넬: 미니센티넬은 센티넬시스템을 시범적으
로 적용하는 2009년부터 5년에 걸친 프로젝트이다. 안전성
평가에 역학적, 통계학적 방법론을 적용, 실제 센티넬시스
템 구축에 대비하여 문제점을 파악하는 것을 목적으로 하였
다. 즉, 체계적이고 전산화된 방법으로 자료에 접근하고 능
동적 약물감시방법론을 개발하여 평가하는 것, 장기적으로
수행하고 활용할 수 있도록 기반을 다지고, 조사역량과 정
책, 절차 등의 문제점을 발견, 해결하는 것이 미니센티넬의
목적이다. 2009년 하버드대학(하버드 필그림센터, Harvard
Pilgrim Health Care Institute)을 중심으로 27개의 기관을 연
계하여 각각의 데이터를 표준양식으로 수합하고 자료접근 및 분석 등에 대한 연구를 통해, 향후 FDA가 담당하게 될 협연센터(Coordinating center) 모델을 개발하였다. 의료기관- 보험회사 연합(Data partners)으로부터 자료원을 확보하고 분 산되어 있는 전산자료를 모으기 위한 네트워크를 구성한다 (그림 2). 홈페이지에 보고된 현황에 따르면, 2013년 9월 22 일 기준으로 미니센티넬은 18개 협력기관들의 데이터를 처 리하였으며, 153,000,000명의 환자자료를 처리하였다.
358,000,000인-년 동안 추적관찰하였으며 48,000,000명에 대 한 자료가 등록되어 새로운 자료로 축적되었다. 36,000,000 명에 대해서는 3년 이상 축적된 자료를 가지고 있으며, 40 억 건의 의약품 처방조제자료를 포함하고 있다.
18)② OMOP (Observational Medical Outcomes Partnership): 약 물 안전성 평가를 위한 또 다른 대규모 프로젝트인 ‘OMOP’
은 제약회사, 학계, 비영리단체, 미국 FDA 및 그외 국가기 관의 전문가가 참여하는 네트워크로서, 제약회사의 공동기 금을 중심으로 미국 국가보건기구재단의 재정지원을 받는 민관협력기구이다. OMOP은 의약품 안전성과 효과를 평가 하기 위한 자료원을 효율적으로 관리하기 위한 기반구축을 목적으로 하였으며, 특히 다양한 경로로 모아진 관찰적 보 건의료자료를 활용하고자 하였다.
구체적으로는 체계적 위해관리를 위하여 변수명이나 기 타 형태 등을 통일하여 서로 다른 자료들의 공동데이터모형 (Common Data Model)을 개발함으로써, 통합된 자료(데이터 네트워크)를 활용한 분석방법론을 구축하고자 하였다. 이렇 게 구축된 대규모 자료원을 이용한 약물-질병간 인과관계 분석방법론을 목록화하고, 표준화된 자료의 특성을 파악하 는 절차를 마련하였으며, 관심질병(Health outcomes of inte- rest)을 정의ㆍ적용하였다. 약물안전성이슈 도출 방법론의 성과를 평가하고 자료원 간의 비교를 하였고, 마지막으로 의약품안전성 의사결정에 있어서의 효과성과 유용성을 평 가하고자 노력하였다.
OMOP은 2009년에 착수한 이후 2억 명의 환자를 포함하 는 10개 자료원 네트워크를 마련하고자 하였으며, 2013년 6 월 종료되었다. 지난 2009년, 2011년, 2012년, 2013년 4차례 심포지엄을 개최하여 그간의 성과를 발표하였다. 개발된 방 법론과 그것을 이용한 분석방법 등을 포함한 심포지엄 내용 을 홈페이지를 통해 공개하고 있다.
19)(2) 전자보건의료데이터를 이용한 약물역학연구 수행지 침
20): 2006년 IOM보고서의 권고안에 따라 FDA는 대응보 고서(IOM 권고에 대한 FDA의 대처, 2007)에서 ‘의약품 안 전관리시스템의 개혁’을 위한 방법 중 하나로 ‘안전성 감시 수단과 방법의 강화’를 꼽았다. 이의 실천방안 중 하나로 약 물역학연구 우수사례에 대한 가이드라인을 개발 및 배포하 고 전문의약품 허가신청자비용부담법 4차 개정안(PDUFA
IV)에 따라, 의약품안전관리체계를 강화하고 현대화하고자 하였다. 따라서 FDA는 약물역학연구의 가장 이상적인 수행 방법을 정의하고, 이 방법을 지침서로 개발하기 위하여 ‘전 자보건의료데이터를 이용한 약물역학연구 수행지침’을 작 성하였고, 2013년 3월에 발표하였다. 이 지침서는 전자보건 의료데이터(청구자료, 의무기록)를 이용하여 약물역학연구 수행 및 보고와 관련된 최적의 수행방법에 관한 내용으로 서, FDA에서 연구프로토콜을 검토할 때와 최종보고서를 기 관에 제출할 때 고려해야 할 연구설계, 분석방법, 결과를 작 성하는 방법에 대한 권고사항을 포함하고 있다. 이 지침서 의 목적은 크게 세 가지이다. 첫째, 약물역학연구의 연구설 계, 연구수행, 분석에 대한 지침을 업계와 FDA에 제공하기 위함이다. 둘째, 약물역학연구 프로토콜 및 최종보고서를 FDA에 제출할 때 필요한 업계의 업무체계를 제시하기 위함 이다. 마지막으로, 약물역학연구 프로토콜과 최종보고서를 검토할 때 필요한 FDA의 업무체계를 제시하기 위함이다.
전자보건의료데이터를 이용한 약물역학연구에 적용하기 위 한 최적의 수행방법에 대한 지침을 주안점으로 작성되었으 며, 연구사례들을 소개하는 것뿐만 아니라 다른 종류의 데 이터를 사용한 약물역학연구에 광범위하게 적용하기 위하 여 다양한 개념들을 논의하였다.
결론 및 제언
로페콕시브 시판철회와 관련한 7개의 기존 국외연구사례 와 미국 FDA의 의약품안전관리체계에 대해 알아보았다. 임 상시험, 환자-대조군연구, 코호트연구, 코호트내 환자-대조 군연구, 임상시험 메타분석연구 등 다양한 연구방법으로 분 석한 국외연구사례를 통하여, 로페콕시브로 인한 심혈관계 부작용발생의 관련성이 밝혀지는 과정을 파악하였고, 더불 어 이와 관련된 미국의 의약품안전관리체계가 변화된 흐름 을 살펴보았다.
FDA는 2005년 IOM에 미국의 의약품 안전관리시스템 평 가를 요청하였고, 이에 따라 IOM에서는 2006년 9월 “The Future of Drug Safety - Promoting and Protecting Health of the Public”이라는 보고서를 발표하였다. 2006년 IOM 보고서에 서 권고한 바에 따라 FDA는 대응보고서(IOM 권고에 대한 FDA의 대처, 2007)에서 ‘의약품 안전성 시스템의 개혁’을 위한 방법 중 하나로 ‘안전성 감시 수단과 방법의 강화’를 꼽았다. 이의 실천방안 중 하나로 약물역학연구 우수사례에 대한 가이드라인을 개발 및 배포하기로 제안하였으며 (PDUFA IV 제안서) ‘전자보건의료데이터를 이용한 약물역 학연구 수행지침서’를 만들었다.
우리나라에서도 건강보험심사평가원 청구자료, 병원 전
자의무기록자료, 통계청 사망자료 등과 같은 대규모 자료원
을 이용한 약물유해반응의 실마리정보검색 및 인과성 평가 가 학계를 중심으로 이루어지고 있다. 하지만 정책결정의 근거자료로 활용될 타당도 높은 자료를 확보하기 위하여, 약물사용과 질병에 대한 정보를 담은 자료원과 통계청의 사 망자료, 국립암센터의 암등록자료 등을 연계한 데이터네트 워크가 구축되어야 하고 이를 원활히 하기 위하여 선진국과 같이 국가차원에서 이루어져야 한다.
이를 실천하기 위하여, 센티넬 이니셔티브에서 적용되고 있는 다양한 이해당사자들의 협력체계, 방법론적 접근, 정 보공개와 공유체계 등을 벤치마킹하여, 관련 자료원을 보유 하고 활용하는 기관간의 협력체계를 원활히 하고, 각 임상 현장에서 연구수행을 활발히 하여야 하겠다. 뿐만 아니라, 기본적으로 공익적 목적의 자료활용에 대한 법 또는 정책적 개선을 우선시하여, 국내 약물 안전관리체계의 선진화에 더 욱 박차를 가해야 하겠다.
이 고를 통하여, 의약품 사용 후 예기치 못한 중대한 부작 용 발생으로 인한 환자의 피해와 더 나아가 국가차원의 사 회경제적 손실에 대한 경각심을 갖기를 바란다. 또한, 의약 품 부작용 규명을 위한 대규모 자료원을 연계한 약물역학연 구의 활성화의 필요성을 강조하며, 앞서 제시한 국외 연구 사례들을 참고하여 우리나라의 대규모 자료원을 이용한 효 과적인 약물역학연구 수행체계가 구축되기를 기대한다.
참고문헌
1. 최돈웅, 최미섭, 고아라. 우리나라의 의약품 안전관리 현 황. J Korean Med Assoc 2012;55:827-34.
2. 박병주. 부작용보고, 이제는 질적 성장이 관건이다. 대한 약물역학위해관리학회 칼럼. 1월.
3. 최남경, 이중엽, 박병주. 의약품 안전관리의 최신 국제동 향. J Korean Med Assoc 2012;55:819-26.
4. 서울식약청: 서울지방청 알림마당. 보도ㆍ해명. “로페콕시 브제제”사용중지(recall)조치.[cited 2004 October 06] Available from: http://www.mfds.go.kr/seoul/index.do?seq=8204&mid=27
&cmd=v[accessed 2014 Feb 6].
5. 대한약물역학위해관리학회 엮음. 약물역학. 서울대학교출 판문화원. 2012.
6. Bombardier C, Laine L, Reicin A, Shapiro D, Burgos-Vargas R, Davis B, Day R, Ferraz MB, Hawkey CJ, Hochberg MC, Kvien TK, Schnitzer, TJ. Comparison of upper gastrointes- tinal toxicity of rofecoxib and naproxen in patients with rheu- matoid arthritis. VIGOR Study Group. N Engl J Med 2000;
343:1520-8.
7. Solomon DH, Schneeweiss S, Glynn RJ Kiyota Y, Levin R, Mogun H, Avorn J. Relationship between selective cyclo- oxygenase-2 inhibitors and acute myocardial infarction in old-
er adults. Circulation. 109:2068-73.
8. Mamdani M, Rochon P, Juurlink DN, Anderson GM, Kopp A, Naglie G, Austin PC, Laupacis A. Effect of Selective Cyclooxygenase 2 Inhibitors and Naproxen on Short-term Risk of Acute Myocardial Infarction in the Elderly. Arch Intern Med 2003;163:481-6.
9. Mamdani M, Juurlink DN, Lee DS, Rochon pa, Kopp A, Naglie G, Austin PC, Laupacis A, Stukel TA. Cyclo-oxygen- ase-2 inhibitors versus non-selective non-steroidal anti-inflam- matory drugs and congestive heart failure outcomes in elderly patients: a population-based cohort study. Lancet 2004;363:
1751-6.
10. Ray WA, Stein CM, Daugherty JR Hall K, Arbogast PG, Griffin MR. COX-2 selective non-steroidal anti-inflammatory drugs and risk of serious coronary heart disease. Lancet 2002;
360:1071-3.
11. Graham DJ, Campen D, Hui R, Spence M, Cheetham C, Levy G, Shoor S, Ray WA. Risk of acute myocardial infarc- tion and sudden cardiac death in patients treated with cyclo- oxygenase 2 selective and non-selective non-steroidal anti-in- flammatory drugs: nested case-control study. Lancet 2005;
365:475-81.
12. Ross JS, Madigan D, Hill KP. Egilman DS, Wang Y, Krumholz HM. Pooled analysis of rofecoxib placebo-con- trolled clinical trial data lessons for postmarket pharmaceut- ical safety surveillance. Arch Intern Med 2009;169:1976-85.
13. Institute Of Medicine. The Future of Drug Safety: Promoting and Protecting the Health of the Public. 2006.
14. U.S. Department of Health and Human Services Food and Drug Administration(FDA). FDA’s Response to the Institute of Medicine’s 2006 Report. January 2007.
15. US Department of Health and Human Services, US Food and Drug Administration. The Sentinel Initiative: a national strat- egy for monitoring medical product safety [Internat]. Silver Spring: US Food and Drug Administration; 2011 [cited 2012 Sep 7]. Available from: http://www.fda.gov/downloads/Safety/
FDAsSentinelInitiative/UCM274548.pdf.
16. Mini-Sentinel. Principles and Policies. 2013.[cited 2013 No- vember] Available from: http://mini-sentinel.org/work_prod- ucts/About_Us/Mini-Sentinel-Principles-and-Policies.pdf[ac- cessed 2014 Feb 6].
17. U. S. Government printing office: Electronic code of federal regulations [cited 2014 February 4]. Available from: http://
www.ecfr.gov/cgi-bin/text-idx?SID=05f365b01ba63b4c2ab2144 451786b3c&node=45:1.0.1.3.78.5.27.8&rgn=div8[accessed 2014 Feb 6].
18. Mini-Sentinel: About Mini-Sentinel. Distributed Database.[cit-
ed 2013 September 22] Available from: http://www.mini- sentinel.org/about_us/MSDD_At-a-Glance.aspx[accessed 2014 Feb 6].
19. Observational Medical Outcomes Partnership. Available from:
http://omop.org/[accessed 2014 Feb 6].
20. U.S. Department of Health and Human Services Food and
Drug Administration Center for Drug Evaluation and Re- search (CDER) Center for Biologics Evaluation and Research (CBER), Best Practices for Conducting and Reporting Phar- macoepidemiologic Safety Studies Using Electronic Health- care Data. 2013.