Vol. 12, No. 4, December, 2005
― 263 ― ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
<접수일:2005년 9월 28일, 심사통과일:2005년 10월 11일>
※통신저자:김 호 연
서울시 서초구 반포동 505번지
가톨릭대학교 의과대학 의과학연구원 류마티스연구센터
Tel:02) 590-2533, Fax:02) 599-4287, E-mail : ho@catholic.ac.kr
본 논문은 한국과학재단 우수연구센터연구(과제번호 R11-2002-098-05001-0)지원으로 수행되었음.
말초혈액 CD4
+CD25
-T 세포로부터 IL-4로 유도된 CD4
+CD25
+면역조절 T 세포의 획득과 특성 규명
가톨릭대학교 의과대학 의과학연구원 류마티스연구센터
허성범․조미라․박미경․민소연․주지현․박경수․조영규․윤종현․박성환․김호연
= Abstract =
IL-4 Induces CD4
+CD25
+Regulatory T Cells from CD4
+CD25
-T Cells in Peripheral Blood
Seong-Beom Heo, Mi-La Cho, Ph.D., Mi-Kyung Park, So-Youn Min, Ph.D., Ji-Hyun Joo, M.D., Kyung-Soo Park, M.D., Young-Kyu Cho, Chong-Hyeon Yoon, M.D.,
Sung-Hwan Park, M.D., Ho-Youn Kim, M.D.
The Rheumatism Research Center (RhRC), Catholic Research Institute of Medical Science, The Catholic University of Korea, Seoul, Korea
Objective: The CD4+CD25+ regulatory T cells (Treg) can be induced by TGFβ and IL-10 in the periphery, and understanding the biological function of cytokine-induced Treg is critically important for the control of autoimmune diseases. We investigated the IL-4-induced CD4+CD25+ regulatory T cells in human PBMCs, which were derived from the CD4+CD25- T cells.
Methods: The CD4+CD25- T cells from human PBMC were isolated by MACS and cultured in the presence of IL-4 or absence of IL-4. The presence and phenotype of induced CD4+CD25+ T cells were determined by flow cytometry. Supressive activity of induced CD4+CD25+ T cells were assessed by culturing CD4+CD25- and CD4+CD25+ T cells with anti-CD3 monoclonal antibodies and antigen-presenting cells, followed by proliferation
Results: After 5 days, significant amount of CD4+CD25+ T cells were generated from the CD4+ CD25- T cells cultured with anti-CD3 antibody in the presence of IL-4. These IL-4 induced CD4+ CD25+ T cells presented with similar phenotype to natural occurred Treg cells, including CD45ROhi, CD45RAlo, CTLA-4hi, OX40hi, CD62Lhi and HLA-DRhi, and also exhibited high ex- pression of Foxp3 molecule. In addition, the IL-4 induced CD4+CD25+ T cells can suppress the proliferative responses against anti-CD3. The regulatory property of IL-4 induced CD4+CD25+ T cell was partially abrogated after treatment with anti-IL-10 and anti-TGFβ antibodies.
― 264 ― 서 론
억제성 T 세포(Suppressor T cell)라고 불리는 면역 조절 T 세포(Regulatory T cell; Treg)는 자가(self)와 비자가(non-self) 항원에 대하여 발생하는 면역반응을 조절하는 대표적인 세포이다1-4). 자연 발생하는 가장 대표적인 면역조절 T 세포(naturally acquired Treg)는 흉선이 기원인 CD4와 CD25를 함께 발현하는 세포 로서 in vitro에서는 자극에 대하여 반응성을 가지지 않는 세포로 알려져 있고, 마우스와 사람에서 전체 CD4+ T 세포 중 5∼10% 정도가 분포한다5-8). CD4+ CD25+ 면역조절 T 세포는 전사인자인 Foxp3와 공 조수용체인 CTLA-4 (cytotoxic T lymphocyte antigen- 4)를 발현하며 CD103과 GITR (glucocorticoid induc- ed TNFR)도 발현한다9,10). 이러한 면역조절 T 세포의 분화는 흉선뿐만 아니라 말초의 CD4+ T 세포가 IL- 10, TGFβ, IL-2와 같은 사이토카인 혹은 특이 세포 표현형을 가지는 비성숙 수지상세포에 의해서 영향 을 받아 CD4+CD25+ 면역조절 T 세포로 분화가 되 었다는 결과가 있다16-21). 반면에 T 세포 수용체 자극 을 통해 증식된 CD4+CD25+ T 세포는 다른 T 세포 의 증식을 비특이적으로 억제하는 효과를 가진다. 특히 TGFβ의 경우 Foxp3의 전사조절인자인 SMAD를 직접 적으로 활성화시키는 사이토카인으로 CD4+CD25- T 세포에서 CD4+CD25+ 면역조절 T 세포로 전환시킴 과 동시에 이러한 면역조절 T 세포의 특이 전사인 자인 Foxp3의 발현을 유도하는 것으로 확인되었 다23,24). IL-10은 in vivo에서 무력(anergy)상태의 CD4
+CD25+ T 세포를 억제 기능을 가지는 CD4+CD25+ 면역조절 T 세포로 전환시키고40), CD4+ T 세포에 TGFβ와 동시에 작용하여 CD4+ 면역조절 T 세포로 분화를 유도시키는 것으로 확인되었다. 이 외에도 IL-10은 면역조절 T 세포 중에서 Tr1 세포의 분화를 촉진하고 반응 T 세포의 증식반응 억제기능에 관여
하는 것으로 알려져 있다.
IL-4는 T 세포, 비만세포, 호염구와 같은 세포에서 생성되며 다양한 세포와 조직에 영향을 미치는 것으 로 알려져 있다25). IL-4는 B세포의 분화 활성 증식을 유도하며 T 세포에서는 helminths나 다른 세포 밖의 기생충, 그리고 알러지 질환의 병인진행을 차단할 수 있는 면역반응을 유도하는 Th2 세포로의 분화를 유도하고 촉진하는 역할을 수행한다25). IL-4는 MHC class II 분자발현을 증가시키고 IL-6와 TNFα와 같 은 사이토카인 분비를 촉진한다25). CD4+ Th2 세포 와 CD8+ Tc2 세포의 증식을 유도하며 cytotoxic T 세포 기능을 항진시킨다25). 경우에 따라서는 IL-4가 단핵구로부터 사이토카인 분비를 억제하며 이러한 세포의 사멸을 유도함으로써 염증조절에 관여하기도 한다26). IL-4는 자가면역질환으로 알려진 관절염27), 뇌척수염28), 당뇨병29)과 같은 질환에서 질환의 완화 나 치료 효과가 있다는 보고도 있다.
IL-4가 CD4+CD25+ 면역조절 T 세포의 연관된 연 구로 IL-4가 결핍된 마우스에서 면역조절 기전이 현 저하게 떨어지는 것을 심장이식 관용모델에서 확인 하였고30), 반대로 IL-4 유전자를 주입할 경우 CD4+ CD25+ 면역조절 T 세포의 관용 유도 효과가 증가 하는 것도 확인되었다31). 마우스의 비장세포에서 분 리한 CD4+CD25+ 면역조절 T 세포에 IL-4를 처리하 면 CD4+CD25+ T 세포에서 IL-2Rα 사슬인 CD25의 발현을 촉진시키고 면역조절 T 세포로서의 기능을 상승시킨다는 보고도 있다32). 이와는 반대로 IL-4가 CD4+CD25+ 면역조절 T 세포의 T 세포 활성억제 반응을 막는다는 결과도 있어33) IL-4가 CD4+CD25+ 면역조절 T 세포에 미치는 영향에 대한 결론을 내 리기는 어려운 상황이다.
본 연구에서는 IL-4가 인간의 말초혈액에서 분리 한 CD4+CD25- T 세포로부터 CD4+CD25+ 면역조 절 T 세포로의 전환을 유도할 수 있는지 조사하고자 하며 이때 이러한 세포가 가지는 세포 표현형의 특 Conclusion: These data indicate that IL-4 induced CD4+CD25+ Treg cells can be generated from the CD4+CD25- T cells in the peripheral blood, and may contribute to the important immunoregulatory function in human.
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ Key Words: IL-4, CD4+CD25+ regulatoy T Cell, PBMC, IL-10, TGFβ
― 265 ― 징과 면역조절 T 세포로의 기능을 확인하고자 한다.
대상 및 방법 1. 대상
정상인 15명을 대상으로 하였으며, 대상자의 성별 은 여성이 80%이며, 나이는 25±3세이다. 본 연구는 가톨릭중앙의료원 임상연구관리 규정을 준수하여 실 험하였다.
2. 세포 분리
말초혈액 단핵세포(peripheral blood mononuclear cells, PBMC)의 분리는 헤파린을 처리한 주사기로 혈액을 PBS (Phosphate-Buffered Saline, Gibco BRL.
Carlsbad, CA)와 1:1로 섞어 Ficoll과 1:4의 비율로 Ficoll 층에 섞이지 않게 조심스럽게 50 mL tube에 천천히 띄운 다음 혈액을 20oC의 930 g에서 30분간 원심 분리하였다. Buffy coat 층만을 따서 새 용기에 옮긴 후 PBS로 세척하였다. 말초혈액 단핵세포의 CD4+CD25- T 세포의 분리는 MACs bead를 이용해 서 분리하였다. 먼저 anti-human CD4 biotin cocktail (Milteny biotec, Bergisch Gladbach, Germany)와 4oC, 15분간 반응시킨 후 anti-human CD4 biotin Micro- bead (Milteny biotec)와 4oC, 15분간 반응시킨 후 1%
BSA (bovine serum albumin), 2 mM EDTA (Amresco) 가 포함된 PBS 용액(pH 7.4)으로 세척하고 Column (Milteny biotec)을 통과시켜 음성 분획으로 CD4+ T 세포를 분리하였다. 분리된 CD4+ T 세포를 또 한번 1% BSA, 2 mM EDTA (Amresco)가 포함된 PBS 용 액(pH 7.4)으로 세척하고, 다음으로 anti-human CD25 microbead (Milteny biotec)와 4oC, 15분간 반응시킨 후 1% BSA, 2 mM EDTA (Amresco)가 포함된 PBS 용액(pH 7.4)으로 세척하고 Column (Milteny biotec) 을 통과시켜 양성 분획으로 CD4+CD25+ T 세포와 음성 분획으로 CD4+CD25- T 세포를 얻은 후 각각 의 세포를 PBS로 세척하고 10% 우태아 혈청이 포 함된 RPMI1640 (Gibco BRL) 세포 배양액에 재부유 시켰다.
3. 세포 자극
말초 혈액 단핵세포의 CD4+CD25- T 세포 1×106/
mL를 10% 우태아 혈청이 포함된 RPMI1640 세포 배양액과 함께 anti-CD3 Ab (BD phamigen, San Die- go, CA)가 2 ug/mL coating 처리된 24 well plate (Costar, Cambrige, MA) 분주하고 IL-4 10 ng/mL (R&D, Minneapolis, MN), IL-10 10 ng/mL (R&D), TGFβ 10 ng/mL (Peprotech, Rocky Hill, NJ), IL-2 10 ng/mL (Endogen, Rockford, IL)로 각각 자극하여 5일 동안 37oC, 5% CO2 배양기에서 배양하였다. 또한 자 극에 의해서 유도된 CD4+CD25+ 세포의 억제반응기 전을 확인하기 위해서 anti-human IL-4 (R&D, Minneapolis, MN), anti-human TGFβ (R&D), an- ti-human IL-10 (R&D)를 각각 10 ug/mL 첨가하여 3 일 동안 37oC, 5% CO2 배양기에서 배양하였다.
4. CD4+CD25+ T 세포의 유세포 분석(flowcytome- try)
Anti-CD3 Ab와 사이토카인으로 5일간 자극된 세 포의 세포표면항원의 발현과 함께 세포의 공조수용 체의 발현정도 유세포분석을 통해서 알아보았다. 먼 저 5일 동안의 자극 후 수집된 세포의 표면항원을 분석하기 위해서 peridinin chlorophyll protein (PerCP) 로 표지된 anti-CD4 항체(Becton Dickinson, San jose, CA)와 allophycocyanin (APC)가 표지된 anti-CD25항 체(BD pharmingen, San Diego CA), fluorescein iso- thiocyanate (FITC)가 표지된 anti-CD45RA항체(BD pharmingen) phycoerythrin (PE)가 표지된 anti-CD45RO 항체(BD pharmingen)를 사용하였으며, FITC가 표지 된 anti-human CD62L항체(Ebioscience, San Diego, CA) 와 PE가 표지된 anti-human HLA-DR항체(Ebioscience) 또한 사용하였다. 이러한 항체들과 수집한 세포를 4oC에서 30분간 암시야에서 반응한 다음 FACs buf- fer (0.02% sodium azide, 0.2% BSA in Dulbecco's PBS)로 세포를 세척하였다. 또한 배양된 세포의 공 조자극수용체(OX40, CTLA-4, GITR (glucocorticoid induced TNFR))를 분석하였다. 먼저 PerCP-anti CD4 항체(BD pharmingen)와 APC-anti CD25항체(BD phar- mingen), PE-anti CD25항체(BD pharmingen)를 이용해 서 세포표면항원을 염색한 후에 Cyto fix/perm (BD pharmingen)으로 4oC에서 20분간 암시야에서 반응 후, FITC-anti CD134항체(BD pharmingen)와 APC-an- ti CD152항체(BD pharmingen), FITC-anti GITR항체
― 266 ― (BD pharmingen)로 4oC에서 30분간 암시야에서 반응
하였다. 마지막으로 이 세포들은 Permwash buffer (BD pharmingen) 두차례 세척한 후 FACs buffer에 재부유 하여 FACs Calibur (BD, San Diego, CA)로 분석하였 다. 이때 분석프로그램은 Flow Jo (Version 4.5, Tree- star, Ashland, OR)를 사용하였다. 림프구 그룹은 전 체세포를 forward/side scatter 특징에 따라 나눈 그룹 중에 선별하여 읽었다. 그 외 FITC가 표지된 anti- Foxp3를 이용해서 세포 내 Foxp3 합성정도를 측정 하였다. Foxp3는 FITC anti-human Foxp3 stainning set (Ebioscience)을 사용하였고 항체의 염색방법은 제조 사의 추천을 따랐다.
5. 역전사 중합효소 반응(Reverse transcription poly- merase chain reaction)
Anti-CD3, IL-4 10 ng/mL (R&D)와 함께 5일간 배 양된 세포로부터 총 RNA를 RNA zolBTM (Tel. Test, Friendswood, TX)를 이용하여 추출하였다. 추출한 총 RNA를 주형으로 cDNA를 합성하기 위하여, 0.5 ug random nonamer (Takara, Shiga, Japan)와 70oC에서 5 분 반응시킨 뒤 4oC에서 급냉시킨 다음 10 mM dNTP mix (Invitrogen, Carlsbad, California) 1μL, 역전사 효 소 M-MuLV (MBI Fermentas, Hanover, MD) 1 unit, 5 X M-MuLV 희석용액(MBI Fermentas) 4μL, RNase Inhibitor (MBI Fermentas) 0.5μL을 가하고 전체를 nuclease free water (Promega, Madison, WI) 20μL로 맞춘 뒤, 25oC에서 10분, 42oC에서 60분, 72oC에서 10분간 반응시켰다. 이렇게 생성된 cDNA 산물을 이 용하여 중합효소 연쇄반응을 시행하였다. 본 실험에 사용한 GAPDH, Foxp3의 시발체는 모두 Genotec Co (Korea)에서 구입하였고 염기서열은 Foxp3 (sense:
CTG CTG GCA GCC AAG GCC CTG antisense:
ACT CAG GTT GTG GCG GAT G) GAPDH (sense:
CGA TGC TGG GCG TGA GTA C, antisense: CGT TCA GCT CAG GGA TGA CC)를 사용하였다.
PCR 과정 중 각각 서로 다른 양으로 역전사된 cDNA와 PCR cycle 수를 변경하면서 PCR을 시행하 여 대수적으로 증가하는 cDNA양과 PCR cycle 수를 결정하였다. PCR를 위한 반응 화합물은 총 25μL가 되도록 하였고, 용액의 조성은 2.5μL의 10× reaction buffer (10 mM Tris-HCl, pH 8.3: 15 mM MgCl2: 50
mM KCl; Takara, Japan), 0.5 mM의 dNTP (Takara, Japan)를 사용하였다. 증폭을 위해 Dual-bay Thermal cycler system (MJ Research)를 사용하였다. PCR 조건 은 GAPDH는 변성단계에서 94oC 1분, annealing 단계 에서 56oC 1분, 신장단계에서 72oC 1분간의 과정을 진행하였으며 총 25회를 반복하였고, Foxp3는 변성 단계에서 94oC 30초, annealing 단계에서 53oC 30초, 신장 단계에서 72oC 30초간 진행하였으며 총 35회를 반복하였다. 음성 대조군으로 추출한 cDNA 대신 증 류수를 사용하여 시행한 PCR 반응에서 PCR 산물이 관찰되지 않도록 하여 PCR 오염이 없음을 확인하였 다.
6. T 세포 증식반응에 대한 CD4+CD25+ T 세포 의 억제반응과 그 기전 확인
분리한 CD4+CD25- T 세포를 anti-CD3 Ab와 여러 가지 사이토카인 (IL-4, IL-10, TGFβ, IL-2)과 함께 5 일간 배양하였다. 위와 같이 처리한 세포로부터 CD4+CD25+ T 세포와 CD4+CD25- T 세포를 분리 하기 위해서 fluorescein isothiocyanate (FITC)가 표지 된 anti-CD4 항체(BD pharmingen, San Diego, CA)와 phycoerythrin (PE)가 표지된 anti-CD25 항체(BD phar- mingen, San Diego, CA)를 동시에 넣고 4oC, 30분간 암시야에서 반응한 다음 PBS로 세척하고 10% 우태 아 혈청이 포함된 RPMI1640 세포 배양액에 재부유 시켰다. 그리고 FACs vantage cell sorter (BD bioscie- ne)를 이용해서 CD4+CD25+ T 세포와 CD4+CD25- T 세포를 분리하였다. 말초 혈액 단핵세포는 anti- human CD4 biotin cocktail (Milteny biotec, Bergisch Gladbach, Germany)와 4oC, 15분간 반응시킨 후 anti- human CD4 biotin Microbead (Milteny biotec, Bergisch Gladbach, Germany)와 4oC, 15분간 반응시킨 후 1%
BSA, 2 mM EDTA (Amerso)가 포함된 PBS 용액(pH 7.4)으로 세척하고 Column (Milteny biotec)을 통과시 켜 CD4+ T 세포를 얻었다. 그리고 CD4+ T 세포가 배제된 세포를 5,000 rad의 방사선에 조사시켜 항원 제시세포로 사용하였다. 앞서 얻은 CD4+ T 세포와 항원제시세포를 각각 1×105/well씩 anti-CD3 (BD phamingen, San Diego, CA)가 3 ug/mL으로 coating 처리된 U자 모양의 96 well plate (Iwaki Japan)에 부 유한 후 여기에 FACs vantage cell sorter를 이용해서
― 267 ― 얻어진 CD4+CD25+ T 세포와 72시간 동안 공조배 양하였다. 실험 시 대조군으로는 CD4+CD25- T 세 포와의 공조배양을 CD4+CD25- T 세포의 억제반응 과 비교하였다. 배양종료 16시간 전에 3H-thymidin (NEN, Boston, MA)를 well당 1.0μCi씩 넣어 주었으 며, 세포를 수집한 후 beta counter (Packard Instrument Co., Downers Grove, IL)로 동위원소 양을 측정하였 다. CD4+CD25+ T 세포의 억제반응기전 확인하기 위하여 앞서 얻은 CD4+ T 세포와 항원제시세포를 1×105/well씩 anti-CD3 Ab (BD phamingen, San Die- go, CA)가 3 ug/mL으로 coating 처리된 24 well plate (Costar)에 부유한 후 차단실험을 위해 anti-human IL-4 (R&D, Minneapolis, MN), anti-human TGFβ (R&
D), anti-human IL-10 (R&D)를 각각 10 ug/mL씩 처 리하고, 또한 pore size가 0.4μm의 trans well (BD FalconTM, Franklin Lakes, NJ)를 각 well에 넣고 앞서 FACs vantage cell sorter를 이용해서 얻어진 CD4+ CD25+ T 세포를 부유하여 두 세포 사이의 직접적 인 접촉을 물리적으로 방해한 상태로 3일 동안 공조 배양하였다. 실험 시 대조군으로는 CD4+CD25- T 세포와의 공조배양을 CD4+CD25+ T 세포의 억제반 응과 비교하였다.
7. 통계적 유의성의 검증
실험 결과는 평균±표준오차(standard error mean, SEM)로 표현하였으며 통계적 유의성의 검증은 SPSS 통계 program (version 11.5, Chicago, IC)을 사 용하여 student's t-test를 실시하였고 p값이 0.05이하 일 때 통계적으로 유의하다고 분석하였다.
결 과
1. 정상인의 말초혈액단핵구세포(PBMC)에서 CD4+ CD25+ 면역조절 T 세포의 구성 비율 및 기능 조사
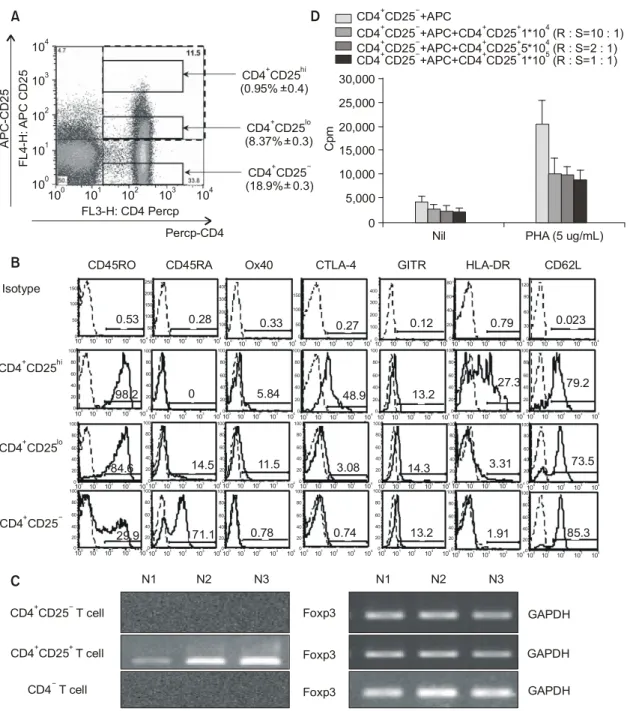
정상인의 말초혈액단핵구세포에서 유세포분석기 (FACS)를 이용하여 CD4+CD25+ T 세포를 분석한 결 과 CD4+CD25+ T 세포는 약 10%이며 이들 중 CD25 를 과발현하는 CD4+CD25+hi T 세포는 약 0.95%의 비율로 존재하였다(그림 1A). 이러한 결과는 David 그룹에서 보고한 연구결과와 일치했으며 세포 표현
형 분석을 위해 CD4+CD25+hi (0.95%±0.4) CD4+ CD25+lo (8.37%±0.3), CD4+CD25- (18.9%±0.3) 세 개의 군으로 나누어 CD45RO, CD45RA, CTLA-4, OX40, CD62L, HLA-DR, GITR를 분석하였다. CD4+ CD25+hi 와 CD4+CD25+lo 군은 CD4+CD25-군에 비하 여 T 세포 증식과 활성에 관련하는 CD45RO (CD4+ CD25+hi: 98.2, CD4+CD25+lo: 84.6 vs CD4+CD25-: 29.9)는 높게 발현하며 naïve T 세포의 표지자인 CD- 45RA (CD4+CD25+hi: 0, CD4+CD25+lo: 14.5 vs CD4+ CD25-: 71.1)는 낮게 발현하였다. 또한 CD4+CD25+ 면역조절 T 세포에서 대표적인 보조자극인자로 알 려진 CTLA-4 (CD4+CD25+hi: 48.9, CD4+CD25+lo: 3.08 vs CD4+CD25-: 0.74)도 CD4+CD25+hi, CD4+ CD25+lo 그룹에서 높았으며, 또 다른 보조자극인자 인 OX40 (CD4+CD25+hi: 5.84, CD4+CD25+lo: 11.5 vs CD4+CD25-: 0.78)와 HLA-DR (CD4+CD25+hi: 27.3, CD4+CD25+lo: 3.31 vs CD4+CD25-: 1.91)의 발 현도 증가되어 있었다. GITR (CD4+CD25+hi: 13.2, CD4+CD25+lo: 14.3 vs CD4+CD25-: 13.2)과 CD62L (CD4+CD25+hi: 79.2, CD4+CD25+lo: 73.5 vs CD4+ CD25-: 85.3)은 CD4+CD25+ 그룹과 CD4+CD25- 그 룹간에 발현의 차이는 관찰되지 않았다(그림 1B).
이러한 결과에서 볼 수 있듯이 CD4+CD25+hi 세포에 서 일반적으로 알려진 CD4+CD25+ 면역조절 T 세 포에서 발현된다고 알려진 세포표현형의 발현이 더 욱 뚜렷이 관찰될 수 있었다. CD4+CD25+ T 세포에 서는 Foxp3 gene의 mRNA 발현을 관찰하였다(그림 1C). CD4+CD25+ T 세포가 반응 T 세포군(Respon- der T cell)의 증식반응을 억제하는지 조사하기 위하 여 PHA와 함께 공조배양한 결과 CD4+CD25+ T 세 포가 반응 T 세포군에 비하여 10배 적게 들어가는 배양에서도 반응 T 세포군의 증식반응이 억제되었 다(그림 1D).
2. IL-4에 의한 혈액내 CD4+CD25- T 세포로부터 CD4+CD25+ T 세포의 유도
말초혈액단핵구세포로부터 MACS를 이용하여 CD4+ CD25- T 세포를 분리하여 IL-4 (0.1∼10 ng/mL)나 anti-CD3 (2 ug/mL)와 IL-4 (0.1∼10 ng/mL)로 자극하 여 5일 동안 배양 후 CD4+CD25+ T 세포를 FACS 로 조사하였다. 5일 배양 조건은 1일부터 7일까지
Fig. 1. Human peripheral blood contains CD4+CD25+ regulatory T cells. (A) Human peripheral blood contains both CD4+ CD25+hi and CD4+CD25+lo regulatory T cells. Mononuclear cells from freshly drawn human blood were stained with different combination of anti-CD4 (PerCP) and anti-CD25 (APC). The cells in these analyses were gated on lymphocytes via their forward and side scatter properties. The CD4+CD25+hi CD4+CD25+lo and CD4+CD25- populations were analyzed using indicated gates. (B) Human CD4+CD25+ T cells are CD45RO+, CD45RA- and express surface Ags associated with activated T cells. Human PBMC were stained with either anti-CD4 (PerCP), anti-CD25 (APC), and or anti-CD25 (PE), or anti-CD45RA (FITC) or ant-CD45RO (PE), or anti-OX40 (FITC), or anti-CTLA4 (APC), or anti-GITR (FITC), or anti-HLA-DR (PE), or anti-CD62L (FITC). Control samples stained with mIgG1 (FITC), mIgG1 (PE), mIgG2a (APC), mIgG2b (PE), mIgG2b (FITC), mIgG2a (PE), as the triple color staining. Gates were set as described in (A). The histogram analysis of the CD4+CD25- and CD4+CD25+hi, CD4+CD25+lo populations were scaled to 100. The analysis was performed with CellQuest software C. (C) Foxp3 is expressed by CD4+CD25+ T cells. RNA was extracted from purified CD4+CD25+, CD4+CD25- T cells and CD4- T cells immediately after cell isolation from 3 normal patients. Foxp3 mRNA was reverse transcribed into cDNA and amplified by PCR. An expected 320-bp PCR product was detectable in CD4+ CD25+ but not in CD4+CD25- T cells. (D) CD4+CD25+ T cells suppress proliferation of T cells. Freshly isolated CD4+T cells (1×105 cells/well) were cultured with irradiated APC (1×105 cells/well) in the absence or presence of PHA (5μg/
mL), and then added to CD4+CD25+ T cells in a dose dependent (1×105, 5×104, 1×103 cells/well). Proliferation was assessed by 3H-Thymidine incorporation after a pulse during the last 16 h of a 72 h culture.
FL4-H: APC CD25APC-CD25
FL3-H: CD4 Percp Percp-CD4 104
103
102
101
100
150 100
50
50 100 150 200 250
0
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100 0
20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100 0
20 40 60 80 100
0 20 40 60 80 100
0 0 0 0 0 0
30 60 90 120
20 40 60 80
100 200 300 400
50 100 150
100 200 300 400
100
100
100
100
100 100 100 100 100
101
101
101
101
101 101 101 101 101
102
102
102
102
102 102 102 102 102
103
103
103
103
103 103 103 103 103
104
104
104
104
100 101 102 103 104
100 101 102 103 104100 101 102 103 104
100 101 102 103 104
100 101 102 103 104100 101 102 103 104 100 101 102 103 104
100 101 102 103 104100 101 102 103 104
100 101 102 103 104
100 101 102 103 104100 101 102 103 104 100 101 102 103 104
100 101 102 103 104100 101 102 103 104
100 101 102 103 104
100 101 102 103 104 100 101 102 103 104
100 101 102 103 104
104 104 104 104 104
Isotype
CD45RO
0.53
98.2 0 5.84 48.9 13.2 27.3 79.2
84.6 14.5
29.9 71.1 0.78 0.74 13.2 1.91 85.3
11.5 3.08 14.3 3.31 73.5
0.28 0.33 0.27 0.12 0.79 0.023
CD45RA
N1 N2 N3 N1 N2 N3
Ox40 CTLA-4 GITR HLA-DR CD62L
100 101 102 103 104
CD4 CD25 (0.95% 0.4)
+ hi
CD4 CD25+ hi
CD4 CD25 (8.37% 0.3)
+ lo
CD4 CD25+ lo
CD4 CD25 (18.9% 0.3)
+ -
CD4 CD25+ -
CD4 CD25+ - T cell Foxp3 GAPDH
Foxp3 GAPDH
Foxp3 GAPDH
CD4 CD25+ + T cell
CD4- T cell
+
+
+
Cpm
Nil PHA (5 ug/mL)
CD4 CD25 +APC+ -
CD4 CD25 +APC+CD4 CD25 1*10 (R : S=10 : 1)+ - + + 4 CD4 CD25 +APC+CD4 CD25 5*10 (R : S=2 : 1)+ - + + 4 CD4 CD25 +APC+CD4 CD25 1*10 (R : S=1 : 1)+ - + + 5
0 30,000 25,000 20,000 15,000 10,000 5,000
A D
B
C
― 268 ―
― 269 ―
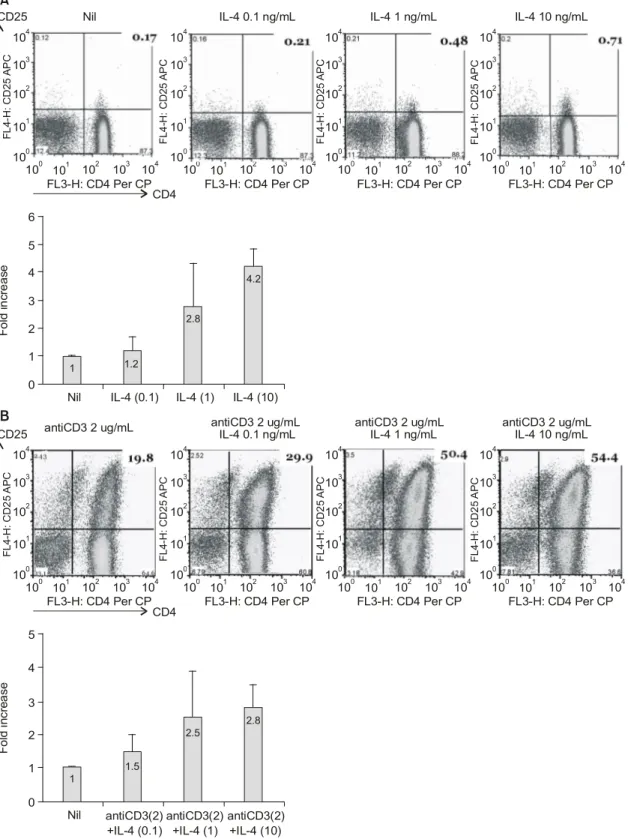
Fig 2. CD4+CD25- cells convert into CD4+CD25+ regulatory T cells in vitro under IL-4 stimulation. (A) Isolated CD4+CD25- T cell from PBMC stimulated by IL-4 (0.1 ng, 1 ng, 10 ng) in the absence or the presence of anti-CD3 (3 ug) for 5 day. Cultured CD4+CD25- T cells were stained by anti-CD4 (PerCP) and anti-CD25 (APC) for CD4+CD25+ T cells. (B) Folding increase values for IL-4 Converts CD4+CD25- T Cells to CD4+ CD25+ T cells in each sample were calculated as the relative quantity of CD4+CD25+ T cells divided by the relative quantity of unstimulated of CD4+CD25- T cells.
FL3-H: CD4 Per CP
FL3-H: CD4 Per CP
FL3-H: CD4 Per CP
FL3-H: CD4 Per CP
FL3-H: CD4 Per CP
FL3-H: CD4 Per CP
FL3-H: CD4 Per CP
FL3-H: CD4 Per CP CD4
CD4
FL4-H: CD25 APCFL4-H: CD25 APC
104
104 103
103 102
102 101
101 100
100 100
100 101
101 102
102 103
103 104
104
FL4-H: CD25 APCFL4-H: CD25 APC
104
104 103
103 102
102 101
101 100
100 100
100 101
101 102
102 103
103 104
104
FL4-H: CD25 APCFL4-H: CD25 APC
104
104 103
103 102
102 101
101 100
100 100
100 101
101 102
102 103
103 104
104
FL4-H: CD25 APCFL4-H: CD25 APC
104
104 103
103 102
102 101
101 100
100 100
100 101
101 102
102 103
103 104
104
Fold increaseFold increase
Nil
Nil
IL-4 (0.1)
+IL-4 (0.1)
IL-4 (1)
+IL-4 (1)
IL-4 (10)
+IL-4 (10) CD25
CD25
Nil
antiCD3 2 ug/mL antiCD3 2 ug/mL
antiCD3(2) antiCD3(2) antiCD3(2)
antiCD3 2 ug/mL antiCD3 2 ug/mL IL-4 0.1 ng/mL
IL-4 0.1 ng/mL
IL-4 1 ng/mL
IL-4 1 ng/mL
IL-4 10 ng/mL
IL-4 10 ng/mL 0
0 6
5
4
3
2
1 5 4 3 2 1
A
B
1
1 1.5
2.5 2.8
1.2
2.8
4.2
― 270 ― 조사해 본 결과 가장 이상적인 세포의 전환을 관찰 할 수 있었던 배양시간이었다(data not shown).
CD4+CD25+ T 세포는 IL-4 단독에 의해서 1.2배에서 4.2배까지 농도 의존적으로 증가하는 것을 관찰하였 다(그림 2A). Anti-CD3 Ab와 IL-4 (0.1∼10 ng/mL)로 동시에 자극한 경우에도 anti-CD3 Ab단독 처리군에 비하여 1.5배에서 2.8배까지 증가하는 것을 확인하였 다(그림 2B). 따라서 IL-4는 단독으로 혹은 anti-CD3 Ab 자극과 함께 CD4+CD25- T 세포를 CD4+CD25+ T 세포로 유도됨을 관찰할 수 있었다.
3. IL-4로 유도된 CD4+CD25+ T 세포의 표현형 분석
CD4+CD25+ 면역조절 T 세포의 일반적인 세포 표 현형은 Fig 1에서 살펴본 바와 같다. 우리는 IL-4의 자극을 통해 생성된 CD4+CD25+ T 세포의 표현형 을 일반적인 CD4+CD25+hi T 세포의 표현형과 비교 조사하였다. IL-4와 anti-CD3 Ab동시에 자극한 경우 생성된 CD4+CD25+ T 세포는 CD45RO (82.4%)와 CTLA-4 (49.7%)가 높게 발현되며 HLA-DR (36.5%) 과 CD62L (87.9%) 역시 높게 발현되는 반면 CD45RA (1.56%)는 적게 발현되어 이런 결과는 정상적인 혈
액의 CD4+CD25+hi T 세포와 매우 유사하다. IL-4단 독 자극에 의해 생성된 CD4+CD25+ T 세포는 위의 세포표현형들의 발현정도가 일반적인 CD4+CD25+hi T 세포나 IL-4와 anti-CD3 Ab 자극을 통해 생성된 CD4+CD25+ T 세포보다 떨어져 있는 것을 관찰할 수 있었다(그림 3). 특히 HLA-DR (1.85%)의 발현은 현저하게 떨어져 있었다. 재미있게도 IL-4와 anti- CD3 Ab 자극에 의해서 생성된 CD4+CD25+ T 세포 는 면역조절 T 세포의 증식과 활성에 관여하는 것 으로 알려진 OX40 (19.6%) 보조자극인자의 발현이 의미있게 증가되는 것을 관찰하였고, GITR (79.6%) 역시 일반적인 CD4+CD25+hi T 세포군에 비하여 현 저히 증가하여 발현하는 것을 관찰하였다.
4. IL-4로 유도된 CD4+CD25+ T 세포의 Foxp3 유 전자 발현 조사
일반적으로 T 세포 증식반응을 억제하는 CD4+CD- 25+ 면역조절 T 세포는 특이적으로 Foxp3 유전자를 발현한다. IL-4와 anti-CD3 Ab 자극에 의해서 생성된 CD4+CD25+ T 세포가 이러한 Foxp3 유전자를 발현 하는지 조사하기 위하여 RT-PCR과 FACS 염색을 하 였다. IL-4 단독에 의해서 자극한 세포는 자극 없이 Fig. 3. Expression of surface markers CD45RO, CD45RA, CTLA4, HLA-DR and CD62L is similar between converted and naturally harvested CD4+CD25+ T cells. Converted CD4+CD25+ T cells were with either anti-CD4 (PerCP), anti-CD25 (APC), and or anti-CD25 (PE), or anti-CD45RA (FITC) or ant-CD45RO (PE), or anti-OX40 (FITC), or anti-CTLA4 (APC), or anti-GITR (FITC), or anti-HLA-DR (PE), or anti-CD62L (FITC). Control samples stained with mIgG1 (FITC), mIgG1 (PE), mIgG2a (APC), mIgG2b (PE), mIgG2b (FITC), mIgG2a (PE), as the third color staining. Gate wasdescribed as Fig. 1A. The histogram analysis of the naturally CD4+CD25+hi Treg, converted CD4+CD25+ by IL-4, and converted CD4+CD25+ by IL-4 plus anti CD3 populations were scaled to 100. The analysis was performed with CellQuest software.
100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0 100
80 60 40 20 0 100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0 100
80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0
100 80 60 40 20 0 100 101 102 103 104
100 101 102 103 104
100 101 102 103 104 100 101 102 103 104 100 101 102 103 104100 101 102 103 104 100 101 102 103 104100 101 102 103 104100 101 102 103 104 100 101 102 103 104 100 101 102 103 104100 101 102 103 104 100 101 102 103 104100 101 102 103 104100 101 102 103 104 100 101 102 103 104 100 101 102 103 104 100 101 102 103 104 100 101 102 103 104 100 101 102 103 104 100 101 102 103 104
CD45RO
98.2
31.4
82.4 1.56 19.6 49.7 79.6 36.5 87.9
20.5 4.25 16 29.1 1.85 90.4
0
FL2-H: PECD45RO
FL2-H: PECD45RO
FL1-H: HRCTCD45RA FL1-H: HRCTCOX40
FL1-H: HRCTCOX40 FL1-H: HRCTCD45RA
FL4-H: APCCLA4
FL4-H: APCCLA4
FL1-H: RTCGITR
FL1-H: RTCGITR
FL2-H: PEHLA-DR
FL2-H: PEHLA-DR
FL1-H: FITCCD62L
FL1-H: FITCCD62L
% of MAK% of MAK
5.84 48.9 13.2 27.3 79.2
CD45RA Ox40 CTLA-4 GITR HLA-DR CD62L
CD4 CD25+ + (IL-4 10 ng/mL)
(AntiCD3 10 ng/mL)
+IL-4 CD4 CD25+ hi
CD4 CD25+ +
― 271 ― 배양된 세포에 비해서 2배의 Foxp3 유전자 발현이 증가되는 것을 관찰하였고, IL-4와 anti-CD3 Ab를 동 시에 자극한 세포인 경우 anti-CD3 Ab만 자극한 세 포에 비하여 Foxp3 유전자 발현이 증가되는 것을 관 찰하였다(그림 4A). 이전에 보고된 CD4+CD25+ T 세포 유도 시 TGFβ가 Foxp3 발현을 촉진한다는 결 과를 참조하여 anti-CD3 Ab와 TGFβ나 IL-4를 동시 에 자극하여 Foxp3 발현을 FACS로 조사해 본 결과 자극하지 않은 대조 그룹에 비하여 TGFβ를 자극한 경우 Foxp3 발현이 8.9배 증가되었으며 IL-4 (1∼10 ng/mL)로 자극할 경우 6∼22.2배 Foxp3 발현시키는 것을 관찰할 수 있었다. 따라서 이전 보고에서 확인 된 TGFβ에 의해 유도되는 Foxp3 유전자보다 IL-4 (10 ng/mL)를 처리한 세포군에서 나타난 Foxp3 유전 자 발현이 더 높게 나타났다(그림 4B). 이러한 결과 로 IL-4 자극을 통하여 생성 유도된 CD4+CD25+ T 세포에서도 일반적인 CD4+CD25+ 면역조절 T 세포 와 같이 Foxp3 유전자가 발현됨을 확인하였다.
5. IL-4로 유도된 CD4+CD25+ T 세포의 T 세포 증 식 억제기능 조사
본 연구에서 관찰된 IL-4에 의해서 유도된 CD4+ CD25+ T 세포가 면역조절 T 세포로써 T 세포 증식 억제기능을 가지고 있는지를 조사하기 위해서 IL-4 로 자극 후 CD4+CD25+ T 세포와 CD4+CD25- T 세포를 각각 분리하였다. 이전에 CD4+CD25+ 면역 조절 T 세포와 연관이 있는 것으로 알려진 IL-10과 TGFβ도 IL-4와 동일한 방법으로 세포에 자극을 준 후 CD4+CD25+ T 세포와 CD4+CD25- T 세포를 각 각 분리하였다. 이러한 세포들을 anti-CD3 Ab, 반응 T 세포군, 항원제시세포와 함께 공조배양 시 반응 T 세포 증식반응을 억제하는지 조사하였다. IL-4, IL- 10, TGFβ로 각각 자극 후 분리한 CD4+CD25- T 세포들은 반응 T 세포 증식반응을 억제하지 못했다.
반면에 IL-4 자극 후 분리한 CD4+CD25+ T 세포는 반응 T 세포의 증식반응을 의미있게 억제하는 것을 Fig. 4. Converted CD4+CD25+ T cells exhibit expression of Foxp3. (A) CD4+CD25- T cells were cultured Nil (unstimulated)(lane 1), IL-4 (10 ng/mL)(lane 2), anti-CD3 (2 ug/mL)(lane 3), anti-CD3 (2 ug) plus IL-4 (10 ng/mL) (lane 4), for 5 day. Foxp3 expression was assessed by RT-PCR. A representative of three independent experiments is shown. (B) Isolated CD4+CD25- T cells were cultured with anti-CD3 (2 ug/mL) or plus IL-4 (1 ng/mL, 10 ng/mL) or TGF-β (10 ng/mL) for 5 day and they stained by anti-Foxp3. Folding increase values for Foxp3 expression in each sample were calculated as the relative quantity of Foxp3 divided by the relative quantity of unstimulated of CD4+CD25- T cells.
Fold increase (Foxp3 expression)
Ratio (Foxp3/GAPDH)
Nil IL-4 1 ng/mL
IL-4 10 ng/mL
TGF 10 ng/mLβ
Media IL-4 Anti-CD
Ab 3 Anti-CD3Ab +IL-4
Anti-CD3Ab 1
FOXP3
GAPDH
2 3 4
0
0
35 30 25 20 15 10 5 6
5 4 3 2 1
A B
― 272 ― 관찰하였고(65.6%), 이러한 결과는 TGFβ 자극 후 분리한 CD4+CD25+ T 세포의 효과와도 유사하였다 (58.8%). 하지만 IL-10 자극 후 분리한 CD4+CD25+ T 세포나 사이토카인 자극 없이 배양 후 분리한 CD4+ CD25+ T 세포는 반응 T 세포증식 억제효과가 없었
다(그림 5A). 다음은 anti-CD3 Ab 자극과 동시에 IL-4, IL-10, TGFβ 각각의 사이토카인을 자극한 후 CD4+CD25+ T 세포와 CD4+CD25- T 세포를 각각 분리하였다. 이때 흥미롭게도 IL-4 단독 배양 후 분리 한 CD4+CD25- T 세포와는 달리 anti-CD3 Ab와 Fig. 5. Converted CD4+CD25+ cells suppress responder cell proliferation. (A) Isolated CD4+CD25- T cell from PBMC were cultured with absence or presence cytokines (IL-4, TGF-β, IL-10). After 5 day, viable CD4+CD25- T cell were stained with anti-CD4 (FITC) and anti-CD25 (PE), then sorted with flowcytometry into two populations. The individual populations (sorted CD4+CD25+ T cells or sorted CD4+CD25- T cells; (1×104/well) were cultured with responder T cells, irradiated APCs and anti CD3 to monitor their proliferative response.
Proliferation was assessed by 3H-thymidine incorporation after a pulse during the last 16 h of a 72 h culture. The data are shown as mean of triplicate wells of 3H incorporation (cpm). The data are representative of three experiments. (B) Isolated CD4+CD25- T cell from PBMC were cultured with absence or presence cytokines (IL-4, TGF-β, IL-10) plus anti-CD3. After 5 day, viable CD4+CD25- T cell were stained with anti-CD4 (FITC) and anti-CD25 (PE), then sorted with flowcytometry into two populations. The individual populations (sorted CD4+ CD25+ T cells or sorted CD4+CD25- T cells; 1×104/well) were cultured with responder T cells, irradiated APCs and antiCD3 to monitor their proliferative response.
― 273 ― IL-4를 동시에 자극한 후 분리한 CD4+CD25- T 세
포는 약간의 반응 T 세포증식 억제 효과를 관찰하 였다(18.5%). 또한 이들의 CD4+CD25+ T 세포는 단 독 사이토카인 배양 후 분리한 CD4+CD25+ T 세포 결과와 유사하게 IL-4나 TGFβ의 자극 후 분리 배양 된 CD4+CD25+ T 세포에서 가장 의미있는 반응 T 세포 증식반응 억제효과를 관찰하였다(IL-4: 63.7%, TGFβ: 45.4%)(그림 5B). CD4+CD25+ 면역조절 T 세포가 T 세포 증식반응을 억제하는 기전으로 세포 접촉을 통한 직접적인 기전과 IL-10과 TGFβ와 같은 사이토카인 의존적인 간접적인 기전이 알려져 있다.
IL-4에 의해서 생성된 CD4+CD25+ T 세포가 어떤 기전으로 반응 T 세포 증식반응을 억제하는지 조사 하기 위하여 증식반응 조사시에 transwell과 IL-10, IL-4, TGFβ 각각에 대하여 차단항체를 넣어 기전을 조사하였다. 먼저 세포접촉에 의한 억제기능 여부를 판별할 수 있는 transwell 사용 결과 IL-4에 의해 생 성된 CD4+CD25+ T 세포는 transwell에 의해 반응 T 세포 증식반응이 약간 회복되는 것을 관찰하였다(그
림 6A). 사이토카인 의존적인 T 세포 증식반응 조절 기전이 있는지 확인하기 위해 IL-10, IL-4, TGFβ 각 각의 차단항체를 넣어 증식반응을 조사해 본 결과 IL-10, IL-4, TGFβ 각각의 차단항체에 의해 부분적 으로 반응 T 세포 증식반응을 회복시키는 것이 확 인되었다. 이러한 사이토카인 차단항체들간의 차이 는 나타나지 않았다(그림 6B).
따라서 IL-4 자극을 통해 생성된 CD4+CD25+ T 세포는 면역조절 T 세포로써 중요한 T 세포 증식 억 제기능이 있으며 이때 T 세포 증식을 억제하는 기전 은 반응 T 세포와 직접적인 세포접촉과 IL-10, TGF β, IL-4와 같은 면역조절사이토카인 분비를 통한 간 접적인 기전이 모두 관여하는 것으로 추정되었다.
고 찰
본 연구에서는 IL-4라는 특정 사이토카인을 말초 혈액에서 분리한 CD4+CD25- T 세포군에 처리하여 CD4+CD25+ T 세포로 전환시켰으며 이때 전환된 Fig. 6. Converted CD4+CD25+ T cells suppress responder cell proliferation through cell contact and the production TGFβ, IL-10 and IL-4. Purified CD4+CD25- T cells were cultured with IL-4 plus anti-CD3 for 5 day. viable CD4+CD25- T cell were stained with anti-CD4 (FITC) and anti-CD25 (PE), then sorted with flow- cytometry into two populations. The individual populations (sorted CD4+CD25+ T cells or sorted CD4+CD25- T cells; (1×104/well) were cultured with responder T cells, irradiated APCs and antiCD3 and transwell (A), or anti-TGF-β neutralizing antibody, or anti-IL-10 neutralizing antibody, or anti-IL-4 neutralizing antibody (B).