생물전환 기법을 이용한 토란 뿌리 추출물의 RAW 264.7 세포에 대한 항염증 효과
박태진, 심지한, 홍혜현, 한동환*, 김승영*
Anti-inflammatory Effect of Colocasia esculenta Biorenovate Extract in LPS-stimulated RAW 264.7 Cells
Taejin Park, Ji Han Sim, Hyehyun Hong, Dong-Hwan Han*, and Seung-Young Kim*
Received: 25 May 2020 / Revised: 28 May 2020 / Accepted: 29 May 2020
© 2020 The Korean Society for Biotechnology and Bioengineering
Abstract: Biorenovation is a method of modifying the struc- ture of a broad range of substrates such as chemical com- pounds and plant extract by microbial enzymes with the potential benefits of reduced cytotoxicities and enhanced bio- logical activities relative to its parent substrates. We generated Colocasia esculenta L. Schott root extract using Biorenova- tion technology and tested the anti-inflammatory properties of its Biorenovation product (CEB) in lipopolysaccharide (LPS)- treated RAW264.7 murine macrophages. CEB inhibited the LPS-induced production of pro-inflammatory markers such as nitric oxide (NO), prostaglandin E
2(PGE
2), interleukin-6 (IL- 6), interleukin-1β (IL-1β), cyclooxygenase-2 (COX-2), induc- ible nitric oxide synthase (iNOS) in a concentration dependent manner without no noticeable toxicities in RAW 264.7 cells.
Then together, our results indicate that CEB could be a new source for the ingredients of cosmetics and pharmaceuticals.
Keywords: anti-inflammation, Bio-renovation, COX-2, iNOS, Colocasia esculenta L. Schott
1. INTRODUCTION
염증은 독성물질, 손상된 조직과 병원균의 감염 등의 유해한 자극으로부터 신체를 방어하기 위해 가장 먼저 일어나는 병 리학적 반응의 특징으로, 다양한 면역세포가 염증 매개 인자 를 발현하여 외부 감염에 대해 반응을 하는 복잡한 과정이다 [1-3]. 염증 반응은 외부 자극으로 인한 조직의 손상에 대하 여 구조나 기능을 회복시킬 수 있는 유익한 체내 방어기전이 지만 염증 반응이 만성적이고 과하면 세포나 조직의 기능장 애 및 괴사를 일으키며 뇌 질환, 아토피, 암, 심혈관 질환 등 과 같은 다양한 질병으로 발달할 수 있어서 염증을 일으키는 인자들을 찾아 조절 및 제거하고 기전을 밝히기 위한 연구가 활발히 진행되고 있다 [4-11]. 이와 같은 염증 반응은 주로 대 식세포가 관여하며, 그 중 그람 음성균 외막에 존재하는 Lipopolysaccharide (LPS)가 대식세포를 자극하는 대표적인 염 증 유발 인자로 작용한다. 대식세포는 CD14에 결합된 LPS를 Toll-like receptor 4 (TLR4)라 불리는 pattern recognition receptor를 통해 인식하여, mitogen-activated protein kinase (MAPK) family 및 여러 신호전달 경로를 활성화시킨다 [12- 14]. 그로 인하여 nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB) 를 유도하고 inducible nitric oxide synthase (iNOS) 와 cyclooxygenase-2 (COX-2), interleukin-1β (IL-1β), interleukin-6 (IL-6) 및 tumor necrosis factor-α (TNF- α) 등과 같은 pro-inflammatory cytokine들의 발현으로 이어 진다 [15-17].
본 연구에서 사용된 천남성과에 속하는 토란 (Colocasia esculenta L. Schott)은 이용가치가 높은 구황작물로 한국뿐
선문대학교 제약생명공학과Department of Pharmaceutical Engineering & Biotechnology, Sunmoon University, Asan 31460, Korea
Tel: +82-41-530-2227, Fax: +82-41-530-2939 E-mail: dhhan@sunmoon.ac.kr
Tel: +82-41-530-2390, Fax: +82-41-530-2939 E-mail: sykim01@sunmoon.ac.kr
Research Paper
만 아니라 인도, 인도네시아 등에 서식한다 [18]. 토란은 생산 과 소비지역에 따라 taro, dasheen, eddoe 등으로 불리며, 수분 을 제외하고 dextrin과 sucrose, galactan. galactose, mannose 등 이 포함되어 있다고 알려져 있다. 동의보감에 따르면 토란은 생식을 하면 약간의 독이 있으며, 피와 원기를 보호하여 숙 혈과 사기를 없애주는 특효약으로 민간요법에 이용되었다 고 한다. 또한, 관절염 및 통풍, 고혈압, 항암 등에 좋은 효능 을 가진다고 보고되었다 [19]. 최근 이미 알려진 소재들을 다 양한 기술을 통하여 재활용하는 연구 개발이 이루어지고 있 는 가운데, 본 연구에서는 Bacillus amyloliquefaciens (KCTC 43033) 균을 이용한 생물전환 기법인 biorenovation 기법을 이용하였다 [20]. 생물전환을 통한 토란의 생리활성 연구를 위하여 RAW 264.7 세포에 대한 독성뿐만 아니라 IL-6, IL- 1β, TNF-α의 전염증성 사이토카인의 발현과 iNOS, COX-2 의 단백질 발현 억제 효과를 조사하였고, 생물전환을 통한 토란 추출물의 기능성 식품, 화장품 소재나 약재 원료 등으 로서의 활용 가능성을 모색하고자 한다.
2. MATERIALS AND METHODS
2.1. 토란 추출물 제조
본 연구에 사용된 토란 (Colocasia esculenta (L.) Schott)의 뿌 리는 제주특별자치도 제주시 아라동에서 2018년 4월에 채집 되었으며 제주생물자원(주)으로부터 제공받았다. 토란의 뿌 리는 실온에서 24시간 동안 70% Ethanol을 이용하여 2회에 걸쳐 추출하였으며, paper filter로 여과한 후 감압농축기를 사용하여 농축하였다. 농축된 추출물을 −110
oC에서 동결 건 조한 후 실험에 사용하였다.
2.2. 미생물 배양 및 Biorenovation 반응
본 연구에서 사용된 미생물은 Bacillus amyloliquefaciens (KCTC 43033) 균주이며 미생물센터에서 분양받아 Nutrient broth (Beef extract 3.0 g/L, Peptone 5.0 g/L)에서 최적 생육 조 건에 맞추어 20시간 동안 배양 후, 10분 동안 5,000 rpm으로 원심 분리하여 미생물 pellet을 수득하였다. 얻어진 pellet을 PG buffer (50 mM Phosphate buffer, 2% Glycerin) 로 2회 세척한 후, 동일 buffer에 현탁하여 사용하였다. 30
oC에서 72시간 반응 후, 원심 분리하여 얻어진 상등액을 감압농축기를 사용하여 농축한 후, −110
oC에서 동결 건조하여 실험에 사용하였다.
2.3. Biorenovation 전환물의 HPLC 분석
HPLC분석을 위해 Shimadzu SpectroMonitor 3200 digital UV/Vis detector (Phenomenex 4 μm Hydro-RP 80 Å, 250 × 4.6 mm)를 사용하였으며, 이동상은 0.1% TFA (Trifluoroacetic acid)를 함유한 water와 Acetonitrile를 사용하였다. 분석 조건 은 시료를 10 μL 주입하였으며, 유속은 1.0 mL/min으로, 온 도는 40
oC에서 Gradient 조건으로 30분 동안 254 nm의 파장 으로 분석하였다.
2.4. 세포배양
본 연구에서 사용된 RAW 264.7 세포는 한국세포주은행에서 분양받아 10% fetal bovine serum (FBS)과 100 units/mL penicillin-streptomycin 이 함유된 Dulbecco's Modified Eagle Medium (DMEM, Gibco, NY, USA) 배양액을 사용하여 37
oC, 5% CO
2조건에서 배양하였다.
2.5. 세포 독성 측정
세포 독성 측정은 24 well plate에 RAW 264.7 세포를 8.0 × 10
4cells/well만큼 분주하여 37
oC, 5%, CO
2조건의 incubator 에서 24시간 전 배양한 후 시료와 LPS (1 μg/mL)를 동시 처 리하고, 24시간 동안 배양하였다. 이후 MTT를 첨가하여 37
oC에서 4시간 동안 반응시킨 다음 상층액을 제거한 후 DMSO를 첨가하여 침전물을 용해시킨 후 96-well plate에 옮 겨 담아 ELISA reader를 사용하여 570 nm에서 흡광도를 측 정하였다. 각 시료 군에 대한 평균 흡광도를 측정하였으며, 대조군의 흡광도 측정값과 비교하여 세포독성을 평가하였다 [21].
2.6. NO 생성 억제 활성 측정
24 well plate에 RAW 264.7 세포를 8.0 × 10
4cells/well만큼 분 주하고 37
oC, 5% CO
2조건의 incubator에서 24시간 전 배양시 켰다. 이후 시료와 LPS (1 μg/mL)를 동시 처리하여 24시간 배 양한 후 상층액 100 μL와 Griess 시약 [1% (w/v) sulfanilamide, 0.1% (w/v) naphylethylenediamine in 2.5% (v/v) phosphoric acid] 100 μL를 96 well plate에서 동량 혼합하여 10분간 암반 응 시킨 후 ELISA reader를 사용하여 540 nm에서 흡광도를 측정하였다.
2.7. Prostaglandin E
2(PGE
2) 생성 억제 활성 측정 RAW 264.7 cell (8.0 × 10
4cells/well) 에 시료와 LPS (1 μg/mL)를 동시에 처리하여 24시간 배양하였다. 24시간 후 배양 배지를 원심분리 (12,000 rpm, 3 min) 하여 얻어진 상등액의 PGE
2함 량을 mouse enzyme-linked immnunosorbent assay (ELISA) kit (R&D Systems Inc., Minneapolis, MN, USA)를 이용하여 측정하였다.
2.8. Western blot analysis
RAW 264.7 세포를 4.0 × 10
5cells/well만큼 24시간 전 배양한
후 시료와 LPS (1 μg/mL)를 동시 처리하여 24시간 배양하였
다. 이후 세포를 PBS를 이용해 2회 세척하고 lysis buffer
[1×RIPA (Upstate Cell Signaling Solution, NY, USA), 1 mM
phenylmethylsulfonyl fluoride (PMSF), 1 mM Na
3VO
4, 1 mM
NaF, 1 μg/mL aprotinin, 1 μg/mL pepstatin, and 1 μg/mL
leupeptin]를 이용해 1시간 동안 lysis 시킨 후 원심 분리하여
단백질 상층액을 분리하였다. 단백질 농도는 BCA kit (Bio-
Rad, USA) 를 사용하여 정량하였다. 정량한 단백질을 10%의
polyacrylamide gel에 전기영동하고 poly-vinylidene difluoride
(PVDF) membrane (Milipore, Burlington, MA, USA)에 200
mA, 2시간 동안 전이시켰다. 단백질이 전이된 membrane을 5% 탈지분유를 포함한 0.05% Tween 20/Tris-buffered saline (0.05% T/TBS)에 넣고 상온에서 1시간 blocking 시킨 후, 1차 항체와 반응시켰다. 1차 항체 반응은 iNOS antibody (1:5,000, Bio-Rad, USA), COX-2 antibody (1 : 1,000, Rockland Immunochemicals, Inc., USA), β-actin antibody clone AC-74 (1 : 10,000, Sigma, USA)를 이용하여 4
oC에서 하루 밤 동안 반응시킨 후 0.05% T/TBS 용액으로 3회 세척 후 2차 항체 (Jackson ImmunoResearch, USA) 를 1 : 10,000으로 희석하여 상온에서 1시간 반응한 뒤 0.05% T/TBS 용액으로 3회 세척 하였다. 단백질은 ECL kit (Bio-Rad, USA)를 사용하여 imaging densitometer (model GS-700, Bio-rad, USA) 를 통해 측정하였다. 또한, imageJ program (NIH, Bethesda, MD, USA)을 이용하여 β-actin 대비 iNOS와 COX-2 단백질 발현 량의 면적을 수치화한 뒤 그래프로 나타내었다.
2.9. 전염증성 cytokine (TNF-α, IL-6, IL-1β) 생성 억제 활성 측정
RAW 264.7 세포를 24 well plate에 8.0 × 10
4cells/well만큼 37
oC, 5% CO
2incubator에서 24시간 동안 전 배양한 후 다양 한 농도의 시료와 LPS (1 μg/mL)를 동시에 처리하여 24시간 배양하였다. 이후 배양 배지를 원심분리 (12,000 rpm, 3 min) 하여 얻어진 상층액의 전염증성 cytokine 생성량은 Mouse TNF-α ELISA Kit (Invitrogen, California, USA), Mouse IL-6 ELISA Kit (BD Biosciences, California, USA), Mouse IL-1β ELISA Kit (R&D Systems Inc., Minneapolis, MN, USA)를 이 용하여 측정하였다.
2.10. 통계처리
모든 실험은 3회 반복하여 측정하였고, 그 결과는 평균값±표 준편차로 나타냈으며 통계적 분석은 각 처리구간의 유의성 (* p < 0.05; **p < 0.01)을 검증을 위해 분산분석 (analysis of variance, ANOVA)후 student’s t-test로 다중비교를 실시하였다.
3. RESULTS AND DISCUSSION
3.1. Biorenovation 전환물의 HPLC 분석
B. amyloliquefaciens 균주를 이용하여 토란 뿌리 추출물을
biorenovation 기법으로 생물 전환하였다. 반응 후, 원심분리 를 통해 반응물의 상등액을 회수하여 감압농축 하였고, HPLC를 통해 분석을 진행한 결과, 토란의 뿌리 추출물과 비 교했을 때 biorenovate 추출물 시료에서 신규 peak를 확인할 수 있었다 (Fig. 1). 이는 본 논문에서 사용된 생물전환 기법 에 의해 토란 뿌리 추출물에 존재하는 다수 화합물이 B.
amyloliquefaciens에 의해 미지의 화합물로 생물전환 되어 나 타난 peak의 가능성을 시사했다.
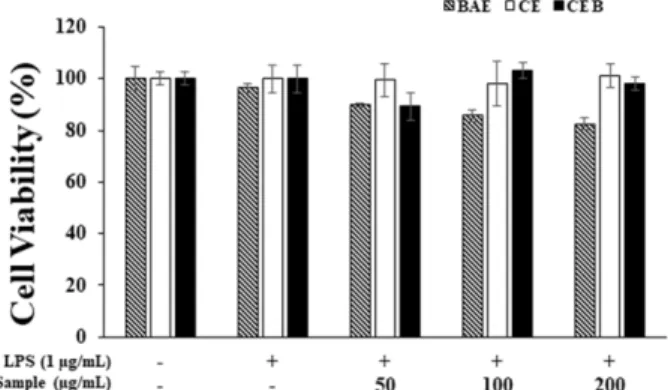
3.2. 세포 독성 비교 측정
RAW 264.7 세포에 대한 토란 뿌리 추출물 (CE)과 생물 전환 된 토란 뿌리 추출물 (CEB), 생물 전환 기법에 사용된 B.
amyloliquefaciens 추출물 (BAE)을 각각 사용하여 세포 생존 율을 조사하였다. 그 결과 CEB 추출물은 처리 농도에서 모 두 약 90% 이상의 생존율을 나타내었으며 CE 추출물도 CEB 추출물과 동일하게 무 처리 군과 비교 시 측정 농도에 서 90% 이상의 생존율을 보이며 두 추출물 모두 RAW 264.7 세포에 대한 독성이 미미한 것을 확인하였다. 그리고 생물 전환에 사용된 BAE의 추출물은 200 μg/mL까지 82% 이상의 세포 생존율을 보였지만 농도 의존적으로 세포에 대한 독성 을 보이는 것을 확인하였다 (Fig. 2). 추후 실험에서 세포 독
Fig. 1. HPLC Chromatogram of Colocasia esculenta (L.) Schott Root extract(CE), Colocasia esculenta Biorenovate Extract (CEB) and Bacillus amyloliquefaciens (BAE). The chromatogram of a) showed Colocasia esculenta root Extract (CE). The chromatogram of B) showed Colocasia esculenta Biorenovate Extract (CEB).
Fig. 2. Inhibitory effects of BAE, CE, and CEB on cell viability in RAW 264.7 cells. The production of nitric oxide was assayed in the culture medium of cells stimulated with LPS (1 μg/
mL) for 24 h in the presence of BAE or CE or CEB (50, 100, and
200 μg/mL). Cytotoxicity was determined by MTT assay. Result
is expressed as percentages compared to the respective values
obtained for the control.
성을 보이지 않는 농도(50, 100, 200 μg/mL)로 진행하였다.
3.3. NO 생성 억제 활성 비교
염증을 유발하는 원인이 되는 활성산소 Nitric oxide (NO)의 생성에 CE 추출물과 CEB 추출물 그리고 BAE 추출물이 어 떠한 영향을 미치는지에 대해서 조사하였다 (Fig. 3). RAW 264.7 세포에 각각의 추출물 (50, 100, 200 μg/mL)과 LPS (1 μg/mL)를 동시 처리하여 NO의 생성을 유도한 후 Griess 시 약을 이용하여 세포 배양액에 존재하는 NO
2-의 양을 측정하 였다. 그 결과 LPS 단독 처리 군과 비교했을 시 CEB 추출물 은 50 μg/mL 농도에서 NO 생성을 36%, 100 μg/mL 농도에서 는 63%, 200 μg/mL에서는 78%만큼 NO의 생성을 감소시키 는 것으로 나타났으며, CE 추출물은 50 μg/mL 농도에서 NO 생성을 0%, 100 μg/mL 농도에서는 16%, 200 μg/mL에서는 20%로 CEB 추출물과 마찬가지로 농도 의존적으로 NO의 생 성을 감소시키는 경향을 보였고, BAE 추출물은 측정 농도에 서 100%, 101%, 110% 만큼의 NO 생성하는 것을 보아 NO 생성 억제에 효능이 없다는 것을 확인할 수 있었다. 위 결과 를 통해 생물 전환한 추출물인 CEB가 CE보다 더욱 좋은 NO 생성 억제 효능을 나타내는 것은 생물 전환 기법에 사용된 BAE가 포함되어 있어서가 아니라는 것을 확인할 수 있었다.
따라서 생물전환 기법을 이용하면 염증 발생에 의한 질환 유 발을 더욱 효과적으로 제어할 수 있을 것으로 사료된다.
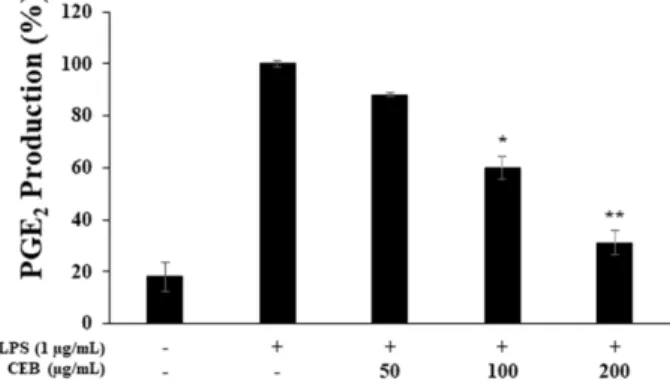
3.4. PGE
2생성 억제 활성
PGE
2는 면역 관련 세포의 활성을 유도해서 염증반응을 일으 키며, 부종 및 발열, 암 등을 유발하는 물질로 알려져 있다 [22]. CEB 추출물을 상기의 NO 실험과 동일한 조건으로 PGE
2의 생성 억제 활성을 측정한 결과, LPS가 단독 첨가되어 염증이 유발된 군과 CEB 추출물이 첨가된 각각의 처리 농도
(50, 100, 200 ug/ml)를 비교했을 때 88%. 60%. 31%로 PGE
2의 생성을 감소시켰다 (Fig. 4). 위 결과로 추출물 농도의 증가함 에 따라 PGE
2의 생성 억제 효과도 증가하는 것을 확인할 수 있었다. 특히 200 μg/mL 농도에서는 LPS 처리군보다 PGE
2생 성 억제를 69% 하는 것으로 나타났다. 따라서 CEB 추출물은 NO 생성 억제뿐만 아니라 PGE
2의 생성을 감소시킴으로써 보 다 나은 항염 효과를 기대할 수 있을 것으로 사료된다.
3.5. iNOS 및 COX-2 발현 억제
대식세포는 LPS에 의하여 자극을 받아 COX-2 및 iNOS 등 과 같은 pro-inflammatory 유전자를 발현한다. 그 중 iNOS는 산화질소 합성 효소로 NO의 생성을 지속적으로 유도하여 염증 반응을 매개하며, COX-2는 PGE
2를 합성하는 효소로서 암과 관련되어 있다고 알려져 있다 [23-25]. 따라서 본 실험 에서는 CEB 추출물에 의한 염증 억제의 신호 경로를 확인하 기 위해 RAW 264.7 세포를 LPS로 자극을 하였고, CEB 추출 물을 농도별로 처리하여 iNOS와 COX-2의 단백질 발현 정 도를 관찰하였다. 실험 결과, 대조군과 비교하여 LPS 처리 군에서는 발현량이 증가 된 것을 확인하였으며, 증가 된 iNOS 단백질 발현량이 CEB 추출물을 처리했을 때 농도가 증가함에 따라 iNOS 단백질 발현량이 크게 감소한 것을 확 인하였다 (Fig. 5(a)). 또한, COX-2의 단백질 발현량 역시 CEB 추출물에 의해 농도 의존적으로 감소시키는 것을 확인 하였다 (Fig. 5(b)). LPS 자극에 의한 MAPK (ERK, JNK, p38) 의 인산화와 IκB-α의 degradation, NF-κB의 인산화는 염증성 cytokines의 발현을 유도한다 [26,27]. 따라서 CEB 추출물이 NO, PGE
2,iNOS, COX-2의 발현을 효과적으로 감소시켜 항 염증 효과를 나타내는 것은 MAPK와 NF-κB의 신호 전달과 정을 통해 이루어지고 있음을 시사했다.
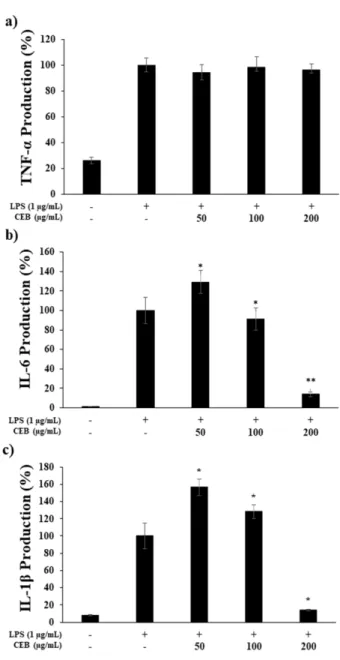
3.6. 전염증성 cytokines (TNF-α, IL-6, IL-1β) 생성 억제 대표적인 pro-inflammatory cytokine으로 알려진 TNF-α, IL- Fig. 3. Inhibitory effects of BAE, CE, and CEB on nitric oxide
production in RAW 264.7 cells. The production of nitric oxide was assayed in the culture medium of cells stimulated with LPS (1 μg/mL) for 24 h in the presence of BAE or CE or CEB extract (50, 100, and 200 μg/mL). Result is expressed as percentages compared to the respective values obtained for the control. Data represent the means±SD with three separate experiments. *p <
0.05; **p < 0.01.
Fig. 4. Inhibitory effects of CEB extract on PGE
2production
in RAW 264.7 cells. The production of PGE
2was assayed in the
culture medium of cells stimulated with LPS (1 μg/mL) for 24 h
in the presence of CEB extract (50, 100, and 200 μg/mL). Result
is expressed as percentages compared to the respective values
obtained for the control. Data represent the means ± SD with
three separate experiments. *p < 0.05; **p < 0.01.
1β 및 IL-6는 염증반응을 조절하는 것으로 알려져 있으며, 면 역세포의 활성, 증식 및 분화를 조절하는 것으로 알려져 있 다 [28]. 본 실험에서는 LPS에 의해 자극된 RAW 264.7 세포 에 대한 CEB 추출물이 전염증성 사이토카인 IL-1β, IL-6, TNF-α 의 발현에 미치는 영향을 ELISA kit를 이용하여 조사 하였다 (Fig. 6). LPS에 의해 RAW264.7 세포의 IL-1β, IL-6, TNF-α의 발현이 유의적으로 증가된 것을 확인하였으며, CEB 추출물을 50, 100 및 200 μg/mL 농도로 처리하여 LPS 에 의해 증가된 IL-1β와 IL-6의 생성량이 억제된 것을 확인 하였다 (Fig. 6b, 6c). 특히, CEB 추출물은 LPS 단독 처리군 대비 200 μg/mL 농도에서 IL-1β와 IL-6 분비량이 각각 87%
와 86%까지 감소되는 것을 확인 하였다. 반면, TNF-α은 LPS 처리군과 비교했을 때 억제능이 미비하게 관찰되는 것으로 보아 CEB 추출물이 TNF-α 생성 기작에는 크게 관여하지 않 는 것으로 사료된다 (Fig. 6(a)). 이는 CEB 추출물이 TNF-α보
다 IL-1β와 IL-6의 생성 기전에 뛰어난 영향을 미치는 것으 로 사료되며, CEB 추출물에 의해 전염증성 cytokine의 발현 이 억제되고 있음을 시사하고 있다.
4. CONCLUSION
본 연구에서는 토란 뿌리 추출물과 Biorenovation 생물전환 기법을 이용하여 얻은 추출물의 세포에 대한 독성과 항염 효 과를 비교하기 위하여 LPS에 의해 염증반응이 유도된 RAW Fig. 5. Inhibitory effects of CEB extract on the protein level of
iNOS and COX-2 expression in LPS-stimulated RAW 264.7 cells. Cells (1.0 × 10
6cells/well) were pre-incubated for 18 h, and then treated with LPS (1 μg/mL) and Sample for 24 h. The protein levels of iNOS, COX-2 were analyzed by western blot. β- actin was used as the control.
Fig. 6. Inhibitory effects of CEB extract on production of pro- inflammatory cytokines in RAW 264.7 cells. The production of a) TNF-α, b) IL-6, and c) IL-1β was assayed in the culture medium of cells stimulated with LPS (1 ug/mL) for 24 h in the presence of CEB extract (50, 100, and 200 μg/mL). Results are expressed as a percentage of the control. Data represent the means
± SD with three separate experiments. *p < 0.05; **p < 0.01.
264.7 세포를 이용하여 측정하였다. 그 결과 각각의 모든 농 도에서 90% 이상의 세포 생존율을 확인하였으며, CEB 추출 물은 CE 추출물에 비해 각각의 농도에서 2배 이상 NO생성 을 억제하는 것이 관찰되었다. 또한, CEB 추출물의 PGE
2의 생성 저해, 전염증성 cytokine (IL-6, IL-1β) 생성 억제, iNOS 및 COX-2 단백질의 발현 억제 효과를 추가로 측정한 결과 각 농도에서 PGE
2생성을 농도 의존적으로 억제하였다. 또 한, 전염증성 cytokine인 IL-1β, IL-6의 생성 억제 활성을 비 교한 결과 200 μg/mL 농도에서는 뛰어난 억제 활성을 보였 다. 이러한 결과로부터, biorenovtion 기법을 통한 생물전환 기법은 본래의 효능을 더욱더 증대시킨다는 것을 확인할 수 있었으며 [29], 이 결과가 미생물에 의하여 효능이 증가한 게 아니라 CEB 추출물에 존재하는 본래 성분이 biorenovation 기법에 의하여 전환되어 보다 나은 효능을 나타낸다는 것을 확인할 수 있었다 . 본 연구는 biorenovation 생물전환 기법을 이용한 CEB 추출물은 천연 항염증 효능을 가진 기능성 식품 및 화장품 소재로 활용될 가능성을 제시하는 결과로 사료되 며, 앞으로 CEB 추출물 내에 존재하는 항염 효능을 가진 유 효성분 분석에 관한 연구가 추가로 진행되어야 할 것으로 판 단된다.
Acknowledgements
본 연구는 중소벤처기업부가 지원하는 국가융복합단지 연 계 지역기업 상용화 R&D 사업으로 수행된 연구결과입니다 (P0009943).
REFERENCES
1. Wynn, T. A. and L. Barron (2010) Macrophages: master regula- tors of inflammation and fibrosis. Semin. Liver. Dis. 30: 245-257.
2. Mogensen, T. H. (2009) Pathogen recognition and inflammatory signaling in innate immune defenses. Clin Microbiol Rev. 22: 240- 273.
3. Halliwell, B. (1996) Antioxidants in human health and disease.
Annu Rev Nutr. 16: 33-50.
4. Hofseth, L. J. and L. Ying (2006) Identifying and defusing weap- ons of mass inflammation in carcinogenesis. Biochim Biophys Acta. 1765: 74-84.
5. Reuter, S., S. C. Gupta, M. M. Chaturvedi, and B. B. Aggarwal (2010) Oxidative stress, inflammation, and cancer: how are they linked?. Free Radic Biol Med. 49: 1603-1616.
6. Woo, J. H., J. H. Lee, H. Kim, S. J. Park, E. H. Joe and I. Jou (2015) Control of inflammatory responses: a new paradigm for the treatment of chronic neuronal diseases. Exp. Neurobiol. 24: 95- 102.
7. Alfadda, A. A. and R. M. Sallam (2012) Reactive oxygen species in health and disease. Biomed Res Int. 2012: 936486.
8. Lee, E. J., E. Y. Whang, K. Whang, I. S. Lee, and S. A. Yang
(2009) Anti-allergic effect of Zizania latifolia turcz Extracts.
Korean J. Food Sci. Tecnol. 41: 717-721.
9. An, S. G. (2003) Atopic dermatitis and moisturizer. Update in der- matology for dermatologists. 1: 21-25 .
10. Jeong, H. R., M. S. Sung, Y. H. Kim, H. M. Ham, Y. M. Choi, and J. S. Lee (2012) Anti-Inflammatory activity of Salvia plebeia R.
Br. leaf through heme oxygenase-1 induction in LPS-Stimulated RAW264.7 macrophages. J. Korean Soc. Food Sci. Nutr. 41: 888- 894.
11. Grivennikov, S. I., F. R. Greten, and M. Karin (2010) Immunity, inflammation, and cancer. Cell. 140: 883-899.
12. Lim, K. H. and L. M. Staudt (2013) Toll-like receptor signaling.
Cold Spring Harb. Perspect. Biol. 5: a011247.
13. Guo, C., L. Yang, J. Luo, C. Zhang, Y. Xia, T. Ma, and L. Kong (2016) Sophoraflavanone G from Sophora alopecuroides inhibits lipopolysaccharide-induced inflammation in RAW264.7 cells by targeting PI3K/Akt, JAK/STAT and Nrf2/HO-1 pathways. Int.
Immunopharmacol. 38: 349-356.
14. Dou, W., J. Zhang, A. Sun, E. Zhang, L. Ding, S. Mukherjee, X.
Wei, G. Chou, Z. T. Wang, and S. Mani (2013) Protective effect of naringenin against experimental colitis via suppression of Toll-like receptor 4/NF-κB signalling. Br. J. Nutr. 110: 599-608.
15. Shao, J., Y. Li, Z. Wang, M. Xiao, P. Yin, Y. Lu, X. Qian, Y. Xu, and J. Liu (2013) A novel naphthalimide derivative, exhibited anti- inflammatory effects via targeted-inhibiting TAK1 following down-regulation of ERK1/2- and p38 MAPK-mediated activation of NF-κB in LPS-stimulated RAW264.7 macrophages. Int. Immu- nopharmacol. 17: 216-228.
16. Guzik, T. J., R. Korbut, and T. Adamek-guzik (2003) Nitric oxide and superoxide in inflammation and immune regulation. J. Physiol Pharmacol. 54: 469-487.
17. Iwalewa, E. O., L. J. McGaw, V. Naidoo, and J. N. Eloff (2007) Inflammation: the foundation of diseases and disorders. A review of phytomedicines of south african origin used to treat pain and inflammatory conditions. Afr. J. Biotechnol. 6: 2868-2885.
18. Choo, S. K., Y. T. Park, and K. W. Yun (2002) The Effect of Acti- vated Charcoal on Growth and Yield in Taro, Colocasia antiquo- rum var. esculenta Engl. Korean Journal of Plant Resources.
15: 293-297.
19. Hong, J. H. (1966) Donguibogam: Principles and Practice of Eastern Medicine. pp.1195-1196.
20. Choi, H. R., J. S. Park, K. M. Kim, M. S. Kim, K. W. Ko, C. G.
Hyun and S. Y. Kim (2018) Enhancing the antimicrobial effect of genistein by biotransformation in microbial system. Ind Eng Chem. 63: 255-261.
21. Denizot, F., and R. Lang (1986) Rapid colorimetric assay for cell growth and survival: modifications to the tetrazolium dye proce- dure giving improved sensitivity and reliability. J Immunol Meth- ods. 89: 271-277.
22. Jang, S. I., C. S. Jun, K. C. Kwak, M. S. Bae, J. H. Lee, K. Y. Kim, Y. G. Yun, and G. Y. Chai (2006) Evaluation of korean phytome- dicinal plants on inhibition of prostaglandin E2 (PGE2) produc- tion and cyclooxygenase-2 (COX-2) in LPS-stimulated U937 cells. Korean J. Oriental Physiology & Pathology. 20: 455-459.
23. Jang, S. I., C. S. Jun, K. C. Kwak, M. S. Bae, J. H. Lee, K. Y. Kim,
Y. G. Yun, and G. Y. Chai (2006) Evaluation of korean phytome- dicinal plants on inhibition of prostaglandin E2 (PGE2) produc- tion and cyclooxygenase-2 (COX-2) in LPS-stimulated U937 cells. Korean J. Oriental Physiology & Pathology. 20: 455-459.
24. Ninnemann, J. L. (1984) Prostaglandins in inflammation and dis- ease. Immunology today. 5: 173-175.
25. Lee, J. Y., D. H. Yoo, Y. S. Jeong, S. H. Joo, and J. W. Chae (2018) Verification of Anti-inflammatory Activities of the Ethanol Extracts of Glechoma hederacea var. longituba in RAW 264.7 Cells. J. Life Sci. 28: 429-434.
26. Paik, Y. H., R. F. Schwabe, R. Bataller, M. P. Russo, C. Jobin, and D. Brenner (2003) A. Toll-like receptor 4 mediates inflammatory
signaling by bacterial lipopolysaccharide in human hepatic stellate cells. Hepatology. 37: 1043-1055.
27. Chung, Y. C., S. M. Park, J. H. Kim, G. S. LEE, J. N. Lee, and C.
G. Hyun (2018) Anti-inflammatory effect of pratol in LPS-stimu- lated RAW 264.7 cells via NF-κB signaling pathways. NPC. 13:
547-550.
28. Baldwin, A. S. Jr. (1996) The NF-kappa B and I kappa B proteins:
new discoveries and insights. Annu Rev Immunol. 14: 649-683.
29. Kim, M. S., T. J. Park, J. S. Lim, and S. Y. Kim (2019) Effect of Agaricus biorenovate Extract on Collagen Synthesis and Matrix Metalloproteinase-1 Production in Human Dermal Fibroblast.
KSBB Journal. 34: 49-53.