대한소화기학회지 2008;51:346-359 □ REVIEW □
연락처: 임형준, 425-707, 경기도 안산시 단원구 고잔동 516 고려대학교 안산병원 소화기내과
Tel: (031) 412-6565, Fax: (031) 412-5582 E-mail: gudwns21@medimail.co.kr
Correspondence to: Hyung Joon Yim, M.D.
Department of Internal Medicine, Korea University Ansan Hospital, 516, Gojan-dong, Danwon-gu, Ansan 425-707, Korea Tel: +82-31-412-6565, Fax: +82-31-412-5582
E-mail: gudwns21@medimail.co.kr
약제 내성 B형간염에 대한 대처
고려대학교 의과대학 내과학교실
임 형 준
Management of Antiviral-Resistant Chronic Hepatitis B Virus Infection Hyung Joon Yim, M.D.
Department of Internal Medicine, Korea University Medical College, Seoul, Korea
Substantial progress has been made in the treatment of chronic hepatitis B during the past decade. Nucleos(t)ide analogues are now widely used due to their convenience, less side effects, and considerable response rates.
However, development of antiviral resistance is a major problem being considered as the most important factor for the treatment failure. Viral breakthrough associated with selection of antiviral-resistant hepatitis B virus (HBV) is usually followed by biochemical breakthrough, clinical deterioration, and even progressive liver failure.
Therefore, appropriate management of antiviral resistance is critical for improving treatment outcomes. Strategies for the management of antiviral-resistant chronic HBV infection are described herein considering recently pub- lished guidelines. Lamivudine/telbivudine resistance can be managed by adding adefovir. Switching to adefovir or entecavir is also a viable option. However, careful follow-up of viral load is mandatory to detect any primary or secondary treatment failure in case of sequential monotherapy. Interferon or peg-interferon therapy can also be considered in case of young patients with compensated liver disease. For adefovir resistance, lamivudine can be added, but adding or switching to entecavir is a more reasonable option. Likewise, adding or switching to adefo- vir can be considered for entecavir resistance. Adding or switching to tenofovir needs to be considered upon availability. Experiences for clevudine resistance are still lacking, and need to be studied further upon the iso- lation of clinically resistant strains. To avoid emergence of resistant mutations, antiviral therapy should be ini- tiated after careful balance of risk and benefit, and the most potent antiviral agent with the lowest resistance rate should be selected. (Korean J Gastroenterol 2008;51:346-359)
Key Words: Chronic hepatitis B; Antiviral resistance; Mutation; Guidelines
서 론
지난 10년간 만성 B형간염 치료는 발전을 거듭하여 다양 한 치료 약제의 선택이 가능하게 되었다.1 특히 경구용 핵산 유사체는 인터페론 제제에 비하여 보다 적은 부작용과 투약
의 편리성, 우수한 항바이러스 효과로 널리 사용되고 있으 나 단기간의 치료로 지속적인 B형간염 바이러스(HBV) 증 식 억제 효과를 기대하기는 어렵다는 단점이 있다.1 이로 인 한 장기간의 투약은 항바이러스 내성을 유발하여 약제 변경 을 필요로 하게 되고 이러한 순차적인 항바이러스 치료는
임형준. 약제 내성 B형간염에 대한 대처 347
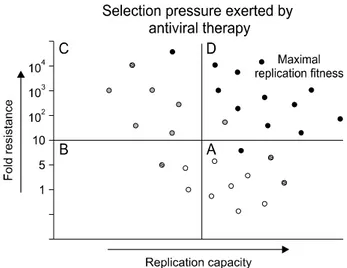
Fig. 1. Viral population changes from A, B, C to D. Wild type
viruses (blank circle) are suppressed after initiation of antiviral therapy (A to B). Some viruses with natural polymorphism (circle with dashed lines) may survive. Viruses with primary re- sistant mutations (grey circle) appear under selection pressure with prolonged therapy (B to C). Viruses with compensatory mu- tations (black circle) are finally selected due to recovered repli- cation capacity maintaining high fold resistance (C to D). This process supports the rule of “selection of the fittest”.다시 두 가지 이상의 약제에 내성을 보이는 다약제 내성 HBV의 출현을 초래하는 등 지속적인 문제점을 유발하기도 한다. 따라서 항바이러스 내성의 발생 여부는 약제 순응도 와 함께 치료의 성패를 좌우하는 가장 중요한 요소로 자리 잡게 되었다.1,2
항바이러스 내성의 발생은 곧 바이러스 및 생화학 돌파 현상에 따른 임상적인 악화로 이어질 수 있으므로 이에 대 한 적절한 대처가 필요하다.3-5 이 글에서는 항바이러스 내 성 발생기전과 이에 대한 대책에 대하여 논하고자 한다. 항 바이러스 내성에 대한 대책은 2007년 대한간학회(KASL) 가 이드라인과 2007년 미국간학회(AASLD) 가이드라인, 최근 예비 발표된 2008년 아시아태평양간학회(APASL) 가이드라 인을 비교 검토하여 기술한다.3,6
항바이러스 내성 발생 기전
1. 바이러스 자연변이의 발생빈도
인체 내에서의 HBV의 생성 속도는 매우 빨라 하루에 1011의 새로운 virion이 만들어지는 것으로 추정된다. 따라서 HBV virion이 약 3,200 base pair로 구성되어 있음을 감안하 면 하루 1014 이상의 새로운 뉴클레오타이드가 생성되는 셈 이다. 그러나 HBV의 역전사효소는 스스로 잘못 생성된 뉴 클레오타이드를 제거하는 교정쇄(proof reading) 기능이 없으 므로 자연 상태에서도 바이러스 증식 도중에 수많은 변이가 발생하게 된다.7 알려진 바로는 한 개의 뉴클레오타이드당 하루 10−7의 변이가 생기는데 매일 체내에서 약 1014의 HBV 뉴클레오타이드가 복제된다고 할 때 하루에 약 107의 새로운 변이가 생기는 셈이다. 바이러스 증식이 활발할수록 변이 발생 빈도는 더욱 증가하고 따라서 내성 발생 빈도도 높아진다.
2. 선택 압력(selection pressure) 및 증식 적합성 (replication fitness)
증식과정 중 자연적으로 발생한 바이러스 변이는 체내 바 이러스 저장소(reservoir)에 축적되면서 인체의 면역 기능이 나 항바이러스제의 작용과 같은 특정한 선택 압력에 의해 몇 가지의 바이러스 quasispecies가 선택된다. 특히 항바이러 스제에 의한 선택압력이 가해질 경우 그 약제의 영향하에서 도 효과적으로 증식할 수 있는 능력, 즉 증식 적합성이 우수 한 변이종이 선택되게 된다. 이때 증식 적합성은 변이종의 증식력(replication capacity)과 특정 약제에 대한 겹저항성 (fold resistance)에 의해 결정된다. 특정 약제에 대하여 최초 발생하는 내성 변이는 증식능이 저하되어 있기도 하나 시간 이 지남에 따라 보상변이(compensatory mutation)가 추가로
발생하면서 변이 바이러스의 증식능을 야생종 수준으로 회 복시킨다.8 겹저항성은 야생종 바이러스 증식을 50% 감소시 키는 데 필요한 약제 농도에 대한 변이종 바이러스 증식을 50% 감소시키는 데 필요한 약제 농도의 비(mutant IC50/wild type IC50)이다. 겹저항성이 높을 경우 해당 약제가 변이종 바이러스 증식을 차단하지 못한다.
높은 증식능과 최대 겹저항성을 보이는 변이종은 뛰어난 증식 적합성을 보여 특정 약제에 의한 선택압력하에 주 내 성 변이종으로서 빠르게 증식하게 된다(Fig. 1).
3. 항바이러스제의 유전자 장벽(genetic barrier)
항바이러스제의 유전자 장벽은 해당 약제에 대한 내성을 나타내기 위해 필요한 바이러스 유전자 변이의 수이다.
1-2 부위의 변이만으로 바이러스가 내성을 획득하는 라미 부딘, 텔비부딘 등의 유전자 장벽은 상대적으로 낮은 반면 라미부딘 내성 변이에 추가 변이가 발생해야 하는 엔테카 비어의 유전자 장벽은 상대적으로 매우 높다.9 라미부딘과 아데포비어를 병합하는 경우도 유전자 장벽을 높일 수 있 다.
4. 항바이러스제의 증식억제능(antiviral potency)
강력한 증식 억제 효과를 보이는 항바이러스제는 내성 변 이의 발생 가능성이 낮다. 또한 증식 억제 효과가 낮은 경우 도 변이종에 대한 선택 압력 역시 낮게 작용하여 내성 변이
348 The Korean Journal of Gastroenterology: Vol. 51, No. 6, 2008
Table 1. Antiviral-Resistant Hepatitis B Virus Mutations
Domain A Domain B Domain C Domain D Domain E Lamivudine rtL80V/I rtI169T rtV173L rtM204V/I/S* - -
rtL180M rtA181T/V* rtQ215S rtT184S
Telbivudine - rtA181T/V* rtM204I* - - Adefovir rtV84M rtA181T/V* rtV214A‡ rtI233V
rtS85A rtQ215S‡ rtN236T*
rtP237H rtN238T/D
Tenofovir - rtA194T* rtM204I - -
rtL180M
Entecavir† - rtI169T rtS202G/I/C* - rtM250V/I/L*
rtT184L/F/A/M/S/I/C/G*
* Primary resistant mutations.
†In the presence of lamivudine resistant mutations.
‡Present at inter-domain C-D.
종의 선택이 적게 나타난다. 그러나 중등도의 증식억제능을 보이는 항바이러스제는 바이러스 억제가 완전하지 않은 반 면 선택 압력이 상대적으로 높아 내성 변이종이 선택될 가 능성이 높다.10
5. 증식공간
증식공간은 기존의 바이러스가 차지하고 있지 않은 새로 운 간세포로서, 감염된 간세포 사멸 또는 괴사 후 새로운 세 포가 재생되거나 혹은 간이식후 HBV에 감염되어 있지 않 은 이식편이 들어왔을 경우 발생한다. 새로운 증식공간이 있을 경우 내성 변이종의 cccDNA (covalently closed circular DNA)가 그 자리를 차지하며 빠르게 확산되어 나가게 된 다.11
6. 기타
과거 항바이러스제 복용 기왕력이 있는 경우, 장기간의 약제 복용, 약제 유효 농도(peak and trough level)가 적절하 게 유지되지 않는 경우, 환자의 약제 순응도가 나쁜 경우 내 성 발생률이 증가한다.
항바이러스 내성의 정의
1. 일차 치료 실패 및 이차 치료 실패
항바이러스제를 6개월 투여한 후에도 혈청 HBV DNA가 치료 전에 비해 1/100 미만으로 감소되지 않는 경우 일차 치료 실패(primary treatment failure or non-response)로 정의한 다.3,6 일차 치료 실패에 따른 지속적인 HBV 증식은 향후 항
바이러스 내성 발생 위험을 증가시킨다.12
항바이러스 내성 발생의 첫 징후는 치료 후 일차적으로 바이러스 증식 억제가 있었던 환자에서 HBV DNA가 최저 점으로부터 다시 10배 이상 상승하는 바이러스 돌파현상 (virologic breakthrough)이 관찰되는 것이며 이차 치료 실패 (secondary treatment failure)로 간주한다.13 약제 순응도가 좋 았음에도 바이러스 돌파현상이 발견될 경우 약제 내성 검사 (antiviral resistance test)를 한다.
생화학 돌파현상(biochemical breakthrough)은 항바이러스 치료 후 정상화되었던 ALT가 치료를 지속하는 중에 다시 상승하는 것으로 치료 전 ALT의 2배 혹은 정상 상한의 10 배 이상 상승하는 급성 악화(acute exacerbation or flare)를 동 반하기도 한다.3,13 바이러스 돌파현상이 발생한 후에도 생화 학 돌파 현상이 나타나기까지 수개월 이상 시간이 소요되기 도 한다.13
2. 유전자형 내성 및 표현형 내성
유전자형 내성(genotypic resistance)은 항바이러스제에 대 한 저항성을 보이는 돌연변이 바이러스가 환자 혈청에서 발 견되는 것이며 표현형 내성(phenotypic resistance)은 발견된 유전자 변이(genotypic mutation)가 실제 in vitro 검사에서 약 제에 대한 감수성을 저하시킴을 확인하는 것이다.3,13,14 유전자형 내성 검사는 직접 염기서열 분석(direct sequen- cing)이 가장 기본이 되는 검사이며 특히 알려지지 않은 새 로운 변이 유무를 확인하는 데도 매우 유용하다. 다만 변이 종이 야생종의 20-30% 이상 되어야 검출이 가능하다는 단 점이 있다. 이 외에도 RFLP (restriction fragment length poly- morphism),15 RFMP (restriction fragment mass polymor-
Yim HJ. Management of Antiviral-Resistant Chronic Hepatitis B Virus Infection 349
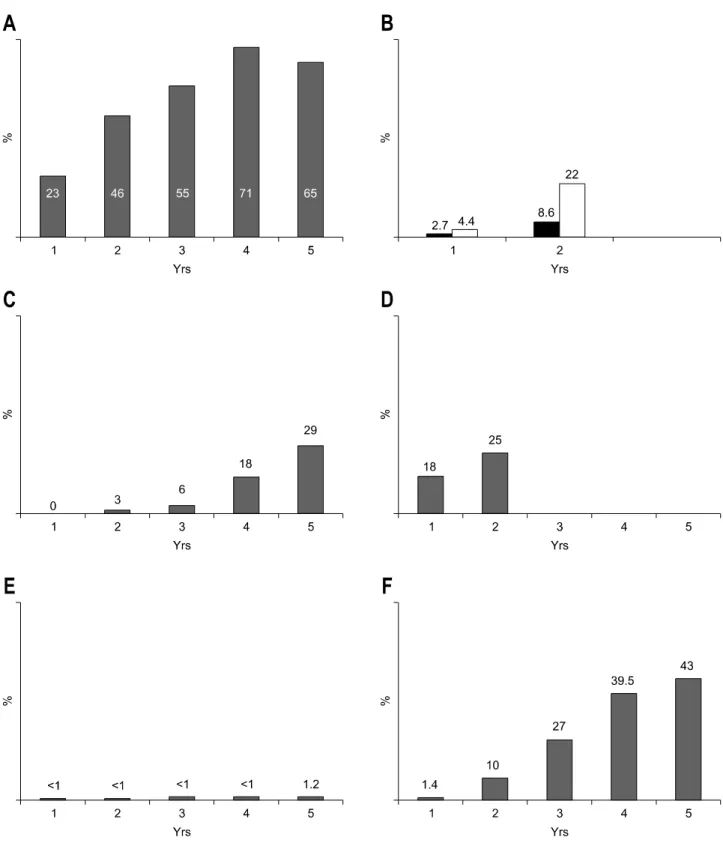
Fig. 2. Cumulative resistance rates to nucleoside analogues. (A) Lamivudine resistance rates (B) Telbivudine resistance rates in HBeAg
positive (black bar) and HBeAg negative (gray bar) patients (C) Adefovir resistance rates in HBeAg negative treatment-naive patients (D) Adefovir resistance rates in lamivudine resistant patients (E) Entecavir resistance rates in treatment-naive patients (F) Entecavir resistance rates in lamivduine refractory patients. Adapted from ref. 22,23,25,45,52,53,61,64,65.phism),16,17 line probe assay,18 real-time PCR, multiplex PCR assay19 등을 이용하면 이미 알려진 부위의 변이 존재 여부 를 보다 예민하게 검사 할 수 있다(∼1%). 예민한 검사법을
사용하는 경우에는 내성 변이가 발견되었다 하더라도 임상 에서의 의미를 해석하는 데 주의를 요한다.20
350 대한소화기학회지: 제51권 제6호, 2008
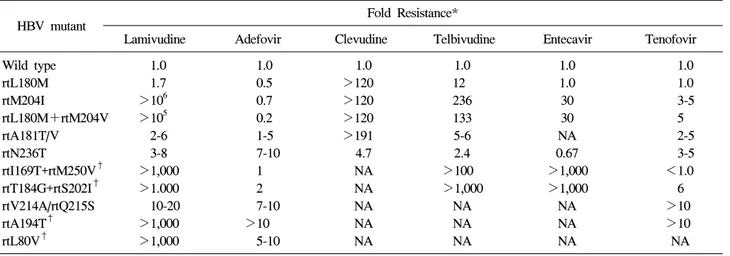
Table 2. In Vitro Sensitivity of Drug-Resistant HBV
HBV mutant Fold Resistance*
Lamivudine Adefovir Clevudine Telbivudine Entecavir Tenofovir Wild type 1.0 1.0 1.0 1.0 1.0 1.0
rtL180M 1.7 0.5 >120 12 1.0 1.0
rtM204I >106 0.7 >120 236 30 3-5
rtL180M+rtM204V >105 0.2 >120 133 30 5
rtA181T/V 2-6 1-5 >191 5-6 NA 2-5
rtN236T 3-8 7-10 4.7 2.4 0.67 3-5 rtI169T+rtM250V† >1,000 1 NA >100 >1,000 <1.0 rtT184G+rtS202I† >1.000 2 NA >1,000 >1,000 6 rtV214A/rtQ215S 10-20 7-10 NA NA NA >10
rtA194T† >1,000 >10 NA NA NA >10
rtL80V† >1,000 5-10 NA NA NA NA
* fold resistance=(mutant IC50)/(wild type IC50).
†In the presence of lamivudine resistant mutations.
3. 일차 및 이차 약제내성변이와 교차 내성
항바이러스제에 대한 감수성 저하와 직접 관계되는 변이 를 일차 약제내성변이(primary drug resistant mutation)라 하 고 변이 바이러스 중합효소의 기능 결함, 즉 저하된 증식력 (replication capacity)을 회복시켜주는 변이를 이차 보상변이 (secondary compensatory mutation)라 한다.13 각 항바이러스제 에 대한 일차 내성변이 및 이차 변이의 위치는 Table 1과 같 다. 이차 보상변이가 더해지면 표현형 내성 검사에서 겹저 항성(fold resistance)은 큰 변화가 없으나 변이 바이러스의 증식력 향상으로 증식적합성(replication fitness)이 좋아지므 로 HBV DNA가 치료 전 수준 또는 2,000 IU/mL 이상 다시 올라가는 바이러스 반등(viral rebound)이 나타날 수 있다.13 마지막으로, 한 가지 약제에 의해 발생한 내성 변이가 노출 된 적이 없는 다른 약제에도 내성을 보이는 것을 교차내성 (cross resistance)이라 하며 임상적으로 두 가지 이상의 약제 에 내성을 가지는 다약제 내성 발생의 한 원인이기도 하다.
따라서 처음 사용한 약제로 인한 내성 변이 발생은 이후에 사용하는 약제의 선택 범위를 제한하게 되며 다음 약제에 대한 내성 발생률에도 영향을 미친다.
약제내성에 대한 대처
경구용 핵산유사체의 분류는 염기 종류에 따라 purine 유 사체(adenosine, guanine)와 pyrimidine 유사체(cytosine, thymi- dine)로 크게 나눌 수 있다. Purine 유사체는 당의 형태에 따 라 크게 acyclic phosphonate 계통(아데포비어, 테노포비어)과 deoxyguanosine 유사체 계통(엔테카비어)으로 나누고 pyrimi- dine 유사체는 모두 L-nucleoside와 유사한 형태를 지닌다(라
미부딘, 텔비부딘, 클레부딘).21 일단 한 가지 약제에 대한 내성 변이가 발생한 경우 노출된 적이 없는 다른 약제에도 교차 내성을 보일 수 있으며 구조 요법으로 교차내성이 없 는 약제로 대체한다고 해도 후속 약제의 내성 발생률은 증 가한다(Fig. 2).22-24 특히 같은 계통의 약제를 순차적으로 사 용하는 것은 적절하지 않다.
항바이러스 내성 발생 시 구조 치료제 선택에 있어 고려 하여야 할 것은 환자 요소(기저 간질환의 중증도 및 간예비 능, 동반된 여타 질환, 약제의 순응도), 약제 요소(바이러스 억제능, 시판 여부, 약제비, 약제 교체 시기), 바이러스 요소 (바이러스의 증식 정도, HBeAg 상태, 항바이러스 내성변이 양상 및 교차 내성 여부) 등이 있다. 특히 HBV의 내성 변이 양상에 따른 교차 내성 여부와 항바이러스제에 대한 감수성 을 고려한 약제 선택이 임상 경과를 안정시키고 추가적인 내성 발생을 줄이는 데 핵심이 된다(Table 2). 최근 제시된 가이드라인은 Table 3과 같이 각 지역의 약제 시판 및 승인 여부에 따라 차이가 있다. 항바이러스제 내성 발생 시 대처 에 대한 국내 가이드라인은 Fig. 3과 같이 요약할 수 있다.
1. 라미부딘 내성
1) 라미부딘 내성 변이
라미부딘 내성은 매년 14-32%에서 발생하여 4년째에는 약 70%에 가까운 내성 발생률을 보인다.25 라미부딘 내성 발생 가능성을 증가시키는 요인으로는 치료 전 높은 HBV DNA와 ALT 수준,26 불충분한 바이러스 증식 억제 등이 다.12,25
라미부딘에 대한 일차 내성 변이는 rtM204V/I 변이와 rtA181T/V 변이이다.13 rtM204V/I 변이는 역전사효소(reverse transcriptase) 204번 코돈의 methionine이 valine 또는 isoleu-
임형준. 약제 내성 B형간염에 대한 대처 351
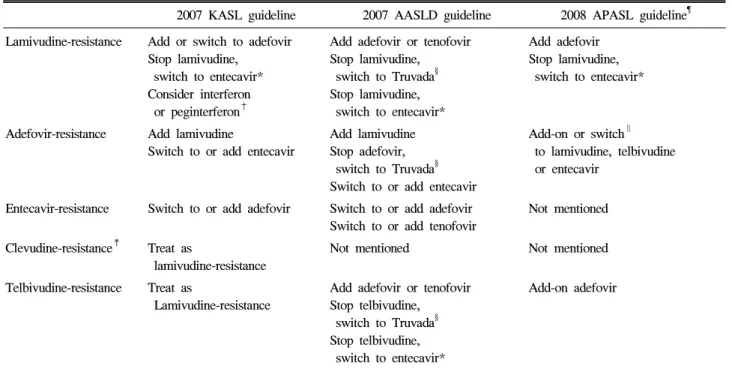
Table 3. Comparison of Strategies for Managing Antiviral-Resistant HBV
2007 KASL guideline 2007 AASLD guideline 2008 APASL guideline¶ Lamivudine-resistance Add or switch to adefovir
Stop lamivudine, switch to entecavir*
Consider interferon or peginterferon†
Add adefovir or tenofovir Stop lamivudine, switch to Truvada§ Stop lamivudine, switch to entecavir*
Add adefovir Stop lamivudine, switch to entecavir*
Adefovir-resistance Add lamivudine
Switch to or add entecavir
Add lamivudine Stop adefovir, switch to Truvada§ Switch to or add entecavir
Add-on or switch∥ to lamivudine, telbivudine or entecavir
Entecavir-resistance Switch to or add adefovir Switch to or add adefovir Switch to or add tenofovir
Not mentioned
Clevudine-resistance‡ Treat as
lamivudine-resistance
Not mentioned Not mentioned
Telbivudine-resistance Treat as
Lamivudine-resistance
Add adefovir or tenofovir Stop telbivudine, switch to Truvada§ Stop telbivudine, switch to entecavir*
Add-on adefovir
* Pre-existing lamivudine-resistant mutation predisposes to entecavir resistance.
†Consider interferon or peg-interferon if only the patient has compensated liver disease.
‡Clinical experiences are lacking.
§Truvada is a combination pill with emtricitabine 200 mg and tenofovir 300 mg.
∥In case of no history of prior lamivudine-resistance
¶Provisional document was released at 2008 Seoul APASL meeting. Switching to interferon based therapy is an option.
Fig. 3. Schematic summary of Korean Association for the Study
of the Liver (KASL) guideline for the management of antiviral resistance. LMV, lamivudine; L-dT, telbivudine; CLV, clevudine;ADV, adefovir; ETV, entecavir. Adapted from ref. 6.
cine 등으로 치환된 것으로 변이 발생 시 steric hinderance에 의해 라미부딘이 바이러스의 역전사효소에 결합하는 힘을
감소시킨다.21 rtA181T/V 변이는 역전사효소 181번 코돈의 alanine이 threonine 혹은 valine으로 치환된 것으로 빈도는 흔하지 않지만 rtM204V/I 변이를 동반하지 않고 단독으로 발생할 수 있어 일차 내성 변이로 간주하며 라미부딘과 아 데포비어에 대한 동시 내성을 보인다.27-29 이차 보상 변이로 rtL80V/I, rtI169T, rtV173L, rtL180M, rtT184S, rtA200V, rtQ215S 등이 있다. rtL180M이 rtM204V/I와 가장 흔히 동반 되는데 이는 단독으로는 라미부딘 내성을 보이지 않으나 rtM204V/I 변이 동반시 바이러스의 증식력을 증대시키고 라 미부딘 내성을 강화시킨다.30 rtV173L은 라미부딘 내성 환자 의 9-22%에서 나타나는데 이 변이가 추가되는 경우 증식력 이 야생종 이상으로 증가된다. 이는 이 변이가 역전사효소 의 중합기능을 더욱 촉진시키기 때문이다.31
그 외 rtL80V/I나 rtA200V도 보상 변이로서 일차 내성 변 이를 동반한 변이 바이러스의 증식력을 증대시킨다.32 또한 rtL80V/I는 rtQ215S 변이와 마찬가지로 라미부딘과 아데포비 어에 교차내성이 있어 향후 아데포비어 구조 치료 시 치료 반응을 저하시킨다.24,32,33 rtM204V/I 변이는 엠트리시타빈, 텔 비부딘, 클레부딘과 같은 타 L-nucleoside 유사체에도 교차 내 성을 보인다.
352 The Korean Journal of Gastroenterology: Vol. 51, No. 6, 2008
2) 라미부딘 내성 시 치료
라미부딘 내성에 대한 치료로 다음과 같은 방법이 제시되 고 있다.
① 라미부딘에 아데포비어를 추가하는 병합요법(KASL, AASLD, APASL)
② 아데포비어로 대체한 단독요법(KASL)
③ 엔테카비어 1 mg으로 대체하여 사용하는 방법(KASL, AASLD, APASL)
④ 라미부딘에 테노포비어를 추가하는 병합요법(AASLD) ⑤ 테노포비어와 엠트리시타빈 복합제제를 투여하는 방
법(AASLD)
⑥ 그 외 대상성 간기능을 가진 환자의 경우 인터페론 제 제 투여를 고려(KASL, APASL)
(1) 아데포비어: 라미부딘 내성이 발생한 경우 아데포비 어로 교체 하는 경우와 이를 추가하여 병합 치료하는 방법 을 비교한 최초의 pilot 연구에서 48주 치료 후 양군에서의 바이러스 억제 효과(각각 −4.4와 −3.59 log copies/mL)와 ALT 정상화율(각각 53%와 47%)은 유사하였고 다만 ALT 상승이 치료 초기에 아데포비어 단독 치료군 37%에서 관찰 되었다.34 이러한 자료를 근거로 아데포비어 구원치료 시 초 기 ALT 상승을 막기 위해 아데포비어를 2-3개월 정도 단기 간 동안만 추가 병합하여 쓰거나 단독으로 교체하는 방법을 우선 고려하게 되었다. 그러나 이후 라미부딘 내성 환자에서 아데포비어 단독으로 교체시 아데포비어 내성이 1년에 18%, 2년에 25%까지 매우 높게 발생됨이 보고되고,22,23 또한 최근 한 소규모 전향 연구에서, 라미부딘 내성 HBeAg 음성 만성 B형간염 환자를 약 3년간 추적관찰 하였을 때 아데포비어 를 추가 병합한 경우 단독 치료에 비해 내성 발생이 의미 있게 감소함이 알려지면서(각각 0%와 21%) 아데포비어와 라미부딘을 병합하여 치료하는 경우가 점차 많아지고 있 다.35 이러한 병합 요법의 효과는, 이후 588명을 대상으로 이 태리에서 시행된 한 대규모 연구에서, HBeAg 음성인 라미 부딘 내성 환자를 대상으로 2년간 병합 치료군과 아데포비 어 단독 치료 군을 비교하였을 때도 바이러스 돌파현상 발 생률(2%와 9%)과 아데포비어 내성률(0.8%와 5%)이 의미있 는 차이를 보임으로써 더욱 설득력을 얻고 있다.36 단, 양군 에서의 바이러스 억제 효과의 차이는 없었다. 그러나 또다 른 연구에서 구원치료 시점에서 HBV DNA 수준이 높은 경 우(HBV DNA>17,200 IU/ 즉, 5 log copies/mL)에는 단독 치 료를 하였을 때 보다 병합 치료를 하였을 때 바이러스 억제 효과가 의미있게 좋았으므로 이러한 경우는 병합요법이 좀 더 추천된다.35,37 병합 치료 시에는 다약제 내성바이러스 발 생에 대한 고려가 필요하다.24,38,39 또한, 현재까지 대부분의 보고가 HBeAg 음성인 Caucacian 환자가 대다수인 연구여서, 추후 HBeAg 양성 또는 동양인 환자에서도 아데포비어 단
독 치료와 병합치료 간에 아데포비어 내성 발생 빈도 혹은 바이러스 억제에 있어 같은 결과를 보일 것인지에 대하여는 상반되는 의견이 있으므로 향후 추가 연구가 필요하다.40 최 근 rtA181T/V/S 변이가 동반된 라미부딘 내성 환자에서 아데 포비어 병합요법 시에도 rtA181 변이가 계속 남아 일차 또는 이차 치료 실패의 요인이 되었다.29,33,41 rtA181T/V는 엔테카비 어에 감수성이 있다.38
(2) 엔테카비어: 엔테카비어는 라미부딘과 약간의 교차 내성을 보인다. 따라서 라미부딘 내성 환자에서 사용 시에 는 초치료 환자에서의 용량 0.5 mg보다 높은 1 mg을 사용 한다.42 HBeAg 양성인 라미부딘 내성 만성 B형간염 환자를 대상으로 48주간 엔테카비어를 투여한 연구에서 HBV DNA 가 300 copies/mL 이하로 감소한 경우가 19%, HBeAg 혈청 전환율이 8%, 바이러스 감소는 평균 −5.11 log copies/mL이 었고 ALT 정상화율은 61%였다.43 또한 엔테카비어에 대한 유전자형 내성은 7%에서, 바이러스 돌파 현상을 동반한 경 우는 1.4%에서 관찰되어 기존 초치료 환자를 대상으로 한 연구에서 보다 높은 내성률을 보였다. 2년간 라미부딘 내성 환자를 대상으로 엔테카비어를 투여하였을 때 HBV DNA는 34%에서 PCR로 검출되지 않았으나 바이러스 돌파현상을 동반한 엔테카비어 내성 변이는 9%에서 관찰되었다.44 최근 보고된 5년 누적 유전자형 내성 발생률은 51%였고 바이러 스 돌파 현상을 동반한 경우는 43%였다.45 따라서 엔테카비 어는 라미부딘 내성 환자에서 초기의 바이러스 증식 억제 효과는 우수하나 장기간 사용 시 내성 발생의 빈도가 높으 므로 이에 대한 고려가 필요하다. 엔테카비어 내성은 기존 라미부딘 내성 변이에 추가 변이가 나타나면서 생기게 되며 배경이 되는 라미부딘 내성 변이는 대개 rtL180M+rtM204V 이고 추가 변이는 rtI169, rtT184, rtS202, rtM250 등에 다양한 조합으로 나타난다.9 단, rtL180M+rtM204V 변이 없이 rtT184, rtS202, rtM250에만 변이가 있을 경우 엔테카비어에 대한 내성은 미미하다.9 따라서 라미부딘 내성변이가 선택 되지 않도록 기존에 투여하던 라미부딘을 중단하는 것이 중 요하다. 엔테카비어 내성 발생 시의 치료에 대하여는 추후 에 다시 기술한다.
(3) 테노포비어: 테노포비어는 아직 만성 B형간염 치료 제로 승인을 받지는 않았지만 HIV에 동시 감염된 환자를 중심으로 이미 사용되고 있으며 라미부딘 내성 변이 바이러 스에도 강력한 증식 억제 효과를 나타낸다.46,47 53명의 라미 부딘 내성환자를 대상으로 테노포비어와 아데포비어의 항 바이러스 효과를 후향적으로 비교한 한 연구에서 48주 치료 후 HBV DNA가 105 copies/mL 이하로 감소하는 경우가 테 노포비어군에서 100%인 반면 아데포비어군에서는 44%로 양 군 간에 유의한 차이가 있었다.46 평균 HBV DNA 감소의 정도도 각각 5.5 copies/mL와 2.8 copies/mL로 테노포비어군
Yim HJ. Management of Antiviral-Resistant Chronic Hepatitis B Virus Infection 353
에서 의미있게 높은 폭의 감소가 관찰되었다.46 이러한 테노 포비어의 강력한 항바이러스 효과는 두 약제 간의 용량 차 이(300 mg과 10 mg)에 기인하는 것으로 생각된다. 또 다른 후향 연구에서 라미부딘 내성으로 15개월 이상 아데포비어 를 투약하였음에도 불구하고 지속적인 HBV 증식(>104 copies/mL)이 있었던 환자 20명을 대상으로 테노포비어 투 여후 치료 반응을 평가하였을 때 3.5개월 내에 95%의 환자 에서 HBV DNA가 PCR로 검출되지 않았다(검출한계 400 copies/mL).47 따라서 테노포비어를 포함한 치료 전략은 라미 부딘 내성을 극복하는 데 아데포비어에 비해 보다 효과적인 것으로 판단된다. AASLD 가이드라인에서는 라미부딘 내성 치료 시 드물지만 추가 테노포비어 내성 발생을 막기 위해 단독 치료보다는 라미부딘에 추가하거나 또는 엠트리시타 빈과 병합하여 치료할 것을 권고하고 있다.3
(4) 인터페론: 대상 간기능을 가진 경구 항바이러스제 내성 만성 B형간염 환자의 경우 인터페론 알파 또는 페그 인터페론 알파의 투여를 고려하여 볼 수 있다.48,49 최근 라 미부딘 내성 환자에서 페그인터페론의 효과를 평가한 후향 연구에서 반응율 12.5%로 결과가 그다지 고무적이지는 않
으나,48,49 환자가 젊고 대상 간기능을 잘 유지하는 경우라면
핵산 유사체의 연속 치료(sequential therapy)로 인한 다약제 내성의 발생을 피한다는 측면에서 이점이 있을 것으로 판단 된다.24,50
(5) 교체시기: 라미부딘 내성 발생 시 바이러스 돌파현 상이 관찰되고 내성 바이러스의 존재가 확인되면 AST/ALT 상승 전에 다른 항바이러스제를 추가 또는 변경하는 것이 바람직하다.6,37 이는 HBeAg 음성인 라미부딘 내성 환자를 대상으로 한 최근 연구에서 유전자형 내성이 발견되었으나 HBV DNA가 3-6 log copies/mL이고 생화학 돌파 현상이 발 생하지 않은 환자군과 HBV DNA가 6 log copies/mL 이상 상 승되고 생화학 돌파 현상이 발생한 환자군을 비교하였을 때 3개월째 HBV DNA의 PCR 음전율이 100%와 46%, 2년째 음 전율이 100%와 78%로 전자에서 훨씬 치료 반응이 좋았기 때문이다.37 그러나 국내에서 이를 현실에 적용하기 위해서 는 관련 건강보험급여 조항 개정을 위한 노력이 병행되어야 하겠다.
2. 아데포비어 내성
1) 아데포비어 내성 변이
초치료 시의 아데포비어 내성 발생은 최초 48주간의 3상 임상시험에서는 발견되지 않았으나 2년째부터 발생이 보고 되었으며 HBV 역전사효소 236번 코돈의 asparagine이 threo- nine으로 치환된 rtN236T와 전술한 rtA181V/T가 일차 내성 변이이다.51 HBeAg 음성 환자에서의 아데포비어 내성발생 빈도는 5년에 29% 수준이다.52 그러나 라미부딘 내성 환자
에서 아데포비어를 사용하였을 때 그 내성률은 현저히 증가 하게 되어 2년에 22-25%로 보고되었다.22,23,53 높은 빈도의 내성 발생률은 이때 시행된 내성 변이 검사가 기존의 직접 염기서열 분석이 아닌 line probe assay, RFMP 등의 예민한 검사 방법을 사용한 것과 관련이 있을 것으로 생각한다.16,18 아데포비어 내성 발생의 위험 인자로는 최초 높은 바이러스 수준, 치료 중 바이러스의 불충분한 억제, 그리고 앞서 기술 한 라미부딘 내성 발생 후의 교체 치료 등이 있다.35,54 아데 포비어 치료에 따른 반응으로 향후 내성 발생 여부를 판단 하는 시기는 주로 48주째로 Hadziyannis 등은 이때의 HBV DNA가 3 log copies/mL 미만 시 약 4년째(192주) 내성 발생 률이 6%에 불과하지만 그 이상일 경우 내성 발생률이 49%
로 현저히 증가함을 보고하였다.52
아데포비어 내성변이 중 rtN236T 변이의 아데포비어에 대 한 저항성은 야생종의 7-10배 수준이며 rtA181V/T는 이보다 낮은 2.5-5배의 저항성을 보인다.21 라미부딘 내성변이종의 경우와 같이 100배 이상의 저항성을 보이는 것은 아님에도 아데포비어 내성 변이의 출현은 임상적으로 바이러스 반등, 간염의 급성 악화, HBeAg 혈청 전환의 지연 또는 역전, 간 부전, 심지어 사망 등이 발생할 수 있다.5 때로 rtN236T나 rtA181V/T 변이를 동반하지 않고도 아데포비어에 대한 내성 을 보이기도 하며 rtV84M, rtS85A, rtV214A, rtQ215S, rtI233V, rtP237H, rtN238T/D 등이 현재까지 보고된 변이들이다.55,56 단, rtI233V는 아데포비어 치료에 대한 일차 실패를 유발할 수 있는 자연 발생 변이로 최초 보고되었으나 이후의 연구에서 실험실 내성이 증명되지는 않았다.56,57 rtA181T와 rtV214A, rtQ215S는 라미부딘과 교차 내성이 있으므로 아데포비어 내 성 치료 약제 선택 시 이를 고려한다.24,29,33
2) 아데포비어 내성 시 치료
아데포비어 내성에 대한 치료로 다음과 같은 방법이 제시 되고 있다.
① 라미부딘을 추가하는 방법(KASL, AASLD)
② 엔테카비어로 전환하거나 추가하는 방법(KASL, AASLD, APASL)
③ 아데포비어를 중단하고 테노포비어와 엠트리시타빈 복합제제를 투여하는 방법(AASLD)
④ 라미부딘 사용력이 없는 경우 라미부딘 또는 텔비부 딘으로 전환하거나 추가하는 방법(APASL)
(1) 라미부딘: 아데포비어 내성 변이로 rtN236T만 발생 한 경우는 라미부딘에 감수성이 있으나 rtA181T/V가 동반된 경우 감수성이 저하된다.29,33,58 아데포비어 초치료 환자에서 아데포비어 내성 발생 시 라미부딘으로 교체하는 것은 이후 의 라미부딘 내성 발생 위험에 여전히 노출되므로 라미부딘 과 아데포비어로 병합 치료할 것을 우선 고려한다. 그러나
354 대한소화기학회지: 제51권 제6호, 2008
과거 라미부딘 내성 발생으로 아데포비어를 단독으로 투약 받고 있던 경우 라미부딘을 추가하여 사용할 수 있으나 짧 은 시간 내에 라미부딘 내성이 다시 출현할 수 있다.24 이는 라미부딘 내성 변이가 cccDNA 형태로 핵내에 잔존하고 있 던 것이 다시 라미부딘의 재투여로 적절한 선택압력 (selection pressure)이 가해짐에 따라 재출현 하는 것으로 해 석된다. 따라서 라미부딘 내성으로 아데포비어를 단독 투여 받던 환자의 경우에 라미부딘을 추가할 때에는 보다 주의 깊은 경과 관찰이 필요하다.
(2) 엔테카비어: 근래 아데포비어 내성 환자에서 엔테카 비어를 투여하였을 때 HBV의 증식이 효과적으로 억제됨을 보고한 예들이 있으며 이때 rtA181T/V 변이 혹은 rtN236T 변이가 발생한 경우 모두에서 유효하였다.5,38 이는 아데포비 어 내성 변이에 대하여 엔테카비어는 교차 내성이 없기 때
문이다.38,58 다만 장기적인 자료가 부족하고 또한 기존의 라
미부딘에 내성이 있었던 경우 엔테카비어 투여 중 다시 라 미부딘 내성 변이가 선택되면서 추후 엔테카비어 내성이 발 생할 위험성이 있으므로 엔테카비어로 교체하는 것 외에 아 데포비어와 엔테카비어를 병합하여 치료하는 것을 고려할 수 있다.
(3) 테노포비어: 라미부딘과 아데포비어에 대한 동시 내 성이 있었던 경우 테노포비어를 사용하여 효과적으로 바이 러스증식을 억제한 보고가 있다.50 그러나 테노포비어는 아 데포비어 내성 변이에 약간의 감수성 저하가 있어 교차 내 성을 보일 가능성이 높다. 따라서 아데포비어 내성 변이가 발생한 환자에서는 테노포비어 단독보다는 엠트리시타빈과 의 병용 투여를 고려하는 것이 보다 적절하다.3 실제 아데포 비어 내성 환자에서 테노포비어 단독치료로 불충분한 바이 러스 감소를 보인 환자에서 엠트리시타빈 병합 치료 후 추 가적인 바이러스 수준의 감소가 있었다.59
(4) 텔비부딘: 임상에서 아데포비어 내성 시의 구조 치 료 약제로 사용된 보고는 아직 없으나 아데포비어 내성 변 이인 rtN236T에 대하여 비교적 감수성이 유지되므로 사용 이 가능하다. rtA181T/V 변이에 대하여는 교차 내성 가능성 이 있어 추가 연구가 필요하다.
3. 엔테카비어 내성에 대한 대처
1) 엔테카비어 내성 변이
엔테카비어 내성 발생은 2단계의 과정(two hit mechanism) 을 거친다. 즉, 기존 라미부딘 내성 변이가 낮은 수준으로 존재하다가 추가 변이가 나타나면서 엔테카비어 내성이 생 기게 된다. rtL180M+rtM204V가 배경이 되는 라미부딘 내 성 변이이고 여기에 엔테카비어에 대한 일차 내성 변이인 rtT184L/F/A/M/S/I/C/G, rtS202G/I/C, rtM250V/I/L와 같은 추 가 변이가 나타나면서 엔테카비어에 대한 감수성이 현저히
감소한다.9,44,60 그러나 rtM250V 단독으로 존재할 때 겹저항 성이 9배 증가하는 것 외에는 rtT184, rtS202에 단독으로 변 이가 존재할 때에는 엔테카비어에 대한 뚜렷한 감수성 저하 가 나타나지 않는다. rtI169T는 보상 변이로서 rtT184, rtS202, rtM250 변이의 엔테카비이어에 대한 겹저항성을 크 게 증가시킨다. 따라서 엔테카비어에 대한 내성이 나타나고 겹저항성이 높아지기 위해서는 다수의 유전자 염기서열의 변화를 필요로 하므로 유전자 장벽(genetic barrier)이 높아 초치료 환자에서는 드물게 관찰된다. 그러나 기존에 라미부 딘 치료를 받은 기왕력이 있거나 라미부딘 내성이 발생한 환자에서 엔테카비어를 사용할 경우에는 내성 변이 발생에 유의하여야 한다. 지금까지 보고된 엔테카비어 내성의 빈도 는 초치료 환자에서 5년 누적 1.2%로 보고되었으나 연구 설 계와 방법이 적절하지 않다는 지적이 있어 향후 추가 자료 수집이 필요하다.45,61 라미부딘 내성 환자에서 바이러스 돌 파를 동반한 엔테카비어 누적 유전자형 내성 발생률은 1, 2, 3, 4, 5년째 각각 6%, 15%, 36%, 46%, 51%였고 바이러스 돌 파 현상을 동반한 경우는 누적 1%, 10%, 27%, 39.5%, 43%
였다.44,45,61
2) 엔테카비어 내성 시 치료
엔테카비어 내성에 대한 치료로 다음과 같은 방법이 제시 되고 있다.
① 아데포비어로 전환하거나 추가하는 방법(KASL, AASLD) ② 테노포비어로 전환하거나 추가하는 방법(AASLD) (1) 아데포비어: 엔테카비어 내성 치료에 관한 자료는 현재 매우 제한적이다. 단, 치료 방법 선택에서 초치료 환자 혹은 라미부딘 내성의 기왕력이 있는 환자 모두 라미부딘 내성 변이를 가지고 있으므로 치료 방법의 큰 차이는 없을 것으로 생각된다. 엔테카비어 내성 변이는 아데포비어에 감 수성을 가지고 있고, 최근 보고에서 임상적으로 효과적인 바이러스 억제를 보인 예가 있어 우선적으로 고려할 수 있 는 약제로 판단된다.62,63 아데포비어를 엔테카비어에 추가하 는 것은 추후 아데포비어 내성을 줄이고 바이러스 억제 효 과를 향상시킬 수 있을 것으로 보인다.
(2) 테노포비어: 테노포비이어 역시 엔테카비어 내성 시 사용 경험은 미미하나 in vitro 검사에서 교차 내성이 적고 바이러스 증식 억제능이 뛰어나 향후 국내 사용이 가능하게 된다면 매우 유용한 약제가 될 것으로 판단된다.
4. 텔비부딘 내성에 대한 대처
1) 텔비부딘 내성 변이
3상 임상 연구에서 텔비부딘 내성으로 rtM204I 변이가 발 견 되었다.64 이 연구에서 텔비부딘 투여군의 내성 발생률은 HBeAg 양성인 환자에서 1년째 4.4%, 2년째 21.6%였으며
임형준. 약제 내성 B형간염에 대한 대처 355
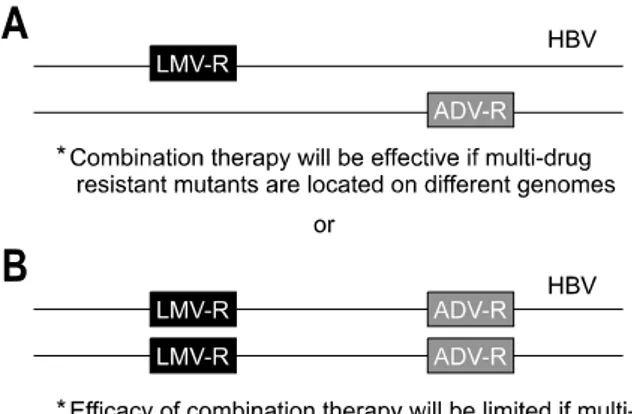
Fig. 4. Two different hypothesis of location of multiple-drug re-
sistant mutations in vivo. (A) Resistant mutations to different drugs are located on different viral genomes (B) Resistant muta- tions to different drugs are located on the same viral genome.Most of clinical isolates from multi-drug resistant mutations show co-location of drug-resistant mutations on the same viral genome.
Therefore, efficacy of combination therapy with prior drugs will not be effective, and new antiviral agents with no (or the least) cross-resistance to both drugs need to be instituted. LMV-R, lam- ivudine-resistant mutations; ADV-R, adefovir-resistant mutations;
HBV, hepatitis B virus. Adapted from ref. 24.
HBeAg 음성인 환자에서는 각각 2.7%, 8.6%였다.64,65 이에 반해 라미부딘을 투여 받은 대조군에서는 1년 및 2년째 각 각 HBeAg 양성의 경우 9.1%, 30%, HBeAg 음성의 경우 9.8%, 21.9%를 보여 텔비부딘군이 내성 발현이 적었다.64 그 러나 라미부딘 치료군의 내성 발생률이 타 임상 연구에서 보고된 바와 비교하여 상대적으로 낮은 것을 고려할 때 실 제 텔비부딘의 내성의 발생 빈도는 3상 임상연구 결과에서 보다 높을 수 있다. 텔비부딘에 내성을 보이는 일차 내성 변 이는 rtM204I 변이이며 아데포비어와 교차 내성은 없다.21,64 이차 내성 변이로 rtL80I/V, rtL80I/V+rtL180M가 나타날 수 있다.64
2) 텔비부딘 내성 시 치료
텔비부딘 내성에 대한 치료로 다음과 같은 방법이 제시되 고 있다.
① 라미부딘 내성 치료에 준하여 치료(KASL, AASLD) ② 아데포비어를 추가하여 병합(APASL)
③ 인터페론 제제로의 변경은 선택 사항으로 고려(APASL) 최근 한 연구에서 텔비부딘 내성 시 아데포비어 구조 치 료는 혈청 HBV DNA를 효과적으로 감소시켰다.66 그 외 테 노포비어 또는 엔테카비어로의 교체 투여도 고려할 수 있겠 으며 엔테카비어를 투여할 경우에는 기존의 텔비부딘은 중 단하여야 한다.3
5. 클레부딘 내성에 대한 대처
1) 클레부딘 내성
현재까지 임상적으로 의미있는 내성 발생의 보고는 드물 다. 12주 및 24주간 HBeAg 양성인 B형간염 환자를 대상으로 투약한 임상 시험에서 각각 rtV142V/D, rtA181A/T, rtV214V/A 와 rtA181A/T, rtA181T, rtV191V/I 등의 변이가 관찰되었 으나 바이러스 돌파현상은 관찰되지 않았다.67,68 그러나 rtA181T 변이가 실제로 약제 감수성 감소를 보일 수 있음에 도 특징적인 virion 분비장애(secretory defect)로 인해 바이러 스 돌파 현상이 지연되었을 가능성도 있어 이 변이가 발생 한 환자에 대한 임상경과의 관찰이 필요할 것으로 생각된 다.69 클레부딘은 라미부딘 내성변이인 rtL180M±rtM204I/V 에 높은 겹저항성을 보여 라미부딘, 텔비부딘 등에 교차내 성이 있을 것으로 생각되므로 이들 약제에 대한 내성이 발 생한 환자에서 사용은 피한다.6 rtA181V에 대한 감수성 저 하도 최근 보고되었다.58
2) 클레부딘 내성 시 치료
대한간학회 가이드라인에서는 라미부딘 내성에 준하여 치 료할 것으로 권고했으나 rtL180M±rtM204I/V와 같은 라미부 딘 내성 변이가 클레부딘을 투약 받는 환자에서 실제 출현
할 빈도에 대하여는 추가 임상 연구가 필요하다.70 또한 발 견되는 새로운 변이에 대한 추가 약제 감수성 검사도 필수 적이다.
6. 다약제 내성에 대한 대처
1) 다약제 내성
핵산 유사체의 순차적인 사용은 두 가지 이상의 약제에 대한 내성 변이를 동시에 나타내는 다약제 내성 HBV 출현 을 유발하게 되었다.24,50,62 즉, 과거 라미부딘에 대한 내성이 발생한 환자에서 아데포비어를 투여하던 중 다시 내성이 발 생하여 라미부딘을 재투여하거나, 라미부딘에 내성이 발생 한 환자에서 엔테카비어를 투여하는 경우, 아데포비어를 초 치료로 투여 받던 중 내성이 발생하여 라미부딘을 추가로 투여 받던 경우 등에서 다시 내성이 발생하고, 기존의 약제 에 대한 내성 변이가 사라지지 않고 있거나 다시 출현하여, 각각의 약제에 대한 내성 변이가 따로 존재하지 않고 한 바 이러스 게놈 내에 나란히 존재하게 되는 것이다(Fig. 4).24,62 이러한 내성변이는 간이식을 시행받은 환자에서 B형간염 면역글로불린에 대한 내성 변이를 표면항원 유전자(S gene) 에 동반하기도 한다.24,50 한 바이러스 게놈 내에 나란히 존 재하는 각각의 약제에 대한 내성 변이는 항바이러스제 병합 치료의 한계를 보여준다는 점에서 매우 우려되는 사항이다.
예로써 in vitro 연구에서 라미부딘 내성 HBV와 아데포비어
356 The Korean Journal of Gastroenterology: Vol. 51, No. 6, 2008
내성 HBV는 모두 라미부딘과 아데포비어의 병합 치료에 효과적으로 증식이 억제되지만 두 가지 변이가 함께 존재할 때는 병합 치료에 대한 겹저항성이 50배 이상 증가하였다.71 임상에서 직접염기서열 검사로 두 가지 약제에 동시 내성을 보이는 환자의 혈청을 clonal analysis를 통하여 분석하였을 때 80% 이상의 clone에서 이미 두 가지 약제에 대한 내성 변이가 한 게놈 내에 나란히 위치하고 있어 기존 사용 약제 의 병합 치료는 더 이상의 임상적 유용성이 없을 가능성이 높았다.24
2) 다약제 내성 시 치료
라미부딘과 아데포비어에 대한 내성 변이가 동시에 존재 할 경우 테노포비어와 엠트리시타빈의 병합치료, 테노포비 어와 엔테카비어의 병합치료를 고려할 수 있다.13 현재 국내 에서는 테노포비어의 사용이 용이하지 않으므로 라미부딘 내성이 동반되어 있는 아데포비어 내성 환자의 경우 아데포 비어와 엔테카비어를 병합하는 것을 고려할 수 있다. 그러 나 좀더 근본적으로는 면역 내성기에 있는 환자처럼 바이러 스 증식이 많고 치료에 대한 반응이 낮아 내성이 생길 가능 성이 높은 사람에게 불필요하게 항바이러스제를 투여하는 것을 삼가하고 일단 치료를 시작한 경우에는 단일 약제의 순차적 항바이러스제 투여를 되도록 피하는 것이 좋다.
결 론
한 번 아미노산 변이가 생긴 바이러스의 염기서열은 추가 변이가 생기기 용이해지며 교차 내성을 유발하므로 이어서 사용하게 되는 항바이러스제의 선택 범위 및 치료 결과를 크게 제한하게 된다.21,24 따라서 치료 중에는 적절한 경과 모니터를 통해 바이러스 돌파나 생화학 돌파 여부를 관찰하 고 규칙적인 약제 복용에도 불구하고 바이러스 돌파가 발생 할 경우 항바이러스 내성 검사를 통해 유전자 내성을 확인 하여 추가 임상 악화가 발생하기 전에 조기에 항바이러스 치료 방침을 변경하는 것이 필요하다.3,6,37 약제 변경 시는 내성 변이의 특성을 파악하여 교차내성이 발생하지 않도록 구조 치료 약제를 선택하는 것이 필요하다. 또한, 교체 요법 보다는 병합 요법이 이후에 나타날 수 있는 추가적인 약제 내성의 빈도를 줄여 주는 것으로 판단되므로 장기간의 항바 이러스 치료가 필요하거나 혹은 추가 내성 발생 가능성이 높은 경우, 내성 발생 시 비대상 악화의 우려가 높은 경우에 는 병합치료를 고려한다. 단, 비용 대비 효과 측면에 대한 분석이 필요할 것으로 생각한다.
중요한 것은 최초 만성 B형간염 치료를 시작할 때 과연 환자의 간기능이 치료 시작을 꼭 필요로 하는 상황인지, 그 리고 적절한 시기인지를 판단하고 약제 선택 시 바이러스
증식억제력과 내성 발생률을 고려하여 강력하고 내성 발생 이 적은 약제를 일차적으로 선택하고 약제 순응도를 면밀히 모니터 하는 것이 약제 내성을 예방할 수 있는 핵심이다.
참고문헌
1. Lok AS. Navigating the maze of hepatitis B treatments.
Gastroenterology 2007;132:1586-1594.
2. Locarnini S, Hatzakis A, Heathcote, et al. Management of an- tiviral resistance in patients with chronic hepatitis B. Antivir Ther 2004;9:679-693.
3. Lok AS, McMahon BJ. Chronic hepatitis B. Hepatology 2007;45:507-539.
4. Liaw YF, Chien RN, Yeh CT, Tsai SL, Chu CM. Acute ex- acerbation and hepatitis B virus clearance after emergence of YMDD motif mutation during lamivudine therapy. Hepatolo- gy 1999;30:567-572.
5. Fung SK, Andreone P, Han SH, et al. Adefovir-resistant hep- atitis B can be associated with viral rebound and hepatic decompensation. J Hepatol 2005;43:937-943.
6. Lee KS, Kim DJ, Guideline Committee of Korean Associa- tion for the Study of the Liver. Management of Chronic Hepatitis B. Korean J Hepatol 2007;13:447-488.
7. Nowak MA, Bonhoeffer S, Hill AM, Boehme R, Thomas HC, McDade H. Viral dynamics in hepatitis B virus infec- tion. Proc Natl Acad Sci U S A 1996;93:4398-4402.
8. Melegari M, Scaglioni PP, Wands JR. Hepatitis B virus mu- tants associated with 3TC and famciclovir administration are replication defective. Hepatology 1998;27:628-633.
9. Tenney DJ, Levine SM, Rose RE, et al. Clinical emergence of entecavir-resistant hepatitis B virus requires additional sub- stitutions in virus already resistant to Lamivudine. Antimicrob Agents Chemother 2004;48:3498-3507.
10. Richman DD. The impact of drug resistance on the effective- ness of chemotherapy for chronic hepatitis B. Hepatology 2000;32:866-867.
11. Zhou T, Saputelli J, Aldrich CE, Deslauriers M, Condreay LD, Mason WS. Emergence of drug-resistant populations of woodchuck hepatitis virus in woodchucks treated with the an- tiviral nucleoside lamivudine. Antimicrob Agents Chemother 1999;43:1947-1954.
12. Keeffe EB, Zeuzem S, Koff RS, et al. Report of an interna- tional workshop: Roadmap for management of patients receiv- ing oral therapy for chronic hepatitis B. Clin Gastroenterol Hepatol 2007;5:890-897.
13. Lok AS, Zoulim F, Locarnini S, et al. Antiviral drug-resistant HBV: standardization of nomenclature and assays and recom-
Yim HJ. Management of Antiviral-Resistant Chronic Hepatitis B Virus Infection 357
mendations for management. Hepatology 2007;46:254-265.
14. Durantel D, Brunelle MN, Gros E, et al. Resistance of human hepatitis B virus to reverse transcriptase inhibitors: from gen- otypic to phenotypic testing. J Clin Virol 2005;34(suppl 1):S34-S43.
15. Jardi R, Buti M, Rodriguez-Frias F, et al. Rapid detection of lamivudine-resistant hepatitis B virus polymerase gene va- riants. J Virol Methods 1999;83:181-187.
16. Hong SP, Kim NK, Hwang SG, et al. Detection of hepatitis B virus YMDD variants using mass spectrometric analysis of oligonucleotide fragments. J Hepatol 2004;40:837-844.
17. Kim HS, Han KH, Ahn SH, et al. Evaluation of methods for monitoring drug resistance in chronic hepatitis B patients dur- ing lamivudine therapy based on mass spectrometry and re- verse hybridization. Antivir Ther 2005;10:441-449.
18. Hussain M, Fung S, Libbrecht E, et al. Sensitive line probe assay that simultaneously detects mutations conveying resist- ance to lamivudine and adefovir. J Clin Microbiol 2006;44:
1094-1097.
19. Kim JK, Lee HJ, Lee YJ, et al. Direct detection of lam- ivudine-resistant hepatitis B virus mutants by a multiplex PCR using dual-priming oligonucleotide primers. J Virol Methods 2008;149:76-84.
20. Lee CH, Kim SO, Byun KS, et al. Predominance of hepatitis B virus YMDD mutants is prognostic of viral DNA break- through. Gastroenterology 2006;130:1144-1152.
21. Bartholomeusz A, Locarnini SA. Antiviral drug resistance:
clinical consequences and molecular aspects. Semin Liver Dis 2006;26:162-170.
22. Lee YS, Suh DJ, Lim YS, et al. Increased risk of adefovir resistance in patients with lamivudine-resistant chronic hep- atitis B after 48 weeks of adefovir dipivoxil monotherapy.
Hepatology 2006;43:1385-1391.
23. Yeon JE, Yoo W, Hong SP, et al. Resistance to adefovir di- pivoxil in lamivudine resistant chronic hepatitis B patients treated with adefovir dipivoxil. Gut 2006;55:1488-1495.
24. Yim HJ, Hussain M, Liu Y, Wong SN, Fung SK, Lok AS.
Evolution of multi-drug resistant hepatitis B virus during se- quential therapy. Hepatology 2006;44:703-712.
25. Lai CL, Dienstag J, Schiff E, et al. Prevalence and clinical correlates of YMDD variants during lamivudine therapy for patients with chronic hepatitis B. Clin Infect Dis 2003;36:
687-696.
26. Chae HB, Hann HW. Baseline HBV DNA level is the most important factor associated with virologic breakthrough in chronic hepatitis B treated with lamivudine. World J Gastro- enterol 2007;13:4085-4090.
27. Gerolami R, Bourliere M, Colson P, et al. Unusual selection of rtA181V HBV mutants cross-resistant to adefovir follow- ing prolonged lamivudine monotherapy: report of two cases.
Antivir Ther 2006;11:1103-1106.
28. Villet S, Pichoud C, Billioud G, Trepo C, Zoulim F. What is the role of HBV rtA181V/T mutant in hepatitis B treatment failure? J Hepatol 2007;46(suppl 1):S299.
29. Yeon J, Kim Y, Han W, et al. Pre-existing or rapid emer- gence of A181T polymerase mutation in lamivudine resistant chronic hepatitis B patients treated with adefovir. Hepatology 2006;44(suppl 1):560A.
30. Ono SK, Kato N, Shiratori Y, et al. The polymerase L528M mutation cooperates with nucleotide binding-site mutations, increasing hepatitis B virus replication and drug resistance. J Clin Invest 2001;107:449-455.
31. Delaney WE 4th, Yang H, Westland CE, et al. The hepatitis B virus polymerase mutation rtV173L is selected during lam- ivudine therapy and enhances viral replication in vitro. J Virol 2003;77:11833-11841.
32. Kim S, Chung Y, Lee Y, et al. Effect of rtL80V/I variant of hepatitis B virus on the respnse to adefovir dipivoxil therapy.
Hepatol Int 2007;1:16.
33. Villet S, Pichoud C, Trepo C, Zoulim F. Selection of the A181T/V substitution in HBV chronically infected patients who developed a resistance to lamivudine and/or adefovir.
Hepatology 2006;44(suppl 1):555A.
34. Peters MG, Hann HW, Martin P, et al. Adefovir dipivoxil alone or in combination with lamivudine in patients with lam- ivudine-resistant chronic hepatitis B. Gastroenterology 2004;
126:91-101.
35. Rapti I, Dimou E, Mitsoula P, Hadziyannis SJ. Adding-on versus switching-to adefovir therapy in lamivudine-resistant HBeAg-negative chronic hepatitis B. Hepatology 2007;45:307- 313.
36. Lampertico P, Marzano A, Levrero M, et al. Adefovir and lamivudine combination therapy is superior to adefovir mono- therapy for lamivudine-resistant patients with HBeAg-negative chronic hepatitis B. J Hepatol 2007;46(suppl 1):S191.
37. Lampertico P, Vigano M, Manenti E, et al. Adefovir rapidly suppresses hepatitis B in HBeAg-negative patients developing genotypic resistance to lamivudine. Hepatology 2005;42:1414- 1419.
38. Villet S, Pichoud C, Billioud G, et al. Impact of hepatitis B virus rtA181V/T mutants on hepatitis B treatment failure. J Hepatol 2008;48:747-755.
39. Gaia S, Barbon V, Smedile A, et al. Lamivudine-resistant chronic hepatitis B: an observational study on adefovir in
358 대한소화기학회지: 제51권 제6호, 2008
monotherapy or in combination with lamivudine. J Hepatol 2008;48:540-547.
40. Fung J, Lai CL, Yuen JC, et al. Adefovir dipivoxil mono- therapy and combination therapy with lamivudine for the treatment of chronic hepatitis B in an Asian population.
Antivir Ther 2007;12:41-46.
41. Karatayli E, Karayalcin S, Karaaslan H, et al. A novel muta- tion pattern emerging during lamivudine treatment shows cross-resistance to adefovir dipivoxil treatment. Antivir Ther 2007;12:761-768.
42. Chang TT, Gish RG, Hadziyannis SJ, et al. A dose-ranging study of the efficacy and tolerability of entecavir in Lamivu- dine-refractory chronic hepatitis B patients. Gastroenterology 2005;129:1198-1209.
43. Sherman M, Yurdaydin C, Sollano J, et al. Entecavir for treatment of lamivudine-refractory, HBeAg-positive chronic hepatitis B. Gastroenterology 2006;130:2039-2049.
44. Tenney DJ, Rose RE, Baldick CJ, et al. Two-year assessment of entecavir resistance in Lamivudine-refractory hepatitis B virus patients reveals different clinical outcomes depending on the resistance substitutions present. Antimicrob Agents Che- mother 2007;51:902-911.
45. Tenney D, Pokornowski KA, Rose RE, et al. Entecavir at five years shows long-term maintenance of high genetic bar- rier to hepatitis B virus resistance. Hepatol Int 2008;2:A88-89.
46. van Bommel F, Wunsche T, Mauss S, et al. Comparison of adefovir and tenofovir in the treatment of lamivudine-resistant hepatitis B virus infection. Hepatology 2004;40:1421-1425.
47. van Bommel F, Zollner B, Sarrazin C, et al. Tenofovir for patients with lamivudine-resistant hepatitis B virus (HBV) in- fection and high HBV DNA level during adefovir therapy.
Hepatology 2006;44:318-325.
48. Shi M, Wang RS, Zhang H, et al. Sequential treatment with lamivudine and interferon-alpha monotherapies in hepatitis B e antigen-negative Chinese patients and its suppression of lamivudine-resistant mutations. J Antimicrob Chemother 2006;
58:1031-1035.
49. Leemans WF, Flink HJ, Janssen HL, et al. The effect of pe- gylated interferon-alpha on the treatment of lamivudine re- sistant chronic HBeAg positive hepatitis B virus infection. J Hepatol 2006;44:507-511.
50. Villet S, Pichoud C, Villeneuve JP, Trepo C, Zoulim F.
Selection of a multiple drug-resistant hepatitis B virus strain in a liver-transplanted patient. Gastroenterology 2006;131:
1253-1261.
51. Villeneuve JP, Durantel D, Durantel S, et al. Selection of a hepatitis B virus strain resistant to adefovir in a liver trans-
plantation patient. J Hepatol 2003;39:1085-1089.
52. Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, et al.
Long-term therapy with adefovir dipivoxil for HBeAg-neg- ative chronic hepatitis B for up to 5 years. Gastroenterology 2006;131:1743-1751.
53. Fung SK, Chae HB, Fontana RJ, et al. Virologic response and resistance to adefovir in patients with chronic hepatitis B.
J Hepatol 2006;44:283-290.
54. Lampertico P, Vigano M, Manenti E, Iavarone M, Sablon E, Colombo M. Low resistance to adefovir combined with lam- ivudine: a 3-year study of 145 lamivudine-resistant hepatitis B patients. Gastroenterology 2007;133:1445-1451.
55. Bartholomeusz A, Locarnini S, Ayres A, et al. Molecular modeling of hepatitis B virus polymerase and adefovir resist- ance identifies three cluster of mutations. Hepatology 2004;
40(suppl):246A.
56. Schildgen O, Sirma H, Funk A, et al. Variant of hepatitis B virus with primary resistance to adefovir. N Engl J Med 2006;354:1807-1812.
57. Curtis M, Zhu Y, Borroto-Esoda K. Hepatitis B virus contain- ing the I233V mutation in the polymerase reverse-tran- scriptase domain remains sensitive to inhibition by adefovir. J Infect Dis 2007;196:1483-1486.
58. Qi X, Xiong S, Yang H, Miller M, Delaney WE 4th. In vitro susceptibility of adefovir-associated hepatitis B virus polymer- ase mutations to other antiviral agents. Antivir Ther 2007;12:
355-362.
59. Tan J, Degertekin B, Wong SN, Husain M, Oberhelman K, Lok AS. Tenofovir monotherapy is effective in hepatitis B patients with antiviral treatment failure to adefovir in the ab- sence of adefovir-resistant mutations. J Hepatol 2008;48:391- 398.
60. Tenney DJ, Baldick CJ, Rose RE, et al. Only a subset of HBV substitutions at entecavir resistance residues lead to phenotypic resistance and virologic rebound. Hepatology 2006;44(suppl 1):253A.
61. Colonno RJ, Rose RE, Pokornowski K, et al, Tenney DJ.
Four year assessment of entecavir resistance in nucleo- side-naive and lamivudine refractory patients. J Hepatol 2007;
46(suppl 1):S294.
62. Villet S, Ollivet A, Pichoud C, et al. Stepwise process for the development of entecavir resistance in a chronic hepatitis B virus infected patient. J Hepatol 2007;46:531-538.
63. Yatsuji H, Hiraga N, Mori N, et al. Successful treatment of an entecavir-resistant hepatitis B virus variant. J Med Virol 2007;79:1811-1817.
64. Lai CL, Gane E, Liaw YF, et al. Telbivudine versus lam-
임형준. 약제 내성 B형간염에 대한 대처 359
ivudine in patients with chronic hepatitis B. N Engl J Med 2007;357:2576-2588.
65. Lai CL, Leung N, Teo EK, et al. A 1-year trial of telbivu- dine, lamivudine, and the combination in patients with hep- atitis B e antigen-positive chronic hepatitis B. Gastroenterol- ogy 2005;129:528-536.
66. Gane E, Lai CL, Min A, et al. Adefovir salvage therapy for telbivudine treated patients from Globe with virologic breakthrough. Hepatol Int 2007;1:14.
67. Lee HS, Chung YH, Lee K, et al. A 12-week clevudine ther- apy showed potent and durable antiviral activity in HBeAg-positive chronic hepatitis B. Hepatology 2006;43:982- 988.
68. Yoo BC, Kim JH, Chung YH, et al. Twenty-four-week clevu- dine therapy showed potent and sustained antiviral activity in
HBeAg-positive chronic hepatitis B. Hepatology 2007;45:
1172-1178.
69. Locarnini S. The multi-drug resistant HBV rtA181T has a se- cretion defect and significantly reduces the kinetics of viral rebound. Hepatology 2007;46(suppl):654A.
70. Chin R, Shaw T, Torresi J, et al. In vitro susceptibilities of wild-type or drug-resistant hepatitis B virus to (-)-beta-D-2,6- diaminopurine dioxolane and 2'-fluoro-5-methyl-beta-L-arabi- nofuranosyluracil. Antimicrob Agents Chemother 2001;45:2495- 2501.
71. Brunelle MN, Jacquard AC, Pichoud C, et al. Susceptibility to antivirals of a human HBV strain with mutations confer- ring resistance to both lamivudine and adefovir. Hepatology 2005;41:1391-1398.