서 론
여성의 유방암 발생률이 세계적으로 증가하고 있다.(1) 유방암 은 미국에서 여성에게 가장 많이 발생하는 종양으로 미국 여성 10 만 명당 124.5명에게 발생하고 30.2명이 사망하는 것으로 보고 되고 있다.(2) 우리나라에서도 유방암 발생빈도가 최근 점차 높아 져, 여성을 기준으로 2005년 한 해 동안 발생한 유방암 환자수는 9,842명으로 인구 10만 명당 연령표준화 발생률 35.5명에 달하
는 것으로 보고되고 있다.(3)
발생률이 급격히 증가하고 있는 유방암은 2001년부터 우리나 라 여성 암 중 가장 발생빈도가 높은 암으로 대두되었다.(1) 우리 나라 유방암 발생 분포의 특징은 60대에 많이 발생하는 서구와 달리 40대에서 제일 높은 발병률을 나타낸다는 점(3)과 점차 발 병연령이 낮아지고 있다는 점을 들 수 있다. 이와 같이 비교적 젊 은 연령층에 호발하는 우리나라 여성 유방암은 긴 유병기간에 따 른 의료비의 증가와 함께 국가 경제의 생산성을 감소시키는 결과 를 초래하고 있다.(1)
전이성 유방암 치료의 주된 목적은 질병의 완화이며, 이를 위한 방법으로 주로 항암화학요법과 항암호르몬 요법을 사용한다.(4) 전이성 유방암의 치료를 위한 항암화학제제로서 단독적 파클리탁 Purpose: The aim of this study was to determine the incre-
mental effectiveness (the differences in progression-free survival between treatments), the incremental cost and the incremental cost-effectiveness of Genexol-PM compared to Paclitaxel when these drugs were used as treatment for pa- tients with metastatic breast cancer. Methods: In the absence of any comparative direct evidence of the relative efficacy of Paclitaxel and Genexol-PM in this setting, a meta-analysis was conducted to determine the effects of the Paclitaxel on the health outcome. The decision tree model was constructed to evaluate the two treatment regimens. All the costs are in 2008 Korean Won (KW) and they were evaluated according to the 3rd party payer perspective, and the direct nonmedical and indirect costs were excluded. Results: When compared with Paclitaxel, Genexol-PM was shown to increase the re-
sponse rate and the time to progression for patients with metas- tatic breast cancer. Although the overall treatment costs of Genexol-PM were slightly higher than those of Paclitaxel, Genexol-PM was associated with a delayed time to progres- sion of 4.78 months per patient. The incremental cost effec- tiveness ratio for Genexol-PM versus Paclitaxel was KW 2,295,228 per year gained, which is far below the per capi- ta GDP or the threshold of the willingness-to-pay in Korea.
Conclusion: Compared with Paclitaxel, Genexol-PM for treating metastatic breast cancer is within the acceptable range of the cost-effectiveness ratio for medical intervention.
Key Words: Breast neoplasms, Cost-benefit analysis, Neoplasm metastasis, Paclitaxel
중심단어: 유방암, 비용효과분석, 암전이, 파클리탁셀
Cost-Effectiveness of Genexol-PM for Treating Metastatic Breast Cancer
Jinhyun Kim, Sangjin Shin
1Seoul National University College of Nursing, Seoul; 1Seoul National University School of Public Health, Seoul, Korea
Breast Cancer
O R I G I N A L A R T I C L E
김진현ㆍ신상진1
서울대학교 간호대학, 1서울대학교 보건대학원
전이성 유방암 치료를 위한 제넥솔-피엠의 비용효과분석
책임저자: 김진현
110-799 서울시 종로구 연건동 28, 서울대학교 간호대학 Tel: 02-740-8818, Fax: 02-766-1852
E-mail: Jinhyun@snu.ac.kr
접수일: 2009년 2월 19일 게재승인일: 2009년 10월 12일
104
셀의 용량과 용법은 일반적으로 매 3주마다 3-24시간에 걸쳐서 175 mg/m2또는 매주마다 1시간에 걸쳐서 80 mg/m2을 투여하 는 방법이 추천되며 좋은 치료효과를 보이는 것으로 알려져 있다.
하지만 제제의 최대투여용량은 부형제인 크레모퍼(Cremophor EL)에 의해 나타나는 심각한 독성 때문에 한번에 투여할 수 있는 양이 제한되고 있다. 이러한 부작용을 극복하기 위해서 기존 제제 에서 난용성인 파클리탁셀(paclitaxel)을 용해하기 위해 사용되 는 크레모퍼를 사용하지 않고, 분자량이 낮고 무독성의 생분해성 고분자인 methoxy poly를 이용한 미소입자(nanomicelle) 파클 리탁셀을 형성하여 가용성을 증가시킨 제넥솔-피엠(Genexol- PM, Samyang Genex, Seoul, Korea)이 개발되었다.
제넥솔-피엠은 전이성 유방암 또는 재발성 유방암의 1차 치료 에 사용되고 3주마다 약 300 mg/m2을 3시간 동안 점적 정맥 정 주하여 투여하는데 파클리탁셀과 달리 전처치가 불필요하다는 장 점이 있다. 즉, 제넥솔-피엠은 파클리탁셀의 투여 가능량을 최대 화하여 유효율을 증가시키고 부형제와 관련한 독성을 최소화시켜, 파클리탁셀에 대한 우수성을 인정 받았으며 2007년부터 국내에 서 시판되고 있다. 이렇듯 기존 파클리탁셀 대신 제넥솔-피엠의 사용이 투여가능용량을 최대화하여 유효성이 개선되는 효과를 가 져온다는 것은 임상시험을 통해 보여주고 있으나,(5) 제넥솔-피 엠의 투여가 추가 편익뿐 아니라 추가 비용 또한 가져오게 되므로 비용-효과에 대한 분석이 필요하다. 즉, 특정 약물이 보편적으로 임상에서 사용되기 위해서는 안전성, 유효성에 더하여 비용-효과 성(cost-effectiveness)에 대한 평가가 필요하며, 비용-효과성 에 대한 판단은 추가편익에 대해 사회가 어느 정도 지불하고자 하 는가를 반영하게 된다.
따라서 본 연구는 이러한 배경 하에서 한국에서 실시된 제넥솔- 피엠의 제2상 임상시험(5)에서 보고된 제넥솔-피엠의 안전성과 효과성에 대한 자료를 근거로, 한국에서 유방암 환자에게 제넥솔- 피엠을 사용하는 것이 비용-효과적인지를 평가하기 위해 수행되 었다. 본 연구의 경제성 평가 관점은 보험자 관점으로 치료에 수반 되는 직접비용만을 반영하였으며 그 중 점증적 비용(incremental cost)만을 본 연구에서 추정하였다. 비용-효과성의 평가는 점증 적 비용효과비(incremental cost-effectiveness ratio)로 제시 되었다. 즉, 파클리탁셀 대신 제넥솔-피엠 투여로 인해 증가된 효 과에 대해 추가적으로 지불하는 비용이 어느 정도인가를 제시하 였으며, 이 비용-효과비의 적정성에 대한 평가는 한국 사회의 지 불의사나 지불능력을 고려하여 이루어지게 될 것이다.
방 법
본 연구에서는 제넥솔-피엠과 파클리탁셀의 효과를 추정하기
위해 주요 임상문헌을 이용하였다. 먼저, 제넥솔-피엠의 효과는 국내에서 시행된 제2상 임상시험(5)을 이용하였다. Lee 등(5)은 2004년 7월부터 2005년 10월까지 국내 8개 종합병원에서 전이성 유방암환자를대상으로제넥솔-피엠의유효성과안전성을평가하 였다. 총 41명의 환자 결과가 분석대상에 포함되었는데, 이들은 매3주마다300 mg/m2의제넥솔-피엠을3시간에걸쳐투여받았 고 환자당 항암제 투여주기의 중간값은 8주기(범위, 1-16)였다. 이 연구에서 유효성 평가를 위한 1차 결과변수는 반응률이며 2차 결과 변수는반응지속기간, 질병의진행까지의시간및생존기간이었다.
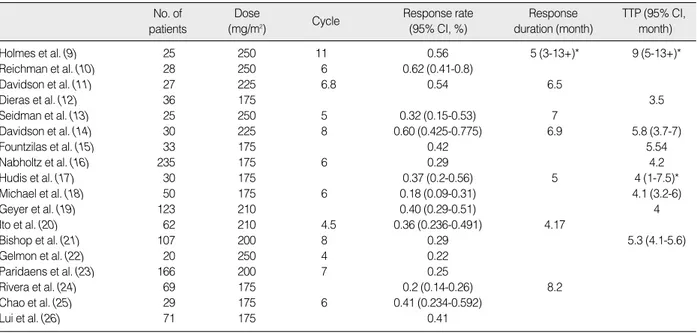
제넥솔-피엠의 효과와 비교하기 위한 파클리탁셀의 효과를 추 정하기 위해 Lee 등(5)의 연구와 비교 가능한 기존 연구 문헌을 검 색하였다. 문헌 검색에서 주요 기준으로 삼은 것은 1) 대상환자가 Lee 등(5)의 연구와 동일한 전이성 유방암 환자를 대상으로 한 것, 2) 주요 임상시험 논문으로서 종설(review article), 예비보고 (preliminary report) 등은 제외하고, 전문(full text) 확인이 가 능한 논문이며 비교대상인 파클리탁셀의 효과를 보고한 논문, 3) 효과변수가 본 연구의 경제성 평가에서 활용할 변수인 반응률과 질병진행까지 시간(time to progression, TTP)인 논문, 4) 파 클리탁셀 투여용량은 현재 표준 투여용량인 175 mg/m2를 기준으 로 하였다. 고용량 투여가 되는 제넥솔-피엠과의 비교를 보수적으 로 하기 위해 175 mg/m2를 넘어서는 고용량 투여 연구 결과도 포함시켜 민감도 분석에서 이용하였다. 5) 투여방법은 3주 간격으 로 정해진 용량을 투여한 논문을 기준으로 하였다. 우선, PubMed 에서 검색기간을 1990년-2006년으로 두고 검색어로‘breast cancer’이면서‘phase II trial’또는‘paclitaxel’을 가진 684 개의 논문을 1차로 확인하였다. 확인된 논문에 대해 위에 제시한 기준과 파클리탁셀과 다른 약제와의 병용투여에 대한 논문은 제 외하는 기준을 적용하여 비교대상 논문을 다시 선별하였다. 이러 한 과정을 통해 최종적으로 18개의 비교 가능한 논문을 선정하였 다(Table 1). 이 중 175 mg/m2를 기준으로 한 논문만을 포함하 여 기본분석을 시행하였다.
비용효과분석에서는 제넥솔-피엠의 효과지표로 종양 반응률 과 Kaplan-Meier방법으로 생존분석을 실시한 결과인 TTP를 이용하였다. 종양 반응률은 전체 피험자 대비 완전관해 또는 부분 관해를 보인 피험자의 분율이며, 질병진행까지의 시간은 치료 시 작일부터 질병의 진행이 확인된 시점 또는 마지막 접촉 시점 또는 다른 항암치료를 시작한 시점까지로 정의하였다. 각각의 약제별 로 비용과 효과를 추정하기 위해 본 연구에서는 결정분석모형 (Figure 1)을 이용하였다. 환자군은 임상시험의 환자집단과 동일 하게 전이성 유방암환자로 설정하였으며, 각 약제군별로 종양반 응률을 보인 군과 보이지 않은 각각에서의 병의 진행까지의 시간 을 효과로 설정하였다. 즉, 종양반응여부와 상관없이 모든 환자
에서 병의 진행이 나타나지만 단지 병의 진행까지의 시간을 지연 시키는 것을 효과로 가정하였다. 분석기간은 6주기(cycles)를 기 준으로 3주 간격으로 6회 투여한 즉, 18주로 설정하였다.
비용효과분석의 또 다른 요소인 비용은 보험자관점에서 추정 하였고, 전이성 유방암 치료과정에서 기존 약제인 파클리탁셀을 제넥솔-피엠으로 대체하였을 때 발생하는 점증적 비용만을 연구 에 포함시키는 것을 원칙으로 하였다. 전이성 유방암 치료에서 소 요되는 직접 의료비용에는 입원비용, 외래비용, 약품비, 기타 처 치비용 등이 있지만 약품비를 제외하고 나머지 항목은 파클리탁셀 군과 제넥솔-피엠 군 간의 차이가 없는 것으로 가정하고 제넥솔- 피엠과 파클리탁셀의 약품비만을 추정하였다. 약품비는 2008년
기준 단위비용을 이용하였으며 파클리탁셀의 경우는 오리지널 약품과 복제약이 시장에서 모두 사용되므로, 오리지널과 나머지 복제약의 2005년 시장점유율에 근거하여 가중평균가격을 산출 하였다. 이렇게 구한 2008년 기준 단위비용에 평균 항암요법 주 기에 대해 전문가 의견에 따라 6주기를 지속하는 것으로 가정하 여 비교대상 약제의 직접 약제비용을 추정하였다. 이상의 과정을 통해 파클리탁셀이 아닌 제넥솔-피엠을 투여하였을 때 추가로 소 요되는 비용과 추가적으로 얻을 수 있는 효과(반응률, 병의 진행까 지의 시간)를 산출하고 이에 근거하여 점증적 비용효과비를 산출 하였다.
한편, 제시된 점증적 비용효과비가 본 연구에서 이용한 모수값 과 가정이 가지고 있는 불확실성 정도에 따라 어느 정도 반응을 하는지에 대한 검토를 위해 추가적으로 민감도 분석을 실시하였 다. 점증적 비용효과비 산출의 주요 변수가 되는 비용과 효과라는 변수 각각에 대해 비용의 경우, 제넥솔-피엠 약품 단가를 현재 가 격 기준 상하 15% 범위에서 변화를 허용하였을 때, 그리고 효과의 경우 제넥솔-피엠과 파클리탁셀의 효과추정치를 현재를 기준으 로 상하 15% 범위에서 변화를 허용하였을 때 점증적 비용효과비 값이 어느 정도 수준에서 변화하고 있는지 확인하여 본 연구에서 제시하는 점증적 비용효과비 추정치의 수용성을 검토하였다.
결 과
전이성 유방암 환자들에 대한 제넥솔-피엠의 유효성 측정결과, Table 1. Studies included in the Paclitaxel treatment meta-analysis
No. of patients
Response rate (95% CI, %) Dose
(mg/m2) Cycle Response
duration (month)
TTP (95% CI, month)
Holmes et al. (9) 25 250 11 0.56 5 (3-13+)* 9 (5-13+)*
Reichman et al. (10) 28 250 6 0.62 (0.41-0.8)
Davidson et al. (11) 27 225 6.8 0.54 6.5
Dieras et al. (12) 36 175 3.5
Seidman et al. (13) 25 250 5 0.32 (0.15-0.53) 7
Davidson et al. (14) 30 225 8 0.60 (0.425-0.775) 6.9 5.8 (3.7-7)
Fountzilas et al. (15) 33 175 0.42 5.54
Nabholtz et al. (16) 235 175 6 0.29 4.2
Hudis et al. (17) 30 175 0.37 (0.2-0.56) 5 4 (1-7.5)*
Michael et al. (18) 50 175 6 0.18 (0.09-0.31) 4.1 (3.2-6)
Geyer et al. (19) 123 210 0.40 (0.29-0.51) 4
Ito et al. (20) 62 210 4.5 0.36 (0.236-0.491) 4.17
Bishop et al. (21) 107 200 8 0.29 5.3 (4.1-5.6)
Gelmon et al. (22) 20 250 4 0.22
Paridaens et al. (23) 166 200 7 0.25
Rivera et al. (24) 69 175 0.2 (0.14-0.26) 8.2
Chao et al. (25) 29 175 6 0.41 (0.234-0.592)
Lui et al. (26) 71 175 0.41
CI=confidence interval.
*Numbers in parenthesis are range, not 95% CI.
Figure 1. Decision tree.
Metastastic Breast Cancer
Genexol-PM
Response
No Response
Response
No Response No progression Progression No progression
Progression No progression
Progression No progression
Progression
Paclitaxel
반응률은 58.5% (완전관해 12.2%, 부분관해 46.3%)이고 반응률 에 대한 95% 신뢰구간은 43.5-72.3%, 질병진행까지의 시간은 9.0개월, 범위는 1.0-17.0개월로 제시되고 있다.(5)
종양 반응률과 질병진행까지의 시간에 대한 파클리탁셀의 효과 는 175 mg/m2를 기준으로 하는 논문 7개에서 제시된 효과 값에 각 연구의 환자수를 이용한 가중치를 적용하여 평균을 산출하였 다. 그 결과 종양 반응률은 28.4%, 그리고 질병진행까지의 시간 은 평균 4.22개월로 추정되었다.
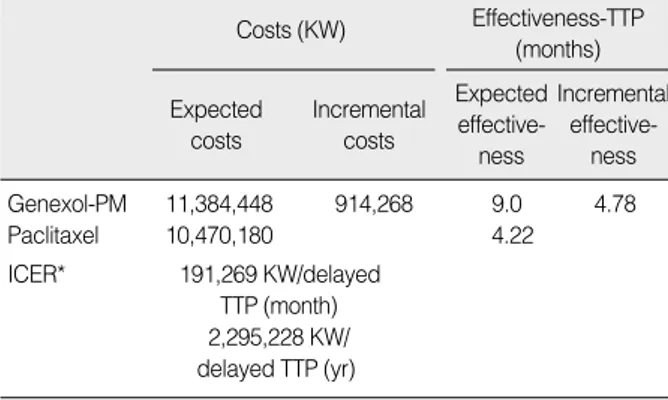
비용추정의 경우, 제넥솔-피엠의 약품비는 임상시험에서 한 주기당 평균 투여용량인 434.10 mg을 기준으로 산출하였다. 이 는 임상시험 시 1회 투여 평균량으로 임상시험에서 초회 권장용량 은 300 mg/m2으로 최대 2회까지 환자의 상태에 따라 감량이 가 능하여 1회 감량 시에는 240 mg/m2(240×1.7=408 mg), 2회 감량 시에는 190 mg/m2(240×1.7=323 mg)로 조정이 가능하 도록 하였다. 환자상태에 따라 조정되어 투여된 평균 투여량은 1인당 434.1 mg이었다. 그 결과 주기당 제넥솔-피엠의 비용은 1,897,408원으로 추정되었다. 또한 파클리탁셀의 경우는 체표면 적당 175 mg/m2을 투여하는 것을 기준으로 성인 1인의 체중 60 kg을 가정하여 1주기의 필요용량을 추정한 결과 297.50 mg으 로 산출되었으며 이에 소요되는 비용은 1,745,030원으로 추정되 었다(Table 2).
약제군별로 산출된 주기당 비용을 기준으로 6주기의 전체 약 제비를 산출한 결과 제넥솔-피엠은 11,384,448원으로, 파클리 탁셀은 10,470,180원으로 추정되었다. 두 약제 간의 점증적 비용 은 914,268원이었다. 이는 항암요법을 6주기를 진행하는데 제넥 솔-피엠을 투여할 경우 파클리탁셀을 투여할 때보다 약 91만 원 이 더 소요된다는 것이다.
임상문헌을 통해 추정된 각 약물군별 효과를 기준으로 추정된 점증적 비용효과비는 Table 3과 같다. 제넥솔-피엠의 점증적 비 용효과비는 질병진행까지의 시간 1개월당 191,269원으로, 1년에
2,295,228원으로 추정되었다. 즉, 이는 전이성 유방암 환자의 질 병진행까지의 시간을 1년을 연장하는데 제넥솔-피엠은 파클리탁 셀에 비해 약 230만 원의 비용이 더 소요된다는 것을 의미한다.
추가로 본 연구에서 이용된 모수값과 가정이 가지고 있는 불확 실성에 대한 검토를 위하여 민감도 분석을 실시하였다. 먼저 제넥 솔-피엠의 질병진행까지의 시간을 9.0개월에서±15% 변화를 허용하였을 때(즉, 제넥솔-피엠의 질병진행까지의 시간이 7.65- 10.35개월까지 변한다고 하였을 때) 제넥솔-피엠의 점증적 비 용효과비는 질병진행까지의 시간 1개월당 149,146-266,550원 (1년 기준; 1,789,752-3,198,600원)까지 변화하는 것으로 나타 났다. 마찬가지로 파클리탁셀의 효과인 질병진행까지의 시간 4.22 개월에±15%의 변화를 허용하였을 때 제넥솔-피엠의 점증적 비용효과비는 질병진행까지의 시간 1개월 연장에 대해 168,996- 220,838원(1년 기준: 2,027,952-2,650,056원)범위로 변화한 다. 파클리탁셀의 효과추정을 위한 논문의 포함기준을 175 mg/
m2이상으로 적용한 경우, 즉 Table 1의 18편의 논문을 모두 포함 하여 효과를 추정하여 민감도 분석을 실시하였다. 그 결과 파클리 탁셀의 질병진행까지의 시간은 4.81개월로, 점증적 비용효과비는 186,205-264,239원(1년 기준: 2,234,460-3,170,872원)범위 로 변화한다.
또한 한 환자당 평균항암요법 주기는 파클리탁셀 임상논문에 서 나온 최소값 4회에서 최대값 11회에 대해서 민감도 분석을 시 행한 결과 점증적 비용효과비는 질병진행까지의 시간 1개월 연장 에 대해 127,513-350,660원(1년 기준: 1,530,156-4,207,920 원)으로 분석되었다. 마지막으로 제넥솔-피엠 가격에 대해 상하 15%의 변화를 허용하였을 경우, 파클리탁셀의 시장점유율 가중 Table 2. Estimated drug costs
Genexol-PM Paclitaxel
Drug price 30 mg/Vial: 179,310 KW 30mg/Vial: 174,503 KW*
100 mg/Vial: 384,697 KW
Dosage/1 cycle 434.10 mg 297.5 mg�
(100 mg×4 vials+ (30 mg×10 vials) 30 mg×2 vials)
Drug price/1 cycle 1,897,408 KW 1,745,030 KW
No of cycles needed 6 cycle 6 cycle
Total costs 11,384,448 KW 10,470,180 KW KW=Korean Won.
*Average price of original and generic drugs weighted by its market share in 2005; �297.50 mg=175 mg/m2×1.7 m2.
Table 3. Cost-effectiveness analysis
Costs (KW) Effectiveness-TTP (months) Expected
costs
Incremental costs
Expected effective-
ness
Incremental effective-
ness
Genexol-PM 11,384,448 914,268 9.0 4.78
Paclitaxel 10,470,180 4.22
ICER* 191,269 KW/delayed TTP (month) 2,295,228 KW/
delayed TTP (yr) KW=Korean Won; TTP=time to progression.
*ICER (incremental cost-effectiveness ratio)
= COST (Genexol PM)-COST (Taxol)
EFFECTIV ENESS (TTPGenexol PM)-EFFECTIVENESS (TTPTaxol)
= Incremental costs
Incremental effectiveness
평균가격이 제넥솔-피엠의 92% 수준인 상태에서 제넥솔-피엠 가격에 15% 인하를 인정하면 오히려 제넥솔-피엠 가격이 파클리 탁셀 가격보다 낮아져서 파클리탁셀이 열등한 대안(dominated) 이 된다. 여기서 파클리탁셀이 열등대안이라는 것이 의미하는 바 는 기존 파클리탁셀에 비해 제넥솔-피엠을 사용함으로써 더 좋 은 효과도 기대하면서 동시에 비용도 절감될 수 있음을 의미한다.
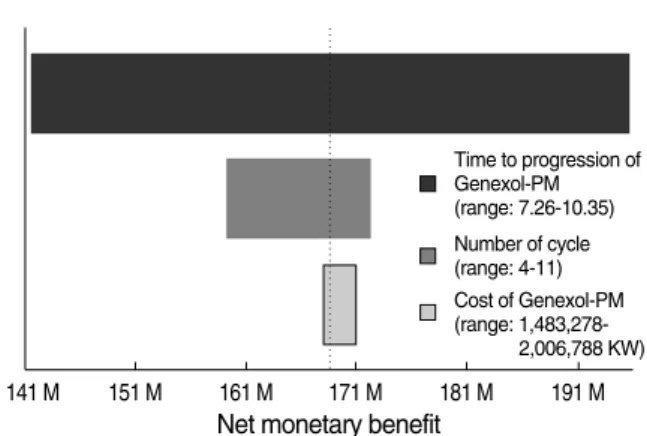
이상을 종합하여 본 결과(Table 4), 여러 모수값 중 제넥솔-피엠 과 파클리탁셀에서 질병진행까지의 시간 범위가 비용효과 분석 결과에 가장 큰 영향을 미치는 변수로 분석되었다. 이를 단변량 민감도 분석결과를 하나의 그래프에 모아 놓은 토네이도 다이어 그램(tornado diagram)으로 순편익(net monetary benefit) 을 나타내보았다(Figure 2). 순편익은 자원을 제넥솔-피엠이라 는 새로운 치료대안에 투자하였을 때 얻을 수 있는 편익으로 해석 할 수 있으나 이는 비용-효과성 임계값(threshold)의 함수로 순 편익을 해석할 때 반드시 고려되어야 한다. 본 분석에서는 2008 년 국민 1인당 GDP가 약 2,000만 원 수준으로 이를 이용하였다.
토네이도 다이어그램은 결과에 가장 큰 영향을 미치는 변수를 그 래프의 위쪽에, 나머지를 영향의 정도에 따라 그 아래로 배치하게 된다. 질병진행까지의 시간, 분석기간, 제넥솔-피엠의 가격에 대 해서 분석한 결과 비용효과성에 가장 영향을 많이 미치는 변수는 제넥솔-피엠의 효과인 질병진행까지의 시간으로 나타났으며 질 병진행까지의 시간(4-15개월)에 따라 사회적 순편익은 약 1억
4,200만 원-1억 9,600만 원으로 나타났다. 또한 제넥솔-피엠의 질병진행까지의 시간이 4.27개월 미만인 경우 더 이상 제넥솔- 피엠은 파클리탁셀에 비해 비용-효과적인 대안이 아닌 것으로 분석되었다.
고 찰
제넥솔-피엠은 기존 파클리탁셀에 포함된 가용화제인 크레모 퍼를 사용하지 않음으로써 그로 인한 독성 및 과민반응을 줄였으 며 크레모퍼가 파클리탁셀의 투여용량 175 mg/m2을 제한하는 단점을 개선하였다. 따라서 제넥솔-피엠은 투여용량을 최대 300 mg/m2까지 고용량 투여가 가능하도록 하여 항암효과를 향상시킨 주사제이다. 국내 전이성 유방암 환자를 대상으로 실시한 2상 임 상시험의 결과 58.5%의 반응률, 9개월의 질병진행까지의 시간이 나타났다.(5) 이러한 효과는 기존 파클리탁셀 제제보다 현저히 높 은 치료효과로 개량신약의 우수성을 인정받은 것이라 할 수 있다.
따라서 본 연구에서는 임상시험을 통해 밝혀진 제넥솔-피엠의 임상적 우수성에 기초하여 제넥솔-피엠의 효과와 비용을 분석하 였다. 그 결과 제넥솔-피엠의 점증적 비용효과비는 질병진행까지 의 시간을 1년 연장하는데 230만 원이 소요되는 것으로 분석되었 다. 현재 우리나라에서는 수명 1년 연장당 지불할 수 있는 임계값 에 대한 사회적 합의가 이루어져 있지 않아 본 연구의 분석결과에 기초하여 제넥솔-피엠이 비용효과적인 대안이라고 결론짓는 것에 는 한계가 있다. 하지만 본 연구의 결과에 기초할 때, 제넥솔-피엠 은 분명히 항암제 중에서 비용효과적인 대안으로써 검토가 가능 한 약물임을 확인하였다. 또한 탁센(Taxane)계 항암제가 국내 항암제 전체 시장의 약 20%를 차지하고 이 중 절반이 수입완제품 인 점을 고려하면 제넥솔-피엠은 기존 약물에 비해 우수한 항암 치료 방법을 제공함과 동시에 국산제제로서 높은 수입대체 효과 Table 4. Base-case estimates and ranges used in sensitivity
analysis
Base-case estimate (range)
Parameter Results of sensitivity
analysis Response rate (%)
Genexol-PM 58.5
Paclitaxel 28.4 Time to progression (months)
Genexol-PM 9.0 (7.65-10.35) Min: 149,146* (1,789,752�) Max: 266,550* (3,198,600�) Paclitaxel 4.22 (3.59-4.86) Min: 168,996* (2,027,952�) (175 mg/m2) Max: 220,838* (2,650,056�) Paclitaxel� 4.81 (4.09-5.54) 218,202* (2,618,424�) (≥175 mg/m2) Min: 186,205* (2,234,460�) Max: 264,239* (3,170,872�) Drug price/1 cycle (KW)
Genexol-PM 1,897,408 Min: dominated
(1,483,278-2,006,788) Max: 328,567* (3,942,804�) Paclitaxel 1,745,033
Cycle
Genexol-PM 6 cycles (4-11 cycle) Min: 127,513* (1,530,156�) Paclitaxel 6 cycles (4-11 cycle) Max: 350,660* (4,270,920�) KW=Korean Won; TTP=time to progression.
*KW/delayed TTP (mo); �KW/delayed TTP (yr); �Inclusion criteria above 175 mg/m2was applied.
Figure 2. Tornado diagram (cost-effectiveness threshold:
20,000,000 Korean Won).
M=Million Korean Won.
Net monetary benefit
Time to progression of Genexol-PM (range: 7.26-10.35) Number of cycle (range: 4-11) Cost of Genexol-PM (range: 1,483,278-
2,006,788 KW)
141 M 151 M 161 M 171 M 181 M 191 M
를 가져올 수 있음을 기대할 수 있다.
우리나라에서는 최근 새로운 치료법의 도입에 있어 효능과 안 전성뿐 아니라 효과와 비용을 고려하는 것이 현재 건강보험 약제 비 관리정책의 방향이다. 본 연구 역시 이러한 정책적 요구에 기초 하여 진행하였으나 아직 자료의 한계와 관련하여 몇몇 제한점을 갖는다. 본 연구에서 이용한 제넥솔-피엠의 효과는 국내에서 실 시된 제 2상 임상시험에 기초하여 추정하였다. 한국의 약물 경제 성 평가 가이드라인에서는 두 비교약물의 직접비교자료를 이용 하는 것을 권고하나 본 연구에서는 제넥솔-피엠과 파클리탁셀을 직접 비교한 논문이 부재하여 간접비교를 실시하였다는 한계가 있다. 또한 파클리탁셀의 효과 역시 7편의 임상문헌을 이용한 메 타분석을 통하여 추정한 한계가 있다. 메타분석의 경우 문헌 간의 이질성, 출판 편향이라는 제한점에 주의를 기울여야 한다. 이 연구 에서는 제넥솔-피엠의 2상 임상연구와 유사한 연구디자인을 가 진 연구들을 선별한 것으로 비교군이 없는 연구들로 통계적으로 이질성 검증(test for heterogeneity)을 시행하지는 못했지만, 반응률에서 동질적이라고 보기 어려운 경향이 나타났다. 따라서 본 연구에서의 결과해석에는 주의를 기울여야 한다. 또한 출판 편 향의 문제에서는 깔때기 그림(funnel plot)을 통해 살펴보았지만 포함된 연구의 수가 많지 않아 메타분석에서 깔때기 그림으로 출 판 편향에 대해 결론짓기는 어렵지만, 일정한 패턴을 보이지는 않 았다.
전이성 유방암환자들을 대상으로 하는 탁센계의 약물경제성분 석에 대한 선행연구(6-8)들을 검토하였다. 선행연구에서 비교약 제로 포함된 약물은 본 연구와 달리 결과를 비교하기는 적절하지 않았다. 방법론적으로 선행연구에서는 임상시험자료에 기초한 직접비교 혹은 본 연구에서와 유사한 간접비교방법을 적용하였으 며 본 연구와는 달리 장기간 동안 해당 약물의 경제성을 마콥모형 (Markov model)을 적용하여 분석한 차이점이 있었다. 하지만 본 연구에서 비교약제로 포함한 제넥솔-피엠의 효능을 측정한 임 상논문은 단기간 추적한 임상논문(5)이 유일한 자료라는 한계로 인하여 선행연구와는 달리 장기효과분석을 적용하지 못하였다.
따라서 향후 제넥솔-피엠에 대한 장기적인 유효성에 대한 추가 적인 임상연구가 이루어질 경우 생존자료를 이용하여 추정된 연장 된 수명(life-year gained) 혹은 질보정수명(quality-adjusted life years)을 설정하는 장기 분석의 시행이 필요하다.
본 연구는 제넥솔-피엠의 임상 유효성과 안전성에 대한 자료 가 제한적이기 때문에 경제성 평가분석의 방법론 적용에 한계가 있었지만 약물을 선택하는 과정에서 비용과 효과의 고려가 점점 필수적인 사항이 되고 있는 현 상황에서 제넥솔-피엠의 경제성 에 대한 정보를 제공하고자 수행되었다. 파클리탁셀에 대한 경제 성분석을 시행한 선행연구 검토결과, 제넥솔-피엠은 파클리탁셀
에 비해 전이성 유방암 환자의 질병진행까지의 시간을 1년 연장 하는데 소요되는 비용이 230만 원으로 분석되었다. 이는 한국에 서 전이성 유방암환자의 항암요법에서 제넥솔-피엠이 비용효과 적인 대안으로 검토가 가능한 약물이라고 판단할 수 있다는 근거 가 된다.
결 론
전이성 유방암 환자를 대상으로 항암제인 제넥솔-피엠과 파클 리탁셀을 보험자 관점에서 경제성 평가를 한 결과 제넥솔-피엠 이 비용효과적인 대안으로써 검토가 가능한 약물로 평가되었다.
참고문헌
1. Kim SW, Han W, Jeong J, Park HK, Noh WC, Lee ES, et al. The policy proposal for effective prevention and management of breast cancer. J Breast Cancer 2006;9:270-92.
2. SEER Cancer Statistics Review, 1975-2004. National Cancer Institute.
2007. http://seer.cancer. gov/csr/1975_2004. accessed September 24th, 2009.
3. 2005 Annual report of the central cancer registry in Korea. Seoul:
Ministry for Health Welfare and Family Affairs, Cancer Registry Center; 2008. p.20. http://www. cancer.go.kr/. accessed September 24th, 2009.
4. Park WC, You YK, Choi SH, Suh YJ, Oh SC, Cho WI, et al. Thera- peutic effects of paclitaxel (Taxol) in metastatic breast cancer. J Korean Surg Soc 1999;56:509-14.
5. Lee KS, Chung HC, Im SA, Park YH, Kim CS, Kim SB, et al. Multi- center phase II trial of Genexol-PM, a Cremophor-free, polymeric micelle formulation of paclitaxel, in patients with metastatic breast cancer. Breast Cancer Res Treat 2008;108:241-50.
6. Brown RE, Hutton J, Burrell A. Cost-effectiveness of treatment options in advanced breast cancer in the UK. PharmacoEconomics 2001;19:1091-102.
7. Launois R, Reboul-Marty J, Henry B, Bonneterre J. A cost-utility analysis of second-line chemotherapy in metastatic breast cancer.
Docetaxel versus paclitaxel versus vinorelbine. Pharmacoeconomics 1996;10:504-21.
8. Limwattananon S, Limwattananon C, Maoleekulpairoj S, Soparata- napaisal N. Cost-effectiveness analysis of sequential paclitaxel adjuvant chemotherapy for patients with node positive primary breast cancer.
J Med Assoc Thai 2006;89:690-8.
9. Holmes FA, Walters RS, Theriault RL, Forman AD, Newton LK, Raber MN, et al. Phase II trial of taxol, an active drug in the treatment of metastatic breast cancer. J Natl Cancer Inst 1991;83:1797-805.
10. Reichman BS, Seidman AD, Crown JPA, Heelon R, Hakes TB, Leb- wohl DE, et al. Paclitaxel and recombinant human granulocyte colony- stimulating factor as initial chemotherapy for metastatic breast cancer.
J Clin Oncol 1993;11:1943-51.
11. Davidson NG. Single-agent paclitaxel at first relapse following ad- juvant chemotherapy for breast cancer. Semin Oncol 1995;22:2-6.
12. Dieras V, Marty M, Tubiana N, Corette L, Morvan F, Serin D, et al.
Phase II randomized study of paclitaxel versus mitomycin in advanced breast cancer. Semin Oncol 1995;22:33-9.
13. Seidman AD, Tiersten A, Hudis C, Gollub M, Barrett S, Yao TJ, et al. Phase II trial of paclitaxel by 3-hour infusion as initial and salvage chemotherapy for metastatic breast cancer. J Clin Oncol 1995;13:
2575-81.
14. Davidson NG, Chick JB, Perren TJ, Campbell N, Thompson JM, Chan YT. A phase II study of single agent paclitaxel in patients at first relapse following initial chemotherapy for breast cancer. Clin Oncol 1996;8:358-62.
15. Fountzilas G, Athanassiades A, Giannakakis T, Bafaloukos D, Kara- kousis K, Dombros N, et al. A phase II study of paclitaxel in advanced breast cancer resistant to anthracyclines. Eur J Cancer 1996;32A:47-51.
16. Nabholtz JM, Gelmon K, Bontenbal M, Spielmann M, Catimel G, Conte P, et al. Multicenter, randomized comparative study of two doses of paclitaxel in patients with metastatic breast cancer. J Clin Oncol 1996;14:1858-67.
17. Hudis C, Riccio L, Holmes F, Seidman A, Baselga J, Currie V, et al.
Phase II study of semisynthetic paclitaxel in metastatic breast cancer.
Eur J Cancer 1997;33:2198-202.
18. Michael M, Bishop JF, Levi JA, Bell DR, Zalcberg JR, Friedlander ML, et al. Australian multicentre phase II trial of paclitaxel in women with metastatic breast cancer and prior chemotherapy. Med J Aust 1997;166:520-3.
19. Geyer CE Jr, Green SJ, Moinpour CM, O’Sullivan J, Goodwin DK, Canfield VA, et al. Expanded phase II trial of paclitaxel in metastatic breast cancer: a Southwest Oncology Group study. Breast Cancer Res Treat 1998;51:169-81.
20. Ito Y, Horikoshi N, Watanabe T, Sasaki Y, Tominaga T, Okawa T, et al. Phase II study of paclitaxel (BMS-181339) intravenously in- fused over 3 hours for advanced or metastatic breast cancer in Japan.
BMS-181339 Breast Cancer Study Group. Invest New Drugs 1998;
16:183-90.
21. Bishop J, Dewar J, Toner G, Smith J, Tattersall M, Olver I, et al.
Initial paclitaxel improves outcome compared with CMFP combi- nation chemotherapy as front-line therapy in untreated metastatic breast cancer. J Clin Oncol 1999;17:2355-64.
22. Gelmon K, Eisenhauer E, Bryce C, Tolcher A, Mayer L, Tomlinson E, et al. Randomized phase II study of high-dose paclitaxel with or without amifostine in patients with metastatic breast cancer. J Clin Oncol 1999;17:3038-47.
23. Paridaens R, Biganzoli L, Bruning P, Klijn JG, Gamucci T, Houston S, et al. Paclitaxel versus doxorubicin as first-line single-agent chemo- therapy for metastatic breast cancer: a European Organization for Research and Treatment of Cancer Randomized Study with cross- over. J Clin Oncol 2000;18:724-33.
24. Rivera E, Holmes FA, Frye D, Valero V, Theriault RL, Booser D, et al. Phase II study of paclitaxel in patients with metastatic breast carcinoma refractory to standard chemotherapy. Cancer 2000;89:
2195-201.
25. Chao TC, Chu Z, Tseng LM, Chiou TJ, Hsieh RK, Wang WS, et al.
Paclitaxel in a novel formulation containing less Cremophor EL as first-line therapy for advanced breast cancer: a phase II trial. Invest New Drugs 2005;23:171-7.
26. Liu F, Jiang ZF, Song ST, Liu XQ, Wang T, Yan M, et al. Relation of dose intensity and efficacy, toxicity in paclitaxel as a single agent for advanced breast cancer. Zhonghua Zhong Liu Za Zhi 2005;27:
56-8.