흡착제 및 흡착기술은 인류의 역사와 더불어 아주 오래전부터 사용되어져 왔다. 점토는 이미 기원전부터 건 조, 표백제, 페인트 운반체 및 다양한 의료 목적으로 사용되었고, 강모래는 물의 담수화를 위해서 사용되었다. 우 리들의 어머니들은 김치의 군내를 없애기 위해 참숯을 이용하였고, 성경책에서도 흡착 실험에 대한 설명을 찾을 수 있다. 1785년 독일 태생의 러시아제국 화학자 요한 토바이어스 로이츠(Johann Tobias Lowitz, 1757-1804년)는 숯(Charcoal)의 탈색 효과를 발견 한 뒤, 해독제로서의 적용 가능성을 보고하였고, 이를 설탕의 정제에 사용하기 도 하였다. 1881년 독일의 물리학자 하인리히 카이저(Heinrich Kayser, 1853-1940년)는 현대적 의미에서의 "흡착 (Adsorption)"이라는 단어를 처음 사용하였고, 활성탄의 아버지라 불리었던 폴란드 국적의 화학자 라파엘 폰 오 스트라이코(Raphael von Ostrejko, 1863년-미상)는 1900년부터 다수의 특허를 통해 흡착제 및 흡착기술에 대한 산업 적용의 길을 열었다.
최초로 흡착을 적용한 측정기기는 그 유명한 레오나르도 다 빈치(Leonardo da Vinci, 1452-1519년)등이 고안한 습구 온도계이며, 흡착에 대한 체계적인 연구는 스웨덴의 화학자 칼 빌헬름 셸레(Carl Wilhelm Scheele, 1742- 1786년)가 부피법(volumetric method)을 이용하여 목탄에서의 공기 흡착 관찰에 성공한 1773년부터 시작되었다.
1912년 미세화학(microchemistry)의 창시자라고 불리 우는 오스트리아의 화학자 프리드리히 에미히(Friedrich Emich, 1860–1940년)는 미세전자저울을 이용한 중량법(gravimetric method)으로 흡착량을 측정할 수 있는 매 우 정밀한 기기를 개발하였고, 19세기말 Mitscherlich, Chappuis 및 Kayser는 흡착평형 등온선(adsorption equilibrium isotherms)을 이용하여 흡착량을 나타내는 방법을 제시하였다. 1938년 Brunauer, Emmett 및 Teller 는 부피법을 이용하여 기공 크기, 분포 및 표면적을 비교적 정확히 평가 할 수 있는 획기적인 방법을 제시하였고, 우리가 흔히 BET라 부르는 흡착장비의 프로토타입(prototype)을 고안하였다. 이는 오늘날까지도 가장 널리 쓰이 고 있는 미세기공 측정 장치가 되었다.
이후, 흡착기술의 눈부신 발달로 습윤 공기 건조(air drying), 정수 (water purification), 수소 분리 (수소 PSA), 공기로부터 산소 또는 질소 생성 (PSA 혹은 VSA), 악취 제거, VOC(Volatile Organic Compounds)류 제거, 탄화 수소 분리 등 열역학적으로는 분리가 어려운 여러 난제들에 대한 상업적 적용이 가능해졌고, 가장 최근에는 이산 화탄소 포집용 흡착제, 흡수제 및 공정 개발에도 큰 성과를 거두었다. 다만, 상용 공정 적용이 가능한 흡착제는 여
특 별 기 획
Sorbents (흡착제 및 흡수제), 그 한계를 넘어서
문종호 충북대학교 화학공학과 moonjongho@chungbuk.ac.kr
특 별 기 획 ( I )
1. 서론
지속적으로 증가하는 온실가스들에 의한 지구온 난화(Global warming)는 이 시대에 해결해야 할 매우 시급한 문제 중 하나이다[1]. 메탄은 온난화지수가 이산화탄소의 21 배로 적은 배출양에도 온난화 기여 도가 높으나 기존 화석연료에 비해 값이 싸고 연소 시 부산물을 적게 생산하여 청정에너지로 각광받고 있다[2].
메탄은 천연가스의 주성분이지만, 많은 천연가 스전들이 분리가 어려운 질소를 다량으로 함유하고 있어서 이에 대한 효율적인 분리기술이 요구되고 있다. 그러나, CH4으로부터 N2를 분리하는 것은 두 기체의 유사한 kinetic diameters (CH4: 3.8 Å, N2: 3.6 Å)와 polarizability (CH4: 26.0ⅹ10-25 cm3, N2: 17.6ⅹ 10-25 cm3)[3]에 따른 유사한 물리·화학적 특성 때문 에 매우 어려운 기술이다. 따라서, 현재까지 메탄으 로부터 질소의 제거는 에너지 집약적인 극저온 증
류에 의해서만 가능하고, 경제성 문제로 인해 현재 많은 저급 천연가스전들이 개발되지 못하고 있다.
뿐만 아니라, 메탄은 철강, 석유화학 공정 과정의 부생가스들에도 다량으로 포함되어 있지만, 경제성 있는 분리기술이 개발되지 않아 현재까지는 공기 중으로 방류되거나 저부가가치의 발전용으로만 주 로 사용되고 있는 실정이다. 따라서, 저급 천연가스 및 산업 부생가스로부터 고순도의 CH4을 회수하여 고부가 가치 화학원료 및 신재생에너지로 이용하기 위해서는 효율적인 N2/CH4 분리 기술이 절실히 필 요하다.
따라서, 에너지 절약적인 흡착에 의한 N2/CH4
혼합물 분리가 많은 관심을 받고 있지만, 현재까지 는 효율적인 흡착제가 개발되지 못하여서 많은 연 구가 필요한 상황이다. 유무기 복합다공체(Metal- organic framework, MOF)는 전이 금속 클러스터 노 드와 이를 연결하는 유기 리간드로 구성된 새로운
유무기 복합다공체 기반 N
2/CH
4분리용 흡착제
김태훈, 배윤상*
연세대학교 화공생명공학과 mowbae@yonsei.ac.kr 전히 활성탄, 활성 알루미나, 실리카겔 및 알루미노 실리케이트 단 4종류에 머무르고 있다는 문제도 있다. 흡착제 및 흡착공정 연구의 활로를 찾기 위해서는 새로운 소재 및 공정, 그리고 새로운 적용처의 발굴이 시급하다.
이에 NICE지에서는 2회에 거쳐 “Sorbents (흡착제 및 흡수제), 그 한계를 넘어서”라는 주제로 비교적 젊은(?) 흡착 연구자들의 특별 기고문을 모아 내보내고자 한다. 첫 번째 특별기고에서는 연세대학교의 배윤상 교수님께서 N2/CH4 분리용 흡착제, 한국에너지기술연구원의 김현욱 박사님께서 CO2/CO 분리용 흡착제, 한국에너지기술연구 원의 조강희 박사님과 인하대학교의 조창범 교수님께서 CO 및 올레핀 선택성 흡착제에 대해 집필하여 주셨다.
※ 다음 편에는 한국에너지기술연구원의 윤형철 박사님과 충남대학교의 이광복 교수님께서 암모니아 흡착제, 경북대 학교의 이수출 교수님께서 탈황 흡착제, 고려대학교의 이기봉 교수님께서 탈질 흡착제, 강릉원주대학교의 김경민 교수님께서 난분리성 액상물질 분리를 위한 SMB (simulated moving bed) 공정에 대한 특별기고글을 게재한다.
특 별 기 획 ( I )
형태의 다공성 재료이며, 높은 비표면적, 구조적 안 정성, 다양한 기공크기 및 표면성질 등의 매력적인 성질로 인해 유망한 차세대 흡착제로 간주되고 있 다[4-6].
2. N2/CH4 분리용 흡착제 개발 동향
N2/CH4 분리용 흡착제 개발은 매우 중요한 이 슈임에도 워낙 도전적인 과제이기 때문에 현재까 지 이에 대한 연구 결과는 상대적으로 많이 보고되 어 있지 않다. 2000년대 초반에 미국의 Engelhard 사에 의해 N2/CH4를 속도론적으로 분리할 수 있는 Titanosilicate 기반의 ETS-4 흡착제가 개발되었지만, 낮은 흡착량과 재생성 등의 문제로 상용화되지 못하 였다[7, 8]. 최근에는 미국, 한국, 중국, 독일을 중심 으로 MOF를 기반으로 한 N2/CH4 분리용 흡착제 개 발 연구가 보고되고 있기는 하지만, 아직 기초 연구 단계이다[9-12].
저급 천연가스 및 산업 부생가스로부터 메탄을 회수하여 고부가가치의 자원으로 사용하기 위해서 는 상대적으로 적은 양으로 존재하는 질소를 제거하 기 위한 질소 선택적인 흡착제의 개발이 보다 선호 되어진다. 그러나, 질소/메탄 선택적인 흡착제의 개 발이 매우 도전적이기 때문에, 메탄/질소 선택적인 흡착제의 개발에 대한 연구도 함께 진행되고 있다.
3. N2/CH4 분리용 흡착제 개발 전략
첫 번째 전략은 N2가 CH4에 비해 약간 작은 크기
를 가지기 때문에, 기공 입구의 크기가 적절한 흡착 제를 개발하여 N2와 CH4을 속도론적 혹은 분자체적 으로 분리해내는 것이다. 한 가지 예가 2001년에 미 국의 Engelhard 사에 의해 개발된 Titanosilicate 기반 의 ETS-4 흡착제인데, 높은 속도론적 N2/CH4 선택 도를 보였지만, 낮은 질소 흡착량, 주기적인 열재생 의 필요성 등의 문제를 보였다[7, 8]. 이러한 단점은 근본적으로 속도론적인 흡착제의 한계로부터 비롯 되기 때문에, 열역학적 평형 분리 메커니즘을 이용 한 흡착제 개발이 보다 선호된다.
두 번째 전략은 N2에 대한 특별한 인력을 가지 는 전이금속을 활용해 열역학적인 N2/CH4 선택도를 가지는 흡착제를 개발하는 것이다. 2014년에 미국 University of California, Berkeley의 연구진에서는 양 자역학적 시뮬레이션 접근 방법을 통해서 불포화 V2+
싸이트를 가지는 V-MOF-74가 열역학적인 N2/CH4
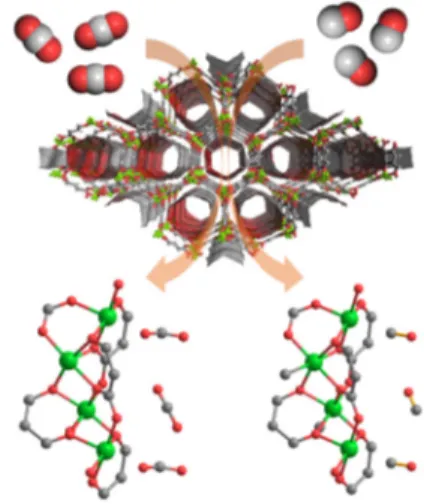
선택도를 보일 수 있다고 제시하였지만, 이 MOF는 공기중에서 매우 불안정한 구조이기 때문에 실제 합 성된 구조는 보고된 바 없다[13]. 2016년에 한국화 학연구원과 연세대학교의 연구진들이 실험과 계산 을 통해 불포화 Cr3+ 싸이트를 가지는 MIL-100(Cr)이 N2/CH4 선택도를 보임을 확인하였다[14]. 이는 실험 적으로 최초로 보고된 열역학적 N2/CH4 선택도를 가 지는 흡착제로서, 큰 N2 흡착량과 높은 N2/CH4 선택 도를 보였으며, 열처리 없이도 실온에서도 쉽게 재 생이 되는 우수한 특성을 보였다(그림 1).
세 번째 전략은 높은 열역학적 CH4/N2 선택도를
그림 1. (a) Cr3+ 기반 MOF 구조, (b) 283K에서 N2 및 CH4 흡착등온선[14].
특 별 기 획 ( I )
가지는 흡착제를 개발하는 것이다. 기본적으로 CH4
이 N2에 비해 높은 polarizability를 가지기 때문에, 대 부분의 흡착제들은 2-3 정도의 낮은 CH4/N2 선택도 를 가진다. 그러나, 적절한 크기를 가지는 기공의 내 부 표면과 기체 사이의 상호작용을 늘리는 개질 방 법을 이용하면, 두 기체의 작은 polarizability의 차이 를 극대화하여 메탄 선택성을 최대화시킬 수 있고, 이로부터 효율적인 CH4/N2 선택적 흡착제를 개발할 수 있다. 한 가지 예로서 2020년에 연세대학교의 연 구진에서 안정성이 뛰어난 지르코늄 기반의 UiO-66 내부에 polarizability가 높은 브롬 작용기를 도입하여 흡착제 표면과 기체사이의 상호작용을 증가시키는 전략을 사용하여 높은 CH4/N2 선택도를 보일 수 있 음을 보고한 것이다[15]. 이 흡착제는 PSA 공정 운전 조건에서 높은 운전용량을 가질 뿐 아니라 열처리 없이 상온 조건에서도 쉽게 재생이 되는 우수한 특 성을 보였다(그림 2).
4. 맺음말
효율적인 N2/CH4 혼합물 분리용 흡착제의 개발이 절실히 요구되고 있지만, 이를 위한 연구는 현재까 지 미흡한 실정이다. 저급 천연가스나 산업 부생가 스로부터 메탄을 효율적으로 회수해줄 수 있는 흡착 제가 개발된다면 그 파급 효과는 매우 클 것으로 기 대되기에, 이에 대한 정부 차원에서의 지원과 연구 자들의 노력이 필요해 보인다.
참고문헌
[1] D.A. Lashof, D.R. Ahuja, "Relative contributions of greenhouse gas emissions to global warming", Nature, 344, 529-531 (1990).
[2] C.Ö. Karacan, F.A. Ruiz, M. Cotè, S. Phipps, "Coal mine methane: a review of capture and utilization practices with benefits to mining safety and to greenhouse gas reduction", Int. J. Coal Geol., 86, 121- 156 (2011).
[3] R.T. Yang, Adsorbents: Fundamentals and Applications, John Wiley & Sons Inc, Hoboken, New Jersey (2003).
[4] G. Férey, "Hybrid porous solids: past, present, future", Chem. Soc. Rev., 37, 191-214 (2008).
[5] J.-R. Li, R.J. Kuppler, H.-C. Zhou, "Selective gas adsorption and separation in metal–organic frameworks", Chem. Soc. Rev., 38, 1477-1504 (2009).
[6] H. Furukawa, K.E. Cordova, M. O’Keeffe, O.M. Yaghi,
"The chemistry and applications of metal-organic frameworks", Science, 341, (2013).
[7] S.M. Kuznicki, V.A. Bell, S. Nair, H.W. Hillhouse, R.M.
Jacubinas, C.M. Braunbarth, B.H. Toby, M. Tsapatsis,
"A titanosilicate molecular sieve with adjustable pores for size-selective adsorption of molecules", Nature, 412, 720-724 (2001).
[8] B. Majumdar, S. Bhadra, R. Marathe, S. Farooq,
"Adsorption and diffusion of methane and nitrogen in barium exchanged ETS-4", Ind. Eng. Chem. Res., 50, 3021-3034 (2011).
[9] J. Möllmer, M. Lange, A. Möller, C. Patzschke, K. Stein, D. Lässig, J. Lincke, R. Gläser, H. Krautscheid, R.
Staudt, "Pure and mixed gas adsorption of CH 4 and N 2 on the metal–organic framework Basolite®A100 and a novel copper-based 1, 2, 4-triazolyl isophthalate MOF", J. Mater. Chem., 22, 10274-10286 (2012).
[10] X.-W. Liu, Y. Guo, A. Tao, M. Fischer, T.-J. Sun, P.Z. Moghadam, D. Fairen-Jimenez, S.-D. Wang, 그림 2. (a) Br 작용기가 도입된 MOF 구조, (b) UiO-66-Br2 펠렛 충전탑에 대한 3 cycle 동안의 CH4/N2 혼합물 파과 곡선[15].
특 별 기 획 ( II )
"“Explosive”synthesis of metal-formate frameworks for methane capture: an experimental and computational study", Chem. Commun., 53, 11437- 11440 (2017).
[11] X.-W. Liu, Y.-M. Gu, T.-J. Sun, Y. Guo, X.-L. Wei, S.-S.
Zhao, S.-D. Wang, "Water resistant and flexible MOF materials for highly efficient separation of methane from nitrogen", Ind. Eng. Chem. Res., 58, 20392- 20400 (2019).
[12] Z. Niu, X. Cui, T. Pham, P.C. Lan, H. Xing, K.A.
Forrest, L. Wojtas, B. Space, S. Ma, "A Metal–Organic Framework Based Methane Nano‐trap for the Capture of Coal‐Mine Methane", Angew. Chem.-Int. Edit., 58, 10138-10141 (2019).
[13] K. Lee, W.C. Isley III, A.L. Dzubak, P. Verma, S.J.
Stoneburner, L.-C. Lin, J.D. Howe, E.D. Bloch, D.A. Reed, M.R. Hudson, "Design of a metal–
organic framework with enhanced back bonding for separation of N2 and CH4", J. Am. Chem. Soc., 136, 698-704 (2014).
[14] J.W. Yoon, H. Chang, S.-J. Lee, Y.K. Hwang, D.-Y.
Hong, S.-K. Lee, J.S. Lee, S. Jang, T.-U. Yoon, K.
Kwac, "Selective nitrogen capture by porous hybrid materials containing accessible transition metal ion sites", Nat. Mater., 16, 526-531 (2017).
[15] T.-H. Kim, S.-Y. Kim, T.-U. Yoon, M.-B. Kim, W. Park, H.H. Han, C.-i. Kong, C.-Y. Park, J.-H. Kim, Y.-S. Bae,
"Improved methane/nitrogen separation properties of zirconium-based metal-organic framework by incorporating highly polarizable bromine atoms", Chem. Eng. J., 399, 125717 (2020).
감사의 글
이 논문은 2020년도 정부(과학기술정보통신 부)의 재원으로 한국연구재단-기후변화대응기 술개발사업의 지원을 받아 수행된 연구임(No.
2017M1A2A2043449).
다양한 금속 루이스 산점을 가진 금속-유기 구조체를 이용한 CO
2/CO 분리
김현욱*
한국에너지기술연구원 에너지소재연구실 hyunuk@kier.re.kr
1. 서론
CO2/CO 분리 및 회수는 온실 가스 배출을 줄이 는 것 뿐만 아니라 다양한 정유 공정에서 고부가가 치 화학 물질을 합성하는 데에도 중요한 역할을 한 다. [1-4] 수소와 일산화탄소를 반응시켜 액체 탄화 수소연료를 만드는 Fischer-Tropsch 공정에서 잔류 기체로 나오는 CO2 및 CO의 선택적 분리 및 재활용 은 합성 효율을 높일 수 있는 필수적인 공정이다.[5- 7] 기존에는 제올라이트를 이용한 압력 스윙 흡착기 술이 CO2/CO 포집에 사용되었다.[8-9] 또한, 제철소 의 배가스에 포함된 CO2 및 CO를 분리 및 포집하면 철광석의 환원제로 사용되는 코크스 사용을 줄이고 대기 중으로 방출되는 온실가스를 줄일 수 있다.[10-
12] 미국항공우주국 NASA는 화성의 대기 중에 풍부 한 CO2를 고체 산화물 연료전지를 사용하여 O2로 변 환하는 연구를 진행하고 있다. 이때 O2와 더불어 생 성되는 CO를 선택적으로 포집하여 제거해야 순수한 O2를 얻을 수 있기 때문에 관련 연구가 활발히 진행 되고 있다.[13] 현재까지 많은 흡착공정에서 CO2/CO 분리는 기체의 유사한 특성으로 인해 완벽한 분리가 어려워 새로운 흡착소재의 개발이 필요하다.
금속-유기 구조체 (MOFs)는 금속이온과 유기 리 간드가 배위 결합을 통해 자기 조립 하여 형성된 3 차원적으로 무한히 연결된 다공성 결정 구조체이다.
금속 및 유기 분자들을 이용하여 다공성 결정물질을 만드는 경우, 구조 및 성질을 예측하여 디자인 하는
특 별 기 획 ( II )
것이 가능하고, 결정 물질 내 빈 공간의 크기, 구조, 성질 등을 자유자재로 조절할 수 있다. MOFs는 기체 저장과 분리, 촉매 등의 분야에서 높은 응용 가능성 을 보였는데 최근에는 다양한 열린 금속자리를 이용 한 특정 기체 분리 연구가 활발히 진행되고 있다.
2. 기술개발 동향
2.1 금속 루이스 산점을 가진 MOFs의 CO2/CO 분리 성능
열린 금속자리를 가지고 있는 [M2(DOBDC)]
(MOF-74)는 금속의 종류에 따라서 흥미로운 CO2
및 CO 흡착 특성을 보여준다. 그림 2 (a)와 (b)의 CO2
및 CO 흡착 등온선을 보면 금속 루이스 산점을 가진 MOF-74(Mg, Co, Ni)는 금속의 종류에 따라서 상이 한 CO2와 CO 친화성을 나타낸다. CO2에 대한 흡착
그림 1. 금속-유기 구조체를 이용한 CO2/CO 분리.
그림 2. (a) CO2 및 (b) CO 흡착 (열린 심볼) 및 탈착 (닫힌 심볼) 등온선, Mg-MOF-74 (파란색), Co-MOF-74 (검은 색) 및 Ni-MOF-74 (갈색), (c) 323K에서 CO2/CO의 파과 데이터 (Mg-MOF-74(상단), Co-MOF-74(중간) 및 Ni-MOF-74(하단), CO2 (갈색), CO (파란색)).
특 별 기 획 ( II )
친화력은 Mg2+에서 가장 높고 Ni2+, Co2+ 순서 이고 CO에 대한 친화성은 Ni2+와 Co2+가 높고 Mg2+이 아주 낮다. 이러한 흡착 친화성은 비리얼 방정식으로 계 산한 CO2와 CO의 흡착엔탈피 순서와도 일치하였다.
CO2의 흡착에탈피는 44.0(Mg), 39.8(Ni), 35.0(Co) kJ/
mol로 얻어지며 CO의 흡착에탈피에서는 59.7(Ni), 55.5(Co) 38.3(Mg) kJ/mol로 계산된다.
그림 2(c)에 나타낸 CO2/CO 혼합가스의 파과 실험 결과 Mg-MOF-74는 CO2에 대한 친화도가 크기 때 문에 CO보다 CO2에 대해 더 긴 파과 시간을 보인 반 면, Co-MOF-74와 Ni-MOF-74는 CO에 대한 친화 성이 크기 때문에 CO2보다 CO에 대해 더 긴 파과 시 간을 보였다. 따라서, 어떤 금속 루이스 산점을 가진 MOF를 사용하는지에 따라서 CO2/CO의 분리 성능 을 조절할 수 있다.[14]
2.2 CO2/CO 분리 메커니즘 규명
CO2 및 CO의 흡착 및 분리 메커니즘을 원자수준 에서 규명하는 것은 대단히 어렵다. 대부분의 연구 결과가 흡착등온선과 흡착엔탈피 계산을 통해서 분 리 메커니즘을 설명하고 있다. CO2 및 CO의 흡착이 일어나는 금속 루이스 산점의 역할을 원자수준에서 규명하기 위해서는 엑스선 회절 실험을 하는 것이 가장 효과적인 방법이다. 그러나 많은 경우 기체의 흡착 위치를 엑스선 회절법으로 규명하는 것은 제한 적이다. 한국에너지기술연구원 김현욱 박사 연구팀 은 포항가속기연구소 2D 빔라인의 고출력 엑스선 회 절 실험을 통해서 다양한 금속 루이스 산점에 결합 된 CO2 및 CO 흡착 위치를 원자수준에서 체계적으 로 규명하는데 성공하였다. 그 결과 Mg2+에 결합된 CO2의 결합거리가 Co2+,Ni2+에 결합된 CO2와의 결합 거리보다 월등히 짧다는 것을 확인할 수 있었다. 이 는 Mg-MOF-74가 다른 금속보다 강한 루이스 산점 으로 작용하여 CO2에 대한 친화성이 높기 때문에 나 타나는 현상이다. Co-MOF-74와 Ni-MOF-74의 전 이금속은 CO와의 결합거리가 짧게 측정되었는데 이 는 전이금속과 CO가 강한 파이 역결합을 형성하기
때문이다. 따라서, Co,Ni-MOF는 CO와의 강한 결 합력을 바탕으로 CO에 대해 높은 친화성이 보인다.
[14]
3. 맺음말
CO2/CO의 선택적인 흡착 및 분리는 산업적으로 여러 분리공정에 효과적으로 활용될 수 있다. 이러 한 분리 공정에서 핵심이 되는 것은 고효율 흡착제 를 개발하는 것이며 MOF는 높은 표면적과 금속 루 이스 산점에 기반한 독특한 흡착 특성으로 인해 큰 관심을 받고 있다. 현재까지 MOF는 대량 합성의 어 려움과 비싼 가격으로 인해 제한적으로 응용되고 있 지만 세계적으로 여러 스타트업 기업들이 속속 상용 화에 나서고 있어 앞으로는 적용범위가 더욱 확대될 것으로 기대된다.
참고문헌
1. R. Stuart Haszeldine, “Carbon Capture and Storage:
How Green Can Black Be?” Science, 325, 1647–1652 (2017)
2. Kenji Sumida, David L. Rogow, Jarad A. Mason, Thomas M. McDonald, Eric D. Bloch, Zoey R. Herm, Tae-Hyun Bae, Jeffrey R. Long, “Carbon Dioxide Capture in Metal–Organic Frameworks”, Chem. Rev.
112, 724–781 (2012).
3. Jian-Rong Li, Ryan J. Kuppler, Hong-Cai Zhou
“Selective Gas Adsorption and Separation in Metal–
그림 3. Mg-MOF-74의 CO2 및 CO 흡착 결정 구조.
특 별 기 획 ( III )
Organic Frameworks”, Chem. Soc. Rev. 38, 1477–1504 (2009).
4. Arwyn Evans, Ryan Luebke, Camille Petit “The Use of Metal-Organic Frameworks for CO Purification”, J.
Mater. Chem. A, 6, 10570-10594 (2018).
5. J. Perez-Carbajo, P. Gómez-Álvarez, R. Bueno- Perez, P. J. Merkling, S. Calero, “Optimisation of the Fischer–Tropsch Process Using Zeolites for Tail Gas Separation”, Phys. Chem. Chem. Phys. 16, 5678–5688 (2014).
6. Haiqing Lin, Zhenjie He, Zhen Sun, Jimmy Vu, Alvin Ng, Moyeen Mohammed, Jay Kniep, Timothy C.
Merkel, Tony Wu, Robert C. Lambrecht “CO2-Selective Membranes for Hydrogen Production and CO2 Capture–
Part I: Membrane Development”, J. Membr. Sci. 457, 149–161 (2015).
7. D. Korelskiy, M. Grahn, P. Ye, M. Zhou, J. Hedlund, “A Study of CO2/CO Separation by Sub-micron b-Oriented MFI Membranes” RSC Adv. 6, 65475–65482 (2016).
8. Hideki Miyajima, Akio Kodama, Motonobu Goto, Tsutomy Hirose, “Improved Purge Step in Pressure Swing Adsorption for CO Purification”, Adsorption 11, 625–630 (2005).
9. Yan Zhou, Yuanhui Shen, Qiang Fu, Donghui Zhang,
“CO Enrichment from Low-Concentration Syngas by a Layered-Bed VPSA Process.” Ind. Eng. Chem. Res. 56, 6741−6754 (2017).
10. S. A. Sapchenko, D. N. Dybtsev, D. G. Samsonenko, R. V. Belosludov, V. R. Belosludov, Y. Kawazoe, M.
Schröder, V. P. Fedin, “Selective Gas Adsorption in Microporous Metal–Organic Frameworks Incorporating Urotropine Basic Sites: an Experimental and Theoretical Study”, Chem. Commun. 51, 13918–
13921 (2015).
11. Hyunuk Kim, Yonghwi Kim, Minyoung Yoon, Soyoung Lim, Se Min Park, Gon Seo, Kimoon Kim, “Highly Selective Carbon Dioxide Sorption in an Organic Molecular Porous Material”, J. Am. Chem. Soc. 132, 12200–12202 (2010).
12. Nguyen Hong Duc, Fabien Chauvy, Jean-Michel Herri
“CO2 Capture by Hydrate Crystallization–A Potential Solution for Gas Emission of Steel Making Industry”, Energy Convers. Manage. 48, 1313–1322 (2007).
13. K. R. Sridhar, J. E. Finn, M. H. Kliss, In-Situ Resource Utilization Technologies for Mars Life Support Systems. Adv. Space Res. 25, 249–255 (2000).
14. Hyunuk Kim, Muhammad Sohail, Kanghoon Yim, Young Cheol Park, Dong Hyuk Chun, Hak Joo Kim, Seong Ok Han, Jong-Ho Moon, “Effective CO2 and CO Separation Using [M2(DOBDC)] (M = Mg, Co, Ni) with Unsaturated Metal Sites and Excavation of Their Adsorption Sites” ACS Appl. Mater. Interfaces 11, 7014−7021 (2019).
감사의 글
이 논문은 한국에너지기술연구원의 주요사업 (C0-2428)으로 수행한 결과입니다.
p -착화합결합 흡착제
조강희1,*, 조창범2,*
1한국에너지기술연구원 청정연료연구실, 2인하대학교 화학과 chokanghee@kier.re.kr, jochangbum@inha.ac.kr
1. 서론
흡착, 분리 분야에서 일반적으로 사용되고 있는 대다수의 흡착제는 흡착제와 흡착질 사이의 Van der Waals의 힘, 즉 상대적으로 결합 세기가 약한 물리적 인 정전기력을 기반으로 한 흡착제 들이다 [1-3]. 반 면, 화학적 결합의 경우 앞 서 언급한 Van der Waals 인력보다 더 강한 인력을 보이고 있어 특정 성분에 대한 높은 선택도를 보이고 물리적인 인력을 기반으
로 한 다른 흡착제에 비해 탈착, 재생이 덜 용이하지 만 공학적 수단으로 해결할 수 있기 때문에 이 화학 적 결합을 기반으로 한 흡착제를 흡착, 분리 공정에 활용될 수 있다는 사실이 1987 King에 의해 제안되면 서 현재까지 중요한 흡착제의 한 분류가 되고 있다 [4]. 화학적 결합에도 여러 종류가 있지만 그 중 흡착 제 분야에서 가장 많이 활용되고 있는 결합은 이번 장에서 소개할 π-착화합결합이다. π-결합은 흡착제
특 별 기 획 ( III )
와 흡착질을 구성하는 원자 성분의 π-오비탈 사이의 인력을 말하며 주로 d-오비탈을 갖고 있는 Ag, Cu 등의 d-block 전이금속 27 종이 이에 해당된다. 이러 한 금속이나 이온은 흡착질 분자와 상호작용을 하게 될 때에 s-오비탈과 σ-결합을 형성할 수 있으며 동 시에 반결합 π-오비탈(anti-bonding π-orbital)에 전 자를 되돌려 줌(π-back bonding)으로써 더욱 안정된 결합을 형성할 수 있어 π-착화합결합을 기반한 흡착 제에 주 성분으로 사용된다. 흡착질과 흡착제 간의 결합세기는 흡착제 표면에 있는 양이온의 최외각 s- 오비탈의 비어있는 정도, 흡착질 분자에 있는 π전자 의 양과 이러한 π전자를 양이온의 s-오비탈에 제공 해 주는 정도, 양이온의 d-오비탈 전자의 양과 이러 한 d-오비탈 전자를 흡착질 분자에 얼마나 쉽기 제 공해줄 수 있는가의 정도에 의해 결정 된다. 이 결합 세기가 특정 강흡착 성분에 대한 흡착 용량과 선택 도를 결정하게 된다. 앞 서 언급한 것과 같이 π-착 화합결합 흡착제의 가장 큰 장점은 특정 성분에 대 한 높은 선택도 이며, 그동안 일산화탄소(CO, carbon monoxide) 분리(또는 제거) 공정, 올레핀/파라핀 분 리 공정, 방향족, 지방족 분리 공정 등 다양한 산업 분야에서 활용되어 왔다.
대부분의 π-착화합결합 흡착제는 알루미나, 실 리카겔, TiO2, 활성탄, 여러 제올라이트 등 비표면적 이 넓고, 가격이 싸며 성형하기 쉬운 상용 지지체에 전이금속염을 고분산시켜 제조 해 왔다. 다른 물리 흡착제들도 마찬가지이겠지만 이 흡착제의 경우 특 히 흡착 용량과 선택도를 결정짓는데 표면에 노출되 어 있는 π-착화합결합을 갖는 전이금속 성분의 양 이 중요하기 때문에, 비표면적이 큰 지지체를 선별 하고 전이금속염을 얼마나 고분산 시켜 함침할 수 있는 방법을 찾는 것이 중요했다. 1946년 Russel과 Stokes가 γ-알루미나에 MoO3 의 단일층 분산을 성 공하면서 그 가능성을 처음 보였고, 1990년대에 들 어선 Xie와 Tang이 알루미나나 제올라이트에 CuCl 를 단일층으로 고분산 시킨 흡착제 합성에 성공하고 이 흡착제가 일산화탄소 선택적 흡착에 매우 우수
한 성능을 보인다는 것을 발표하였으며 [5], 그 외에 서 효과적으로 전이금속염을 비표면적이 큰 지지체 에 분산시킬 수 있는 다양한 방법들이 개발 되었다.
물이나 에탄올 등 유기 용매에 쉽게 녹는 전이금속 염은 이 용매들에 용해시킨 후 지지체와 잘 혼합하 고 용매만 증발시켜 전이금속 염만 지지체 내 기공 에 남기는 습윤 함침법(incipient wetness impregnation method)을 통해 쉽게 담지시킬 수 있다. 어떤 용매에 도 잘 녹지 않은 전이금속염(대표적인 예로 CuCl)의 경우 지지체와 혼합한 후 그 혼합물을 전이금속염의 Tamman 온도(결정 격자가 유동을 보이기 시작하는 온도로 대략 절대온도 기준 융점의 절반정도 됨)와 융점 사이의 특정 온도로 가열하여 전이금속염이 지 지체의 기공 내로 주입(infusion)하는 가열 단층 분산 법(thermal monolayer dispersion method)를 통해 담지 시킬 수 있다. 또한 제올라이트와 같이 양이온 교환 점이 있는 지지체에 전이금속 염 내 금속 양이온만 이온 교환하여 담지시키는 방법도 많이 사용된다.
1900년대 중반 유기물질과 금속 이온으로 조립 된 결정성 다공 물질인 금속-유기 구조체(Metal- Organic Framework, MOF)가 처음 발견된 이후 많은 연구가 진행되면서 구조 및 성분이 다른 다양한 금 속-유기 구조체가 개발되어 왔다. 특히, 금속-유기 구조체는 많은 양의 금속 이온을 포함하고 있기 때 문에 흡착, 분리 분야에서는 π-착화합결합 흡착제로 서 많은 관심을 끌었고, 실제로도 여러 금속-유기 구 조체 소재들이 올레핀, 방향족, 일산화탄소 등 π-결 합을 갖는 성분들에 대해 기존 흡착제들에 비해 매 우 높은 성능을 보이는 결과들이 발표되면서 최근 이를 이용한 고부가 제품 분리 공정을 개발하려는 연구들도 많이 진행되고 있다. 금속-유기 구조체 기 반 흡착제들에 대한 더 자세한 정보들은 바로 앞장 의 배윤상 교수님, 김현욱 박사님의 기고글을 참고 하기 바란다.
이번 장에서는 π-착화합결합 흡착제의 가장 대표 적인 예인 일산화탄소 선택적 흡착제, 올레핀 선택 적 흡착제들을 자세히 살펴보면서 π-착화합결합 흡
특 별 기 획 ( III )
착제의 원리, 합성방법, 이를 이용한 응용 분야들에 대해 설명하고 π-착화합결합 흡착제의 중요성을 강 조해 보고자 한다.
2. 일산화탄소 선택적 흡착제
일 산 화 탄 소 는 제 련 소 , 수 증 기 개 질 ( s t e a m reforming) 공정, 부분 산화(partial oxidation) 공정 등 다양한 산업 현장에서 부생가스로 다량 발생된다[5].
특히, 제철소에서는 금속 제련 방법에 따라 일산화 탄소가 배출가스에 최소 20%에서 최대 80%까지 포 함되어 배출되어 그 발생량은 연간 약 300만톤이나 된다. 제련소에서 발생되는 일산화탄소는 환경에 유 해한 물질로 대부분 추가 연소 과정을 통해 제거되 며 동시에 열원으로 사용되기도 한다[6]. 하지만, 일 산화 탄소는 아세트산, 폴리우레탄, 폴리카보네이 트, 포름산, 아크릴산, 포스겐 등 다양한 고부가가치 화학물의 원료 물질로 사용될 수도 있고 수소와 함 께 합성가스(syn gas)를 구성하여 Fischer-Tropsch 공 정을 통해 가솔린을 생산할 수도 있기 때문에, 제련 소 부생가스에서 일산화탄소를 효과적으로 분리해 낼 수 있다면 고부가가치 상품화가 가능할 것으로 생각된다.
최근 수소 경제 사회 이행에 따라 우리나라를 포 함한 주요 선진국(미국, 일본, 호주, 독일 등)에서 수 소 생산 기술에 대한 관심과 수요가 크게 증가함에 따라 더불어 일산화탄소 분리, 제거 기술에 대한 관 심도 높아지고 있다. 수소는 수전해 방법을 통해 온 실가스 배출이 거의 없이 생산할 수도 있지만(green hydrogen), 아직까지 가격 경쟁력, 규묘 장벽 등의 이 유로 아직까지 대부분의 수소는 천연가스의 수증기 개질(methane steam reforming reaction)을 통해 생산 되는 회색수소(grey hydrogen)다. 앞 서 설명한 것과 같이 천연가스를 수증기 개질할 때 일산화탄소가 일 부 발생하는데 이 불순물이 최종 수소 제품의 섞여 있을 경우 큰 문제가 된다. 현재 수소 경제 사회에 있 어서 가장 중요한 수소 소요처인 연료전지(fuel cell) 에 일산화탄소가 미량이라도 섞여 들어간다면 연료
전지 내 핵심 소재인 촉매가 피독되게 되어 지속적 으로 성능이 저하된다. 이에 따라, 수증기 개질 공정 에서 일산화탄소는 0.1 ppm 이하로 반드시 제거되어 야 하는데, 대부분의 일산화탄소는 수증기 개질 공 정 후단에 설치되어 있는 수성 가스 전환 공정(water gas shift reaction)에서 이산화탄소로 전환되어 제 거 되지만, 이후에도 남아 있는 일산화탄소는 수소 를 정제하여 제품화하는 압력변동흡착공정(pressure swing adsorption, H2-PSA) 내 포함되어 있는 일산화 탄소 고선택성 흡착제에 의해 제거된다. 이때의 흡 착제의 기능은 일산화탄소 분리 및 고순도화 보다 는 제거에 가깝다. 올해 한국에너지기술연구원에서 100% 국산 기술로 개발 성공한 50kg/day 급 수소 스 테이션 기술(책임자: 윤왕래)에도 역시 일산화탄소 흡착제 기술이 포함되어 있다. 앞 서 설명한 응용 예 를 보더라도, 일산화탄소의 흡착 및 분리를 위한 기 술이 다양한 산업 분야에서 중요한지 알 수 있다.
지금까지 일산화탄소는 주로 심냉법(cryogenic distillation), 흡수법(absorption), 흡착법(adsorption) 등 을 통해 분리할 수 있었다 [7-10]. 심냉법의 경우 보 통 일산화탄소를 대규모로 정제하는 공정에서 많 이 사용되었으나 냉각을 위해 많은 에너지를 소비 하는 단점을 갖고 있다. 더불어, 일산화탄소와 끓는 점이 비슷한 질소가 같이 포함되어 있을 경우 심냉 법을 통해 두 성분을 분리하기 쉽지 않다. 흡수법에 서는 CuAlCl4, 톨루엔 용액을 일산화탄소 흡수제로 사용하는 COSORB 방법이 주로 사용된다. 이 방법 을 사용하면 고압 조건 하에서 일산화탄소를 흡수하 고 감압하여 다시 일산화탄소를 회수할 수 있다. 이 방법은 일산화 탄소를 고순도로 분리해낼 수 있으 며 회수율이 높다는 장점이 있지만 흡수액으로 사용 되는 톨루엔이 환경적으로 유해한 물질이며 흡수액 에 포함된 Cu+ 이온이 공기 중에서 쉽게 산화되어 흡 수 성능이 저하될 수 있다는 단점이 있다. 흡착법에 서는 고성능 흡착제를 사용하여 압력 또는 온도 조 건을 바꿔가며(pressure-swing adsorption, PSA, 또는 pressure-, temperature-swing adsorption, PTSA) 일산
특 별 기 획 ( III )
화탄소를 선택적으로 흡착, 탈착하며 분리한다(그림 1). 이 방법은 비용측면에서 다른 방법들에 비해 중 소규모의 일산화탄소 분리에 유리한 장점을 갖고 있 다.
이 흡착법에서 공정 성능을 높이는데 가장 중요 한 부분은 바로 고성능 일산화탄소 선택적 흡착제 개발이다. 앞 서 설명한 것과 같이 흡착제는 일산화 탄소 분자와 강한 π 공유 결합을 가질 수 있는 Cu (I) 이온, Ag (I)과 같은 금속 성분을 포함하는 것이 좋으 며, 일산화탄소 흡착, 분리 적용 분야들에서 발생하 는 인입 가스 성분들을 고려했을 때 이 흡착제는 이 산화탄소, 질소, 산소, 메탄, 수소 대비 일산화탄소 선택도가 높아야 한다.
일반적으로 실제 산업에서 사용되고 있는 일산화 탄소 흡착제는 제올라이트 X에 Ca2+나 Li+ 양이온을 교환한 형태가 대부분이다. 이 외에도 일본 고베 스 틸(Kobe steel)이나 중국 Pioneer사에서는 알루미나나 제올라이트, 활성탄에 CuCl을 담지시켜 제조한 일산 화탄소 흡착제를 일산화탄소 분리 공정에 실제 적용 한 사례도 있다. CuCl을 함침시킨 흡착제는 Ca2+나 Li+ 양이온을 포함한 제올라이트 흡착제들에 비해 일 산화탄소에 대한 인력과 흡착량이 더 크다는 장점이 있다. 학계에서는 오랫동안 Cu+ 형태의 염(대표적으 로 CuCl) 또는 Ag+ 형태의 염(AgCl) 등을 비표면적이 큰 다양한 지지체에 함침시켜 일산화탄소 흡착제를 개발하는 연구가 많이 진행되어 왔다. 특히, Cu+ 양 이온은 일산화탄소 분자와 친화력이 매우 좋아 일산 화탄소 흡착제 매우 적합하다고 알려져 있는데 Cu+ 양이온은 공기 중의 산소에 의해 일산화탄소와 친화
력이 매우 낮은 Cu2+로 쉽게 산화되거나 CuCl을 쉽 게 녹일 수 있는 용매가 많지 않아 함침 시키는데 어 려움이 있어 이를 이용한 일산화탄소 흡착제 제조 를 상용화하는데 아직까지도 많은 한계가 있다. 이 런 이유로 CuCl은 앞 서 언급한 것과 같이 가열 단층 분산법을 통해 함침시키는 경우가 대부분이고, 고농 도 암모니아에 소량 녹여서 습윤 함침을 하거나 물 에 쉽게 녹는 제일구리염(CuCl2)를 습윤 함침 시킨 후 Cu+ 형태로 환원 시키는 방법도 개발되었다. 하지 만 고농도 암모니아에 녹여 함침시키는 경우 여전히 용해도 측면에서 한계가 있어 함침량이 적은 단점이 있고 Cu2+를 환원시키는 방법은 Cu(0)까지 환원될 가 능성이 크기 때문에 CuCl을 가열 단층 분산하는 방 법에 비해 많은 양의 CuCl을 지지체에 고분산 시키 기 어렵다.
1990년대 들어서 Xie와 Tang이 제올라이트 X (또는 Y) 지지체에 CuCl을 가열 단층 분산시켜 일산 화탄소 흡착제를 합성하는 방법을 처음 선보였으며 [5], 그 후에 제올라이트 뿐만 아니라 활성탄, 실리카 겔, 메조다공성 실리카(MCM-41, SBA-15 등), 알루 미나 등에도 CuCl을 담지하여 일산화탄소 선택성 흡 착제를 제조하는 연구도 많이 진행되었다 [11-15].
또한, 앞 서 말한 CuCl 담지 상의 어려움을 해결하 기 위해 상용 알루미나 지지체에 제이구리염을 습윤 함침 시키고 일산화탄소-수소 혼합가스를 이용하여 Cu+ 형태로 환원시켜 흡착제를 제조하는 연구도 있 었으나 전체 제이구리염을 제일구리염으로 100% 환 원하기 어렵고 일부분은 구리(0) 메탈로 전환된다는 단점이 있었다[16,17].
그림 1. 일본 Kobe-Steel 사(좌) 중국 Pioneer 사(우)에서 제작한 일산화탄소 VPSA 장치.
특 별 기 획 ( III )
이렇게 기존에 발표된 많은 문헌을 통해 알 수 있 듯이, CuCl을 비표면적이 큰 지지체에 담지하여 제 조한 소재가 일산화탄소 선택적 흡착제로써 매우 적 합하다고 통상적으로 인정되고 있지만, 실제 산업 분야에서 사용하기에는 여전히 해결해야 하는 점이 많다. 산화가 쉽게 되어 일산화탄소 흡착 성능을 잃 어버릴 수 있는 CuCl 성분을 장시간 초기 상태를 유 지시킬 수 있는 방법을 개발해야 하며, 용해도가 떨 어져 가열 단층 분산 밖에 할 수 없는 CuCl 함침 공 정을 효율적으로 대형화시킬 수 있는 방법을 찾아야 한다. 또한, 대부분의 기존 문헌에서는 일산화탄소 흡착량에 대해서는 많이 보고 했지만 이산화탄소나, 질소, 수소 등 다른 성분 대비 선택도에 대해서는 보 고 하지 않은 경우가 많아 일산화탄소 선택도에 대 한 정보를 판단하기 쉽지 않다.
최근 한국에너지기술연구원에서는 연구원 자 체 사업(2016~2018년, 책임자: 한상섭)과 외부 사업 (2019년, 책임자: 한상섭)을 통해 제철소 배가스 내 에 포함된 일산화탄소를 선택적으로 흡착하여 감 압 압력 변동 분리 공정(Vacuum Pressure Swing Adsorption)을 통해 고순도화시킬 수 있는 기술과 이 에 사용되는 일산화탄소 고 선택성 흡착제를 개발하 였다. 제철소 배가스는 사용하는 용광로 종류에 따 라 조성이 약간씩 차이가 있으나(Linz-Donawitz Gas:
65~80% CO + 5~7% CO2 + N2 trace, Blast Furnace Gas: 20~36% CO + 4~13% CO2 + 55~61% N2 + 1.5~8% H2), 공통적으로 일산화탄소 외에 질소와 이 산화탄소가 많이 포함되어 있다. 따라서 이러한 조 성에서 일산화탄소만 선택적으로 흡착, 분리하기 위 해선 일산화탄소 흡착량, 이산화탄소와 질소 대비 일산화탄소 선택도가 높은 흡착제를 개발해야 했다.
필자가 포함된 연구팀에서는 체계적인 소재 개발 연 구를 통해 일산화탄소 흡착량을 높일 수 있도록 제 일 구리염을 균일하게 분산시킬 수 있고 반면 이산 화탄소, 질소는 거의 흡착하지 않은 적합한 기질을 탐색하였다. 효율적인 탐색 작업을 위해 우선 제일 구리염의 분산도를 높이기 위해 필요한 화학적 성질
과 이산화탄소에 대한 친화력을 낮출 수 있는 방법 에 대해 근본적으로 이해하고자 했다. 그 결과, 2017 년에는 알루미나 유사 물질에 CuCl를 가열 단층 분 산 시켜 298 K에서 35 cm3/g의 일산화탄소 흡착량을 보이고 2.9 cm3/g의 작은 CO2 흡착량을 보이는 흡착 제를 개발할 수 있었다[18]. 더욱 흥미로운 것은 이 흡착제는 쉽게 대량 합성할 수 있으며 자체 개발한 특수 성형 방법을 통해 물리적 강도가 높고 공기 중 에 6개월 이상 노출 되어도 전혀 산화되지 않아 초기 일산화탄소 흡착량을 거의 똑같게 유지할 수 있게 할 수 있음을 확인하였다. 대량 제조한 구형(직경: 1 mm) 일산화탄소 흡착제를 벤치 스케일 VPSA 장치 에 넣고 테스트 한 결과 예상한 것처럼 높은 회수율 과 생산성을 보였다. CO 성분을 65% 함유하고 있는 원료로부터 제품순도 99.0%인 CO 가스를 생산할 때 90% 이상의 회수율과 11.5 cm3-CO/cm3-adsorbent/
cycle 이상의 생산성을 보였다. 이 공정성능은 현재 까지 보고된 성능 중 단연 세계 최고이며, 그 기술의 우수성을 인정 받아 2019년 반도체 특수가스 생산 업 체인 ㈜티이엠씨에 기술이전할 수 있었다. 또한, 연 계 연구를 통해 2019년에는 알루미나 계열 신규 지지 체를 사용하여 298 K에서 더 높은 일산화탄소 흡착 량(48.5 cm3/g)과 매우 낮은 이산화탄소, 질소, 수소 흡착량(CO2: 2.89 cm3/g, N2 & H2: <1 cm3/g)을 보이는 흡착제를 개발하였다(그림 2)[19]. 이 흡착제를 대량 제조하여 VPSA 공정에 적용하는 연구는 현재 진행 중이지만 분명 기존 공정 기술보다 높은 일산화탄소 회수율과 생산성을 보일 수 있을 것으로 예상할 수 있다.
3. 올레핀 선택적 흡착제
상용 규모의 탄화수소 분리는 전 세계 에너지 소 비의 상당량을 차지하며, 특히, 고분자 원료로 사용 되는 에틸렌/프로필렌의 효율적 분리는 전세계적 이 슈다. 현재, 이러한 분리는 고압액화증류법 (high- pressure cryogenic distillation)을 이용한다. 고압 액화 증류법은 엄청난 에너지를 필요로 하는 공정으로 에
특 별 기 획 ( III )
틸렌, 프로필렌 생산단가의 상당량을 차지할 뿐만 아니라, 에틸렌과 프로필렌의 분리 공정에만 소비되 는 에너지가 전세계 에너지 소비량의 0.3%에 달할 정도이다 [20]. 온도제어 공정(예, 분별증류)을 흡착 제 기반 공정으로 대체한다면 고순도 화합물 생산에 수반되는 에너지 소비 및 생산비용을 20% 이하로 줄 일 수 있다.
흡착제는 분리 메커니즘에 따라 (1) 선택적 결합 흡착 또는 (2) 분자체 로 나눌 수 있다 [21]. 가장 많 이 연구된 첫 번째 부류는 타겟 분자의 우선적 흡착 을 기반으로 한다. 예를 들어, 파라핀으로부터 올레 핀을 분리하기 위한 흡착제로 올레핀과 강한π-결 합을 형성하는 금속(예, Ag+,Cu+)이 담지된 다공성 물질이 사용된다 [22]. 최근에는 금속-유기-골격체 (MOF)의 open-metal sites를 이용하여 올레핀을 선택 적으로 분리하는 연구도 활발히 진행되고 있다 [23].
하지만, 전이금속을 이용한 선택적 결합 흡착은 상 용 측면에서 몇 가지 결정적 단점이 존재하는데, 첫 째로 강하게 흡착된 타겟 분자의 제거에 상당한 고 온이 필요하는 등 재생이 어렵고, 고온재생 시 기공 내부의 금속 클러스터링(clustering)을 야기하여 종종 기공이 막히는 문제가 발생한다. 뿐만 아니라, 황 화 합물 또는 수분에 노출 시 금속 흡착 부위의 안정성 이 상대적으로 낮다.
두 번째 부류인 분자체 기반의 분리 메커니즘은 분자의 크기를 기반으로 흡착(주로, 큰 분자)을 배제 하는 방식이다. 이 방식은 약한 물리흡착을 기반으 로 하기 때문에 저온 재생이 가능하다. 하지만, 분자 체 기반의 흡착제는 상대적으로 낮은 선택성을 보이 는데, 이는 분리하고자 하는 분자들의 직경 차이가 매우 작아 적절한 기공크기를 갖는 분자체 제조가 어렵기 때문이다. (예를 들어, 에탄은 4.44 Å, 에틸렌
그림 2. 이산화탄소, 질소, 메탄, 수소 대비 높은 일산화탄소 선택성을 보이는 흡착제[19].
그림 3. 선택적 결합 흡착(a)과 분자체(b)를 이용한 분리.
특 별 기 획 ( III )
은 4.16 Å).
본 총론에서는 선택적 결합 흡착을 기반으로 한 분리에 주안점을 맞춘다. 제올라이트는 결정성 마이 크로다공성 알루미노실리케이트로 높은 비표면적, 1-nm이하의 균일한 기공, 이온 교환점을 갖는다. 제 올라이트의 이온 교환 특성을 이용하여 Ag+, Cu+ 이 온으로 교환된 제올라이트를 이용하면 높은 선택성 을 가지는 제올라이트 분자체를 만들 수 있다. 일례 로, Ca-LTA 제올라이트에 Ag+ 이온을 교환시켜서 합성한 AgA 제올라이트는 에탄 흡착은 전혀 하지 않 으면서 에틸렌은 선택적으로 흡착한다[21]. 이러한 AgA의 높은 에틸렌 선택성은 Ag+와 에틸렌 사이의 강한 흡착력과 AgA의 작은 기공에 의한 분자체의 시 너지적 효과에 기인한다.
무기-유기 골격체(MOF)도 올레핀 선택적 흡착 제로 많이 연구되고 있다. HKUST-1 ([Cu3(btc)2; btc3-
= benzene-1,3,5-tricarboxylate])는 Cu2+의 open metal sites를 가지며, 이 sites에 에탄과 에틸렌의 흡착에 너지가 약 2kJ/mol 정도의 차이를 보인다 [24]. 이러 한 흡착열 차이를 이용해 에틸렌과 에탄을 분리하였 다. HKUST-1의 open metal sites를 이용한 최초의 분 리 시연 이후로, 같은 원리를 이용한 다양한 종류의 MOF가 보고되었다 [25]. Open metal sites를 가지고 있지 않은 대부분의 MOF는 올레핀의 대한 선택성을 보여주는 예가 거의 없었다. 하지만 NOTT-300 물 질은 다른 방식의 원리를 이용하여 올레핀 선택성을 보였다 [26]. AlO4(OH)2 octahedra가 유기적으로 연 결되어 만들어진 NOTT-300은 골격 내에 Brønstead acidic sites를 가진다. 에틸렌은 acidic OH 그룹에 에 탄보다 강하게 결합하는 특성을 가져 NOTT-300 물 질은 높은 올레핀 선택성을 가지며 동시에 H2S나 H2O와 같은 오염물질에 open metal sites보다 강한 저 항성을 가진다.
최근에는 유연한 MOF(flexible MOF)에서 일어나 는 gate-opening 현상을 이용해 파라핀과 올레핀을 분리하는 기술도 보고되었다 [27]. ZIF-7 물질은 골 격의 유연성을 가지는 물질로 상온 조건에서는 에
탄과 에틸렌을 모두 흡착한다. 하지만 에탄과 에틸 렌의 흡착이 일어나는 압력의 시점이 크게 다르다.
ZIF-7의 gate-opening 현상이 에탄을 흡착할시 훨 씬 더 저압에서 일어나게 되어, 에탄을 선택적으로 흡착할 수 있다. 이는 에탄 기체가 threefold rational symmetry를 가지기 때문에 반데르발스 힘이 최대가 되어 저압에서 gate-opening이 일어나는 것으로 보고 되었다.
Paraffin을 선택적으로 흡착하는 MOF소재도 보 고되었다. MAF-49 [Zn(batz); batz2= bis(5-amino- 1,2,4-triazol-3-yl)methane]는 에탄의 대한 흡착열이 에틸렌에 비해서 이례적으로 높은 물질이다 [28]. 이 는 상대적으로 부피가 큰 에탄이 MAF-49 골격 내에 있는 아민 그룹과 더욱 많은 상호작용을 할 수 있기 때문이다. MAF-49를 이용한 파과실험 결과 에탄/에 틸렌이 1:1로 섞여 있는 혼합물에서 99.98% 의 에틸 렌을 한 번의 파과컬럼을 통해 얻는 결과가 발표되 었다.
다이올레핀을 갖고 있는 분자의 분리도 최근 많 은 연구를 하고 있다. 대표적인 예로 1,3-butadiene 은 고무제조의 원료로 사용되는 물질이다. butane 으로부터 1,3-butadiene을 제조하기 위한 여러 노 력이 수행되고 있는 현재, 에너지 소모를 줄이기 위해 butane의 탈수소화후 형성되는 다양한 생성 물 (예, butane, butene, 1,3-butadiene)에서 선택적 으로 1,3-butadiene를 흡착제를 써서 분리하는 기 술이다. Chen 그룹에서는 hydrophilic한 MOF인 [Zn2(btm)2] (H2btm = bis(5-methyl-1H-1,2,4-triazol- 3-yl)methane를 이용하여 butadiene의 선택적 분리 를 보였다 [29]. [Zn2(btm)2] 의 기공 특징은 분리된 기 공(cavity)이 아주 얇은 채널을 통해 연결이 되어 있 다. Concave 모양을 가지는 cavity 에는 open metal site의 Zn를 가지며, 이 Zn의 존재와 기공모양 인해 butadiene과 높은 선택도로 결합하여 butadiene을 분 리하는 능력을 가진다. 동시에 얇은 채널은 butadiene 을 원활히 이동시켜주는 역할을 수행한다. 얇은 채 널이 없다면 butadiene은 cavity 내부에 갇혀 탈착이
특 별 기 획 ( III )
거의 되지 않는다. 이러한 기공 제어를 통해 butane, butene, isobutene, 1,3-butadiene에서 1,3-butadiene을 선택적으로 분리하는 것을 보였다.
4. 맺음말
일산화탄소와 올레핀은 다중결합을 갖는 화합물 들로, 다중결합의 특성으로 인해 π-결합을 갖는다.
결합축을 따라 형성된 σ-결합과는 달리 결합축의 위/아래 공간에 형성된 π-결합은 다른 형태의 화학 결합을 보인다. 예를 들어, metal의 비워진 d-orbital 에 (open-metal sites)에 강하게 결합을 할 수 있다. 하 지만 π-결합과 선호적인 결합을 하는 흡착점들은 대 게 비공유 전자쌍을 갖고 많이 갖고 있는 Lewis base 들과도 강하게 결합을 한다(예를 들어, H2O, H2S, NH3). 이에 이러한 물질들이 소량만 존재해도 그 흡 착점 특성을 쉽게 잃어버리는 장점이 있다. 흡착제 의 개발을 통해 Lewis base의 흡착에 강한 저항성을 가지면서 π-결합을 선호적으로 흡착하는 신소재의 개발이 필요할 것이다.
참고문헌
1. Francoise Rouquerol, Jean Rouquerol, Kenneth Sing, Philip Llewellyn, Guillaume Maurin, Adsorption by Powders and Porous Solids: Principles, Methodology and Applications, Academic Press, San Diego(1998) 2. Santi Kulprathipanja, Zeolites in Industrial Separation
and Catalysis, Wiley-VCH, Glasgow(2010)
3. Patricia Horcajada, Ruxandra Gref, Tarek Baati, Phoebe K. Allan, Guillaume Maurin, Patrick Couvreur, Gerard Ferey, Russell E. Morris, Christian Serre, “Metal-organic frameworks in biomedicine”, Chem. Rev., 112(2), 1232- 1268(2012)
4. 조순행, 흡착제, 그 원리와 응용, 지구문화사 (2006) 5. Youchang Xie, Jiaping Zhang, Jianguo Qiu, Xianzhong
Tong, Jinping Fu, Ge Yang, Haojie Yan, Yougi Tang,
“Zeolites modified by CuCl for separating CO from gas mixtures containing CO2”, Adsorption, 3, 27-32(1996).
6. S.S. Hou, C.H. Chen, C.Y. Chang, C.W. Wu, J.J. Ou, T.H. Lin, “Firing blast furnace gas without support fuel in steel mill boilers”, Energy Convers. Manage., 52(7), 2758-2767(2011)
7. Hajime Tamon Kenji Kitamura Morio Okazaki,
“Adsorption of carbon monoxide onactivated carbon impregnated with metal halide”, AIChE J. 42(2), 422-
430(1996)
8. F. Kasuya, T. Tsuji, “High purity CO gas separation by pressure swingadsorption”, Gas Sep. Purif. 5(4), 242–
246(1991)
9. Fei Gao, Yaquan Wang, Shuhai Wang, “Selective adsorption of CO on CuCl/Y adsorbent prepared using CuCl2 as precursor: equilibrium and thermodynamics”, Chem. Eng. J., 290 418–427(2016)
10. 조강희, “고성능 국산 흡착제 개발: 소재 원천 기술 확보와 상용화를 위한 노력”, News & Information for Chemical Engineers, 35(4), 307-314 (2017)
11. Hirai Hidefumi, Wada Keiichiro, Komiyama Makoto,
“Active carbon-supported copper(I) chlorideas solid adsorbent for carbon monoxide”, Bull. Chem. Soc.
Jpn., 59(7), 2217–2223(1986)
12. Yan Huang, Ying Tao, Liang He, Yu Duan, Jing Xiao, Zhong Li, “Preparation of CuCl@AC with high CO adsorption capacity and selectivity from CO/N2 binary mixture”, Adsorption 21, 373–381(2015)
13. Y. Wang, Y. Lin, “Sol-gel synthesis and gas adsorption properties of CuClmodified mesoporous alumina”, J.
Sol-Gel Sci. Technol., 11, 185–195(1998)
14. Y. Yin, P. Tan, X.-Q. Liu, J. Zhu, L.-B. Sun,
“Constructing a confined space in silicananopores:
An ideal platform for the formation and dispersion of cuproussites”, J. Mater. Chem. A, 2, 3399–3406(2014) 15. Yuhe Wang, Ralph T. Yang, John M. Heinzel,
“Desulfurization of jet fuel by π-complexation adsorption with metal halides supported on MCM-41 and SBA-15 mesoporous materials”, Chem. Eng. Sci., 63, 356-365(2008)
16. Timothy C. Golden, Wilbur C. Kratz, Frederick C.
Wilhelm, Highly dispersed cuprous compositions,US Patent No. 5,126,310, 1992.
17. Timothy C. Golden, Wilbur C. Kratz, Frederick C.
Wilhelm, Ronald Pierantozzi, Andrzej Rokicki, Highly dispersed cuprous compositions, US Patent No.
5,175,137, 1992.
18. Kanghee Cho, Jungsu Kim, Hee Tae Beum, Taesung Jung, Sang Sup Han, “Synthesis of CuCl/Boehmite adsorbents that exhibit high CO selectivity in CO/CO2
separation”, J. Hazard. Mater., 344, 857-864(2018) 19. Kanghee Cho, Jungsu Kim, Jong-ho Park, Taesung
Jung, Hee Tae Beum, Dong-Woo Cho, Young Woo Rhee, Sang Sup Han, “High CO adsorption capacity, and CO selectivity to CO2, N2, H2, and CH4 of CuCl/
bayerite adsorbent”, Micropor. Mesopor. Mater., 277, 142-148(2019)
20. D. S. Sholl, R. P. Lively, Seven chemical separations to change the world, Nature, 532, 435-437 (2016) 21. S. Aguado, G. Bergeret, C. Daniel, D. Farrusseng,
JACS, 134, 14635-14637, (2012)
22. Y. Xie, N. Bu, J. Lium G. Yang, J. Qiu, N. Yang, Y.