대한소화기학회지 2002;39:216 - 225
서 론
10)담즙은 체내 콜레스테롤과 인지질의 주요한 운송 수단이 며, 담낭 안에서 농축되어 때로는 콜레스테롤이 과포화되
접수: 2001년 11월 19일, 승인: 2002년 2월 7일
연락처: 이진, 150-020, 서울특별시 영등포구 영등포동 94-200 한림의대 한강성심병원 내과
Tel: (02) 2639-5405, Fax: (02) 2637-9097 E-mail: jinleeprof @hanmail.net
※ 본 논문 요지의 일부는 2001년 Atlanta, 미국소화기학회에서 구 연발표되었음.
기도 한다.1 담낭 담즙의 콜레스테롤 및 인지질 농도의 변 화는 임상적으로 담낭의 콜레스테롤 담석이나 콜레스테롤 침착증 등과 연관되어진다.1 ,2 담낭상피세포의 첨부(apical) 표면은 항상 고농도의 콜레스테롤이 포함된 담즙과 접촉하 므로, 담즙의 콜레스테롤 또는 인지질 농도를 조절하는 기 전을 지니고 있는 것으로 알려지고 있다.1- 3 그러나 담낭상 피세포에 의해 흡수된 콜레스테롤과 인지질의 처리 기전은 아직 확실하지 않다.
최근, 대식세포에 축적된 콜레스테롤을 세포 밖으로 유 출시키는 기전으로서, 혈장과 농도 차이에 의한 수동적
담낭상피세포에 있어서 극성화된 콜레스테롤 및 인지질 유출에 대한 연구 모델의 개발
한림대학교 의과대학 내과학교실
이 진
I n t r o d u c t i o n o f a M o d e l f o r S tu d y o f P o la r i z e d C h o l e s t e r o l a n d P h o s p h o l i p i d E ff lu x i n G a l lb la d d e r E p i t h e l i a l C e l l
J in Le e , M.D .
Department of Internal Medicine, Hallym University College of Medicine, Seoul, Korea
Background/Aim s : The cholesterol absorption by gallbladder epithelial cell (GBEC) is well known . However,
the metabolism of the absorbed cholesterol in GBEC is not established yet. Thus, in this study, I introduced an
effective system to investigate polarized cholesterol and phospholipid efflux in GBEC. Methods: Dog
GBEC-CL 1 was cultured on Transwell system . After apical loading of cells with mixture of model bile (MB)
and
14C-cholesterol or
3H-choline, cholesterol and phospholipid efflux were measured in apical and basolateral
media. Cellular proliferation and MB toxicity were evaluated by the method using 3-(4,5-dimethylthiazol-2-yl)-
2,5-diphenyltetrazolium bromide. Paracellular permeability was measured by
12 5I-apo A-I and
14C-cholesterol leakage
tests. Additionally, immunofluorescence staining and immunoblotting were performed to demonstrate specific
transporters associated with cholesterol and phospholipid efflux. Results: Cellular proliferation without collagen
matrix on Transwell showed normal confluent monolayer growth, not allowing leakage between apical and
basolateral compartments. MB did not show any toxicity to cells. Only GBEC loaded with MB showed basolateral
predominant cholesterol and phospholipid efflux following treatment of apo A-I and cAMP. Immunofluorescence
and immunoblotting studies demonstrated expression of ATP-binding cassette transporter A 1 (ABCA 1) or
scavenger receptor class type I. Conclu sions: Dog GBEC-CL 1 culture on Transwell using MB is an efficient
system in studying polarized cholesterol and phospholipid efflux. (Korean J Gastroenterol 2002 ;39 :2 16-225)
Key W ords: Gallbladder epithelial cell, Cholesterol, Phospholipid, Model bile, ABCA 1
이진. 담낭상피세포의 콜레스테롤 유출에 대한 연구 모델
분산 경로와 apo A-I 매개성 능동적 경로가 있는 것으로 알려져 있다.4 세포형질막에 존재하는 ATP-binding cassette transporter A1 (ABCA1)이 apo A-1 매개성 능동적 경로에 있 어서 apo A-I에 직접적으로 콜레스테롤 또는 인지질을 전 해주는 수송체임이 밝혀졌다.4 - 7 또한 scavenger receptor class type I (SR-BI)은 콜레스테롤 흡수에 주로 관여하나, 세포내 콜레스테롤 농도에 따라, 때로는 수동적 분산 경로 에 의한 유출을 강화시키는 것으로 보고되고 있다.8 그렇다 면 담낭상피세포에도 과도하게 축적된 콜레스테롤 또는 인 지질을 배출하는 기전으로서 ABCA1이나 SR-BI이 존재할 가능성이 매우 높다 하겠다.
담낭상피세포는 대식세포와는 달리 고도로 분화되어 있 으며, 담즙과 직접 접촉하는 첨부 표면과 혈장과 닿아 있 는 기저측부(basolateral) 표면으로 세포막의 기능이 분화되 어 있는 극성을 지니고 있다.9 극성이 있는 담낭상피세포 에서 콜레스테롤 및 인지질의 유출에 관한 연구를 위해서 는 다음과 같은 조건이 만족되는 세포주의 선택 및 세포 배양법 등을 포함하는 효율적인 연구 모델이 필요하다.
첫째, 세포 자체에 의한 순수 극성화된 콜레스테롤 또는 인지질 유출을 측정하기 위하여 Transwell의 polycarbonate 막의 표면에 콜라겐 기질의 처리 없이 성장과 증식이 가 능하여야 한다. 둘째, 세포들 사이의 결합이 충분하여 세 포 성장의 합류도(confluency)가 100%에 이를 때 첨부 구 획에서 기저측부 구획 또는 반대 방향으로의 배양배지나 그 속에 함유된 물질의 누출 현상이 없어야 한다. 셋째, 생체내 담낭상피세포의 생리적 환경과 유사하며, 독성이 없는 효율적인 세포내 콜레스테롤 및 인지질 부하 방법 이 있어야 한다. 넷째, 콜레스테롤 및 인지질의 흡수와 유 출에 관여하는 ABCA1 등의 주요 수송체가 존재하여야 한다. 다섯째, 실제적으로 적절한 자극에 따라 콜레스테 롤 및 인지질의 유출 현상이 관찰되어야 한다. 이처럼 실 험 조건이 까다로워서 아직 담낭상피세포에서 콜레스테 롤 및 인지질의 유출에 관한 연구는 이루어지고 있지 못 한 실정이다.
본 연구의 목적은 위에서 언급한 조건을 만족하여 담낭 상피세포에서의 극성화된 콜레스테롤 및 인지질의 유출에 관한 연구를 원활히 할 수 있는 연구 모델의 개발 및 체계 의 확립에 있다.
대상 및 방법
1. 사용된 재료
Eagle's minimum essential media (EMEM), fetal bovine serum (FBS), trypsin-EDTA, penicillin-streptomycin, L-α
-phosphatidylcholine, 8-bromo-cyclic AMP (8-Br-cAMP) 그 리고 peroxidase-conjugated anti-rabbit IgG는 Sigma (St.
Louis, MO, USA)에서 구입하였으며, Vitrogen은 Celtrix (Palo Alto, CA, USA) 제품을 사용하였다. Transwell 세포 배양용기(직경 12 또는 24 mm, pore 크기 3.0 µm)는 Costar (Cambridge, MA, USA) 제품을 사용하였다. Taurocholic acid, fatty acid-free bovine serum albumin (BSA) 그리고 콜 레스테롤은 Calbiochem (La Jolla, CA, USA) 제품이었다.
14C-cholesterol과3H-mannitol은 NEN (Boston, MA, USA)에서, methyl-3H-choline chloride과 enhanced chemilumilnescence (ECL-Plus) 검출시약은 Amersham Pharmacia (Piscataway, NJ, USA)에서 구입하였다. Fluorescein-conjugated goat anti-rabbit IgG는 Molecular Probes (Eugene, OR, USA), peroxidase- conjugated anti-goat IgG는 Rockland (Gilbertsville, PA, USA) 제품이었다. Polyclonal anti-SR-BI은 Novus (Litteton, CO, USA) 제품이었다.
2. 개의 담낭상피세포 배양
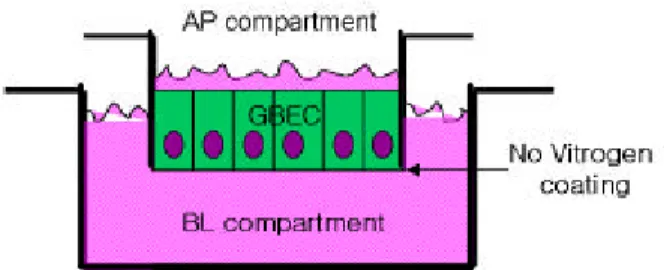
담낭상피세포는 Oda 등9이 개의 담낭에서 분리하여 냉동 보존한 GBEC-CL1을 사용하였다. 보존배양(stock culture) 은 100 mm Petri 배양접시에 2 mL Vitrogen gel (Vitrogen과 배지의 1:1 혼합물)을 도포하고, 10% FBS, 2 mM L-glutamine, 20 mM HEPES, 100 IU/mL penicillin 그리고 100 mg/mL streptomycin이 첨가된 EMEM을 정규배지로 하여 시행하였 다. 배지는 일주일에 2회 교환하였고, 세포들은 5% CO2가 포함된 37℃ 배양기에서 배양하였다. 세포들이 배양용기 내에서 합류되면 2.5 g/L trypsin과 1 g/L EDTA를 사용하여 7-10일 간격으로 계대배양을 하였다. Transwell 위에서의 배양은 Vitrogen 도포 없이 보존배양과 같은 조건에서 이루 어졌다(Fig. 1).
Fig. 1. Schematic illustration of gallbladder epithelial cell (GBEC) culture system on Transwell insert. AP, apical; BL, basolateral.
3. 모델담즙의 제작과 apo A- I의 정제
콜레스테롤 포화지수가 1.5인 모델담즙을 Klinkspoor 등10이 기술한 방법에 따라 제조하였다. Methanol과 물 2 17
The Korean Journal of Gastroenterology: Vol. 39, No. 3, 2002
(85/ 15, vol/vol)에 용해된 taurocholic acid, lecithin (L- α- phosphatidylcholine) 그리고 chlorform에 용해되어 있는 정제 된 콜레스테롤과 적절히 혼합하여 콜레스테롤 포화지수 1.5가 되도록 하였다. 포함된 용매는 질소가스를 주입하면 서 증발시켰으며, 잔류물은 동결건조하였다. 동결건조된 모 델담즙은 사용 전까지 -70°C 냉동고에 보관하였다. 각 실험 을 위하여 모델담즙은 5 mL, pH 7.4 phosphated buffered solution (PBS)에 용해하여 56°C에서 최소 8시간 이상 평준 화하였다. 이는 다시 SFM와 1:10으로 희석한 후 0.45 mm 필터로 여과하여 사용하였다. Apo A-I은 Francis 등1 1이 기 술한 방법에 따라 HDL로부터 정제하였다.
4. 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) 방법을 사용한 담낭상피세포에 대한 모델담즙의 영향 평가
담낭상피세포를 12 mm 직경의 플라스틱 배양용기에 Vitrogen의 도포 없이 약 50% 합류를 이룰 때까지 배양하 였다. 각 세포들은 조건에 따라서 정규배지, SFM, 또는 0.0 1에서 1.0 배율로 희석된 모델담즙을 부하하여 48시간 동안 배양하였다. Kaneko 등12이 기술한 방법에 따라서, 그 후 MTT를 배지 1 mL당 0.1 mL를 가하여 37°C에서 2시간 동안 반응시키고 산성화된 isopropanol을 가하였다. 반응중 지용액을 처리한 후 570 nm의 파장으로 색상반응을 광도 계측법으로 측정하였다.
5. 담낭상피세포에 의한 콜레스테롤 흡수 효율성의 비교 담낭상피세포는 12 mm 직경의 Transwell에서 Vitrogen 의 도포 없이 약 90% 합류를 이룰 때까지 배양하였다. 콜 레스테롤 포화지수 1.5인 모델담즙 또는 ethanol에 용해 된 20 µg/mL 콜레스테롤이 포함된 SFM에 0.12 µCi/mL
14C-cholesterol을 가하여 1시간 동안 평준화시킨 후, 혼합액 을 48시간 동안 실험 계획에 따라 세포의 첨부 구획에 부하하였다. 배양액을 모두 흡입 제거한 후, 세포층은 4°C PBS/0.2% BSA로 2회 그리고 4°C PBS로 2회 세척하였다.
조직용해제 TS-2로 24시간 처리한 후, scintillation액을 첨 가하여 방사능계측기를 사용하여 방사능을 측정하였다. 배 지에 존재하는 콜레스테롤 농도와 실제 세포 내의 방사능 의 비율을 결정하여, ethanol에 용해된 콜레스테롤 처리군 의 흡수도로 100으로 하였을 때 상대적인 모델담즙 처리군 의 흡수도로 나타내었다.
6. 합류된 담낭상피세포의 누출성 검정
담낭상피세포는 12 mm 직경의 Transwell에서 Vitrogen 의 도포 없이 약 90% 합류를 이룰 때까지 배양하였다.
모델담즙을 48시간 동안 첨부 구획에 부하하였고, 48시
간 중 후반 24시간 동안은 지정된 세포에 한하여 1 mM 8-Br-cAMP를 양측에 첨가하였다. 그 후 0.2% BSA가 함유 된 PBS로 3회 세척하고 다시 한 번 0.2% BSA가 함유된 SFM으로 세척하였다. 세포들은 10 mg/mL 12 5I-apo A-I, 0.12 µCi/mL 14C-cholesterol 또는 2.0 µCi/mL3H-mannitol이 포함된 SFM/0.2% BSA를 첨부 또는 기저측부 구획에 부하 하고 그 반대편은 SFM로 채우고 배양하였다. 24시간 후 첨 부 배지와 기저측부 배지를 각각 수집하여 감마선 방사능 또는 14C 및3H 방사능을 측정하였다.
7. 담낭상피세포에서 ABCA1 및 SR- BI에 대한 sodium dodecyl sulfate- PAGE 및 Western Blotting
담낭상피세포를 Transwell 위에서 완전 합류가 되도록 배 양한 후, 조건에 따라 모델담즙 또는 SFM을 지정된 세포들 의 첨부 측에 48시간 부하하였다. 이후 세포들은 2배 농축 sodium dodecyl sulfate 부하완충액(loading buffer) (250 mM Tris pH 6.8, 4% sodium dodecyl sulfate, 10% glycerol, 0.006%
bromophenol blue, 2% β-mercaptoethanol)으로 용해하였다.
세포 추출물의 단백질 정량은 Lowry의 단백질 정량법에 의해 이루어졌다.13 ABCA1에 대해서는 4% polyacrylamide stacking gel과 6% resolving gel, SR-BI에 대해서는 4%
polyacrylamide stacking gel과 10% resolving gel을 사용하여 sodium dodecyl sulfate-PAGE를 시행하였고, polyvinylidene difluoride막으로 단백질을 전기영동법으로 이전하였다. 단 백질이 이전된 polyvinylidene difluoride막은 4°C에서 16시간 동안 저지완충액(blocking buffer, PBS/ 0.05% Tween-20 용액내 1% BSA)으로 처리하고, 저지완충액으로 적절히 희 석된 polyclonal human ABCA1 rabbit 항체 또는 polyclonal human SR-BI rabbit 항체와 함께 1시간 동안 실온에서 교반 하였다. 이후 polyvinylidene difluoride막을 세척완충액으로 3회 세척하고, 저지완충액으로 적절히 희석된 anti-rabbit horse radish peroxidase와 함께 1시간 동안 실온에서 교반 하였다. 다시 세척 후에 ECL-plus 검출시약에 5분간 작용 시킨 다음, 자가감광을 X-선 필름에 적정 시간 시행하였다.
8. 담낭상피세포에서 ABCA1 및 SR- BI에 대한 면역형 광염색
담낭상피세포를 Transwell 위에서 완전 합류가 되도록 배 양한 후, 조건에 따라 모델담즙 또는 SFM을 지정된 세포들 의 첨부 구획에 48시간 부하하였다. 세포들은 4°C PBS로 2회 세척 후, 세포가 부착된 Transwell의 polycarbonate막을 적절히 절제하여 배양용기 내에 두었다. 15분 동안 -20°C에 서 methanol/acetone (1:1, vol/vol)용액으로 고정 처리하고 다시 4°C PBS로 세척하였다. 15분간 저지완충액으로 처 리한 후, 조건에 따라 저지완충액으로 적절히 희석된 2 18
Lee. Study Model for Cholesterol Efflux in Gallbladder Epithelial Cell
polyclonal human ABCA 1 rabbit 항체, polyclonal human SR-B 1 rabbit 항체 또는 음성조건용 감작 전 혈청과 함께 1시간 반응시켰다. 10분간 3회 세척 후에 2차 항체 용액인 fluorescein-conjugated goat anti-rabbit IgG와 1시간 동안 반 응시켰다. 세포들은 다시 10분간 3회 세척 후에 슬라이드 표본으로 제작하여 Nikon Eclipse E600 형광현미경으로 관 찰 및 촬영하였다.
9. 담낭상피세포에서 콜레스테롤과 인지질 유출 확인 실험 담낭상피세포는 12 mm 직경의 Transwell에서 Vitrogen 의 도포 없이 약 90% 합류를 이룰 때까지 배양하였다. 모델 담즙과 0.12 µCi/mL14C-cholesterol 또는 2 µCi/mL3H-choline 혼합액을 48시간 동안 세포의 첨부 구획에 부하하였다. 48 시간 중 후반 24시간 동안은 지정된 세포에 한하여 1 mM 8-Br-cAMP를 양측에 첨가하였다. 그 후 0.2% BSA가 함유 된 PBS로 3회 씻고 다시 한 번 0.2% BSA가 함유된 SFM 으로 세척하였다. 실험 설정에 따라서 세포들은 이어서 24시간 동안 AP, BL 또는 양측에 1 mM 8-Br-cAMP 그리 고/또는 10 µg/mL 순수 정제 human apo A-I이 함유된 SFM/0.2% BSA 배지로 배양하였다. 24시간 후에 각각의 Transwell의 첨부 또는 기저측부 배지를 수집하여 세포 잔재물 제거를 위해 원심분리를 시행하였다. 세포층은 4°C PBS/0.2% BSA로 2회 그리고 4°C PBS로 2회 세척하 였다. 수확된 배지는 scintillation액을 첨가하여 방사능계 측기를 이용하여 직접 측정하였고, 세포층은 조직용해제 TS-2로 24시간 처리하여 배지와 같은 방법으로 방사능을 측정하였다.14C-cholesterol 또는3H-choline의 유출 정도는 백분율(%)로[(첨부 또는 기저측부 배지의 cpm/첨부와 기저 측부 배지의 cpm+세포층의 cpm) ×100] 나타내었다.
10. 통계 처리
각 실험에서 얻어진 결과는 각각의 조건을 위해 시간의 차이를 두어 최소한 3회의 세포 배양에서 얻었으며, 같은 시기에 이루어진 실험에서는 2개 이상의 같은 조건을 가진 세포군을 사용하였다. 셋 이상의 군 사이는 ANOVA test, 두 군 사이는 Student's ttest를 사용하여 비교하였으며 통계 적 유의성은 p<0.05로 하였다. 수치로 표현된 결과는 평균±
표준편차로 나타내었다.
결 과
1. 콜레스테롤 흡수 및 유출에 있어서 콜라겐 도포의 영향 평가
Transwell의 polycarbonate막의 표면에 처리된 콜라겐 기
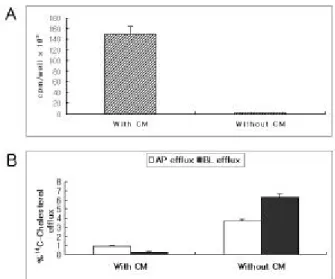
질인 Virogen이 14C-cholesterol의 흡수와 배출에 어떠한 영 향을 미치는지를 먼저 평가하였다. 방법에서 일부 언급한 것 같이, 모델담즙과 0.12 µCi/mL 14C-cholesterol의 혼합액 을 Vitrogn이 도포된 Transwell에서 배양된 담낭상피세포와 그렇지 않은 Transwell에서 배양된 담낭상피세포에 각각 부 하하고 24시간 후에 각 Transwell막의 방사능을 측정하였 다. Vitrogen이 처리된 Transwell막은 그렇지 않은 경우에 비하여 57.6배나 많은 14C-cholesterol의 흡수를 나타내었다 (Fig. 2a, p<0.00 1). 이 결과는, Vitrogen이 처리된 Transwell 에서 담낭상피세포 배양을 시행하였을 경우, 부하된 대부 분의 콜레스테롤이 콜라겐 기질에 흡수되고 있음을 보여준 다. 실제로 8-Br-cAMP와 apo A-I을 가한 후에 시행한 콜레 스테롤 배출 실험에서도, Vitrogen이 처리된 Transwell의 경 우 14C-cholesterol의 첨부 및 기저측부 유출 모두 1% 미만 으로 Vitrogen 처리를 하지 않은 경우에 비해 현저하게 낮 았으며(p<0.001), Vitrogen 처리 없이 배양된 경우의 기저측 부 우위의 유출도 관찰되지 않았다(Fig. 2b, p<0.001). 즉, Vitrogen이 처리된 Transwell에서 배양된 담낭상피세포는 극성화된 콜레스테롤 유출 실험에 부적절함을 보여 준다.
또한 본 연구에서 사용된 개의 GBEC-CL1은 Vitrogen 처리 없이도 Transwell의 polycarbonate막 위에서 생장하고 세포 들의 완전한 합류를 이루는 데 있어서 Vitrogen이 처리된 Transwell에서 배양된 담낭상피세포와 비교하여 차이가 없 음을 MTT 실험으로 확인할 수 있었다(자료 제시 생략).
Fig. 2. The effect of Vitrogen coating on labeling and efflux of
14C-cholesterol. (A) The 14C-cholesterol labeling level in the cell layer with Vitrogen coating is significantly higher (p<0.001) than in the cell layer without Vitrogen coating. (B) The level of AP and BL efflux of 14C-cholesterol in GBEC layer cultured with Vitrogen coating is significantly lower (p<0.001) than that without Vitrogen coating, and there is no BL predominant efflux in Vitrogen coating group (p<0.001). CM, collagen matrix (Vitrogen).
2 19
대한소화기학회지: 제39권 제3호, 2002
2. 완전 합류 상태로 배양된 담낭상피세포의 누출성 평가 Transwell의 첨부 측의 배지에 부하된 12 5I-apo A-I의 기 저측부로의 유출은 모델담즙 처리 또는 cAMP 처리 조건과 관계없이 2% 미만이었으며(Fig. 3a), 그 반대로 부하된 경 우의 유출 역시 1% 미만이었다(Fig. 3b). 또한14C-cholesterol 과3H-mannitol을 사용한 누출 실험에서도 같은 결과를 나 타내었다(자료 제시 생략). 즉, 완전 합류 상태로 배양된 담낭상피세포에 있어서, 세포가 배양된 막을 사이에 두고 첨부 또는 기저측부 배지에 존재하는 물질의 세포 사이 또는 세포를 통한 반대편으로의 누출은 극히 미미함을 나 타내었다.
Fig. 3. Transcellular or paracellular permeability of apo A-I in GBEC. There is no significant leakage of12 5I-apo A-I between AP and BL compartments with all tested conditions. (A) 12 5I-apo A-I is added to the AP side. (B)125I-apo A-I is added to the BL side.
MB, model bile; Tx, treatment. p<0.001, compared with opposite side media.
3. 모델담즙을 사용한 담낭상피세포 내의 콜레스테롤 부하 방법의 효율성
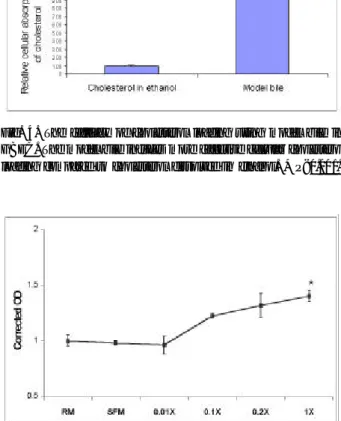
친수성인 모델담즙에 포함된 콜레스테롤을 이용하면 더 욱 효율적인 콜레스테롤 부하가 가능하리라는 가정하에, ethanol에 용해된 콜레스테롤과 비교하여 담낭상피세포의 상대적 콜레스테롤 흡수 정도를 알아보았다. 모델담즙을 이용한 군에서 ethanol에 용해된 콜레스테롤을 이용한 군보 다 약 9.6배(p<0.001)의 높은 세포내 콜레스테롤 흡수를 보 였다(Fig. 4). 한편, 모델담즙이 담낭상피세포에 화학적 독 성을 나타내는지 알기 위하여 각 조건에서 MTT검사를 시 행하였다. 0.01, 0.1, 0.2 또는 1.0의 희석배율로 세포의 첨 부 측에 부하한 모델담즙은 정규 배지 및 SFM과 마찬가지
로 세포의 생장에 전혀 문제가 없었으며, 오히려 모델담즙 의 농도가 증가함에 따라 diphenyltetrazolium의 흡수가 증 가함을 관찰할 수 있었다(Fig. 5). 즉, 실험에 사용된 모델담 즙은 담낭상피세포에 독성이 없으며, 세포의 생장 및 흡수 활동에 장애를 주지 않음을 확인할 수 있었다.
Fig. 4. The efficacy of cholesterol loading using model bile in GBEC. The model bile induces more effective cellular cholesterol loading compared to cholesterol dissolved in ethanol. * P<0.001.
Fig. 5. MTT test for model bile toxicity to GBEC. The loading of model bile increases absorption of MTT, rather than induces any cellular toxicity in GBEC. RM, regular media; X, dilution ratio of model bile. * P<0.001 compared with RM and SFM.
4. 담낭상피세포의 세포형질막에 존재하는 ABCA1 및 SR- BI 표출의 확인
ABCA 1과 SR-BI의 특이적 항체를 각각 이용하여 면역형 광염색을 시행한 결과, 세포형질막을 따라서 존재하는 특이적 ABCA 1 및 SR-BI의 표출을 확인할 수 있었으며 (Fig. 6), 항체의 특이도를 알기 위한 각각의 음성 대조군에 서는 특이적 형광 신호의 검출이 관찰되지 않았다(자료 제시 생략). Western blot 실험에서도, 콜레스테롤 부하에 따라 표출량이 증가하는 220 kD의 ABCA1 이 확인되었 고(Fig. 7a), 콜레스테롤 부하에 따라 표출량이 감소하는 82 kD의 SR-BI이 검출되었다(Fig. 7b).
220
이진. 담낭상피세포의 콜레스테롤 유출에 대한 연구 모델
Fig. 6. Immunofluorescence study for ABCA1 and SR-BI expression in GBEC. (A) Confocal immunofluorescence microscopy shows specific ABCA1 signal on plasma membrane. (B) Routine im- munofluorescence microscopy shows specific SR-BI signal on the plasma membrane.
Fig. 7. Western blot study for ABCA1 and SR-BI. (A) ABCA1 signal increased by cholesterol loading is observed at 220 kD. (B) SR-BI signal decreased by cholesterol loading is observed at 82 kD. Tx, model bile treatment; MB, model bile.
5. 담낭상피세포에서 ABCA1 조절성 apo A- I 매개성 콜레스테롤 및 인지질 유출의 확인
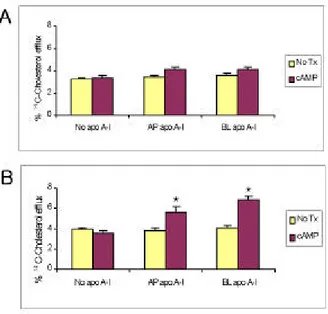
담낭상피세포에 존재하는 ABCA1이 실제적으로 세포내 콜레스테롤 및 인지질 유출을 유발할 수 있는지 알기 위하 여 본 실험을 시행하였으며 그 결과는 Fig. 8과 같다. 첨부 구획으로의 유출의 경우, apo A-I이 첨부 또는 기저측부 구 획에 존재하고 cAMP의 자극이 있을 때, 대조군에 비하여 경미한 증가가 있었으나 통계적으로 유의한 수준은 아니었 다(Fig. 8a). 유의한 콜레스테롤 유출은 cAMP가 존재하고 첨부 또는 기저측부 구획에 apo A-I이 가해졌을 때 기저측 부 구획에서 관찰되었다(Fig. 8b, p<0.001). 흥미로운 점은, 기저측부 측으로의 콜레스테롤 유출은 cAMP가 존재하에 apo A-I을 첨부 구획에 가하였을 때에도 대조군에 비해 증 가하는 것이다(Fig. 8b, p<0.001). 방사선표지자로 사용된
14C-cholesterol의 세포내 수준은 시험된 모든 조건에서 유 의한 차이가 없었으며(자료 제시 생략), 이는 각 조건에 따른
Fig. 8. Cholesterol efflux assays in GBEC. (A) There is no significant cholesterol efflux into the AP compartment regardless of presence of apo A-I and/or 8-Br-cAMP. (B) Significant cholesterol efflux is observed in the BL compartment with AP or BL apo A-I added in the presence of 8-Br-cAMP. Tx, cAMP treatment.
* P<0.001 compared with no cAMP or no apo A-I treatment groups.
Fig. 9. Phospholipid efflux assays in GBEC. (A) There is no significant phospholipid efflux into the AP compartment regardless of presence of apo A-I and/or 8-Br-cAMP. (B) Significant phospholipid efflux is only observed in the BL compartment with AP or BL apo A-I added in the presence of 8-Br-cAMP. Tx, cAMP treatment. * P<0.001 compared with no cAMP or no apo A-I treatment groups.
22 1
The Korean Journal of Gastroenterology: Vol. 39, No. 3, 2002
콜레스테롤 부하의 차이에 따라 이러한 결과가 발생하지 않았음을 의미한다. 한편, 3H-choline을 방사선표지자로 사 용하여 시행한 인지질 유출에 관한 실험에서도 콜레스테롤 유출 실험과 유사한 결과를 얻었다(Fig. 9). 첨부 측으로의 의미 있는 phospholipid의 유출은, 비록 apo A-I을 첨부 또 는 기저측부 구획에 가하더라도, 8-Br-cAMP의 존재 유무 와 상관없이 관찰되지 않았다(Fig. 9a). 더욱이 apo A-I 또 는 8-Br-cAMP을 가하지 않은 대조군에서는 첨부 또는 기 저측부 측으로의 phospholipid 유출은 나타나지 않았다(Fig.
9a, 9b). 가장 유의한 phospholipid 유출은 cAMP가 존재하 고 기저측부 또는 첨부 구획에 apo A-I이 가해졌을 때 기저 측부 구획에서 관찰되었다(Fig. 9b, p<0.001).
고 찰
최근에, 매우 낮은 혈장 HDL 농도, 대식세포를 포함한 말 초조직내 cholesterol ester의 과도한 축적 그리고 조기 동맥 경화증 등을 특징으로 하는 Tangier병의 원인이 ABCA1 유 전자의 변이임이 규명되었다.4 - 7 또한 ABCA1이 말초조직 내에 축적된 콜레스테롤과 인지질의 능동적 유출에 있어서 핵심 역할을 하는 수송체임이 밝혀졌다.4 - 7 그러므로 ABCA1 은 향후 콜레스테롤 관련 질환의 치료와 예방에 있어서 주 요한 목표가 될 것으로 생각된다.
담낭의 결석 및 콜레스테롤 침착증 등은 모두 콜레스테 롤 대사와 밀접한 연관을 지니고 있으며, 담낭상피세포 내 에 과도하게 축적된 콜레스테롤은 담낭의 저운동성을 초래 한다.1- 3 따라서 담낭상피세포는 세포 내에 축적된 콜레스테 롤을 제거하는 기전을 지니고 있을 것으로 추정된다. 실제 로 담낭상피세포에서 콜레스테롤의 유출의 경로가 존재한 다는 몇 가지 간접적인 증거가 있다. 즉, 콜레스테롤과 인 지질의 담낭상피세포에 의한 흡수는 담즙의 콜레스테롤 용 해도에 영향을 주고,2 혈장에 존재하는 apolipoprotein은 담 낭상피세포에 의해 흡수된 콜레스테롤을 받아들이는 역할 을 하며,14 담즙에도 apolipoprotein이 존재하여 콜레스테롤 결정 형성을 억제하는 기능이 있다.15 이외에도 담즙내 apo A-I은 담낭상피세포의 점막 측에서 장막 측으로 콜레 스테롤 수송을 돕는다는 연구 결과도 있다.16 그렇다면 대 식세포나 섬유아세포에서 규명된 ABCA1이 담낭상피세포 에서도 콜레스테롤 및 인지질의 유출에 중심 역할을 할 가능성이 크다.
그러나 담낭상피세포는 대식세포나 섬유아세포와는 달 리 극성을 지니고 있어서, 만약 콜레스테롤 유출이 일어난 다면 어느 방향인지, ABCA1 실제로 존재한다면 세포형질 막의 어느 표면에 존재할지, ABCA1 표출에 관여하는 인자 및 ABCA1과 상호 작용하는 분자생물학적 기전이 무엇인
지 등을 규명하기 위해서는 전혀 새로운 연구 모델이 필요 하다.
담낭상피세포를 포함한 대부분의 정상 상피세포의 배양 에 있어서, Vitrogen 처리 없이 완전 합류를 이루기가 어렵 고, 효율적인 콜레스테롤과 인지질의 세포내 부하 방법 이 밝혀진 바 없다.17 , 1 8 Fig. 2에서 보여준 결과에 따르면 Vitrogen이 처리된 Transwell에서 배양된 담낭상피세포는 극성화된 콜레스테롤 유출 실험에 부적절하였다. 배양이 용이한 암세포주의 이용을 고려할 수 있겠으나, 이는 정상 세포와는 다른 결과를 보일 가능성이 높다. 본 연구에 사용 된 개의 GBEC-CL1은 정상 세포에서 자발적으로 불사화 (immortalized)된 세포주로서, 생리학 및 생화학 그리고 조 직학적으로 정상 담낭상피세포와 거의 일치함이 증명되어 있으며,9 이 세포주를 이용하여 10여 편 이상의 연구가 이 루어진 바 있다.19 - 2 1 본 연구의 초기에 생쥐 또는 인간의 담 낭상피세포로 배양을 Vitrogen 처리 없이 시도하였으나 실 험에 적합한 상태에 이르지 못하였었다. 다행히 본 연구에 사용된 개의 GBEC-CL1은 Vitrogen 도포에 관계없이 성장 분열이 가능하여 완전한 합류를 이루었다.
어떠한 세포의 극성을 알기 위해서는 첨부 구획과 기저 측부 구획이 나뉘어 있는 Transwell을 이용하여 세포를 배양하게 된다.2 2 만일 세포층에서 누출 현상이 있다면, 각각의 구획에 분리하여 자극을 하였을 때, 특정 물질의 극성화된 분비 또는 유출 현상의 관찰은 불가능하다. 일반 적으로 허용되는 오차범위 이내의 누출은 2% 이내이다.2 3 본 실험에서 완전 합류를 이룬 담낭상피세포는 12 5I-apo A-I과 14C-cholesterol 심지어는3H-mannitol의 서로 다른 구 획으로의 누출이 2% 미만이었다. 본 연구에서 12 5I-apo A-I 과 14C-cholesterol을 누출의 표지자로 사용한 것은 콜레스 테롤의 유출 실험의 결과가12 5I-apo A-I과14C-cholesterol의 누출에서 비롯된 것이 아님을 증명하기 위함이었다. 또한
3H-mannitol은 그 분자량이 매우 작아서 배양된 세포층의 세포간 결합 정도를 평가하는 데 일반적으로 널리 사용되 어 왔는데,2 3 3H-mannitol의 누출이 2% 미만이라는 점은 본 연구에 사용된 담낭상피세포 세포층이 극성화된 유출을 관 찰하는 실험에 적합한 세포주라는 것을 의미한다.
배양된 어떤 세포에서 콜레스테롤의 유출 정도를 알기 위해서는 먼저 적절한 콜레스테롤의 세포내 부하가 필수적 이다.7 , 8 ,2 4 ,2 5
연구 초기에는 다른 연구에서와 같이 상용화된 콜레스테롤을 ethanol에 용해시켜서 사용하여, 적절한 자극 을 시행하였으나 능동적인 콜레스테롤의 유출 현상을 관찰 할 수 없었다. 이는 ethanol에 용해된 콜레스테롤의 친수성 의 부족이 원인이 아닌가 추정하여, 담낭상피세포에 좀더 생리적이며 친수성이 있는 모델담즙을 이용하여 콜레스테 롤 부하를 시도하였다. Fig. 4에서 보는 바와 같이 세포내 222
Lee. Study Model for Cholesterol Efflux in Gallbladder Epithelial Cell
콜레스테롤 부하 정도는 매우 만족스러웠다. 한편, 상용화 된 콜레스테롤은 보통 99% 정도의 정제도를 지니고 있으 며, 세포에 독성을 지니는 산화 콜레스테롤이 존재한다.2 6 모델담즙을 제조할 때 사용된 콜레스테롤은 상용화된 콜 레스테롤을 4회에 걸쳐 methanol 침전법에 의해 재결정화 한 다음에 lecithin 및 taurocholic acid와 혼합하였으며, 지 속적으로 질소를 투입하여 용매를 제거한 후 동결건조 시 켜 밀봉 보관하여, 원천적으로 콜레스테롤의 산화를 방지 하였다. 이렇게 제조된 모델담즙을 담낭상피세포에 부하 할 때 전혀 세포에 독성을 보이지 않았다. 흥미로운 사실 은 모델담즙과 함께 배양된 담낭상피세포에서 정규 배지 또는 SFM과 함께 배양된 세포들보다 오히려 더 높은 diphenyltetrazolium의 흡수도를 보인 점이다. 이는 정상 생 체 내의 담낭상피세포가 항상 담즙과 접촉하는 환경에서 생장 및 증식을 하므로 담즙이 담낭상피세포의 생장에 도 움을 주는 것이 아닌가 추정된다.
앞에서 언급한 바와 같이, 향후 진행될 연구는 ABCA1의 담낭상피세포 내에서의 여러 가지 역할의 규명에 있다. 본 연구자가 추정하는 담낭상피세포에 의한 간으로의 역콜레 스테롤 수송의 기전은, 담낭상피세포의 형질세포막의 AP 표면에 존재하는 SR-BI이 과포화된 담즙내 콜레스테롤을 세포 내로 흡수하는 수용체 역할을 하고, 기저측부 표면에 주로 존재하는 ABCA1은 세포내 포화된 콜레스테롤을 기 저측부로 유출시키는 수송체의 역할을 하여, 유출된 콜레 스테롤은 혈장 apo A-I과 함께 HDL을 형성하여 간으로 이 동하는 것이다. 따라서 담낭상피세포 내에 ABCA1 등, 콜 레스테롤의 유출에 관여하는 수송체 또는 수용체가 필수적 으로 존재하여야만 이 연구를 시행할 가치가 있을 것이다.
면역형광염색 및 Western blot 실험에서 각 항체에 특이적 인 ABCA1과 SR-BI의 존재를 담낭상피세포의 형질세포막 에서 확인할 수 있어서, 향후 이와 관련된 연구를 진행하는 데에 적합함을 확인할 수 있었다.
대식세포 및 섬유아세포에서, 콜레스테롤의 포화도 증가 및 cAMP의 자극은 ABCA1의 표출을 증가시키는 인자들로 서 알려져 있으나,2 4 ,2 7 ,2 8
담낭상피세포에서도 같은 결과를 보일지는 미지수였다. 면역형광염색 및 Western blot 실험 에서, 세포내 콜레스테롤의 부하는 ABCA1의 표출을 증가 시킴을 확인할 수 있었다. 그렇다면 실제적으로 담낭상피 세포에서 apo A-I 매개성 콜레스테롤 및 인지질 유출이 있 어야만, 담낭상피세포의 ABCA1이 능동적인 기능을 수행 한다고 주장할 수 있을 것이다. 또한 ABCA1은 콜레스테롤 유출과 함께 병행하여 인지질의 유출을 유도하는 것으로 알려져 있다.2 9 ,3 0 만일 콜레스테롤의 유출과 인지질의 유출 의 양상이 서로 다른 결과를 보인다면 그 결과를 신뢰하기 어렵다. 본 실험에서는, apo A-I이 존재와 cAMP의 자극이
있는 경우에만 콜레스테롤이 과포화된 담낭상피세포에서 기저측부로의 콜레스테롤의 유출이 확인되었다. 이 결과는 인지질의 유출에서도 비슷한 양상으로 관찰되었다. 즉 담 낭상피세포에는 cAMP에 의존하고 ABCA1 조절하는 apo A-I 매개성 콜레스테롤 및 인지질 유출의 기전이 존재하며, 그 유출 방향의 극성은 기저측부 방향임을 확인할 수 있었 다. 한편, 간세포의 SR-BI은 말초조직에서 역수송된 혈장 내 콜레스테롤을 간세포 내로 흡수하는 역할을 주로 하고, 대식세포의 SR-BI은 세포내 콜레스테롤 농도에 따라 때로 는 유출에도 관여한다고 알려져 있다.8 담낭상피세포에서 SR-BI의 역할은 알려진 바 없으나, Western blot에서 콜레 스테롤 부하 후의 그 표출량이 감소하는 것으로 보아, 유출 보다는 담즙 내의 콜레스테롤 흡수에 관여하는 것이 아닌 가 추정되나 향후 이를 규명하기 위한 연구가 필요하리라 생각된다.
결론적으로 Vitrogen의 도포 없는 Transwell에서의 담낭 상피세포 배양, 모델담즙을 사용한 콜레스테롤 및 인지질 의 부하, 그리고 극히 낮은 누출률을 보이면서 능동적인 ABCA 1 및 SR-B1의 표출이 관찰되는 개의 GBEC-CL1 세 포주의 선택 등은, 담낭상피세포의 극성화된 콜레스테롤 및 인지질 유출에 관련된 연구를 수행함에 있어서 매우 유용한 연구 모델이라고 생각된다. 앞으로 이 연구 모델을 사용하여, ABCA1과 SR-BI의 세포내 표출의 위치 확인, ABCA 1과 SR-BI의 조절 및 억제인자의 규명, apo A-I과 ABCA 1 결합의 분자생물학적 기전, ABCA 1의 상위 조절 수용체의 규명 그리고 더 나아가 ABCA1 조절에 의한 혈중 및 담즙 콜레스테롤 강하제의 개발 등에 유용하게 쓰일 수 있으리라 생각된다.
요 약
목적 : 담낭상피세포에 의한 담즙내 콜레스테롤 및 인지 질의 흡수는 규명되었으나, 흡수된 콜레스테롤과 인지질이 어떻게 처리되는지 알려진 바 없다. 본 연구의 목적은 담낭 상피세포에서 극성화된 콜레스테롤 및 인지질 유출에 대한 효과적인 연구모델의 제시에 있다. 대상 및 방법: 개의 GBEC-CL 1을 Vitrogen 도포 없이 Transwell에서 배양하였 다. 모델담즙과 14C-cholesterol 또는 3H-choline의 혼합액을 세포층의 첨부 측에 부하한 후, cAMP 및 apo A-I의 자극에 따른 콜레스테롤과 인지질의 유출을 첨부 및 기저측부 배지 에서 측정하였다. 세포의 증식과 모델담즙의 독성은 MTT 방법으로 측정하였다. 세포층의 누출성은 12 5I-apo A-I 또는
14C-cholesterol 누출 검사법으로 확인하였다. 콜레스테롤과 인지질에 관련된 수송체 또는 수용체는 면역형광염색과 Western blot으로 확인하였다. 결과 : Transwell에 콜라겐 기
223
대한소화기학회지: 제39권 제3호, 2002
질 처리 없이도 세포의 증식은 가능하여 단층의 완전 합류 가 이루어졌으며, 합류 후 첨부 구획과 기저측부 구획 사이 의 누출은 없었다. 콜레스테롤 및 인지질 부하를 위해 사용 된 모델담즙의 세포에 대한 독성은 없었으며, 모델담즙을 부하한 담낭상피세포에서만 cAMP 및 apo A-I의 자극에 따 른 기저측부 우위의 콜레스테롤 및 인지질의 유출 현상이 관찰되었다. 면역형광염색과 Western blot검사에서 담낭상 피세포의 형질세포막을 따라 존재하는 ABCA1과 SR-BI을 확인할 수 있었다. 결론 : 모델담즙을 사용한 Transwell에서 의 GBEC-CL1 배양 방법은 담낭상피세포에서의 극성화된 콜레스테롤 및 인지질 유출 연구에 있어서 유용한 연구 모 델이라고 생각된다.
색인단어 : 담낭상피세포, 콜레스테롤, 인지질, 모델담즙, ABCA 1
감사의 글
본 연구를 지원하고 유용한 조언을 해준 미국 University of Washington, 소화기내과의 Sum P. Lee 및 Rahul Kuver 교수, 그리고 순수 정제된 apo A-I과 ABCA1 항체를 제공 해 준 미국 University of Washington, 내분비 및 대사 연구 소의 John F. Oram 교수에게 특별한 감사의 뜻을 표한다.
세포배양기법과 각종 분자생물학적 방법의 기술적 지원과 자문을 해준 Sum Lee 연구실의 Christopher Savard와 Andrew Shirk에게도 감사드린다.
참 고 문 헌
1. Jacyna MR, Ross PE, Bakar MA, Hopwood D, Bouchier IA.
Characteristics of cholesterol absorption by human gallbladder:
relevance to cholesterolosis. J Clin Pathol 1987;40:524-529.
2. Corradini SG, Elisei W, Giovannelli L, et al. Impaired human gallbladder lipid absorption in cholesterol gallstone disease and its effect on cholesterol solubility in bile. Gastroenterology 2000;118:912-920.
3. Hayashi A, Lee SP. Bidirectional transport of cholesterol between gallbladder epithelial cells and model bile. Am J Physiol 1996;271:G410-G414.
4. Remaley AT, Rust S, Rosier M, et al. Human ATP-binding cassette transporter 1(ABC1): genomic organization and identi- fication of the genetic defect in the original Tangier disease kindred. Proc Natl Acad Sci USA 1999;96:12685-12690.
5. Bodzioch M, Orso E, Klucken J, et al. The gene encoding ATP-binding cassette transporter 1 is mutated in Tangier disease. Nat Genet 1999;22:347-35 1.
6. Brooks-Wilson A, Marcil M, Clee SM, et al. Mutations in ABC1 in Tangier disease and familial high-density lipoprotein deficiency. Nat Genet 1999;22:336-345.
7. Oram, JF, Vaughan AM. ABCA1-mediated transport of cellular cholesterol and phospholipids to HDL apolipoproteins. Curr Opin Lipidol 2000;11:253-260.
8. Ji Y, Jian B, Wang N, et al. Scavenger receptor BI promotes high density lipoprotein-mediated cellular cholesterol efflux. J Biol Chem 1997;272:20982-20985.
9. Oda D, Lee SP, Hayashi A. Long-term culture and partial characterization of dog gallbladder epithelial cells. Lab Invest 1991;64:682-692.
10. Klinkspoor JH, Kuver R, Savard CE, et al. Model bile and bile salts accelerate mucin secretion by cultured dog gallbladder epithelial cells. Gastroenterology 1995;109:264-274.
11. Francis GA, Knopp RH, Oram JF. Defective removal of cellular cholesterol and phospholipids by apolipoprotein A-1 in Tangier disease. J Clin Invest 1995;96:78-87.
12. Kaneko H, Fujiwara T, Mori S, Shigeta S. Evaluation of antiviral agents for adenovirus using the MTT method in vitro. Nippon Ganka Gakkai Zasshi. 2000;104:786-791.
13. Dawson JM, Heatlie PL. Lowry method of protein quanti- fication: evidence for photosensitivity. Anal Biochem 1984;
140:391-393.
14. Della Guardia P, Grossi A, Elisei W, et al. Plasma lipoproteins affect rate of cholesterol absorbed from bile by gallbladder:
preliminary data. Ital J Gastroenterol Hepatol 1999;31: 587-592.
15. Hasegawa T, Makino I. Measurement of apolipoprotein A1 in cholesterol gallstones and gallbladder bile of patients with gallstones. J Gastroenterology 1995;30:96-102.
16. Secknus R, Darby GH, Chernosky A, Juvonen T, Moore EW, Holzbach RT. Apolipoprotein A-I in bile inhibits cholesterol crystallization and modifies transcellular lipid transfer through cultured human gall-bladder epithelial cells. J Gastroenterol Hepatol 1999;14:446-456.
17. Berge KE, Tian H, Graf GA, et al. Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters. Science 2000;290:1771-1775.
18. Chignard N, Mergey M, Veissiere D, et al. Bile acid transport and regulating functions in the human biliary epithelium.
Hepatology 2001;33:496-503.
19. Kuver R, Ramesh N, Lau S, Savard C, Lee SP, Osborne WR.
Constitutive mucin secretion linked to CFTR expression.
Biochem Biophys Res Comm 1994;203:1457-1462.
20. Kuver R, Savard C, Oda D, Lee SP. PGE generates intracellular cAMP and accelerates mucin secretion by cultured dog gallbladder epithelial cells. Am J Physiol 1994;267:G998-G1003.
224
이진. 담낭상피세포의 콜레스테롤 유출에 대한 연구 모델
2 1. Kuver R, Klinkspoor JH, Osborne WR, Lee SP. Mucous granule exocytosis and CFTR expression in gallbladder epithelium. Glycobiology 2000;10:149-157.
22. Holtkamp GM, Van Rossem M, de Vos AF, Willekens B, Peek R, Kijlstra A. Polarized secretion of IL-6 and IL-8 by human retinal pigment epithelial cells. Clin Exp Immunol
1998;112:34-43.
23. Malik JK, Schwarz LR, Wiebel FJ. Assessment of membrane damage in continuous cultures of mammalian cells. Chem Biol Interact 1983;45:29-42.
24. Oram JF, Lawn RM, Garvin MR, Wade DP. ABCA1 is the cAMP-inducible apolipoprotein receptor that mediates choles- terol secretion from macrophages. J Biol Chem 2000;275:
34508-34511.
25. Chambenoit O, Hamon Y, Marguet D, Rigneault H, Rosseneu M, Chimini G. Specific docking of apolipoprotein A-I at the cell surface requires a functional ABCA1 transporter. J Biol Chem 2001;276:9955-9960.
26. Colles SM, Irwin KC, Chisolm GM. Roles of multiple oxidized LDL lipids in cellular injury: dominance of 7 beta-hydroperoxycholesterol. J Lipid Res 1996;37:2018-2028.
27. Bortnick AE, Rothblat GH, Stoudt G, et al. The correlation of ATP-binding cassette 1 mRNA levels with cholesterol efflux from various cell lines. J Biol Chem 2000;275:28634-28640.
28. Oram JF, Mendez AJ, Lymp J, Kavanagh TJ, Halbert CL.
Reduction in apolipoprotein-mediated removal of cellular lipids by immortalization of human fibroblasts and its reversion by cAMP: lack of effect with Tangier disease cells.
J Lipid Res 1999;40:1769-1781.
29. Wang N, Silver DL, Thiele C, Tall AR. ATP-binding cassette transporter A1(ABCA1) functions as a cholesterol efflux regulatory protein. J Biol Chem 2001;276:23742-23747.
30. Haidar B, Mott S, Boucher B, Lee CY, Marcil M, Genest J Jr. Cellular cholesterol efflux is modulated by phospholipid- derived signaling molecules in familial HDL deficiency/
Tangier disease fibroblasts. J Lipid Res 2001;42:249-257.
225