인체이식용 무세포 진피 제조를 위한 바이러스 불활화 공정
배정은1·김진영2·안재형2·최다미2·정효선2·이동혁1·김인섭1*
1한남대학교 생명·나노과학대학 생명과학과 & 바이오의약품안전성검증센터
2한스바이오메드(주) 한스대덕연구소
Virus Inactivation Processes for the Manufacture of Human Acellular Dermal Matrix. Bae, Jung Eun1, Jinyoung Kim2, Jaehyoung Ahn2, Da Mi Choi2, Hyo Sun Jeong1, Dong Hyuck Lee1, and In Seop Kim1*.
1Department of Biological Sciences & Center for Biopharmaceuticals Safety validation, Hannam University, Dae- jeon 305-811, Korea, 2Hans Biomed Corporation, Daejeon 305-811, Korea − Acellular dermal matrix (ADM), produced by decellularization from human cadaveric skin, has been used for various biomedical applications.
A manufacturing process for ADM (SureDermTM) using tri-n-butyl phospahate (TnBP) and deoxycholic acids as the decellularization solution has been developed. The manufacturing process for SureDermTM has 70%
ethanol treatment and ethylene oxide gas sterilization for inactivating infectious microorganisms. The purpose of this study was to examine the efficacy of the 70% ethanol treatment, decellularization process using 0.1%
TnBP and 2% deoxycholic acids, and EO gas sterilization process in the inactivation of viruses. A variety of experimental model viruses for human pathogens, including the human immunodeficiency virus type 1 (HIV- 1), bovine herpes virus (BHV), bovine viral diarrhoea virus (BVDV), hepatitis A virus (HAV), and porcine parvovirus (PPV) were all selected for this study. Enveloped viruses such as HIV-1, BHV, and BVDV were effectively inactivated to undetectable levels by 70% ethanol treatment. However HAV and PPV showed high resistance to 70% ethanol treatment with the log reduction factors of 1.85 and 1.15, respectively. HIV-1, BHV, and BVDV were effectively inactivated to undetectable levels by decellularization process. All the viruses tested were completely inactivated to undetectable levels by EO gas treatment. The cumulative log reduction factors of HIV-1, BHV, BVDV, HAV, and PPV were ≥12.71, ≥18.08, ≥14.92, ≥6.57, and ≥7.18, respectively.
These results indicate that the production process for SureDermTM has a sufficient virus-reducing capacity to achieve a high margin of the virus safety.
Key words: Acellular dermal matrix, 70% ethanol, decellularization, ethylene oxide, virus inactivation
서 론
피부는 바깥 면을 이루고 있는 얇은 층인 표피(epidermis) 와 표피 밑의 보다 깊은 층인 진피(dermis)로 구성되어 있다.
표피는 각질층, 과립층, 유극층, 기저층으로 구성되며, 진피 는 유두층, 망사층, 유두하층으로 구성된다. 진피는 콜라겐 단백질로 만들어진 교원섬유가 주요 구성 성분이고, 그 사 이에 엘라스틴 단백질로 이루어진 탄성섬유가 그물 모양으 로 짜여 있다. 진피는 피부의 대부분을 차지하며, 표피에 영 양분을 공급하여 표피를 지지하고 외부의 손상으로부터 몸 을 보호한다. 또한 수분을 저장하는 능력과 체온 조절의 기 능이 있으며, 감각에 대한 수용체 역할을 하고, 표피와 상호 작용에 의해 피부를 재생하는 기능도 한다[12].
손상된 피부 조직을 재생시키기 위한 방법으로는 환자자
신의 피부를 이식하는 자가이식, 다른 사람의 피부를 이식 하는 동종이식, 동물의 피부를 이식하는 이종이식의 세 가 지 방법이 있다[3, 9, 10, 29, 33]. 이들 방법 중 자가이식이 가장 이상적이지만 손상부위가 광범위한 경우 조직을 확보 할 수 있는 부위에 제한이 따르며 채취 부위가 새로운 상처 부위로 남게 되는 어려움이 있다. 동종이식은 영구적인 생 착 보다는 상처 주변부 세포의 이동과 치유를 돕는 역할을 한다. 동종이식의 경우 사체에서 채취한 표피를 글리세롤 등 에 냉동 보존하여 사용하기도 하며, 사체의 피부에서 면역 반응을 일으킬 수 있는 세포들을 제거한 무세포 진피 (acellular dermal matrix)의 형태로 만들어서 사용하기도 한 다. 그러나 인체 피부 기증자가 부족하여 대안으로 동결 건 조시킨 돼지 피부를 사용하기도 하는데, 이 경우 안정적인 공급의 장점이 있지만, 아직까지 초급성 거부반응 등 해결 해야 할 문제점이 남아 있다[6, 10, 26].
피부조직 내 진피층의 3차원적 구조를 손상시키지 않고 다 양한 구조 단백질 및 성분들을 유지한 상태에서 면역반응의 대상인 세포성 항원만을 선별적으로 제거한 무세포 진피는
*Corresponding author
Tel: 82-42-629-8754, Fax: 82-42-629-8751 E-mail: inskim@hnu.kr
다양하게 의료용 소재로 사용되고 있다[1, 8, 38]. 무세포 진 피는 화상, 교통사고, 궤양 등으로 인한 피부결손 환자에게 이식해 피부를 복원시키는 인체이식용 피부조직으로 전층 피 부, 비중격, 뇌척수 경막결손창의 재건뿐 아니라 함몰 반흔 교정, 반안면 위축 교정, 유두 재건, 입술 확대의 재건성형 및 미용성형면에서 그 이용범위가 확대되어 왔다[7, 25, 34, 37].
사람의 피부조직을 재료로 하여 생산되는 이식용 무세포 진피는 원료 자체에 감염성 병원인자(바이러스, 세균, 곰팡 이 등)가 오염될 가능성이 있다. 인체조직은 hepatitis B virus(HBV), hepatitis C virus(HCV), human immunodefi- ciency virus(HIV), Human T cell leukaemia virus(HTLV) I과 II, cytomegalovirus, herpes simplex virus 같은 외피 바이러스(enveloped virus)와 hepatitis A virus(HAV), human parvovirus B19(B19) 같은 비-외피 바이러스(non- enveloped virus) 등 다양한 바이러스에 오염된 사례가 있다 [2, 5, 14, 24, 36]. 조직은행에서는 기증자의 안전성 확보를 위해 기증자의 병력을 검토하고, 기증자의 신체에 대한 육 안 검사를 통해 감염의 증후, 외상 등 조직의 성상에 영향을 주는 요인의 유무를 확인하고, 또한 기증자의 혈액검사 및 조직에 대한 미생물학적 검사를 통해 감염질환에 대한 선별 검사를 실시한다. 인체조직에 오염될 수 있는 감염성 위해 인자 중 바이러스에 대한 안전성을 보증하기 위해 인체조직 기증자의 혈액검사 검사를 통해 HBV, HCV, HIV, HTLV를 검사한다[16]. 이러한 바이러스 검사는 혈액이나 조직에 존 재할지도 모를 위해 바이러스를 모두 검사하기 보다는 특정 지표 바이러스들을 대상으로 수행된다. 이러한 특정지표 바 이러스 조사만으로는 현재 수행하고 있는 분석 방법으로는 검색되지 않는 변이주 또는 미동정 바이러스를 검색할 수가 없어 인체조직의 안전성을 보증할 수가 없다. 또한 바이러 스 검사를 위해 조직의 일부만 채취하기 때문에 검사의 한 계가 있고, 만약 바이러스가 너무 낮은 농도로 존재하여 검 출한계 이하라면 검사의 오류를 범할 수 있다[39].
세포 진피는 한 사람의 기증자로부터 불특정 다수의 수혜 자에게 이식이 가능하다는 것이 특징이다. 따라서 이식을 위 해 채취한 조직이 바이러스에 오염되었을 경우 그 오염이 많 은 사람들에게 전파될 수 있다. 따라서 무세포 진피 제조공 정은 바이러스 안전성을 보증하기 위해서 인체조직 내재 또 는 혼입 가능 위해 바이러스에 대한 제거 및 불활화 공정을 포함하여야 한다. 또한 바이러스 제거 및 불활화 정도가 과 학적이고, 합리적으로 검증되어야만 한다[19].
무세포 진피를 제조하기 위해 면역원성 세포 제거 방법으 로 trypsin 또는 dispase 같은 단백질 분해 효소를 사용하거 나, 반복적인 동결-해동, NaCl과 SDS 처리 방법 등이 사용 되어 왔는데, 이러한 공정으로 만들어진 무세포 진피는 많 은 항원성분을 지니고 있어 수여부에 이식 시 면역거부반응 을 일으켜 결과적으로 낮은 생착률을 초래하였다[27, 35, 38].
또한 바이러스를 효과적으로 제거 또는 불활화시키는 공정
을 포함하지 않고 있어 안전성을 보증할 수가 없었다. 따라 서 바이러스 안전성이 보증되고, 생체적합성과 치유 능력이 향상된 무세포 진피 제조 공정의 개발이 요구되었다. 이에 Tri-n-butyl phospahate(TnBP)와 deoxycholic acids를 사용 하여 피부조직 내 진피층의 3차원적 구조를 손상시키지 않 고 다양한 구조 단백질 및 성분들을 유지한 상태에서 면역 반응의 대상인 세포성 항원만을 선별적으로 제거한 이식용 동종 무세포 진피인 SureDermTM을개발하였다. SureDermTM 은 면역반응을 일으키는 표피와 진피에 있는 세포들을 제거 한 후 급속 동결 및 건조하여 진피층의 3차원 구조를 그대 로 유지한 인체이식재이다. SureDermTM제조공정은 감염성 위해인자 불활화 공정으로 70% 에탄올 처리와 산화에틸렌 가스 처리 공정을 포함하고 있다.
본 연구에서는 SureDermTM의 바이러스 안전성을 평가하 기 위해 70% 에탄올 처리, 세포제거용액 처리, 산화에틸렌 가스 처리에 의한 바이러스 불활화 효과를 검증하고자 하였 다. 바이러스 불활화 효과를 검증하기 위해 5종의 바이러스 [HIV type 1(HIV-1), bovine herpes virus(BHV), Bovine viral diarrhoea virus(BVDV), HAV, porcine parvovirus (PPV)]를 생물학적 지표로 사용하였다.
재료 및 방법 인체이식용 무세포 진피 제조 공정
미국 FDA 및 미국조직은행연합회에서 승인한 조직은행 을 통해 기증된 피부조직을 사용하여 인체이식용 무세포 진 피인 SureDermTM을 생산하였다(Fig. 1). 인체조직 기증자의 혈액검사 검사를 통해 HBV, HCV, HIV, HTLV와 매독 감 염 여부를 확인하고, 세균 검사를 통해 안전성이 확인된 피 부를 재료로 사용하였다. 입고된 사체 피부는 원재료 시험 검사를 실시한 후 조직을 보호하는 보호 용액을 세척하고, 70% 에탄올을 20분간 처리하였다. 면역반응의 항원 대상인 표피를 제거하기위해 표피제거용액으로 24시간 처리하였다.
생리식염수로 5분씩 6회에 걸쳐 세척하여 표피제거용액을 제거하였다. 면역거부반응을 일으키는 진피 내 세포를 제거 하기 위해 0.1% TnBP와 2% Deoxycholic acids로 구성된 세포제거용액을 10시간동안 처리하였다. 세포제거가 끝난 후 생리식염수로 세척을 하여 세포제거용액을 제거하였다. 무 세포 진피의 보존 및 보관을 용이하게 하기 위해 동결건조 를 실시하였다. 동결건조한 무세포 진피를 포장용기에 넣어 포장한 후 산화에틸렌 가스로 멸균하여 최종 제품을 생산하 였다. 70% 에탄올 처리, 세포제거용액 처리, 산화에틸렌 가 스 멸균에 의한 바이러스 불활화 효과를 검증하기 위해 SureDermTM 제조공정에서 각 단계별 조직을 확보하였다.
무세포 진피의 조직학적 검사
SureDermTM 제조공정을 통해 생산된 무세포 진피에서 진
피층 매트릭스의 미세 구조 변화가 있는지와 세포가 제거되 었는지의 여부를 확인하기 위해서 조직학적 평가를 실시하였 다. 정상피부조직과 무세포 진피의 세포 배열과 형태학적 변 화를 비교하기 위해 핵과 세포질을 구분해서 볼 수 있는 H&E(hematoxylin and eosin) 염색을 하였다. 조직을 10% 포 르말린에 넣고 고정시킨 다음, 파라핀에 침지시켰다. 침지되 어 고정된 조직을 4 µm 두께로 절편하여 슬라이드를 제작하 였다. Xylene을 이용하여 파라핀을 제거하고 다시 무수알코 올로 xylene을 제거하였다. 100%, 95%, 80%, 70% 에탄올에 각각 1분간 처리하고 증류수에 10분간 넣어 수화과정을 마친 뒤 hematoxylin으로 핵을 염색하였다. 다시 흐르는 물에 1분 간 슬라이드 뒷면을 대고 세척하였다. 70% 알코올을 처리한 뒤 5분간 흐르는 물에 슬라이드 뒷면을 대고 세척하였다.
Eosin 염색을 3분간 하고 10초간 흐르는 물에 세척하였다.
70%에서 100% 알코올로 순차적으로 탈수를 하고 canada balsam으로 고정한 후 현미경으로 관찰 및 촬영을 하였다.
바이러스 배양 및 정량
본 연구를 위해 사용한 바이러스들의 특성은 Table 1과 같다. HIV-1(HBX2 strain), BHV(ATCC VR 188), BVDV (ATCC VR 534), HAV(ATCC VR 1402), PPV(ATCC VR 742)의 배양과 정량을 위해 C8166-45 세포, Minipig Kidney (MPK) 세포(ATCC CCL 166), bovine turbinate(BT) 세포 (ATCC CRL 1390), FRhK-4 세포(ATCC CRL 1688), Minipig Kidney(MPK) 세포(ATCC CCL 166)를 각각 사용 하였다[11, 21, 22]. HIV-1(HBX2 strain)과 C8166-45 세포 는 성균관대학교 배용수 교수에게 분양받아 사용하였다.
C8166-45 세포는 10% fetal bovine serum(FBS: Gibco BRL, Gaithersburg, USA)를 첨가한 RPMI 1640 배지에 배 양하였다. 다른 세포들은 10% FBS를 첨가한 Dulbecco's Minimun Essential Medium(DMEM: Gibco BRL)에 배양 하였다. 바이러스 배양을 위해서는 2% FBS가 첨가된 배지 를 사용하였다. T-175 flask에 배양된 단층 세포에 바이러 스를 감염시킨 후 주기적으로 HIV의 경우 거대세포 (syncitium), 다른 바이러스들의 경우에는 세포병변효과 (cytopatic effect)를 관찰하였다. 거대세포 또는 세포병변효 과가 명백하게 관찰될 때 배양액과 세포를 수거한 다음, 400×g에서 7분간 원심분리하여 상층액은 따로 모으고 침전 물은 현탁하였다. 침전물을 동결과 해빙과정을 2회 반복하 여 파쇄한 후 400×g에서 7분간 원심분리하여 상등액을 얻 었다. 원심 상등액을 혼합한 후 0.45 µm 필터로 여과한 다 음 소분하여 -70oC에 보관하였다.
본 연구에서는 감염성 있는 바이러스의 역가를 50% 조직 배양감염용량[50% tissue culture infectious dose(TCID50)]
으로 나타내었다[20]. 바이러스 불활화 실험 시 바이러스 역 가를 정확하게 측정하기 위해서 먼저 바이러스를 첨가하지 않은 음성대조 실험에서 취한 시료들이 바이러스의 정량 분
석을 위해 사용되는 세포에 세포독성을 나타내는지, 바이러 스 정량분석에 간섭효과를 일으키는지를 먼저 실험하였다 [17]. 바이러스 불활화 실험 중 취한 시료들을 세포독성과 간 섭효과를 나타내지 않은 농도로 바이러스 배양 배지를 사용 하여 희석하였다. 희석된 시료를 7배수로 희석하여 HIV-1의 경우 96 well plate에 배양된 세포에 0.1 mL씩, BHV, BVDV, HAV, PPV의 경우에는 24 well plate에 배양된 세포 에 0.25 mL씩 접종하였다. 각 바이러스의 양성 대조구로 역 가를 알고 있는 바이러스를 7배수로 희석하여 각 plate에 배 양된 세포에 접종하였다. 음성대조군으로 바이러스가 첨가 되지 않은 배양배지를 접종하였다. 그 후 CO2배양기에서 35oC로 배양하면서 계속적으로 현미경으로 거대세포 또는 세포병변효과를 관찰하였다. 감염성 바이러스가 검출되지 않 을 때, 즉 검출한계 이하로 관찰될 때에는 바이러스의 역가 를 95% 신뢰도를 가지고 이론적 최소 검출량(a theoretical minimal detection level)을 사용하여 계산하였다[17, 23]. 바 이러스의 농도가 낮을 경우 시료에 감염성 바이러스가 없을 확률은 c=ln p/-v라는 Poisson 분포를 따르게 되는데, c는 mL 당 감염성 바이러스의 농도, p는 시료에 감염성 바이러 스가 없을 확률, v는 시료의 부피를 나타낸다. 95% 신뢰도 로 이론적 최소 검출량을 계산할 때 p는 0.05이다.
불활화 효과 실험
70% 에탄올 처리, 세포제거용액 처리, 산화에틸렌 가스 멸균에 의한 불활화 효과를 검증하기 위해 각 단계별로 확 보한 피부조직을 동결건조한 후 각 바이러스를 첨가하여 바 이러스 용액이 피부조직에 침투하도록 하였다. 각 불활화 공 정을 실시한 후 조직에서 각 바이러스를 회수하여 정량한 후 불활화 정도를 비교하였다. 조직으로부터 바이러스를 회수 하기 위해 세포배양배지를 첨가한 후 혼합 실험기(vortex mixer)를 이용하여 격렬하게 반응시킨 후 바이러스를 추출 하였다. 바이러스 추출은 바이러스 회수율이 90% 이상이 되 게 3차례이상 실시하였다.
70% 에탄올 처리 공정에서 바이러스 불활화 검증 70% 에탄올 처리 공정에서 각 바이러스들의 불활화 정도 를 비교하였다. 동결건조한 3×3 cm 피부에 바이러스를 1 mL 첨가하여 바이러스 용액을 조직속으로 침투시켰다. 바이 러스를 첨가한 조직으로부터 바이러스를 회수하여 즉시 정 량하였다. 또한 바이러스가 첨가된 피부를 70% 에탄올에 2.5 분, 5분, 10분, 20분간 처리한 후 바이러스를 회수하여 즉시 정량하였다.
세포제거용액 처리 공정에서 바이러스 불활화 검증 표피가 제거된 진피를 4×5 cm로 자른 후 동결건조를 하 였다. 각 바이러스를 4 mL 첨가하여 바이러스 용액을 조직 속으로 침투시켰다. 바이러스를 첨가한 조직으로부터 바이
러스를 회수하여 즉시 정량하였다. 0.1% TnBP와 2%
deoxycholic acids로 구성된 세포제거용액을 처리한 후 5, 30, 60, 120분 간격으로 바이러스를 회수하여 즉시 정량하 였다.
산화에틸렌 가스 처리 공정에서 바이러스 불활화 검증 세포가 제거된 3×3 cm 무세포 진피에 바이러스를 3 mL 첨가한 후 동결건조를 하였다. 동결건조한 무세포 진피로부 터 바이러스를 회수하여 즉시 정량하였다. 또한 바이러스를 첨가한 무세포 진피에 산화에틸렌 가스를 처리한 후 바이러 스를 회수하여 불활화 정도를 비교하였다. 산화에틸렌 가스 멸균에 의한 감염성 위해인자 불활화 검증을 위해 37oC, 상 대습도 60% 조건에서 1,000 mg/L의 산화에틸렌 가스 농도 로 4시간 동안 처리하였다. 무세포 진피에 잔존하는 산화에
틸렌 가스가 바이러스 정량 분석을 위한 감염성 세포주에 독 성을 일으킬 수 있기 때문에 무세포 진피로부터 바이러스를 회수하기 전에 산화에틸렌 가스를 제거하기 위해 상온에서 24시간 보관하였다. 산화에틸렌 가스 멸균 공정을 규정한 ISO 11135 규정에 준하여 검증을 실시하였다[18].
바이러스 감소인수(Virus reduction factor)의 계산 바이러스 정량 분석이 끝난 후 그 결과를 기초로 각 공정 에서 바이러스 감소인수를 구하였다. 바이러스 감소인수는 바이러스가 첨가된 공정출발물질에 존재하는 바이러스 양의 log 값에서 공정진행 후에 존재하는 바이러스 양의 log 값을 뺀 log 감소인수(reduction factor)로 정의하였다[11, 17]. 모 든 실험은 독립적으로 두 번 실시하여 평균값을 구하였다.
결 과
무세포 진피의 조직학적 특성
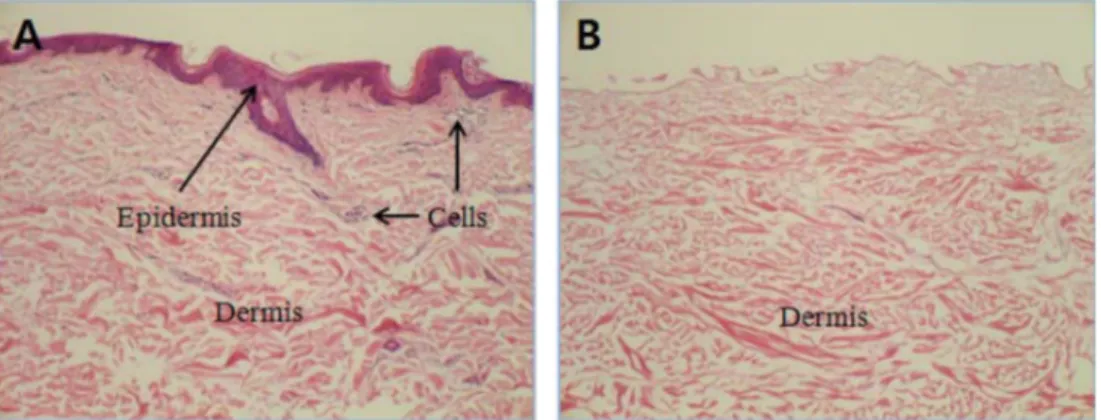
정상피부와 0.1% TnBP와 2% deoxycholic acids로 구성 된 세포제거용액을 처리하여 생산된 무세포 진피의 조직학 적 미세구조를 H&E 염색 후 비교하였다(Fig. 2). 정상피부 에는 표피와 세포들이 존재하고 있지만 무세포 진피에는 면 역반응의 대상인 표피와 세포성 항원이 존재하지 않았다. 무 세포 진피의 미세구조는 정상피부의 진피 내 미세구조와 차 이가 없었다.
70% 에탄올 처리에 의한 바이러스 불활화
70% 에탄올을 처리하면서, 처리시간에 따른 바이러스 불 활화 효과를 비교 검증하였다(Table 2). HIV-1, BHV, BVDV와 같은 외피 바이러스는 2.5분 안에 검출한계이하로 완벽하게 불활화되었다. HIV-1, BHV, BVDV의 log 바이러 스 감소인수는 각각 ≥3.66, ≥6.36, ≥4.66이었다. 하지만 HAV와 PPV 같은 비-외피 바이러스는 70% 에탄올에 큰 저 항성을 나타내었다. HAV의 경우 초기 바이러스 역가가 6.20 log10 TCID50에서 처리 시간에 비례하여 점진적으로 감소하 여, 20분 처리 후 4.35 log10 TCID50를 나타내어 log 바이러 스 감소인수는 1.85이었다. PPV의 경우에도 초기 바이러스 역가가 6.56 log10 TCID50에서 처리 시간에 비례하여 점진 적으로 감소하였지만, 20분 처리 후 5.41 log10 TCID50를 나 타내어 log 바이러스 감소인수는 1.15이었다.
Fig. 1. Flow diagram of manufacturing process for acellular dermal matrix (SureDermTM). The boxes indicate the validation steps evaluated for virus inactivation.
Table 1. Salient features of viruses used for the evaluation of virus clearance.
Virus Family Genome Envelop Size
(nm)
Resistance to physicochemical reagents Human immunodeficiency virus type 1 (HIV-1) Retroviridae ss-RNA Yes 100 Low
Bovine herpes virus (BHV) Herpesviridae ds-DNA Yes 100-200 Medium
Bovine viral diarrhea virus (BVDV) Flaviviridae ss-RNA Yes 45-55 Medium
Hepatitis A virus (HAV) Picornaviridae ss-RNA No 27-32 Medium-High
Porcine parvovirus(PPV) Parvoviridae ss-DNA No 18-26 High
세포제거용액 처리에 의한 바이러스 불활화
0.1% TnBP와 2% deoxycholic acids을 처리하면서, 처리 시간에 따른 바이러스 불활화 효과를 비교 검증하였다(Table 3). HIV-1, BHV, BVDV와 같은 외피 바이러스는 5분 안에 검출한계이하로 완벽하게 불활화되었다. 세포제거용액 처리 에 의한 HIV-1, BHV, BVDV의 log 바이러스 감소인수는 각각 ≥4.90, ≥6.43, ≥5.34이었다.
산화에틸렌 가스 처리에 의한 바이러스 불활화
바이러스에 대한 산화에틸렌 가스 멸균 효과를 조사하였 다(Table 4). 산화에틸렌 가스 처리에 의해 HIV-1, BHV,
BVDV와 같은 외피 바이러스뿐만 아니라 HAV, PPV 같은 비-외피 바이러스 모두 검출한계 이하로 불활화되었다. EO 가스 멸균에 의한 HIV-1, BHV, BVDV, HAV, PPV의 log 바이러스 감소인수는 각각 ≥4.15, ≥5.29, ≥4.92, ≥4.72,
≥6.03이었다.
고 찰
생체적합성과 치유 능력이 향상된 무세포 진피를 제조하 기 위해서는 진피층의 3차원 구조를 그대로 유지하면서 면 역거부반응을 일으키는 진피 내 세포들만 완벽하게 제거하 는 공정의 개발이 필요하다. 또한 동종피부에 오염될 가능 Table 2. Inactivation of viruses during 70% ethanol treatment.
Sample Total virus titer (Log10 TCID50)
HIV-1 BHV BVDV HAV PPV
Spiked starting material 5.75 8.45 6.75 6.20 6.56
2.5 min after 70% ethanol treatment NDa(≤2.09)b ND(≤2.09) ND(≤2.09) 5.93 6.36 5 min after 70% ethanol treatment ND(≤2.09) ND(≤2.09) ND(≤2.09) 5.67 6.06 10 min after 70% ethanol treatment ND(≤2.09) ND(≤2.09) ND(≤2.09) 5.14 5.76 20 min after 70% ethanol treatment ND(≤2.09) ND(≤2.09) ND(≤2.09) 4.35 5.41
Log reduction factor ≥3.66 ≥6.36 ≥4.66 1.85 1.15
aNo infectious virus was detected.
bThese values were calculated using a theoretical minimum detectable level of infectious virus with a 95% confidence level.
Table 3. Inactivation of viruses during decellularization process using 0.1% TnBP and 2% deoxycholic acids.
Sample Total virus titer (Log10 TCID50)
HIV-1 BHV BVDV
Spiked starting material 6.38 7.91 6.82
5 min after decellularization process ND(≤1.48) 1.64 ND(≤1.48)
30 min after decellularization process ND(≤1.48) ND(≤1.48) ND(≤1.48)
60 min after decellularization process ND(≤1.48) ND(≤1.48) ND(≤1.48)
120 min after decellularization process ND(≤1.48) ND(≤1.48) ND(≤1.48)
Log reduction factor ≥4.90 ≥6.43 ≥5.34
aNo infectious virus was detected.
bThese values were calculated using a theoretical minimum detectable level of infectious virus with a 95% confidence level.
Fig. 2. Histological photographs of human cadaveric skin (A) and acellular dermal matrix (B). The specimens were stained with H&E.
성이 있는 감염성 위해인자에 대한 안전성을 보증하기 위해 서는 무세포 진피의 화학적 구조와 물성에 영향을 미치는 않 는 소독 및 멸균공정의 확립이 필요하다. 동종 무세포 진피 인 SureDermTM제조공정은 이러한 요구를 충족시키는 70%
에탄올 소독공정, TnBP와 Deoxycholic acids를 사용한 진피 내 세포 제거 공정, 산화에틸렌 가스멸균 공정을 포함하고 있다(Fig. 1).
일반적으로 사람 혈장 유래 의약품의 바이러스 제거 또는 불활화를 위해 열처리, 용매/계면활성제 처리, low pH 처리, 바이러스 필터 공정과 같은 의도적인 바이러스 제거/불활화 공정을 적용하고 있으나[4, 15, 17], 인체조직 이식재인 무 세포 진피는 3차원의 단백질 구조로 이루어져 있어 바이러 스를 제거 또는 불활화 하기가 쉽지 않다. 또한 열처리, low pH 처리 등의 방법들은 진피 내 단백질의 변성을 일으킬 수 있어 그 사용이 제한적이다. 용매/계면활성제 처리는 단백질 의 활성에 영향을 미치지 않고, HIV, HBV, HCV 등 외피보 유바이러스를 효과적으로 사멸시키는 방법으로 혈장 유래 단백질 제제(면역글로불린, 혈액응고인자 제8인자, 혈액응고 제9인자, 안티트롬빈 III 등) 제조공정에서 화학적 바이러스 불활화 공정으로 사용되어 왔다. 주로 사용되는 용매는 TnBP 이며, 계면활성제로는 Tween 80, Triton X-100, 또는 sodium cholate가 사용된다. 용매/계면활성제 처리는 외피보 유바이러스의 지질막을 파괴함으로 해서 바이러스를 불활성 화 시키며, 그 불활화 효과는 처리 시간과 온도에 따라 달라 진다[13, 21]. SureDermTM 제조과정 중 TnBP/deoxycholic acids를 이용한 세포제거공정은 진피 내 세포들을 제거하기 위한 목적뿐만 아니라 외피보유바이러스를 효과적으로 불활 화시키기 위해 개발되었다.
혈장유래의약품 또는 동물세포를 이용하여 생산하는 단백 질의약품의 제조공정에서 바이러스 불활화 검증 실험은 단 백질 용액에 바이러스를 첨가하고 불활화 공정을 진행하면 서 시간별로 또는 공정별로 시료를 분취하여 감염성 세포주 에 접종하고 바이러스를 배양한 후 감염성 바이러스 입자의 수를 정량하는 과정을 통해 진행된다. 이때 첨가한 바이러 스가 단백질 용액에서 고루 혼합되도록 교반을 하는 것이 필 요하다. 피부와 같은 인체조직은 단백질 용액과는 다른 고 형성분이기 때문에 바이러스 불활화 검증 실험을 위해 첨가 하는 바이러스가 조직속에 골고루 침투하기가 쉽지 않다. 본
연구에서는 피부조직 안에 바이러스가 고루 침투할 수 있도 록 조직을 동결건조 후 바이러스를 첨가하였다.
감염성 위해인자 불활화를 위한 소독 및 멸균 공정에서 바이러스 불활화 효과 평가 연구를 위한 생물학적 지표 선 택 시 고려하여야만 할 사항은 다음과 같다. 첫째, 검증을 위해 사용될 생물학적 지표는 인체조직에 오염 가능성이 있 는 감염성 위해인자 그 자체 또는 가장 유사한 미생물이어 야 한다. 또한 다양한 물리·화학적 성질의 생물학적 지표 를 선택하여 불활화 효과검증을 함으로 해서 일반적으로 모 든 종류의 감염성 위해인자를 불활화할 수 있다는 것을 보 여 주어야 한다. 둘째, 선택된 생물학적 지표는 되도록 물 리·화학적 처리에 큰 저항성을 나타내는 것이어서 다른 미 지의 또는 동정되지 않은 감염성 위해인자의 불활화를 보장 할 수 있어야 한다. 셋째, 검증용 생물학적 지표는 되도록 쉽게 분석 가능하며 고농도로 배양할 수 있어야 한다. 넷째 , 선택된 생물학적 지표는 시험자에게 감염의 위험이 적어야 한다. 본 연구에서는 무세포 진피 제조공정의 바이러스 불 활화 효과 검증을 위한 지표 바이러스로 HIV와 HTLV의 모 델 바이러스인 HIV-1, Herpes virus와 Cytomegalovirus의 모델 바이러스인 BHV, HCV의 모델 바이러스인 BVDV, B19의 모델 바이러스인 PPV, 그리고 HAV를 선정하였다 (Table 1). 이러한 바이러스들은 일반적으로 사람 체액, 혈액 및 조직 유래 바이오의약품 제조공정의 바이러스 안전성 검 증을 위해 사용되고 있다[11, 21].
일반적으로 소독의 개념은 비교적 약한 살균력을 이용하 여 병원미생물의 성장을 억제하거나 파괴하여 감염의 위험 성을 없애는 조작으로 소독제에 민감한 미생물만을 사멸시 킨다[32]. 조직과 조직을 다루는 용기는 주로 알코올을 사용 하여 소독하고 있다. 알코올은 인지질을 녹여내고, 단백질을 변성 시켜 살균 효과를 나타낸다[30]. 피부 조직을 소독하기 위해 70% 에탄올로 20분간 처리하는 공정은 외피 바이러스 (HIV-1, BHV, BVDV)에 대해 완벽한 불활화 효과를 나타내 지만, 비-외피 바이러스(HAV, PPV)에 대해서는 불활화 효 과가 미미하였다(Table 2).
진피내 세포들을 제거하기 위해 사용하는 TnBP/deoxy- cholic acids는 세포들을 효과적으로 제거할 뿐만 아니라 외 피보유바이러스 불활화 능력도 탁월하였다. HIV-1, BHV, BVDV와 같은 외피보유바이러스를 피부조직에 오염시킨 후 Table 4. Inactivation of viruses during ethylene oxide treatment.
Sample Total virus titer (Log10 TCID50)
HIV-1 BHV BVDV HAV PPV
Before ethylen oxide treatment 5.73 6.87 6.50 6.30 7.61
After ethylen oxide treatment NDa(≤1.58)b ND(≤1.58) ND(≤1.58) ND(≤1.58) ND(≤1.58)
Log reduction factor ≥4.15 ≥5.29 ≥4.92 ≥4.72 ≥6.03
aNo infectious virus was detected.
bThese values were calculated using a theoretical minimum detectable level of infectious virus with a 95% confidence level.
세포제거용액에 처리하자마자 5분안에 완벽하게 불활화되었 다(Table 3). SureDermTM제조 시 세포제거용액 처리 시간 은 10시간이지만 처리 5분 안에 첨가한 바이러스가 완벽하 게 불활화 되었기 때문에 피부조직에 오염된 바이러스의 양 에 관계없이 완벽한 불활화가 가능하다고 판단된다.
산화에틸렌 가스 멸균은 온도에 민감한 기구나 인체조직 을 멸균하는데 널리 사용되고 있다. 산화에틸렌 가스는 RNA 또는 DNA에 알킬화(alkylation) 반응을 야기하여 감염성 위 해인자들의 유전체를 파괴함으로써 바이러스, 세균, 곰팡이 를 불활화시킨다[28, 31]. 산화에틸렌 가스 멸균이 효과적으 로 이루어지기 위해서는 적절한 노출시간(2-5시간), 산화에 틸렌 가스 농도(450-1200 mg/L), 처리 온도(29-65oC), 상대 습도(45-85%)가 중요한데, 감염성 위해인자 불활화 검증을 위해 37oC, 상대습도 60% 조건에서 1,000 mg/L의 산화에 틸렌 가스 농도로 4시간 동안 처리한 후 바이러스 불활화 효과를 조사하였다(Table 4). 산화에틸렌 가스 처리에 의해 바이러스 모두 검출한계 이하로 불활화되었다. 이와 같은 결 과에서 산화에틸렌 가스 공정은 바이러스를 모두 불활화할 수 있는 공정임을 확인하였다.
바이러스 불활화 검증 연구의 해석을 위해 전체적인 바이 러스 감소인수는 독립된 공정에서 얻은 바이러스 감소인수 의 합(Cumulative log reduction factor)으로 나타낸다. 세가 지 공정에서 HIV-1, BHV, BVDV, HAV, PPV에 대한 log 바이러스 감소인수 합은 각각 ≥12.71, ≥18.08, ≥14.92,
≥6.57, ≥7.18이었다(Table 5).
인체조직 이식재의 소독 및 멸균 공정은 다양한 물리·화 학적 특성을 갖는 광범위한 영역의 바이러스에 대하여 효과 적인 불활화 공정을 포함하여야 한다. 이식용 사람 무세포 진피의 안전한 소독과 멸균을 위해서 최초의 감염성 위해인 자 불활화공정에서 남아 있는 감염성 위해인자를 두 번째 공 정 단계에서 효과적으로 불활화할 수 있도록 상호보완적인 두 단계 공정을 포함하는 것이 바람직하다. 특정 불활화공 정에서 감염성 위해인자 불활화 효과가 매우 크다고 할지라 도, 부적절하게 공정이 진행될 수도 있고, 그 공정에 저항성 을 갖는 새로운 감염성위해인자가 오염될 수도 있기 때문이 다. SureDermTM제조공정은 70% 에탄올 소독 공정, 용매/
계면활성제 처리 공정, 산화에틸렌 가스 멸균 공정과 같이 서로 작용기작이 다른 바이러스 불활화 공정을 포함하고 있
고, 각 공정의 바이러스 불활화 효율이 매우 크기 때문에 기 증된 피부조직에 감염성 바이러스가 오염되어 있다 할지라 도 안전성을 보증할 수 있는 충분한 바이러스 불활화 능력 을 갖고 있는 것으로 판단된다.
요 약
사체 피부에서 면역반응을 일으킬 수 있는 세포들을 제거 한 무세포 진피는 다양한 의료용 소재로 사용되고 있다. Tri- n-butyl phospahate(TnBP)와 deoxycholic acids를 세포제거 용액으로 사용하여 피부조직 내 진피층의 3차원적 구조를 손상시키지 않고 다양한 구조 단백질 및 성분들을 유지한 상 태에서 면역반응의 대상인 세포성 항원만을 선별적으로 제 거한 이식용 동종 무세포 진피인 SureDermTM을개발하였다.
SureDermTM 제조공정은 감염성 위해인자 불활화 공정으로 70% 에탄올 처리와 산화에틸렌 가스 처리 공정을 포함하고 있다. 본 연구에서는 SureDermTM제조공정 중 70% 에탄올 소독 공정, 세포제거용액(0.1% TnBP와 2% deoxycholic acids) 처리 공정, 산화에틸렌 가스 멸균의 바이러스 불활화 효과를 검증하기 위해 국제적 가이드에 따라 5종의 바이러 스 [human immunodeficiency virus type 1(HIV-1), bovine herpes virus(BHV), Bovine viral diarrhoea virus(BVDV), hepatitis A virus(HAV), porcine parvovirus(PPV)]를 생물 학적 지표로 사용하였다. 피부조직에 각 생물학적 지표를 첨 가한 후 불활화 공정을 실시한 다음 각 바이러스를 회수하 여 정량한 후 불활화 정도를 비교하였다. 70% 에탄올 20분 처리 공정에서 HIV-1, BHV, BVDV 같은 외피 바이러스는 처리 시간 2.5분 안에 불활화되었지만, HAV와 PPV 같은 비 -외피 바이러스는 에탄올에 저항성을 나타내어 20분 처리 후 log 바이러스 감소인수가 각각 1.85와 1.15였다. 세포제거용 액 처리 공정에서 HIV-1, BHV, BVDV는 각각 5분, 30분, 5분 안에 검출한계 이하로 불활화되었다. 산화에틸렌 가스 처리에 의해 본 연구에 사용한 모든 바이러스가 검출한계 이 하로 불활화되었다. 3가지 공정에서 HIV-1, BHV, BVDV, HAV, PPV에 대한 log 바이러스 감소인수 합은 각각
≥12.71, ≥18.08, ≥14.92, ≥6.57, ≥7.18이었다. 이와 같은 결 과에서 SureDermTM제조공정은 바이러스 안전성을 보증할 수 있는 충분한 바이러스 불활화 능력을 갖고 있는 것으로
Table 5. Cumulative log reduction factors of viruses achieved during the manufacturing process of SureDermTM.
Process step Enveloped viruses Non-enveloped viruses
HIV-1 BHV BVDV HAV PPV
70% ethanol treatment ≥3.66 ≥6.36 ≥4.66 1.85 1.15
Decellularization process ≥4.90 ≥6.43 ≥5.34 -* -
Ethylen oxide treatment ≥4.15 ≥5.29 ≥4.92 ≥4.72 ≥6.03
Cumulative log reduction factor ≥12.71 ≥18.08 ≥14.92 ≥6.57 ≥7.18
*Not determined.
판단된다.
감사의 글
본 연구는 교육과학기술부와 한국산업기술진흥원의 지역 혁신인력양성사업과 식품의약품안전청 용역연구개발사업으 로 수행된 연구결과이며 이에 감사드립니다.
REFERENCES
1. Altman, A. M., N. Matthias, Y. Yan, Y. H. Song, X. Bai, E.
S. Chiu, D. P. Slakey, and E. U. Alt. 2008. Dermal matrix as a carrier for in vivo delivery of human adipose-derived stem cells. Biomaterials 29: 1431-1442.
2. Biswas, S., P. Suresh, R. E. Bonshek, G. Corbitt, A. B. Tullo, and A. E. A Ridgway. 2000. Graft failure in human donor corneas due totransmission of herpes simplex virus. Br. J.
Ophthalmol. 84: 701-705.
3. Bjarne, B. and F. Alsbjrn. 1992. Biologic wound coverings in burn treatment. World J. Surg. 16: 43-46.
4. Burnouf, T. and M. Radosevich. 2000. Reducing the risk of infection from plasma products: specific preventative strategies.
Blood Rev. 4: 94-110.
5. Carlson E. R., R. E Marx, and B. E. Buck. 1995. The potential for HIV transmission through allogeneic bone. A review of risks and safety. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 80: 17-23.
6. Chan, B. P., I. E. Kochevar, and W. Robert. 2002. Redmond enhancement of porcine skin graft adherence using a light- activated process. J. Surg. Res. 108: 77-84.
7. Chaplin, J. M., P. D. Costantino, M. E. Wolpoe, J. B.
Bederson, E. S. Griffey, and W. X. Zhang. 1999. Use of an acellular dermal allograft for dural replacement: an experi- mental study. Neurosurg. 45: 320-327.
8. Chen, R.-N., H.-O. Ho, Y.-T. Tsai, and M.-T. Sheu. 2004.
Process development of an acellular dermal matrix (ADM) for biomedical applications. Biomaterials 25: 2679-2686.
9. Chester, D. L. and R. P. G Papini. 2004. Skin and skin substitutes in burn management. Trauma 6: 87-99.
10. Chiu, T. and M. Shah. 2002. Porcine xenograft dressing for facial burns: beware of the mesh imprint. Burns 28: 279–
282.
11. Choi, Y. W. and I. S. Kim. 2008. Viral clearance during the manufacture of urokinase from human urine. Biotechnol.
Bioprocess Eng. 13: 25-32.
12. Denda, M. 2000. Skin barrier function as a self-organizing system. Forma 15: 227-232.
13. Dichtelmüller, H. O., L. Biesert, F. Fabbrizzi, R. Gajardo, A.
Gröner, I. von Hoegen, J. I. Jorquera, C. Kempf, T. R. Kreil, D. Pifat, W. Osheroff, and G. Poelsler. 2009. Robustness of solvent/detergent treatment of plasma derivatives: a data collection from plasma protein therapeutics association member companies. Transfusion 49: 1931-1943.
14. Eastlund, T. 1995. Infectious disease transmission through cell, tissue, and organ transplantation: reducing the risk through donor selection. Cell Transplant. 4: 455-477.
15. Fischer, G., W. K. Hoots, and C. Abrams. 2001. Viral reduc- tion techniques: types and purpose. Transfus. Med. Rev.
15(Suppl 1): 27-39.
16. Hornicek, F. J., J. E. Woll, and D. Kasprisin. 2002. Standards for tissue banking, pp. 31-45. American Association of Tissue Banks, Bethesda, Maryland, USA.
17. Immelmann, A., K. Kellings, O. Stamm, and K. Tarrach.
2005. Validation and quality procedures for virua and prion removal in biopharmaceuticals. BioProcess Int. 3: 38-44.
18. International organization for standardization. 1994. Medical devices-Validation and routine control of ethylene oxide sterilization. Geneva, Switzerland.
19. International organization for standardization. 1998. Sterili- zation of medical devices-Microbiological methods. Part 2:
Test of sterility performed in the validation of a sterilization process. Geneva, Switzerland.
20. Kärber, J. 1931. Beitrag zur kollectiven behandlung pharma- kologische reihenversuche. Arch. Exp. Path. Pharmak. 162:
480-483.
21. Kim, I. S., J. E. Bae, H. M. Sung, Y. Kang, and Y. W. Choi.
2009. Removal and inactivation of viruses during the manufacture of a high-purity antihemophilic factor IX from human plasma. Biotechnol. Bioprocess Eng. 14: 716-724.
22. Kim, I. S., Y. W. Choi, Y. Kang, H. M. Sung, K. W Sohn, and Y.-S. Kim. 2008. Improvement of virus safety of an antihemophilic factor IX by virus filtration process. J.
Microbiol. Biotechnol. 18: 1317-1325.
23. Kim, I. S., Y. W. Choi, Y. Kang, H. M. Sung, K. W. Sohn, and J. S. Shin. 2008. Dry-heat treatment process for enhanc- ing viral safety of an antihemophilic factor VIII concentrate prepared from human plasma. J. Microbiol. Biotechnol. 18:
997-1003.
24. Lavanchy, D. 2008. Hepatitis B virus transmission in organ, tissue, and cell transplantation. Gastroenterol. 135: 1041- 1043.
25. Lee, K. C., N. H. Lee, J. H. Ban, and S. M. Jin. 2008.
Surgical treatment using an allograft dermal matrix for nasal septal perforation. Yonsei Med. J. 49: 244-248.
26. Lineen, E. and N. Namias. 2008. Biologic dressing in burns.
J. Craniofac. Surg. 19: 923-928.
27. Livesy, S. A., D. N. Herndon, M. A. Hollyoak, Y. H.
Atkinson, and A. Nag. 1995. Transplanted acellular allograft dermal matrix. Potential for the reconstruction of viable dermis. Transplantation 60: 1-9.
28. Maillard, J. Y. and A. D. Russell. 1997. Virucidal activity and mechanism of action of biocides. Sci. Prog. 30: 287- 315.
29. Matouková, E., P. Stehlíek, and P. Vesely. 2002. Acellular porcine xenodermis as a temporary wound cover and substratum for cultured keratinocytes. Eur. Cells Mater. 4:
83-85.
30. McDonnell, G. and A. D. Russell. 1999. Antiseptics and
disinfectants: activity, action, and resistance. Clin. Microbiol.
Rev. 12: 147-179.
31. McDonnell, G. E. 2007. Antisepsis, disinfection, and sterili- zation, pp. 191-197. ASM Press, American Society for Microbiology, Washington D. C., USA.
32. McDonnell, G. E. 2007. Antisepsis, disinfection, and sterili- zation, pp. 32-54. ASM Press, American Society for Micro- biology, Washington D. C., USA.
33. Qaryoute, S., I. Mirdad, and A. A. Hamail. 2001. Usage of autograft and allograft skin in treatment of burns in children.
Burns 27: 599-602.
34. Sclafani, A. P., T. Romo, A. A. Jacono, S. McCormick, R.
Cocker, and A. Parker. 2000. Evaluation of acellular dermal graft in sheet (AlloDerm) and injectable (micronized AlloDerm) forms for soft tissue augmentation. Clinical observations and histological analysis. Arch. Facial Plast.
Surg. 2: 130-136.
35. Takami, Y., T. Matsuda, M. Yoshitake, M. Hanumadass, and
R. J. Walter. 1996. Dispase/detergent treated dermal matrix as a dermal substitur. Burn 22: 182-190.
36. Van Baare J., E. E. Ligtvoet, and E. Middelkoop. 1998.
Microbiological evaluation of glycerolized cadaveric donor skin. Transplant. 65: 966-970.
37. Wainwright, D. J. 1995. Use of an acellular allograft dermal matrix (Alloderm) in the management of full-thickness burns. Burns 21: 243-248.
38. Walter, R. J., T. Matsuda, H. M. Reyes, J. M. Walter, and M.
Hanumadass. 1998. Characterization of acellular dermal matrix (ADMs) prepared by two different methods. Burns 24: 104-113.
39. Wang, S., C. Zinderman, R. Wise, and M. Braun. 2007.
Infections and human tissue transplants: review of FDA MedWatch reports 2001-2004. Cell Tissue Bank. 8: 211-219.
(Received April 13, 2010/Accepted June 16, 2010)