대한소화기학회지 2000;36:39 - 45
접수: 2000년 1월 4일, 승인: 2000년 4월 12일
연락처: 손희정, 135-710, 서울시 강남구 일원동 50번지, 삼성서울병원 소화기내과 Tel: (02) 3410-0335, Fax: (02) 3410-3849, E-mail: hjson@smc.samsung.co.kr
위암조직에서 H ig h M ob ility G r ou p 1 m RNA 발현
성균관대학교 의과대학 내과학교실, 병리학교실*, 일반외과학교실†
박동일・손희정・송상용*・손태성†・김재준・김영호 이 풍 렬・고 광 철・백 승 운・이 종 철・최 규 완
Ex p re s s io n o f th e H ig h Mo bili ty Gro u p 1 m RN A i n Ga s tric Ca n c e r
Dong Il P ark, M.D., He e J u ng Son, M.D., Sang Yon g Son g, M.D.*, Tae Sung Son, M.D.†, J ae J u n Kim , M.D., Yo un g-Ho Ki m , M.D., P o on g-Lyu l Rh e e , M.D.,
Kw a n g Ch e ol Ko h , M.D., S e u n g Woo n P a i k , M.D., J o n g Ch u l R h e e , M.D. a n d Ky o o Wa n Ch o i , M.D.
Departments of Medicine, Pathology* and General Surgery† Samsung Medical Center, Sungkyunkwan University School of Medicine, Seoul, Korea
Background/Aims: High mobility group (HMG) proteins are nonhistone intranuclear architectural
proteins involved in transcriptional regulation of gene. The purpose of this study was to investigate the role of HMG-1 protein expression in gastric cancer. Methods: We obtained the biopsy specimens from 12 normal tissue, 14 patients with metaplastic gastritis, 14 patients with chronic atrophic gastritis, and 18 patients with gastric cancer. After performing comparative reverse transcription- polymerase chain reaction using GAPDH for these specimens, we analyzed the expression of HMG-1 mRNA semi-quantitatively. We investigated the relationship between the clinicopathologic findings and the level of HMG-1 mRNA expression in gastric cancer. Results: The mean level of HMG-1/GAPDH ratio was 0.7±0.07 in normal tissue, 0.9±0.13 in gastritis, and 1.6±0.40 in gastric cancer (p<0.05). There was no significant correlation between the levels of HMG-1 mRNA expression and several parameters such as age, gender, tumor size, depth of invasion, differentiation, Lauren’s classification, and lymph node metastasis in gastric cancer. Conclusions: The expression of HMG-1 mRNA was increased significantly in patients with gastric cancer. The function and the mechanism of HMG-1 protein in tumorigenesis and tumor differentiation are still unclear. Thus, further study is needed to elucidate the relationship between HMG-1 expression and tumorigenesis or tumor differentiation. (Kor J Gastroenterol 2000;36:39 - 45)Key Words: High mobility group (HMG)-1 protein, Gastric cancer
40 대한소화기학회지 : 제 36 권 제 1 호 2000
서 론
최근 발암기전에 관한 연구에서 관심이 집중되고 있는 분야는 전사과정(transcription) 의 조절에 관한 것이다. 그 기전이 매우 복잡하기는 하나 최근 다양 한 연구에 의하면 전사 요소(transcription factors), 중합효소(polymerase), 세포주기 조절인자, DNA 수 선 단백 등의 기능적 상호반응 과정이 자세히 알려 지면서 여러 질환에서 DNA-단백질, 단백질-단백질 상호작용 과정의 돌연변이가 발암의 원인기전으로 제시되고 있다.1 전사과정의 조절에서 DNA에 부착 되는 단백의 역할이 중요한데 DNA 부착 단백군의 하나가 high mobility group (HMG) 단백이다.
HMG 단백은 분자량, 아미노산 서열, DNA 부착 능력에 따라 HMG-1/-2 family, HMG-14/-17 family, HMG-I family 등의 세 가지 독특한 아형으로 분류 된다. 그 중 가장 많이 연구된 것은 HMG-I family 로 이들을 coding하는 유전자의 재조합은 지방종,2,3 폐 연골과오종,4 자궁근종 등5 여러 가지 간엽종에서 발견되어 이들의 발견이 진단과 예후를 예측할 수 있는 인자일 것이라고 보고되고 있다. HMG-1 단백 유전자의 발현에 대한 보고는 대부분 정상 조직이 나 백혈병세포주6에 국한되어 있다가 최근 위선암 및 대장암에서의 발현이 보고되었다.7
그러나 우리 나라에서는 아직 HMG-1에 대한 연 구가 없는 실정이어서 저자 등은 위선암에서 HMG- 1단백의 발현이 종양의 발생 및 진행에서 어떤 역할 을 하는지 알아보기 위해 본 연구를 시행하였다.
대상 및 방법
1. 대 상
위내시경검사에서 정상 소견을 보인 12예, 화생 성 위염 14예, 만성 위축성 위염 14예 및 위선암 18 예를 대상으로 하였다. 58명의 대상 중 남자는 34 명, 여자는 24명이었으며 평균 나이는 54.5세였다.
2. 방 법
1) 검체 채취 및 m RN A 추출
정상 및 위염 환자 군에서는 위전정부에서 2점, 위선암 환자군에서는 병변 부위에서 2점의 조직을 채취하여 1점은 H&E 염색을 실시하고 1점은 역전 사 PCR (중합효소 연쇄 반응)을 시행하기위해 생검 즉시 액체질소에서 동결시켜 -80℃ 상태로 보관하 였다. 액체질소에 보관된 생검조직을 잘게 부순 후 mRNA extraction kit (Quiagen GmbH, Hilden, Ger- many)를 이용하여 mRNA를 추출하였다.
2) 역전사 P CR, 및 H M G- 1 m RNA 의 정량적 분석
Radom hexamer를 시발체(primer)로 사용하여 dNTP 혼합물을 MMLV와 반응시켜 cDNA를 얻은 후 HMG-1과 GAPDH (dACCACAGTCCATGCCA- TCAC, dTCCACCACCCTGTTGCTGTA)에 각각 특 이적인 시발체를 사용하여 PCR을 시행하였다.
HMG-1 PCR은 94℃에서 60초간 변성반응(dena- turation), 55℃에서 90초간 결합반응(annealing), 7 4℃에서 120초간 연장반응(extension)이 일어나도록 하였으며 이와 같은 cycle의 총 횟수는 35회로 정하 였고, GAPDH PCR은 94℃에서 60초간 변성반응, 60℃에서 90초간 결합반응, 74℃에서 120초간 연장 반응이 일어나도록 하였으며 이와 같은 cycle의 총 횟수는 30회로 정하였다. PCR 산물을 ethidium bro- mide를 포함하는 1% agarose gel에서 전기영동하여 HMG-1, GAPDH의 발현을 확인하였다. HMG-1의 발현은 상대적 역전사 PCR을 이용하여 반정량적 계측을 하였고, GAPDH를 house keeping gene으로 사용하였다. GEL-DocTM single wave length mini- transilluminator를 이용하여 분석하였다. 인체 위암 세포주 MKN 28을 양성 대조군으로 사용하였다.
3) 위선암의 예후인자와의 상관관계
위선암의 크기, 침윤의 깊이, 분화도, Lauren분류 및 림프절 전이 여부 등 위선암의 예후인자의 유무 와 HMG-1의 발현 정도와의 상관관계를 분석하였다.
박동일 외 10인. 위암조직에서 High Mobility Group 1 mRNA의 발현 41
결 과
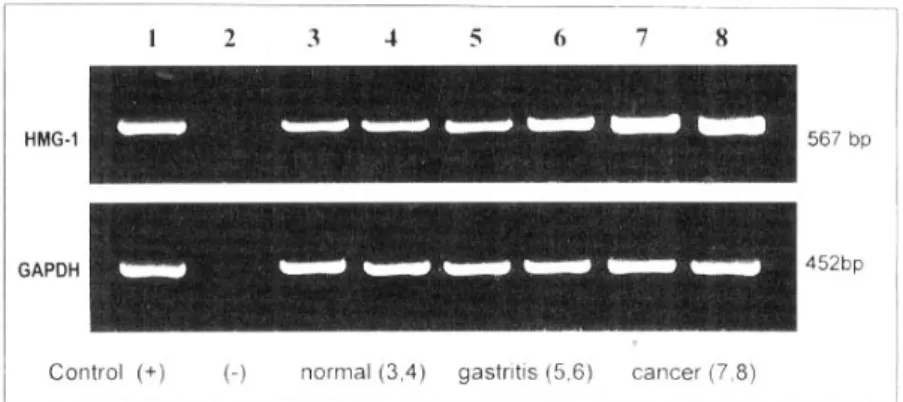
1. 정상 조직, 위염 그리고 위선암 환자에서 H M G- 1 m RN A 발현 정도의 비교 18예의 위선암 환자 모두에서 HMG-1 mRNA의 발현을 관찰할 수 있었고 정상 조직, 화생성 위염 및 만성 위축성 위염 환자군에서도 모두 HMG-1 mRNA의 발현을 관찰할 수 있었다(Fig. 1). 평균 HMG-1/GAPDH 비율(mean±SD)은 위선암 환자에 서는1.6±0.40이었으며, 정상 조직에서는 0.7±0.07,
위염 환자군에서는 0.9±0.13으로 위선암 환자군에 서 통계적으로 의미 있는 HMG-1 mRNA 발현의 증 가를 관찰할 수 있었다(Fig. 2). 양성 대조군인 위암 세포주 MKN 28에서의 평균 HMG-1/GAPDH 비율 은 1.4±0.1이었다.
2. 연령 및 성별에 따른 위선암에서의 HMG- 1 m RN A 발현 정도의 비교
55세 이하군에서 HMG-1/GAPDH 비율은 1.74±
0.35, 55세 이상군에서는 1.52±0.85로 양군간에 차 이가 없었으며, 남자에서는 1.63±0.32, 여자에서는 Fig. 1. HMG-1 mRNA expression in normal gastric tissues, gastritis and gastric cancer
by comparative RT-PCR. Glyceraldehyde 3-phosphate-dehydrogenase (GAPDH) hybridization to the same blots is shown as a loading control. Lane 1, MKN 28 human gastric cancer cell line, positive control; Lane 2, negative control; Lane 3-4, normal gastric tissue; Lane 5-6, patients with gastritis; Lane 7-8, patients with gastric cancer.
Fig. 2. Comparison of HMG-1/GAPDH ratio in normal, gastritis, and gastric cancer patients. The mean level of HMG-1/GAPDH ratio was 0.7±
0.07 in normal tissue, 0.9±0.13 in gastritis, and 1.6±0.40 in gastric cancer (p<0.05).
42 The Korean Journal of Gastroenterology : Vol. 36, No. 1, 2000
1.51±0.52로 환자의 나이에 따른 HMG-1 mRNA 발현 정도의 차이도 관찰할 수 없었다(Table 1).
3. 위암의 예후인자와 H M G- 1 m RNA 발현 정도의 비교
위선암의 크기가 5 cm 이하인 군에서 HMG-1/
GAPDH 비율은 1.64±0.32, 5 cm 이상인 군에서는 1.58±0.40로 양군간에 차이가 없었고, 침윤의 깊이 에 따라 점막과 점막하층까지 침윤한 군에선 1.71±
0.63, 고유근층과 장막층까지 침윤한 군에선 1.57±
0.57로 침윤의 깊이에 따른 HMG-1 mRNA 발현 정 도의 차이도 관찰할 수 없었다. WHO 분류에 따라 암종의 분화도를 저분화도, 중등도의 분화도 및 고 분화도로 분류하였을 때 각각 1.54±0.58, 1.38±
0.65, 1.35±0.54로 차이를 관찰할 수 없었고, Lauren 분류에 따라 장형과 미만형으로 분류하였을 때도
1.56±0.77과 1.60±0.88로 차이가 없었으며 림프절 전이 유무에 따라 분류하였을 때 전이가 있었던 군 에선 1.59±0.40, 전이가 없었던 군에선 1.61±0.57 로 양군간에 차이를 관찰할 수 없었다(Table 1).
고 찰
Philadelphia 염색체8의 발견 및 t(9;22)에 의한 BCR-ABL 융합9의 역할이 알려진 이후 수많은 악성 종양에서 다양한 종류의 염색체 전좌(translocation) 가 발견되었는데 이들 염색체 전좌 분절점의 염기 서열에 대한 cloning이 가능해지면서 두 가지 종양 발생기전이 발견되었다.10 첫 번째는 두개의 서로 다 른 유전자가 염색체 전좌를 통해 융합되어 형질변 환 기능(transforming activity)을 갖게 되는 경우이 고, 두 번째는 proto-oncogene을 coding하는 유전자 Table 1. The Relationship between Clinico-pathologic Data and HMG-1 mRNA Expression in Gastric Cancer
Variable Number HMG-1/GAPDH p-value
Age (years) Less than 55 More than 55 Gender
Male Female Tumor size
Less than 5 cm More than 5 cm Depth of invasion
m, sm mp, se
Tumor differentiation Well
Moderate Poor
Lauren' s classification Intestinal
Diffue
Lymph-node metastasis Absent
Present
10 8 13 5 4 14 2 16 1 2 15 4 14 3 15
1.74±0.35 1.52±0.85 1.63±0.32 1.51±0.52 1.64±0.50 1.58±0.40 1.71±0.63 1.57±0.57 1.35±0.54 1.38±0.65 1.54±0.58 1.56±0.77 1.60±0.88 1.61±0.57 1.59±0.40
NS
NS
NS
NS
NS
NS
NS
m, mucosa; sm, submucosa; mp, muscular propria; se, serosa; NS, not significant.
Park, et al. Expression of the High Mobility Group 1 mRNA in Gastric Cancer 43
근처에 위치하면서 정상적으로 발현이 억제되어 있 는 proto-oncogene을 활성화시키는 역할을 하는 enhancer 근처에 분절점이 위치하게 되는 경우이다.
최근 발견된 여러 가지 염색체 전좌 중 간엽종 (mesenchymal tumor)에서 특징적으로 발견되는 염 색체 전좌의 분절점으로 12q12-15, 6p21 등이 발견 되었는데 이 부위가 바로 HMG 단백을 coding하는 부위이다.11,12
HMG 단백은 비히스톤, 핵내 단백으로 크기가 작 기 때문에 전기영동에서 high mobility를 보이게 되 며 이러한 이유로 HMG 단백이라 명명되었다. 1970 년대 초반 HMG 단백이 발견된 이래 특히 지난 수 년 동안 암종의 발생과정에서의 HMG 단백의 역할 에 대해 많은 관심이 집중되고 있으며 지금까지 연 구된 결과에 의하면 HMG 단백은 유전자 전사과정 의 조절에 관여하는 중요한 구조단백(architectural protein)의 하나로 유전자의 재조합(rearrangement)에 관여하고, 효율적인 유전자의 이송을 위한 새로운 운송체계를 제공하며, 형질변환된 세포(transformed cell)에서의 발현 정도는 종양의 악성화 정도와 좋은 상관관계를 보이는 것으로 보고되고 있다.1,13
HMG 단백은 분자량, 아미노산 서열, DNA 부착 능력에 따라 HMG-1/-2 family, HMG-14/-17 family, HMG-I family 등의 세 가지 독특한 아형으로 분류 된다. 그 중 가장 많이 연구된 것은 HMG-I family 로 HMG-I, HMG-I (C), HMG-I (Y)로 구성되어 있 는데 앞서 기술한 바와 같이 이들을 coding하는 유 전자의 재조합은 지방종,2,3 폐연골과오종,4 자궁근종 등5 여러가지 간엽종에서 발견되어 이들의 발견이 진단과 예후를 예측할 수 있는 인자일 것이라는 보 고가 있으며, 최초 국내의 연구에서 대장암의 초기 단계에 HMG-I (Y)의 발현이 증가되어 있었다고 보 고14하였다. 두 번째는 HMG-14/-17 family로 쥐의 glucagonoma에서 발현이 증가되었다는 보고 등15이 있지만 많은 연구가 되어있지 않은 실정이다. 세 번 째는 HMG-1/-2 family로 이들의 구조는 N-terminal domain A, central domain B, C-terminal domain C로 이루어졌으며, 이들의 기능에 대해서는 아직 자세히 알려진 바 없지만 여러 종(species)에서 그들의 염기 서열이 확고하게 유지되고 있는 점 등을 보면 아마
도 세포의 생존에 필수적인 것으로 생각되며16 전사, 복제, 염색사 조립, 세포분화 등에 관여하는 것으로 추측되고 있다.17 HMG-1 단백 유전자의 발현에 대 한 보고는 대부분 정상 조직이나 백혈병세포주6,18와 간암 등19에 국한되어 있다가 최근 위선암 16예와 대장암 17예를 대상으로 암종 부위와 암종과 떨어 진 정상 점막 부위에서 HMG-1 mRNA의 발현을 비 교한 보고7에 의하면 암종 부위는 33예 모두에서 HMG-1 mRNA의 발현이 증가되어 있었고 발현의 강도도 정상 점막 부위에 비하여 강하였다고 한다.
또한 암종과 떨어진 정상 점막 부위에서의 발현은 암종의 조직 침윤 정도가 깊을수록 증가되었다고 하고, 암종의 분화도에 따라 관찰하였을 때 고도의 분화도를 보인 군의 정상 점막 부위에서는 18.2%, 중등도의 분화도를 보인 군에서는 60%, 분화도가 좋지 않은 군에서는 83.3%의 발현을 보여 HMG-1 mRNA의 발현 정도가 위장관선암의 병기 및 분화 도와 좋은 상관관계를 보인다고 보고하였다.
그러나, 본 연구에서는 위선암 환자군에서 정상 이나 위염 환자군에 비교하여 통계적으로 유의성있 는 HMG-1 mRNA 발현의 증가를 관찰할 수 있었으 나 위선암의 크기, 침윤의 깊이, 분화도(WHO), Lauren 분류 및 림프절 전이 여부 등 위선암의 예후 인자의 유무에 따른 HMG-1 mRNA의 발현 정도의 차이는 관찰할 수 없었다. 아직 위선암의 발암과정 과 암종의 분화과정 중에서 HMG-1 단백이 차지하 는 역할이나 기전은 불확실하지만 여러 가지 측면 에서 좀더 깊은 연구를 진행해볼 가치가 있을 것으 로 생각된다.
요 약
목적: HMG 단백은 유전자의 전사과정의 조절에 관여하는 중요한 비히스톤, 핵내 구조단백의 하나로 유전자의 재조합에 관여하고, 효율적인 유전자의 이 송을 위한 새로운 운송체계를 제공하며, 형질변환된 세포에서의 발현 정도는 종양의 악성화 정도와 좋 은 상관관계를 보이는 것으로 보고되고 있다. 이에 저자 등은 HMG-1단백의 발현이 위선암의 발생 및 진행에서 어떤 역할을 하는지 알아보기 위해 본 연
44 대한소화기학회지 : 제 36 권 제 1 호 2000
구를 시행하였다. 대상 및 방법: 위내시경검사 및 조 직생검에서 위선암 18예를 대상으로 생검조직에서 추출해낸 RNA를 이용하여 HMG-1 mRNA의 발현 정도를 반정량적 역전사 PCR로 조사하였고 12예의 정상 조직, 14예의 화생성 위염, 14예의 만성 위축 성 위염 환자에서의 결과와 비교하였다. 환자의 성 별, 나이 및 위암의 예후인자(위암의 크기, 침윤의 깊이, 분화도, Lauren분류 및 림프절 전이 여부와 HMG-1 mRNA의 발현 정도와의 상관관계를 분석 하였다. 결과: 총 58예 전부에서 HMG-1 mRNA의 발현을 관찰할 수 있었으며 평균 HMG-1/GAPDH 비율은 정상에서는 0.7±0.07, 위염 환자군에서는 0.9±0.13, 위선암 환자군에서는 1.6±0.40으로 위선 암 환자군에서 통계적으로 유의한 HMG-1 mRNA 발현의 증가를 관찰할 수 있었다. 환자의 나이와 성 별에 따른 HMG-1 mRNA 발현 정도의 차이는 관찰 할 수 없었으며, 위선암의 크기, 침윤의 깊이, 분화 도, Lauren 분류 및 림프절 전이 여부 등 위선암의 예후 인자의 유무에 따른 HMG-1 mRNA 발현 정도 의 차이도 관찰할 수 없었다. 결론: 아직 그 역할이 나 기전이 충분히 밝혀지지는 않았지만 HMG-1 단 백은 위암의 발암기전이나 분화과정에서 중요한 역 할을 담당할 것으로 기대되며 향후 보다 많은 연구 가 필요할 것으로 생각된다.
색인단어: High mobility group (HMG)-1 단백, 위 선암
참 고 문 헌
1. Wunderlich V, Bottger M. High-mobility group proteins and cancer an emerging link. J Cancer Res Clin Oncol 1997;123:133-140.
2. Sreekantaiah C, Leong SLP, Karakousis CP, et al.
Cytogenetic profile of 109 lipomas. Cancer Res 1991;51:422-433.
3. Mandahl N, Hoglund M, Mertens F, et al. Cyto- genetic aberrations in 188 benign and borderline adipose tissue tumors. Genes Chromosomes Cancer 1994;9:207-215.
4. Dal Cin P, Kools P, De Jonge I, et al. Rearran- gement of 12q14-15 in pulmonary chondroid hamartoma. Genes Chromosomes Cancer 1993;8:
131-133.
5. Williams AJ, Powell WL, Collins T, et al. HMG-I (Y) expression in human uterine leiomyomata. Am J Pathol 1997;150:911-918.
6. Cabart P, Kalousek I, Jandova D, Hrkal Z. Dif- ferential expression of nuclear HMG-1, HMG-2 protein and H1 (zero) histone in various blood cells. Cell Biochem Funct 1995;13:125-133.
7. Xiang YY, Wang DY, Tanaka M, et al. Exression of high mobility group-1 mRNA in human gastroin- testinal adenocarcinoma and corresponding non- cancerous mucosa. Int J Cancer 1997;74:1-6.
8. Nowell PC, Hungerford DA. A minute chromosome in human chronic granulocytic leukemia. Science 1960;132(abstr):1497.
9. Rowley JD. A new consistent chromosomal abnor- mality in chronic myelogenous leukemia identified by quinacrine fluorescence and Giemsa staining.
Nature 1973;243:290-293.
10. Rabbitts TH. Chromosomal translocations in human cancer. Nature 1994;372:143-149.
11. Ashar HR, Schoenberg FM, Tkachenko A, et al.
Disruption of the architectural factor HMGI-C:
DNA binding AT modifs fused in lipomas to distinct transcriptional regulatory domains. Cell 1995;82:57-65.
12. Schoenmarkers EFPM, Wanschura S, Mols R, Bullerdiek J, Van den Berghe H, Van den Ven WJM. Recurrent rearrangements in the high mo- bility group protein gene, HMGI-C in benign mesenchymal tumors. Nat Genet 1995;10:436-444.
13. Grosschedl R, Giese K, Pagel J. HMG domain proteins: architectural elements in the assembly of nucleoprotein structures. Trends Genet 1994;10:94- 100.
14. Kim DH, Park YS, Park CJ, et al. Expression of the HMG-I (Y) gene in human colorectal cancer.
Int J Cancer (Pred Oncol) 1999;84:376-380.
15. Nielsen E, Welinder B, Madsen OD. Protein HMG-
박동일 외 10인. 위암조직에서 High Mobility Group 1 mRNA의 발현 45
17 is hyper-expressed in ret glucagonoma. Single- step isolation and sequencing. Eur J Biochem 1990;192:81-86.
16. Bustin M, Lehn DA, Landsman D. Structural fea- tures of the HMG chromosomal proteins and their genes. Biochim Biophys Acta 1990;104:231-243.
17. Kohlstaedt LA, Sung EC, Fujishige A, Cole RD.
Non-histone chromosomal protein HMG-1 modu- lates the histone-H1-induced condensation of DNA.
J Biol Chem 1987;262:524-526.
18. Sparatore B, Passalacqua M, Patrone M, Melloni E, Pontremoli S. Extracellular high mobility group 1 protein is essential for murine erythroleukemia cell differentiation. Biochem J 1996;320:253-256.
19. Kawahara N, Tanaka T, Yokomizo A, et al. En- hanced coexpression of thioredoxin and high mobi- lity group protein 1 genes in human hepatocellular carcinoma and the possible association with de- creased sensitivity to cisplatin. Cancer Res 1996;56:
5330-5333.