대한소화기학회지 2001;37:120-127
서 론
7)췌장암은 조기 진단이 매우 어려우며 따라서 그 예후가 극히 불량한 암으로서, 우리나라의 경우 인구 10만 명당 연 간 사망률이 1990년에 3.3명이던 것이 1999년에는 5.4명으 로 증가하는 추세에 있고 전체 암 중 그 사망률이 5위를 차 지한다.
접수: 2000년 12월 22일, 승인: 2001년 1월 18일
연락처: 윤용범, 110-744, 서울특별시 종로구 연건동 28번지 서울대학교 의과대학, 내과학교실
Tel: (02) 760-3346, Fax: (02) 765-8265
※ 본 논문은 2000년도 대한소화기학회 글락소웰컴 연구비의 보조 로 이루어진 것임.
췌장암의 발병기전을 규명하기 위한 기존의 연구를 통해 K -ras , p53, DP C4 등의 유전자 변이가 췌장암세포에서 비 교적 흔히 관찰됨이 알려져 있으며, 또한 많은 췌장암에서 세포고사(apoptosis) 과정에 장애가 있음이 보고되었다.
일반적으로 종양의 성장은 세포의 증식과 사멸 간의 불 균형에 의해 일어난다고 볼 수 있으므로, 세포고사의 장애 는 발암기전에 있어서 중추적 역할을 차지할 것으로 추정 되고 있다. 근래의 연구에 의하면 세포고사 과정에는 Fas-Fas ligand 체계가 주요 경로로 작용함이 알려져 있다.1 Fas는 TNF 수용체군에 속하는 분자량 48 kDa의 제 1형 세 포막 단백질로서 319개의 아미노산으로 이루어지며,2 세포 막과의 상대적 위치에 따라 3부분으로 나뉠 수 있는데, 155 개의 아미노산으로 구성된 세포 외 부분 및 19개의 아미노
췌장암에서의 F a s 유전자 변이
서울대학교 의과대학 내과학교실, 간연구소, 외과학교실*
김 진・김윤준・장유현・이우진・류지곤・김용태・김선회*・윤용범・김정룡
F a s G e n e Mu t a t i o n i n P a n c r e a t i c C a n c e r
J i n K i m , M .D ., Y o o n J u n K i m , M .D ., Y o o H y u n J a n g , M .D ., W o o J i n L e e , M .D ., J i K o n R y u , M .D ., Y o n g -T a e K i m , M .D ., S u n W h e K i m , M .D .*,
Y o n g B u m Y o o n , M .D . a n d C h u n g Y o n g K i m , M .D .
Dep artments of Internal Medicine and Surg ery * and Liver Research Institute, Seoul National University Colleg e of Medicine, Seoul, Korea
Background/Aim s: Fas is a type 1 transmembrane protein of the tumor necrosis factor (TNF) receptor
superfamily, which mediates apoptosis upon cross-linking to Fas ligand. Although pancreatic cancer cells express
both Fas and Fas ligand on their surface, Fas-induced apoptosis is impaired for unknown reasons. This study was
performed to examine the possible role of the Fas gene mutation in the impaired Fas-mediated apoptosis in
pancreatic cancer . M ethods: From eight subjects with pancreatic cancer, needle biopsy specimens or ascites were
collected and xenografted into the nude mice. After extracting genomic DNA from xenografted tumor, the entire
coding region and all splice sites of the Fas gene were analyzed for the detection of the gene mutations using
polymerase chain reaction-single strand conformation polymorphism method and DNA sequencing. Five pancreatic
cancer cell lines were also analyzed. Results: In two-cultured cell lines of pancreatic cancer, C-to-T base change
was observed in exon 7, which corresponded to the polymorphism shown in other study. No mutation resulting
in amino acid substitution was observed in this study. Conclusions: In pancreatic cancer, Fas gene mutation does
not play a major role in the impairment of Fas-mediated apoptosis. Further studies focusing on downstream
signalling pathways and other cofactors of apoptosis may be needed. (K orean J Gastroenterol 200 1;37 :120 -127)
K ey W ords: Pancreatic cancer, Fas, Fas ligand, Mutation, SSCP
췌장암에서의 Fas 유전자 변이 12 1
산으로 이루어진 세포막 부분, 그리고 145개의 아미노산으 로 이루어진 세포 내 부분으로 구성되며,3 세포 내 부분의 일부는 death domain 이라고 알려진 TNF 수용체군에 공통 적인 구조를 갖는다.4 한편 Fas 유전자는 10번 염색체의 장 완에 위치하며,5 그 길이는 대략 25 kb 가량으로 9개의 exon으로 이루어져 있다.3 ,6
Fas는 Fas ligand (FasL)나 특정한 anti-Fas 항체에 의해 활성화될 경우 세포의 사멸(apoptotic cell death)을 초래할 수 있으며,4 ,7 이러한 Fas-FasL 상호작용 및 그와 관련한 세 포고사 기전은 조직의 발생과 항상성 유지 및 T세포의 세 포독성을 매개하는 데 중요한 역할을 하는 것으로 알려져 있다.1 ,8 특히 여러 장기의 종양 발생(tumorigenesis) 과정에 서 세포고사의 장애가 중요한 기전으로 작용할 가능성이 많은 연구에서 제시되었고, 그 과정에서 Fas 관련 신호전달 체계의 이상이 중요한 역할을 할 가능성도 여러 연구에서 시사된 바 있다.9 - 1 1
췌장암 세포주를 이용한 몇몇 연구에서 Fas 및 FasL의 발현은 이루어지나 Fas 매개성 세포고사는 저하되어 있음 이 알려져 있고,12 췌장암 조직에서도 유사한 소견이 보고 된 바 있다.13
한편 자가면역성 림프증식증후군 환자의 백혈구에서 Fas 유전자의 변이가 있으며, 그 결과로 발현된 변형 Fas는 적 절한 자극에도 불구하고 세포고사를 유도하지 않음이 알려 져 있는데,14 이는 설사 Fas가 발현되더라도 그것이 정상 Fas가 아니라 변형된 것일 경우에는 세포고사를 유도하는 본래의 기능을 상실함을 보여주는 것이다. 췌장암에서도 비록 Fas의 발현은 저하되어 있지 않다 하더라도 만일 발현 된 Fas가 정상적인 것이 아닐 경우에는 세포고사를 유도하 는 본래의 기능에 장애가 있을 가능성이 있고, 이는 발암기 전에서 중요한 역할을 할 수 있을 것인데, 췌장암에서의 Fas 유전자 변이에 대한 연구는 국내외적으로 이루어진 바 가 없다.
본 연구에서는 췌장암에서 나타나는 Fas 매개성 세포고 사의 장애에 있어서 세포 내 신호전달체계상 가장 상위에 위치하는 Fas의 유전자 변이가 관여하는지를 밝히기 위해 췌장암 및 췌장암세포주에서 Fas 유전자의 변이 여부를 알 아보고자 하였다.
대상 및 방법
1. 연 구 대 상
서울대학교병원에서 수술 또는 경피적 침생검을 통해 췌장암으로 확진된 환자로서, 생검 조직 또는 복수에 포함 된 암세포를 누드 마우스로 이식한 후 종양이 증식한 8명
(Table 1)과 5종의 췌장암 세포주(AsPC- 1, Capan - 1, Capan- 2, MIA PaCa-2, PANC- 1)를 대상으로 하였다.
2 . 방 법
1) 인간 췌장암의 누드 마우스로의 이종 이식 (xe nograft) 과 DNA 추출
췌장암 환자에서 경피적 침생검을 통해 얻은 조직편을 penicillin G (Sigma, St . Louis, MO, USA)와 streptomycin sulfate (Sigma)가 각각 100 U/mL과 100 ㎍/mL의 농도로 첨가된 Dulbecco s Modified Eagle s Medium (DMEM, Sigma)과 섞은 다음 조직편의 직경이 1 mm 미만이 되도록 잘게 썰었다. 이를 250 μL 취하여 MATRIGEL Basem ent Membrane Matrix (Becton Dickson Labware, Bedford, MA, U SA) 250 μL와 혼합한 후 저온 상태를 유지하면서 3주령 의 BALB/c 누드 마우스에 18게이지 바늘을 이용하여 피하 주사하였다. 또는 췌장암의 복강내 파종으로 인해 발생한 복수를 50 m L 취하여 1,400 rpm에서 5분간 원침한 다음 침 전된 세포층을 penicillin G와 streptomycin이 첨가된 DMEM 250 μL로 부유시키고 나서 MATRIGEL Base- m ent Membrane Matrix 250 μL와 혼합하여 누드 마우스에 피하주사하였다.
이후 이종 이식된 종양의 크기가 누드 마우스 체중의 약 10 %에 도달할 때 종양을 적출하여 미리 냉각된 100 % isopentane (Yakuri Pure Chem icals, Osaka, Japan)으로 처 리한 다음 -70℃에 보관하였다.
냉동 보관된 종양 조직을 상온에서 해동한 후 이중 25 m g을 취하여 잘게 썬 다음 QIAamp DNA Mini Kit (Qia- gen, Valencia, CA, USA)를 이용하여 DNA를 추출하였다.
2) 췌장암세포주의 배양과 DNA 추출
5종의 췌장암세포주(AsPC- 1, Capan - 1, Capan -2, MIA PaCa-2, PANC- 1)를 10 % FBS를 함유하는 DMEM 또는
Table 1. Characteristics of the Subj ects
Subj ect Sex Age Source 1
2 3 4 5 6 7 8
F F M M F M F F
62 60 80 64 72 65 76 6 1
ascites biopsy ascites biopsy biopsy biopsy ascites biopsy M :F=3:5 67 .5±7.5*
M, male ; F, female .
* Mean±SD .
12 2 The Korean Journal of Gastroenterology: Vol. 37, No. 2, 2001
RPMI- 1640 배양액에서 공기중 이산화탄소 농도 5 %, 온도 37℃가 되도록 하면서 5 - 6일간 배양하였다. 세포가 증식 하여 6-well plate의 각 well 바닥을 거의 덮을 때(2× 106 cells/well) 배양액을 버리고 trypsin -EDTA 용액 200 μL를 넣은 다음 세포가 배양용기에서 떨어진 것을 육안으로 확 인한 후 이를 취하여 800 rpm 에서 5분간 원침하였다. 침전 된 세포층에 PBS를 가하여 그 양이 200 μL가 되도록 하면 서 부유시킨 후 이를 취하여 QIAamp DNA Mini Kit를 이 용하여 DNA를 추출하였다.
3) 중합효소연쇄반응 (polyme ras e cha in reaction, PCR)
추출된 genomic DNA에서 Fas 유전자의 9개 exon 모두 에 대하여 중합효소연쇄반응을 시행하였는데, exon 3은 두 부분으로, exon 9는 세 부분으로 나누어 증폭하였으며 각각
에 사용한 시발체(prim er)는 Table 2와 같다.
중합효소연쇄반응은 총 반응량이 20 μL가 되게 하여 시 행하였는데, 그 조성은 조직 또는 세포주에서 얻은 DNA 3 μL, dNTP 2 nm ol, MgCl2 30 nmol, 10× buffer (GeneAmp 10× PCR Gold Buffer ; Perkin Elmer , Foster City, CA, U SA) 2 μL, Taq polymerase (AmpliTaq Gold; Perkin Elmer , Foster City, CA, USA) 1 단위, [α-3 3P]dATP (3000 Ci/mmol, 10mCi/ml, NEN Life Science Products, Boston , MA, USA) 0 .5 μL, 정방향과 역방향의 시발체 각각 6 pmol 이 되도록 하였다. 중합효소연쇄반응은 GeneAmp PCR System 9600 (Perkin Elmer Cetus, Norwalk, CT, USA)을 이용하였으며 반응 조건은, 94℃에서 5분간 처리한 다음, DNA를 변성시키기 위해 94℃에서 50초, annealing을 위해 50-6 1℃에서 40초, 시발체의 연장(extension)을 위해 72℃에 서 40초간 처리하는 과정을 35 cycle 거치도록 하였고, 최 종 연장을 위해 72℃에서 5분간 처리하였다.
Table 2 . Prim ers Used in PCR-SSCP Assay of Fas Gene
Primers Sequence Size of PCR product (bp) Annealing temp (℃) exon 1-F
exon 1-R exon 2-F exon 2-R exon 3A -F exon 3A -R exon 3B-F exon 3B-R exon 4-F exon 4-R exon 5-F exon 5-R exon 6-F exon 6-R exon 7-F exon 7-R exon 8-F exon 8-R exon 9A -F exon 9A -R exon 9B-F exon 9B-R exon 9C-F exon 9C-R
5 ' -ctcttctcccgcgggttggt-3 ' 5 ' -cactttgcctatccccgggactaa-3 ' 5 ' -gttgcttacttcagaaatcaataa-3 ' 5 ' -actgtaatctctggatgttttgt-3' 5 ' -acttcccaccctgttacctg-3 ' 5 ' -catcacacaatctacatcttctgc-3' 5 ' -gtacacagacaaagcccatttttc-3 ' 5 ' -gtgtcaacatagcaccacagtagg-3' 5 ' -cgcgataactaatagtttccaa-3' 5 ' -ctctcagtcagtgttacttcccta-3 ' 5 ' -aattattctgccaggcttttg-3 ' 5 ' -gattggtttttcttcacatctttc-3' 5 ' -tttcatataatatgccaatgttcc-3' 5 ' -cttcccccaagttatttcaat-3 ' 5 ' -ctacaaggctgagacctgagtt-3 ' 5 ' -tttcaaggaaagctgatacctatt-3 ' 5 ' -ttgtctttctctgcttccatt-3 ' 5 ' -attggcctattactctaaaggatg-3 ' 5 ' -tgctggagtcatgacactaagt-3' 5 ' -caatgtgtcatacgcttctttc-3' 5 ' -taattggcatcaacttcat-3 ' 5 ' -gaatttgttgtttttcactcta-3' 5 ' -ggttttcactaatgggaatttcat-3' 5 ' -cttcattgacaccattctttcg-3'
17 1
249
192
17 1
228
180
145
164
117
163
175
19 1
6 1
53
60
57
55
53
55
55
53
50
49
50 F, forward; R, reverse; temp, temperature .
Kim, et al. Fas Gene Mutation in Pancreatic Cancer 12 3
4) 단일쇄 형태구조 다형성 (s ingle- stra nded conformationa l polymorphis m, SSCP) 검사 및 DNA의 염기서열 분석 중합효소연쇄반응 산물 2 μL를 취하여 95 % formamide, 10 mM NaOH, 0 .25 % bromophenol blue 및 0 .05 % xylene cyanol을 함유하는 변성액(denaturing solution) 10 μL와 혼 합한 후 94℃에서 3분간 열변성을 유도하고 나서 얼음 위 에서 5분간 급속 냉각하였다. 이중 3 μL를 SSCP용 젤판 (MDE gel solution ; BioWhittaker Molecular Applications, Rockland, ME, USA)에 부하하고 4℃에서 8 W의 전력을 통하면서 12시간 가량 전기영동을 한 후 젤을 여과지 (Whatman , 3MM, Maidstone, United Kingdom)로 옮기고 젤 건조기를 이용하여 80℃에서 3시간 동안 건조시켰다. 이를 Kodak Bio-Max MR 필름(Eastman Kodak, Rochester, NY , USA)에 부착한 다음 -70℃에서 보관하였다가 48시간 후에 현상하였다.
유전자 변이를 검출하기 위해 이동성 변위(mobility shift) 를 보인 띠(band)에 해당하는 젤을 오려내어 증류수가 담긴 시험관에 넣고 하루 동안 녹인 후 원침하여 상층액을 취한 다음 에탄올과 3 M sodium acetate를 이용하여 통상적인 방 법으로 DNA를 추출하였다. 이를 처음과 같은 시발체를 이 용한 35 cycle의 중합효소연쇄반응을 통해 증폭한 다음 Perkin Elm er s ABI Dye Term inator Cycle Sequencing Ready Reaction Kit (PE Applied BioSystems, Foster City, CA, USA)를 사용하여 ABI Prism Model 377 (PE Applied BioSystems, Foster City, CA, USA)에서 자동 염기서열 분 석을 하였다.
결 과
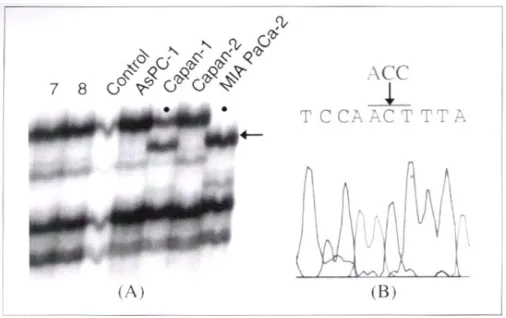
8명의 췌장암 환자와 정상 대조군 1명, 그리고 췌장암 세포주 5종에 대하여 Fas 유전자의 변이를 알기 위해 SSCP 를 시행한 결과, exon 3B에 해당하는 표본은 췌장암 환자 3예에서(Fig 1), exon 7에 해당하는 표본은 췌장암세포주 2 종에서 이동성 변위를 보이는 띠를 보였고(Fig 2), exon 9C 에 해당하는 표본은 췌장암 환자 1예와 췌장암세포주 2종 에서 이동성 변위를 보였다(Fig 3).
이동성 변위를 보이는 띠의 염기서열을 분석하여 기존에 알려져 있는 Fas 유전자의 염기서열과 비교한 결과, exon
Fig. 1. SSCP analysis and DNA sequencing of exon 3B. (A) Subject 2, 6, and 8 show bands with mobility shift on SSCP analysis (arrow). (B) The aberrant bands have C-to-T transition in intron 3.
Table 3 . Results of Nucleotide Sequencing Case/Cell line Fas gene change
1 2 3 4 5 6 7 8 AsPC- 1 Capan- 1 Capan-2 MIA PaCa-2
PANC- 1
intron 8, TTTTCTA deletion intron 3, C→T
WT WT WT
intron 3, C→T WT
intron 3, C→T
intron 8, TTTTCTA deletion exon 7, nt836 C→T, polymorphism intron 8, TTTTCTA deletion exon 7, nt836 C→T, polymorphism WT
WT, wild type ; nt, nucleotide.
12 4 대한소화기학회지: 제37권 제2호 2001
3B에 해당하는 표본은 3예 모두 intron 3의 46번째 염기인 C가 T로 대치된 것이었으며(Fig 1), exon 9C에 해당하는 표본 역시 3예 모두 intron 8에서 염기 TTTTCTA의 유무와 관련한 다형성(polymorphism )으로서 exon 내부의 변이는 없었다(Fig 3).
한편 exon 7에 해당하는 표본은 exon 7 내의 836번째 염 기가 C에서 T로 치환되어 있었으나 아미노산의 변화를 유 발하지 않는 다형성에 해당하였다(Fig 2). 이를 요약하면 Table 3과 같다.
고 찰
본 연구의 결과 췌장암 8예와 췌장암세포주 5종에서 아 미노산의 변화를 수반하는 Fas 유전자의 변이는 없는 것으 로 나타났다. exon 3B와 exon 7, 그리고 exon 9C에 해당하 는 표본에서 SSCP 상 이동성 변위가 관찰되었지만 이들의 염기서열을 분석한 결과, exon 3B와 exon 9C에 해당하는 표본에서 보였던 이동성 변위 6예는 모두 intron의 변이였 으며, 특히 exon 9C에 해당하는 표본의 이동성 변위 3예는 Fig. 3. SSCP analysis and DNA sequencing of exon 9C. (A) Bands with mobility shift were
detected in subject 1 (arrow), AsPC- 1 (not shown), and Capan-2 (not shown). (B) Deletion of the base sequence TTTTCTA is observed in intron 8.
Fig. 2. SSCP analysis and DNA sequencing of exon 7. (A) Pancreatic cancer cell line Capan-1 and MIA PaCa-2 have aberrant bands on SSCP analysis (arrow). (B) Nucleotide sequencing of the bands show C-to-T change in nucleotide 836.
췌장암에서의 Fas 유전자 변이 12 5
intron 8의 3 말단부에서 TTTTCTA의 소실로 인해 나타난 것으로서 Cascino 등15에 의하면 정상인에서도 나타날 수 있다. 한편 exon 7에서 보인 이동성 변위 2예는 염기서열 분석 결과 exon 내의 변이로서 Fas 유전자의 836번째 염기 가 C→T로 치환된 것이었으나, 아미노산의 변화를 수반하 지 않는 변화로서 Fiucci 등16에 의하면 건강한 백인에서 흔 히 나타나는 다형성에 해당하는 것이었다.
다른 장기의 종양을 대상으로 이루어진 최근의 연구 결 과를 보면, Fas 유전자의 변이는 비호지킨 림프종의 11%, 소아에서의 T세포 계통 급성 림프구성 백혈병의 약 2 %, 다 발성 골수종의 약 10 %에서 관찰되는 것으로 보고되고 있
으며,17 - 19 고형암 중에는 방광암의 28%, 비소세포성 폐암의
7 .7 %, 피부 흑색종의 6.8 %에서 Fas 유전자의 변이가 확인 되었다는 보고가 있다.2 0 - 2 2
본 연구에서는 췌장암과 췌장암세포주에서 Fas 유전자의 변이가 검출되지 않았는데 표본의 수가 많지 않다는 점을 고려할 때 Fas 유전자 변이가 낮은 빈도로나마 일어날 가능 성을 완전히 배제할 수는 없을 것이다. 또한 단일쇄 형태구 조 다형성 분석의 방법을 이용하였으므로 Fas 유전자의 소 실(deletion)이 있을 경우 이를 검출하는 데 난점이 있었을 가능성도 고려할 수 있겠다. 그러나 비록 적은 표본 수이지 만 exon의 변이를 보인 경우가 한 예도 없으며, 타 장기의 종양을 대상으로 한 다른 연구의 대부분도 단일쇄 형태구 조 다형성 검사를 이용하였다는 점을 감안하면 적어도 Fas 유전자의 변이가 췌장암 발생의 주요 기전으로 작용할 가 능성은 희박하다고 생각된다.
그렇다면 췌장암 세포주와 사람의 췌장암에서 Fas의 발 현은 정상적으로 이루어지나 FasL나 anti-Fas 항체에 의한 세포고사는 심하게 저하되어 있는 현상,12 즉 췌장암에서는 Fas mRNA가 증가되어있고, 면역화학적으로 조사하였을 때 Fas 단백도 잘 발현되어있으며, FasL도 동시에 발현됨에 도 불구하고, FasL나 anti-Fas 항체로 자극하였을 때 세포고 사가 잘 일어나지 않는 것13 ,2 3에 대한 설명으로는 다음과 같은 몇 가지 가능성을 고려할 수 있을 것이다.
첫째, Fas의 발현 과정에서 alternative splicing이 일어날 수 있을 것이다. 실제로 Cascino 등15은 Fas 유전자의 alternative splicing에 의해 3가지 다른 형태의 가용성 (soluble) Fas 분자가 발현될 수 있음을 보였으며, 이들은 세 포막에 부착된 Fas와는 반대로 세포고사를 억제하는 작용 을 하는 것으로 알려져 있다. 본 연구에서는 cDNA가 아니 라 genomic DNA를 조사하였으므로 alternative splicing이 실제로 작용한다면 이를 확인하지 못하였을 가능성도 배제 할 수는 없을 것이다. 그러나, exon뿐만 아니라 인접한 intron도 비교적 충분히 포함하여 조사하였으므로, 췌장암 에서의 세포고사 장애에 있어서 alternative splicing이 주요
기전으로 작용할 가능성은 높지 않다고 생각된다.
둘째, 아직 뚜렷하게 규명되지는 않았지만 Fas의 하부 (downstream) 신호전달체계에서 세포고사 신호를 차단하는 인자가 작용할 가능성도 생각할 수 있을 것이다. 이와 관련 하여 일부 다른 종양에서 bcl-2의 과다 발현, Fas의 억제 도 메인과 상호작용하는 Fas-associated phosphatase- 1 (FAP- 1) 의 과다 발현, FLICE-inhibitory protein (FLIP)의 과다 발현 등의 가능성이 제시된 바 있다.2 4 - 2 8
셋째, 생체 내에서(in vivo) Fas와 함께 발현된 FasL가 면 역 감시 기능을 하는 세포독성 T세포 등의 세포고사를 유 도하여 결과적으로 암세포가 면역학적인 공격에서 벗어나 증식하는 결과로 이어질 가능성을 고려할 수 있다.10 ,2 9
따라서 향후 췌장암에서의 세포고사 장애기전의 규명을 위해서는 Fas보다 하위 신호전달체계에 대한 연구와 함께 세포 내외의 다른 신호 전달 인자와의 상호 작용에 대한 연 구가 필요할 것으로 생각된다.
본 연구에서는 췌장암 환자의 조직을 그대로 조사한 것 이 아니라, 생검을 통해 얻은 소량의 조직 또는 복수 내에 포함된 암세포를 누드 마우스로 이종 이식하여 증식시킨 다음 이를 적출하여 Fas 유전자의 변이 여부를 조사하였다.
이는 대부분의 췌장암이 진단 당시에 수술적 치료가 불가 능할 정도로 진행된 상태라서 충분한 조직을 얻기 어렵고, 설사 조직을 얻더라도 췌장암의 특성상 염증세포의 침윤 및 섬유화가 심하여 암세포만을 분리하기 위한 미세 박리 (microdissection)가 힘들다는 방법론상의 문제를 극복하는 데 큰 도움이 된 것으로 생각되며 향후 췌장암에 대한 유 전학적 연구에 있어서 유용한 수단이 될 수 있을 것으로 보인다.
결론적으로, 췌장암에서 Fas 유전자 자체의 변이가 세포 고사 장애의 주요 기전으로 작용할 가능성은 낮은 것으로 생각된다. 따라서, 향후 보다 많은 수의 췌장암 예에 대한 연구와 함께, Fas의 세포고사 유발 기능에 필수적인 보조 인자의 장애 또는 Fas보다 하위의 신호전달체계 이상에 관 한 추가 연구가 필요할 것으로 생각된다.
요 약
목 적 : Fas (CD95/APO- 1)는 TNF 수용체군에 속하는 제1 형 막단백으로서 세포고사를 유발하는 신호전달체계에서 중추적 기능을 수행한다. Fas는 Fas ligand 또는 anti-Fas 항 체와 결합하면 세포 내에서의 하부 신호전달계통을 경유하 여 궁극적으로 세포고사를 초래하는데, 췌장암 세포에서는 Fas와 Fas ligand의 발현은 잘 되고 있음에도 불구하고 Fas 매개성 세포 사멸 기전에 장애가 있음이 알려져 있다. 본 연구에서는 췌장암에서의 Fas 매개성 세포고사 장애의 원
12 6 The Korean Journal of Gastroenterology: Vol. 37, No. 2, 2001
인을 규명하고자 Fas 유전자의 변이 여부를 조사하였다. 대 상 및 방 법 : 8명의 췌장암 환자에서 조직편 또는 복수를 채 취하여 이를 누드 마우스에 이종 이식한 다음 증식된 종양 조직을 적출하여 Fas 유전자의 변이를 조사하였다. 이와 함 께 5종의 췌장암세포주에서도 Fas 유전자의 변이 여부를 조사하였다. Fas의 9개 exon 및 인접 intron에 대하여 PCR-SSCP를 통해 이동성 변위를 보이는 band를 찾은 다음 이의 염기서열을 분석하였다. 결 과 : 췌장암세포주 2종의 Fas 유전자 exon 7에서 다형성에 해당하는 염기 변화가 있 었으나, 아미노산의 변화를 수반하는 변이는 발견되지 않 았다. 결 론 : 췌장암에서 Fas 유전자의 변이가 세포고사 장 애의 주요 기전으로 작용할 가능성은 낮은 것으로 생각된 다. 향후 보다 많은 수의 췌장암 예에 대한 연구와 함께, Fas의 세포고사 유발 기능에 필수적인 다른 보조 인자의 장 애 또는 Fas보다 하위의 신호전달체계 이상에 관한 추가 연 구가 필요할 것으로 생각된다.
색 인 단 어 : 췌장암, Fas, 변이, 단일쇄 형태구조 다형성
참 고 문 헌
1. Nagata N, Golstein P. The Fas death factor. Science 1995;267:1449- 1456.
2. Oehm A, Behrmann I, Falk W, et al. Purification and molecular cloning of the APO- 1 cell surface antigen, a member of the tumor necrosis factor/nerve growth factor receptor superfamily. J Biol Chem 1992;267:10709- 107 15.
3. Behrmann I, Walczak H, Krammer PH. Structure of the human APO- 1 gene. Eur J Immunol 1994;24:3057-3062.
4. Itoh N, Yonehara S, Ishii A, et al. The polypeptide encoded by the cDNA for human cell surface antigen Fas can mediate apoptosis. Cell 199 1;66:233-243.
5. Inazawa IN, Itoh TA, Nagata S. Assignment of the human Fas antigen gene (FAS) to 10q24.1. Genomics 1992; 14:
82 1-822.
6. Cheng J, Liu C, Koopman WJ, Mountz JD. Characterization of human Fas gene - exon/intron organization and promotor region. J Immunol 1995;154:1239- 1245.
7. Brunner T, Mogil RJ, LaFace D, et al. Cell-autonomous Fas (CD95)/Fas-ligand interaction mediates activation-induced apoptosis in T-cell hybridomas. Nature 1995;373:44 1-444.
8. Ju S-T, Panka DJ, Cui H, et al. Fas(CD95)/FasL interactions required for programmed cell death after T-cell activation. Nature 1995;373:444-448.
9. O Connell J, O Sullivan GC, Collins JK, Shanahan F. The Fas counterattack: Fas-mediated T cell killing by colon
cells expressing Fas ligand. J Exp Med 1996;184:1075- 1082.
10. O Connell J, Bennett MW, O Sullivan GC, Collins JK, Shanahan F. The Fas counterattack: cancer as a site of immune privilege. Immunol Today 1999;20:46-52.
11. von Reyher U, Strater J, Kittstein W, Gschwendt M, Krammer PH, Moller P. Colon carcinoma cells use different mechanisms to escape CD95-mediated apoptosis. Cancer Res 1998;58:526-534.
12. Ungefroren H, Voss M, Jansen M, et al. Human pancreatic adenocarcinomas express Fas and Fas ligand yet are resistant to Fas-mediated apoptosis. Cancer Res 1998;58:
174 1- 1749.
13. Kornmann M, Ishiwata T, Kleeff J, Beger HG, Korc M. Fas and Fas-ligand expression in human pancreatic cancer . Ann Surg 2000;23 1:368-379.
14. Fisher GH, Rosenberg FJ, Straus SE, et al. Dominant interfering Fas gene mutations impair apoptosis in a human autoimmune lymphoproliferative syndrome. Cell 1995;8 1:
935-946.
15. Cascino I, Fiucci G, Papoff G, Ruberti G. Three functional soluble forms of the human apoptosis-inducing Fas molecule are produced by alternative splicing. J Immunol
1995; 154:2706-27 13.
16. Fiucci G, Ruberti G. Detection of polymorphism within the FAS cDNA gene sequence by GC-clamp denaturing gra- dient gel electrophoresis. Immunogenetics 1994;39:437-439.
17. Grønbæ k K, Straten PT, Ralfkiaer E, et al. Somatic Fas mutations in non-Hodgkin s lymphoma: association with extranodal disease and autoimmunity. Blood 1998;92:
30 18-3024.
18. Beltinger C, Kurz E, Böhler T, Schrappe M, Ludwig WD, Debatin KM. CD95 (APO- 1/Fas) mutations in childhood T-lineage acute lymphoblastic leukemia. Blood 1998;9 1:
3943-395 1.
19. Landowski TH, Qu N, Buyuksal I, Painter JS, Dalton WS.
Mutations in the Fas antigen in patients with multiple myeloma. Blood 1997;90:4266-4270.
20. Lee SH, Shin MS, Park WS, et al. Alterations of Fas (APO- 1/CD95) gene in transitional cell carcinomas of urinary bladder . Cancer Res 1999;59:3068-3072.
2 1. Lee SH, Shin MS, Park WS, et al. Alterations of Fas (Apo- 1/CD95) gene in non-small cell lung cancer . Oncogene 1999; 18:3754-3760.
22. Shin MS, Park WS, Kim SY, et al. Alterations of Fas (Apo- 1/CD95) gene in cutaneous malignant melanoma. Am J Pathol 1999; 154:1785- 179 1.
Kim, et al. Fas Gene Mutation in Pancreatic Cancer 12 7
23. von Bernstorff W, Spanj aard RA, Chan AK, et al.
Pancreatic cancer cells can evade immune surveillance via nonfunctional Fas (APO-1/CD95) receptors and aberrant expression of functional Fas ligand. Surgery 1999; 125:
73-84.
24. Martin SJ, Green DR. Apoptosis and cancer : the failure of controls on cell death and cell survival. Crit Rev Oncol Hematol 199 1; 18:137- 153.
25. Sato T, Irie S, Kituda S, Reed JC. FAP- 1: a protein tyrosine phosphatase that associates with Fas. Science
1995;268:4 11-4 15.
━━━━━━━━━━━━━━
26. Mori S, Murakami-Mori K, Jewett A, Nakamura S, Bona- vida B. Resistance of AIDS-associated Kaposi 's sarcoma cells to Fas-mediated apoptosis. Cancer Res 1996;56:
1874- 1879.
27. Irmler M, Thome M, Hahne M, et al. Inhibition of death receptor signals by cellular FLIP. Nature 1997;388:190- 195.
28. Hofmann K. The modular nature of apoptotic signaling proteins. Cell Mol Life Sci 1999;55:1113- 1128.
29. Hueber A-O. CD95: more than just a death factor? Nat Cell Biol 2000;2:E23-E25.