A R TIC LE Vol. 4, No. 1, May 2011
논문접수일: 2011년 3월 31일 / 심사완료일: 2011년 4월 25일
교신저자: 이재태, 대구시 중구 삼덕 2가 50, 700-721, 경북대학교병원 핵의학과
Tel: 053-420-5586, Fax: 053-422-0864, E-mail: jaetae@knu.ac.kr
This work was supported by Ministry of Education, Science & Technology (MEST) and National Research Foundation of Korea (NRF) through the Basic Atomic Energy Research Institute (BAERI, 2010).
본 논문은 2011년 대한핵의학회 젠자임학술상 수상자의 기념 논문임.
갑상선암의 핵의학 영상
경북대학교 의학전문대학원 핵의학교실
정신영, 이재태
Nuclear Imaging of Differentiated Thyroid Cancer: Current Status and Future Perspective
Shin Young Jeong, MD, PhD and Jaetae Lee, MD, PhD
Department of Nuclear Medicine, Kyungpook National University School of Medicine, Daegu, Korea
Nuclear imaging studies have been used for individualized treatment planning, and to optimize management in patients with differentiated thyroid cancer (DTC). Nuclear imaging studies demonstrate whole body distribution of radioactive tracer and are complementary to radiological studies as they give functional information. Recently, hybrid imaging modalities such as single photon emission computed tomography (CT) with integrated CT and positron emission tomography with integrated CT allow the rapid and efficient fusion of functional and anatomical images, and provide diagnostic information that influence management decision in patients with DTC. This article reviewed nuclear imaging studies and hybrid imaging modalities used in patients with DTC, and future perspectives of functional molecular imaging of the thyroid cancer.
Key Words: Thyroid cancer, Nuclear imaging
서 론
갑상선학의 발전은 핵의학의 발전과 그 시작을 같이 하여왔다. 1937년 Saul Hertz, Arthur Roberts, Robley Evans가 I-128 (반감기: 28분)를 이용한 토끼의 갑상선 대사를 처음 연구한 보고 이후, 1937년 J. Livingood와 G. Seaborg에 의하여 발견된 I-131 (반감기: 8.1일)는 1939년부터 갑상선의 생리 연구뿐만 아니라, 각종 갑상 선 질환의 감별진단에 널리 이용되기 시작하였고, 같 은 해에는 Emilio Segre와 Glenn Seaborg가 현재 갑상 선 핵의학 영상에 가장 널리 이용되는 Tc-99m을 발견 하였다.1)
분화된 갑상선암에서 핵의학 영상 검사의 이용은
1942년에 Keston 등에 의해 처음으로 시행된 후, 갑상 선암 전이 부위에서 방사성요오드가 집적됨이 보고되 었고,2) 1946년 Seidlin, Marinelli, Oshry는 I-131을 “ato- mic cocktail”이라는 명칭으로 갑상선암 환자의 치료에 시작한 바 있다. 1951년 Cassen의 신티레이션 스캐너 (rectilinear scanner), 1958년 Anger의 신티레이션 카메 라(gamma camera)의 개발로 방사성의약품의 전신적 분포를 영상화 할 수 있게 되었고, 갑상선암의 영상진 단과 방사성요오드 치료가 더욱 활성화 되었다. 한편 1996년 Carrasco 등과 Jhiang 등은 각각 쥐와 사람에서 요드의 갑상선 축적을 야기하는 NIS (sodium iodide symporter)유전자를 클로닝함으로써 여러 종류의 방사 성 의약품들의 갑상선 조직과 분화암에 섭취되는 기전 을 이해하고, 새로운 치료 분야를 개척할 수 있는 기반
을 마련하였다.
핵의학 영상 검사들은 방사성의약품의 전신적 분포 를 통해 기능적 정보를 제공하여, 해부학적 영상술들 과 상호보완적으로 분화된 갑상선암 환자에서 사용되 고 있다. 최근에 들어 영상기술들의 발달로 기능적 정 보와 해부학적 정보를 한번에 제공해주는 SPECT/CT 와 PET/CT의 이용이 늘고 있다. 이 논문에서 갑상선 암환자에서 현재 사용되고 있는 핵의학적 영상법을 살 펴보고, 새로운 갑상선 영상용 방사성의약품의 개발과 분자영상법의 응용 가능성을 알아보고자 하였다.
Tc-99m Pertechnetate Scan
Tc-99m pertechnetate (반감기: 6시간)는 sodium- iodide symporter (NIS)에 의하여 갑상선 세포내로 이동 이 되는 영상추적자로서 핵의학 시설이 있는 곳에서는 Tc-99m 발생기로부터 쉽게 구할 수 있고, 깨끗한 영상 을 얻을 수 있다는 장점이 있다. 그러나, 유기화 과정을 거치는 요오드와는 달리 세포내 섭취가 된 후, 비교적 빠른 시간에 다시 배출되므로, 갑상선암에 축적되는 것을 영상화하는 특이적 진단법으로는 적당하지 않다.
갑상선결절 환자의 Tc-99m pertechnetate 주사 후 20분 에 얻은 스캔영상에서 냉결절이 열결절보다 암의 가능 성이 높다고 알려져 있어, 미국갑상선학회 권고에서는 Tc-99m pertechnetate를 이용한 갑상선 스캔을 시행하 고 냉결절일 경우에 조직세포검사를 권하고 있으나,3) 초음파 유도하의 세포검사가 광범위하게 이루어지고 있는 우리의 현실에 그대로 적용하기에는 쉽지 않다.
Boughattas 등은 Tc-99m pertechnetate scan에서 림프절 과 폐전이 병소의 섭취를 보고한 증례가 있으나,4) Lee 등의 연구에서처럼 방사성요오드 치료 후 전신스캔과 비교하여 낮은 정도의 진단능이 보고되었으며,5) 갑상 선암 수술 후 잔여갑상선 조직이나 전이 병소 발견을 위해 Tc-99m pertechnetate를 이용한 스캔은 널리 이용 되고 있지 않다.
Radioactive Iodine Imaging
방사성요오드는 갑상선세포에 NIS를 통해 능동적으 로 유입되며, 갑상선 호르몬 합성에 사용되게 된다. 이 러한 특징을 이용하여 방사성요오드는 갑상선 기능 평 가에 널리 사용되어 왔다.6) 분화된 갑상선암 세포에서 도 일정부분 갑상선세포의 특징을 유지하고 있고 방사 성요오드를 갑상선암세포 내로 유입하게 된다. 이런
갑상선암세포의 특징을 이용하여 방사성요오드는 분 화된 갑상선암의 영상 진단과 치료에 이용되고 있다.7) I-131은 분화된 갑상선암 환자의 치료와 전신 스캔 을 위해 전통적으로 사용되어 온 방사성요오드이다.
I-131은 원자로에서 생산되며, 비교적 값이 싼 편이다.
I-131에서 방출되는 β-선은 치료에 사용되며, 동시에 방출되는 γ-선은 영상에 이용되게 된다. 하지만 비교 적 높은 에너지인 364 KeV γ-선으로 인해 산란현상이 많이 발생하게 되며, 영상의 질이 저하되게 된다. 더욱 이 진단적 영상으로 사용할 경우 β-선에 의한 갑상선 암세포의 “기절현상”이 보고되어 최소의 양을 사용할 것이 권고되고 있다.8) 이러한 이유로 최근에 I-123 이 용이 증가하는 추세이다. I-123은 싸이클로트론에서 생 산되며, 보다 비싼 방사성요오드이다. I-123은 핵의학 영상에 적당한 159 KeV γ-선을 방출하며, β-선은 방 출하지 않아, 영상의 질이 좋으며 “기절현상”의 위험은 낮은것으로 알려져 있다.
진단적 방사성요오드 전신스캔
진단적 방사성요오드 전신스캔은 I-131 (74∼150 MBq) 혹은 I-123 (30∼1,000 MBq)을 이용하여 방사성 요오드 치료 전 평가와 방사성요오드 치료 후 갑상선 분화암환자의 추적관찰에 이용된다. 방사선요오드 치 료 전 전신스캔은 요오드를 섭취하는 잔여갑상선조직 및 전이병소의 존재여부에 대한 정보를 제공한다. 하 지만 방사선요오드 치료 전 전신스캔 결과가 잔여 갑 상선제거술의 시행 여부의 결정에 미치는 영향이 적고, I-131에 의한 정상 갑상선조직이나 갑상선암에 대한 기 절효과(stunning)를 고려하여 방사성요오드 치료 전 전 신스캔을 시행하지 않는 경향이 증가하고 있으며,9) 검 사를 시행할 경우에는 I-123이나 2 mCi (74 MBq) 전후 의 저용량 I-131을 사용하고, 치료 용량은 진단 용량이 투여되고 72시간 이내에 투여하는 것이 적절하다고 대 한 갑상선학회 권고안에서는 권고하고 있다.8)
방사성요오드 잔여갑상선제거술 후 진단적 방사성 요오드 전신스캔은 갑상선분화암환자의 추적에 널리 이용되어왔다. 여러 연구에서 “저위험군” 환자에서 일 상적으로 시행하는 진단적 방사성요오드 전신스캔의 유용성이 떨어짐이 보고되었고,10) 대한갑상선학회 권 고안에서는 방사성요오드 잔여갑상선제거술을 시행받 고 치료 후 전신스캔을 시행한 “저위험군” 환자에서는 TSH-억제 thyroglobulin (Tg)가 측정되지 않고, 경부 초음파검사상 음성이라면 추적 관찰 중에 진단적 방사 성요오드 전신스캔을 일상적으로 시행할 필요는 없다
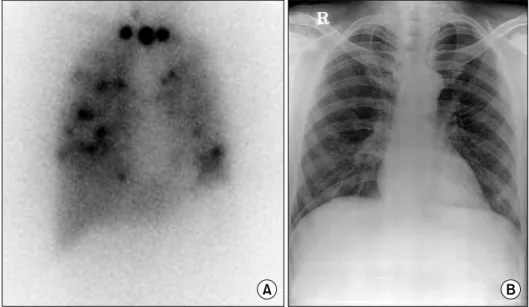
Fig. 1. Post-therapeutic I- 131 scan (A) and Chest radiograph (B) of 48 yr-old male patient with differen- tiated thyroid cancer. Post- therapeutic I-131 scan shows diffuse and nodular iodine uptake in both lung fields, suggesting disseminated lung metastases. Chest radio- graph shows no remarkable abnormal finding.
고 권고하고 있다.8) “중간위험군” 또는 “고위험군” 환 자에서는 방사성요오드 잔여갑상선제거술 후 6-12개월 후에 시행하는 소량의 I-131 또는 I-123 전신스캔이 유 용할 수 있다. 갑상선분화암환자의 추적관찰 중 가장 일반적인 적응증은 무증상 환자에서 Tg 수치가 지속적 으로 상승하는 경우이다. I-131은 반감기가 8일로 포적/
주위조직 섭취비율(target to background ratio)의 최적 화를 위해 I-131를 경구 투약 후 24∼72시간 이후에, I-123은 상대적으로 짧은 반감기(13시간)로 인해 6∼48 시간 영상을 획득할 수 있으며, 보통의 경우 24시간에 영상을 얻는 것이 적절하다.11) 저자들의 연구에서도 I-123 주사 후 6시간 영상에 비해 24시간 영상이 높은 정확성을 보였다.12)
진단적 방사성요오드 전신스캔은 병변의 요오드 섭 취능을 최대화시키기 위하여 투여중인 갑상선호르몬 을 중단하거나, rhTSH를 주사하여 TSH치를 30 mU/L 이상 상승시킨 후, 방사성요오드를 투여한다. 진단적 방사성요오드 전신스캔에서 비정상적인 섭취 소견이 관찰되면, 치료 방침의 결정을 위해 single-photon emis- sion computed tomography (SPECT) 영상 혹은 com- puted tomography (CT)와 같은 다른 단층 영상기술을 이용하여 섭취 증가 부위를 국소화시킨다. 임상적으로 갑상선암 병변이 의심되나, 진단적 방사성요오드 전신 스캔에서 비정상적인 섭취 소견이 관찰되지 않을 경우 엔 혈관조영제나 amiodarone과 같은 요오드를 함유한 약제에 의해 방사성요오드의 섭취가 영향을 받았는가 를 조사하여야 하며, 검사 전 부적절한 준비로 인해 갑 상선 자극 호르몬(TSH)의 상승이 부족하였는가를 확
인하여야 한다.13)
방사성요오드 치료 후 전신스캔
치료 용량의 I-131 (3.7∼10.1 GBq)은 수술 후 갑상 선 잔여조직 제거나 잔여갑상선암, 재발 및 전이 병소 치료를 위해 사용된다. I-131 치료 후 전신 스캔은 투약 후 3∼7일 사이에 시행한다. 치료 전 진단적 전신스캔 과 비교하여 치료 후 전신스캔은 보다 많은 병소를 발 견할 수 있어 반드시 시행해야 한다.14,15) 진단적 방사성 요오드 전신스캔과 비교하여 방사성요오드 치료 후 전 신스캔에서는 10∼26%의 전이 병소가 추가로 발견되 는데, 새로운 비정상적 요오드 섭취는 경부, 폐, 종격동 에서 가장 흔하게 발견되었고, 이러한 새로운 병변은 약 10%의 환자에서 병기에 영향을 주거나 9∼15%에서 치료 방침에 영향을 준 것으로 보고되었다.16-18)
분화된 갑상선암 세포의 탈분화가 일어나면 암세포 의 방사성요오드 섭취는 감소되며, 방사성요오드 치료 효과가 감소된다. 방사성요오드 치료 후 전신스캔에서 갑상선암 조직에 방사성요오드가 섭취 정도는 환자의 예후와 관계되어 있으며, 섭취가 낮을 경우 나쁜 예후 를 나타낸다.19)
방사성요오드 치료 후 전신스캔, 특히 지연 스캔에 서 간에 미만성 섭취는 자주 관찰되며, radiolabeled thyroxine의 간대사로 인해 나타나는 것으로 여겨진다.
잔여갑상선제거술 후 전신 스캔에서 이러한 소견은 잔 여갑상선 조직에 의해 생성되는 radiolabeled thyroxine 에 의한 것으로 판단되나, 성공적인 잔여갑상선제거술 을 시행한 환자에서는 방사성요오드 전신스캔에서 미
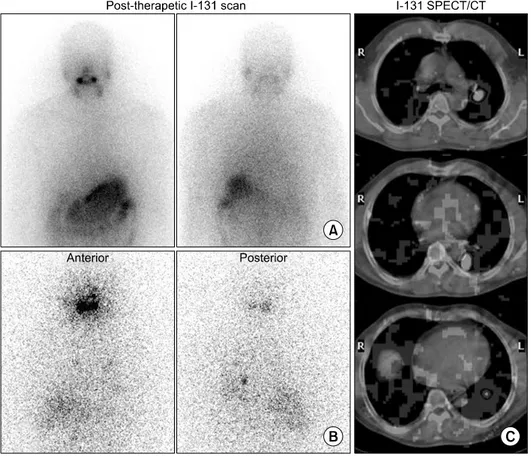
Fig. 2. Post-therapeutic I- 131 scan at 3 day (A) and 7 day (B), and SPECT/CT (C) after high dose I-131 the- rapy in 52 yr-old male pat- ient underwent total thyroi- dectomy and radioiodine ab- lation due to differentiated thyroid cancer. SPECT/CT (C) shows intense iodine accumulation in lung meta- stases.
만성 간섭취만 관찰되는 경우에선 국소적으로 섭취가 관찰되진 않지만 요드섭취 기능이 보존된 암세포가 남 아 있는 것을 암시한다.20)
방사성요오드 전신스캔은 특히 폐전이의 발견에 높 은 민감도를 나타낸다.21) 갑상선암은 속립성 폐전이가 많은 경향이 있어 흉부 X-선 검사에선 관찰되지 않는 경우가 많으며, 심지어 흉부 CT에서 병소가 관찰되지 않고 방사성요오드 전신스캔에선 미만성의 높은 폐섭 취를 보이는 경우도 있다(Fig. 1). 이런 방사성요오드 전신스캔에서만 관찰되는 전이의 경우 방사성요오드 치료에 반응이 좋으며, CT 등 다른 영상검사에서 관찰 되는 경우보다 좋은 예후를 보인다.22) 폐전이는 방사성 요오드 치료 전 진단 스캔에서 관찰되지 않다가 치료 후 전신 스캔에서 관찰되는 경우도 있다.13,15) 여성 환자 의 경우 미만성 폐섭취는 전면 영상에서 유방의 생리 적 섭취와 구별이 모호한 경우가 있으며, 이런 경우 측 면 영상이 도움이 된다.
뼈는 갑상선암에서 전이가 잘 발생하는 부위 중 하 나로서, 전신 영상검사가 필요하며 방사성요오드 전신 스캔은 이러한 목적에 잘 부합하는 검사이다. 방사성 요오드를 이용한 전신스캔에서 뼈전이가 의심되는 소 견이 관찰되면 정확한 해부학적 위치 판단을 위해 CT
같은 영상검사나 SPECT 검사가 필요하다.
방사성요오드 SPECT/CT (Radioiodine SPECT-CT Imaging)
PET/CT의 사용이 증가함과 더불어 SPECT/CT 기 술의 이용에 대한 관심도 증가하고 있다. 더불어 SPECT/CT가 뼈영상, somatostatin 수용체영상, 부갑상 선 영상 및 부신영상에서 평면 영상이나 SPECT 영상 에 비해 보다 나은 성적을 보인다고 보고되었고,23) SPECT/CT의 진단적 성능의 향상은 방사능의 해부학 적 부위 정보 제공과 CT를 이용한 감쇄보정에 의한다 고 생각된다.
갑상선암 환자에서 I-131 SPECT/CT의 역할에 대한 여러 연구들이 있어 왔으며, 주로는 치료 후 I-131 SPECT/CT에 대한 연구가 있었다. Tharp 등은 방사성 요오드 전신스캔과 비교하여 SPECT/CT가 57%의 환 자에서 진단적에 도움이 되었으며, 환자의 치료 방침 결정에 영향을 미친다고 보고한 바가 있다.24)
SPECT/CT가 방사능요오드 섭취 부위의 보다 정확 한 해부학적 정보로 제공함으로써 생리적인 섭취와 갑 상선암에 의한 섭취를 정확히 구별할 수 있었다. 생리 적인 방사성요오드 섭취는 침샘, 점막, 위, 장, 신장, 방
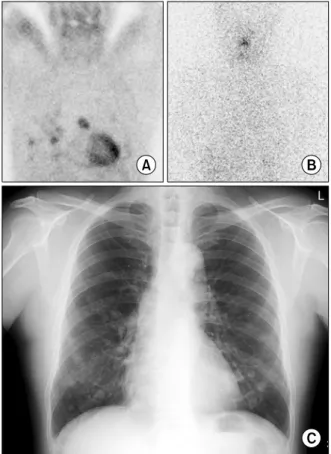
Fig. 3. Tc-99m MIBI whole body scan (A), post-therapeutic I-131 scan (B) and Chest PA (C) in 57 yr-old male patient with differentiated thyroid cancer. Tc-99m MIBI whole body scan (A) shows multiple hot uptakes in both lung fields, suggesting lung metastases. However, post-therapeutic I-131 scan (B) shows no abnormal iodine uptake in both lung fields. Chest PA (C) shows multiple nodular lesions in both lung, suggesting lung metastases.
광 및 흉선 등의 장기에서 관찰되며, 타액과 소변으로 배출된다. 평면 스캔영상에서 생리적인 섭취들과 타액 과 소변에 의한 오염은 병적 섭취로 오인될 수 있다.25) 평면 스캔에서 예기치 못한 섭취가 관찰될 때 SPECT/
CT는 생리적인 섭취와 병적 섭취를 구분할 수 있는 좋 은 도구이다. 예를 들어 평면영상에서 종격동의 섭취 가 관찰될 때, 생리적인 섭취(esophageal secretions, gastrooesophageal reflux, hiatus hernia, thymus, trache- obronchial aspiration and breast tissue)와 병적 섭취 (mediastinal nodal, pulmonary or osseus metastases)를 구분하여 진단에 도움을 주며, 치료방향 결정에 영향 을 미치게 된다.26)
또한 SPECT/CT 기술의 이용은 모호한 병소의 정확 한 국소화를 통해 분화된 갑상선암 환자에서 I-131 스 캔의 진단적 정확도를 향상시킨다(Fig. 2). SPECT/CT 를 이용하여서 잔여갑상선제거술 후 I-131 전신스캔에 선 잘 구별되지 않는 잔여갑상선과 경부림프절 전이를 구분할 수 있으며,27) 전신스캔상 모호한(equivocal) 병 변의 진단에 도움이 되었다.28) SPECT/CT는 방사성요 오드 치료 후 스캔이나 진단적 전신 스캔과 비교하여 진단 정확도를 21∼73.9% 정도 상승시킨다고 한다.29) 특히 SPECT/CT는 35∼47%의 환자에서 치료방침 변 화에 영향을 주게 되고, 약 20%의 환자에서 불필요한 치료를 피할 수 있게 하였다. 또한 SPECT/CT 결과로 약 25%의 환자에서 재발 위험군의 변화를 가져오게 하
였다.28,30) 또한, CT를 통한 감소보정이 가능해짐으로
써 치료 목표의 크기를 측정하고 방사성요오드 섭취 정도를 계산하여 보다 나은 치료 방침을 결정하는데 도움을 주게 되었다.31)
Tl-201, Tc-99m MIBI, Tc-99m Tetrofosmin Scan
K (potassium) 유사체인 Tl-201은 Na-K-ATPase에 의하여 능동적으로 세포내로 이동되는 방사성핵종으 로서 혈류분포가 많거나, 대사가 활발한 세포에 많이 섭취되는 특성이 있어 악성 갑상선결절의 감별진단과 갑상선암의 추적 시 국소 재발이나 전이의 검사에 이 용이 되었다. 그러나, 긴 반감기와 낮은 에너지로 영상 이 선명하지 못하고, 사이클로트론으로 생산되므로 사 용이 불편한 관계로 일본과 우리나라를 중심으로 많이 연구되었으나 보편화되지는 못하였다.
Tc-99m MIBI (methoxyisobutylisonitrile)과 Tc-99m tetrofosmin는 지용성 리간드로서 수동확산으로 세포의
세포막과 미토콘드리아막을 통과한다. 미토콘드리아 막의 음성전하가 세포막보다 크기 때문에 1가의 양이 온을 형성하는 Tc-99m MIBI는 대부분 미토콘드리아 내에 포획된다. 암세포에서도 Tc-99m MIBI는 미토콘 드리아내 포획되게 되고 이를 이용해 분화된 갑상선암 평가에 사용되게 된다. MIBI, tetrofosmin는 핵의학에 서 가장 쉽고 많이 이용되는 Tc-99m 표지 방사성의약 품으로써 영상의 질이 우수하고 사용 접근성이 좋다는 장점을 가지고 있으며, 더불어 방사성요오드 스캔을 촬영하기 위한 갑상선 호르몬 보충 중지와 같은 전처 치가 필요하지 않다는 장점이 있다. Tc-99m tetro- fosmin과 Tc-99m MIBI을 이용한 영상은 진단능에서는 차이가 없으나, Tc-99m tetrofosmin을 이용한 영상이 표적/주위조직 섭취비율이 Tc-99m MIBI를 이용한 영 상보다 높다고 알려져 있다.32)
가장 일반적인 적응증은 Tg치가 상승하였으나 방사 성요오드 스캔에서 병변을 찾을 수 없는 경우이다(Fig.
3). Tg치가 상승하였으나 방사성요오드 스캔에서 병변 을 찾을 수 없는 환자 연구에서 Tc-99m tetrofosmin는 갑상선암 전이를 발견하는 민감도가 57.9∼74%로 보고
되었다.33,34) Tc-99m MIBI를 이용한 연구에서 림프절
전이 진단에 높은 민감도가 보고 되었으나,35) 폐전이의 진단에는 방사성요오드에 비해 낮은 정확도를 보인다 고 알려져 있다.36) Tc-99m MIBI 스캔은 미토콘드리아 는 세포내 많이 분포하나 요오드를 집적하지 않는 Hurthle 세포 종양의 평가에 유용하게 사용될 수 있 다.37) 또한 정상 갑상선조직이 남은 환자에서 요드스캔 은 투여량이 대부분 정상조직에 섭취되어, 전이병변에 관찰되지 않을 수 있으나, MIBI, tetrofosmin, T-201 스 캔은 잔류 갑상선 조직의 존재 여부와 관련이 없이 영 상화 할 수 있다는 장점이 있다.
그러나 Tc-99m Tetrofosmin과 Tc-99m MIBI는 방사 성요오드와 달리 특이도가 매우 낮다는 단점을 지니고 있다. Tc-99m Tetrofosmin과 Tc-99m MIBI는 방사성요 오드와 달리 갑상선암외 다른 종류의 암종에도 섭취가 관찰된다.38) 최근 F-18 PET가 광범위하게 보급된 이후 에는 F-18 FDG PET나 PET/CT로 대체되고 있다.
PET (Positron Emission Tomography)
대부분의 악성 종양의 진단과 병기결정, 치료효과의 평가, 재발 및 전이암의 진단에 PET, PET/CT가 이용 되고 있으며, 최근 암세포의 생물학적 및 생화학적 특 성이나, 환자의 유전적 소양을 특이적으로 구별할 수 있는 암세포의 특이적 물질을 개발하고 병변을 특이적 으로 표적하는 추적자들이 개발되고 있다. 그러므로 PET 영상을 기반으로 한 환자나 병변에 맞춤치료를 할 수 있을 뿐만 아니라, 새로 개발된 약제나 치료방법 의 효과를 조기에 평가할 수 있고, 필요에 따라 치료방 법을 변경할 수도 있다. 현재 갑상선암에서는 F-18 FDG (fluorodeoxyglucose), I-124를 방사성의약품으로 이용한 PET 영상이 널리 사용되고 있다.
F-18 FDG PET/CT
분화된 갑상선암 환자에서 F-18 FDG PET/CT의 확 립된 역할은 thyroglobulin (Tg) 수치가 상승하였으나 진단적 방사성요오드 스캔에서 의심부위가 없는 경우 에 숨은 전이 조직을 찾는 것이다.39) 분화갑상선암의
수술 전 병기결정에서는 효용성을 인정받지 못하고 있 다.
방사성요오드를 집적할 능력이 없는 전이나 잔여갑 상선암의 발견 및 수술 혹은 방사선 치료 같은 치료 방침 결정에 F-18 FDG PET/CT의 이용은 증가하고 있다. 대한갑상선학회 권고안에는 분화도가 나쁜(poor- ly differentiated) 갑상선암 또는 침습성 Hürthle 세포암 의 초기 병기 결정의 일환으로, 특히 영상 검사에서 다 른 병변의 증거가 있거나 혈청 Tg 수치가 상승된 경우, 전이 병소가 있는 환자에서 급속한 병의 진행이나 암 에 의한 사망의 위험이 높은 환자를 식별하는 예측 방 법으로 쓰고자 하는 경우, 그리고 전이성 또는 국소 침 습성 병변의 전신 또는 국소치료 후 치료 반응을 평가 하고자 하는 경우에 이용할 수 있다고 권고하였다.8)
분화된 갑상선암세포에서 요오드와 포도당의 섭취 의 차이가 있다. 갑상선암세포가 보다 침습적인 성향 을 보일 때 포도당 대사는 증가하며, 요오드 섭취능은 감소하게 되고 그에 따라 방사성요오드 스캔상 섭취 부위가 관찰되지 않으나, F-18 FDG PET에서 포도당 대사 증가 병소가 관찰되게 된다. 그와 반대로 요오드 섭취능을 유지하고 있는 분화된 갑상선암에서 F-18 FDG PET의 병소 발견능은 감소한다. 이러한 사실은 F-18 FDG PET 영상소견을 방사성요오드스캔과 비교 하면, 갑상선암환자의 병변에 특이적인 맞춤치료를 가 능하게 할 것이다.
F-18 FDG PET/CT의 진단적 성능을 올리기 위해, rhTSH 혹은 갑상선 호르몬 투약 중단을 통한 TSH 자 극하에 시행함이 권고되고 있다.8) 갑상선암에서 FDG 섭취는 TSH 자극에 의해 상승한다. 임상적 연구에서 도 TSH 자극하에 시행한 F-18 FDG PET/CT가 TSH 억제하에 시행한 F-18 FDG PET/CT 검사보다 숨은 전이나 잔여갑상선암을 찾을 수 있다고 보고하였다.40)
Tg 수치가 상승된 환자에서 F-18 FDG PET/CT의 전이 병변 발견에 대한 민감도 85%, 특이도 95% 정도 로 보고된 바 있으므로, 이 같은 경우에 F-18 FDG PET/CT 전신 검사가 유용한 검사법으로 사용되고 있 다.39) F-18 FDG PET/CT는 경부림프절 전이 발견에 도움을 주고 있으며, 수술 부위 결정에 도움을 준다.
또한 분화된 갑상선암에서 흔히 전이가 되는 뼈와 폐 병변을 쉽게 평가할 수 있다. Seo 등은 Tg치가 정상이 나 anti-Tg antibody 수치가 정상의 3배 이상 증가되었 거나, 추적검사상 anti-Tg antibody가 증가하는 경향을 보이는 경우 갑상선암의 재발이나 전이병변이 많았고, F-18 FDG PET/CT는 경부 초음파검사에서 진단하지
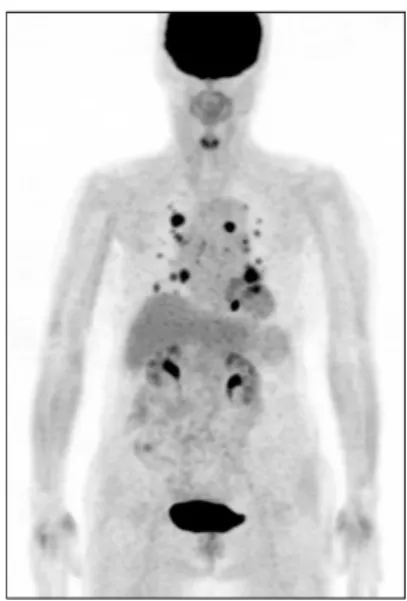
Fig. 4. F-18 FDG PET/CT in 81 yr-old female patient with differentiated thyroid cancer. F-18 FDG PET/CT shows multiple hypermetabolic nodules in both lung fields, suggesting lung metastases. In radioimmunoassay, serum thyroglobulin under thyroid hormone suppression was not detectable (<0.2 ng/ml), but anti-thyroglobulin antibody was highly elevated (>
4,000 U/ml).
못하였던 16개의 병변(21%), 전신스캔에서 진단할 수 없었던 17개의 병변(22.4%)을 추가로 진단할 수 있었다 (Fig. 4).41)
I-124 PET or PET/CT
I-131 혹은 I-123을 사용한 전신 스캔에 비해 I-124 PET 혹은 PET/CT는 훨씬 높은 공간해상력과 민감도 를 가지고 있다. 현재 I-124의 사용에 대한 활발한 연구 가 진행중이다. I-131 혹은 I-123 진단적 전신 스캔, I-131 치료 후 스캔과 I-124 PET/CT와의 비교 연구에 서 Phan 등은 I-124 PET/CT는 전이 병소 발견에 방사 성요오드를 이용한 진단적 검사보다 월등히 우수하며, 치료 후 I-131 전신 스캔과 비슷한 정도를 보였다고 보 고하였으며,42) Capoccetti 등의 연구에서는 I-124 PET/
CT는 치료 전 병기 결정에 유용하고, 치료 후 I-131 전 신 스캔보다 높은 민감도를 보이며, 기절효과도 보이 지 않았다고 보고하였다.43) I-124 PET/CT는 낮은 민감 도를 보이는 진단적 방사성요오드 전신스캔을 대체할 수 있는 유용한 방법이 될 것으로 판단된다. 또한 I-124 PET/CT은 방사성요오드 용량 결정을 위한 방사선량 분석에 사용될 수 있다. 잔여갑상선제거술에 있어서 적절한 방사선량 측정을 위한 진단적 방사성요오드 전 신스캔의 이용은 스캔의 질이 낮고, 방사성요오드 섭 취의 정량적 분석의 부적합성, 높은 오차로 인해 널리
사용되고 있지 않다. I-124는 I-131 혹은 I-123으로 할 수 없었던 요오드 동역학(iodine kinetics)에 대한 정량 적 분석을 가능하게 해주며, CT를 이용하여 해당 병변 의 부피를 계산할 수 있다. 또한 잔여갑상선제거술 전 I-124 PET/CT 검사는 예상치 않은 전이 병소를 보다 정확하게 찾아 낼 수 있어 적절한 용량의 방사성요오 드를 사용할 수 있다. 여러 연구에서 I-124 PET/CT를 이용한 방사선량측정으로 많은 환자에서 경험적 용량 에 비해 적은 용량의 방사성요오드를 사용하게 되었고, 방사선 노출에 위험이 있는 장기의 피폭선량을 줄일 수 있다고 보고하였다.43,44) 또한 Freudenberg 등의 연구 에서는 전이 병소 발견능은 CT가 56%, 치료 후 I-131 전신 스캔이 83%, I-124 PET이 87%, 그리고 I-124 PET/CT가 100%로 보고하였다.45) 잔여갑상선제거술 전 I-124 PET/CT를 이용함으로 예기치 못한 전이를 발견하고 그에 따라 적절한 치료 방침과 방사성요오드 의 치료용량이 조정되었다고 보고하였다.
I-124 PET/CT를 이용한 국소재발과 전이병소 발견 에 대한 보고는 아직 많지는 않다. Tg가 상승하였으나 경부초음파 검사에서 이상을 발견할 수 없는 환자를 대상으로 I-124 PET/CT와 F-18 FDG PET/CT 검사를 시행한 연구에서 국소재발 발견에서 I-124 PET/CT 민 감도 60%, F-18 FDG PET/CT 65%, 그리고 CT scan이 20%였으며, 병리학적으로 증명된 병소의 1/3에서만 I- 124 PET/CT와 F-18 FDG PET/CT 모두에서 섭취가 관찰되었고 나머지 2/3은 한 가지 검사에서만 섭취가 발견되어, I-124 PET/CT와 F-18 FDG PET/CT는 상호 보완적이며 국소재발이나 전이병소 검사를 위해 동시 에 시행하는 것이 필요하다고 보고하였다.46) 분화된 갑 상선암 환자에 I-124 PET/CT의 적용에 대해 더 많은 다양한 연구가 더 필요할 것으로 생각된다.
Future Perspectives for Molecular Imaging of Thyroid Cancer
NIS 단백질을 운반기질로 이용하는 I-131, I-123, Tc- 99m pertechnetate 감마카메라 영상은 지난 50년 이상 갑상선암의 진단과 치료에 유용하게 사용되어왔다. 최 근에는 높은 공간해상력과 정량적 분석이 가능하다는 장점을 지닌 PET을 위하여 NIS PET 추적자로 Tc-94m pertechnetate가 개발되었으나, 합성이 복잡하 여 널리 사용되기 어려워, I-124 PET이 갑상선암의 진 료에 가장 많이 이용되고 있다. 그러나 I-124 생산을 위 해서는 비교적 대용량 사이클로트론과 타겟 설비가 필
요하여 핵의학 임상에서 널리 사용하기 어렵고, posi- tron yield가 낮고 반감기가 길어서 단위조직에 대한 방 사선조사량이 PET 영상에 많이 이용되는 F-18에 비해 18배 많다는 단점이 있다. 그러므로 사용하기 쉽고 공 간해상력이 뛰어난 F-18로 표지한 NIS PET 추적자의 개발이 필요하였고, Jauregui-Osoro 등은 F-18 tetra- fluoroborate가 hNIS가 독성이 적고, 쉽게 합성이 가능 한 우수한 PET용 방사성의약품으로 사용될 수 있음을 보고하였고,47) 임상에서도 적용이 되리라 생각된다.
핵의학적 분자영상 기법은 세포에서 일어나는 분자 수준의 변화를 영상화하여, 환자의 유전자수준에서의 변화와 질병에 의한 체내 변화를 조기에 진단할 수 있 다는 장점이 있다. 저자들은 방사성요오드에서 방출되 는 방사선과 물질과의 상호작용에서 생성되는가를 Cerenkov radiation을 이용하여 핵의학 영상기기를 이 용하지 않고도 광학영상기기만을 이용하여 갑상선영 상을 얻을 수 있음을 보고한 바가 있다. 이러한 융합영 상과 새로운 추적자의 개발은 환자 각각에 적절한 치 료 방법을 쉽게 선택할 수 있게 하여 준다. 연구분야에 서도 분자영상 기법의 갑상선 분야 응용을 위한 새로 운 시도들은 갑상선세포 및 갑상선암 연구에도 많은 도움을 줄 수 있을 것으로 판단된다. 특히, 소동물 실험 에 적절한 분자영상 실험기반의 완비는 새로운 약제의 개발과정에서 개발 기간을 현저하게 단축할 수 있게 하며, 비침습적인 방법으로 분자수준에서 질병을 진단 하고 치료에 따른 경과관찰을 위한 적절한 영상기술을 개발하는 전초기지 역할을 할 것으로 판단된다.
결 론
분화된 갑상선암에서 핵의학 영상 검사는 유용한 도 구로 사용되어 왔다. SPECT/CT나 PET/CT의 사용 및 I-124의 사용은 분화된 갑상선암환자에게 보다 정확한 정보를 제공하고 적절한 치료를 받을 수 있게 도움을 줄 것이다. 분화된 갑상선암에서 핵의학 영상 검사의 이용에 대한 정확한 이해로 적절한 임상적 적용이 필 요하며, 새로 적용되는 방사성동위원소와 기기에 대한 폭 넓은 연구가 필요할 것이다.
중심 단어: 갑상선암, 핵의학 영상.
References
1) Sawin CT, Becker DV. Radioiodine and the treatment of hyperthyroidism: The early history. Thyroid 1997;7(2):163-76.
2) Keston AS, Ball RP, Frantz VK, Palmer WW. Storage of radioactive iodine in a metastasis from thyroid carcinoma.
Science 1942;95(2466):362-3.
3) Cooper DS, Doherty GM, Haugen BR, Kloos RT, Lee SL, Mandel SJ, et al. Revised American thyroid association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009;19(11):1167-214.
4) Boughattas S, Hassine H, Arifa N, Chatti K, Degdegui M, Abdelkefi M, et al. Preoperative scintigraphic visualization of lymph nodes and pulmonary metastases from papillary thyroid carcinoma. Ann Nucl Med 2004;18(1):59-62.
5) Lee JR, Ahn BC, Jeong SY, Lee J, Lee KB. Detection for residual thyroid tissue and metastatic lesion after total thyroidectomy in patients with differentiated thyroid cancer:
Comparison between Tc-99m pertechnetate scan and high dose I-131 therapy scan. Korean J Nucl Med 2003;37(2):120-7.
6) Rosenberg IN. Evaluation of thyroid function. N Engl J Med 1972;286(17):924-7.
7) Sherman SI. Thyroid carcinoma. Lancet 2003;361(9356):
501-11.
8) Yi KH, Park YJ, Koong SS, Kim JH, Na DG, Ryu JS, et al. Revised Korean thyroid association management guidelines for patients with thyroid nodules and thyroid cancer. J Korean Thyroid Assoc 2010;3(2):65-96.
9) Muratet JP, Giraud P, Daver A, Minier JF, Gamelin E, Larra F. Predicting the efficacy of first iodine-131 treatment in differentiated thyroid carcinoma. J Nucl Med 1997;38(9):
1362-8.
10) Mazzaferri EL, Robbins RJ, Spencer CA, Braverman LE, Pacini F, Wartofsky L, et al. A consensus report of the role of serum thyroglobulin as a monitoring method for low-risk patients with papillary thyroid carcinoma. J Clin Endocrinol Metab 2003;88(4):1433-41.
11) Shankar LK, Yamamoto AJ, Alavi A, Mandel SJ. Comparison of 123I scintigraphy at 5 and 24 hours in patients with differentiated thyroid cancer. J Nucl Med 2002;43(1):72-6.
12) Lee HJ, Lee SW, Song BI, Kang SM, Seo JH, Yoo J, et al.
Optimal imaging time for diagnostic I-123 whole body scan in the follow-up of patients with differentiated thyroid cancer:
Comparison between 6- and 24-hour images of the same subjects.
Nucl Med Mol Imaging 2009;43(2):129-36.
13) Mazzaferri EL, Kloos RT. Clinical review 128: Current approaches to primary therapy for papillary and follicular thyroid cancer. J Clin Endocrinol Metab 2001;86(4):1447-63.
14) Pacini F, Lippi F, Formica N, Elisei R, Anelli S, Ceccarelli C, et al. Therapeutic doses of iodine-131 reveal undiagnosed metastases in thyroid cancer patients with detectable serum thyroglobulin levels. J Nucl Med 1987;28(12):1888-91.
15) Schlumberger M, Mancusi F, Baudin E, Pacini F. 131I therapy for elevated thyroglobulin levels. Thyroid 1997;7(2):
273-6.
16) Fatourechi V, Hay ID, Mullan BP, Wiseman GA, Eghbali- Fatourechi GZ, Thorson LM, et al. Are posttherapy radioiodine scans informative and do they influence subsequent therapy of patients with differentiated thyroid cancer? Thyroid 2000;10(7):
573-7.
17) Sherman SI, Tielens ET, Sostre S, Wharam MD Jr, Ladenson
PW. Clinical utility of posttreatment radioiodine scans in the management of patients with thyroid carcinoma. J Clin Endocrinol Metab 1994;78(3):629-34.
18) Souza Rosário PW, Barroso AL, Rezende LL, Padrão EL, Fagundes TA, Penna GC, et al. Post I-131 therapy scanning in patients with thyroid carcinoma metastases: An unnecessary cost or a relevant contribution? Clin Nucl Med 2004;29(12):
795-8.
19) Kogai T, Hershman JM, Motomura K, Endo T, Onaya T, Brent GA. Differential regulation of the human sodium/iodide symporter gene promoter in papillary thyroid carcinoma cell lines and normal thyroid cells. Endocrinology 2001;142(8):3369-79.
20) Chung JK, Lee YJ, Jeong JM, Lee DS, Lee MC, Cho BY, et al. Clinical significance of hepatic visualization on iodine-131 whole-body scan in patients with thyroid carcinoma. J Nucl Med 1997;38(8):1191-5.
21) Küçük ON, Gültekin SS, Aras G, Ibiş E. Radioiodine whole-body scans, thyroglobulin levels, 99mTc-MIBI scans and computed tomography: Results in patients with lung metastases from differentiated thyroid cancer. Nucl Med Commun 2006;27(3):261-6.
22) Hindié E, Mellière D, Lange F, Hallaj I, de Labriolle-Vaylet C, Jeanguillaume C, et al. Functioning pulmonary metastases of thyroid cancer: Does radioiodine influence the prognosis? Eur J Nucl Med Mol Imaging 2003;30(7):974-81.
23) Buck AK, Nekolla S, Ziegler S, Beer A, Krause BJ, Herrmann K, et al. SPECT/CT. J Nucl Med 2008;49(8):1305-19.
24) Tharp K, Israel O, Hausmann J, Bettman L, Martin WH, Daitzchman M, et al. Impact of 131I-SPECT/CT images obtained with an integrated system in the follow-up of patients with thyroid carcinoma. Eur J Nucl Med Mol Imaging 2004;31(10):1435-42.
25) Shapiro B, Rufini V, Jarwan A, Geatti O, Kearfott KJ, Fig LM, et al. Artifacts, anatomical and physiological variants, and unrelated diseases that might cause false-positive whole-body 131-I scans in patients with thyroid cancer. Semin Nucl Med 2000;30(2):115-32.
26) Haveman JW, Phan HT, Links TP, Jager PL, Plukker JT.
Implications of mediastinal uptake of 131I with regard to surgery in patients with differentiated thyroid carcinoma. Cancer 2005;103(1):59-67.
27) Wong KK, Zarzhevsky N, Cahill JM, Frey KA, Avram AM.
Incremental value of diagnostic 131I SPECT/CT fusion imaging in the evaluation of differentiated thyroid carcinoma. AJR Am J Roentgenol 2008;191(6):1785-94.
28) Chen L, Luo Q, Shen Y, Yu Y, Yuan Z, Lu H, et al.
Incremental value of 131I SPECT/CT in the management of patients with differentiated thyroid carcinoma. J Nucl Med 2008;49(12):1952-7.
29) Spanu A, Solinas ME, Chessa F, Sanna D, Nuvoli S, Madeddu G. 131I SPECT/CT in the follow-up of differentiated thyroid carcinoma: Incremental value versus planar imaging. J Nucl Med 2009;50(2):184-90.
30) Schmidt D, Szikszai A, Linke R, Bautz W, Kuwert T. Impact of 131I SPECT/spiral CT on nodal staging of differentiated thyroid carcinoma at the first radioablation. J Nucl Med 2009;50(1):18-23.
31) Patel CN, Chowdhury FU, Scarsbrook AF. Clinical utility of hybrid SPECT-CT in endocrine neoplasia. AJR Am J Roentgenol 2008;190(3):815-24.
32) Lind P, Gallowitsch HJ. The use of non-specific tracers in the follow up of differentiated thyroid cancer: Results with Tc-99m tetrofosmin whole body scintigraphy. Acta Med Austriaca 1996;23(1-2):69-75.
33) Wu HS, Liu FY, Huang WS, Liu YC, Chang CT, Kao CH.
Technetium-99m tetrofosmin single photon emissioncomputed tomography to detect metastatic papillary thyroid carcinoma in patients with elevated human serum thyroglobulin levels but negative I-131 whole body scan. Clin Radiol 2003;58(10):
787-90.
34) Lind P, Gallowitsch HJ, Langsteger W, Kresnik E, Mikosch P, Gomez I. Technetium-99m-tetrofosmin whole-body scinti- graphy in the follow-up of differentiated thyroid carcinoma. J Nucl Med 1997;38(3):348-52.
35) Küçük NO, Külak HA, Aras G. Clinical importance of technetium-99m-methoxyisobutylisonitrile (MIBI) scintigraphy in differentiated thyroid carcinoma patients with elevated thyroglobulin levels and negative I-131 scanning results. Ann Nucl Med 2006;20(6):393-7.
36) Ng DC, Sundram FX, Sin AE. 99mTc-sestamibi and 131I whole-body scintigraphy and initial serum thyroglobulin in the management of differentiated thyroid carcinoma. J Nucl Med 2000;41(4):631-5.
37) Vattimo A, Bertelli P, Cintorino M, Burroni L, Volterrani D, Vella A. Identification of Hürthle cell tumor by single-injection, double-phase scintigraphy with technetium- 99m-sestamibi. J Nucl Med 1995;36(5):778-82.
38) Aktolun C, Bayhan H, Kir M. Clinical experience with Tc-99m MIBI imaging in patients with malignant tumors. Preliminary results and comparison with Tl-201. Clin Nucl Med 1992;17(3):171-6.
39) Feine U. Fluor-18-deoxyglucose positron emission tomography in differentiated thyroid cancer. Eur J Endocrinol 1998;138(5):
492-6.
40) Chin BB, Patel P, Cohade C, Ewertz M, Wahl R, Ladenson P. Recombinant human thyrotropin stimulation of fluoro- D-glucose positron emission tomography uptake in well- differentiated thyroid carcinoma. J Clin Endocrinol Metab 2004;89(1):91-5.
41) Seo JH, Lee SW, Ahn BC, Lee J. Recurrence detection in differentiated thyroid cancer patients with elevated serum level of antithyroglobulin antibody: Special emphasis on using (18)F-FDG PET/CT. Clin Endocrinol (Oxf) 2010;72(4):
558-63.
42) Phan HT, Jager PL, Paans AM, Plukker JT, Sturkenboom MG, Sluiter WJ, et al. The diagnostic value of 124I-PET in patients with differentiated thyroid cancer. Eur J Nucl Med Mol Imaging 2008;35(5):958-65.
43) Capoccetti F, Criscuoli B, Rossi G, Ferretti F, Manni C, Brianzoni E. The effectiveness of 124I PET/CT in patients with differentiated thyroid cancer. Q J Nucl Med Mol Imaging 2009;53(5):536-45.
44) Jentzen W, Hobbs RF, Stahl A, Knust J, Sgouros G, Bockisch A. Pre-therapeutic (124)I PET(/CT) dosimetry confirms low
average absorbed doses per administered (131)I activity to the salivary glands in radioiodine therapy of differentiated thyroid cancer. Eur J Nucl Med Mol Imaging 2010;37(5):884-95.
45) Freudenberg LS, Antoch G, Jentzen W, Pink R, Knust J, Görges R, et al. Value of (124)I-PET/CT in staging of patients with differentiated thyroid cancer. Eur Radiol 2004;14(11):
2092-8.
46) Freudenberg LS, Antoch G, Frilling A, Jentzen W, Rosenbaum SJ, Kühl H, et al. Combined metabolic and
morphologic imaging in thyroid carcinoma patients with elevated serum thyroglobulin and negative cervical ultrasonography: Role of 124I-PET/CT and FDG-PET. Eur J Nucl Med Mol Imaging 2008;35(5):950-7.
47) Jauregui-Osoro M, Sunassee K, Weeks AJ, Berry DJ, Paul RL, Cleij M, et al. Synthesis and biological evaluation of [(18)F]
tetrafluoroborate: A PET imaging agent for thyroid disease and reporter gene imaging of the sodium/iodide symporter. Eur J Nucl Med Mol Imaging 2010;37(11):2108-16.