■ 접 수 : 2012년 9월 7일, 수정 : 2012년 9월 15일, 채택 : 2012년 10월 9일
■ 교신저자 : 손낙원, 경기도 용인시 기흥구 서천동 1번지 경희대학교 전자정보관 444호 Tel:(031) 201-2747, Fax:(031) 204-6832, E-mail : sohnnw@khu.ac.kr
Tetramethylpyrazine이 흰쥐 척수압박손상의 신경세포 자연사에 미치는 영향
조종진⋅김승환⋅이준석⋅신정원⋅김성준⋅손낙원
경희대학교 동서의학대학원 한의과학전공
Effect of Tetramethylpyrazine on Neuronal Apoptosis in Spinal Cord Compression Injury of Rats
Jong-Jin Jo, Ph.D., O.M.D., Seung-Hwan Kim, Ph.D., O.M.D., Joon-Seok Lee, Ph.D., O.M.D.
Jung-Won Shin, Ph.D., Seong-Joon Kim, Ph.D., O.M.D., Nak-Won Sohn, Ph.D., O.M.D.
Dept. of Oriental Medical Science, Graduate School of East-West Medical Science, Kyung-Hee University
Objectives :
The pathophysiology of acute spinal cord injury(SCI) may be divided into primary and secondary mechanisms of injury. The secondary mechanism involves free radical formation, excitotoxicity, inflammation and apoptotic cell death, and sets in minutes after injury and lasts for weeks or months. During this phase the spinal tissue damages are aggravated. Therefore, secondary mechanisms of injury serve as a target for the development of neuroprotective drug against SCI. The present study investigated the effect of tetramethylpyrazine(TMP), an active ingredient purified from the rhizome of Ligusticum wallichii(川芎, chuanxiong), on neuronal apoptosis in spinal cord compression injury in rats.
Methods :
SCI was subjected to rats by a static compression method(35 g weight, 5 mins) and TMP was treated 3 times(30 mg/kg, i.p.) during 48 hours after the SCI.
Results :
TMP ameliorated the tissue damage in peri-lesion of SCI and reduced TUNEL-labeled cells both in gray matter and in white matter significantly. TMP also attenuated Bax-expressed motor neurons in the ventral horn and preserved Bcl-2-expressed motor neurons.
Conclusions :
These results indicate that TMP plays a protective role in apoptotic cell death of neurons and oligodendrocytes in spinal cord injury. Moreover, it is suggested that TMP and TMP-containing chuanxiong may potentially delay or protect the secondary spinal injury.
Key words : Tetramethylpyrazine, Ligusticum wallichii, Spinal cord injury, TUNEL, Bax, Bcl-2
Ⅰ. 서 론
척수손상은 매우 심각한 후유증을 남기는 질 환으로, 손상의 발생기전은 일차손상과 이차손상 으로 나누어진다. 일차손상은 직접적인 물리적 또는 기계적 손상으로부터 유발되며, 특히 압박 손상은 척수조직에 허혈을 발생시키고, 이러한 허혈상태는 신경세포들의 사망과 염증반응을 유 발하게 된다1,2). 이러한 이차손상 기전은 일차손 상 수 분 이후부터 시작되어 수 주간 또는 수 개 월간 지속되며, 이 기간 동안에 손상의 범위가 넓어져 간다3). 척수손상의 특성상 일차손상은 예 방될 수 없고, 척수조직의 허혈과 혈액척수관문 (blood-spinal cord barrier) 손상에 따른 염증과 부종 및 신경세포의 자연사 등을 특징으로 하는 이차손상 기전에 대한 이해가 척수손상의 치료와 완화를 위한 약물효능 연구의 주목표가 된다1,4,5).
이차척수손상 기전 중 하나인 세포자연사(apoptosis) 는 척수조직의 신경세포와 희소돌기아교세포 (oligodendrocyte), 미세아교세포(microglia) 등에 서 유발되어 회색질에서는 신경세포를 감소시키 고, 백색질에서는 신경섬유의 손상과 탈수초변성 (demyelination)을 유발하여 신경섬유의 신호전달 을 차단하는데 관여하고 있다6,7). 척수조직의 세포 자연사 역시 glutamate excitotoxicity, cytokines, free radicals 등의 세포자연사 유발인자들에 의해 세포내 Ca2+ 과유입이 일어나고8,9), 미토콘드리아의 기능이상 및 cytochrome C의 분비, caspase 활성화 와 Bax, Bad, Bcl-2, Bcl-xl 등 B-cell lymphoma(Bcl)-2 계열 단백질 발현의 증가, endoneuclease에 의한 DNA 절단 등의 programmed cell death pathway 를 거친다10,11).
한편으로, tetramethylpyrazine(TMP)은 川芎 (Ligusticum wallichii, chuanxiong)의 주요 활성성
분 중 하나로 뇌허혈과 척수손상에 대해 신경손 상보호효능이 보고되었다12,13). 그리고 TMP가 중 대뇌동맥폐쇄 흰쥐에서 중성백혈구의 침착과 free radical 형성 억제, 미세아교세포 활성화의 억제 등 을 통해 뇌경색 크기를 감소시켰다고 보고되었다14,15). 또한 척수손상과 관련하여, 토끼 척수의 허혈손 상에 대해 TMP가 tumor necrosis factor-alpha (TNF-α)와 interleukin(IL)-1β 등 염증유발 cytokine 발현을 억제하고 Bax 발현을 억제하는 기전을 통 해 척수손상을 완화시켰다고 보고된바 있다16-18). 그러나 척수의 압박손상에 따른 이차손상 기전에 주요한 요소인 신경세포의 자연사에 대한 연구보 고는 없었다. 그러므로 본 연구에서는 흰쥐의 척 수에 압박손상을 가하고 TMP를 투여한 다음 척 수의 조직손상 변화, 세포자연사 지표인 terminal deoxynucleotidyl transferase dUTP nick end labeling(TUNEL) 반응, 세포자연사 유발인자인 Bax 및 세포자연사 억제인자인 Bcl-2 발현을 면 역조직화학염색을 통해 관찰한바 유의한 결과를 얻었기에 이에 보고하는 바이다.
Ⅱ. 실험방법
1. 실험동물
실험동물은 나라바이오텍(Nara Biotechnology, Korea)에서 구입한 300 g 전후의 Sprague-Dawley 계 수컷 흰쥐를 사용하였다. 실험동물의 사육과 처치는 경희대학교 실험동물윤리위원회의 방침 과 동물실험관련 규정을 따랐으며, 실험에 사용 한 생쥐는 온도(21~23 ℃), 습도(40~60%)와 조명 (12시간 명/암)이 자동적으로 유지되는 사육실에 서 무균음수와 사료가 자유롭게 공급되는 환경에 서 사육되었고, 실험실 환경에 1주 이상 적응시
킨 후 사용하였다.
2. 약물 및 시약
본 실험에 사용한 2,3,5,6-Tetramethylpyrazine (TMP; C8H12N2, molecular mass 136.20 u)과 lipopolysaccharide(LPS; from Escherichia coli O55:B5)는 Sigma-Aldrich(St. Louis, MO, USA)에서 구입하였다. TACS 2 TdT-DAB in situ Apoptosis Detection kit는 Trevigen(Gaithersburg, MD, USA) 으로부터 구입하였고, rabbit anti-Bax antibody는 Abcam(Cambridge, UK), mouse anti-Bcl-2 antibody 는 Santa Cruz Biotechnology(Santa Cruz, CA, USA)로부터 구입하여 사용하였다. 그 이외의 시 약들은 전문제조회사의 실험실용 최고 품질의 시 약을 구입하여 사용하였다.
Fig. 1. Chemical structure of tetramethylpyrazine.
3. 실험군의 구분 및 처치
흰쥐를 무작위로 4개 군으로 구분하였다. 정상 군(Normal)은 마취 등 일체의 처치를 가하지 않 았으며, Sham군(Sham)은 마취와 배부의 피부절 개 및 척추의 천공 과정은 시행하였으나 압박손 상을 가하지 않았고, 대조군(SCI)은 Sham군과 같 은 사전 준비과정에 이어 척수에 압박손상을 가 하였다. TMP 투여군(SCI+TMP)은 SCI군과 같이 척수 압박손상을 가한 다음 TMP 30 mg/kg을 1 회 용량으로 하여 압박손상 후 2, 22 및 46 시간 후에 총 3회 복강주사 하였다.
4. 척수압박손상
척수압박손상의 유발은 실험동물을 1.5% isoflurane (3% induction, 1.5% maintenance)을 함유한 70%
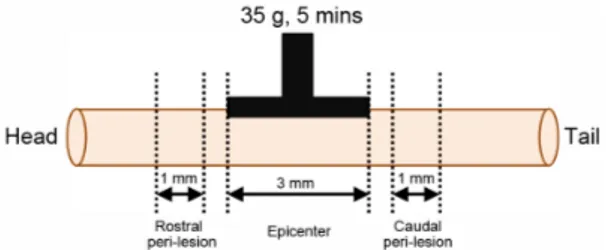
N2O와 30% O2 가스로 흡입마취한 다음 electronic temperature controller(CMA150, CMA, Sweden) 를 사용하여 정상체온(37±0.5 ℃)이 유지되는 상 태에서, 다음의 과정으로 실시하였다. 배부의 털 을 제거한 다음 피부와 배부 근육들을 절개한 상 태에서, 전기드릴을 사용하여 제 10흉추의 추궁 (vertebral lamina)을 제거하였다. 경막(dura mater) 이 유지되는 상태에서 척수가 노출되도록 하였 다. 이때 전기드릴에 의하여 척수 실질조직이 손 상되지 않도록 하였으며, 실질조직이 손상된 실험 동물은 실험에서 제외하였다. 경막으로 덮힌 척수 위에 35 g 무게의 압박플랫폼(2 mm×3 mm)을 5 분간 올려놓는 방법으로 압박손상을 가했다19). 이후 배부 근육과 피부를 봉합하고 마취에서 깨 어나게 하였다.
5. 척수조직의 처리
척수압박손상 48시간 후에 tiletamine과 zolazepam (50:50, 18 mg/kg, Zoletil, Virbac Laboratoris, Carros, France)으로 깊게 마취한 다음 개흉하고, 심장을 통하여 0.05 M phosphate buffered saline (PBS)과 4% paraformaldehyde로 충분히 관류하였 다. 이후 척수를 적출하고, 압박손상부위를 중심으 로 하여 8 mm 크기로 절단한 다음 24시간 정도 post-fixation하고, sucrose 용액에 담궈 침전시킨 다음 척수조직을 -40 ℃의 dry ice-isophentane 용액으로 동결시켰다. 조직절편은 cryocut으로 30 μm 두께의 횡단절편으로 제작하였으며, 압박 손상중심부(epicenter)로부터 머리쪽(rostral)과 꼬
리쪽(caudal)으로 각각 연속절편을 만들어 조직 염색에 사용하였다.
6. TUNEL 염색
신경세포의 자연사 관찰을 위해서는 TACS 2 TdT-DAB in situ apoptosis detection kit(Trevigen, Cat# 4810-30-K, USA)를 사용하였으며, 그 방법은 다음과 같다. 척수조직을 PBS로 세척하고 cytonin 에서 30분간 반응시킨 다음 다시 PBS로 세척하고, TdT labeling buffer에 5분간 반응시킨 뒤, labeling reaction mix(TdT dNTP mix, TdT enzyme, 50x Mn2+ stock, 1x TdT labeling buffer)로 37 ℃ humidity chamber에 1시간 동안 반응시킨다. 이후 TdT stop buffer로 반응을 멈추고, 다시 PBS로 세척한 후 37 ℃ humidity chamber에서 strep-HRP solution에 10분간 반응시킨다. 이후 과정이 끝나면 3,3'-diamino-benzidine tetrachloride(DAB, Sigma -Aldrich, USA)로 발색반응을 일으킨 후 0.2%
methyl green 용액으로 약하게 배경염색한 다음 수세하고 탈수, 봉입하여 조직표본을 제작하였다.
7. Bax와 Bcl-2의 면역조직화학염색
척수의 조직학적 소견과 신경세포들의 관찰을 위해서는 0.5% cresyl violet 용액만을 사용하여 일반조직염색법에 따라 조직표본을 제작하였다.
Bax와 Bcl-2에 대한 면역조직화학염색은 척수조 직 절편을 0.05 M PBS로 5분간 3회 씻어내고, 1% H2O2에서 10분간 반응시킨 다음 다시 3회 씻 어낸 뒤 10% normal horse serum(Vectastain, USA)과 bovine serum albumin(Sigma-Aldrich, USA)를 PBS에 섞은 blocking solution에 한 시간 정도 반응시켰다. 이후 PBS로 3회 씻어 낸 후,
anti-Bax(AB7977, 1:500, rabbit polyclonal, Abcam, USA)와 anti-Bcl-2(SC7382, 1:500, mouse monoclonal, Santa Cruz Biotechnology, USA)를 일차항체로 사 용하여, PBS와 Triton X-100을 섞은 용액으로 희 석한 후 4 ℃에서 반응시켰다. 이후 biotinylated secondary antibody(1:200, Millipore, USA)를 이 차항체로 반응시키고, avidin-biotin complex(Vector Laboratories, USA) 방법에 따라 0.05% DAB (Sigma-Aldrich, USA)로 발색하였다. 이후 0.5%
cresyl violet 용액으로 약하게 배경염색한 다음 탈수, 봉입하여 조직표본을 제작하였다.
8. 조직손상 및 TUNEL, Bax, Bcl-2 양성반응 세포의 관찰
척수조직을 epicenter와 rostral peri-lesion, caudal peri-lesion 부위로 구분하여(Fig. 1), 각각 염색된 조직표본에서 척수조직손상의 변화를 CCD camera (DP70, Olympus, Japan)가 장착된 광학현미경 (BX51, Olympus, Japan)으로 관찰하였다. TUNEL 과 Bax 및 Bcl-2 양성반응 세포의 관찰은 양성반 응 세포 수 측정을 위해서 각각의 영상을 영상분 석시스템에 저장하고 ImageJ software(ver. 1.41, NIH, USA)를 사용하여 수를 측정한 다음 일정 면적(105 μm2)으로 보정하여 자료로 사용하였다.
Fig. 2. Schematic diagram showing regions of epicenter, rostral and caudal peri-lesion.
9. 통계처리
본 연구에서 제시된 자료들은 Mean±Standard error로 표시되었으며, 각 자료의 통계적 유의성 검정은 Student's t-test와 ANOVA 분산분석을 사용하여 SCI군과 SCI+TMP군 사이에 p<0.05 이 상의 유의수준으로 검정하였다.
Ⅲ. 결 과
1. 척수조직 손상의 변화
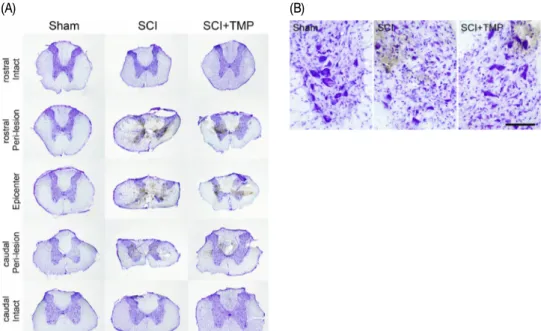
척수압박손상을 받지 않은 Sham군에서는 정 상적인 조직소견을 보였다. 압박손상을 받은 SCI 군의 epicenter 부위는 전체적으로 척수의 굵기 가 감소하였고, 척수 내부 회색질의 후각(dorsal horn)은 물론 전각(ventral horn)까지 정상적인 조직학적 구조를 관찰하기 어려울 정도로 심하게 위축되었으며, 중심관 주위와 백실질의 일부에 공 포가 형성되어 있었다(Fig. 3-A, SCI, Epicenter).
Epicenter 부위에서 영상분석으로 측정한 손상면 적비율은 전체 척수 횡단면의 약 45% 정도를 차 지하였다. 이러한 조직손상은 머리쪽(rostral)과 꼬리쪽(caudal) peri-lesion 부위에서도 관찰되었 으며, 손상면적비율이 25~35% 정도를 나타내었 으며, epicenter로부터 머리쪽과 꼬리쪽 각각 약 4 mm 외부에서는 압박으로 인한 조직손상이 관찰 되지 않았다(Fig. 3-A, SCI). 이에 비하여 SCI+TMP 군은 epicenter 부위에서는 조직손상의 양상이 SCI군과 유사하였으며(Fig. 3-A, SCI+TMP, Epicenter), 손상면적비율도 40~45%를 나타내었다. 머리쪽과 꼬리쪽 peri-lesion 부위에서는 형태학적 조직손 상의 정도가 SCI군의 peri-lesion 부위에 비하여
감소한 소견을 보이고, 손상면적비율이 15~30%
정도를 나타내어 TMP 투여에 의해 척수의 조직 손상이 감소된 경향을 관찰할 수 있었다(Fig. 3-A, SCI+TMP).
또한 척수 전각의 운동신경세포들을 관찰한 결 과, Sham군은 세포체가 큰 정상적인 운동신경세 포들이 많이 관찰되었으나(Fig. 3-B, Sham), SCI 군의 epicenter 부위에서는 운동신경세포들을 거 의 관찰할 수 없었고, peri-lesion 부위에서는 압 박손상의 영향으로 운동신경세포들이 위축되거 나 사망하여 그 수가 현저하게 감소되어 있었다 (Fig. 3-B, SCI). 이에 비하여 SCI+TMP군의 epicenter 부위에서는 역시 운동신경세포들을 관찰할 수 없 었고, peri-lesion 부위에서는 SCI군에 비해 운동 신경세포들이 많이 관찰되어 압박손상에 의한 운 동신경세포의 위축과 사망이 감소한 것을 관찰할 수 있었다(Fig. 3-B, SCI+TMP).
2. TUNEL 표지세포의 변화
세포자연사 지표인 TUNEL 표지세포를 peri-lesion 부위에서 관찰한 결과, 정상군과 Sham군에서는 관찰되지 않았으나 SCI군과 SCI+TMP군은 회색질 과 백색질 모두에서 TUNEL 표지세포들이 관찰 되었다(Fig. 4-A). 각 부위의 일정면적에서 TUNEL 표지세포 수를 측정한 결과, SCI군의 회색질에서 는 9.8±1.1 개/105 μm2가 관찰되었고, 백색질에서 는 12.3±1.2 개/105 μm2가 관찰되었다. 이에 비하 여 SCI+TMP군의 회색질에서는 6.0±1.2 개/105 μm2 가 관찰되었고, 백색질에서는 8.8±0.9 개/105 μm2 가 관찰되어 SCI군에 비해 회색질과 백색질 모두 에서 p<0.05의 유의성 있는 TUNEL 표지세포 수 의 감소가 관찰되었다(Fig. 4-B).
(A) (B)
Fig. 3. Representative photographs showing spinal tissue damage by compression in SCI rat.
Spinal cord injury was induced by a static compression method(35 g, 5 mins) on the spinal cord. TMP was treated with i.p.
injection 3 times during 48 hours after the SCI induction. (A) Sham group shows normal histological features. Epicenter of SCI group shows excessive tissue damages in the gray matter and large vacuoles in the white matter. Peri-lesion of SCI group also shows similar features of tissue damage by compression. The regions about 4 mm apart from epicenter demonstrate normal histological features. Epicenter of SCI+TMP group also shows similar features of tissue damage to that of SCI group.
However, tissue damage of peri-lesion in SCI+TMP group was ameliorated by TMP treatment. Scale bar is 1.0 mm. (B) Motor neurons in the ventral horn were markedly decreased in the SCI group by cell atrophy and death (SCI). On the contrary, TMP reduced the decrease of motor neurons with respect to SCI group(SCI+TMP). Scale bar is 100 μm.
(A) (B)
Fig. 4. Effect of tetramethylpyrazine(TMP) on TUNEL positive cells in the peri-lesion of SCI rats.
(A) Representative photographs showing TUNEL positive cells in the spinal tissue. SCI was induced by a static compression method(35 g, 5 mins) on the spinal cord. TMP was treated with i.p. injection 3 times during 48 hours after the SCI induction.
No cells labeled to TUNEL are shown both in Normal and Sham groups. SCI group shows an increase of TUNEL positive cells both in the gray matter and in the white matter(SCI, arrows). TMP reduced TUNEL positive cells with respect to SCI group (SCI+TMP, arrows). Scale bar is 100 µm. (B) The number of TUNEL positive cells was significantly reduced by TMP treatment both in the gray matter and in the white matter with respect to the SCI group. Data are represented by mean±SEM(n=6, *p<0.05).
3. Bax 발현 운동신경세포의 변화
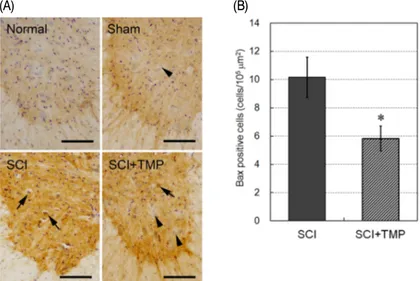
세포자연사 유발인자인 Bax 발현을 peri-lesion 부위의 척수 전각 운동신경세포에서 관찰한 결 과, 정상군과 Sham군에서는 Bax를 발현하지 않 은 큰 세포체의 운동신경세포들이 다수 관찰되었 고(Fig. 5-A, Sham, arrow), SCI군에서는 Bax가 발현된 운동신경세포들이 다수 관찰되고, Bax가 발현된 거의 모든 운동신경세포들은 세포체가 위 축되어 있었다(Fig. 5-A, SCI, arrows). 이에 비하
여 SCI+TMP군은 Bax가 발현된 운동신경세포들 의 수가 감소하였고(Fig. 5-A, SCI+TMP, arrow), 일부 운동신경세포들은 Bax가 발현되지 않았다 (Fig. 5-A, SCI+TMP, arrowheads). 각 조직의 일정 면적에서 Bax 양성반응 세포 수를 측정한 결과, SCI군은 10.2±1.4개/105 μm2가 관찰되었고, SCI+TMP 군은 5.8±0.9개/105 μm2가 관찰되어 SCI군에 비 해 p<0.05의 유의성 있는 Bax 양성반응 세포 수 의 감소가 관찰되었다(Fig. 5-B).
(A) (B)
Fig. 5. Effect of tetramethylpyrazine(TMP) on Bax positive motor neurons in the ventral horn of SCI rats.
(A) Representative photographs showing Bax positive motor neurons in the spinal tissue. SCI was induced by a static compression method(35 g, 5 min) on the spinal cord. TMP was treated with i.p. injection 3 times during 48 hours after the SCI induction. No cells labeled to Bax are shown both in Normal and Sham groups. SCI group shows Bax-expressed motor neurons which are condensed(SCI, arrows). TMP reduced Bax positive motor neurons with respect to SCI group(SCI+TMP, arrow). Some motor neuron did not express Bax(SCI+TMP, arrowheads). Scale bars are 100 µm. (B) The number of Bax positive motor neurons was significantly reduced by TMP treatment. Data are represented by mean±SEM (n=6, *p<0.05).
4. Bcl-2 발현 운동신경세포의 변화
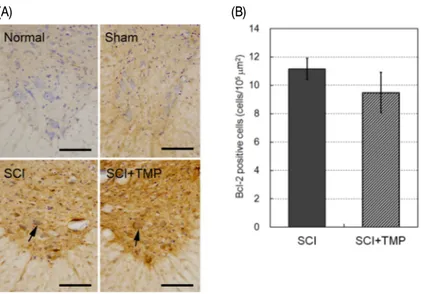
세포자연사 억제인자인 Bcl-2 발현을 peri-lesion 부위의 척수 전각 운동신경세포에서 관찰한 결 과, 정상군과 Sham군의 운동신경세포들은 Bcl-2
를 발현하지 않았다(Fig. 6-A). SCI군에서는 Bcl-2 가 발현된 운동신경세포들이 다수 관찰되고, Bcl-2가 발현된 거의 모든 운동신경세포들 역시 세포체가 위축되어 있었다(Fig. 6-A, SCI, arrow).
이에 비하여 SCI+TMP군은 Bcl-2가 발현된 운동
신경세포들의 수가 다소 감소하였으나(Fig. 5-A, SCI+TMP, arrow), Bcl-2의 염색 정도는 더 강해 진 경향을 보였다. 각 조직의 일정면적에서 Bcl-2 양성반응 세포 수를 측정한 결과, SCI군은 11.2±0.7
개/105 μm2가 관찰되었고, SCI+TMP군은 9.5±1.4 개/105 μm2가 관찰되어 유의한 변화가 없었다(Fig.
6-B).
(A) (B)
Fig. 6. Effect of tetramethylpyrazine(TMP) on Bcl-2 positive motor neurons in the ventral horn of SCI rats.
(A) Representative photographs showing Bcl-2 positive motor neurons in the spinal tissue. SCI was induced by a static compression method(35 g, 5 mins) on the spinal cord. TMP was treated with i.p. injection 3 times during 48 hours after the SCI induction. No cells labeled to Bcl-2 are shown both in Normal and Sham groups. SCI group shows Bcl-2-expressed motor neurons which are condensed(SCI, arrow). The number of Bcl-2 positive motor neurons in SCI+TMP groups was decreased, but not different from SCI group(SCI+TMP, arrow). Scale bars are 100 µm. (B) The number of Bcl-2 positive motor neurons was not different between SCI and SCI+TMP groups statistically. Data are represented by mean±SEM (n=6).
Ⅳ. 고 찰
사람의 척수손상은 다양한 원인에 의해 유발되며, 척수조직의 타박(contusion)과 압박(compression) 및 부분적인 절단(partial transection)이 복합적으로 손상에 관여하고 있다20). 실험동물의 척수에 압 박손상을 가할 경우 사람의 척수손상에서 관찰될 수 있는 조직병리학적 변화와 신경학적 임상지표 들이 비교적 유사하게 관찰된다고 하였다21,22).
척수의 압박손상은 손상 즉시 소량의 국소적
인 조직출혈과 부종이 유발되고, 이어서 회색질 의 용해(dissolution)와 백색질의 부분적인 탈수 초변성과 연화증(malacia)이 시작되고, 이후 작은 소포들이 형성되거나 척수 내 여러 부위들에 걸 친 큰 공포가 형성된다고 하였다23,24). 또한 공포 주변부위에는 흉터형성기전의 일환으로 활성성상 세포(reactive astrocyte), 미세아교세포(microglia) 및 섬유아세포(fibroblast)의 침착과 세포외기질 (extracellular matrix)의 침착 등이 유발된다고도
하였다25,26). 척수에 35 g 무게로 5분간 압박을 가
한 본 실험의 결과에서도 압박손상을 받은 SCI군은
압박손상의 중심부인 epicenter 부위에서는 척수 내부의 정상적인 조직학적 구조를 관찰하기 어려 울 정도로 심하게 손상되고, 중심관 주위와 백색 질의 일부에 공포가 형성되었으며, 척수 전각의 운동신경세포들도 관찰하기 어려웠다. 압박손상의 중심부로부터 약 2~3 mm 바깥쪽의 peri-lesion 부위에서도 유사한 조직손상이 관찰되었다. 이에 비하여 30 mg/kg의 TMP를 투여한 SCI+TMP군 은 epicenter 부위의 조직손상 정도는 SCI군과 차이가 없었으나 peri-lesion 부위에서는 조직손 상이 감소된 것을 관찰할 수 있었다. 이러한 결 과는 TMP가 척수손상에 유의한 효과를 나타낼 수 있음을 보여주는 것이다. 하지만 척수압박손 상에 의해 양측 후지의 발목관절을 굽히지 못하 며 발등끌기를 주로 하는 마비증상은 큰 차이가 없었다. 이러한 결과는 투약기간이 짧기 때문으 로 생각되며, peri-lesion 부위에서 척수조직 손상 을 완화시킨 결과로 살펴본다면 보다 장기적인 실험연구에서는 마비증상의 회복 가능성을 추측 하게 한다.
본 연구의 주요 결과는 TMP가 흰쥐의 척수압 박손상에 대해 척수 신경세포의 자연사를 억제하 였다는 것이다. TMP는 川芎(Ligusticum wallichii, chuanxiong)의 가장 주된 유효성분으로 중추신 경계 손상에 대해 보호효능이 있음이 보고된바
있다12,14,15,18). 특히 본 실험에서 川芎을 직접 사용
하지 않고 유효성분인 TMP를 사용한 것은 우리 나라에서 川芎은 중국의 Ligusticum wallichii와 일 본의 Cnidium officinale가 모두 사용되고 있는 현 실에서, 두 종류의 식물이 동일한 것이라는 보고
27)에 근거하여 수차례의 예비실험을 시행하였지 만 안정적인 결과를 얻을 수 없었기에 가장 주된 유효성분이 TMP를 사용하였다.
척수손상에서 일부 세포들은 괴사(necrosis)의 기전에 의해 사망하고, 일부 세포들은 자연사 기
전에 의해 사망한다. 자연사 기전에 의한 척수 신경세포의 사망은 수일에서부터 수주에 걸쳐 일 어나며, 손상을 확장시키고, 결과적으로 신경섬유 의 소실을 초래한다3,24). 그러므로 척수손상에 대 한 신경손상 보호효능 연구의 일차적인 목표가 신경세포의 자연사에 대한 억제효능 연구이다
1,4,5). 신경세포의 자연사에 대한 TMP 효능연구의
결과들을 살펴보면, Zhang 등28)은 TMP가 cerebellar granule cell의 세포배양실험에서 FeSO4의 산화 적 손상에 의한 세포자연사를 억제하였다고 보고 하였고, Kao 등15)과 Jia 등29)은 흰쥐의 국소뇌허 혈에서 뇌경색과 신경세포 소실이 억제되었는데, 이는 TMP가 caspase-3와 Bax 발현의 억제, 미세 아교세포 활성화의 억제 등을 일으켜 이에 의하 여 유발된 것이라고 하였다. 또한 Chang 등30)은 중대뇌동맥폐쇄 흰쥐에서 20 mg/kg의 TMP 투 여가 신경세포 자연사를 억제하고, TNF-α, HIF-1α 및 caspase-3 활성을 억제한다고 하였고, Gao 등31) 은 지주막하 뇌출혈 흰쥐에서 30 mg/kg의 TMP 투여가 TUNEL 양성반응 세포를 감소시켰다고 보고하였다. 나아가 Fan 등18)이 토끼 척수의 허혈 손상에서 TMP 30 mg/kg 투여가 TUNEL 양성반 응 신경세포 수를 감소시키고, Bax 발현은 억제 하고 Bcl-2 발현을 증가시켜 신경세포의 자연사 를 억제하는 효능이 있다는 것을 척수손상 모델 에서 보여주었다.
세포의 자연사를 관찰하는 방법은 DNA가 internucleosomal 180-200 base의 조각으로 갈라지 는 현상인 DNA laddering과 DNA fragmentation 이 일어나는 것을 이용한 TUNEL표지 방법이 가 장 널리 사용되고 있다32). 또한 Bax는 Bcl-2와 함 께 세포자연사를 조절하는 인자로서, 신경세포에 서 Bax의 발현은 장차 신경세포가 사망할 것이 라는 것을 판별할 수 있는 중요한 지표로 사용되 며33), Bcl-2는 Bax와 결합하여 Bax가 세포자연사를
일으키는 기능을 저해하는 세포자연사 억제인자 로 알려져 있다34). 척수압박손상 실험모형을 사용 한 본 연구에서 TMP 30 mg/kg 투여는 TUNEL 표지세포 수와 Bax 발현 운동신경세포 수를 유 의하게 감소시켰다. 이전의 연구 결과들과 본 연 구의 결과들을 종합하면, TMP가 척수손상에서 신경세포의 자연사를 억제하는 효능이 있다는 것 을 확인할 수 있다.
본 연구에서 확인한 결과 중 흥미로운 한 가지 는 TMP가 회색질에서의 TUNEL 양성반응 세포 를 억제함과 동시에 백색질에서도 TUNEL 양성 반응 세포들을 유의하게 억제하였다는 것이다.
회색질에서 나타난 TUNEL 양성반응 세포들은 신경세포들이지만 백색질에서 나타난 TUNEL 양 성반응 세포들은 주로 희소돌기아교세포 또는 미 세아교세포들이다. 척수 백색질의 희소돌기아교 세포는 손상에 매우 취약하며, 세포자연사 기전 에 의해 사망한다35). 흰쥐 척수의 압박손상에서 는 희소돌기아교세포의 사망이 압박손상 15분 후 부터 관찰되기 시작하여 24시간까지 지속적으로 증가하며, 미세아교세포의 자연사가 압박손상 3주 이후에도 관찰된다고 하였다6,36). 이러한 희소돌 기아교세포의 사망은 허혈에 의한 산화적 손상과 excitotoxicity에 의하며37), 또한 압박손상으로 활성 화된 미세아교세포가 분비하는 염증유발 cytokine 들과 free radical에 의해 사망한다고 하였다38). TMP가 척수조직의 희소돌기아교세포에 미치는 영향을 직접적으로 관찰한 연구보고는 없었다.
그러므로 희소돌기아교세포에 대한 TMP의 영향 에 대해서는 보다 더 진전된 연구가 필요한 것으 로 생각된다.
한편으로, 이전의 연구에서 TMP가 뇌허혈 손상 에서 미세아교세포의 활성화를 억제하였다는 보고15) 와 미세아교세포 배양실험에서 iNOS와 reactive oxygen species 발생을 억제하였다는 보고가 있
다39). 또한 우리 연구조직에서 흰쥐의 척수압박 손상에서 미세아교세포 활성화에 미치는 TMP의 영향에 대한 연구가 진행되었으며, 그 결과 척수 압박손상 주변부의 회색질과 백실질에서 세포체 가 커지고, 돌기들이 짧고 굵어진 미세아교세포 의 형태학적 활성화가 TMP 투여에 의해 억제되 는 것이 관찰되었다40).
그러므로 TMP의 이러한 미세아교세포 활성화 를 억제하는 작용과 세포자연사를 억제하는 작용 등을 통해 희소돌기아교세포의 사망에도 유의한 작용을 하는 것으로 설명할 수 있다. TMP가 희 소돌기아교세포의 자연사를 억제하는 작용이 관 찰된 본 연구의 결과는 TMP가 척수손상에서 나 타나는 신경섬유의 탈수초변성에도 유의한 작용 을 할 것이라는 것을 추측하게 한다. 하지만 이 러한 결과들을 확정하기 위해서는 보다 더 장기 적인 약물투여 상태에서 임상적인 마비증상의 회 복에 대한 관찰 등이 추가되는 보다 정밀한 동물 실험 연구가 진행되어야 할 것으로 생각되며, 또 한 TMP 단일성분으로서의 효능 확인에서 나아 가 川芎의 척수손상에 대한 효능연구로 확장될 수 있도록 하는 것이 바람직하리라 생각한다.
V. 결 론
川芎의 주요 활성성분 중 하나인 tetramethylpyrazine (TMP)이 척수손상에서 신경세포 자연사에 미치는 영향을 관찰하기 위하여, 흰쥐에 static compression 방법(35 g 무게, 5분)으로 압박손상을 유발하고 TMP 를 압박손상 유발 후 48시간동안 3회(30 mg/kg) 복강주사하였다. 그 결과 TMP는 척수 압박에 의 한 조직손상을 완화하였으며, 손상주변부의 회색 질과 백색질에서 세포자연사 지표인 TUNEL 표 지세포의 수를 유의하게 감소시켰다. 또한 척수
전각의 운동신경세포에서 발현된 세포자연사 유 발인자인 Bax 발현을 유의하게 억제하였으며, 세 포자연사 억제인자인 Bcl-2 발현은 억제하지 않 았다. 이러한 결과들은 TMP가 척수 신경세포와 희소돌기아교세포의 자연사를 억제하는 효능이 있는 것을 보여주는 것이며, 그러므로 TMP 또는 TMP를 함유한 川芎이 척수의 이차손상을 보호하 거나 지연시키는 효능이 있는 것으로 생각된다.
참고문헌
1. Boulenguez P, Vinay L. Strategies to restore motor functions after spinal cord injury. Curr Opin Neurobiol. 2009;19(6):587-600.
2. Dumont RJ, Okonkwo DO, Verma S, Hurlbert RJ, Boulos PT, Ellegala DB, Dumont AS. Acute spinal cord injury, part I: pathophysiologic mechanisms. Clin Neuropharmacol. 2001;24(5):
254-64.
3. Tanhoffer AR, Yamazaki KR, Nunes AE, Pchevozniki IA, Pchevozniki MA, Nogata C Aikawa J, Bonatto JS, Brito G, Lissa DM, Fernandes CL. Glutamine concentration and immune response of spinal cord-injured rats. J Spinal Cord Med. 2007;30:140-6.
4. Park E, Velumian AA, Fehlings MG. The role of excitotoxicity in secondary mechanisms of spinal cord injury: a review with an emphasis on the implications for white matter degeneration. J Neurotrauma. 2004;21(6):754-74.
5. Donnelly DJ, Popovich PG. Inflammation and its role in neuroprotection, axonal regeneration and functional recovery after spinal cord injury.
Exp Neurol. 2008;209(2):378-88.
6. Liu XZ, Xu XM, Hu R, Du C, Zhang SX, McDonald JW, Dong HX, Wu YJ, Fan GS, Jacquin MF, Hsu CY, Choi DW. Neuronal and glial apoptosis after traumatic spinal cord injury. J Neurosci. 1997;17(14):5395-406.
7. Casha S, Yu WR, Fehlings MG. Oligodendroglial apoptosis occurs along degenerating axons and is associated with FAS and p75 expression following spinal cord injury in the rat.
Neuroscience. 2001;103(1):203-18.
8. Liu D, Xu GY, Pan E, McAdoo DJ. Neurotoxicity of glutamate at the concentration released upon spinal cord injury. Neuroscience. 1999;
93(4):1383-9.
9. Klusman I, Schwab ME. Effects of pro-inflammatory cytokines in experimental spinal cord injury.
Brain Res. 1997;762(1-2):173-84.
10. Polster BM, Fiskum G. Mitochondrial mechanisms of neural cell apoptosis. J Neurochem. 2004;
90(6):1281-9.
11. Kirkland RA, Franklin JL. Bax, reactive oxygen, and cytochrome c release in neuronal apoptosis.
Antioxid Redox Signal. 2003;5(5):589-96.
12. Ran X, Ma L, Peng C, Zhang H, Qin LP.
Ligusticum chuanxiong Hort: A review of chemistry and pharmacology. Pharm Biol.
2011;49(11):1180-9.
13. Zhu XL, Xiong LZ, Wang Q, Liu ZG, Ma X, Zhu ZH, Hu S, Gong G, Chen SY.
Therapeutic time window and mechanism of tetramethylpyrazine on transient focal cerebral ischemia/reperfusion injury in rats.
Neurosci Lett. 2009;449(1):24-7.
14. Hsiao G, Chen YC, Lin JH, Lin KH, Chou DS, Lin CH, Sheu JR. Inhibitory mechanisms
of tetramethylpyrazine in middle cerebral artery occlusion(MCAO)-induced focal cerebral ischemia in rats. Planta Med. 2006;72(5):411-7.
15. Kao TK, Ou YC, Kuo JS, Chen WY, Liao SL, Wu CW, Chen CJ, Ling NN, Zhang YH, Peng WH. Neuroprotection by tetramethylpyrazine against ischemic brain injury in rats. Neurochem Int. 2006;48(3):166-76.
16. Chen S, Xiong L, Wang Q, Sang H, Zhu Z, Dong H, Lu Z. Tetramethylpyrazine attenuates spinal cord ischemic injury due to aortic cross-clamping in rabbits. BMC Neurol. 2002;
2:1-6.
17. Fan L, Wang K, Shi Z, Die J, Wang C, Dang X. Tetramethylpyrazine protects spinal cord and reduces inflammation in a rat model of spinal cord ischemia-reperfusion injury. J Vasc Surg. 2011;54(1):192-200.
18. Fan LH, Wang KZ, Cheng B, Wang CS, Dang XQ. Anti-apoptotic and neuroprotective effects of Tetramethylpyrazine following spinal cord ischemia in rabbits. BMC Neurosci. 2006;7:
48-56.
19. Ward RE, Huang W, Curran OE, Priestley JV, Michael-Titus AT. Docosahexaenoic acid prevents white matter damage after spinal cord injury. J Neurotrauma. 2010;27(10):1769-80.
20. Kakulas BA. Pathology of spinal injuries. Cent Nerv Syst Trauma. 1984;1(2):117-29.
21. Graham DI, McIntosh TK, Maxwell WL, Nicoll JAR. Recent advances in neurotrauma. J Neuropathol Exp Neurol. 2000;59:641-51.
22. Metz GA, Curt A, van de Meent H, Klusman I, Schwab ME, Dietz V. Validation of the weight-drop contusion model in rats: a
comparative study of human spinal cord injury. J Neurotrauma. 2000;17:1-17.
23. Bunge RP, Puckett WR, Becerra JL, Marcillo A, Quencer RM. Observations on the pathology of human spinal cord injury. A review and classification of 22 new cases with details from a case of chronic cord compression with extensive focal demyelination. Adv Neurol. 1993;59:75-89.
24. Kakulas BA. A review of the neuropathology of human spinal cord injury with emphasis on special features. J Spinal Cord Med.
1999;22:119-24.
25. Fawcett JW, Asher RA. The glial scar and central nervous system repair. Brain Res Bull. 1999;49:377-91.
26. Grimpe B, Silver J. The extracellular matrix in axon regeneration. Prog Brain Res. 2002;
137:333-49.
27. Zhu S, Fushimi H, Han G, Tsuchida T, Uno T, Takano A, Komatsu K. Molecular identification of “Chuanxiong” by nucleotide sequence and multiplex single base extension analysis on chloroplast trnK gene. Biol Pharm Bull. 2007;30:527-31.
28. Zhang Z, Wei T, Hou J, Li G, Yu S, Xin W.
Iron-induced oxidative damage and apoptosis in cerebellar granule cells: attenuation by tetramethylpyrazine and ferulic acid. Eur J Pharmacol. 2003;467(1-3):41-7.
29. Jia J, Zhang X, Hu YS, Wu Y, Wang QZ, Li NN, Wu CQ, Yu HX, Guo QC. Protective effect of tetraethyl pyrazine against focal cerebral ischemia/reperfusion injury in rats:
therapeutic time window and its mechanism.
Thromb Res. 2009;123(5):727-30.
30. Chang Y, Hsiao G, Chen SH, Chen YC, Lin JH, Lin KH, Chou DS, Sheu JR. Tetramethylpyrazine suppresses HIF-1alpha, TNF-alpha, and activated caspase-3 expression in middle cerebral artery occlusion-induced brain ischemia in rats. Acta Pharmacol Sin. 2007;28(3):327-33.
31. Gao C, Liu X, Liu W, Shi H, Zhao Z, Chen H, Zhao S. Anti-apoptotic and neuroprotective effects of Tetramethylpyrazine following subarachnoid hemorrhage in rats. Auton Neurosci. 2008;141(1-2):22-30.
32. Love S, Hilton DA. Comparison of methods for the detection of cells indifferent stages of apoptosis. Neuropathol Appl Neurobiol.
1996;22:161-2.
33. Gillardon F, Wickert H, Zimmermann M.
Up-regulation of Bax and down-regulation of Bcl-2 is associated with kainate-induced apoptosis in mouse brain. Neurosci Lett.
1995;192:85-8.
34. Hara A, Iwai T, Niwa M. Immunohistochemical detection of BAX and BCl-2 proteins in gerbil hippocampus following transient forebrain ischemia. Brain Res. 1996;711:249-53.
35. Almad A, Sahinkaya FR, McTigue DM.
Oligodendrocyte fate after spinal cord injury.
Neurotherapeutics. 2011;8(2):262-73.
36. Grossman SD, Rosenberg LJ, Wrathall JR.
Temporal-spatial pattern of acute neuronal and glial loss after spinal cord contusion.
Exp Neurol. 2001;168:273-82.
37. McAdoo DJ, Xu GY, Robak G, Hughes MG.
Changes in amino acid concentrations over time and space around an impact injury and their diffusion through the rat spinal cord. Exp Neurol. 1999;159:538-44.
38. Jones TB, McDaniel EE, Popovich PG.
Inflammatory-mediated injury and repair in the traumatically injured spinal cord.
Curr Pharm Des. 2005;11:1223-36.
39. Liu HT, Du YG, He JL, Chen WJ, Li WM, Yang Z, Wang YX, Yu C. Tetramethylpyrazine inhibits production of nitric oxide and inducible nitric oxide synthase in lipopolysaccharide -induced N9 microglial cells through blockade of MAPK and PI3K/Akt signaling pathways, and suppression of intracellular reactive oxygen species. J Ethnopharmacol. 2010;129(3):335-43.
40. Moon JY. Effects of tetramethylpyrazine on microglia activation and pro-inflammatory cytokines in spinal cord compression injury of rodents. Thesis for the degree of doctor of philosophy, Graduate school of east-west medical science, Kyung Hee university. 2011.