교모세포종 U-251MG, U-373MG세포주의 Cytokines처리에 의한 세포내 ICAM-1 발현
*중앙대학교 의과대학 신경외과학교실
이종원·권정택·민병국·박승원·김영백·황성남·석종식·최덕영
= Abstract =
Cytokine Induction of Intercellular Adhesion Molecule-1((((ICAM-1)))) Expression on Human Glioblastoma Cell Line, U-251 MG, U-373 MG
Jong-Won Lee, M.D., Jung-Taek Kwon, M.D., Byung-Kook Min, M.D., Seung-Won Park, M.D., Young-Baeg Kim, M.D., Sung-Nam Hwang, M.D.,
Jong-Sik Suk, M.D., Duck-Young Choi, M.D.
Department of Neurosurgery, College of Medicine, Chung-Ang University, Seoul, Korea
bjective:Despite advances in the understanding of tumor biology and the tumor immunology, there has been no effective treatment. The Intercellular adhesion molecule-1(ICAM-1) has been shown to be important in interaction involving cells of the immune system and to be upregulated in a number of cell culture systems by cytokines, including immune interferon(IFN-γ) and tumor necrosis factor-α(TNF-α). ICAM-1 has been identified as one of the ligands for lymphocyte function-associated antigen-1(LFA-1). The effectiveness of various cyto- kines to ICAM-1 induction on cultured human glioblastoma cell lines and potential efficacy of immunotherapy were studied.
Method:Human glioblastoma cell lines, U-251 MG, U-373 MG were trypsinized and suspended at 1×105 cells/ml and grown on 8 well chamber slide, the cells were incubated in 0.3ml medium alone or medium containing IFN-γ(1000U/ml) or TNF-α(250U/ml) or IFN-γ plus TNF-α for 6, 12, 24, 48 and 72 hours. The coverslip were then removed and stained with a 1/30 dilution of anti-ICAM-1 antibody.
Result:Surface antigen expression of ICAM-1 was increased by incubating glioblastoma cell lines with IFN-γ and TNF-α. Combined effect of IFN-γ and TNF-α has induced more ICAM-1 expression on glioblastoma cell lines. Upregulation of ICAM-1 expression in an established glioblastoma cell line was of greater magnitude and more rapid following incubation with IFN-γ plus TNF-α. Surface antigen expression of ICAM-1 was increased for up to 48 hours after cytokine treatment on both cell lines(p<0.05). There was no difference on both cell lines(p>0.05).
Conclusion:The results of the present study indicate that ICAM-1 expression in glioblastoma cell lines, U-251 MG and U-373 MG, are induced and enhanced after treatment with IFN-γ and TNF-α. Combined effect of IFN-α and TNF-γ is stronger and more rapid than IFN-γ or TNF-α alone.
KEY WORDS:Glioblastoma・ICAM-1・Adhesion molecule・Cytokine・Immunotherpy.
서 론
교모세포종(glioblastoma)에 대한 세포학적, 생물학적인 이 해가 확대되고, 진단 및 여러 치료방법이 발전하였으나 교모
세포종 환자의 치료결과는 뚜렷한 발전이 없으며 수술요법, 방사선치료, 항암화학요법, 면역요법에도 불구하고 치료성 적이 좋지 않아 반수 이하에서 1년 생존하며 대부분 2년 이 내에 사망한다1). 이러한 환자들에서는 순환혈액내 면역 기 능이 저하되어 있으며, 종양 특이적 면역반응이 억제되어
OOOO
*본 연구는 1998학년도 중앙대학교 학술연구비 지원으로 이루어졌음.
있는 것으로 알려져 있어19), 숙주의 면역반응을 증가시키고 종양성장을 억제시킬 목적으로 인터페론(Interferon, IFN), tumor necrosis factors(TNF), interleukin(IL)등의 여러 가지 cytokine을 이용한 치료가 시도되어 왔으며, 특히 IFN- β의 경우 1980년대부터 악성 교모세포종의 치료의 일환으 로 정주, 척수강내로의 주입, 종양내로의 주입 등이 시도되 었으나 특별한 효과가 없는 것으로 밝혀졌으며17)25), 1988 년 Mahaley등18)은 IFN-γ가 IL-2의 존재하에서 교종 (glioma)세포에 세포독성을 나타내는 임파구를 활성화시키 는 현상을 이용하여 재발성교종 치료에 IFN-γ를 사용하 였으나 효과는 만족스럽지 못하였다. 그러나 중추신경계 이 외의 진행된 종양에서는 적응 면역요법의 효과가 밝혀져 있 으며22), Mizuno등20)은 교모세포종 세포에 인간 IFN-γ 유 전자를 주입하여 세포의 주요 조직적합성항원(human major histocompatability antigen:MHC antigen)과 intercell- ular adhesion molecule-1(ICAM-1)의 발현을 증가시키 고 lymphokine activated killer cell(LAK cell)을 복합투 여하여 치료의 가능성을 제시한 바 있다. TNF-α 또한 ICAM-1의 발현을 증가시키는 것으로 알려져 있다13). 이 러한 배경으로 뇌종양의 면역반응에 대한 이해가 발전하고, 치료의 한계에 도달한 교모세포종에 대한 면역요법이 다각 적으로 연구, 시도되는 실정이다.
ICAM-1은 76~110kD의 단일구조로 immunoglobulin supergene family의 하나로 알려져 있으며8), 성인 신경계 에서 부착물질인 neural cell adhesion molecule(N-CAM), myelin-associated glycoprotein(MAG)과 밀접한 연관을 갖는다26). ICAM-1은 임파구, 섬유아세포, 혈관내막세포, 외피세포, 배양된 태아 성상세포 등 여러 세포에서 발현되
며8)11), 모든 임파구에 존재하는 lymphocyte function-as-
sociated antigen(LAF-1)은 ICAM-1과의 세포내 흡착을 매개하고, ICAM-1을 갖는 세포가 LAF-1과 반응함으로서 임파구의 이동을 촉진하는 작용하는 것으로 알려져 있다8).
본 저자들은 인체에서 유래한 교모세포종세포주 U-373 MG, U-251MG을 cytokine인 IFN-γ과 TNF-α으로 처 리하여 시간에 따른 TNF-α, IFN-γ의 ICAM-1 발현증 가 정도와 복합투여시의 상승효과가 나타나는지의 여부, 아 울러 각 세포의 차이 등을 연구하여 면역요법의 임상적 적 용 가능성을 제시하고자 하였다.
실 험 방 법
1. 실험대상
인체 교모세포종에서 기원한 U-251MG와 U-373MG를
Dulbecco’s modified Eagle’s medium(DMEM), 10% fe- tal bovine serum(FBS), 100U/ml penicillin G, 100μ g/ml streptomycin이 포함된 배지로 25mm2 flask에서 37℃, 95% 공기와 5% CO2 배양기에서 배양하여, 48시간 후에 현미경으로 관찰하여 flask바닥에 세포가 충분한 성장된 것 을 확인하였다. 이 세포를 trypsin으로 처리하여 세포를 분 리하고 상층액을 제거하였다. 세포농도가 1.0×105가 되도 록 희석 후 8-well chamber slide(177402, LAB-TEK, Naperville, IL, USA)에 총용량 0.3ml를 각각 분배하여 각 각 chamber에 3.0×104개의 세포를 cytokine을 포함시켜 배양할 수 있도록 준비하였다.
2. Cytokines 처치
ICAM-1의 발현을 유도하기 위한 cytokine으로는 rec- ombinant human IFN-γ(1.0×105 unit/ml, specific ac- tivity ±20×106 U/mg, HC2030-a-3423A08, HyCult biotechnology b. v. Frontstraat, Netherlands)와 rec- ombinant human TNF-α(1.1×105 unit/μg, specific ac- tivity 1.5×107U/mg, 210-TA, R & D system, Minneapolis, MN, USA)을 사용하였다. 세포주를 3.0×104개가 되도록 준비한 8-well chamber slide에 6시간 배양하여 부유세포 가 착상된 후 각각의 cytokine을 phosphate buffer solution (PBS)으로 희석하여 IFN-γ 1000U/ml, TNF-α 250U/ml, IFN-γ 1000U/ml와 TNF-α 250U/ml의 농도가 되도 록 대조군을 제외한 chamber에 각각 0.1ml를 배지에 첨가 하여 총 0.4ml가 되도록하여 배양기에서 각각 6시간, 12시 간, 24시간, 48시간, 72시간까지 배양하였다.
3. 면역조직화학염색
배양된 세포에서 ICAM-1의 발현 정도를 측정하기 위해 시간대 별로 IFN-γ, TNF-α가 포함된 8-well chamber slide에서 배지를 제거한 후 PBS로 2회 세척하였다. 95%
ethanol로 고정하고 chamber slide의 cap을 제거한 후, anti- ICAM-1 antibody(HM 4004, HyCult biotechnology b.
v., Frontstraat, Netherlands)를 1:30으로 희석하여 염색 하였다. 현미경하에서 100배의 배율로 5시야를 관찰하여 세포질이 갈색으로 염색된 세포의 비율을 구하였다(Fig. 1, 2, Table 1, 2).
4. 결과분석 및 통계처리
Cytokine에 의한 ICAM-1의 발현의 시간대별 차이, cy- tokine의 ICAM-1 발현에 대한 상승효과, 복합처리시의 반응, 종양세포간의 차이 등을 student t-test를 이용하여 통계학적 유의성에 대해 분석하였다.
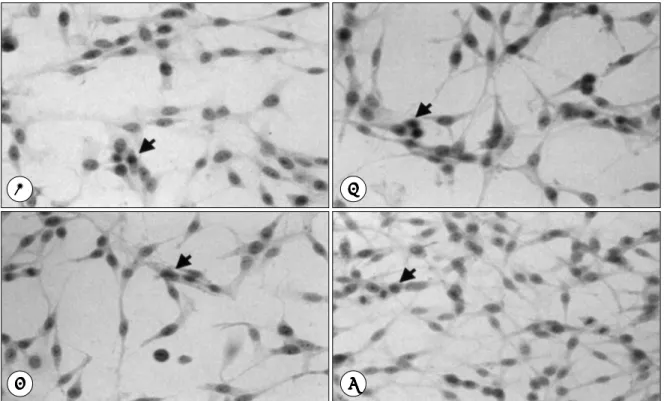
Fig. 1. Photographs of U-251 MG cell line that stained by immunoperoxidase after 24 hours from cytokine treatment, ICAM-1 antibody positive cells showing diffuse brownish cytoplasmic staining(arrow). But negative cells have grayish cyto- plasm. A:Incubated with medium alone, B:Incubated with IFN-γ, C:Incubated with TNF-α, D:Incubated with IFN- γ and TNF-α.
Fig. 2. Photographs of U-373 MG cell line that stained by immunoperoxidase after 24 hours from cytokine treatment, ICAM-1 antibody positive cells showing diffuse brownish cytoplasmic staining(arrow). But negative cells have grayish cyto- plasm. A:Incubated with medium alone, B:Incubated with IFN-γ, C:Incubated with TNF-α, D:Incubated with IFN- γ and TNF-α.
A A A
A BBBB
C CC
C DDDD
A AA
A BBBB
C CC
C DDDD
결 과
1. IFN-γ에 의한 ICAM-1 발현
IFN-γ에 의해 ICAM-1의 발현은 배양 후 12시간부터 의미있게 증가하였으며, 배양 48시간에 최대로 발현되어 점 차적으로 감소함이 관찰되었다. 발현 강도에는 두 세포 군 간의 통계학적 유의성은 없었다(Fig. 3, 4).
2. TNF-α에 의한 ICAM-1 발현
IFN-γ의 경우와 유사하게 12시간부터 증가하여 48시 간에 최대치를 나타냈다. U-251 MG의 경우 IFN-γ보다 급격히 발현이 증가하여 48시간 후에 최고치를 보였으나 IFN- γ에 비해 더 큰 발현 유도 효과를 관찰할 수는 없었다(p>
0.05). TNF-α에 의한 발현유도 효과의 상승폭은 U-251 MG의 경우 12시간에서 24시간대에 최대로 나타났고, U- 373 MG의 경우는 24시간에서 48시간대에 최대의 상승폭 을 나타내었고 두 군 사이에 통계학적으로 유의한 차이를 나타내었다(p<0.05).
3. 두 cytokine의 발현유도 상승효과
IFN-γ, TNF-α 두 cytokine으로 배양한 경우 각각의 cytokine으로 처리한 경우보다 발현이 증가하는 것을 시간 대별로 관찰할 수 있었으며 12시간 후부터 통계학적으로 의미있게 증가하여 48시간까지 시간이 경과함에 따라 증가 하였으나 24시간부터는 상승폭이 둔화되어 배양 후 24시간 과 48시간 사이에 통계학적 차이는 없었다(p>0.05). 두 cytokine에 의한 발현유도의 상승효과에는 두 세포군 간의 차이나 시간에 따른 효과에는 통계학적으로 유의한 차이를 나타내지는 않았다(p>0.05)(Fig. 3, 4).
4. 두 세포군에서 ICAM-1 발현의 차이
U-251 MG의 경우 ICAM-1의 발현은 시간이 경과함에 따라 48시간까지 의미있게 증가하였으며 IFN-γ에 의한 상승작용은 12시간 후부터 나타나 48시간 후에 최대치를 나타냈고(p<0.05), TNF-α에 의한 ICAM-1의 발현은 12시간 후부터 증가하여 24시간 후에 최대의 상승 효과가 나타났다. IFN-γ와 TNF-α 복합사용에 의한 상승작용 또 한 48시간에 최대로 증가하였으나 24시간 후와 통계학적인
Table 1. ICAM-1 expression on U-251 MG treated by cytokines(%)
Cytokine/Incubation time 6 hours(n=30) 12 hours(n=30) 24 hours(n=30) 48 hours(n=30) 72 hours(n=30) Control 15.86±2.23 26.70±4.32 37.98±5.83 46.62±7.68 35.80±4.13
IFN-γ 20.87±9.96 32.69±5.29 47.33±8.99 52.25±3.57 36.54±7.17 TNF-α 19.43±4.37 23.63±3.89 51.65±8.10 54.82±3.69 44.55±6.73 IFN-γ plus TNF-α 4.70±5.34 31.23±3.32 56.92±4.34 59.32±2.89 47.33±7.26
Table 2. ICAM-1 expression on U-373 MG treated by cytokines(%)
Cytokine/Incubation time 6 hours(n=30) 12 hours(n=30) 24 hours(n=30) 48 hours(n=30) 72 hours(n=30) Control 18.37±6.06 19.75±5.77 47.23±7.18 41.26±3.64 32.79±4.77
IFN-γ 18.54±5.23 34.33±6.58 44.22±2.83 49.87±4.64 38.16±4.33 TNF-α 18.34±5.05 31.63±3.87 44.34±6.64 54.19±4.32 43.72±2.85 IFN-γ plus TNF-α 18.91±11.6 31.15±2.36 58.58±8.49 63.53±5.79 45.51±3.41
Fig. 3. Graph showing induction of ICAM-1 expression by
cytokine treatment on U-251 MG cell line. Fig. 4. Graph showing induction of ICAM-1 expression by cy- tokine treatment on U-373 MG cell line.
차이는 없었고(p>0.05) 24시간까지 의미있게 상승하다가 상 승폭이 작아졌다. U-373 MG의 경우는 IFN-γ, TNF-α 각각에 의한 증가는 12시간 후부터 증가하여 48시간까지 증가하였으며, IFN-γ와 TNF-α의 상승 효과는 U-251 MG와 마찬가지로 24시간까지 의미있게 상승하다가 상승폭 이 작아졌고 U-251 MG의 경우보다 수적으로 더 컸으나 통계학적으로 유의한 차이는 없었다(p>0.05).
고 찰
부착물질(adhesion molecules)은 세포간, 바이러스와 세 포간의 상호작용에 생리학적 과정을 매개하는 중요한 물질 로 알려져 있으며19), 세포와 세포외 기질과의 상호작용 및 종양이나 염증반응에서 세포간 상호작용을 매개하는 중요한 역할을 하는 물질로 종양 내로 면역세포를 이동시키고 종양 의 침투를 조절하는 것으로 알려져 있다6). 부착물질은 in- egrin, immunoglobulin superfamily, selectin의 3종류로 구분되며 integrin family는 ICAM-1의 ligand로 작용하는 LFA-1과 fibronectin 그리고 vascular cell adhesion mo- ecule-1의 ligand인 very late antigen-4(VLA-4)로 구 성된다. Immunoglobulin superfamily에는 LFA-3, vas- uar cell adhesion molecule-1(VCAM-1), ICAM-1, NCAM으로 구성되어 있다6)27). 이중 ICAM-1은 백혈구, 섬유아세포, 혈관내막세포, 편평세포암, 대장암, 간암, 흑색 종 세포 등에서 발견되며8)19), integrin LFA-1의 ligand로 작용하여 임파구의 LFA-1과 ICAM-1을 갖는 세포와 작 용함으로서 임파구의 이동을 촉진하고, 이러한 상호작용은 여러 면역반응과 염증반응에서 백혈구의 부착에 필수적인 요소로 작용하여8), 종양에서 백혈구의 종양 내로의 이동과 정에 관여한다23).
신경교세포의 부착물질로는 ICAM-1이 발현되며 항원표 시세포에 높은 농도의 MHC class II가 없는 경우 ICAM- 1이 T 임파구의 반응을 결정하여 교모세포종의 면역반응을 조절하는 것으로 알려져 있으며2), 이러한 현상은 ICAM-1 이나 LFA-1에 대한 단클론성항체가 교모세포종으로의 종양 침투임파구나 LAK cell의 부착을 억제하여 종양세포로의 임 파구의 이동을 억제하는 것으로 설명할 수 있다6). 또 ICAM- 1의 발현이 원발성 종양보다 전이성종양에서 더 고농도로 존재한다는 사실은 이 거대분자가 숙주의 면역체계에 관여 하며 종양세포의 전이에 관여함을 추측할 수 있다13).
본 연구에서 이용된 U-251 MG는 인간 교모세포종에서 기원한 세포주로 배양세포에서 glial fibrillary acidic pro- ein(GFAP)를 생산하여 신경교세포 기원으로 생각되고 HLA
class I을 높은 농도로 발현하나 class II(DR)은 발현하지 않는 세포주이며 U-373 MG는 class I, II 모두를 발현하 나 GFAP를 생산하지 않는 교모세포종기원의 세포주이다3). 본 연구에서는 수술 표본으로 ICAM-1의 발현을 유도하지 않고, 비교적 안정되고 세포의 특성이 밝혀진 세포주를 이 용함으로서 환자의 세포를 이용할 경우 발생할 수 있는 오 차를 감소시키고자 하였다.
IFN은 다발성골수종, 임파종, 흑색종, 신세포암, 유방암 등 의 치료에 부분적이나 완전소실을 일으키는 것으로 보고되 어 있으며24), 악성 신경교세포종이나 수아세포종(medul- loblastoma)등에도 효과가 있는 것으로 보고되어 있다17). 인 터페론의 종양에 대한 효과는 세포주기를 연장시키며, DNA 생성을 억제하고, 세포분화를 억제하는 내적 효과와 T 임파 구와 자연살해세포(natural killer cell)의 활성도를 증가시 키는 것을 포함하여 숙주의 면역반응을 증가시키는 외적효 과로 구분된다7). IFN은 그 기원에 따라 임파구 기원 IFN (IFN-α), 섬유아세포기원 IFN(IFN-β), 면역 IFN(IFN- γ)으로 구분되며 IFN-β는 처음으로 임상적으로 시도되 었고 in vitro에서 신경교세포의 증식을 억제하나 그 효과는 미비하거나 부분적이었다28). 이후 Vita등29)은 유전자재조합 인간 IFN-β가 교모세포종세포 배양에서 IFN-γ보다 억 제작용이 크다고 하였으며, 특히 복합 사용할 경우 억제작 용이 크다고 하였으며 Fetell등9)은 이를 이용하여 교모세포 종의 치료의 가능성을 제시한 바 있다. IFN-α는 in vitro, nude mice에서 증식을 억제하며, HMC class I의 발현은 증가시키나 class II의 발현에는 영향이 없는 것으로 알려져 있다1). IFN-γ는 in vitro에서 신경교세포종 세포의 성장을 억제하고, IL-2 존재 하에서 임파구의 신경교세포에 대한 독성을 증가시킨다4). 그리고 human leukocyte antigen (HLA)-DR antigen과 HLA-DR 특이 RNA의 발현을 증 가시키고 여러 종류의 세포 부착물질을 증가시키며 이러한 주요조직적합성항원과 세포 부착물질은 T 임파구가 항원을 인지하여 면역기능을 조절하는데 필수적이며, 이들의 발현 의 변화가 궁극적으로 생물학적 변화를 야기한다14). 복합투 여가 억제효과를 증강시키는 기전은 명확하지 않으나 가능 한 기전으로는 첫째로 IFN type I(IFN-α/β)과 IFN type II(IFN-γ) 세포표면 수용체결합의 협력작용으로 인한 세 포막을 통한 신호전달의 강화이며, 둘째는 선택적으로 활성 화(selective activation or enhancement)시켜 직접 성장 억제를 유발하는 유전자 전사나 유전자의 발현을 억제하는 물 질을 유도하는 것이며, 셋째로는 전사이후 과정에서 세포증식 을 유도하는 세포성장인자 유발 유전자(growth-factor-in- ducible genes)의 억제에 대한 강화 작용 등이 제시되어
있다21). Kuppner등14)은 cytokine의 ICAM-1발현에 대한 효과를 in vivo에서 교모세포종세포에서 IL-1β, TNF-α, IFN-γ에 의해 ICAM-1의 발현과 IC-AM-1 특이 mRNA 의 양이 증가하며 IL-2, IL-4, IL-6, transforming gr- owth factor-β2(TGF-β2)등은 ICAM-1 발현에 영향 을 미치지 않는다고 하였고, 이 증가를 항ICAM-1 항체를 이용하여 immunoperoxidase staining technique로 측정 하였다. Guarini등 13)은 인간 뇌종양에서 기원한 세포를 이용하여 ICAM-1의 발현의 차이를 연구하였고, 교모세포 종의 경우는 IFN-β의 증강효과가 IFN-γ보다 크고, TNF- α와 복합처리시 발현이 증가하는 것을 확인하였다.
TNF-α는 여러 뇌종양에서 ICAM-1의 발현유도에 가 장 효과적인 cytokine으로 IFN-β와 복합사용으로 단독으 로 사용할 경우보다 ICAM-1의 발현을 증강시키는 것으로 알려져 있다13). 본 연구에서는 IFN-γ, TNF-α를 이용하 여 인간 교모세포종세포에서 기원한 세포주에서 ICAM-1 의 발현에 있어 IFN-γ 또한 TNF-α의 ICAM-1 발현에 대한 상승 효과를 나타내는 것을 관찰할 수 있었다(p<0.05).
두 cytokine에 의한 상승 효과는 24시간까지 급격히 증가 하나 24시간에서 48시간까지의 상승은 이전의 상승폭과 통 계학적으로 의미가 없어(p>0.05), 복합사용시의 상승작용 은 양적 상승뿐만 아니라 발현시간을 촉진시키는 작용을 하 는 것이라 추측된다.
교모세포종의 경우 ICAM-1이 발현되나 정상뇌세포에서 는 발현되지 않으며, 양성교종의 경우는 약하게 발현된다14). 악성 교모세포종의 경우 약 40%에서 HLA-DR(class II) 은 측정가능한 정도로 발현되며 정상적인 뇌세포에서는 발현 되지 않거나 극소수에서 발현된다15). 여러 연구에서 ICAM- 1과 HLA-DR은 유사하게 발현되며, 성상세포는 MHC class II 분자와 연관되어 림프구에게 용해성 항원을 제공하 는 항원제공세포로 작용한다10). 이것은 높은 농도의 HLA- class II의 존재 없이도 이루어져 ICAM-1이 T 임파구 반 응에 결정적인 인자로 작용하며2), 교모세포종세포의 면역반 응을 결정하는 중요한 인자임을 추측할 수 있다. 인체 교모 세포종세포에서 ICAM-I의 발현은 여러 cytokine에 의해 조절되며 발현 정도는 활성화된 T 임파구에 부착된 기간에 비례하나, 세포내 신호를 조절하는 교모세포종 기원 인자는 종양 침투 임파구의 활성화도와 부착물질의 발현정도에 영 향을 미치는 것으로 알려져 있다14). 유방암에서 기질 섬유 아세포의 ICAM-1의 발현과 임파구의 이동의 연관성30), 여러 피부질환에서 피하 임파구의 존재와 ICAM-1 발현12) 등에서 ICAM-1이 임파구의 이동과 ICAM-1이 발현된 세포가 임파구의 LFA-1과 반응하는 데 있어서 중요한 역
할을 하는 것을 추측할 수 있다. 교모세포종에서 혈관주위 와 실질내 임파구의 이동이 관찰되었으나, 정상 뇌세포나 양성 교종에서는 없거나 적은 것이 관찰되어, 종양세포나 종양내 혈관 내피세포의 ICAM-1 발현은 종양 내로 임파 구의 이동에 관여하는 여러 인자 중에 하나임이 제시되어 있다14). Mizuno등20)은 HuIFN-γgene 주입에 의한 LAK cell의 신경교세포에 대한 세 포독성의 증가가 anti-MHC class I 이나 II 단클론성항체에 의해서 중화되지 않으나, 항 ICAM-1 단클론성항체에 의해서는 억제되는 것을 확인하 였다. 본 연구에서는 ICAM-1의 발현이 양 세포군에서 시 간이 증가함에 따라 배양 48시간까지 통계학적으로 의미있 게 증가하였으며 이후 감소하는 것을 발견할 수 있었으나 발현정도에 있어서 두 세포군사이의 통계학적으로 의미있는 차이는 관찰되지 않았다(p>0.05), Cytokine의 ICAM-1 발현 증가효과는 가장 강력한 cytokine으로 알려져 있는 TNF-α가 IFN-γ보다 뚜렷할 것으로 예상되었으나 실제 로는 TNF-α에 의한 ICAM-1발현과 IFN-γ에 의한 발 현의 양적인 차이는 통계학적 차이가 없었고(p>0.05), 이 는 ICAM-1의 최대발현을 나타내는 cytokine의 농도의 차 이에서 나타나는 것으로 추측된다. 뇌종양을 LAK cell과 IL-2로 치료할 경우 뇌부종을 증가시키며 이는 LAK cell 에서 분비된 cytokine이 종양내 혈관내막세포의 ICAM-1 의 발현을 증가시키고 거대분자의 혈관투과성을 증가시키기 때문으로 추측된다5). Saris등25)은 IL-2의 뇌척수액 내로의 이동을 조사하여 종양내 혈관의 투과성이 정상 조직의 그것 보다 증가되어 있으나, 주요 조직접합성항원 발현에 필요한 정도로 cytokine의 이동이 일어나는 기전은 명확하지 않다 고 하였다1). LAK cell에서 분비되는 cytokine이 특히 교모 세포종세포에서 ICAM-1의 발현을 증가시키나 LAK-cell 과 IL-2를 종양세포로 주입할 경우 LAK cell의 종양세포 로의 이동은 현재 보고된 바 없다. 그러나, 종양세포내로의 직접주입요법은 혈관뇌장벽을 회전하고, 종양내 국소적인 고농도의 약물농도를 얻을 수 있고, 전신적인 독성을 감소 시키는 장점이 있어 뇌종양세포의 면역요법에 있어서 종양 내로의 주입이 유용하고, 이러한 방법으로는 직접주입, in- tracavitary instillation, intracavitary topical application, chronic microinfusion, polymer implants를 통한 조절 등 의 방법이 있으며16), 면역치료를 위해 효과적인 약물농도를 유지하며, 사용이 쉽고, 부작용이 적은 장치의 개발이 필요 하며 아울러 부착물질의 발현을 지속적이고 효과적으로 유 지하는 방법과 종양에 대한 면역반응을 유도하는 방법에 대 한 연구가 향후 필요할 것으로 사료된다.
결 론
두 cytokine의 혼합배양의 경우 상승효과가 나타났으며 이는 U-373 MG의 경우가 보다 높은 정도로 증가되었으 나 통계학적 유의성은 없었다. 결론적으로 종양세포에 대한 cytokine 처리가 ICAM-1 발현 유도를 증가시키고 cyto- kine을 복합처리 할 경우 발현이 강화되고 발현시간을 촉진 하여 종양세포에 대한 LAK cell의 세포독성을 증가시키는 것 을 예상할 수 있었다. 이 연구에서 cytokine처리가 ICAM-1 의 발현을 유도하고 이를 기초로 하여 추후 종양세포내로의 유전자 전이를 통해 종양을 억제하는 연구를 진행할 수 있 는 근거가 되리라 기대되며 향후 뇌종양에 대한 치료는 수 술적치료에 종양세포를 억제하는 효과적인 약물농도의 유지 및 cytokine의 면역 증강 효과를 이용한 면역치료의 가능 성을 제시할 수 있으리라 생각된다.
•논문접수일:1999년 8월 11일
•심사완료일:1999년 9월 7일
•책임저자:이 종 원
100-272 서울 중구 필동 2가 82-1 중앙대학교 의과대학 신경외과학교실
전화:02) 2260-2189, 전송:02) 2260-2166 E-mail:cauhns@netsgo.com
References
1) Akbasak A, Oldfield EH, Saris SC:Expression and modu- lation of major histocompatability antigens on murine primary brain tumor in vitro. J Neurosurg 75:922-929, 1991 2) Altman DM, Hogg N, Trowsdale J:Cotransfection of ICAM-
1 and HLA-DR reconstitutes human antigen-presenting cell function in mouse L cells. Nature 338:512, 1989
3) Bigner DD, Bigner SH, Ponten J, Westermark B, Mahaley MS, Ruoslahti E, et al:Heterogeneity of genotypic and phen- otypic characteristics of fifteen permanent cell lines derived from human glioma. J Neuropathol Exp Neurol 40:201-229, 1981
4) Bogdahn U, Fleischer B, Hilfenhaus J, Rothig HJ, Krau- seneck P, Merten HGF, et al:Interferon-β in patients with low-grade astrocytoma- A phase I study. J Neuro-Oncol 3: 125-130, 1985
5) Cotran RS, Pober JS, Gimrone MA Jr, Springer TA, Wiebke EA, Gaspari AA, et al:Endothelial activation during inter- leukin-2 immunotherapy. A possible mechanism for the vascular leak syndrome. J Immunol 140:1883-1888, 1987
6) Couldwell WT, Tribolet N, Antel JP, Gauthier T, Kuppner MC:
Adhesion molecules and malignant gliomas:Implications for tumorigenesis. J Neurosurg 76:782-791, 1992
7) Duff TA, Borden E, Bay J, Piepmeiner J, Siclaff K:Phase II trial of interferon-b for treatment of recurrent glioblastoma multiforme. J Neurosurg 64:408-413, 1986
8) Dustin ML, Rothlein R, Bhan AK, Dinarello CA, Springer TA:Induction by IL-1 and interferon-gamma:Tissue distri- bution, biochemistry, and function of a natural adherence mo- lecule(ICAM-1). J Immunol 137(1):245-254, 1986 9) Fetell MF, Housepian EM, Oster MW, Cote DN, Sisti MB,
Marcus SG, et al:Intratumoral administration of beta inter- feron in malignant glioma:Phase I clinical and laboratory study. Cancer 65:78-83, 1990
10) Fontana A, Hengartner H, de Trobolet N, Weber E:Glio- blastoma cells release interleukin 1 and factors inhibiting in- terleukin 2-mediated effects. J Immunol 132:1837-1844, 1984 11) Frohman EM, Frohman TC, Dustine ML Vayuvegula B, Choi B, Gupta A, et al:The induction of intercellular adhesion molecule-1(ICAM-1) expression of human fetal astrocytes by interferon-γ, tumor necrosis factor-γ, lymphotoxin, and inter- leukin-1:Relevance to intracerebral antigen presentation. J Neuroimmunol 23:117-124, 1989
12) Griffiths CEM, Voorhees JJ, Nickoloff BJ:Characterization of intercellular adhesion molecule-1 and HLA-DR expression in normal and inflamed skin:Modulation by recombinant gamma interferon and tumor necrosis factor. J Amer Acad Dermatol 4:617-629, 1989
13) Guarini L, Temponi M, Bruce JN, Bollon AP, Duigou GJ, Moulton TA, et al:Expression and modulation by cytokines of the intercellular adhesion molecule-1(ICAM-1) in human central nervous system tumor cell cultures:Int J Cancer 46: 1041-1047, 1990
14) Kuppner MC, Meir EV, Hamou MF, Tribolet ND:Cytokine regulation of intercellular adhesion molecule-1(ICAM-1) exp- ression on human glioblastoma cells. Clin Exp Immunol 81: 142-148, 1990
15) Lampson L and Hickey WF:Monoclonal antibody analysis of MHC expression in human brian biopsies:Tissue ranging from “histologically normal” to that showing different levels of glial tumor involvement. J Immunol 144:4054-4062, 1986 16) Laske DW, Ilercil O, Akbasak A, Youle RJ, Oldfield EH:Ef- ficacy of direct Intratumoral therapy with targeted protein toxins for solid human gliomas in nude mice. J Neurosurg 80:520-526, 1994
17) Mahaley MS, Urso MB, Whaley RA, Blue M, Williams TE, Guaspari A, et al:Immunobiology of primary intracranial tu- mors, Part X:Therapeutic efficacy of interferon in the tre- atment of recurrent gliomas. J Neurosurg 63:719-725, 1984 18) Mahaley MS, Bertsch L, Cush S, Gillespie GY:Systemic gamma-interferon therapy for recurrent gliomas. J Neurosurg 69:826-829, 1988
19) Marlin SD, and Springer TA:Purified intercellular adhesion molecule-1(ICAM-1) is a ligand for lymphocyte function-ass- ociated antigen 1(LFA-1). Cell 51:813-819, 1987
20) Mizuno M, Yoshida J, Takaoka T, Sugita K:Liposomal transfection of human β-interferon gene into human glioma cells adaptive immunotherapy using lymphokineactivated killer cells. J Neurosurg 80:510-514, 1994
21) Moulton TA, Jiang H, Guarini L, Fetell MR, Fisher PB:In- duction of growth suppression and modification of gene;Ex- pression in multi-drug-resistant human glioblastoma multi- forme cells by recombinant human fibroblast and immune interferon. Int J Cancer 51:373-378, 1992
22) Mule JJ, Yang J, Shu S, Mule JJ, Yang J, Shu S, Rosenberg SA:The anti-tumor efficacy of lymphokine activated killer cells and recombinant Interleukin 2 in vivo:Direct correla- tion between reduction of established metastasis and cytolytic activity of lymphokine activated killer cells. J Immunol 136: 3899-3909, 1986
23) Pober JS, Gimbrone MA Jr, Lapierre LA, Mendrick DL, Fiers W, Rothlein R, et al:Overlapping patterns of activation of human endothelial cells by Interleukin 1, tumor necrosis factor, and immune interferon. J Immunol 137:1893-1896, 1986
24) Salford LG, Strmblad LG, Nordstrm CH:Intratumoral ad- ministration of interferon in malignant glioma. Acta Neuro-
chir 56:130-131, 1981
25) Saris SC, Patonas NJ, Rosenberg SA, Alexander JT, Frank J, Schwartzentruber DJ, et al:The effect of intravenous Interleu- kin-2 of brain water content. J Neurosurg 71:169-174, 1989 26) Simmons D, Makgoba MW, Seed B:ICAM, an adhesion
ligand of LFA-1, is homologous to the neural cell adhesion molecule NCAM. Nature 331:624-627, 1988
27) Springer TA:Adhesion receptors of the immune system. Na- ture 346:425-433, 1990
28) Tanaka N, Nagao S, Tohgo A, Sekiguchi F, Kohno M, Ogawa H:Effect of human fibroblast interferon on human gliomas transplanted into nude mice. Gann 74:308-316, 1983 29) Vita JR, Edwalds GM, Gorey T, Housepian EM, Fetell MR,
Guarini L, et al:Enhanced in vitro growth suppression of human glioblastoma cultures treated with the combination of recombinant fibroblast and immune interferons. Anticancer Res 8:297-302, 1988
30) Vogetseder W, Feichtinger H, Schulz TF, Schwaeble W, Tabaczewski P, Mitterer M, et al:Expression of 7F7-antigen, human adhesion molecule identical to intercellular adhesion molecule-1(ICAM-1) in human carcinomas and their stromal fibroblast. Int J Cancer 43:768-773, 1989