바이오 의약품 제조 시스템 혁신을 위한 도전과 전망
Challenges and Perspectives for Innovative Bio/Pharmaceutical Manufacturing
Systems Engineering
조재현1, 류준형2,*
1연세대학교 차세대 융복합 에너지물질 특화센터
2동국대학교 창의융합공학부 에너지·전기 전공
*Email:jhryu@dongguk.ac.kr
1. 들어가는 말
과학기술이 발전하고, 자유무역 체계가 전세계 적으로 자리잡으면서 국제 무역이 활성화 되면서, 항공 여행과 해상 물류 운송은 급속도로 보편화되 면서 지구촌이라는 말은 현실이 되었다. 과학기술 의 발전과 함께 여러가지 질병을 이겨내고, 인간의 평균 수명은 연장되게 해 주는 의학기술들도 활발 히 개발되고 있었다. 2020년초부터 코로나 바이러 스 감염증(COVID-19)이 전세계로 빠르게 전파되었 다. 활발해진 무역과 여행 활성화로 인해, 사람들의 이동이 활발하여 전염병 또한 전세계적으로 급속히 확산되었다. 전세계적인 전파로, 수 많은 인명 피해 와, 이를 막기 위한 봉쇄로 인한 경제적 손실은 현 재 인류의 가장 큰 문제가 되었다. 직접적으로 해결 할 수 있는 백신 등 의약품을 개발하는 바이오 제약 산업에 어느때보다 크게 주목하게 되었다. 의학 기 술은 놀라운 신약 개발을 통해 혁신적 성과를 얻어
왔지만, 짧은 기간에 막대한 치료 대상 환자들에게 충분한 의약품을 필요한 시기에 공급할 수 있는 생 산성 한계를 보여주고 있다.
화학공학, 특히 공정 시스템 공학(Process Systems Engineering, PSE)은 이러한 바이오 의약품 제조 공 정의 한계를 극복하는데 기여할 수 있다. 석유 화 학, 정밀 화학 등 중화학 산업의 효율을 향상시키는 데 집중해왔던 PSE분야가 바이오 의약품 제조 산업 에도 기여하여, 인류 전체의 문제를 해결에 기여할 수 있다는 것은 매우 흥미롭다. 이에 대해 해외에서 는 벌써 10여년이전부터 인식하여, 관련 연구 개발 에 많은 노력들이 실행되어 오고 있다. 최근 우리 나라는 의약제조산업을 차세대 산업으로 육성하려 고 노력하고 있지만, PSE 측면에서 아직 할 일이 많 다. 본 글에서는 제약 공정의 한계를 극복하기 위한 PSE 관련 연구 동향과, 향후 전망에 대해 살펴보고 자 한다. 국내 관련 산업의 발전에 대한 PSE를 비롯 한 화학공학의 연계 가능성을 조망해 본다.
2. 바이오 제약산업 개요
바이오 제약 산업은 높은 성장률과 부가가치를 가지고 있는 유망 산업이다. 인류 생존을 위해 제약 산업의 중요성은 어느때보다 강조되고 있는 상황에 서, 중요한 사실은 COVID-19 백신과 같은 신약 개 발만으로 모든 문제를 해결 할 수는 없다는 사실이 다. 예를 들어, 발병 초기 전염병 전파를 막기 위한 마스크와 같은 의료용 보호 장비, 의료용 산소 등 기초적 의료 장비에 대한 급속한 수요 증가에 대응 하지 못해, 많은 희생자가 발생하였다. 새로운 질병 을 극복하기 위해서는 신약 개발도 중요하지만, 개 발된 신약에 대해 품질 관리를 제대로 하여, 불량품 이 없이, 필요한 만큼 생산하고, 필요한 장소와 시 점에 배송할 수 있어야 한다. 이러한 조건들 중 하 나라도 지켜지지 못한다면, 많은 피해자가 생길 수 밖에 없다.
사람이나 동물의 질병을 진단·치료·경감·처 치 또는 예방할 목적으로 사용하는 물품 중 기구·
기계 또는 장치가 아닌 것을 의약품이라 한다1. 제약 산업은 국민의 건강관리 및 질병의 예방, 치료, 처
치, 진단을 위한 의약품을 개발, 제조, 판매하는 산 업으로 정의할 수 있다2. 전세계적으로 의약품 시장 은 1조 2천억 달러(2018년 기준, 1395조원)의 규모를 가지고 있는데 2005년 이후 연평균 6% 성장세를 보 이고 있다3. 자동차산업(1조6000억달러), 콘텐츠 산 업(영화, 드라마 등, 1조4200억달러)보다는 적지만, 반도체(2800억달러), 조선(2500억달러), 항공(3500억 달러) 산업 등보다는 훨씬 큰 규모를 가지고 있다.
제약산업은 각 지역별 규모 측면에서, 북미가 약 40%, 유럽 30%, 아시아 13%, 일본 11%, 라틴 아메리 카 6%에 이른다고 한다4. 부가가치가 크고 많은 일 자리를 만들 수 있기 때문에 의약품 산업은 선진국 형 산업이라 분류되며, 우리 나라에서도 미래 먹거 리 산업으로 육성하려고 노력하고 있다.
3. PSE가 주목할 바이오 의약 산업 주요 이 슈들
바이오 의약 산업이 기존의 상황에서 보다 더 발 전하기 위해서, 공정 시스템 공학(Process Systems Engineering, PSE)을 비롯한 화학공학자들의 전문
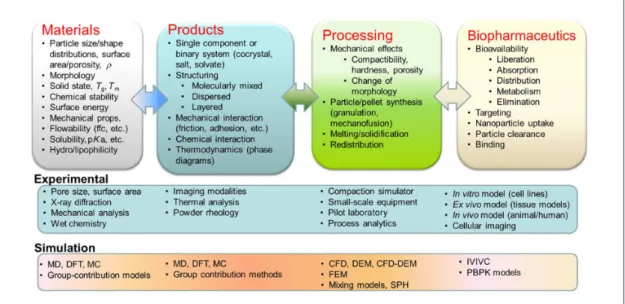
Figure 1. Engineering view of pharmaceutical development (MD, molecular dynamics; DFT, density functional theory computations; MC, Monte Carlo methods; CFD, computational fluid dynamics; DEM, discrete element method; FEM, finite element method; SPH, smoothed particle hydrodynamics; IVIVC, in vitro-in vivo correlations; PBPK, physiologically based pharmacokinetics5.
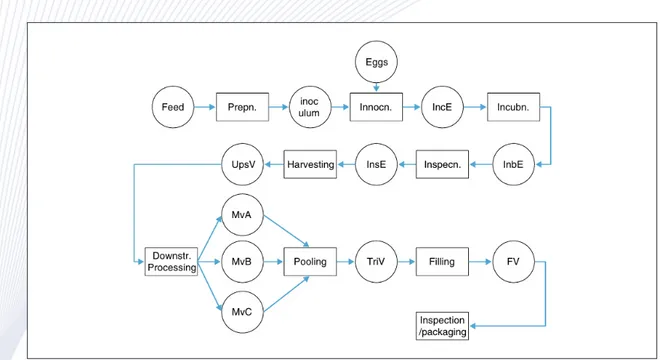
지식을 받아들일 필요가 있다. 이를 위해서는 PSE 연구진과 화학공학자들이 바이오 의약 산업에 대해 이해할 필요가 있다. Figure 1은 제약 개발과 관련된 엔지니어링 활동에 대해 정리하여 보여준다. Figure 2는 백신 생산 공정 사례를 통하여 바이오 제약 생 산 공정의 사례를 보여준다.
바이오 제약 산업의 주요 특징들을 크게 세 가지 로 구분할 수 있다.
첫번째, R&D 연구 개발에 많은 시간과 자본 투 자를 필요로 한다. 일반적으로 새로운 신약을 개발 하고, 인증 받는데 약 10년 이상의 기간과 천문학적 액수의 자본이 필요하다. 신약의 독점적 생산 및 판 매에 대한 특허권을 인정을 받을 수 있는 기간이 정 해진 상황에서 기업이 수익을 얻을 수 있는 기간은 따라서 더욱 짧아지고, 많은 제약들을 받게 된다.
두 번째로, 다른 산업들과 가장 차별화되는 부분 이 의약품 산업이 강력한 규제(regulation)의 영향을 받는다는 것이다. 의약품의 특성상 사람에게 치명 적 영향을 줄 수 있기 때문에 인허가, 제조, 유통 및 판매 등 거의 전 분야에 걸쳐 공공성이 있는 정부기 관들에 의해 강력하게 규제 받고 있다. 제품의 품
질에 문제가 있을 경우, 심각한 인명 피해와 경제적 피해 문제가 있을 수 있기 때문에 부작용 등 문제가 없다는 것을 심사, 검증하는데 많은 비용과 시간이 소비된다. 생산 공정 중에도, 중간 제품들의 특성 과 품질을 검사하고 모니터링해야 한다. 검증을 위 해 제조 공정 중간에 계속 검사를 통해 안정성을 점 검해야 한다. 이러한 강력한 규제를 만족시키기 위 해 공정 검증 기술이 필요하게 되었다. 이를 제약산 업에서 Process Analytical Technology (PAT)라 칭한 다. 보다 효율적으로 이러한 검증하기 위해 제조 공 정 자체를 설계할 때 이를 반영할 수 있도록, 한 단 계 업그레이드 시키는 방안으로 설계부터 품질을 보장할 수 있게 한다는 의미에서 바이오 의약 제조 공정에 대해 설계 기반 품질관리 (Quality by Design, QbD)가 최근 주목받고 있다.
세 번째로, 의약품 시장에서 신약 뿐만 아니라 특허 기간이 만료되어 자유롭게 생산이 가능한 복 제약(generic) 생산이나, 제품 개발 대신에, 위탁생산 (Contracted Manufacturing Organization, CMO)을 집 중하는 비즈니스의 비중이 증가하게 되었다. 신약 개발보다는 특허독점권이 만료되 의약품을 보다 생
Figure 2. An Illustration of vaccine production process6.
산성을 높여 공급하는 것의 수익성이 크다는 것을 인식하게 되었다. 이들 업체들에게 의약품 생산 공 정에 대해 주목하게 되었고, 그 공정의 생산 비용 절 감이 가장 핵심 이슈가 되었다. 한편으로 전 세계적 으로 제약산업이 높은 신장세를 나타내고 있는 요인 중 하나로 바이오 의약품의 활약도 주목할 만하다.
생명공학기술의 발전으로 의약품 시장의 중심이 합 성의약품에서 바이오 의약품으로 이동하고 있다. 바 이오 의약품은 생물체에서 유래한 것을 원료로 제조
한 의약품으로서 합성의약품에 비해 독성이 낮아 부 작용이 적고, 표적 장기에 직접적 효능을 발휘하여 효과가 우수하다7. 전체 의약품 중 바이오 의약품 비 중이 점차 확대되어 2018년 28%(2,430억 달러)에서 2024년 32%(3,880억 달러)에 이를 전망이다8.
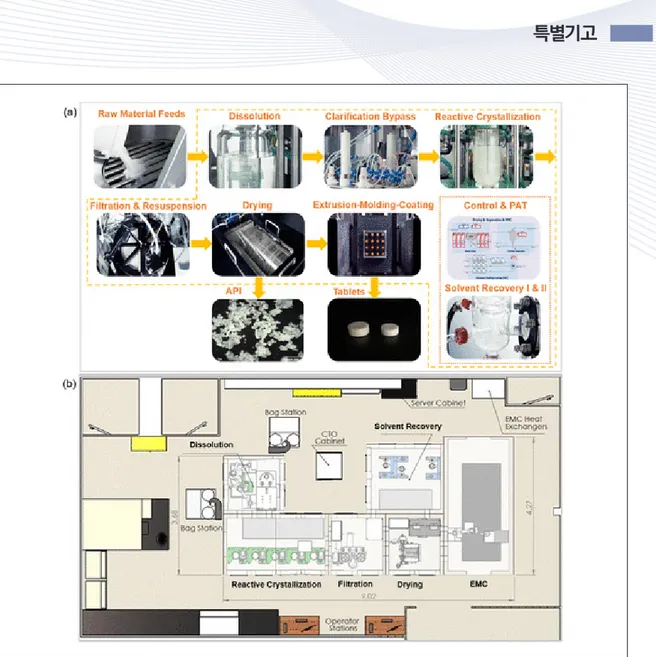
이러한 상황에 따라서 의약품 생산 공정의 중요 성이 새롭게 주목받고 있다 (일반적 바이오 제약생 산공정 개념도 Figure 3 참조). 어렵게 신약을 개발 하여 특허를 인정받게 되면, 독점적 판매 권한을 제
Figure 3. 일반적 바이오 의약품 제조 공정 사례 (a) Process flow from raw materials through the product (API and tablets), control system, PATs, and solvent recovery I and II. (b) Top view and spatial arrangements of the facility, including the process enclosures (Dimensions are provided in meters)9.
한된 기간 동안 가지게 되어, 막대한 수익을 얻을 수 있었다. 하지만 점점 더 제품 개발 기간은 길어 지고, 비용은 늘어가고 있다. 수익을 얻기 위해서는 제품 연구 개발 비용, 인증 비용 및 마케팅 비용 등 을 합한 투자대금 이상의 수익을 거두기 위해서, 짧 은 시간 이내에 대규모로 생산해야 한다. 한편 신약 제품 개발과 그 생산 공정 개발 및 해당 신규 공정 에 대한 규제기관의 인증을 단축하는 것이 제약 산 업의 가장 중요한 이슈라는 것은 변함이 없다.
오랫동안 제약 산업의 주요 관심사는 신약을 개 발하는 것이지, 생산에는 크게 관심을 기울이지 않 았다. 강력한 규제와 신약 개발의 어려움 때문에 신 약 개발 기간은 길어지고, 비용은 더욱더 증가하게 되면서, 특허로 인정받던 독점 판매 기간은 더욱 짧 아지게 되었다. 따라서 짧은 기간 동안 제약 생산 공정을 개발하고 이에 대한 설비를 준비해야 되었 다. 규제는 더욱 강화되고 있기 때문에, 제조 공정 별로 반드시 진행되어야 하는 중간 검사 공정도 심 각한 부담이 된다. 이러한 부담 때문에 역설적으로 의약 생산 공정의 생산성 증가가 중요한 이슈로 부 각된 것이다. 이 이슈들을 해결하기 위해 전세계 제 약 산업체들과 정부 차원의 규제기관들은 제약품 생산 공정을 기존 회분식 공정 대신에 연속식 공정 으로 전환하는데 가장 큰 관심을 두게 되었다.
(1) PAT(Process Analytical Technology) 제약 산업 자체가 기존 석유화학기이나, 정밀 화 학 분야와 차별화되는 측면을 강력한 규제 준수의 의무로 설명할 수 있는데, 제품의 품질에 문제가 있 을 경우 심각한 인명 피해와 경제적 피해 문제가 있 을 수 있기 때문에 제품 생산 공정 중간에 품질 관리 를 엄격하게 하고 있다. 이러한 제약 산업의 규제를
“공정분석기술(Process Analytical Technology: PAT)”
이 대표적이다. PAT는 2002년 미국 식품의약품안전 청(US Food and Drug Administration: FDA)의 정식 발 의(發議)에 의해 제약 산업분야에서 시작된 신개념 의 공정관리 및 진단기술을 일컫는 용어이다. FDA
의 정의에 따르면, “PAT는 원료 나 공정 중의 물질을 실시간으로 분석하고, 분석한 결과 에 따라 공정을 조절할 수 있는 시스템”을 의미한다. PAT는 최적의 품질을 갖춘 의약품을 생산할 수 있도록 품질에 영 향을 미칠 수 있는 단위 공정의 각 단 계를 충분히 이 해함으로써 의약품 품질로서 공정을 디자인하고 제 어한다는 접근방식을 채택하고 있다10.
(2) 설계 기반 품질 관리(Quality by Design) 제약 산업은 의약품의 품질을 보장하는 것이 가 장 큰 문제이다. 중소규모 제약업체들은 복제약 (Generic 의약품)을 주로 생산하는데, 우수 의약품 제조 및 품질 관리 기준(current Good Manufacturing Practice, cGMP)을 제대로 준수하지 못하기도 하 고, 제품 및 공정 변수들에 대한 깊은 이해를 가지 지 못하여 제품 품질을 보장하는데 한계를 가지고 있다. 이러한 문제들을 해결하기 위하여 의약품 제 조 표준을 향상시키는 활동들이 수행되고 있다. 가 장 대표적인 사례가 기존의 전통적인 테스트 기반 품질 관리(Quality by testing, QbT)를 체계적인 설계 기반 품질관리(Quality by Design, QbD)라는 새로운 패러다임을 변환(paradigm shift)하는 것이다. 이를 통해 자원을 경제적으로 사용하고, 품질을 향상시 켜 효율적인 의약품을 생산할 수 있는 체계를 구축 하는 것을 목표로 세우고 있다. 최근 설계 기반 품 질관리(QbD)는 의약품 개발, 생산, 사용의 전 주기 (lifecycle)에 걸쳐 사용되고 있다.
(3) 연속식 공정(Continuous Manufacturing) 기반 제약품 생산 공정
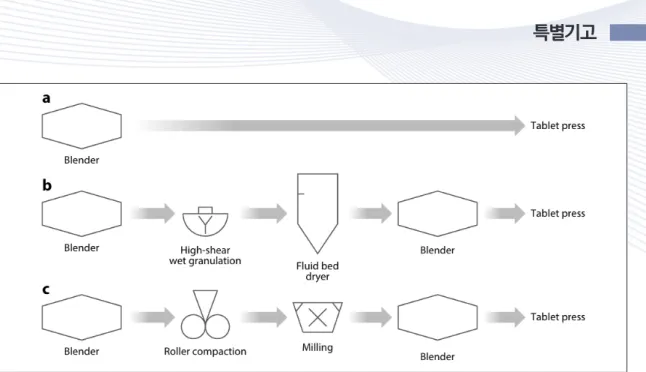
전통적으로 제약 공정은 회분식 공정에 의해 생 산 진행되었다. 회분식 공정으로 진행할 경우 공정 을 세밀하게 제어할 수 있다는 장점을 가지고 있는 반면에 생산량을 증가시키는데 한계를 가지게 된 다. 따라서 전체 공급 사슬 관리 효율도 장점이 적 어, 비용 측면에서 비효율적이다. Figure 4는 회분 식 공정 기반 공정의 바이오제약공정의 개략도를
보여준다.
그런데 의약품 제조 공정을 연속식으로 구성할 수 있다면 이러한 단점들을 극복할 수 있게 된다.
회분식보다 훨씬 대량으로 제품을 생산할 수 있게 된다. 제약 생산공정을 연속식으로 구축할 때 많은 장점을 가지고 있다. Figure 5는 연속식 공정 기반 바이오 제약 생산 공정의 개략도를 보여준다.
회분식 공정이란, 한 사이클 안에서 해당 공정에 포함되는 모든 작업들이 일어나는 방식으로, 소량 생산에 유리하며 비교적 간단한 장치로 쉽게 운전 할 수 있다는 특성을 가지고 있기 때문에 현재 많은 바이오 / 바이오 제약 공정이 이 방식으로 일어나 고 있다(Figure 4 참조). 이와 다르게 연속식 공정은 제품을 연속적으로 생산하는 방식으로, 대량 생산 에 유리하며 공정에서의 물류 관리(flow profiling)가 비교적 쉽다는 장점이 있다. 하지만, 바이오/바이오 제약 공정의 경우 연속공정으로 운전하기 힘든 경 우가 대부분인데, 1) 운전에 사용하는 원료가 생물 혹은 생물에서 유래된 단백질류의 물질이기 때문에 장시간 연속으로 운전하기가 어렵고, 2) 공정의 특 정 부분들에 사용되는 장치들이 회분식인 경우가 많기 때문이다. 예를 들어 생산된 단백질을 분리하
는 공정은 크로마토그래피를 활용하는 경우가 많은 데, 이때 단백질 흡착을 위한 수지들을 계속해서 교 환-재생하는 과정이 필요하다.
회분식 공정의 특성상 반응기를 세척하거나 사 용된 수지를 재생하는 과정이 반드시 포함되는데, 이 과정에서 많은 폐수나 폐기물들이 발생하여 환 경에 많은 부담을 주게 되고, 정책적으로 환경을 보 호하려는 움직임이 점점 더 활발해졌기 때문이다.
때문에 많은 바이오/바이오 제약 회사들이 공정의 효율화뿐만 아니라 환경 보호를 위한 정책적인 움 직임에 대응하여 ‘회분식 공정의 연속 공정화’에 많 은 관심과 투자를 쏟고 있다고 한다.
회분식 구조로 운전이 되면 관리가 쉽고 조업이 간단하며 제품의 양 등을 조절하기 용이하지만 회 분식반응기 내부의 유동이 항상 동일하지 않고 온 도 분포가 변하기 때문에 균일한 성질의 결정이 나 오지 않을 가능성이 있고 시간 또한 중요한 변수가 되므로 제약조건이 늘어나는 단점이 있다. 반면에 슬러그 기반 연속 공정은 단일 슬러그 내부의 같은 성질의 결정이 생성되는 경향이 있고 한번 운전을 시작하면 멈출 때까지 반응기 내부의 성질이 변하 지 않으므로 나오는 생성물의 질과 양이 동일하다.
Figure 4. An Illustration of batch drug product manufacturing: (a)direct compression, (b) wet granulation, (c) roller compaction.
Arrows represent batch transfers between unit operations
이는 대규모 생산에 꼭 필요한 개념이며 이와 관련 된 기술을 완벽하게 이해한다면, 경쟁사들에 비해 서 원가를 더 절감 할 수 있을 것으로 보인다. 또한 이 때 이 공정을 제어하는 제어시스템 또한 필수이 다. 제어시스템으로는 MPC(model predictive control) 등이 있지만, 어떤 제어시스템을 사용하더라도 연 속 공정에서 일어나는 각종 돌발상황들에 대응하여 같은 상태로 장치를 유지시켜주는 것이 필수이다.
이러한 환경은 외부 온도 혹은 습도에 의해서 주로 영향을 받는데 이것에 대한 연구나 제어는 계속 개 발되어야 한다.
연속식 공정으로 전환시키는 것을 대부분의 제 약 산업체들에서 공통적으로 바라고 있다. 하지만 연속식 공정들로 제약 산업 공정을 구축하는 것은 많은 이슈들을 해결해야 한다. 연속 공정으로 진행 될 경우 실시간으로 진행 중인 공정에 대한 조절 변 수들을 조정 값(setting)들도 지속적으로 업데이트 되어야 한다. 그렇지 못할 경우 나쁜 품질의 제품 이 일부 생산될 수도 있다. 실시간 운영에 대한 품
질 관리나 이를 위한 기술적 문제점 해결은 제약 산 업의 강한 규제(regulation)를 감안할 때 매우 도전 적 문제이다. 연속식으로 공정을 구성하기 위해서 는 여러가지의 단위 조업들이 통합되어야 한다. 물 질의 입력과 출력 흐름이 동시에 측정되고, 처리되 어야 하는데, 이는 원료 물질이 투입과 최종 제품의 완료가 동시에 진행되어야 하는 것을 말한다. 하지 만 통합화된 연속식 제약 공정은 업계, 학계, 규제 기관들 모두의 공통된 관심사라고 할 수 있다.
2016년에는 FDA가 최초로 HIV-1 infection 치료 제 Prezista (darunavir)의 생산공정을 회분식에서 연 속식으로 변경을 승인했다. FDA와 같은 규제 기관 도 연속식 공정으로의 전환을 인정하고 있다고 말 할 수 있다. 기존 회분식 합성 공정에서 21가지의 조 업(operations)에 약 300 시간이 걸리는 것을 14 가지 조업에 약 47 시간 만에 생산할 수 있다고 한다. 24 시간에 1000개의 pills를 생산하는 속도이다. Figure 5는 회분식과 비교한 연속식 공정의 진행 과정의 공 정 시간을 비교하였다.
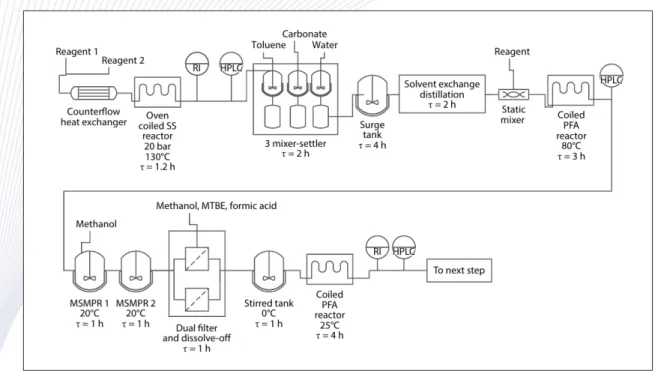
Figure 5. An Illustration of continuous flow scheme for the production of prexasertib monolactate monohydrate11.
2013년에는 고혈압치료제인 aliskiren hemifumarate 를 성공적으로 연속 제약 공정을 통해 생산하고 있 다. 2016년 Science에 발표된 논문에서 몇가지 경구 용 및 국부용 액체 의약품을 수백에서 수 천개까지 냉장고 크기(1미터*0.7미터*1.8미터(폭,길이, 높이)) 의 연속식 공정에서 생산하는 사례가 발표되어 실 시간으로 복잡한 다단계 생산 공정을 반영하면서 제품을 생산하는 전면적인 연속식 공정 합성 개발 에 대한 기대를 가질 수 있게 되었다. 현재 제약 산 업 중 대략 5% 정도가 연속식 공정에 의해 생산되고 있다는 보고도 있다.
한편 흥미로운 사실은 연속식 공정은 단순히 기 존 회분식 공정보다 생산량을 증가시키기 위한 것 이 아니다. 소량 제조 공정에 대해서도 연속식 공정 으로 구현하는 것도 관심을 갖고 연구되고 있다.
(4) 동결 건조(Particulate and Crystallization) 연속 제약 공정 중에 가장 에너지를 많이 필 요로 하는 부분은 약제 활성 물질 (API, Active Pharmaceutical Ingredient)을 용매에 녹인 상태에서 실제로 몸에 흡수시키기 위한 약제로 제조할 때 필 요한 건조(dryer) 공정이라고 할 수 있다. 일반적으 로는 건조는 다양한 방식으로 진행될 수 있는데, 열 에너지를 가하여 용매(solvent)는 증발시키고 약제의 순수한 성분만 남게 하는 방식을 취하는 것이 일반
적이다. 의약품 제조 공정들이 기존의 석유 화학이 나 정밀 화학 공정과 가장 차별화되는 것이 최종 제 품이 고체(알약, 타블렛)로 되는 동결 공정이다. 동 결 단계는 핵 생성과 결정 성장 동역학(crystal growth kinetics)가 형성된 결정의 크기와 개수의 분포를 결 정하기 때문에 의약품의 동결 건조(freeze drying step) 중에서 특히 중요하다. 의약품 중에 가장 중요한 API 는 열에 민감하기 때문에, 손상을 주지 않기 위해서 동결 건조 공정이 저온에서 진행된다.
결정화 반응으로 생성된 단백질 결정의 경우, 그 안정성이 급속냉각하여 보관된 단백질보다 높아서, 부가가치가 높은 단백질의 운반에 활용될 수 있다.
결정화 공정은 반응의 복잡성과 완벽한 조절이 요 구되기 때문에 기술적 진입장벽이 높으며, 높은 가 치를 가지고 있다. 미국에서는 이러한 중요성 때문 에 결정화 공정에 대한 관심이 매우 지대하며 미래 산업의 중요한 분야로 인식되고 있다. 결정 반응 공 정 뿐만 아니라, 결정의 성질을 조절하고 반응식에 대한 연구 또한 공정과 별개로 활발하게 진행되고, 여러 기관들의 협동 프로젝트를 진행한다고 한다.
결정화 모델은 결정 핵의 생성 그리고 성장 이렇 게 두 가지로 나누어 설명할 수 있다. 결정 핵의 생 성은 불확실성 위에서 일어나는 반응으로 그 반응 의 확률이 아직 정확히 정해지지 않았다. 그렇기에 이론적으로 구한 값과 실제로 구한 값의 차이가 존
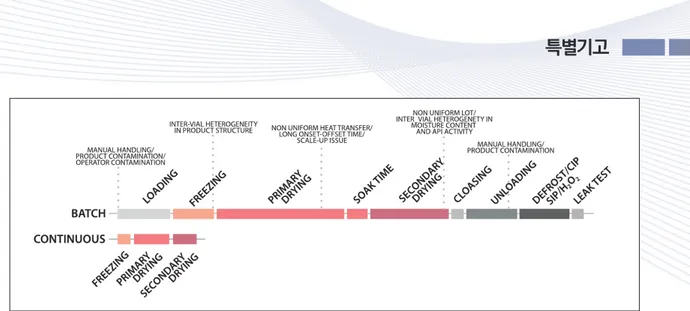
Figure 6. An illustration of timeline for the batch and continuous lyophilization strategies12
재할 수 밖에 없지만 그 존재하는 정도는 추후에 어 느정도 몇 가지 계수를 변경함으로써 실제 모델에 유사하게 만들 수 있다. 실제 산업체에서는 각각 다 른 단백질 혹은 용질에 대해서 실험으로 구한 계수 들을 사용하고 있다고 한다.
4. 바이오 의약 공정 관련 공정시스템공학 연구 개발 활동
공정 시스템 공학(Process Systems Engineering, PSE) 이라는 용어는 1982년 교토에서 열린 Process Systems Engineering Conference 에서 처음으로 사 용되기 시작되었다. PSE 분야는 지속적으로 발전, 확대하여, 특히 석유 화학, 정밀 화학 산업 등 실제
산업과 연계되어, 산업 발전에 기여해 오고 있다.
Figure 6은 화학 산업의 주요 응용 분야들에 대한 차 이점과 공통점들을 정리하여 도식화 하였다.
(1) 제약 산업의 발전에 PSE 역할
PSE분야에서 제약 공정에 대해서도 많은 관심 을 가지고 관련 연구들이 체계적으로 진행되어 오 고 있다. 우선 제약 산업의 특성과 PSE에서 관련 연 구동향들에 대해 여러 총설(review) 논문들이 발표 되어 Marques et al.(2020), Yang et al.(2020), Chen et al.(2020), Yang et al.(2019), Ierapetritou et al.(2016), Reklaitis(2017) 등 10여편에 다다르고 있다.
PSE 분야에서 제약 제품 공정은 여러 연구들
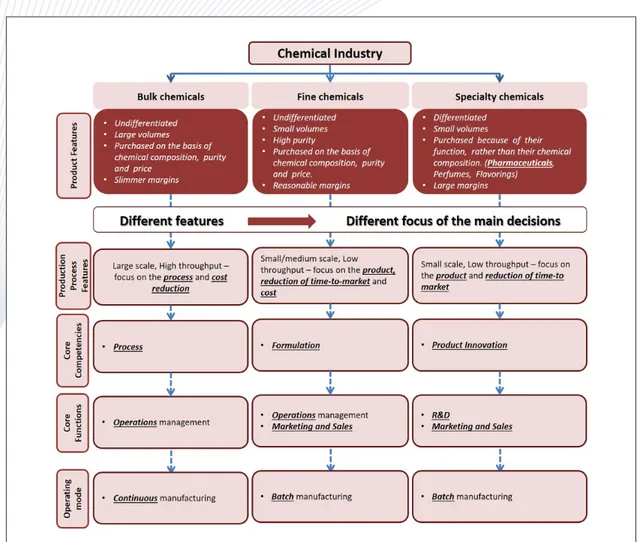
Figure 7. Key differences between the three main classes of the chemical industry13.
고 있으며, 대규모 제약 회사들의 주요 무대가 미국 이기 때문이라고 판단된다.
다양한 의약품 생산공정에 대한 PSE의 관련 연 구들이 있었지만, 가장 주목할 만한 것은 연속식 공 정을 구축하기 위해 관련된 연구들로 구분 지을 수 있다. 우선 제약 공정의 연속식 제약 공정의 구축 에 대한 모델링 연구들이다. 두번째로 제어 공정에 대한 연구이다. 회분식 공정에서 연속식 공정으로 변환하기 위해서는 많은 연구 개발이 필요하다. 연 속 공정에 대해서도 규제에 대응하기 위해서는 중 간 생성물에 대해 품질을 검증 할 수 있어야 하며, 이를 위해 실시간 품질 관리 및 제어에 대해서도 PSE 분야에서 활발히 활동하였다.
해외의 제약 산업의 연속식 공정에 대한 연구 개 발을 공정시스템공학 측면에서 분석하면 다음과 같 다. 연구 분야 측면에서 MIT에서 제어 관련 연구에 서부터 시작하여 제약 공정을 연속 공정으로 전환 하는데 기존 회분식 공정의 사용 후 품질 모니터링 에 대해 직접적 관심을 가졌다. 생산에 있어 제약 생산에 핵심인 규제 준수에 있어 PAT를 준수하면 서 생산량을 극대화할 수 있는 부분에 대해 주로 관 심을 가져왔다. 이를 위해 연속식 공정을 구축해야 하는데, 제약 공정을 진행하는데 최종 제품의 상태 가 고체이기 때문에 액체와 기체를 통한 공정 진행 물들을 건조시켜 상태를 고체로 변화시키는데 필요 한 연구들이 제시되었다. 전체 공정으로 연속 공정 으로 만들기 위해 스케일 확장을 위한 파일롯 플랜 트를 구축하는데 관련된 연구들도 발표되었다. 신
시키려는 노력들도 가시화되고 있다.
미국의 경우 MIT 대학과 제약 기업인 Novartis 가 2009년부터 5년여에 걸쳐 제약산업의 연속 공 정 전환을 위한 공동 연구 센터를 개설하여 이에 대해 집중 연구하였다. 영국의 경우 University of Strathclyde, Cambridge, Imperial College London 등 의 대학들과 GSK, AstraZeneca, Novartis, Pfizer 등의 기업들이 EPSRC(Engineering and Physical Sciences Research Council)이 연계한 Centre in Continuous Manufacturing & Crystallization (CMAC)을 구축하여 제약산업의 선진화에 대해 노력해오고 있다. 덴마 크의 경우 Technical University of Denmark 를 중심 으로 Krist V. Gernaey 교수 연구진들이 활발한 연구 를 해왔다.
Engineering Research Center for Structured Organic Particulate Systems (C-SOPS, United States)14 Synthesis and Solid State Pharmaceutical Centre (SSPC, Ireland)15, the Continuous Manufacturing and Advanced Crystallization Hub (CMAC, UK)16, the Research Center for Pharmaceutical Engineering (RCPE, Austria)17, the Enabling Technology Consortium (members from the United States, European Union, and Asia) 와 같은 협력 기관을 구 성하여 제약 산업의 발전을 위한 공동 연구 및 개발 을 진행하고 있다.
(2) 제약산업의 디지털 변환 - Pharma 4.0 기반 최근 4차 산업혁명과 관련하여 PSE는 독일의 인
더스트리 4.0 및 스마트 제조(smart manufacturing) 에 대해서도 활발한 활동을 하고 있다. 이와 관련 하여 PSE 관련 가장 저명한 저널인 Computers &
Chemical Engineering의 Editor들이 공동으로 발표한 논문에서 스마트 제조에 대한 PSE분야의 역할에 대 해 정리하였다(Figure 7 참조)
4차 산업혁명을 활용하여 제조업 부흥을 위한 산 업 정책을 각 국가들은 펼치고 있는데 독일 인더스 트리 4.0, 일본 채응전략, 중국 제조 2025, 우리 나라 제조업 혁신 3.0가 대표적인 사례이다. 발달된 IT 기 술을 전통적인 제조업의 설비와 업무 체계에 적용 하여 관련 데이터들을 디지털화하고 체계적으로 관 리하여 생산의 효율화, 유연화, 고부가가치화를 목 표로 한다. 이를 제4차 산업혁명이라 불리고 있다.
2012년 독일 정부의 핵심 미래 프로젝트로 도입
된 인더스트리 4.0(Industry 4.0)은 제조업의 경쟁력 강화를 위해 사이버 물리 시스템, 사물인터넷, 클라 우드 컴퓨팅 등을 적용해 결과적으로는 스마트팩토 리(smart factory, 또는 지능형 공장)를 구축하는 것 을 목표로 한다. 즉, 스마트팩토리는 제품의 생산과 정에 있어서 어느 한 부분만이 아닌 전 과정이 연결 돼 상호 커뮤니케이션이 자동으로 이루어지는 공장 을 뜻한다.
인더스트리 4.0이 실현되면 제품의 기획, 제조, 유통 등 전 과정이 통합된다. 에너지 절감과 안전한 생산 환경이 구현되면서 경제적인 측면에서의 효 율성이 높아지는 것뿐만 아니라, 유연한 생산 체계 가 구축되며 생산성 역시 향상할 수 있다. 대량생산 뿐만 아니라, 개별 소량 맞춤형 제품까지 처리할 수 있으며 불량품의 확률을 현저히 줄일 수도 있다. 비
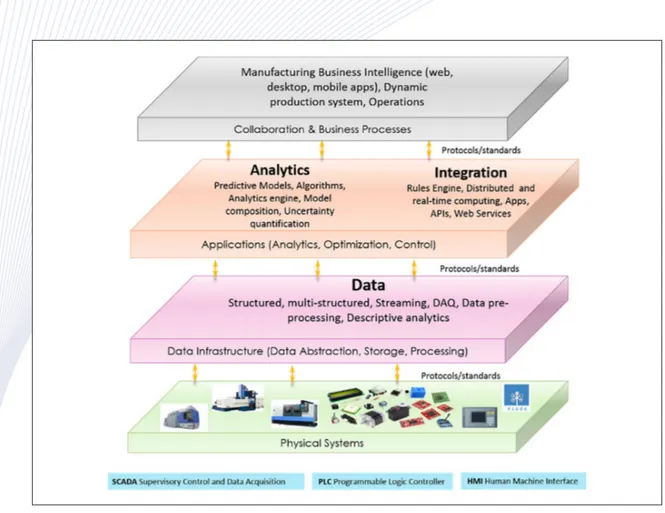
Figure 8. Computer-aided framework for smart manufacturing.18
용의 단축을 통해 바이오 제약 산업의 경쟁력을 향 상시킬 것으로 기대하고 있다. Figure 8은 바이오 제 약산업의 디지털 변환에 대한 연관성과 효과를 정 리하여 보여주고 있다.
제약산업은 제조 기술 측면에서 기존 다른 정밀 화학, 석유 화학 등 산업과 달리 혁신적인 기술을 도입하여 가시적 결과를 얻기가 어려운 측면이 있 는데 이는 의약 제조 공정이 강력한 규제를 우선적 으로 대응해야 하기 때문이다. 따라서 PSE 연구자 들이 제약 산업에 기여할 수 있는 가능성이 크다.
바이오 제약 산업이 발전하면서 여러가지 장비 들이 사용되어야 하며, 이들 장비들은 더욱 고도 화, 정밀화될 수 밖에 없다. 따라서 많은 IT 장비들 도 의약 장비 뿐만 아니라 사용되어야 한다. 바이오
5. 국내 바이오 제약산업 현황
한국 제약산업은 시장규모는 23조 1,175억원 (2018년 기준)으로, 약 1,455조원으로 추정되는 전세 계 의약품 시장에서 약 3%를 차지하고 있다. 국내 전체 경제 측면에서 의약품 시장의 비중은 국내총 생산의 1.3%, 제조업 국내총생산의 4.6%를 차지하 고 있다21. 우리나라 제약 산업은 2000년대 중반 이 후 GMP 선진화 프로젝트에 따라 미국 등 선진 의약 업계에서 요구하는 cGMP 수준의 생산기반 구축을 준비하였다. 식품의약품안전처의 의약품 실사상호 협력기구(PIC/S) 가입(2014년), 국제 의약품규제조 화위원회(ICH) 정회원 가입(2016년), 식품의약품안 전처 EU 화이트리스트에 등재(2019년) 등의 활동을 통해 미국, EU, 일본 등 제약 산업 선진국들과 의약
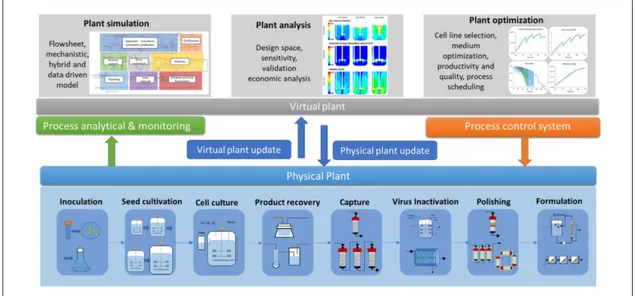
Figure 9. Biopharma process, benefits, and digital twin connections.20
품 규제 수준을 검증 받고, 국제 의약품 규제 정책 주도국에 참여하게 되었다고 한다.
제약산업은 타 산업 대비 R&D 투자비 비중이 매 우 높은 기술집약적 산업으로서 국내 제약사업계도 신약개발 투자를 지속적으로 확대하고 있다. 2018 년 제약기업들의 매출액 대비 연구개발비중은 약 6.4%이다 (상장제약사 9.1%, 연구개발 주도 혁신 형 제약기업 11.5%). 우리나라 관련기업 들은 CMO 와 바이오시밀러에 집중하고 있다. 바이오 시밀러 란 바이오 의약품의 복제약이며, 오리지널 바이오 의약품과 동일한 효과를 가지고 있지만, 더 낮은 가 격에 공급한다는 장점이 있다. CMO는 의탁사에 공 정 정보를 주어 타업체에 생산을 의뢰하는 위탁 생 산 방식을 말하는데 국내 대표 기업으로 셀트리온 이 있다. 위탁사는 생산을 위한 비용을 절감하고, CMO 업체는 약의 매출 이익 일부를 나눠 가질 수 있어 시장 가치가 높다고 할 수 있다. 우리나라 제약 R&D 투자 또한 위탁 생산 체제, 비이오 시밀러 생 산에 집중하고 있다.
최근 코로나 사태의 원천적 해결을 위해 국가적 으로 백신 사업을 육성하려고 하는 것은 제약산업 에 매우 좋은 기회이다. 정부는 백신 투 트랙(two track) 전략을 통해 백신을 국내에서 대량으로 위탁 생산하며 당장의 수급을 안정화하면서 이 기술을 자체 개발해 코로나19의 장기화에 대비하겠다는 정 책 방침을 준비하고 있다. 아스트라제네카, 노바백 스, 스푸트니크 백신에 이어 모더나 백신까지 국내 위탁 생산을 준비하고 한다. 이렇듯 백신의 생산 허 브가 된다는 것은 국내 제약 공정 기술 자체가 상당 히 높은 수준으로 구축되었다는 것을 의미한다. 하 지만, 국내의 경우 해외에서의 활발한 회분식에서 연속식으로의 전환과 관련하여 가시적 활동을 보이 고 있지는 않은 것으로 알려져 있다. 즉 국내 제약 산업이 기존 대량 생산 산업 기술 분야는 어느 정도 기술 축적이 되어 있지만, 향후 세계 선두 기업의 연구 개발 수준까지는 개발되지 못했다고 말 할 수 있다.
국내 산업의 공통적 현상인 주 52시간으로 근로 시간에 대한 규정이 강조되는 등 의 경제 산업 변화 는 제약산업에도 직접적으로 연결된다. 즉 비용 절감 과 함께 생산성 향상까지 기대할 수 있는 스마트 공 정 기술이 바이오 의약품 산업에도 도입될 것이다.
현재 국내 제약사들은 세계 주요 경쟁회사들의 4 차 산업혁명 발전 기술을 적용하고 있는 만큼 스마 트(smart)하지는 못하고 있다. 다국적 제약사들처 럼 제조과정의 생산성을 높일 수 있는 ‘스마트 제약 (pharma 4.0)’을 구축해야 한다. 여기서, ‘스마트 제 약 혹은 Pharma 4.0’의 구축을 위해서는 많은 노력 들이 물론 필요하다. 우선적으로 생산 운영 시스템 의 효율화와 연속식 생산(continuous manufacturing) 공정을 구축하는 것이 중요하다고 할 수 있다. 이에 대해 PSE는 석유/정밀 화학에서의 적용 경험, 반도 체 산업 등 정밀 공정에서의 적용 경험들을 가지고 있어서 향후 큰 역할을 수행할 수 있을 것이다.
6. 국내 제약 산업의 발전을 위한 PSE의 역할
국가적으로 제약 산업을 미래 먹거리 산업으로 육 성하려는 전략을 가지고 있다. 제약산업에서 새로운 신약개발 투자도 중요하지만, 생산 경쟁력 확보하는 것은 그 전략을 실현할 수 있는 중요한 방안 중의 하 나라고 할 수 있다. 분야 지식(domain knowledge, 정 의역 지식)도 중요하지만, 이를 산업화 할 수 있는 PSE지식 또한 중요하다. 바이오 의약품 제조 산업 의 발전은 단순히 바이오 의약 과학 기술에 의한 신규 의약품 개발만으로 달성할 수는 없기 때문이 다. 정밀 기계, 고순도 원료, 장비 전산화 및 자동화 등 다양한 기술들의 통합하고, 관련 인력의 교육과 양성 등 종합적 노력이 필요하다. PSE를 포함한 화 학공학이 여기서 많은 기여를 할 수 있으리라 예상 된다.
최근 반도체 산업의 경우 반도체 개발뿐 만이 아 니라, 다양한 종류의 반도체 생산만 전문적으로 하 는 파운드리 반도체 기업들이 주목받고 있다. 반도 체 생산 공정의 성능 향상이 반도체 신제품 개발과
는 것을 말한다. 바이오 의학, 생명 공학적 기술들의 사업화를 위해 PSE 분야의 협력이 필요하다.
연속식 제약 공정으로의 전환은 전세계 제약산 업의 중요한 화두가 되고 있고, 이 전환에서 PSE의 역할은 더욱 크게 될 수 있을 것이다. 우리 나라 바 이오 제약 회사들 또한 CMO 시장에서 성장세를 보 이며, 바이오시밀러 분야에 집중하면서 급속도로 성장하고 있어 K-bio로 명칭을 불리고 있다.
저자들이 아는 범위 내에서 국내 PSE 학계에서 의약품 생산공정의 연속식 공정으로의 전환과 관 련된 연구들은 거의 황무지인 상황에서, 산업부의 지원으로 서울대학교의 EDRC(엔지니어링개발연 구센터) 사업의 일환으로 유수해외기관파견 프로 그램(2014~2018년) 및 산업혁신인재양성사업(해외 연계: 산업부 지원, KIAT 전담, 연세대학교 주관:
2019~2023)을 통해 MIT와 Harvard 대학에 대학원생 들이 파견 연구를 했던 것이 유일하다. 그 프로그램 에서는 우수 대학원 학생들을 해외의 유수 대학 및 기업에 파견하여 산업체 및 학계에서 체험할 수 있 는 좋은 기회였다. 특히 해외 우수 연구개발 기관에 서 의약품 산업의 연속식 공정 전환과 공정시스템 공학기술의 바이오 메디컬 엔지니어링에 활용 등 산학 연구를 국내 학계에 소개할 수 있는 기회가 되 었다. 이제 중요한 것은 이러한 경험을 소중한 경험 을 얻었다. 이들의 경험을 우리 나라 현실에 맞게 구현할 수 있게 하기 위한 실질적 후속 대책이 필요 할 것이다. PSE 연구자들의 바이오 의약산업에 대 한 이해와 의약산업과 PSE 연구개발 민·관·학의
본 논문에서는 의약품 제조 산업과 관련된 PSE 관련 연구들에 대해 살펴보았다. 제약 산업에서 생 산 효율 증가를 주목하게 되면, PSE의 역할은 더욱 증가할 것이다. 제약 산업의 발전은 연속식 제약 공 정의 구축과 이를 위한 발달하는 4차 산업의 여러 IT 기술의 발전을 이용한 Pharma 4.0으로 구현될 것 이다.
최근 코로나 사태의 원천적 해결을 위해 국가적 으로 백신 사업과 관련하여 정부는 백신 Two Track 전략을 통해, 백신을 국내에서 대량으로 위탁 생산 하며 당장의 수급을 안정화하면서 이 기술을 자체 개발해 코로나19의 장기화에 대비하겠다는 정책을 준비하고 있다. 아스트라제네카, 노바백스, 스푸트 니크 백신에 이어 모더나 백신까지 국내 위탁 생산 을 시작한다고 한다. 백신의 생산 허브가 되기 위 해서는 신제품을 개발하는 것도 중요하며, 그 제품 을 수요에 적기에 대응할 수 있는 기술도 중요하다 고 할 것이다. 여러가지 기술들이 서로 조화를 이룰 때 최대의 효과를 얻을 수 있을 것이다. 인류 전체 의 생존을 위해서는 단지 전염병에 대한 의학 기술 만으로 해결할 수 없다.
COVID-19과 같은 질병은 인류에게 새로운 도 전이 되었다. 그 도전에 대한 응전의 방안으로 백신 개발과 보급은 인류 생존 자체의 문제가 되었다. 이 렇듯 중요한 제약 산업의 발전을 위하여 공정 시스 템 공학, 화학공학 등 다양한 학문 분야들의 복합적 참여가 필요하다.
한편 경제가 발전하고 다원화하면서 화학공학에
서 다룰 수 있는 분야들도 확장하고 있다. 기존 석 유화학 중심의 교육 및 연구 분야가 에너지, 반도 체, 정밀화학, 생명공학, 나노, 환경 등 확대되고 다 원 화되어 가고 있다. 이러한 다원화되어 가는 경제 산업 환경 변화에 대응할 수 있도록 화학공학의 교 육 또한 달라져야 할 것이다. 다양한 분야들에서 공 통적인 분야에 대한 교육과, 변화에 대응할 수 있는 융통성, 신기술 분야에 대응할 수 있는 기반 지식들 을 교육해야 할 것이다. 대학과 산업의 연계된 산학 연구 개발도 더욱더 다양화될 필요가 있다.
참고문헌
1) 약사법 제2조 제4호
2) 제약산업 분석보고서, 한국보건산업진흥원, 2017, 5쪽 3) 한국제약바이오협회, kpbma.or.kr
4) 매출액 기준, IMS Health Market Prognosis, March 2010 5) 출처: J. Rantanen, J. Khinast, The Future of Pharma-
ceutical Manufacturing Sciences, Journal of Pharma- ceutical Sciences, Volume 104, Issue 11, 2015, Pages 3612-3638
6) 출처: Kontoravdi, C., N. J. Samsatli and N. Shah Devel- opment and design of bio-pharmaceutical processes, , Current Opinion in Chemical Engineering, 2013, 2, 435- 441.
7) 한국수출입은행 : 세계의약품산업 및 국내 산업 경쟁력 현 황 2017.8
8) EvaluatePharma World Preview 2019, Outlook 2014 9) C. J. Testa, C. Hu, K. Shvedova, W. Wu, R. Sayin, F.
Casati, B. S. Halkude, P. Hermant, D. E. Shen, A. Ram- nath, Q. Su, S. C. B., Bayan, S. Chattopadhyay, T. F. O’
Connor, X. Yang, S. Ramanujam, and S. Mascia, Design and Commercialization of an End-to-End Continuous Pharmaceutical Production Process: A Pilot Plant Case
Study, Org. Process Res. Dev. 2020, 24, 12, 2874–
2889
10) 우영아, 김종윤, 박용준, 연제원, 송규석, 김효진, 공정분석 기술: 제약산업에서의 기술개발 사례 및 현황 Analytical Science & Technology, Vol. 22, No. 1, 35-43, 2009 11) Burcham, C. L., A. J. Florence, and M. D. Johnson,
Continuous Manufacturing in Pharmaceutical Process Development and Manufacturing, Annual Review of Chemical and Biomolecular Engineering, Vol. 9:253- 281 (2018) HPLC, high performance liquid chroma- tography, MSMPR, mixed suspension, mixed product removal; mTBE, methyl tert-butylether; PFA, perfluor- alkoxy alkane; RI, refractive index; SS, stainless steel.
12) Capozzi, B. L. Trout, and R. Pisano, From Batch to Continuous: Freeze-Drying of Suspended Vials for Pharmaceuticals in Unit-Doses, L.C. Industrial &Engi- neering Chemistry Research, 58, 1635-1649
13) Marques, C. M., S. Moniz, J. P. de Sousa, A. P. Barbo- sa-Povoa, G. Reklaitis, Decision-support challenges in the chemical-pharmaceutical industry: Findings and future research directions, Computers & Chemical En- gineering, Volume 134, 4 March 2020, 106672 14) (http://erc-assoc.org/content/erc-structured-or-
ganic-particulate-systems), 15) (http://www.sspc.ie/) 16) (https://www. cmac.ac.uk/) 17) (http:// www.rcpe.at/en/about-us/)
18) E. N. Pistikopoulos, A. Barbosa-Povoa, J. H. Lee, R.
Misener, A. Mitsos, G. V. Reklaitis, V. Venkatasubra- maniang, F. You, R. Gani, Process systems engineer- ing – The generation next? Computers & Chemical Engineering, Volume 147, April 2021, 107252
19) https://ispe.org/initiatives/pharma-4.0
20) Y. Chem, O. Yang, C. Sampat, P.Bhalode, R. Ram- achandran, and M. Ierapetritou, Digital Twins in Phar- maceutical and Biopharmaceutical Manufacturing: A Literature Review, Processes, 2020, 8, 1088
21) 한국 제약바이오협회, https://www.kpbma.or.kr/