87 서 론
생식세포의 분화는 독성물질에 의해 쉽게 영향을 받을 수 있으며, 면역체계에서 발생한 단백질이 생식세포에게 외부 항원으로 인식될 수 있기 때문에 이들 독성물질과 단 백질로부터 보호받아야 한다. 혈고환장벽은 이들 독성물질 이나 단백질로부터 보호막의 역할을 하나, 항암요법의 경 우 오히려 걸림돌로 작용할 수 있다.1 소아의 급성 림프구성 백혈병에서 항암요법을 한 경우, 고환에서의 재발률이 17%
에까지 이르며 이는 혈뇌장벽에 의해 보호되는 중추신경계
에서의 재발률과 비슷하게 높다.2,3 성인에서 주로 생기는 중추신경계와 고환 림프종의 경우에도 항암요법을 한 경우 치료실패가 많으며 완전 관해 후에도 40-50%에서 재발한 다.4,5 이와 같이 혈고환장벽과 혈뇌장벽은 서로 유사한 점 을 많이 가지고 있다.
최근 들어 뇌 질환 (특히 종양)에서 약물치료 효과를 증 강시키기 위한 혈뇌장벽 개방에 관한 연구들이 진행되고 있다.6,7 고농도 만니톨을 내경동맥으로 주입한 경우 삼투압 차이로 인해 혈관내피세포가 수축되고, 이로 인해 혈뇌장 벽이 약 2시간 정도 일시적으로 열려 항암치료의 효과를 높일 수 있다.6 트리올레인 유상액을 이용한 경우에는 지방
Temporary Opening of the Testis-blood Barrier by Triolein Fat Emulsion
Sang Don Lee, Wan Lee, Hack Jin Kim1
From the Departments of Urology, 1Radiology, College of Medicine, Pusan National University, Busan, Korea
Purpose: Although the purpose of the blood-testis barrier (BTB) is to protect germ cells from harmful influences, it also impedes the delivery of chemotherapeutic agents to the testis. This study was undertaken to determine whether a triolein emulsion could transiently alter the perme- ability of the BTB in cats.
Materials and Methods: An emulsion of 0.05ml triolein in 20ml of saline or just 20ml of normal saline, as the control, were infused into the testicular arteries in 18 and 15 cats, respectively (embolic and control group). Pre- and post-contrast magnetic resonance images (MRIs) were obtained 30 minutes and 2 hours after embolization. Qualitative and quantitative analyses of the MRIs were performed via the presence and degree of contrast enhancement and the contrast enhancement ratios (CERs), respec- tively. An electron microscopy (EM) study was subsequently performed, using a lanthanum tracer, to correlate with the MRI results.
Results: Contrast enhancement of the testis was observed in both groups and at both time points, but was more prominent in the embolic group.
The CERs in the embolic group were significantly higher than those in the control group (p=0.0001). In each group, the CERs at 2 hours were significantly lower than those at 30 minutes (p=0.006). In the EM study, the entry of lanthanum was markedly increased at 30 mins, but recovered at 2 hours after embolization compared to the control.
Conclusions: Intra-arterial infusion of triolein emulsion transiently in- creased the permeability of the BTB. This result may be useful in future studies for a chemotherapy delivery system to the testis. (Korean J Urol 2007;48:87-93)
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
Key Words: Testis blood barrier, Fats, Emulsions, Cats
대한비뇨기과학회지 제 48 권 제 1 호 2007
부산대학교 의과대학
비뇨기과학교실, 1영상의학교실
이상돈․이 완․김학진1
접수일자:2006년 8월 11일 채택일자:2006년 10월 2일
교신저자: 김학진
부산대학교 의과대학 영상의학교실
부산시 서구 아미동 1가 10 ꂕ 602-739
TEL: 051-240-7371 FAX: 051-247-5443 E-mail: hakjink@
pusan.ac.kr
이 논문은 2006년도 부산대학교 의학연구 소 연구비 (2006-00)에 의하여 연구되었 음.
으로 인해 혈관내피세포가 손상되어 혈뇌장벽이 1-3일까지 가역적으로 열릴 수 있어 항암치료 효과를 높일 수 있다.7 위에서 언급한 바와 같이 혈고환장벽은 혈뇌장벽과 서로 유사한 점을 많이 가지고 있다. 만일 뇌혈관장벽과 같이 혈 고환장벽을 일시적으로 개방시킬 수 있다면 고환종양에서 의 항암치료 효과를 증강시킬 수 있을 것으로 생각한다. 이 에 저자는 트리올레인 지방 유상액을 고양이의 고환 동맥 에 주입한 후 자기공명영상 및 전자현미경 검사를 이용하 여 혈고환장벽의 투과성 변화를 알아보고자 하였다.
대상 및 방법 1. 동물모델
체중 2.7-3.5kg (평균 3.2kg)의 건강한 잡종고양이 총 33마 리를 대상으로 실험을 하였다. 고양이들은 케타민 (ketamine HCl , 유한양행, 서울, 한국) 2.5mg/kg과 자일라진 (xylazine, 바이엘 코리아, 서울, 한국) 0.125mg/kg을 근육 내 주사하여 마취하였다. 실험테이블에 앙와위로 누인 후 사지를 고정 하였다. 우측 대퇴동맥을 찾아 18G 혈관주사용 바늘 (Insy- te; Becken Dickinson Vascular Access, Utah, USA)을 삽입 후 외피를 남기고, 그 안으로 3.0Fr. 미세도관 (Microferret-18 Infusion Catheter, William Cook Eroupe, Bjaeverskov, Den- mark)을 삽입하였다. 디지털 감산 혈관촬영기 (MultistarTop, Siemens, Erlangen, Germany) 하에서 양측 신동맥이 분지하 는 대동맥 위치에 미세도관의 끝을 위치시켰다. 조영제와 약물의 혈관 내 주사를 위해서 우측 대퇴정맥에도 동일한 방법으로 3.0Fr. 미세도관을 삽입하여 하대정맥에 위치시켰다.
실험을 위한 지방 유상액은 트리올레인 [1, 2, 3-tri (cis-9- octadecenoyl) glycerol, Sigma, St. Louis, USA] 0.05ml를 1ml 주사기에, 생리식염수 20ml를 20ml 주사기에 각각 채우고 3-way stopcock에 양측 주사기를 끼운 후 1ml 주사기를 왕복 으로 약 2분간 심하게 움직여 트리올레인과 생리식염수가 서로 섞이게 하여 만들었다. 상기 방법으로 만든 트리올레 인 유상액을 5분간에 걸쳐 미세도관으로 천천히 주입하여 고환 지방색전증을 유발하였고 이를 색전군 (18마리)으로 하였다. 대조군으로 15마리의 고양이를 동일한 방법으로 생리식염수 20ml만 5분간에 걸쳐 주입하였다.
혈고환장벽의 미세조직학적 변화를 비교하기 위하여 색 전군과 대조군에서 각각 3마리씩을 이용하여 전자현미경 검사를 추가로 시행하였다.
2. 자기공명영상 검사
자기공명영상은 색전 유발 후 30분과 2시간에 연속적으 로 시행하였다. 고양이는 앙와위로 고정된 그대로 자기공
명영상기기에 놓은 뒤 연성코일을 골반 주위에 설치하여 촬영하였다. 모든 검사는 1.5-T MR 기기 (Sonata, Siemens, Erlangen, Germany)를 사용하였고 영상은 축상면을 얻었다.
스핀에코기법의 T1강조영상을 조영제 주입 전과 후에 각각 얻었으며 이 때 사용한 영상기법의 변수는 TR/TE=320/20 ms, 절편두께 (section thickness) 4mm, 간격 (gap) 0.1mm, 영 상영역 70-75mm, 2회의 영상획득수, 획득행렬수 210x256으 로 설정하였다. 조영제는 0.2mmol/kg의 Gadobenate dime- glumine (Multihance, Bracco, Milan, Italy)을 사용하였다.
3. 자기공명영상의 정성 및 정량분석
조영제 주입 전의 T1 강조영상에 비해 조영제 주입 후의 T1 강조영상의 조영증강 정도를 시각적으로 정성분석하였 다. 또 대조군과 색전군에서 시간의 경과에 따른 조영증강 정도의 변화를 정량분석하기 위해 동일한 부위 고환의 조 영 전과 조영 후 30분과 2시간 각각 세 개의 연속영상에서
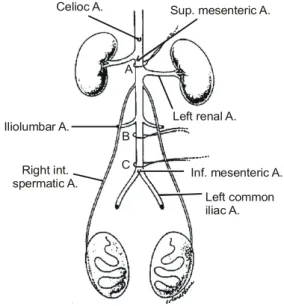
Fig. 1. Schematic drawing showing the abdominal aorta and its main branches. The right and left internal spermatic arteries originating immediately below the renal arteries. Three ligatures (A, B and C) are indicated. A cannula is inserted retrogradely into aorta between the two lower most ligatures, with the tip is pushed beyond the point of the middle ligature (B). During the perfusion procedure, the three ligatures were tied. Ligature A prevented the fixative from reaching the gastrointestinal tract and thorax; ligature B secured the cannula in the aorta, preventing fixative from reaching the iliac vessels and legs; ligature C secured the cannula in the aorta, preventing displacement. Only the portion of the aorta receiving fixative is a 2-3cm region between ligatures A and B;
the left renal artery, two internal spermatic (testicular artery) and lumbar vessels originate from this part of the aorta (from Forss- mann et al., 1977).
Celioc A. Sup. mesenteric A.
Iliolumbar A.
Right int.
spermatic A.
Left renal A.
Inf. mesenteric A.
Left common iliac A.
A
B C
조영증강비 [contrast-enhancement ratio=(signal intensity on postcontrast signal intensity on precontrast)/signal intensity on precontrast]를 측정하였다. 세 개의 연속영상에서 조영증강 비의 평균과 표준편차를 30분과 2시간, 그리고 대조군과 색 전군의 항목으로 비교분석하였다.
4. Lanthaum 비투과성 표식자를 이용한 전자현미경 검사
전자현미경 검사는 Sun과 Gondos,8 Forssmann 등9이 이용 한 방법을 변형하여 시행하였다. 실험방법을 간략히 설명 하면 Fig. 1과 같다. 복부대동맥, 상부 장간막 동맥, 하부 장 간막동맥을 노출시킨 후 신동맥과 상부 장간막동맥 사이, 하부 장간막동맥 직상부는 5.0 실크로 완전결찰하였다.
Polyethylene 관 (Intermedic P.E. 160)을 하부 장간막동맥 직 상부에 삽입하고 관의 끝은 요추동맥 상부까지 가도록 한 후 요추동맥 직하부의 복부대동맥을 완전결찰하였다. 우선 polyethylene 관을 통하여 린스용액 (NaCl 9g, polyvinyl pyr- rolidone 25g, heparin 0.25g, procaine-Hcl 5g, 증류수 1l, pH
7.35)을 분당 15ml의 속도로 5분간 고환조직 내를 세척하였 다. 그런 다음 고정용액 (0.2M monosodium phosphate 45ml, 0.2M disodium phosphate 405ml, 25% formaldehyde 60ml, polyvinyl pyrrolidone 25g, lanthanum 20gm, 증류수 1l, pH 7.35)으로 30분간 세척하였다.
고정용액 세척 직후 양측 고환을 제거하여 1mm cube의 전자현미경검사용 조직을 만들어 이들을 고정용액에 1시 간 담근 후 조직을 다시 1% OsO4 용액에서 2시간 동안 고정 시켰다. 그런 후 에탄올로 탈수화시키고 poly/Bed 812 resin (Polysciences, USA) 내에 밤 동안 두었다. 이들 조직을 1μm 두께로 잘라서 톨루이딘 블루로 염색을 하여 원하는 부위 를 전자현미경으로 보고 초미세절단기 (Leica, Vienna, Austria) 를 이용하여 다시 조직을 미세하게 절단하였다. 절단된 미 세조직을 uranyl actetate와 lead citrate로 염색하고 전자현미 경 (JEM 1200 EX-II: JEOL, Toyko, Japan)으로 검사하였다.
5. 통계분석
자기공명영상 분석에 대한 통계분석은 혼합선형모형
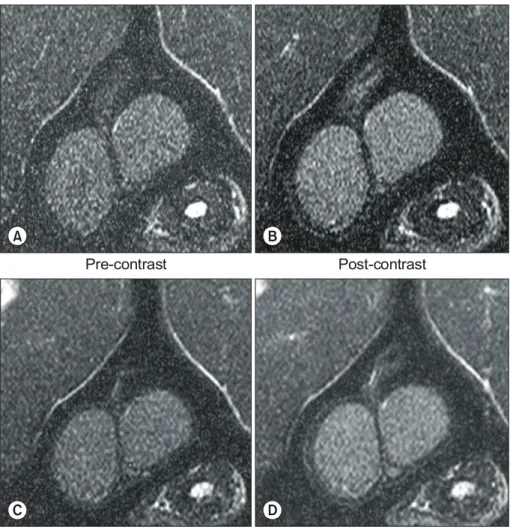
Fig. 2. T1-weighted MR images of the testis at 30 minutes (A and B) and 2 hours (C and D) (TR/TE=320/20) in the control group. At 30 minutes, the testes show mild and diffuse contrast enhancement compared to that of mus- cle (B). In comparison to the image obtained at 30 minutes (B), the testes show decreased contrast enhancement at 2 hours (D).
Pre-contrast Post-contrast
Pre-contrast Post-contrast
A B
C D
(linear mixed model)을 사용하였으며 p-value가 0.05 미만인 경우 유의한 것으로 판정하였다. 공분산행열 (covariance matrix)의 구조로는 모형의 적합도를 고려하여 가장 적절한 것을 선택하였다.
결 과 1. 자기공명영상의 정성 및 정량분석
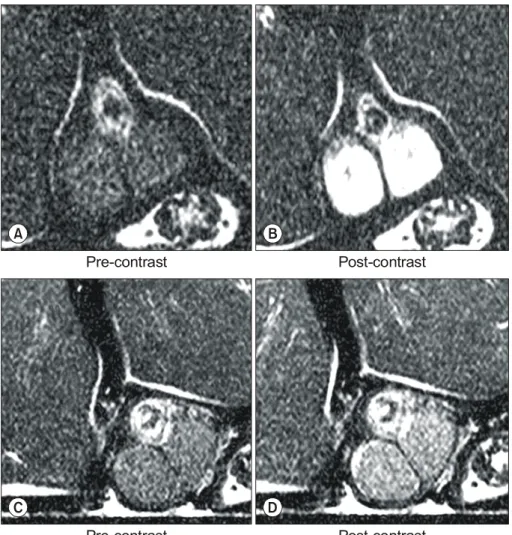
자기공명영상의 신호강도를 정성분석하면 조영제 주입 전의 T1 강조영상에서 고환의 신호강도는 주변 근육의 신 호강도와 유사하였다. 대조군에서 조영제 주입 후 30분과 2시간 영상에서 고환은 약간의 균일한 조영증강을 보였다 (Fig. 2). 색전군에서는 균일한 형태의 조영증강이 30분과 2 시간 영상에서 나타났고 대조군에 비해 조영증강의 정도가 더 현저하였다 (Fig. 3). 고환의 조영증강은 두 군 모두에서 30분에 비해 2시간 영상에서 감소되는 경향을 보였다.
자기공명영상의 신호강도를 정량분석하면 30분과 2시간 영상의 조영증강비는 색전군에서 0.6340 및 0.4213으로 대
Fig. 3. T1-weighted MR images of the testis at 30 minutes (A and B) and 2 hours (C and D) (TR/TE=320/20) in the embolic group. The testes show marked and homogenous enhancement at 30 minutes (B). In comparison to the image obtained at 30 minutes (B), the testes show decreased contrast enhance- ment at 2 hours (D).
Pre-contrast Post-contrast
Pre-contrast Post-contrast
A B
C D
Fig. 4. Plot of the contrast-enhancement ratio (CER) over time.
CERs of the embolic group (solid line) are significantly higher than those of the control group (dotted line) at both 30 minutes and 2 hours (p=0.0001). CERs decrease significantly at 2 hours compared to those at 30 minutes (p=0.0006); however, this decrease showed no significant difference between the control and embolic groups (p=0.1889).
조군의 0.3617 및 0.2800에 비해 통계적으로 유의하게 컸다 (p=0.0001). 30분의 조영증강비가 색전군에서 0.6340, 대조 군에서 0.3617로 2시간의 0.4213 및 0.2800에 비해 통계적으 로 유의하게 더 컸다 (p=0.0006). 30분에 비해 2시간의 조영 증강비는 감소하였으며 이러한 감소 정도는 색전군과 대조 군에서 유의한 차이를 보이지 않았다 (p=0.1899) (Fig. 4).
2. 전자현미경 검사 분석
대조군에서 혈고환장벽 내 lanthanum 비투과성 표지자가 나타나지 않았으나 트리올레인 지방 유상액 주입 30분 후 색전군에서는 이들 표지자들이 증가되어 나타났다. 그러나 트리올레인 유상액 주입 2시간 후 색전군에서는 다시 이들 표지자들이 대부분 소실되었다 (Fig. 5).
고 찰
혈고환장벽은 해로운 독성 물질이나 면역학적인 영향으 로부터 생식세포를 보호하는 것으로 크게 물리화학적 장
벽, 방류펌프 (efflux-pump) 장벽, 면역학적 장벽으로 구성되 어 있다. 물리화학적 장벽은 모세혈관-내피세포간 폐쇄막 (tight junction), 지주세포 (Sertoli cell) 간 폐쇄막, 그리고 세 정관 주변을 둘러싸는 근육양 (myoidl) 세포로 이루어진다.
방류펌프 장벽은 모세혈관의 내피세포와 근육양 세포에 있 는 P-당단백과 지주세포의 기저측면에 있는 다약제내성단 백 1 (multidrug-resistance associated protein 1; MRP 1)으로 이 루어지며, 면역학적 장벽은 지주세포의 Fas 리간드 (ligand) 로 이뤄져 있다.1 혈뇌장벽과 혈고환장벽은 혈관내피세포 의 폐쇄막, 그리고 동일한 방류펌프로 이루어진 강한 물리 화학적 장벽이라는 점과 둘 다 면역학적 장벽이라는 점에 서 서로 비슷하다.1
자기공명영상에서 쓰이는 가돌리니움 조영제는 모든 혈- 장기 장벽들 (blood-organ barriers)을 통과할 수 없는 것으로 알려져 있다. 따라서 혈뇌장벽10 뿐만 아니라 혈고환장벽11 의 투과성 변화는 가돌리니움 조영제의 조영증강 유무로 알아볼 수 있다. Runge 등10은 삼투성 혈뇌장벽 붕괴 고양이 모델에서 가돌리니움 조영제를 이용한 자기공명영상 검사 Fig. 5. Morphological electron microscopy study using a lanthanum electron opaque tracer. Upper (A, B and C) and lower (D, E and F) figures are 4,000 and 25,000 times magnified, respectively. Lanthanum was present in the intercellular spaces throughout the seminiferous cord, which can be seen as a fine, dense line (arrow) at 30 mins after the intra-arterial infusion of the triolein emulsion. Compare to the control, the entry of lanthanum was markedly increased at 30 mins, but recovered at 2 hours after the intra-arterial infusion of the triolein emulsion. Lower figures (D, E and F) demonstrate the circle area of the upper figures (A, B and C).
A B C
F E
D
를 시행하여 혈뇌장벽의 변화를 발표하였다. 그리고 Kim 등12은 고양이 모델에서 가돌리니움 조영제를 사용한 자기 공명영상 검사를 통하여 트리올레인 유상액이 혈뇌장벽의 투과성 변화를 야기한다고 하였다. 저자들도 혈고환장벽의 투과성 변화를 알아보기 위하여 가돌리니움 조영제를 사용 한 자기공명영상 검사를 시행하였다. 아울러 가돌리니움 조영제 사용 전, 후의 자기공명영상을 분석하여 트리올레 인 지방유상액이 혈고환장벽의 투과성 변화를 일시적으로 일으키는지를 알아보고자 하였다.
트리올레인은 지방색전증의 주요 물질 중 하나이다. 트 리올레인을 경동맥에 일시 주사한 경우 혈관성 부종 뿐만 아니라 세포독성 부종, 즉 뇌혈관 폐색에 따른 경색이 초래 되지만7,12 유상액 상태로 주입하면 가역성의 혈관성 부종이 주로 나타난다.7 즉, 트리올레인 유상액 주입 직후에는 혈관 성 부종에 의한 T2 강조영상의 고신호강도와 함께 혈뇌장 벽의 손상으로 인한 조영증강이 관찰된다. 이번 연구에서 색전군 고환의 조영증강이 대조군에 비하여 의미 있게 증 가하였으며 이는 트리올레인 유상액이 혈고환장벽에 손상 을 입힌 것으로 생각한다. 이번 연구 결과는 Kim 등7의 연 구에서 나타난 트리올레인 유상액이 혈뇌장벽을 열어 혈관 성 부종이 나타난 것과 유사한 결과일 것으로 생각한다.
대조군에서 약간의 조영증강이 나타났는데 이는 혈관 내 부와 간질 공간, 즉 세포외 공간에 있는 조영제로 인한 것으 로 생각한다.11 정성검사에서 색전군의 2시간 조영 후 영상 에서 30분의 영상에 비해 좀 더 약한 고신호 강도를 관찰할 수 있었다. 그리고 조영 전과 후의 신호강도비를 비교한 정 량 검사에서 30분 영상과 비교하여 2시간 영상의 조영증강 비가 감소하였다. 이로 미루어 혈고환장벽의 손상 정도는 시간이 지남에 따라 감소한다고 생각한다. 이번 연구에서 T2 강조영상은 얻지 않았는데 이는 정상적으로 고환은 T2 강조영상에서 고신호강도를 보이므로 혈관성 부종에 의한 고신호강도와 감별이 모호할 것으로 생각되었기 때문이다.
또한 확산강조 영상과 현성확산계수 영상도 얻지 않았으며 그 이유는 트리올레인 유상액이 혈관폐색을 일으키지 않아 세포독성 부종이 나타나지 않기 때문이었다.7
Eng 등13은 지방이 혈고환장벽의 투과성 변화에 미치는 영향을 알아보기 위하여 글리세롤을 직접 고환에 주입하였 으며, 그 결과 56주까지도 혈고환장벽의 증가된 투과성을 관찰하였다. Wiebe 등14은 글리세롤을 직접 고환에 주사하 여 실시한 실험에서 글리세롤이 고환의 지주세포 폐쇄막과 관련된 단백질 (actin microfilaments, occludin, microtubules) 에 직, 간접적 영향을 미쳐 혈고환장벽의 투과성이 증가한 다고 하였다. 저자들의 이번 실험결과 나타난 트리올레인 지방 유상액에 의한 혈고환장벽의 투과성 증가는 이들의
연구결과와 일치하였다. 그러나 저자들이 이용한 방법과 같이 고환동맥을 통하여 주입하는 방법이 고환에 직접 주 입하는 방법보다 고환의 병태생리를 이해하는 데 더 나은 방법이라고 생각한다.
상기 기술한 바와 같이 이번 실험에서 저자들은 트리올 레인 유상액이 혈고환장벽의 투과성 변화에 미치는 영향을 자기공명영상 검사를 이용하여 확인하였다. 저자들은 추가 적으로 lanthanum 비투과성 표지자를 이용한 전자현미경 검사를 통해 혈고환장벽의 미세구조 변화를 조사하여 혈고 환장벽의 투과성 변화를 조사하고, 이 결과와 자기공명영 상 결과와 상호 연관성을 알아보고자 하였다.
동물 및 사람의 고환에 대한 전자현미경 연구들에서 혈 고환장벽이 lanthanum 표지자가 생식세포의 상피 내로 투 과되는 것을 방지하는 것으로 알려져있다.1 Dym과 Fawcett15 는 쥐의 혈고환장벽의 lanthanum 투과성에 대한 전자현미 경 실험에서 근육양 세포 사이의 폐쇄막들이 lanthanum 표 지자들이 생식세포의 상피 내로 들어가는 것을 주로 방지 한다고 하였다. 저자들의 연구에서도 대조군에서 lanthanum 표지자들은 혈고환장벽의 근육양 세포나 지주세포간 폐쇄 막을 투과하지 못하였다. 그러나 색전군의 경우 트리올레 인 지방 유상액을 주입한 후 30분 뒤에는 lanthanum 표지자 들이 지주세포간 폐쇄막을 투과하였으며, 2시간 후에는 다 시 소실되었다. 이들 결과로 미루어 lanthanum 표지자를 이 용한 전자현미경 검사와 가돌리니움 조영제를 이용한 자기 공명영상검사 결과는 서로 일치되는 소견을 나타내는 것으 로 생각한다.
결 론
고환동맥을 이용하여 트리올레인 지방 유상액을 주입한 결과 혈고환장벽의 투과성이 일시적으로 증가하였다. 이번 연구결과는 향후 고환암의 약물 효과를 높이기 위한 약물 전달장치의 개발연구를 위한 기초자료로 유용하게 활용될 수 있을 것으로 생각한다.
REFERENCES
1. Bart J, Groen HJ, van der Graaf WT, Hollema H, Hendrikse NH, Vaalburg W, et al. An oncological view on the blood- testis barrier. Lancet Oncol 2002;3:357-63
2. Kamps WA, Bokkerink JP, Hahlen K, Hermans J, Riehm H, Gardner H, et al. Intensive treatment of children with acute lymphoblastic leukemia according to ALL-BFM-86 without cranial radiotherapy: results of Dutch Childhood Leukemia Study Group Protocol ALL-7 (1988-1991). Blood 1999;94:
1226-36
3. Miniero R, Saracco P, Pastore G, Zurlo MG, Terracini B, Rosso P, et al. Relapse after first cessation of therapy in childhood acute lymphoblastic leukemia: a 10-year follow-up study. Italian Association of Pediatric Hematology-Oncology (AIEOP). Med Pediatr Oncol 1995;24:71-6
4. Touroutoglou N, Dimopoulos MA, Younes A, Hess M, Pugh W, Cox J, et al. Testicular lymphoma: late relapses and poor outcome despite doxorubicin-based therapy. J Clin Oncol 1995;13:1361-7
5. Tondini C, Ferreri AJ, Siracusano L, Valagussa P, Giardini R, Rampinelli I, et al. Diffuse large-cell lymphoma of the testis.
J Clin Oncol 1999;17:2854-8
6. Kroll RA, Neuwelt EA. Outwitting the blood-brain barrier for therapeutic purposes: osmotic opening and other means.
Neurosurgery 1998;42:1083-99
7. Kim HJ, Lee CH, Kim HG, Lee SD, Son SM, Kim YW, et al. Reversible MR changes in the cat brain after cerebral fat embolism induced by triolein emulsion. AJNR Am J Neu- roradiol 2004;25:958-63
8. Sun EL, Gondos B. Formation of the blood-testis barrier in the rabbit. Cell Tissue Res 1986;243:575-8
9. Forssmann WG, Ito S, Weihe E, Aoki A, Dym M, Fawcett DW. An improved perfusion fixation method for the testis.
Anat Rec 1977;188:307-14
10. Runge VM, Price AC, Wehr CJ, Atkinson JB, Tweedle MF.
Contrast enhanced MRI: evaluation of a canine model of osmotic blood-brain barrier disruption. Invest Radiol 1985;20:
830-44
11. Farghali H, Williams DS, Simplaceanu E, Ho C, Van Thiel DH. An evaluation of the integrity of the blood-testis barrier by magnetic resonance imaging. Magn Reson Med 1991;22:
81-7
12. Kim HJ, Lee CH, Lee SH, Moon TY. Early development of vasogenic edema in experimental cerebral fat embolism in cat.
Invest Radiol 2001;36:460-9
13. Eng F, Wiebe JP, Alima LH. Long-term alterations in the permeability of the blood-testis barrier following a single intra- testicular injection of dilute aqueous glycerol. J Androl 1994;
15:311-7
14. Wiebe JP, Kowalik A, Gallardi RL, Egeler O, Clubb BH.
Glycerol disrupts tight junction-associated actin microfila- ments, occludin, and microtubules in Sertoli cells. J Androl 2000;21:625-35
15. Dym M, Fawcett DW. The blood-testis barrier in the rat and the physiological compartment of the seminiferous epithelium.
Biol Reprod 1970;3:308-26