저작자표시-비영리-변경금지 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 비영리. 귀하는 이 저작물을 영리 목적으로 이용할 수 없습니다. 변경금지. 귀하는 이 저작물을 개작, 변형 또는 가공할 수 없습니다.
이학 석사학위 논문
한국인 여아 코호트를 이용한
전장유전체분석으로 발굴된
성조숙증 연관 유전자의 기능 연구
아 주 대 학 교 대 학 원
의생명과학과 / 분자의학전공
조 미 란
한국인 여아 코호트를 이용한
전장유전체분석으로 발굴된
성조숙증 연관 유전자의 기능 연구
지도교수 정 선 용
이 논문을 이학 석사학위 논문으로 제출함.
2019년 8월
아 주 대 학 교 대 학 원
의생명과학과 / 분자의학전공
조 미 란
i - 국문요약 -
한국인 여아 코호트를 이용한 전장유전체분석으로 발굴된
성조숙증 연관 유전자의 기능 연구
성조숙증 (Precocious puberty) 은 다인자성 질환으로 유전적 요인과 환경적 요인이 함께 관여한다. 유전적인 요인으로는 인종, 가족력, 유전자 등 이 있으며. 환경적인 요인으로는 비만, 신체 형상, 내분비계 교란물질 (endocrine disrupting chemical; EDC) 등 이 있다. 성조숙증 환자의 50%~80%가 유전적 요인에 영향을 받는 것으로 알려져 있으나 아직까지 정확하게 연관성이 밝혀진 유전자가 많지 않다. 현재까지 알려진 대표적인 성조숙증 유발 관련 유전자로 KISS1, KISS1R, MKRN3 등이 있다. 최근 국내 성조숙증 환자가 급증함에 따라 질환의 진단과 치료에 대한 관심이 증가하고 있다. 특히, 적절한 치료를 위해서는 바이오마커를 활용한 조기진단이 중요하다. 본 연구에서는 성조숙증과 연관성이 있는 새로운 유전 인자를 발굴하여 조기진단 바이오마커로서의 유용성을 검증하는 것을 목표로 하였다. 먼저, 선행연구에서 한국인 여아 성조숙증 연구 코호트 (환자군 669 명, 정상군 300 명)를 통한 임상자료와 단일염기다형성 (SNP) 유전형 자료를 이용한 case-control 전장유전체연관성분석 (GWAS)을 통해 Bonferroni correction p-value 유의성 (p < 5×10-8)을 통과하는 1 개의 SNP 와ii
Suggested p-value 유의성 (p < 1×10-5)을 통과하는 7 개의 SNP 을 포함한
총 8 개의 SNP 을 발굴하였다.
GWAS 결과에서 가장 높은 유의성을 나타낸 rs10900855 SNP (p =
1.1×10-8)의 500 Kbp 내에 위치한 3 개의 유전자 EGR1, HSPA9, ETF1를 본 연구의 후보유전자로 선정하였다. 암컷 마우스의 성장시기별 (10, 22, 30, 36 일) 시상하부 조직을 적출하여 mRNA 를 추출한 후 선정된 후보유전자들의 유전자 발현 패턴을 조사하였다. 마우스의 사춘기 시기(22~30 일) 동안 Egr1 은 발현량이 유의하게 증가하였으며, Etf1 은 발현량이 유의하게 감소하는 양상을 보였다. Hspa9는 마우스 시상하부에서는 발현량의 변화가 거의 없었다. 다음으로, 마우스 시상하부 유래의 생식샘자극호르몬 방출호르몬 (GnRH)을 분비하는 세포주인 GT1-7 세포를 이용하여 후보유전자의 과발현에 의한
GnRH 분비 관련 경로 (pathway) 변화를 조사하였다. Egr1 과 Hspa9 의
과발현은 Gnrh 와 Kiss1r 의 mRNA 발현량에 영향을 주지 않았지만, Etf1 의
과발현은 Gnrh 와 Kiss1r 의 발현량을 현저하게 감소시켰다. 또한, Etf1 의 과발현은 Etf1 단백질 농도 의존적으로 phospholyated-ERK 를 현저하게 감소시켰다. 이러한 결과는 성조숙증 case-control GWAS 에서 가장 높은 유의성을 나타낸 rs10900855 SNP 가 ETF1 유전자와 연관된 SNP 일 가능성이 높으며, ETF1 유전자의 발현량의 변화는 성조숙증과 밀접한 관련이 있음을 시사한다. 마지막으로, 성조숙증 case-control GWAS 에서 가장 높은 유의성을 나타낸 rs10900855 SNP 을 포함 총 45 개의 SNP (p ≤ 1×10-4)에 대한 다중회귀분석을 진행하였으며, 이를 통하여 정확도 (precision) 값 상승에
iii 영향을 미치는 SNP 을 분석하여 최종적으로 23 개의 SNP 를 성조숙증 진단 바이오마커로 선정하였다. 이들 23 개의 SNP 를 이용한 성조숙증 발병 예측의 민감도는 66%, 특이도는 88.6%, 정확도는 81.2%롤 나타났다. 이러한 연구결과로부터, rs1090855 SNP 을 포함한 23 개의 SNP 는 향후 예측율이 높은 성조숙증 조기진단 바이오마커로 활용될 수 있을 것으로 기대된다. __________________________________________________________________ 핵심어: 성조숙증, 조기진단, 유전자 바이오마커, 전장유전체연관성분석, 단일염기다형성, 생식샘자극호르몬 방출호르몬, 시상하부, ETF1 유전자
iv
차 례
국문요약 ··· i 차례 ··· iv 그림차례 ··· vii 표 차례 ··· ix I. 서론 ··· 1 II. 실험재료 및 방법 ··· 7 A. 연구 코호트 ··· 7 B. DNA 추출 및 SNP genotyping ··· 7 C. 세포주 및 세포배양 ··· 8 D. 과발현 construct 제작 ··· 8 E. 마우스 시상하부 적출 ··· 8F. Total RNA 추출 및 cDNA 합성 ··· 9
v F. Western blot 분석 ··· 10 I. 통계분석 ··· 10 III. 결과 ··· 13 A. 한국 여아를 대상으로 한 성조숙증 환자 및 정상군 코호트 구축··· 13 B. 한국인 여아 성조숙증 연구 코호트를 이용한 성조숙증 전장유전체연관성분석 (GWAS) ··· 15 C. 마우스 성장 시기별 시상하부에서의 기존 성조숙증 관련 유전자의 발현 변화 조사 ··· 19 D. 마우스 성장 시기별 시상하부에서의 후보 유전자 발현 변화 조사 ··· 22 E. 마우스 시상하부 유래 GT1-7 세포의 GnRH 분비 유도 조건 확립 ··· 25
F. Egr1 과발현에 의한 Gnrh 와 Kiss1r 발현 및 ERK 활성화 변화
vi
G. Hspa9 과발현에 의한 Gnrh 와 Kiss1r 발현 및 ERK 활성화 변화
조사 ··· 31
H. Etf1 과발현에 의한 Gnrh 와 Kiss1r 발현 및 ERK 활성화 변화 조사 ··· 34 I. 다중회귀분석을 통한 성조숙증 조기진단 바이오마커 발굴 ··· 37 IV. 고찰 ··· 42 V. 결론 ··· 45 참고문헌 ··· 46 ABSTRACT ··· 53
vii
그림 차례
Figure 1. Secondary characteristics shown at an early age in patients with
precocious puberty ··· 5
Figure 2. Hypothalamic-pituitary-gonadal (HPG) axis regulated by Kiss1 and
GnRH neurons. ··· 6
Figure 3 Manhattan plot results of a case-control genome-wide association
analysis (GWAS) in Korean girls ··· 16
Figure 4. Signal plot of the single nucleotide polymorphism (SNP) with the lowest
p-value ··· 18
Figure 5. The mRNA expression patterns of Gnrh, Kiss1, and Mkrn3 during the
pubertal period in the hypothalamus tissue of a female mouse ··· 20
Figure 6. The mRNA expression patterns of the candidate genes (Egr1, Etf1, and
Hspa9) during the pubertal period in the hypothalamus tissue of a female
viii
Figure 7. Induction conditions of GnRH secretion in GT1-7 cells derived from
mouse hypothalamus ··· 26
Figure 8. The results of Gnrh and Kiss1r mRNA expression and ERK activation
upon overexpression of Egr1 ··· 29
Figure 9. The results of Gnrh and Kiss1r mRNA expression and ERK activation
upon overexpression of Hspa9 ··· 32
Figure 10. The results of Gnrh and Kiss1r mRNA expression and ERK activation
upon overexpression of Etf1 ··· 35
Figure 11. Multiple regression analysis of 45 SNPs for the accuracy of precious
ix
표 차례
Table 1. Oligonucleotide primer sequences used for quantitative RT-PCR ···· 12
Table 2. Characteristics of study subjects with precocious puberty and normal
controls ··· 14
Table 3. Eight SNPs satisfying the suggested p-value (p < 1 × 10–5) ··· 17
Table 4. Multiple regression analysis of 45 SNPs for accuracy of precious puberty
prediction ··· 38
- 1 -
I. 서론
성조숙증 (Precocious puberty) 은 2 차성징이 평균성장 속도보다 빨리 나타나는 현상을 의미한다. 성조숙증 여아의 경우 8 세 이전에 유방 및 음모가 발달하고 초경이 시작되며, 남아의 경우 9 세 이전에 고환의 용적이 4mL 이상 또는 직경이 25mm 이상 증가하고 변성기가 오는 등 다양한 2 차성징이 발현됨으로써 임상적으로 정의된다 (Bruk et al., 1960; McGeorge and Connor, 1961; Carel and Leger, 2008; Oh et al., 2017) (Figure 1).성조숙증은 Kiss1 neuron 과 성선 자극 호르몬 분비 호르몬 (gonadotropin-releasing hormone; GnRH) neuron 에 의해 조절되는 시상하부-뇌하수체-생식샘 (hypothalamic pituitary gonadal; HPG) 축의 조기활성화로 인해 GnRH 의 분비가 증가하여 발생된다 (Francis et al., 1993; Carel et al., 2004)(Figure 2). 시상하부의 arcuate nucleus (ARC) 와
anteroventral periventricular nucleus (AVPV)에 위치하는 Kiss1 neuron 은
kisspeptin 을 분비한다. kisspeptin 은 복측 (ventral) 시상하부의 preoptic area (POA)에 위치한 GnRH neuron 의 G protein-coupled receptor 54 (GPR54) 과 결합하여 GnRH 분비를 유도한다 (Teles et al., 2008). GnRH 는 뇌하수체 전엽에 위치하는 생식 세포 (gonadotropic cell)를 자극하여 성선자극호르몬 (gonadotropin) 인 황체 형성 호르몬 (luteinizing hormone; LH) 과 난포자극호르몬 (follicle-stimulating hormone; FSH)의 분비를 유도한다 (Dungan et al., 2006; Gojska et al., 2014). LH 와 FSH 는 생식선 성장, 발달 및 성숙과정을 일으키며, 난소 및 고환에서 성 스테로이드 호르몬 (sexual steroid hormone); 에스트로겐 (estrogen), 프로게스테론
- 2 -
(progesterone), 안드로겐 (androgen)의 분비를 유도한다 (Weltzien et al., 2004; Cortes et al., 2015). 성 스테로이드 호르몬들 중 에스트로겐과 안드로겐의 한 종류인 테스토스테론 (testosterone) 은 음성되먹임 (negative feedback)을 통하여 GnRH 분비를 조절한다 (Handa et al., 1994).
성조숙증 환아는 성인이 되었을 때 여아의 경우 약 12cm, 남아의 경우 약 20cm 정도 평균신장보다 작은 신장을 가지게 된다 (Carel and Leger, 2008). 또한 어린 나이에 노출되는 성호르몬은 제 2 형 당뇨, 성인 비만 그리고 유방암, 난소암, 자궁내막암 등을 포함한 다양한 여성암 원인이 될 수 있다 (Elks et al., 2010). 이러한 성조숙증은 약 5,000~10,000 명 중 1 명 정도로 발생되며, 남아보다 여아에게서 5~10 배 정도 발생률이 높다 (Teilmann et al., 2005; Cesario and Hughes, 2007).
성조숙증은 유전적인 요인과 환경적인 요인이 복합적으로 작용하여 발생하는 대표적인 다인자성 질환 (multifactorial disease) 이다. 유전적인 요인으로는 인종, 가족력, 유전자 등 이 있으며. 환경적인 요인으로는 비만, 신체 형상, 내분비계 교란물질 (endocrine disrupting chemical; EDCs) 등 이 있다. 성조숙증과 관련된 대표적인 EDCs 로는 DDT (dichloro-diphenyl-trichloroethane), DDE (dichloro-diphenyl-dichloroethylene), BFR (brominated flame retardants), 납 등이 알려져 있다 (Buck Louis et al., 2008).
성조숙증은 50~80%가 유전적인 요인에 의해 영향을 받는 것으로 알려져 있다 (Palmert and Boepple, 2001; Kaminski and Palmert, 2008; Oh et al., 2017). 성조숙증과 연관된 유전자로는 KISS1 (kisspeptin) (Silveira et al., 2010), KISS1R (kisspeptin receptor; GPR54)(Teles et al., 2008), 그리고
- 3 -
MKRN3 (makorin ring-finger protein-3) (Abreu et al., 2013) 가 있다.
KISS1 유전자가 암호화하고 있는 kisspeptin 은 54 아미노산으로 이루어져
있으며, KISS1R 유전자가 암호화하고 있는 G protein-coupled receptor 54 (GPR54)와 결합하여 GnRH 분비 및 사춘기 발현에 관여하는 것으로 알려져 있다 (Silveira et al., 2010; Gojska et al., 2014). MKRN3 유전자가 암호화하고 있는 makorin ring-finger protein-3 는 단백질의 유비퀴틴화 (ubiquitination)에 관여하며, GnRH 의 박동성 (pulsatile) 분비를 억제하는
역할을 한다. 돌연변이 (mutation)로 인한 MKRN3 유전자의 결핍은
성조숙증을 유발하는 것으로 알려져 있다 (Abreu et al., 2013; Dimitrova-Mladenova et al., 2016). 성조숙증의 진단은 문진과 진찰을 통하여 2 차 성징의 시작시기를 확인한 후 골연령의 진행속도를 확인하기 위하여 좌측 수부 및 수근골 X 선 사진을 촬영하여 골연령검사를 진행한다. 2 차성징의 발현과 골연령이 평균나이보다 빠르게 진행되고 있는 것으로 판단되면 GnRH 자극검사를 시행한다. 이는 HPG 축이 활성화 여부를 확인하기 위한 검사로 GnRH 유사체 (analogue)를 투여한 후 15~30 분 간격으로 총 2 시간동안 혈액을 채취하여 LH 및 FSH 의 농도를 측정한다. GnRH 유사체를 투여한 후 LH 의 농도가 5 IU/L 이상이면 성조숙증으로 진단한다 (Carel and Leger, 2008; Nam et al., 2012).
최근 세계적으로 성조숙증 환자가 급격하게 증가하고 있어 사회적으로 큰 문제가 되고 있다. 서구 선진국에서 조사된 바에 따르면 점점 여아의 초경 연령이 빨라지고 있으며, 성조숙증의 발생률 또한 증가하는 추세로 보고되고 있다 (Herman-Giddens et al., 1997). 현재 우리나라에서도 서구 선진국에서 와 같이 성조숙증의 발생률이 급격히 증가하는 추세이다. 2017 년에 발표된
- 4 - ‘건강보험심사평가원’ 통계에 따르면 2006 년이후 10 년간 성조숙증 (질병분류기호 E301)으로 진료받은 인원이 약 12 배이상 증가한 것으로 보고되고 있다. 성조숙증은 조기에 진단하고 치료할수록 성조숙증으로 인해 초래될 수 있는 저 신장과 심리적 장애를 개선할 수 있어 치료 시작시기가 매우 중요한 질병이지만, 현재 시행되고 있는 진단 방법은 조기진단을 하는 데에는 한계점이 있기 때문에 유전자 바이오 마커를 사용한 조기진단의 필요성은 점점 더 커지고 있다. 본 연구에서는 선행연구에서 구축된 한국인 여아 성조숙증 연구 코호트 (환자군 669 명, 정상군 300 명)를 통한 임상자료와 SNP 유전형 자료를 이용하여 case-control 전장유전체연관성분석 (GWAS)을 진행하였으며, 이를 통해 Bonferroni correction p-value 유의성을 통과하는 1 개의 SNP (𝑝 = 1.1 × 10−8)와 𝑝 = 1.0 × 10−5를 통과하는 SNP 7 개를 포함한 총 8 개의 유전자 변이 (Single Nucleotide Polymorphism; SNP)를 발굴하였다. 발굴된 8 개의 SNP 들 중 가장 유의성이 높은 rs10900855 의 500Kbp 이내 영역에 위치하는 3 개의 유전자 EGR1, HSPA9, ETF1 를 성조숙증 바이오마커 후보유전자로 선정하였다. 우리는 선정된 후보유전자들이 성조숙증과 어떤 연관성이 있는지 in vitro 실험을 통해 연구하고자 하였으며, 이를 토대로 성조숙증 조기진단 및 맞춤형치료를 위한 바이오마커 (genetic biomarker) 개발을 최종목표로 하고 있다.
- 5 -
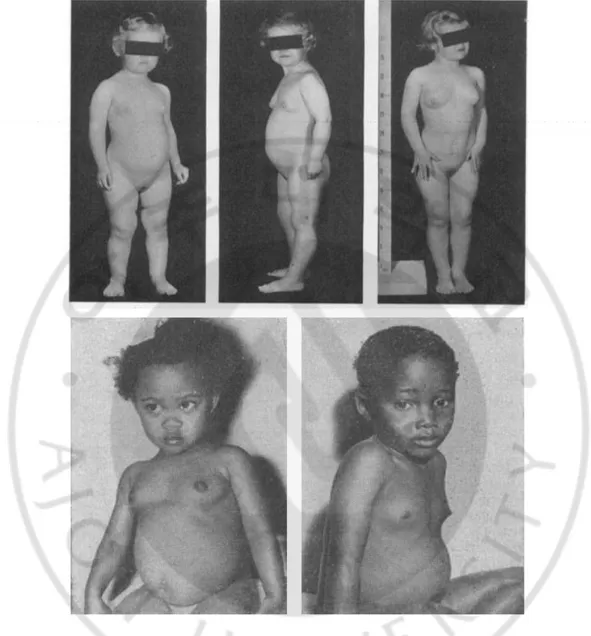
Figure 1. Secondary characteristics shown at an early age in patients with precocious puberty (Bruk et al., 1960; McGeorge and Connor, 1961).
Precocious puberty is the early development of characteristics before the age of 8 in girls and 9 in boys, which includes the growth of pubic and axillary hair and the development of breasts.
- 6 -
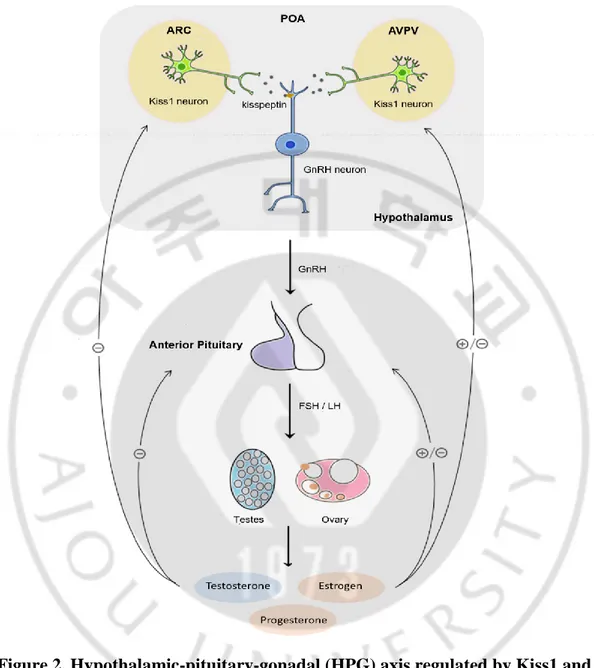
Figure 2. Hypothalamic-pituitary-gonadal (HPG) axis regulated by Kiss1 and GnRH neurons.
GnRH secreted from the hypothalamus induces the secretion of LH and FSH from the anterior pituitary. Then, LH and FSH stimulate the release of sex hormones. The sex hormones affect the hypothalamus and pituitary via the negative feedback mechanism (Kong et al., 2014).
- 7 -
II. 재료 및 실험방법
A. 연구 코호트 본 연구는 수원 아주대병원 소아과를 통해 모집된 성조숙증 환아 669 명을 통하여 성조숙증 코호트를 구축하였다. 또한 만 12 세 이후에 초경을 보인 만 12 세~만 19 세 미만의 여아 300 명을 통하여 정상군 코호트를 구축하였다. 성조숙증 임상 분석의 비교를 위해 유방 발달 및 2 차성징의 유무를 확인하였다. 모든 피실험자는 신장 (cm)과 체중 (kg)을 측정하고 체질량지수 (BMI= 체중 kg/(신장 m)^2)를 산출하였으며, 성 발달 정도는 Tanner’s criteria 에 따라 5 단계로 나누어 평가하였다. 병력으로는 이차 성징의 발현 나이, 과거력, 성조숙증에 관련된 가족력을 조사하였으며, 호르몬 검사는 혈액을 채취하여 혈중 LH, FSH 의 농도를 측정하였다. 모든 실험은 아주대병원 기관심사위원회의 승인을 받아 모든 피실험자에 대한 서면과 동의 후에 진행되었다. B. DNA 추출 및 SNP genotyping피실험자의 전혈 (whole blood)샘플에서 ExgeneTM Blood Kit (GeneAll, Seoul, Korea)를 사용하여 genomic DNA 를 추출하였으며, UV 흡광도 260/280 및 260/230 값으로 DNA 의 질 (quality)과 양 (quantity)을 검증하였다. 추출한 DNA 는 높은 열을 가해 단일가닥 (single strand) 변성 (denature) 시킨 후 무작위로 25-125bp 조각하여 8,754,887 SNP 탐침가 (oligo nucleoride) 가 심어져 있는 Axiom Precision Medicine Research Array (PMRA) microarray chip (Thermo, Santa Clava, CA, USA)에
- 8 -
첨가하여 DNA 를 교잡 (hybridization) 시킨 후 SNP 탐침자와의 결합 여부를 분석하여 각 샘플의 SNP 의 유전형 (genotype)을 분석하였다.
C. 세포주 및 세포배양
마우스 시상하부 유래 GT1-7 세포 (Pamela Mellon, San Diego, California, USA)(Mellon et al., 1990)를 10% FBS (Gibco, New York, USA), penicillin (100U/ml)와 streptomycin (100µg/ml)을 첨가한 4.5g/L glucose 가 함유된
Dulbecco’s modified Eagle’s medium (Corning, Manassas, VA, USA)를
사용하여 5% CO2, 37℃ 환경에서 배양하였다. GT1-7 세포에서 GnRH 를
인위적으로 유도하기위해 1 µg Kisspeptin-10 처리한 후 30 분, 45 분, 1h, 6h,
24h 동안 처리한 후 회수하였다.
D. 과발현 construct 제작
pEZ-Lv105 Vector 에 cloning 된 ORF EGR1, ETF1, HSPA9 construct 를
(GeneCopoeia, USA)에서 구입하여 사용하였다. 각 유전자의 Lentiviral particles transduction 은 제조사의 프로토콜에 따라 진행되었다.
E. 마우스 시상하부 적출
동물 연구 절차는 아주대학교 의과대학의 동물 보호 및 이용 위원회의 승인을 받아 진행되었다. 모든 동물 실험은 ARRIVE 지침을 준수하고 실험실 동물의 관리와 사용에 대한 국립 보건원 가이드 (NIH Publications No. 8023, revised 1978)에 따라 진행되었다. 시상하부 조직은 생후 10 일 15 일, 22 일, 26 일, 26 일, 30 일, 36 일차 별로 Institute of Cancer Research (ICR) 마우스
- 9 -
(Daehan Biolink Co., Korea) 에서 적출하였다. 조직 샘플은 Trizol™ reagent (Invitrogen, USA)에 동결보관 되었다.
F. Total RNA 추출 및 cDNA 합성
배양한 세포와 적출된 조직에서 Trizol™ reagent (Invitrogen, USA)와 RNeasy Mini Kit (Qiagen, Germany)를 이용하여 RNA 를 추출한 후 260 / 280 의 흡광도 비율을 사용하여 quality 를 측정하였다. 추출한 RNA 는 RNase-free DNase Ⅰ(Invitrogen, USA) 2U 을 처리하여 남아 있는 gDNA 를 제거한 후 oligo (dT) 15-18 primer 와 random primer, RevertAid First Strand cDNA Synthesis Kit (Thermo Fisher Scientific, Waltham, MA, USA)를 사용하여 cDNA 를 합성하였다.
G. 정량 RT-PCR
모든 real-time PCR 은 Bio-Rad CFX Connect Real-Time system (Bio-Rad Laboratories; Foster City, CA, USA)을 이용하였다. 100ng 의 cDNA 를 포함하는 10 µg 의 혼합물을 TB green™ Premix Taq™ qPCR Kit (TaKaRa;
Shiga, Japan)을 이용하여 95 ℃에서 5 분 초기 denaturation 시킨 후
95 ℃에서 5 초, 60 ℃에서 30 초, 72 ℃에서 20 초의 조건으로 40 cycle 반복 뒤 2 분 동안 72°C ~95°C (1 초당 5℃) terminal melting 단계를 거쳐 증폭하였다. 각 유전자 mRNA 발현량을 분석하기 위해 사용한 유전자 특이적 primer 는 Table1 에 나타내었다.
- 10 - H. Western blot 분석
배양한 세포를 50 µg/ml PMSF, Protease inhibitor cocktail 이 첨가된 lysis
buffer (150 mM Nacl, 1% Nonidet p-40, 0.5% sodium deoxycholate, 0.1% SDS)와 혼합하여 단백질을 추출한 뒤 여기서 얻어진 시료를 Lowry protein assay reagent kit (Bio-rad laboratories, USA) 방법으로 정량 분석하여 SDS-PAGE loading buffer (5X)와 섞은 후, 100℃에서 10 분간 가열하였다. 이를 각각 20~50µg loading 한 후 8% SDS-PAGE gel 에 전기영동으로 분리하여, Polyvinylidene fluoride (PVDF, Immobilon-P membrane(0.45µm), Millipore Corporation, U.S.A)에 흡착 이동시켜, 다음과 같이 각각의 특이 항체로 Western blot analysis 를 시행하여 분석하였다.
사용한 1 차 항체는 Egr1 (abcam, Cambridge, UK), Etf1 (abcam,
Cambridge, UK), Hspa9 (abcam, Cambridge, UK), ERK (Cell Signaling
Technology, Danvers, MA, USA), phospho-ERK (Cell Signaling
Technology), β-actin (Santa Cruz Biotechnology, Inc. TX, Dallas, USA), 2 차항체로는 peroxidase 가 conjugation 된 goat anti-rabbit antibody, goat anti-mouse antibody 를 이용하여 반응시킨 뒤, West-Q pico dura ECL solution (GenDEPOT, USA)를 처리하여 필름에 현상하였다.
I. 통계분석
통계 분석은 PLINK version 1.9 와 SPSS 프로그램을 사용하였다. XX 표현형은 연령 조정 후 additive model 을 사용하여 선형 회귀 분석을 통해 검정하였다. P-values 값은 다중검정을 실시하지 않았다. In vitro 그래프의 유의성을 검증을 위해 Student’s t-test 를 사용하였다. *p < 0.05, **p < 0.01,
- 11 -
***p <0.001 에서 통계적 유의성이 추정되었다. 본 연구에서 모든 in
vitro 실험은 최소 3 회 이상 독립적으로 반복되었으며, 결과는 평균 ± 표준
- 12 -
- 13 -
III. 결과
A. 한국 여아를 대상으로 한 성조숙증 환자 및 정상군 코호트 구축
선행연구에서는 총 969 명의 한국인 여아 성조숙증 연구 코호트 (환자군 669 명, 정상군 300 명)를 구축하였다 (Table 2). 이들 혈액에서 추출한 DNA 을 PMRA DNA microarray chip 에 처리하여 전체 코호트 참여자들의 SNP 유전형을 분석하였다.
- 14 -
Table 2. Characteristics of study subjects with precocious puberty and normal controls.
Abbreviations: N, Number of individuals; Tanner (B), Breast development at a Tanner stage; Tanner (P), Pubic hair development at a Tanner stage.
- 15 -
B. 한국 여아 성조숙증 연구 코호트를 이용한 성조숙증 전장유전체연관성분석 (GWAS)
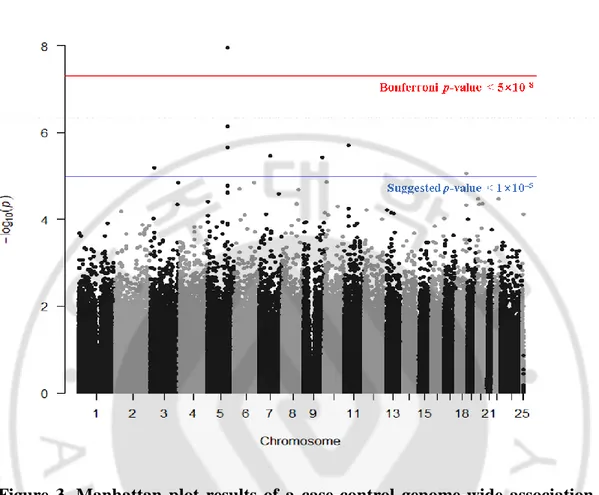
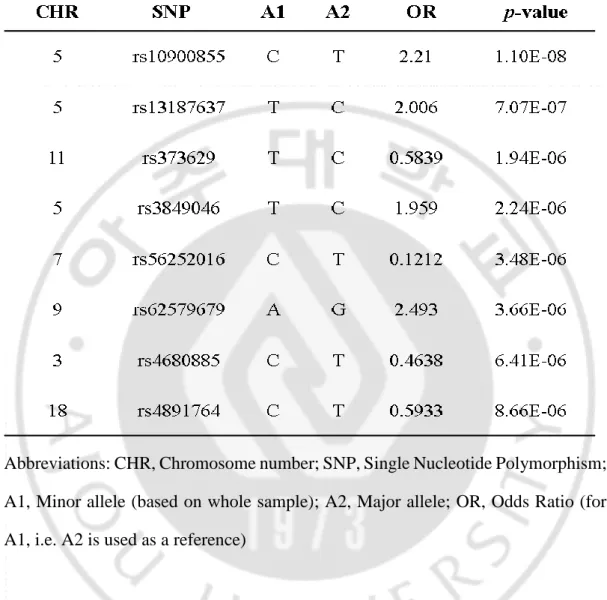
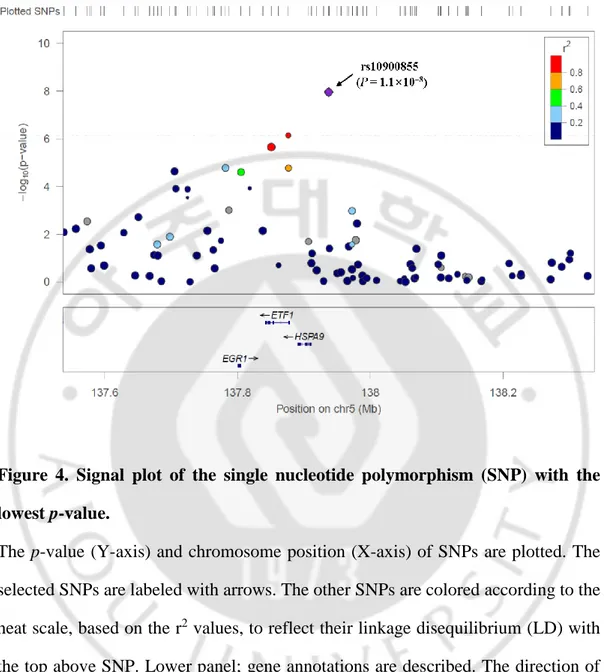
임상자료와 SNP 유전형 자료를 이용한 case-control 전장유전체연관성분석 (GWAS)을 시행하여, 각 SNP 의 chromosome 위치에 따라 Manhattan plot 으로 나타내었다 (Figure 3). 이중 Bonferroni correction p-value 유의성을 통과하는 1 개의 SNP (p = 1.1×10-8)와 Suggested p-value (p < 1.0×10-5)를 통과하는 7 개의 SNP 발굴하였다. 좋은 유의성을 가진 8 개의 SNP 들에 대한 정보를 표로 나타내었다 (Table 3). GWAS 결과에서 가장 높은 유의성을 나타낸 rs10900855 SNP 의 500Kbp 내에 위치한 3 개의 유전자
- 16 -
Figure 3. Manhattan plot results of a case-control genome-wide association analysis (GWAS) in Korean girls.
All the black and grey dots indicate the individual single nucleotide polymorphisms (SNPs) on their physical chromosomal positions (horizontal axis), and their –log10
(values) in the GWAS (vertical axis). The red line indicates the Bonferroni p-value (< 5 × 10–8) and the blue line indicates the suggested p-value (< 1 × 10–5).
- 17 -
Table 3. Eight SNPs satisfying the suggested p-value (p < 1 × 10–5).
Abbreviations: CHR, Chromosome number; SNP, Single Nucleotide Polymorphism; A1, Minor allele (based on whole sample); A2, Major allele; OR, Odds Ratio (for A1, i.e. A2 is used as a reference)
- 18 -
Figure 4. Signal plot of the single nucleotide polymorphism (SNP) with the lowest p-value.
The p-value (Y-axis) and chromosome position (X-axis) of SNPs are plotted. The selected SNPs are labeled with arrows. The other SNPs are colored according to the heat scale, based on the r2 values, to reflect their linkage disequilibrium (LD) with the top above SNP. Lower panel; gene annotations are described. The direction of the transcripts is shown using arrows.
- 19 -
C. 마우스 성장 시기별 시상하부에서의 기존 성조숙증 관련 유전자의 발현 변화 조사
기존에 성조숙증 유전자 마커로 알려진 Gnrh (gonadotrophin-releasing hormone), Kiss1 (Kiss-1 metastasis suppressor), Mkrn3 (makorin ring-finger protein-3)의 mRNA 발현을 확인하기 위해 다섯 마리의 암컷마우스 시상하부 조직을 성장 시기별 (10, 15, 22, 26, 30, 36 일령) 로 채취하여 qRT-PCR 을 진행하였다. Gnrh은 마우스 사춘기 시기인 22 일, 26 일, 30 일에 mRNA 발현이 증가하였다 (p < 0.05) (Figure 5A). Kiss1 은 마우스의 사춘기 후반기인 30 일, 36 일에 mRNA 발현이 증가하였다 (p < 0.05 , p < 0.01) (Figure 5B). Mkrn3는 마우스의 사춘기 시작 시기인 15 일차부터 20 일, 26 일, 30 일, 36 일까지 mRNA 발현이 현저하게 감소하였다(p < 0.001) (Figure 5C).
- 21 -
Figure 5. The mRNA expression patterns of Gnrh, Kiss1, and Mkrn3 during the pubertal period in the hypothalamus tissue of a female mouse.
Quantitative RT-PCR was performed with the gene specific primers using the mouse female hypothalamus tissues dissected at the indicated days. By normalizing to
Gapdh, the Gnrh (A), Kiss1 (B), and Mkrn3 (C) mRNA levels were assessed. The
results are expressed as the fold change over the mRNA level of day 10 and presented as mean values of two independent experiments, each performed with duplicate samples. *p <0.05, **p <0.01, ***p <0.001.
- 22 -
D. 마우스 성장 시기별 시상하부에서의 후보 유전자 발현 변화 조사
성조숙증 후보 유전자인 Egr1 (Early growth response-1), Etf1 (Eukaryotic translation termination factor 1), Hspa9 (Heat shock protein family A member 9)의 mRNA 발현을 변화를 확인하기 위하여 다섯 마리의 암컷 마우스 시상하부 조직을 성장 시기별 (10, 22, 30, 36 일령)로 채취하여 qRT-PCR 을 진행하였다. Egr1 은 마우스의 사춘기 시작 시기 22 일차부터 30 일, 36 일차 까지 mRNA 발현이 증가하는 양상을 보였다 (p < 0.05) (Figure 6A). Etf1 마우스의 사춘기 시작 시기 22 일차 시작하여 30 일차, 36 일차까지 mRNA 발현이 현저히 감소하는 양상을 보였다 (p < 0.01) (Figure 6B). Hspa9 는 마우스 시상하부에서는 mRNA 발현 변화가 없었다 (Figure 6C).
- 24 -
Figure 6. The mRNA expression patterns of the candidate genes (Egr1, Etf1, and Hspa9) during the pubertal period in the hypothalamus tissue of a female mouse.
Quantitative RT-PCR was performed with the gene specific primers using the mouse female hypothalamus tissues dissected at the indicated days. By normalizing to
Gapdh, the Egr1 (A), Hspa9 (B), and Etf1 (C) mRNA levels were assessed. The
results are expressed as the fold change over the mRNA level of day 10 and presented as mean values of two independent experiments, each performed with duplicate samples. *p <0.05, **p <0.01.
- 25 -
E. 마우스 시상하부 유래 GT1-7 세포의 GnRH 분비 유도 조건 확립
마우스 시상하부 유래의 성선자극 호르몬 (GnRH)을 분비하는 cell line 인 GT1-7 세포에서 GnRH 의 분비를 유도하기 위해 1µg 의 kisspeptin 을 시간별 (30m, 45m, 1h, 6h, 24h) 로 처리한 후 qRT-PCR 을 진행하여 Gnrh 와 Jun 의 mRNA 발현 변화를 확인하였다. 1µg 의 kisspeptin 을
24 시간동안 처리하였을 때, Gnrh 와 jun 의 mRNA 발현이 유의성 있게
증가하였다 (p < 0.001) (Figure 7). 이후 모든 GnRH 분비 유도 실험은 1µg 의 kisspeptin 을 24 시간 처리 조건으로 진행하였다.
- 26 -
Figure 7. Induction conditions of GnRH secretion in GT1-7 cells derived from mouse hypothalamus.
GT1-7 cells were treated with 1 µg of kisspeptin for the indicated times. RNAs were extracted from cells and cDNAs were synthesized. Quantitative RT-PCR was performed using the gene specific primers. The Gnrh (A) and Jun (B) mRNA levels were assessed after normalization to that of Gapdh.
- 27 -
The results are expressed as the fold change over the mRNA level of the mock and presented as mean values of two independent experiments, each performed with three samples. ***p <0.001.
- 28 -
F. Egr1 과발현에 의한 Gnrh 와 Kiss1r 발현 및 ERK 활성화 변화 조사
GT1-7 세포에서 Egr1 을 과발현 시킨 후 qRT-PCR 통하여 Egr1, Gnrh,
Kiss1r mRNA 발현 변화를 확인하였다. Egr1 이 과발현 된 것을 확인할 수
있었으며, 1µg kisspeptin 은 Egr1 mRNA 발현 변화에 영향을 주지 않았다 (Figure 8A). Egr1의 과발현은 Gnrh와 Kiss1r의 mRNA 발현에 크게 영향을 주지 않았다 (Figure 8B, C). 또한 Western blotting 을 통한 total-ERK 와 phospholyated-ERK 단백량을 비교 분석한 결과, Egr1 단백의 과발현은 ERK 발현에도 영향을 주지 않았다 (Figure 8D).
- 29 -
Figure 8. The results of Gnrh and Kiss1r mRNA expression and ERK activation upon overexpression of Egr1.
GT1-7 cells were treated with or without 1 µg of kisspeptin and transfected with or without the Egr1 overexpression construct. All cells were incubated for 24 hours. Total RNA was extracted from the cells and cDNA was synthesized; total cell lysate was prepared using a cell lysis buffer. (A, B, C) Quantitative RT-PCR was performed using gene specific primers. The Egr1 (A), Hspa9 (B) and Kiss1 (C)
- 30 -
mRNA levels were assessed after normalization to that of Gapdh. The results are expressed as the fold change over the mRNA level of the mock and presented as mean values of two independent experiments, each performed with three samples. *p <0.05, ***p <0.001. (D) Protein levels of Egr1, phosphorylated-ERK (p-ERK), total ERK (t-ERK), and β-actin were analyzed by Western blotting. Twenty microliters of each sample were loaded per well.
- 31 -
G. Hspa9 과발현에 의한 Gnrh 와 Kiss1r 발현 및 활성화 변화 조사
GT1-7 세포에서Hspa9을 과발현 시킨 후 qRT-PCR 통하여 Hspa9, Gnrh,
Kiss1r mRNA 발현 변화를 확인하였다. Hspa9 이 과발현 된 것을 확인할 수
있었으며, 1µg kisspeptin 은 Hspa9 mRNA 발현 변화에 영향을 주지 않았다 (Figure 9A). Hspa9 의 과발현은 Gnrh 와 Kiss1r 의 mRNA 발현에 크게 영향을 주지 않았다 (Figure 9B, C). 또한 Western blotting 을 통한 total-ERK 와 phospholyated-total-ERK 단백량을 비교 분석한 결과, Hspa9 단백의 과발현은 ERK 발현에도 영향을 주지 않았다 (Figure 9D).
- 32 -
Figure 9. The results of Gnrh and Kiss1r mRNA expression and ERK activation upon overexpression of Hspa9.
GT1-7 cells were treated with or without 1 µg of kisspeptin and transfected with or without the Hspa9 overexpression construct. All cells were incubated for 24 hours. Total RNA was extracted from the cells and cDNA was synthesized; total cell lysate was prepared using a cell lysis buffer. (A, B, C) Quantitative RT-PCR was
- 33 -
performed using gene specific primers. The Hspa9 (A), Gnrh (B), and Kiss1 (C) mRNA levels were assessed after normalization to that of Gapdh. The results are expressed as the fold change over the mRNA level of the mock and presented as mean values of two independent experiments, each performed with three samples. *p <0.05, ***p <0.001. (D) Protein levels of Hspa9, phosphorylated-ERK (p-ERK), total ERK (t-ERK), and β-actin were analyzed by Western blotting. Twenty microliters of each sample were loaded per well.
- 34 -
H. Etf1 과발현에 의한 Gnrh 와 Kiss1r 발현 및 ERK 활성화 변화 조사
GT1-7 세포에 Etf1 을 과발현 시킨 후 qRT-PCR 통하여 Etf1, Gnrh,
Kiss1r mRNA 발현 변화를 확인하였다. 1µg kisspeptin 은 Etf1 mRNA 발현
변화에 크게 영향을 주지 않았지만 (Figure 10A), Etf1 의 과발현은 Gnrh 와
Kiss1r 의 mRNA 발현을 현저하게 감소시켰다 (Figure 10B, C). 또한
Western blotting 을 통한 total-ERK 와 phospholyated-ERK 단백량을 비교 분석한 결과, Etf1 단백의 과발현은 Etf1 단백 농도에 의존적으로 phospho-ERK 의 발현량을 감소시켰다 (Figure 10D).
- 35 -
Figure 10. The results of Gnrh and Kiss1r mRNA expression and ERK activation upon overexpression of Etf1.
GT1-7 cells were treated with or without 1 µg of kisspeptin and transfected with or without the Etf1 overexpression construct. All cells were incubated for 24 hours. Total RNA was extracted from the cells and cDNA was synthesized; total cell lysate was prepared using a cell lysis buffer. (A, B, C) Quantitative RT-PCR was
- 36 -
performed using gene specific primers. The Etf1 (A), Gnrh (B), and Kiss1 (C) mRNA levels were assessed after normalization to that of Gapdh. The results are expressed as the fold change over the mRNA level of the mock and presented as mean values of two independent experiments, each performed with three samples. *p <0.05, ***p <0.001. (D) Protein levels of Etf1, phosphorylated-ERK (p-ERK), total ERK (t-ERK), and β-actin were analyzed by Western blotting. Twenty microliters of each sample were loaded per well.
- 37 - I. 다중회귀분석을 통한 성조숙증 조기진단 바이오마커 발굴 성조숙증 case-control GWAS 에서 가장 높은 유의성을 나타낸 rs10900855 SNP 을 포함 총 45 개의 SNP ( 𝑝 = 1.1 × 10−8 : 1 개, 𝑝 = 1.0 × 10−5: 7 개, 𝑝 = 1.0 × 10−4 : 37 개)에 대한 다중회귀분석을 진행하였다 (Table 4, Figure 11). 유의성이 높은 SNP 부터 순서대로 대입하여 정확도 (precision) 값 상승에 영향을 미치는 SNP 을 분석하였으며, 그 결과 민감도 66%, 특이도 88.6%, 정확도 81.2%로 매우 높은 예측률을 가지는 23 개의 SNP 을 바이오 마커로 최종 선정하였다 (Table 5).
- 38 -
Table 4. Multiple regression analysis of 45 SNPs for accuracy of precious puberty prediction.
- 39 -
Abbreviations: CHR, chromosome; SNP, single nucleotide polymorphism; A1, minor allele; NMISS, number of non-mission genotypes; OR, odds ratio; r2, coefficient of multiple correlation; and P, p- value.
- 40 -
Figure 11. Multiple regression analysis of 45 SNPs for the accuracy of precious puberty prediction.
Precision values of 45 SNPs discovered by case-control GWAS in Korean girls were plotted. ‘81.2’ indicates the maximum precision value in this multiple regression analysis.
- 41 -
Table 5. The 23 selected SNPs for the early diagnosis of precious puberty.
- 42 -
IV. 고찰
최근 우리나라 2017 년 ‘건강보험심사평가원’ 통계에 따르면 2006 년이후 10 년간 성조숙증 (질병분류기호 E301)으로 진료받은 인원이 약 12 배 이상 증가 것으로 보고되고 있다. 또한 국외 연구결과에 따르면 과거 30~40 년 전보다 사춘기 연령이 낮아진 것으로 보고되고 있다 (Kaplowitz, 2004). 성조숙증 환자가 급증함에 따라 사회적으로 큰 문제가 되고 있지만 현재 국내에서는 성조숙증에 대한 연구가 활발하게 진행되지 않는 실정이다. 또한 성조숙증은 치료의 시작 시기가 가장 중요한 질병임에도 불구하고 현재 시행되고 있는 GnRH 자극을 통한 진단 방법은 특이도는 높으나 민감도가 상대적으로 낮아 조기진단을 하는 데에는 한계점이 있다.본 연구에서는 성조숙증 case-control GWAS를 통해 EGR1, HSPA9, ETF1을 후보유전자를 선정하였으며, 암컷 마우스의 시상하부에서 성장시기별 발현패턴을 확인한 후 후보유전자 단백의 과발현을 통해 Gnrh와 Kiss1r 발현 및 ERK 시그널링 발현 패턴을 확인하였다.
EGR1 (Early growth response protein-1)은 뼈, 연골 근육 등 다양한 조직과 중추 신경계 및 말초신경계에도 부분적으로 위치하며 (McMahon et al., 1990), 대식세포 분화 및 T- 림프구 증식 그리고 내피세포 (endothelial cells)에서의 혈소판 유래 성장인자 (platelet-derived growth factor-B; PDGF) 발현을 조절하는 하는 것으로 알려져 있다 (Nguyen et al., 1993; Perez-Castillo et al., 1993; Khachigian et al., 1996). 본 연구에서 Egr1은 사춘기 시기동안 시상하부에서 mRNA 발현 증가한다는 것은 확인하였지만, Egr1의 과발현은 Gnrh 와 Kiss1r 발현 및 ERK 시그널링의 발현에는 영향을
- 43 -
미치지 못하였다. EGR1은 GnRH에 의해 발현이 조절되며, LHβ의 발현에 관여(Tremblay and Drouin, 1999) 한다는 연구결과가 있는 것으로 보아 EGR1이 사춘기 시기에 영향을 미치는 것은 분명하나, 그 역할이 시상하부가 아닌 뇌하수체에서 더 클 것으로 사료된다.
HSPA9 (Heat shock protein family A member 9) 은 세포증식 및
세포노화를 조절하는 역할을 하며, 골수이형성증후군 (Myelodysplastic syndrome; MDS)과 연관이 있는 것으로 알려져 있다 (Chen et al., 2011). 본 연구에서 Hspa9은 사춘기 시기동안 시상하부에서 mRNA 발현 변화가 없었으며, 과발현을 통한 Gnrh 와 Kiss1r 발현 및 ERK 시그널링의 발현에서도 영향을 주지 못하였지만 Hspa9 이 유의성이 가장 높았던 rs10900855 SNP 근처에 위치해 있는 것과 생식샘의 발달에 영향을 준다는 연구결과 (He et al., 2013)를 보았을 때 Hspa9은 성조숙증과 무관하지 않으며 HPG 축 중 생식샘 (gonadal) 과 연관성이 있을 것으로 사료된다.
ETF1 (Eukaryotic translation termination factor 1)은 진핵세포에서 번역의
종결에 직접적으로 관여하는 것으로 알려져 있다 (Frolova et al., 1994). 본 연구에서 ETF1 은 사춘기 시기동안 시상하부에서 mRNA 발현이 감소하는 것을 확인하였으며, Etf1 의 과발현은 Gnrh 와 Kiss1r 의 mRNA 의 발현을 현저하게 감소시켰으며 ERK 의 활성화도 감소시켰다. GnRH 는 PKC 의 활성화를 통하여 LH 와 FSH 분비를 조절하며 (Stojilkovic et al., 1994; Shacham et al., 1999), MAPKs (Mitogen-activated protein kinases)의 subfamilies 인 ERK, JUK, p38MAPK, BMK 의 활성화에 영향을 미친다고 알려져 있다 (Reiss et al., 1997; Levi et al., 1998). GnRH 에 의한 ERK 의 활성화 증가에 대한 연구는 계속해서 보고되고 있다 (Sundaresan et al., 1996;
- 44 -
Caunt et al., 2006). 이는 ETF1 이 HPG 축을 조절하는 유전인자 (genetic factor)임을 시사한다. Etf1 이 성조숙증과 연관성이 있으며 Gnrh 와 Kiss1r 보다 upstream 인 것이 본 연구를 통해 확인되었지만, 더 정확한 메커니즘에 관한 추가적인 연구가 필요하다. 결론적으로, 성조숙증 case-control GWAS를 통해 발굴한 8개의 SNP 중 가장 유의성이 높은 rs10900855 SNP은 ETF1 유전자상의 SNP일 가능성이 높으며, ETF1 유전자의 발현량 변화는 성조숙증과 밀접한 관련이 있을 것으로 사료된다. 본 연구 결과는 성조숙증에 관련된 연구와 임상 분야에 큰 영향을 미칠 수 있으며, 성조숙증의 유전적 연관성과 메커니즘을 연구와 하는 데 기여할 것으로 기대된다. 또한 다중회귀분석을 통해 선정된 성조숙증 발병 위험도와 연관된 23개의 SNP은 향후 바이오마커로서 성조숙증 진단 또는 치료 예후 및 예측에 활용될 수 있을 것으로 기대된다.
- 45 -
V. 결론
한국인 여아 성조숙증 코호트를 이용한 case-control 전장유전체분석 (GWAS) 발굴한 단일염기다형성(SNP) 중에서 Bonferroni correction p -value 유의성을 통과하는 rs10900855 SNP 의 500Kbp 내에 위치하는 유전자
EGR1, HSPA9, ETF1 에 대한 마우스 사춘기 시기의 발현 패턴 및 시상하부
세포주 과발현을 통한 Gnrh 와 Kiss1r의 mRNA 발현 및 ERK 활성화 변화를
분석한 결과 ETF1유전자가 성조숙증과 밀접한 관련이 있음을 밝혔다.
또한, 다중회귀분석을 통하여 rs1090855 SNP 을 포함한 23 개의 SNP 을 성조숙증 조기진단 바이오마커로 선정하였으며, 질환 예측 민감도는 66%, 특이도는 88.6%, 정확도는 81.2%로 나타났다. 이들 SNP 는 향후 성조숙증 조기진단 바이오마커로 활용될 수 있을 것으로 기대된다.
- 46 -
참고문헌
1. Abreu AP, Dauber A, Macedo DB, Noel SD, Brito VN, Gill JC, Cukier P, Thompson IR, Navarro VM, Gagliardi PC, Rodrigues T, Kochi C, Longui CA, Beckers D, de Zegher F, Montenegro LR, Mendonca BB, Carroll RS, Hirschhorn JN, Latronico AC, Kaiser UB: Central precocious puberty caused by mutations in the imprinted gene MKRN3. N Engl J Med 368: 2467-2475, 2013
2. Bruk I, Dancaster CP, Jackson WP: Granulosa-cell tumours causing precocious puberty; oestrogen fractionations in two patients. Br Med J 2: 26-28, 1960
3. Buck Louis GM, Gray LE, Jr., Marcus M, Ojeda SR, Pescovitz OH, Witchel SF, Sippell W, Abbott DH, Soto A, Tyl RW, Bourguignon JP, Skakkebaek NE, Swan SH, Golub MS, Wabitsch M, Toppari J, Euling SY: Environmental factors and puberty timing: expert panel research needs.
Pediatrics 121 Suppl 3: S192-207, 2008
4. Carel JC, Lahlou N, Roger M, Chaussain JL: Precocious puberty and statural growth. Hum Reprod Update 10: 135-147, 2004
5. Carel JC, Leger J: Clinical practice. Precocious puberty. N Engl J Med 358: 2366-2377, 2008
6. Caunt CJ, Finch AR, Sedgley KR, McArdle CA: GnRH receptor signalling to ERK: kinetics and compartmentalization. Trends Endocrinol Metab 17: 308-313, 2006
- 47 -
7. Cesario SK, Hughes LA: Precocious puberty: a comprehensive review of literature. J Obstet Gynecol Neonatal Nurs 36: 263-274, 2007
8. Cortes ME, Carrera B, Rioseco H, Pablo del Rio J, Vigil P: The Role of Kisspeptin in the Onset of Puberty and in the Ovulatory Mechanism: A Mini-review. J Pediatr Adolesc Gynecol 28: 286-291, 2015
9. Dimitrova-Mladenova MS, Stefanova EM, Glushkova M, Todorova AP, Todorov T, Konstantinova MM, Kazakova K, Tincheva RS: Males with Paternally Inherited MKRN3 Mutations May Be Asymptomatic. J Pediatr 179: 263-265, 2016
10. Dungan HM, Clifton DK, Steiner RA: Minireview: kisspeptin neurons as central processors in the regulation of gonadotropin-releasing hormone secretion. Endocrinology 147: 1154-1158, 2006
11. Elks CE, Perry JR, Sulem P, Chasman DI, Franceschini N, He C, Lunetta KL, Visser JA, Byrne EM, Cousminer DL, Gudbjartsson DF, Esko T, Feenstra B, Hottenga JJ, Koller DL, Kutalik Z, Lin P, Mangino M, Marongiu M, McArdle PF, Smith AV, Stolk L, van Wingerden SH, Zhao JH, Albrecht E, Corre T, Ingelsson E, Hayward C, Magnusson PK, Smith EN, Ulivi S, Warrington NM, Zgaga L, Alavere H, Amin N, Aspelund T, Bandinelli S, Barroso I, Berenson GS, Bergmann S, Blackburn H,
Boerwinkle E, Buring JE, Busonero F, Campbell H, Chanock SJ, Chen W, Cornelis MC, Couper D, Coviello AD, d'Adamo P, de Faire U, de Geus EJ, Deloukas P, Doring A, Smith GD, Easton DF, Eiriksdottir G, Emilsson V, Eriksson J, Ferrucci L, Folsom AR, Foroud T, Garcia M, Gasparini P,
- 48 -
Geller F, Gieger C, Consortium G, Gudnason V, Hall P, Hankinson SE, Ferreli L, Heath AC, Hernandez DG, Hofman A, Hu FB, Illig T, Jarvelin MR, Johnson AD, Karasik D, Khaw KT, Kiel DP, Kilpelainen TO, Kolcic I, Kraft P, Launer LJ, Laven JS, Li S, Liu J, Levy D, Martin NG, McArdle WL, Melbye M, Mooser V, Murray JC, Murray SS, Nalls MA, Navarro P, Nelis M, Ness AR, Northstone K, Oostra BA, Peacock M, Palmer LJ, Palotie A, Pare G, Parker AN, Pedersen NL, Peltonen L, Pennell CE, Pharoah P, Polasek O, Plump AS, Pouta A, Porcu E, Rafnar T, Rice JP, Ring SM, Rivadeneira F, Rudan I, Sala C, Salomaa V, Sanna S,
Schlessinger D, Schork NJ, Scuteri A, Segre AV, Shuldiner AR, Soranzo N, Sovio U, Srinivasan SR, Strachan DP, Tammesoo ML, Tikkanen E, Toniolo D, Tsui K, Tryggvadottir L, Tyrer J, Uda M, van Dam RM, van Meurs JB, Vollenweider P, Waeber G, Wareham NJ, Waterworth DM, Weedon MN, Wichmann HE, Willemsen G, Wilson JF, Wright AF, Young L, Zhai G, Zhuang WV, Bierut LJ, Boomsma DI, Boyd HA, Crisponi L, Demerath EW, van Duijn CM, Econs MJ, Harris TB, Hunter DJ, Loos RJ, Metspalu A, Montgomery GW, Ridker PM, Spector TD, Streeten EA, Stefansson K, Thorsteinsdottir U, Uitterlinden AG, Widen E, Murabito JM, Ong KK, Murray A: Thirty new loci for age at menarche identified by a meta-analysis of genome-wide association studies. Nat Genet 42: 1077-1085, 2010
12. Francis RC, Soma K, Fernald RD: Social regulation of the brain-pituitary-gonadal axis. Proc Natl Acad Sci U S A 90: 7794-7798, 1993
- 49 -
13. Frolova L, Le Goff X, Rasmussen HH, Cheperegin S, Drugeon G, Kress M, Arman I, Haenni AL, Celis JE, Philippe M, et al.: A highly conserved eukaryotic protein family possessing properties of polypeptide chain release factor. Nature 372: 701-703, 1994
14. Gojska NM, Friedman Z, Belsham DD: Direct regulation of gonadotrophin-releasing hormone (GnRH) transcription by RF-amide-related peptide-3 and kisspeptin in a novel GnRH-secreting cell line, mHypoA-GnRH/GFP. J
Neuroendocrinol 26: 888-897, 2014
15. Handa RJ, Burgess LH, Kerr JE, O'Keefe JA: Gonadal steroid hormone receptors and sex differences in the hypothalamo-pituitary-adrenal axis.
Horm Behav 28: 464-476, 1994
16. He Y, Luo M, Yi M, Sheng Y, Cheng Y, Zhou R, Cheng H: Identification of a testis-enriched heat shock protein and fourteen members of Hsp70 family in the swamp eel. PLoS One 8: e65269, 2013
17. Herman-Giddens ME, Slora EJ, Wasserman RC, Bourdony CJ, Bhapkar MV, Koch GG, Hasemeier CM: Secondary sexual characteristics and menses in young girls seen in office practice: a study from the Pediatric Research in Office Settings network. Pediatrics 99: 505-512, 1997
18. Kaminski BA, Palmert MR: Genetic control of pubertal timing. Curr Opin
Pediatr 20: 458-464, 2008
19. Kaplowitz P: Clinical characteristics of 104 children referred for evaluation of precocious puberty. J Clin Endocrinol Metab 89: 3644-3650, 2004
- 50 -
20. Kong L, Tang M, Zhang T, Wang D, Hu K, Lu W, Wei C, Liang G, Pu Y: Nickel nanoparticles exposure and reproductive toxicity in healthy adult rats. Int J Mol Sci 15: 21253-21269, 2014
21. Levi NL, Hanoch T, Benard O, Rozenblat M, Harris D, Reiss N, Naor Z, Seger R: Stimulation of Jun N-terminal kinase (JNK) by gonadotropin-releasing hormone in pituitary alpha T3-1 cell line is mediated by protein kinase C, c-Src, and CDC42. Mol Endocrinol 12: 815-824, 1998
22. McGeorge M, Connor DV: A case of precocious puberty in a female. Arch
Dis Child 36: 439-448, 1961
23. Mellon PL, Windle JJ, Goldsmith PC, Padula CA, Roberts JL, Weiner RI: Immortalization of hypothalamic GnRH neurons by genetically targeted tumorigenesis. Neuron 5: 1-10, 1990
24. Nam HK, Rhie YJ, Son CS, Park SH, Lee KH: Factors to predict positive results of gonadotropin releasing hormone stimulation test in girls with suspected precocious puberty. J Korean Med Sci 27: 194-199, 2012 25. Oh YJ, Rhie YJ, Nam HK, Kim HR, Lee KH: Genetic Variations of the
KISS1R Gene in Korean Girls with Central Precocious Puberty. J Korean
Med Sci 32: 108-114, 2017
26. Palmert MR, Boepple PA: Variation in the timing of puberty: clinical spectrum and genetic investigation. J Clin Endocrinol Metab 86: 2364-2368, 2001
27. Reiss N, Llevi LN, Shacham S, Harris D, Seger R, Naor Z: Mechanism of mitogen-activated protein kinase activation by gonadotropin-releasing
- 51 -
hormone in the pituitary of alphaT3-1 cell line: differential roles of calcium and protein kinase C. Endocrinology 138: 1673-1682, 1997
28. Shacham S, Cheifetz MN, Lewy H, Ashkenazi IE, Becker OM, Seger R, Naor Z: Mechanism of GnRH receptor signaling: from the membrane to the nucleus. Ann Endocrinol (Paris) 60: 79-88, 1999
29. Silveira LG, Noel SD, Silveira-Neto AP, Abreu AP, Brito VN, Santos MG, Bianco SD, Kuohung W, Xu S, Gryngarten M, Escobar ME, Arnhold IJ, Mendonca BB, Kaiser UB, Latronico AC: Mutations of the KISS1 gene in disorders of puberty. J Clin Endocrinol Metab 95: 2276-2280, 2010 30. Stojilkovic SS, Reinhart J, Catt KJ: Gonadotropin-releasing hormone
receptors: structure and signal transduction pathways. Endocr Rev 15: 462-499, 1994
31. Sundaresan S, Colin IM, Pestell RG, Jameson JL: Stimulation of mitogen-activated protein kinase by gonadotropin-releasing hormone: evidence for the involvement of protein kinase C. Endocrinology 137: 304-311, 1996 32. Teilmann G, Pedersen CB, Jensen TK, Skakkebaek NE, Juul A: Prevalence
and incidence of precocious pubertal development in Denmark: an epidemiologic study based on national registries. Pediatrics 116: 1323-1328, 2005
33. Teles MG, Bianco SD, Brito VN, Trarbach EB, Kuohung W, Xu S, Seminara SB, Mendonca BB, Kaiser UB, Latronico AC: A GPR54-activating mutation in a patient with central precocious puberty. N Engl J
- 52 -
34. Weltzien FA, Andersson E, Andersen O, Shalchian-Tabrizi K, Norberg B: The brain-pituitary-gonad axis in male teleosts, with special emphasis on flatfish (Pleuronectiformes). Comp Biochem Physiol A Mol Integr Physiol 137: 447-477, 2004
- 53 -
- ABSTRACT -
Functional study of susceptibility genes to precocious puberty
identified by genome-wide association analysis in Korean girls
Mi Ran Jo
Department of Medical Sciences
The Graduate School, Ajou University
(Supervised by Professor Seon-Yong Jeong)
Central precocious puberty results from the premature activation of the hypothalamic-pituitary-gonadal axis and is clinically defined by the development of secondary sexual characteristics before the age of 8 years in girls and 9 years in boys. Incidence of precocious puberty in Korean girls is estimated to be 3.3 to 50.4 per 100,000 girls during the study period (2004–2010), and recent studies have reported that it is increasing significantly in Korea. Genome-wide association studies (GWASs) are very powerful tools for the identification of susceptibility loci for diseases and traits. Our previous case-control GWAS with 300 controls and 699
- 54 -
cases identified one SNP (p-value=1.1×10-8), which was below the genome wide significance level (p<5.0×10-8) and had a very high disease odds ratio (OR>2.0).
In this study, I aimed to identify the gene(s) effected by this SNP and elucidate how the SNP affects precocious puberty in vitro. Because, three genes, EGR1,
HSPA9, and ETF1, were located close to this SNP, I firstly investigated whether the
mRNA expression patterns of these genes in mouse hypothalamus altered during puberty. EGR1 and ETF1 gene expression were significantly changed 22 ~30 days after birth (puberty period). Next, I overexpressed these genes in mouse hypothalamus cells GT1-7, gonadotrophin-releasing hormone (GnRH)-producing cells, and then assessed the gene expression levels of the precocious puberty enhancing markers Gnrh and Kiss1r. Only Etf1 over expression significantly reduced
Gnrh and Kiss1r expression. Notably, the activated form of ERK
(phosphorylated-ERK) which is involved in GnRH production was decreased in an Eff1 dose dependent manner.
These results suggest that ETF1 gene expression levels may be closely engaged in the pathogenesis of precocious puberty in girls.
_________________________________________________________________ Key words: precocious puberty, early diagnosis, genetic biomarker, genetic variants, single genome-wide association study (GWAS), nucleotide polymorphism (SNP), gonadotrophin-releasing hormone (GnRH), hypothalamus, ETF1 gene