중간엽 줄기세포를 이용한 추간판내 유전자 치료:
퇴행성 추간판 질환에서 치료적 의미
연세대학교 대학원
의 학 과
중간엽 줄기세포를 이용한 추간판내 유전자 치료:
퇴행성 추간판 질환에서 치료적 의미
지도 김 학 선 교수
이 논문을 석사 학위논문으로 제출함
2004년 12월 일
연세대학교 대학원
의 학 과
송 기 홍
송기홍의 석사 학위논문을 인준함
심사위원 인
심사위원 인
심사위원 인
연세대학교 대학원
2004년 12월 일
감사의 글
본 논문을 완성하기까지 지도해 주신 김학선 교수님,
자문에 응하여 주신 문성환 교수님과 서활 교수님께 진심
으로 감사드리며, 정성을 다하여 도와주신 정형외과 선생
님들께 감사드립니다.
또한 지금까지 키워주신 부모님과 아낌없는 격려를 보
내준 아내에게 감사드립니다.
저자 씀
차 례
국문요약 ··· 1 Ⅰ. 서론 ··· 3 Ⅱ. 연구대상 및 방법 ··· 5 1. 추간판 조직 채취 및 배양 ··· 5 2. 중간엽 줄기세포의 분리 및 배양 ··· 6 3. 아데노바이러스 재조합 ··· 7 4. 추간판세포와 중간엽 줄기세포의 3차원 배양법 ··· 7 5. 시험관내 아데노바이러스 감염 술식 및 실험군 ··· 8 6. 세포 증식 반응 ··· 8 7. 기질 생성 측정 ··· 98. 세포 표현형 측정 (Aggrecan, collagen type I, type II mRNA 발현) ··· 9
9. 통계 ···10 Ⅲ. 결과 ···11 1. 세포 증식 반응 ···11 2. 신생 당단백 생성 ···11 3 추간판세포 표현형의 발현 ···14 Ⅳ. 고찰 ···16 Ⅴ. 결론 ···18 REFERENCE ···19 Abstract ···24
그 림 목 차
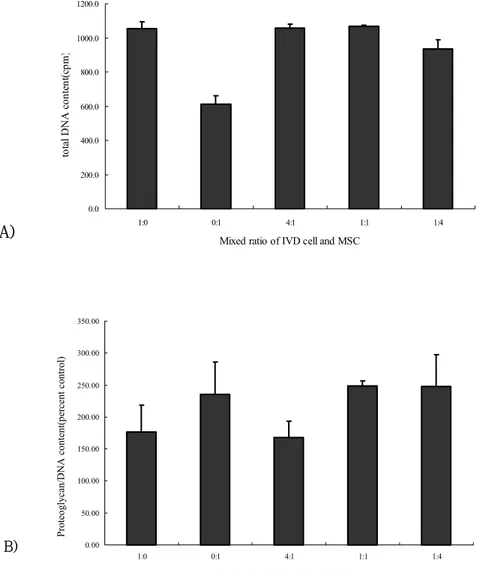
Fig 1. A) total DNA content in three dimensional culture of IVD cells and MSCs, B)Newly synthesized proteoglycan in three dimensional culture of IVD cells and MSCs presented as percent control. Mixed cultures with IVD cells and MSCs equalled or quite decreased in newly synthesized proteoglycan comparing only IVD cell cultures (p〈0.05). ···12
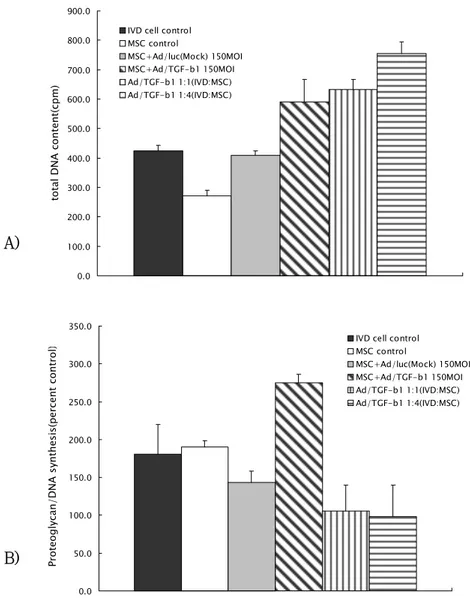
Fig 2. A) total DNA content in three dimensional culture of IVD cells and Ad/TGF-β1-transduced MSCs, B) Newly synthesized proteoglycan in three dimensional culture of IVD cells and Ad/TGF-β1-transduced MSCs presented as percent control (p〈0.05). ···13 Fig 3. RT-PCR for aggrecan, collagen type I, and collagen type II in three
dimensional culture of IVD cells and MSCs. β-actin was used for normalization.
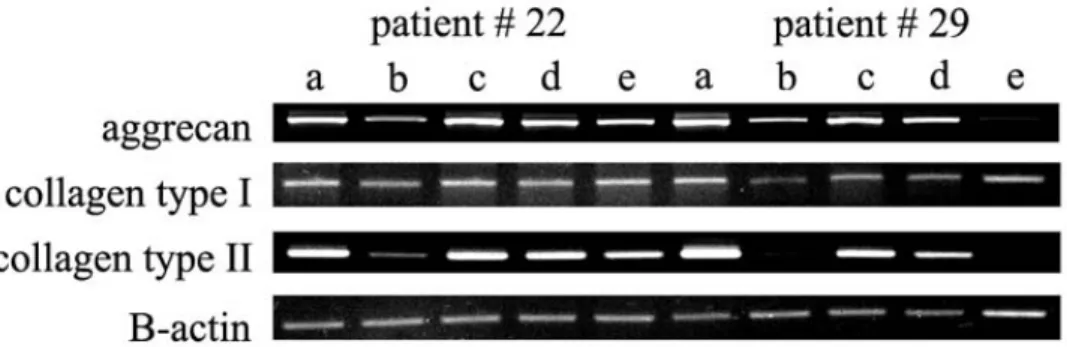
Mixed ratio of IVD cells and MSCs are a) 1:0, b) 0:1, c)4:1, d) 1:1, e) 1:4. ····14 Fig 4. RT-PCR for aggrecan, collagen type I, and collagen type II in three
dimensional culture of IVD cells and Ad-transduced MSCs. β-actin was used for normalization. a) only IVD cells, b) only MSC, c) only Ad/luc-transduced MSC [Mock], d) only Ad/TGF-β1-transduced MSC [Ad/TGF-β1-MSC], e) [IVD cells : Ad/TGF-β1-MSC] 1:1, f) [IVD cells : Ad/TGF-β1-MSC] 1:4. ···15
표 목 차
국문 요약
중간엽 줄기세포를 이용한 추간판내 유전자 치료:
퇴행성 추간판 질환에서 치료적 의미
연구 구도 치료 유전자를 가진 제 5형 아데노바이러스, 인간 중간엽 줄기세포, 추간 판세포를 이용하여 시험관내 연구를 진행하였다. 연구 목적 본 연구에서는 인간의 중간엽 줄기세포에 TGF-β1-유전자를 전달하고 이를 통한 추간판세포의 기질 재생능을 확인하고자 하였다. 대상 및 방법 척추 질환으로 수술한 환자에게서 골수와 추간판을 채취하여 인간 중간엽 줄기세포와 추간판 세포를 각각 분리 배양하였다. 치료 유전자로 TGF-β1를 이용하여, 제 5형 아데노바이러스에 전달하였다. 미리 배양된 인간 중간엽 줄 기 세포에 TGF-β1 유전자가 들어 있는 제 5형 아데노바이러스(Ad/TGF-β1) 를 전이시킨 후, 추간판세포와 TGF-β1 유전자가 전이된 중간엽 줄기 세포를 섞어서 alginate를 이용한 3차원 배양을 실시하였다. [methyl-3H] Thymidine
을 이용해 세포 증식능을 확인하고, [35S]Sulfur를 이용해 당단백 생성능을 확 인하였다. 또한 전사 수준에서의 추간판세포 관련 유전자의 변화를 확인하고 자 RT-PCR을 통한 densitometry로 분석하였다. 결과 인간 중간엽 줄기세포와 추간판세포의 혼합배양시, 신생 당단백의 생성은 추간판세포만을 단독 배양하였을 때와 거의 같은 수준을 유지하였다. Ad/TGF-β1이 전이된 중간엽 줄기세포와 추간판세포를 혼합 배양한 경우,
중간엽 줄기세포의 비율이 증가함에 따라 신생 당단백의 합성이 현저히 감소 하였다. 전사수준에서 Aggrecan과 collagen type II의 합성에있어서도 같은 결과를 얻었다. 그러나 collagen type I의 경우에는 중간엽 줄기세포의 비율이 증가함에 따라 발현양이 점진적으로 증가하였다. 결론 인간 중간엽 줄기세포의 추간판세포에 대한 세포 치료능은 세포 수율 증 가 면에서의 가능성은 제시했다 하겠지만, 중간엽 줄기세포를 통한 유전자 치 료의 면에서는 연골 세포 표현형을 유지하지 못했다. 핵심되는 말 : 인간 중간엽 줄기세포, 추간판세포, TGF-β1, 아데노바이러 스, 유전자 치료
중간엽 줄기세포를 이용한 추간판내 유전자 치로:
퇴행성 추간판 질환에서 치료적 의미
<지도교수 김 학 선> 연세대학교 대학원 의학과송 기 홍
Ⅰ. 서 론
척추 추간판의 퇴행성 변화와 그에 연관된 척추의 질환들 (추간판 탈출증, 척추 신경 병변, 척추관 협착증, 경추 척추증, 퇴행성 척추증 등)은 환자에게 심대한 고통을 끼치며 이로 인한 의료비용도 나날이 증가하고 있다1). 추간판 의 퇴행성 변화는 점진적인 당단백 (proteoglycan)과 2형 교원질 (type II collagen)의 감소로 인해 수핵 (nucleus pulposus) 내의 수분 분압이 감소하여2-8), 결과적으로 척추 후관절 및 척추체에 전반적인 퇴행성 병변을 일으키게 된다9). 현재까지 척추 추간판의 퇴행성 질환의 치료는 물리치료 혹은 진통제 투여 등 보존적 요법이나 추간판 제거, 척추 유합 등 고식적인 방법이었다 8,10-11) . 특히 현재까지 척추 추간판의 퇴행성 변화를 예방한다거나 퇴행성 변 화를 역행시켜 추간판을 정상에 가깝게 회복시키는 등의 근원적인 치료는 시 행되지 않았다. 이와는 대조적으로 여러 종류의 성장인자들 (transforming growth factor-ß1, osteogenic protein-1, insulin like growth factor-1)을 시험관내 의 추간판 조직에 주입하여 기질의 생성을 유도한 실험들이 시도되었으며
12-15) , 이러한 성장인자들의 기질(matrix) 생성능력은 추간판 퇴행에 적용 가능한 접근법으로 제시되기도 하였다. Nishimura16)등은 자가 수핵을 채취하여 퇴행된 추간판 부위에 재주입하 는 술식을 수행하였는데, 이로 인해 일부 추간판의 퇴행을 감소시키는 효과를 얻을 수 있었으며, Okuma17)등은 수핵부와 섬유륜부의 조직을 채취하여 공동 배양한 후, 양 세포간의 생화학적인 작용 기전을 활성화시켜 추간판 부위에 재 주입함으로써 치료 효과가 있음을 보고하였다. 이러한 개념들은 추간판의 퇴행에 대한 치료에 있어서 세포이식을 통해 추간판의 퇴행을 일부 지연시키 거나 재생시킬 수 있다는 대안을 제시한 것이다. 한편 생물학적으로 중요한 단백질의 유전자의 염기서열이 밝혀지고 이러 한 유전자의 조작 및 바이러스 재조합 기술의 발전으로 이제는 체세포로 유전 자를 전달하여 생물학적 효과를 기대하는 유전자치료법이 각광을 받고 있으며 18-20) , 유전자 치료는 외부에서 원하는 유전자를 전달체(vector)를 이용해서 세 포내로 전달하고, 지속적으로 유전자를 발현하게 하여 원하는 산물을 내부적 으로 생산하게 함으로써 생물학적 효과를 지속적으로 얻는 치료개념이다21-24). 유전자 치료의 경우는 한번의 유전자 전달로도 지속적인 유전자 발현을 유지 하여 만성 경과를 취하는 질환에 특히 그 강점을 발휘하는 세련된 약물 공급 기전의 하나이다. 그러나 추간판 변성을 지연 혹은 역전시키기 위해서는 내재한 추간판세포 를 전술한 유전자 전달 등으로 생물학적으로 자극을 주어 추간판 기질 생성을 유도함으로써 치료적 효과를 얻을 수 있으나 퇴행이 한계 이상으로 진행된 경 우는 가용한 추간판세포의 숫자가 체외 전달된 치료적 유전자로서 의미 있는 생물학적 효과를 얻기에는 절대적으로 부족할 수도 있으며 이는 유전자 치료 같은 생물학적 방법의 적용을 제한하는 요소로 작용할 수 있다. 그러므로 퇴 행성 추간판 질환의 치료에 있어 치료적 유전자 전달뿐만 아니라 세포 치료의 개념이 도입 되어야한다.
인간 중간엽 줄기세포는 골수 등에 다수 존재하는 미분화 세포로, 다양한 외부적인 자극에 의해 비만세포, 조골세포, 근세포, 그리고 연골세포등으로의 분화 가능성이 이미 증명 되었으며, 다양한 질환에 있어서 이러한 인간 중간 엽 줄기세포의 이식을 통해 성공적인 치료 효과를 확인할 수 있다25-30). 인간 의 추간판세포는 이미 연골세포와 기질 분포 등 여러 가지 면에서 매우 유사 함이 밝혀져 있으므로, 이러한 미분화된 인간 중간엽 줄기세포에 기질생성을 향상 시킬 수 있는 유전자를 전달하여, 연골세포와 유사한 형태로 분화를 도 모하면서 추간판 조직에 이식한다면 유전자, 세포 치료 단독 사용의 한계점을 극복할 수 있으리라 예상된다. 본 연구의 목적은 골수로부터 쉽게 분리 가능한 인간 중간엽 줄기세포에 치료적 유전자를 전달하여 유전자 조작된 중간엽 줄기세포에 의한 추간판세포 의 기질 생성 반응을 확인하고, 추간판세포와 공동 배양하였을 때 유전자 조 작된 중간엽 줄기세포에 의해 더욱 향상된 기질 생성 반응이 있는지 여부를 확인하고자 하였다.
Ⅱ. 연구 대상 및 방법
1. 추간판 조직 채취 및 배양 요추 추간판 탈출증, 요추 척추관 협착증 등의 척추 질환으로 수술을 시 행한 5명의 환자로부터 추간판 조직을 채취하였다. 척추관내로 탈출된 추간 판 조직은 엄격히 제외하고 역시 척추 연골판 조직도 육안으로 제외하였으며 추간판의 수핵 및 내측 섬유륜 부위의 조직만을 채취하였다. 채취된 추간판 조직은 수술 전 자기공명영상 검사 상 퇴행정도를 분류하여 퇴행정도에 따른 생물학적 반응의 영향을 없애기 위해 grade III, IV의 퇴행된 추간판을 대상 으로 하였다. 통상 채취 후 20분 내에 수술실에서 실험실로 옮긴 후, 채취된추간판 조직을 혈액 및 체액을 제거하기 위해 Dulbecco's Phosphate-Buffered saline (D-PBS, Invitrogen, Grand Island, NY) 으로 세척한 후, 추간판세포는 순차적 효소 소화법으로 조직에서 분리하였다. 즉, 먼저 세척된 추간판 조직을 잘게 썬 다음 5% 우태아 혈청 (FBS, JRH BIOSCIENCES, Lenexa, KS), 0.2% pronase (Sigma, St. Louis, MO), 0.004% deoxyribonuclease II type IV (DNAse, Sigma, St. Louis, MO)를 포함한 Ham's F-12 medium (Invitrogen, Grand Island, NY)을 이용하여 3 7℃에서 60분간 소화시켰다. D-PBS로 세척 한 후, 상기의 효소 용액에서 pronase를 0.02% collagenase type II (Worthington Biochemical Corp., Lakewood, NJ)로 대치시킨 제2의 효소용액으로 역시 37°C에서 4시간 정도 소화시켰다. 분리된 추간판세포는 Ham‘s F-12 medium and Dulbeccos Modified Eagle Medium (DMEM/F12, Invitrogen, Grand Island, NY)으로 세척 후 nylon 여과지 (pore size 75 μm)를 사용하여 부유 조직을 제거하고
세포 생존성 검사 및 세포밀도를 계산한 후 5x105 cells/ml의 밀도로
25cm2-EasYFlaskTM (Nunc, Rockilde, Denmark)에서 배양하였다. 세포 배양
액은 10% FBS, 25ug/ml ascorbic acid, 1% v/v penicillin, streptomycin, nystatin (all antibiotics from Invitrogen, Grand Island, NY)을 함유한
DMEM/F12 배양액을 사용하였다. 추간판세포는 3주간 5%의 CO2를 포함한
37°C 습윤 배양기에서 배양하였고, 배양액은 3일에 한번씩 새로운 배양액으 로 교체하였다.
2. 중간엽 줄기세포의 분리 및 배양
추간판 조직을 채취한 환자로부터 획득한 10ml의 골수 용출액에 10% FBS 를 포함한 Low glucose-Dulbecco's Minimal Essential Medium (DMEM-LG, Invitrogen, Grand Island, NY) 배양액 20ml을 넣고 원심 분리하여 침전물을 모
으고 상층에 뜬 지방층을 버렸다. 모아진 침전물을 배양액 10ml로 부유하여
Ficoll-PaqueTM PLUS (Amersham pharmacia, Uppsala, Sweden)를 이용하여 밀
도 구배법으로 분류하였다. 낮은 밀도 층에 모아진 중간엽 줄기세포를 배양액
으로 헹구고 25cm2-EasYFlaskTM (Nunc, Rockilde, Denmark)에 유핵 세포를 깔
고, 분리한 세포를 5%의 CO2를 포함한 37°C 습윤 배양기에서 5일간 배양한 후, 부착성이 없는 세포를 제거하고 새로운 배양액을 첨가하였다. 배양액은 3 일에 한번씩 새로운 배양액으로 교체하였다. 3. 아데노바이러스 재조합 E1 및 E3 유전자부분이 결여돼 성장이 제한된 제 5형 아데노바이러스를 vector로 사용하였다. E1 유전자 부위에 표식 유전자로 luciferase 유전자를 (Ad/luc), 치료 유전자로 TGF-β1 유전자를(Ad/TGF-β1) 재조합하였다. 재 조합된 유전자는 cytomegalovirus promotor에 의해 강제 발현되며, 재조합된 아데노바이러스는 293 세포에서 증식하였으며, CsCl 밀도 구배법으로 분리 정제하여, 1x10 12 paricles/ml의 농도로 1.5ml 원심분리 tube에 등분하여 -70°C 냉동고에 저장하였다. 또한 바이러스의 particle 수와 감염 가능한 particle 수는 1:100의 비율로 결정하여 실험을 수행하였다. 4. 추간판세포와 중간엽 줄기세포의 3차원 배양법
0.15M NaCl에 2.4%로 녹인 low viscosity alginic acid (Sigma, St. Louis, MO)를 미리 혼합한 세포와 정확히 1/2씩 섞어 alginic acid용액의 농
도가 1.2%가 되도록 준비했다. 최종 세포의 숫자는 2x106 cells/ml이 된다.
26G의 1cc 주사기를 이용하여, 24well plate에 미리 담아 둔 102mM CaCl2
게 한다. 혼합액 방울은 well당 10개가 되도록 했다. 방울로 떨어진 혼합액이 완전히 polymerization이 되도록 10분간 상온에서 방치했다. 0.15M NaCl용액 으로 두차례 세척한 후, 세포를 배양할 10% FBS, 25ug/ml ascorbic acid, 1% v/v penicillin, streptomycin (all antibiotics from Invitrogen, Grand Island, NY)을 함유한 DMEM/F12 배양액으로 한 번 더 세척한 후, 다시 세
포배양액을 well 당 1ml씩 첨가하여 5%의 CO2를 포함한 37°C 습윤 배양기 에서 추가로 7일간 배양하였다. 5. 시험관내 아데노바이러스 감염 술식 및 실험군 배양된 중간엽 줄기세포의 배양액을 제거한 후 D-PBS로 두 번 세척하여, 대조군은 5% FBS가 포함된 DMEM-LG 배양액만을, 실험군에는 표식인자가 재 조합된 Ad/luc 또는 치료 유전자가 재조합된 Ad/TGF-β1를 각각 5% FBS가 포함된 DMEM-LG 배양액으로 희석하여 중간엽 줄기세포에 첨가하였다. 표식 유전자 실험에서 구한 100% 감염을 달성할 수 있는 아데노바이러스의 농도를 참고하여 아데노바이러스는 각 군당 150MOI가 되도록 첨가하였다. 재조합 아 데노바이러스를 첨가한 중간엽 줄기세포는 5%의 CO2를 포함한 37°C 습윤 배양기에서 24시간 추가 배양하였다. 추가 배양한지 24시간이 지난 후, 추간 판세포와 아데노바이러스로 감염된 중간엽 줄기세포를 모두 0.25% Trypsin, 1mM EDTA로 배양 접시에서 분리하여 세포수를 센 후, 각각을 4x106 cells/ml 이 되도록 배양액으로 희석하였다. 추간판세포와 중간엽 줄기세포간의 비율이 1:0, 0:1, 1:1, 1:4 가 되도록 섞은 후, alginic acid를 이용하여 3차원 배양을 실 시하였다. 6. 세포 증식 반응
추간판세포와 중간엽 줄기세포를 혼합 3차원 배양을 실시한지 7일째 되는
날, 배양액을 [methyl-3H]Thymidine (Amersham pharmacia, Uppsala,
Sweden) 5μCi/ml이 첨가된 기본 배지로 교체하여 24시간 동안 배양하였다. 24시간 후 세포를 cell harvester를 이용하여 Glass microfibre filter (Whatman, Maidstone, England)에 흡착시킨 후, D-PBS로 수차례 세척하여
unbounded [methyl-3H]Thymidine을 완전히 제거했다. 16시간동안 상온에서
membrane을 완전히 말린 후, membrane을 scintillation vials에 담아서 Liquid scintillation cocktail 용액 (Beckman, Fullerton, CA)을 3ml 첨가하여, 상온에서 16시간 이상 방치하여 DNA가 노출되도록 하였다. β-scintillation counter (Packard, Downers Grove, IL)를 이용해 DNA의 양을 측정하였다.
7. 기질 생성 측정
추간판세포와 중간엽 줄기세포를 혼합 3차원 배양을 실시한지 7일째 되는
날, 배양액을 [35S]-Sulfur (Amersham pharmacia, Uppsala, Sweden) 20μCi/ml
이 첨가된 기본 배지로 교체하고 4시간 추가 배양 후, 8M guanidine hydrochloride, 20mM EDTA, 그리고 proteinase inhibitors 혼합액을 세포 배양 에 첨가하여 4°C 에서 48시간 동안 당단백을 추출하였다. 방사선동위원소로 표식되는 당단백의 정량적인 분석을 위해 Sephadex G-25M을 포함한 PD-10 column (Amersham pharmacia, Uppsala, Sweden)으로 통과시켜 순차적으로 용 출한 후, Liquid scintillation cocktail 용액 (Beckman, Fullerton, CA)을 6ml을 첨가하여 섞은 후, 16시간 상온에서 방치했다. 제 2, 3, 4 번째의 용출 용액만 을 β-scintillation counter (Packard, Downers Grove, IL)를 통해 새로이 생성 된 당단백양을 측정하였다.
3차원 배양한 세포 bead에 28mM EDTA (pH8.0), 0.15M NaCl용액을 첨가 하여 depolymerization 시킨 후, RNeasy mini kit (QIAGEN, Maryland, USA)를
이용하여 총 RNA를 분리하였다. 분리한 총 RNA 1㎍에 Oligo d(T)16 primer
2.5μM (Invitrogen, Grand Island, NY)을 첨가하여 70°C에서 5분간 annealing 시킨 후, RT premix (Bioneer, 대전, 한국)를 이용하여 42°C에서 1시간, 95°C에서 5분, 4°C에서 5분간 반응하여 cDNA를 합성하였다. 합성한 cDNA 1ul를 각각의 primer 10pmol/ul씩을 첨가하여 최종 부피가 20ul가 되도록 한 후 PCR premix (Bioneer, 대전, 한국)를 이용하여 PCR을 실시하였다 (Table1). RT-PCR에 대한 internal control로 β-actin을 사용하였으며, 유전자 발현 정도 를 TINA program을 이용하여 비교 분석하였다.
9. 통계
자료는 SPSS (SPSS Inc. Chicago IL)를 이용하여 처리하였으며 One-way ANOVA 및 Fisher's protected LSD post-hoc test로 실험군간 비교하였다. 통계 방법의 유의 수준은 p<0.05로 정하였다
Table 1. Primer sequence and reaction temperature
primer sequence(5'->3') annealing temperature(°C)
β-actin GGC GGA CTA TGA CTT AGT TG 53
AAA CAA CAA TGT GCA ATC AA
aggrecan GGA TCT AGC AGT GAG ACG TC 47 CTG CAG CAG TTG ATT CTG AT
collagen type I CCT GTC TGC TTC CTG TTA AC 48 AGA GAT GAA TGC AAA GGA AA
collagen type II CAG GAC CAA AGG GAC AGA AA 54 TTG GTC CTT GCA TTA CTC CC
Ⅲ. 결 과
1. 세포 증식 반응 추간판세포와 중간엽 줄기세포에 어떤 유전자 전달도 하지 않고 혼합하 여, 7일간 3차 배양한 경우에서는 중간엽 줄기세포만 배양한 군이 의미있게 세포증식이 저하되어 있으나 나머지 각 군 간의 세포증식에 있어서 크게 의미 있는 차이를 발견 할 수 없었다(Fig.1A). Ad/TGF-β1을 중간엽 줄기세포에 전달하여 혼합한 예에 있어서는 중간엽 줄기세포의 혼합 비율이 높아짐에 따 라 세포증식이 증가함을 관찰 할 수 있었다 (p<0.05, Fig.2A). 2. 신생 당단백 생성 추간판세포와 유전자전달을 하지 않은 중간엽 줄기세포를 혼합한 예에 있 어서는 중간엽 줄기세포의 혼합 비율을 증가시킴에 따라 당단백의 생성이 증 가된 예는 관찰 할 수 없었으나, 추간판세포와 비교했을 때 당단백의 총량이 같은 수준을 유지하거나 소량 감소한 결과를 얻을 수 있었다 (Fig.1B). 그러나 중간엽 줄기세포에Ad/TGF-β1을 전달하여 추간판세포와 혼합한 예에 있어서 는 중간엽 줄기세포의 혼합 비율이 증가함에 따라 당단백의 생성양이 추간판 세포만을 배양한 예와 비교하면30-50%이상, Ad/TGF-β1가 전달된 중간엽 줄기세포와 비교하면 60-70%이상 감소하는 것을 관찰 할 수 있었다 (Fig.2B). 이러한 신생 당단백의 생성양은 DNA 생성량으로 보정한 수치 결과 이다.A) 0.0 200.0 400.0 600.0 800.0 1000.0 1200.0 1:0 0:1 4:1 1:1 1:4
Mixed ratio of IVD cell and MSC
to ta l DNA cont en t( cp m ) B) 0.00 50.00 100.00 150.00 200.00 250.00 300.00 350.00 1:0 0:1 4:1 1:1 1:4
Mixed ratio of IVD cell and MSC
P ro teo gl yc an /DNA co nt en t(p ercen t c on tro l)
Fig 1. A) total DNA content in three dimensional culture of IVD cells and MSCs, B)Newly synthesized proteoglycan in three dimensional culture of IVD cells and MSCs presented as percent control. Mixed cultures with IVD cells and MSCs equalled or quite decreased in newly synthesized proteoglycan comparing only IVD cell cultures (p〈0.05).
A) 0.0 100.0 200.0 300.0 400.0 500.0 600.0 700.0 800.0 900.0 to tal DN A co nte nt(cp m )
IVD cell control MSC control MSC+Ad/luc(Mock) 150MOI MSC+Ad/TGF-b1 150MOI Ad/TGF-b1 1:1(IVD:MSC) Ad/TGF-b1 1:4(IVD:MSC) B) 0.0 50.0 100.0 150.0 200.0 250.0 300.0 350.0 Pr ot eo gl yc an /D NA sy nt he si s( pe rc en t cont ro
l) IVD cell controlMSC control
MSC+Ad/luc(Mock) 150MOI
MSC+Ad/TGF-b1 150MOI Ad/TGF-b1 1:1(IVD:MSC) Ad/TGF-b1 1:4(IVD:MSC)
Fig 2. A) total DNA content in three dimensional culture of IVD cells and Ad/TGF-β1-transduced MSCs, B) Newly synthesized proteoglycan in three dimensional culture of IVD cells and Ad/TGF-β1-transduced MSCs presented as percent control (p〈0.05).
3 추간판세포 표현형의 발현
추간판세포와 유전자 전달을 하지 않은 중간엽 줄기세포를 혼합하여 3차 배양한 결과, 어떠한 자극도 없이 미분화된 중간엽 줄기세포 자체의 aggrecan, collagen type I, collagen type II의 mRNA 발현이 추간판세포와 비 교하였을 때, 50- 70%이상 적은 발현양을 관찰 할 수 있었으며, 이로 인해 중 간엽 줄기세포의 혼합양이 증가함에 따라 추간판세포 표현형과 관련한 mRNA 발현양이 점진적으로 감소되어 있음을 관찰할 수 있었다 (Fig.3). 또한 치료 유전자인 Ad/TGF-β1을 중간엽 줄기세포에 전달하여 혼합한 예에서도 같은 결과를 관찰 할 수 있었으나, collagen type I의 mRNA 발현에 있어서는 치료 유전자 전달을 한 중간엽 줄기세포의 예에 있어서만 혼합 비율을 증가함에 따 라 발현양이 증가됨을 관찰 할 수 있었다 (Fig.4).
Fig 3. RT-PCR for aggrecan, collagen type I, and collagen type II in three dimensional culture of IVD cells and MSCs. β-actin was used for normalization.
Fig 4. RT-PCR for aggrecan, collagen type I, and collagen type II in three dimensional culture of IVD cells and Ad-transduced MSCs. β-actin was used for normalization. a) only IVD cells, b) only MSC, c) only Ad/luc-transduced MSC [Mock], d) only Ad/TGF-β1-transduced MSC [Ad/TGF-β1-MSC], e) [IVD cells : Ad/TGF-β1-MSC] 1:1, f) [IVD cells : Ad/TGF-β1-MSC] 1:4.
Ⅳ. 고 찰
퇴행성 척추 추간판 질환은 추간판 수핵부의 당단백과 수분의 총량이 점 진적으로 감소하는 데 따른 질환으로, 정상적인 추간판 수핵부에서는 당단백 과 2형 교원질(collagen type II)의 함량이 풍부하고, 섬유륜부에는 당단백과 1 형 교원질 (collagen type I)의 함량이 많은 데에 비해, 초기 추간판의 퇴행 과 정에서는 당단백과 aggrecan의 함량이 현저히 감소하는 현상이 관찰되어 왔
었다3-5). 이에 따라 퇴행성 추간판 질환에 대한 치료적 목적으로 감소된 당단
백의 합성을 자극하고 연골형 표현형 (aggrecan, collagen type II) 발현이 증
가될 수 있도록 다양한 성장인자를 적용하는 연구가 시행되어 왔다12-16). Thompson 등12)은 개의 추간판 조직으로부터 분리한 세포에 재조합 TGF-β 1을 처리하여 당단백의 합성이 증가된다는 것을 확인한 이래, Gruber 등14)도 TGF-β1이 인간의 추간판세포의 3차원 배양에 있어서 세포증식과 세포기질 의 합성이 증가됨을 증명하였다. 그 이외에도 IGF-1, BMP-2 등도 추간판세 포의 당단백 합성을 증가 시킬 수 있는 성장인자로서의 가능성이 있음이 증명 되었다13, 35). 그러나 이러한 성장인자를 퇴행성 추간판 질환의 치료적 목적으 로 이용하였을 때, 인체 내에서는 일시적인 생물학적 활성만을 유지할 수 있 다는 단점이 큰 문제로 대두 되어 왔다. 유전자 치료의 소개로 지속적인 생물학적 자극이 가능해지면서 퇴행성 척 추 추간판 질환에 새로운 전기가 마련되었다31-34). 다만, 인간의 퇴행성 추간판 질환에 있어서 퇴행의 정도가 심하게 진행된 환자에 있어서는 자가 추간판 조 직을 획득하여 치료 유전자를 체외 전달법을 통해 전달한다거나 환자의 추간 판에 직접 전달한다거나 하는 방법은 한계가 있다고 하겠다. 이에 본 연구는 유전자 치료와 중간엽 줄기세포를 이용한 세포 치료를 동반하여, 현저히 감소 된 추간판세포의 숫자를 극복하고, 중간엽 줄기세포에 치료 유전자를 전달하여, 추간판세포와 유사한 연골세포로의 분화를 도모하는 한편, 치료 유전자 전달에
따라 발현되는 성장인자의 도움을 받아 주변 추간판세포의 기질 생성도 향상시 키기 위한 목적으로 실험을 수행하게 되었다. 결과를 살펴보면, 미분화된 중간엽 줄기세포만을 인간 추간판세포와 혼합 배양한 결과에서 단순히 중간엽 줄기세포의 혼합율 만을 높인 예에서도 추간판 세포만을 3차 배양한 군과 비교하였을 때, 당단백의 합성이 같거나 조금 감소 한 것으로 보아, 퇴행된 추간판 질환에서 추간판 조직으로 중간엽 줄기세포를 이식하였을 때의 치료적 효과가 있을 것이라 추론할 수 있었다. 그러나 치료 유전자인 TGF-β1 유전자를 중간엽 줄기세포에 전달하여 추간판세포와 혼합한 예에 있어서는 대조군인 추간판세포만을 배양하였을 때의 기질 생성과 비교하 여 보면, 오히려 감소하는 경향을 관찰한 결과, 이는 중간엽 줄기세포와 추간판 세포의 혼합 배양에 있어서 TGF-β1의 기질생성능이 그리 크지 않다는 것을 알 수 있었다. 또한 추간판세포 표현형을 RT-PCR을 통해 관찰한 결과, 치료 유전자를 전달한 군에서 중간엽 줄기세포의 혼합율을 증가시키면 aggrecan과 collagen type II의 mRNA 발현양이 감소하고 collagen type I의 mRNA 발현 양이 증가하였는데, 이는 TGF-β1 유전자가 전달된 중간엽 줄기세포가 추간 판의 수핵부세포-유사세포로 분화되기 보다는 섬유륜부세포-유사세포로 분 화되었음을 추론할 수 있겠다. 이는 발생학적으로 중간엽 줄기세포가 분화 가 능한 연골세포와 추간판세포의 기원체가 다른 점을 고려해 볼 때 충분히 가능 한 결과라 생각된다. 또한 Hanada 등36)에 따르면 연골 세포를 3차 배양하여 TGF-β1만을 적용한 예에서는 14일까지 배양을 시행하여도 collagen type II 의 mRNA발현이 거의 되지 않음을 확인하였으나 BMP-2를 적용한 예에서는 3일째부터 매우 향상된 기질 생성능이 있음을 확인한 결과로 비추어 볼 때, 본 연구에서 치료 유전자로 TGF-β1보다는 BMP-2를 적용하였을 때는 또 다른 결과를 유추할 수 있지 않을 까 예상된다. 따라서 향후 연구로는 치료 유전자로서 BMP-2를 중간엽 줄기세포에 적용하여 혼합 배양을 실시하여 향 상된 기질 세포발현을 나타내는지를 증명하여야 겠다.
Ⅴ. 결 론
치료 유전자인 TGF-β1 cDNA을 전달한 중간엽 줄기세포와 추간판세포를 혼합한 예에서는 괄목할 만한 기질 생성능을 관찰 할 수는 없었으므로 추간판 재생을 위한 중간엽 줄기세포의 유전자 조작과 세포 이식의 접근법에서 TGF-β1 cDNA는 효과적이지 못하였다. 그러나 유전자를 전달하지 않은 중간엽 줄 기세포와 추간판세포의 혼합 배양에 있어서는 추간판세포만을 배양한 군과 비 교하였을 때, 거의 유사한 수준의 기질 생성을 보임을 관찰한 바, 중간엽 줄 기세포가 퇴행성 추간판 질환의 재생과 복원에 있어서 감소된 기질 생성능을 향상시킬 수 있는 좋은 세포 치료 도구임을 확인 할 수 있었다.REFERENCE
1) Borenstein D: Epidemiology, etiology, diagnostic evaluation, and treatment of low back pain. Curr Opin Rheumatol 1992 ; 4:226-32.
2) Hardingham TE, Adams P: A method for the determination of hyaluronate in the presence of other glycosaminoglycans and its application to human intervertebral discs. Biochem J 1976 ; 159:143-147.
3) Pearce RH, Grimmer BJ, Adams ME: Degeneration and the chemical composition of the human lumbar intervertebral disc. J Orthop Res 1987 ; 5:198-205.
4) Lipson SJ, Muir H: Proteoglycans in experimental intervertebral disc degeneration. Spine 1981 ; 6:194-210.
5) Melrose J, Ghosh P, Taylor TK: A longitudinal study of the matrix changes induced in the intervertebral disc by surgical damage to the annulus fibosus. J Orthop Res 1992 ; 10:665-676.
6) Moullier P, Bohl D, Heard JM, Danos O: Correction of lysosomal storage in the liver and spleen of MPS VII mice by implantation of genetically modified skin fibroblasts. Nat Genet 1993 ; 4:154-159. 7) Buckwalter JA: Aging and degeneration of the human intervertebral disc.
Spine 1995 ; 20:1307-1314.
8) Adams MA, May S, Freeman BJ, Morrison HP, Dolan P: Effects of backward bending on lumbar intervertebral discs. Relevance to physical therapy treatments for low back pain. Spine 2000 ; 25:431-437.
9) Butler D, Trafimow JH, Andersson GB, McNeill TW, Huckman MS: Discs degenerate before facets. Spine 1990; 15:111-113.
10) Herkowitz HN, Abraham DJ, Albert TJ: Management of degenerative disc disease above an L5-S1 segment requiring arthrodesis. Spine 1999 ; 24:1268-1270.
11) Modic MT: Degenerative disc disease and back pain. Magn Reson Imaging Clin N Am 1999 ; 7:481-491.
12) Thompson JP, Oegema TR, Bradford DS: Stimulation of mature canine intervertebral disc by growth facors. Spine 1991; 16:253-260.
13) Osada R, Ohshima H, Ishihara H : Autocrine/paracrine mechanism of insulin-like growth factor-1 secretion, and the effect of insuline-like growth factors-1 on proteoglycan synthesis in bovine intervertebral discs. J Orthop Res 1996 ; 14:690-699.
14) Gruber HE, Fisher EC, Desani B, Stasky AA, Hoelscher G, Hanley EN: Human intervertebral disc cells from the annulus: three dimensional culture in agarose or alginate and responsiveness to TGF-b1. Exp Cell Res 1997 ; 235:13-21.
15) Takegami K, Matuda K, Kumano F: Osteogenic protein-1 is most effective in stimulating nucleus pulposus and annulus fibrosus cells to repair their matrix after chondroitinase ABC-induced chemonucleolysis. 45th Annual Meeting Trans Orthop Res Soc 1999 ; 201.
16) Nishimura K, Mochida J.: Percutaneous reisertion of the nucleus pulposus: an experimental study. Spine 1998 ; 23:1531-1638.
17) Okuma M, Mochida J, Nishimura K, Sakabe K: Nucleus pulposus allograft retards intervertebral disc degeneration: an in vitro and in vivo
experimental study. J Orthop Res 2000 ; 18:988-997.
18) Evans CH, Robbins PD: Possible orthopaedic applications of gene therapy. J Bone Joint Surg 1995 ; 77-A:1103-1114.
19) Evans CH, Robbins PD: Genetically augmented tissue engineering of the musculoskeletal system. Clin Orthop 1999 ; 367:S410-8.
20) Evans CH, Robbins PD: Potential treatment of osteoarthritis by gene therapy. Rheum Dis Clin North Am 1999 ; 25:333-44.
21) Barr E, Leiden JM: Systemic delivery of recombinant proteins by genetically modified myoblasts. Science 1991 ; 4:1507-509.
22) Day CS, Bosch P, Kasemkij WC: Use of muscle cells to mediate gene transfer to the bone defect. Tissue Eng 1999 ; 5:119-125.
23) Dhawan J, Pan LC, Pavlath GK, Travis MA, Lanctot AM, Blau HM: Systemic delivery of human growth hormone by injection of genetically engineered myoblasts. Science 1991 ; 254:1509-1512. 24) Naffakh N, Henri A, Villeval JL: Sustained delivery of erythropoietin in
mice by genetically modified skin fibroblast. Pro Natl Acad Sci 1995 ; 92:3194-3198.
25) Caplan AI, Elyanderani M, Mochizuki Y, Wakitani S, Goldberg VM : Principles of cartilage repair and regeration. Clin Ortho Rel Res 1997 ; 342:254-269.
26) Haynesworth SE, Goshima J, Goldberg VM, Caplan AI: Characterization of cells with osteogenic potential from human marrow. Bone 1992 ; 13:81-88.
27) Haynesworth SE, Reuben D, Caplan AI: Cell-based tissue engineering therapies: the influence of whole body physiology. Adv Drug Del Rev 1998 ; 33:3-14.
28) Quintavalla J, Uziel-Fusi S, Yin J, Boehnlein E, Pastor G, Blancuzzi V, Singh HN, Kraus KH, O'Byrne E, Pelles TC: Fluorescently labeled mesenchymal stem cells(MSCs) maintain multilineage potential and can be detected following implantation into articular cartilage defects. Biomaterials 2002 ; 23:109-119.
29) Wakitani S, Goto T, Pineda S J, Young RG, Mansour JM, Caplan AI, Goldberg VM: Mesenchymal cell-based repair of large, full-thickness defects of articular cartilage. J Bone Joint Surg. 1994 ; 76A:579-592.
30) Im G-I, Kim D-Y, Shin J-H, Hyun C-W, Cho W-H: Repair of cartilage defect in the rabbit with cultured mesenchymal stem cells from bone marrow. J Bone Joint Surg 2001 ; 83B:289-294.
31) Moon S-H, Kang JD, Nishida K, Gilberson LG, Niyibizi C, Smith PN, Knaub MA, Robbins PD, Evans CH: Human cervicl intervertebral disc cells are susceptible to adenovirus-mediated gene therapy. Proc Cerv Spine Res Soc 1999 ; 150-153.
32) Moon S-H, Nishida K, Kang JD, Gilberson LG, Muzzonigro TS, Knaub MA, Robbins PD, Evans CH: Human intervertebral disc cells are genetically modifiable in vitro by adenovirus-mediated gene transfer : Implications for the clinical management of intervertebral disc disorder. Spine 2000 ; 25:,2573-2579.
33) Nishida K, Kang JD, Gilberson LG, Moon S-H, Suh J-K, Vogt MT, Robbins PD, Evans CH: Modulation of the biologic activity of the rabbit intervertebral disc by gene therapy: An in vivo study of adenovirus-mediated transfer of the human transforming growth factor β1 encoding gene. Spine 1999 ; 24:2419-2425.
34) Nishida K, Kang JD, Suh J-K, Robbins PD, Evans CH, Gilberson LG: Adenovirus-mediated gene transfer to nucleus pulposus cells: Implication for the treatment of intervertebral disc degeneration. Spine 1998 ; 23:2437-2443.
35) Kim D-J, Moon S-H, Kim H, Kwon U-H, Park M-S, Han K-J, Hahn S-B, and Lee H-M: Bone morphogenetic protein-2 facilitates expression
of chondrogenic, not osteogenic, phenotype of human
intervertebral disc cells. Spine 2003 ; 28:2679-2684.
36) Hanada K, Solchaga LA, Caplan AI, Hering TM, Goldberg VM, Yoo JU, and Johnstone B: BMP-2 induction and TGF-β1 modulation of rat periosteal cell chondrogenesis. J Cell Biochem 2001 ; 81: 284-294.
Abstract
Mesenchymanl stem cell based intradiscal gene therapy: Therapeutic implication in degenerative disc disease
Kee Hong Song Department of Medicine,
The Graduate School, Yonsei University (Directed by Professor Hak Sun Kim) Study Design :
In-vitro experiment using human mesenchymal stem cell (MSC), intervertebral disc (IVD) cell and type 5 adenovirus/ transforming growth factor-β1 construct (Ad/TGF-β1).
Objectives :
To determine the effect of MSC-based gene therapy for matrix regeneration of IVD cells.
Summary of literature review :
MSCs are known to be multipotent in tissue regeneration. In degeneration of IVD, cellular replacement with genetic modification other than IVD cell may prove a enhanced mechanism of regeneration of IVD.
Materials and Methods :
MSCs and IVD cells were cultured. Adenovirus construct containing TGF-β1 cDNA (Ad/TGF-TGF-β1) was also produced. In first step, MSCs were transduced with Ad/TGF-β1. Then MSCs with Ad/TGF-β1 and IVD cells mixed with certain proportion and cultured three dimensionally.
[methyl-3H]Thymidine incorporation for DNA synthesis and [35S]Sulfur incorporation for proteoglycan synthesis were measured. RT-PCR for aggrecan, collagen type I, and collagen type II mRNA expression was performed
Results :
Mixed cultures with MSCs and IVD cells showed relatively same amount of newly synthesized proteoglycan comparing with cultures of IVD cell only. In mixed cultures transduced with Ad/TGF-β1, there was significant decrease in newly synthesized proteoglycan with regard to increase of the portion of MSCs. Aggrecan and collagen type II mRNA expression showed same finding. But collagen type I mRNA expression increased with an increase of the portion of MSCs with Ad/TGF-β1.
Conclusion :
The cell therapy with MSCs to IVD cells provided a mechanism of cellular augmentation. However, MSC-based gene therapy to IVD cell did not maintain chondrogenic phenotype.
Key words :