의
의
의학
학
학 박
박
박사
사학
사
학
학위
위
위 논
논
논문
문
문
F
F
Fr
r
ru
u
uc
c
ct
t
to
o
os
se
s
e
e1
1
1,
,
,
6
6
6-
-
-d
d
di
ip
i
p
ph
h
ho
o
os
s
sp
p
ph
h
ha
at
a
t
te
e
e의
의
의 U
U
UV
V
V유
유
유도
도
도
피
피
피부
부
부염
염
염증
증
증 억
억
억제
제
제작
작
작용
용
용
아
아
아 주
주
주 대
대
대 학
학
학 교
교
교 대
대
대 학
학
학 원
원
원
의
의
의 학
학
학 과
과
과
안
안
안 수
수
수 미
미
미
F
F
Fr
r
ru
u
uc
c
ct
t
to
o
os
s
se
e1
e
1
1,
,
,
6
6
6-
-
-d
d
di
i
ip
p
ph
h
ho
o
os
s
sp
p
ph
h
ha
a
at
t
te
e
e의
의
의 U
U
UV
V
V유
유
유도
도
도
피
피
피부
부
부염
염
염증
증 억
증
억
억제
제
제작
작
작용
용
용
지
지
지도
도
도교
교
교수
수
수 이
이
이 수
수
수 환
환
환
이
이
이 논
논
논문
문
문을
을
을 의
의
의학
학
학 박
박
박사
사
사학
학
학위
위
위 논
논
논문
문
문으
으
으로
로 제
로
제
제출
출
출함
함
함.
.
.
2
2
20
0
00
0
07
7
7년
년
년 8
8
8월
월
월
아
아
아 주
주
주 대
대
대 학
학
학 교
교
교 대
대
대 학
학
학 원
원
원
의
의
의 학
학
학 과
과
과
안
안
안 수
수
수 미
미
미
안
안
안수
수
수미
미
미의
의 의
의
의
의학
학
학 박
박
박사
사
사학
학
학위
위
위 논
논
논문
문
문을
을
을 인
인
인준
준
준함
함
함.
.
.
심
심
심사
사
사위
위
위원
원
원장
장
장
문
문
문 창
창
창 현
현
현
인
인
인
심
심
심 사
사
사 위
위
위 원
원
원
이 영
이
이
영
영 돈
돈
돈
인
인
인
심
심
심 사
사
사 위
위
위 원
원
원
백
백
백 은
은
은 주
주
주
인
인
인
심
심
심 사
사
사 위
위
위 원
원
원
임
임
임 종
종
종 석
석
석
인
인
인
심
심
심 사
사
사 위
위
위 원
원
원
이
이
이 수
수
수 환
환
환
인
인
인
아
아
아 주
주
주 대
대
대 학
학
학 교
교
교 대
대
대 학
학
학 원
원
원
2
2
20
0
00
0
07
7
7년
년 6
년
6
6월
월
월 2
2
25
5
5일
일
일
-국문요약-
Fructose 1,6-diphosphate 의
의
의
의 UV 유도
유도
유도
유도 피부염증
피부염증
피부염증
피부염증 억제작용
억제작용
억제작용
억제작용
Fructose 1,6-diphosphate (FDP)는 해당과정 (glycolysis)상의 고에너지 대사 중간
체로서 당대사와 관련된 여러 효소들의 allosteric regulator로서 작용할 뿐만 아니 라 심혈관계 보호작용 등의 다양한 생리활성을 지니고 있는 것으로 알려져 있다. 피부세포에서는 최근 human keratinocyte cell line (HaCaT)에서 FDP가 UVB 유도 세포내 H2O2 및 prostaglandin 생성을 유의적으로 억제한다고 보고된 바 있다. 본
연구에서는 FDP가 자외선에 의해 유도되는 염증반응 및 산화적 스트레스를 억 제할 수 있는지를 피부세포배양 모델과 in vivo 동물시험을 통해 검토하고자 하 였다.
FDP 는 HaCaT keratinocyte 에서 UVB 에 의해 유도되는 세포사를 억제하였
으며, COX-2 의 발현 및 MMP-2,9 의 활성을 억제하였다. 또한
1,1-diphenyl-2-
picrylhydrazyl (DPPH)
radical 소거효능 시험을 통해 검증해본 결과 직접적인 라디칼 소거효능이 없음에도 불구하고 UVB 에 의해 유도되는 CAT, SOD 의 활성 및 GSH 감소를 억제함으로써 세포내 항산화계를 보호하는 효과가 있음을 알 수 있었다. UVB 에 의해 유도되는 반응 외에 fibroblast 에서 UVA 에 의해 유도 되는 procollagen 의 감소 및 MMP-1 의 발현을 억제하고, HaCaT keratinocyte 와 마 찬가지로 자외선에 의해 유도되는 GSH 의 감소를 억제하는 효과가 있었다.
FDP의 작용기전을 UVB유도 신호전달계에 미치는 영향을 중심으로 검토해
CREB등의 transcription factor의 조절을 통해 MMP-2 와 COX-2 발현을 억제하는
것을 알 수 있었다.
피부세포 배양모델에서 자외선에 의해 유도되는 항산화계 손상 및 염증반 응을 억제하는 효능이 있는 FDP를 피부에 도포하였을 때 자외선에 의한 피부 손상을 억제할 수 있는지 hairless mouse를 이용하여 실험하였다. 먼저 Franz-
type diffusion cell을 이용하여 피부에 도포할 경우 FDP가 피부를 투과할 수 있
는지 검증해 본 결과 FDP는 시간이 경과함에 따라 피부를 투과하는 것을 알 수 있었다. FDP 1%를 hairless mouse에 도포한 후 자외선을 조사한 경우 자외선 에 의해 유도되는 CAT, SOD 및GSH의 감소를 억제하고 피부 단백질의 산화를 억제하는 등의 자외선에 의한 산화적 손상을 억제하는 효능이 있음을 알 수 있 었다. 이상의 결과로 볼 때 FDP 는 피부에서 자외선에 의해 유도되는 염증반응, 광노화, 피부암 등의 병리학적 증상을 예방하기 위한 목적으로 응용이 가능할 것으로 생각된다. 핵심어 핵심어핵심어
핵심어 : Fructose 1,6-diphosphate(FDP), UV, MMP-2, COX-2, 염증반응, 항산화,
차
차
차
차 례
례
례
례
국문요약……… i 차례 ……… iii 그림차례……….………. vi 약어……… viii I. 서론………... 1 A. 자외선에 의한 피부노화 및 세포내 신호전달……...………...… 1 B. Fructose 1,6-diphosphate……… 6 C. 연구과제의 목표…...……….…….. 9 II. 재료 및 방법………...……… 10 A. 재료……….. 10 B. 방법……….. 101. 인간피부각질 세포주(HaCaT keratinocyte) 및 Normal human fibroblast 의 배양………... 10 2. 자외선 A/B(UVA/UVB) 조사 및 약물처리…..……… 11 3. LDH assay………..……. 11 4. DPPH assay ...………...………..… 12 5. Western analysis………..… 12 6. RT-PCR………..…. 13 7. MMP-2,9 의 활성측정(Zymograph)………...……….. 14
8. Electrophoretic mobility shift analysis(EMSA)………..……….... 14
9. 피부투과시험 ………..………...…. 15
10. In vivo 동물시험……….. 16
11. 항산화 효소 활성측정 …………..….………. 17
12. Protein oxidation assay ...…….………..….. 18
13. 통계처리 ..………...……….….. 19
III. 결과 ……… 20
A. UVB 에 의한 HaCaT keratinocytes 손상 보호효과………..…………. 20
1. UVB 에 의한 세포손상 보호효과....………..… 20
2. Glycolytic metabolites 의 UVB 에 의한 세포손상 보호효과….…..……... 20
3. UVB 에 의해 유도되는 COX-2 발현에 미치는 영향………..…..… 23 4. UVB 에 의해 유도되는 MMP-2 활성 및 발현에 미치는 영향……..…. 25 5. UVB 조사에 의한 세포 항산화 시스템변화에 미치는 영향...……..… 28 B. UVA 에 의한 fibroblast 손상 보호효과……….…… 31 1. UVA 에 의한 procollagen 의 발현에 미치는 영향………..……… 31 2. UVA 에 의한 MMP-1 발현에 미치는 영향 ...………...………. 31 3. UVA 에 의한 GSH 감소에 미치는 영향……….………. 32 C. 자외선에 의해 유도되는 세포내 신호전달계에 미치는 영향……….. 35 1. 자외선에 의해 유도되는 MAPK 활성에 미치는 영향……….…… 35 2. 자외선에 의해 유도되는 PI3K/Akt 활성에 미치는 영향……..………… 36 3. 자외선에 의해 유도되는 transcription factor 활성에 미치는 영향…..… 39
4. 자외선에 의한 MMP-2 의 발현에 영향을 미치는 세포내 신호전달계에 대한 FDP 의 영향………... 42 5. 자외선에 의한 COX-2 발현에 영향을 미치는 세포내 신호전달계에 대한 FDP 의 영향……….…...……… 44 D. Hairless mouse 피부에서 자외선에 의해 유도되는 산화적 손상에 미치는 영향……….………..……….……. 46 1. FDP 의 피부투과 시험...………..………...……….……… 46 2. 자외선에 의해 유도되는 항산화계 손상에 미치는 효과…….………. 48 3. 자외선에 의해 유도되는 단백질 손상에 미치는 효과……… 52 IV. 고찰………...………..….…… 55 V. 결론……….………..67 참고문헌………..………..….…… 68 Abstract………... 84
그림
그림
그림
그림 차례
차례
차례
차례
Fig. 1. ROS-mediated activation of various cell signaling pathway in the skin………...… 2 Fig. 2. Effects of FDP on UV-induced cell death………...…… 21 Fig. 3. Effects of glycolytic metabolites on UV-induced cell death.……….…………..…22 Fig. 4. FDP prevents the UV-induced COX-2 expression in cultured HaCaT
keratinocytes ……….….. 24 Fig. 5. FDP prevents the UV-induced MMP-2,9 activities in cultured HaCaT
keratinocytes ……….….. 26 Fig. 6. FDP prevents the UV-induced MMP-2 expression in cultured HaCaT
keratinocytes ……….……….. 27 Fig. 7. FDP preserves the cellular antioxidant capacity………..… 29 Fig. 8. DPPH radical-scavenging activity of FDP………...…………..…. 30 Fig. 9. FDP prevents the UV-induced MMP-1 expression and procollagen depression in
cultured skin fibroblast……… 33 Fig. 10. FDP preserves the GSH in cultured skin fibroblast after UVA irradiation …….. 34 Fig. 11. FDP inhibits UVB-induced ERK and JNK phosphorylation in HaCaT
keratinocytes………..……… 37 Fig. 12. FDP inhibits UVB-induced Akt and GSK3β phosphorylation in HaCaT
keratinocytes………...………..………. 38 Fig. 13. FDP attenuates UVB-induced transcription factor activities………. 40
Fig. 14. FDP inhibits UVB-induced cJun phosphorylation in HaCaT keratinocytes……. 41
Fig. 15. Effects of MAPK and PI3K inhibitor on UVB-induced MMP-2 expression in HaCaT keratinocytes………...………..…… 43
Fig. 16. Effects of MAPK and PI3K inhibitor on UVB-induced COX-2 expression in HaCaT keratinocytes………..………...…… 45
Fig. 17. Topically applied FDP readily penetrates the skin……… 47
Fig. 18. FDP preserves the antioxidant capacity of hairless mouse skin……… 50
Fig. 19. FDP reverses the UVB-induced loss of catalase protein………...…… 51
Fig. 20. FDP prevents UVB-induced protein oxidation in hairless mouse skin…………. 53
Fig. 21. FDP could not prevent in vitro protein oxidation by hydrogen peroxide……….. 54
Fig. 22. Schematic diagram for the inhibitory role of FDP in UV-induced skin Inflammation………..………66
약
약
약
약 어
어
어
어
FDP : fructose 1,6-diphosphate UVA : ultraviolet A UVB : ultraviolet B COX-2 : cyclooxygenase 2 MMPs : matrix metalloproteinase SOD : superoxide dismutase CAT : catalaseGSH : glutathione NAC : N-acetyl cysteine
MAPKs : mitogen-activated protein kinase PI3K : phosphoinositol-3 kinase
GSK3β : glycogen synthase kinase-3(beta) CREB : cAMP response element binding protein
I. 서론
서론
서론
서론
A. 자외선에자외선에자외선에 의한자외선에 의한의한의한 피부노화피부노화 및피부노화피부노화 및및및 세포내세포내세포내 신호전달세포내 신호전달신호전달신호전달
피부는 외부환경과의 접점에 위치하여 자외선 등의 물리적 자극, 혹은 화학적
자극의 표적이 되는 기관으로서 (Athar M, 2002), 내부 장기를 보호하며 항상성을 유지하는데 중요한 역할을 담당한다. 피부가 자외선에 노출되면 직접적, 혹은 간 접적인 경로를 통해 활성산소 (Reactive Oxygen Species, ROS)가 생성되며, 피부에 산화적 스트레스가 증가하여 피부 생리학적 기능 변화를 초래하며 피부암, 피부 노화 및 홍반 (erythema)과 부종 (edmea)으로 특징지워지는 염증을 유발하는 등 피부에 부정적인 영향을 준다는 사실은 이미 잘 알려져 있다 (Greaves MW와
Sondergaard J,1970; Hruza L와 Pentland AP, 1993; Rittie L 와 Fisher GJ, 2002).
산화적 stress를 일으키는 활성산소종으로는 superoxide anion, hydrogen peroxide,
hydroxy radical 등이 있으며 이들은 자외선 등의 외부 유해자극에 의해 생성되기
도 하지만, 세포내 산소대사과정, 즉 mitochondrial respiratory chain 반응, NADPH
cytochrome P450 reductase, NADPH oxidase, lipoxygenase 또는 cyclooxygenase 등에
의해 생성된다. 생성된 활성산소종들은 세포내 단백질, 지질 또는 핵산 등을 공 격, 손상을 주게 되며 이러한 손상이 축적되어 염증 및 노화 등의 병리학적 손상 을 일으키게 된다. 활성산소종들은 이외에도 다양한 종류의 세포내 신호 전달계 에 영향을 주는 것으로 알려져 있는데, mitogen activated protein kinase (MAPK) 경로 의 활성화, protein kinase C 및 Ca++
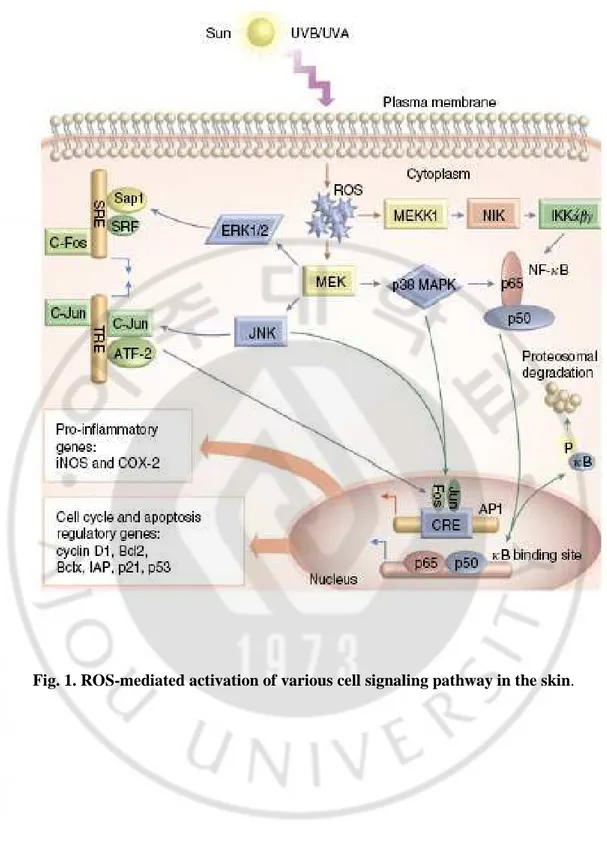
전사인자 (transcription factors)의 활성화 등을 통해 세포내 유전자 발현을 포함한 각종 생체반응을 조절함으로써 세포기능을 변화시키는 것으로 알려져 있다 (Fig.
1) (Kamata H와 Hirata H, 1999; Bicker DR와 Athar M, 2006).
UVB에 의해 유도되는 염증반응은 prostaglandin이나 leukotriene 등과 같은 염
증 매개체 (inflammatory mediator)의 생성을 수반하며, UVB 노출 조건에서 이들
eicosanoid의 생성은 phospholipase A2 (PLA2)의 발현 또는 활성 증가와 밀접한 관
련이 있는 것으로 알려져 왔다 (Kang-Rotondo CH 등, 1993). 그러나 최근의 보고 들에 의하면 prostaglandin 생성에 있어 PLA2의 하위 단계인 cyclooxygenase-2
(COX-2)의 발현 역시 자외선 조사에 의해 야기되는 prostaglandin 생성 증가에 매 우 중요한 역할을 하는 것으로 추정되고 있다 (Soriani M 등, 1999). 이러한 보고 들은 COX-2 저해제들이 자외선에 의한 홍반 생성을 억제한다는 기존의 연구 결 과들과 일치하는 것으로 (Wilgus TA 등, 2000) 자외선 조사에 의해 유도된 염증 반응에 있어서 COX-2의 역할을 뒷받침하고 있다. 또한 자외선에 의한 COX-2 발 현 증가는 photocarcinogenesis 과정에도 중요한 역할을 하고 있는 것으로 알려져 있어 (Pentland AP 등,1999) COX-2는 자외선에 의해 유도되는 피부 병변의 조절에 있어 매우 유효한 표적으로 주목되고 있다. UVB에 의해 나타나는 다양한 병리현상은 COX-2의 발현증가에 의한 염증
반응 외에도 현재까지 20종 이상 isotype이 존재한다고 알려진 matrix metallo-
proteinases (MMPs)(Suomela S 등, 2003)의 발현과도 많은 상관관계가 있는 것으로
알려져 있다. MMP는 collagen과 같은 extracellular matrix를 분해할 뿐만 아니라
TNF-α, interleukin 1-β (IL-1 β) 의 활성화에도 관여한다고 알려져 있다 (McCa-wley LJ 와 Matrisian LM, 2001). UV에 의한 MMPs 발현의 증가는 광노화를 촉진시킬
뿐 아니라 급성염증 (acute inflammation) 반응을 매개한다는 보고도 있다. 또한 피 부세포나 조직에서 PGE2의 처리에 의해서 MMPs의 발현이 증가한다는 연구결과 도 있어 (Han JH 등, 2004) 자외선에 의한 피부의 염증반응에 있어서 COX-2와 MMPs의 상관관계를 시사하고 있다. 자외선조사는 세포내 p38, JNK, ERK1/2등의 세포신호전달계를 활성화시키며 (Bender K 등, 1997), 이들 경로들은 세포의 종류 또는 자극의 종류에 따라 각각 COX-2의 유도와 관련이 있는 것으로 보고된 바 있다 (Xie W 와 Herschman HR, 1995). 특히 최근 보고에 의하면 HaCaT cell에서 UVB에 의한 COX-2 발현은 p38 MAP kinase가 주된 역할을 하는 것으로 알려져 있다 (Chen W 등, 2001). 즉 UVB
조사에 의한 p38 MAP kinase의 활성화는 CREB및 ATF-1의 인산화를 통해 COX-2
promotor의 활성화를 유도하며, 이 때 ERK는 별다른 역할을 하지 않는 것으로
확인 된 바 있다.
이와는 별도로 최근 보고에 의하면 Wnt pathway가 활성화됨에 따라 GSK-3β
가 불활성화 되면 COX-2 발현이 유도되는 것으로 알려져 있다 (Haertel-Wiesmann
M 등, 2000). UVB조사에 의해 PI3-kinase가 활성화되고 PI3-kinase는 GSK-3β를 억
제한다는 사실은 이미 잘 알려져 있으므로 PI3-kinase는 UVB 유도 COX-2 발현에
관여할 것으로 추정된다. 또한, GSK-3β는 여러 실험 모델에서 COX-2 발현 조절
과 직접적으로 관련되어 있는 c-Jun (Nikolakaki E 등, 1993), NF-AT (Beals CR 등,
1997), CREB (Bullock BP와 Habene, 1998) 등의 전사인자를 억제하는 것으로 보고
된 바 있다. 실제로 UVB는 PI3-kinase의 활성화를 통해 Akt를 경유하여 GSK-3β 를 억제함으로써 COX-2 발현을 증가시키는 것으로 확인된 바 있다 (Tang Q 등,
Atypical PKC (aPKC) 경로 또한 UVB 유도 COX-2 발현과 관련되어 있을 것
으로 추정되고 있는데, UVB는 aPKC을 경유하여 전사인자인 AP-1을 활성화시키 는 것으로 알려져 있다. 이 경우, COX-2 발현과의 직접 관련성은 아직 보고되어 있지 않지만 aPKC-MAPK 경로가 관여할 가능성이 제시되고 있다. 이외에, UVB 유도 COX-2 발현에는 tyrosine kinase 및 전사인자인 NF-κB의 관여 가능성이 보고
된 바도 있다 (Miller CC 등, 1994). 위와 같이 UVB 유도 COX-2의 발현에는 다양 한 세포내 신호전달경로가 관여하고 있으며, 복잡한 상호 조절 기전 또한 작용하 고 있는 것으로 알려져 있다. 즉, 자외선을 조사한 조건 하에서Akt의 활성화는
ERK 또는 p38 억제에 의해 저해되며, 반대로 PI3-kinase의 선택적 저해제 처리시 ERK의 활성화가 억제됨이 보고된 바 있다 (Nomura M 등, 2001).
UVB 유도 COX-2 발현과 관련된 세포내 신호전달경로는 COX-2 이외에 c-fos 등 피부 병변과 관련이 있는 인자들의 발현에도 관여하고 있는 것으로 알려
져 있으며, MMP의 발현과도 밀접한 관계가 있다. MMP family의 발현에는 MAPK
signal이 밀접하게 관련되어 있다는 것이 알려져 있는데, ERK pathway를 차단할
경우 MMP-1의 발현이 억제되며 (Frost JA 등; 1994), JNK의 인산화에 의한 AP-1의 활성화가 MMP의 promotor를 활성화시키고 발현을 증가시키는 것으로 알려져 있 다 (Yang SH 등, 2003). 또한 MMP는 전사단계에서의 발현의 조절뿐만 아니라 proenzyme의 활성화 단계에서도 조절이 일어나는데, H2O2는 MMP-2의 활성화를 증가시키는 것으로 보고되어 있다 (Belkhiri A 등; 1997). 따라서 자외선에 의한 활성산소의 생성을 억제하거나 제거를 통해, 혹은 활 성산소에 의해 유도되는 다양한 신호전달계의 조절을 통해 자외선에 의한 다양 한 부정적인 작용의 제어를 기대할 수 있다. 이러한 관점에서 최근 UVB 유도
COX-2의 발현을 억제하는 것으로 보고된 바 있는 Fructose 1,6-diphspate (FDP)가 (Ahn SM 등, 2002) UVB에 의해 변화되는 세포내 신호전달 경로에 미치는 영향을 검토함으로써 FDP의 피부에서의 생리활성을 예측하고 그 활용성을 제공하고자 한다. B. Fructose 1,6-diphosphate (FDP) ◆ ◆◆ ◆ Fructose 1,6-diphosphate의의의의 생리활성생리활성생리활성생리활성 Fructose-1,6-diphosphate (FDP)는 해당과정 (glycolysis)상의 고에너지 대사 중간 체로서 당대사와 관련된 여러 효소들의 allosteric regulator로 작용할 뿐만 아니라 심혈관계 보호작용 등의 다양한 생리활성을 지니고 있는 것으로 알려져 있다. FDP는 풍선 혈관 확장술 (baloon angioplasty) 이후, 허혈/재관류에 따른 심장기능 손상에 대한 보호작용을 나타냄으로써 심장의 기능을 현저히 개선하는 것으로 보고된바 있다 (Nomura M 등, 2001). 즉, 심장 허혈 이후에 발생되는 호중구의 활 성화를 억제하여 자유 래디칼 (free radical)의 생성을 방지함으로써 심장의 산화적 손상을 감소시키고 (Markov AK 등, 1997), 재관류에 의한 arrythmia 발생을 억제하 고, 혈류역학 (hemodynamics)을 개선하며 심근의 수축력을 증가시킴으로써 허혈 성 심장에 대한 보호작용을 나타내는 것으로 알려져 있다. 또한, 최근 in vitro 혈 관 손상 모델에서 혈관 평활근의 이동 및 증식을 효과적으로 억제하는 것으로 보고된 바 있어 혈관 평활근 증식과 관련된 각종 혈관 질환에의 치료적 응용 가 능성이 주목되고 있다 (Cohly HH 등, 1999).
이외에도 FDP는 신장, 간, 뇌 등의 저산소성 손상 (hypoxic injury) 또는 허혈/ 재관류 손상 (ischemia/reperfusion injury)을 예방하며 실험적으로 유도된 내독소 숔 (endotoxic shock)을 경감시킴으로써, 생존율을 현저히 개선하는 것으로 보고된바 있다 (Edde L 등, 1998). 또한 FDP는 cyclosporine과 병용 투여시 심장 이식 거부반 응을 현저히 지연시켰다는 보고도 있다 (Hutcheson AE 등, 1995). FDP의 독성은 매 우 낮은 것으로 알려져 있으며 (Vexler ZS 등, 1999), 이러한 생리/약리 작용을 토 대로 현재 미국을 비롯한 선진 각국의 일부 의료 연구기관에서 FDP의 허혈/재관 류에 따른 심장기능 손상 억제를 위한 임상적 응용이 시도되고 있다 (Munger MA 등, 1994; Niu W 등, 1999). 또한 FDP는 내독소에 의해 자극된 대식세포에서의 iNOS 발현 및 저산소성 뇌손상에 의해 유도되는 iNOS의 발현을 억제하며 특히 후자의 경우 glutamate의 분비 억제와 밀접한 관계가 있는 것으로 알려져 있다. 그러나, 최근에는FDP가 in vitro에서 NOS (NO synthase)의 활성을 증가시킨다는 보 고도 있어 (Firestein BL와 Bredt DS, 1999), FDP에 의한 NO 생성 조절과 관련된 생 리활성의 평가는 재검토되어야 할 필요성을 시사하고 있다. ◆ ◆ ◆ ◆ FDP 작용기전작용기전작용기전 작용기전 FDP는 여러 생리활성을 가지고 있음에도 불구하고, 그 작용기전은 아직 뚜 렷이 밝혀진 바 없다. FDP의 작용은 ATP생성을 위한 기질 제공 (Sano W 등, 1995), 세포내 산화적 스트레스의 억제 (Sun JX 등, 1990), 세포외 calcium의 제거 (Edde L 등, 1998), 세포막의 안정화 (Rao MR 등, 1997) 등의 몇 가지 작용기전으 로 설명되고 있으나 이러한 이론들은 FDP의 유효성에 관한 인과관계를 설명하기
에는 그 실험적 근거가 불충분하며 또한 일부 결과와 부합되지 않는 경우도 있 다. 이와 관련하여 최근 산화적 스트레스에 저항성이 있는 세포들을 대상으로
gene microarray chip을 이용한 검색을 행한 결과, FDP의 활성이 현저히 증가되어
있으며, 이는 pentose phosphate pathway (PPP)의 활성화와 밀접한 관련성이 있는 것 으로 추정된다고 보고된 바 있다 (Voehringer DW 등, 2000). 이는 산화적 스트레 스에 대한 저항성 발현에 있어서의 FDP와 PPP의 역할을 시사하고 있다는 점에 서 매우 주목되고 있다, 또한 FDP는 세포내 GSH를 유지함으로써 산화적 스트레 스로부터 cortical neuron을 보호한다고 보고된 바 있는데 (Vexler ZS 등, 2003), FDP 는 PPP를 통해 GSH의 생성에 관련성이 있으므로 FDP가 PPP와 관련성이 있음을 시사해 주고 있다. 전술한 바와 같은FDP의 허혈/재관류 손상과 같은 산화적
stress에 대한 심혈관 및 뇌세포 보호작용을 설명할 수 있는 주요 작용기전이 될
수 있을 것으로 추정된다. 또한, 염증 등의 다양한 병리적 증상 발현과 밀접한
관련이 있는 PDGF, IL-1β등을 포함한 각종 mitogen들의 세포내 신호전달 과정에
있어서의 활성산소 (reactive oxygen species)들의 중심적 역할들을 감안하면
(Bonizzi G 등, 2000), FDP에 의한 PPP의 활성화와 그에 따른 세포내 산화적 스트 레스의 감소는, 각종 병리학적 증상 발현을 가장 upstream에서 조절하는 event가 될 수도 있을 것이다. 한편으로, FDP의 뇌세포 보호작용은 p38 MAPK/ERK 경로를 통한 ROS 생성 억제에 기인한다는 보고도 있어 (Park JY 등, 2004) FDP의 작용은 단순히 PPP를 경유한 항산화 작용에만 기인하지 않을 가능성이 제시되고 있어 FDP의 작용기전 에 대한 보다 세밀한 검토를 필요로 한다.
C. 연구과제의연구과제의연구과제의 목표연구과제의 목표목표목표
최근 human keratinocyte cell line (HaCaT)에서 FDP가 UVB 유도 prostaglandin 생성을 유의적으로 억제하며, 이는 COX-2 발현 및 그에 따른 cyclooxygenase 활 성 억제에 기인한다는 사실을 보고한 바 있다. 본 연구에서는 COX-2의 발현 외에도 자외선에 의해 유도되는 MMP활성증 가 등의 염증반응에 미치는FDP의 조절작용과 함께. UVB와 관련된 세포 신호 전달체계에 미치는 영향을 검토함으로써, UVB 유도 피부병변의 효과적 제어를 위한 FDP의 응용 가능성을 탐색하고 그 이론적 근거를 제시하고자 하였다. 마 지막으로 피부에 도포했을 때 자외선에 의해 유도되는 산화적 스트레스를 억제 할 수 있는지를 in vivo동물시험을 통해 검토함으로써 자외선에 의해 유도되는 피부의 생리학적 기능변화, 즉 피부 염증 및 노화, 피부암 등에의 응용 가능성 을 검토하고자 하였다.
II. 재료
재료
재료
재료 및
및
및
및 방법
방법
방법
방법
A. 재료재료재료 재료
Dulbecco’s modified Eagle’s medium (DMEM), Penicillin-streptomycin, 0.25% trypsin-EDTA는 Gibco, BRL (Grand Island, NY, USA)에서, fetal bovine serum 은 Hyclon (Logan, UT, USA)에서, D-fructose-1,6-diphosphate (FDP), N-acetylcysteine (NAC), 등은 Sigma (St. Louis, MO, USA)에서 각각 구매하였다. MAPK inhibior인 SP600125 (JNK inhibitor), PD98059 (ERK inhibitor), SB202190 (p38 inhibitor)와 wortmanin (PI3K inhibitor)는 Calbiochem (San Diego, CA, USA)에서 구입하였다. ERK, JNK, p38, Akt, GSK3β 항체는 Cell Signaling (Danvers, MA, USA)에서, SOD, Catalase, anti-DNP는 Sigma (St. Louis, MO, USA)에서 MMP-2, COX-2 항체는 CHEMICON (Temecula, CA, USA)에서 구입하여 사용하였다. 그 외에 사용된 시약은 따로 언급
이 없는 한 1급 이상의 것을 사용하였다.
B. 방법방법방법방법
1. 인간인간인간인간 피부피부피부피부 각질각질각질각질 세포세포주세포세포주주주 (HaCaT Keratinocyte) 및및및및 normal human fibroblast 의의의 배의 배배배 양
양양 양
인간 피부 각질 세포주인 HaCaT keratinocyte는 Dr. Fusenig (German Cancer
Research Center, DKFZ, Heidelberg, Germany)로부터 분양 받아 사용하였으며, normal human fibroblast는 사람의 포피로부터 분리 배양하여 사용하였다. 세포는 DMEM
세포배양기 (37 , 5% CO℃ 2 95% air)에서 배양하였다. 세포의 배양을 위해서는0.25%
trypsin-EDTA를 이용 하였으며, 96 well, 24 well plate에는 1x105/well, 6 well plate에는 1x106/ml의 세포를 가하여 overnight배양한 후 실험에 사용하였다.
2. 자외선자외선자외선A/B (UVA/UVB) 조사자외선 조사조사조사 및및및 약물및 약물약물약물 처리처리처리처리
자외선 A (UVA)는 UVATEC (Sherman Oaks, CA, USA) 조사기를 이용하였고,
자외선 B (UVB) 는 290~320 nm의 파장을 가지는 UVB lamp (G15T8EE SANYO
DENKI, Japan)을 이용하여 조사하였다. 광량은 IL1700 radiometer (International Light Inc., Newburyport, MA, USA)를 사용하여 측정하였다 자외선 조사 전에 배지를 제
거하고 세포를 PBS로 두 번 세척한 후에 PBS를 세포가 살짝 잠기게 가한 뒤 UVB 30 mJ/cm2, 또는 UVA 15 J/cm2 로 조사하였다. 자외선 조사 후 PBS로 한번 세척한 후에 새로운 DMEM (1% serum 함유) 배지를 넣고 FDP를 농도별로 처리 하였다. PD98059, SB202190 등의 약물은 자외선 조사 전에 30분간 전처리 하고 PBS로 두번 세척한 후 자외선 조사를 하고 다시 각 약물이 함유된 배지로 갈아 준 다음 일정 시간 동안 배양 후 시험에 이용하였다. 3. LDH assay 세포를 96웰 (well)형 세포배양 플레이트의 각 웰에 1X104개씩 넣고 24시간 동안 배양하였다. 18시간 후, 배양액을 제거하고 각 웰에 50 µl의 인산완충염액
(phosphate buffered saline, PBS)을 넣었다. 세포에 UVB 30 mJ/㎠를 조사한 후, PBS를
여기에 FDP를 각 농도로 처리한 후, 16~20시간 동안 배양하였다. 일정시간 경과 후, 배양 상층액을 적당량 취하여 세포 손상의 지표 효소인 젖산탈수소화효소
(lactate dehydrogenase, LDH)의 양을 정량하였다. 배양 상층액 중의 LDH 양은 Promega사 (Madison, WI, USA)의 Cytotox 96 non-radioactive cytotoxicity assay 키트
를 이용하여 정량한 후 흡광도는 ELISA reader를 이용하여 측정하였다. 4. DPPH assay 1,1-Diphenyl-2-picryl-hydrazyl (DPPH) 래디칼 소거 활성은 100 μM의 DPPH 용 액을 시료와 혼합하여 37℃에서 30분간 반응시킨 후 515 nm에서 흡광도 변화를 측정하였다. 5. Western analysis 전술한 바와 같이 처리한 피부세포를 일정시간 배양한 후 PBS로 세척한 뒤,
1.5 ml의 solubilizing buffer (10 mM Hepes, PH 7.6, 15 mM KCl, 2 mM MgCl2, 0.1 mM
EDTA, 1.0 mM dithiothreitol-DTT, 0.1% SDS, 0.2% Nonidet P-40)에 재현탁 시키고, 15
분간 얼음 위에 방치하였다. Cell lysate 을 18,000g, 10 분간 원심분리 하여 얻은 상층액으로부터 일정량의 단백질을 취하여 (20-40 µg) 10% polyacrylamide gel 상에 서 전기 영동한 다음, PVDF membrane에 전기적으로 transfer 하였다. Membrane을
5% non fat dry milk TBST (10 mM Tris (pH8.0), 150 mM NaCl, 0.05% Tween 20)로 1 시
간 동안 blocking한 뒤 Akt, phospho-Akt, phospho-GSK-3β, phospho-ERK, phospho-p38, 항체(1/1,000) 등의 1차 항체로 3-4 시간 동안 처리하고, horseradish peroxidase- 결
합 2차 항체 및 LumiGlo (NEN Biolabs, Beverly, MA, USA)를 이용하여 band intensity를 확인하였다.
6. RT-PCR
Total RNA는 acid guanidium thiocyanate-phenol chloroform (AGPC) 방법에 의하
여 분리한 후, denaturating solution (4M guanidium thiocyanate, 25 mM sodium citrate:
pH 7.0, 0.1 M 2-mercaptoethanol, 0.5 % sarcosyl), 2 M sodium acetate (pH 4.0), phenol 을 1:0.1:1 의 비율로 처리하고, chloroform/isoamyl alcohol (v/v, 49:1) 을 넣고 잘 섞은 후 4 ℃ 에서 5 분간 방치하였다. 10,000 g로 4℃에서 20 분 동안 원심분리하여 상 등액을 분리한 후 여기에 동량의 isopropyl alcohol 을 첨가하여 -20 ℃ 에서 1 시 간 동안 침전 시켰다. 10,000 g 로 4℃에서 20 분 동안 원심분리를 통해 RNA 침 전물을 얻어, 70% ethanol로 씻고 공기 중에서 10 분간 건조한 후 spectrophotometer를 이용하여 260 nm 에서 RNA양을 측정하였다.
Total RNA 1µg 을 취하여 first strand cDNA를 합성하며, Random primer p(dN)6
를 사용하여 5 mM MgCl2, 1 mM dNTP, 50U RNase inhibitor 의 조건하에서 20U
AMV reverse transcriptase (Boehringer Mannheim, Mannheim, Germany) 로 20 µl 반응
부피로 40℃ 에서 60분간 반응시켰다. 반응의 종료를 위해서 95℃ 에서 10분간 불활성화 시켰다. PCR 반응을 위해서 First strand cDNA template 2 µl를 취해서 각 각의 MMP isotype (MMP-1,2,3,9), GAPDH를 primer로 사용하여 1×PCR buffer (10
mM Tris/ HCl, 1.5 mM MgCl2, 50 mM KCl, pH 8.3) 에서 0.25 U Taq polymerase
(Boehringer Mannheim, Mannheim, Germany)로 PCR 반응하였다. MMP-2 primer forward (5’-CAC CTA CAC CAA GAA CYY CC-3’)
reverse (5’ AAC ACA GCC TTC TCC TCC TG-3’) GAPDH primer forward (5’-GGT CCG AGT CAA CGG ATT TG-3’) reverse (5’-ATG AGC CCC AGC CTT CTC CAT-3’)
PCR 반응 조건은 94℃ 에서 1분간 denaturation 시키고, 60℃에서 20 초간, annealing, 72℃에서 30초간 extension 하여 30회 PCR 반응을 시켰다.
7. MMP-2,9의의의의 활성활성활성활성 측정측정측정측정 (Zymography)
같은 protein 양을 loading 할 수 있도록 조절을 해서 sample과 같은 부피의
sample buffer(2X)를 혼합하여 실온에서 10분간 반응 시킨 후 10% zymogram gel (Invitrogen, Carlsbad, CA, USA)에 loading 하였다. 전기영동으로 protein을 분리하고, Novex Zymogram Renaturing Buffer (1X)로서 30분간 반응시켰다. 이후 Novex Zymogram Developing Buffer (1X)로 바꾸어서 약 1시간 상온에서 반응시킨 후 새
로운 developing buffer 로 교체하여 37℃에서 반응시켰다. Commassie blue R-250
solution (dye 50 mg, MeOH 22.5 ml, DW 22.5 ml, glacial acetic acid 5 ml)으로 염색 후 destaining solution (MeOH 5ml, glacial acetic acid 5 ml, DW 40 ml)으로 탈색하였다.
8. Electrophoretic mobility shift analysis (EMSA)
Nuclear extract는 Satriano 및 Schlondorff의 방법 (Satriano J와 Schlondorff D, 1994)에 의해 조제하였다. 세포를 PBS로 세척한 뒤, 1.5 ml의 hypotonic buffer A (10 mM Hepes, PH 7.6, 15 mM KCl, 2 mM MgCl2, 0.1 mM EDTA, 1.0 mM
dithiothreitol-DTT, 0.2% Nonidet P-40) 에 재현탁 시키고, 5분간 얼음 위에 방치하였다. 세포 homogenate를 650 g에서 원심 분리한 뒤, buffer A로 한번 세척하였다. Pellet 을
100 µl buffer C (25 mM Hepes, PH 8.0, 50 mM KCl, 0.1 mM EDTA, 1.0 mM dithiothreitol- DTT, 10% glycerol, 0.4M NaCl) 에 현탁하여 4℃에서 45 - 50분간 방치 후 18,000 g, 10 분간 원심분리 하였다. 상등 액을 일정량씩 분주한 후 사용할 때까지 -70 ℃
에 보관하였다.
3 µg 의 nuclear extract를 32P로 표지된 NF-κB specific oligonucleotide (5'-AGT TGA GGG GAC TTT CCC AGG C-3'), CREB sequence (5'-AGA GAT TGC CTG ACG TCA GAG AGC TAG-3'), AP-1( 5’-CGC TTG ATG AGT CAG CCG GAA-3’) 와 반응
시킨 뒤, non-denaturing polyacrylamide gel (4%)상에서 전기영동하고 (1X TBE buffer ,
PH 8.0) autoradiography를 수행하였다. DNA 결합은 1-4 µl 의 nuclear extract, 5x binding buffer (50 mM Hepes, PH7.5, 500 mM NaCl, 25% glycerol, 5 mM EDTA), 5000 cpm 의 oligonucleotide 및 1 µg poly dI-dC 존재 하에서 30분간 상온 반응 시킨다. Autoradiography 후 densitometry를 통해 DNA-protein complex의 양을 정량하였다.
9. 피부투과피부투과피부투과피부투과 시험시험시험시험
피부투과는 Franz-type glass diffusion 방법을 이용하여 시험을 수행하였다
(Franz T, 1975; Chilcott RP 등, 2000).
6-8주령 hairless mouse (Skh:hr-1) skin을 2 × 2 cm2 정도로 자른 후 프란츠 타
입의 글래스 확산기구 (franz-type diffusion cell, 내경 9 mm)에 피부를 잘 덮은 후 캡을 씌우고 고정을 시켰다. 리셉터 부분에 0.01 M 인산 완충용액 (pH 7.4)을 넣
고 확산기구의 온도는 섭씨 37 ± 0.1℃를 유지시켰다. 시험물질의 조제는 Sigma로
부터 구입한 2 µCi의 14C-FDP (0.1 mCi/ml, 248 mCi/mmol)을 1%의 FDP (270 mM in 70% water, 30% propylene glycol ) 용액에 1/10의 부피로 섞어서 사용하였다. 시험물
질 20 µl 을 피부의 각질층 면에 적용한 다음, 리셉터 용액 (인산 완충용액)을 일
정한 속도 (600 rpm)로 교반시킨 후 미리 정해진 시간 (4, 8, 24 시간)이 경과한 후 리셉터 부분의 용액을 0.5 ml 채취하고, 0.5 ml의 새로운 인산 완충용액을 보충해 주었다..
채취된 용액은 vial에 넣고 scintillation cocktail 2.5 ml을 가한 후 충분히
vortexing한 후 liquid scintillaton counter (LSC, Wallac 1409 DSA, Helsinki, Finland)로
측정하여 피부를 투과한 FDP의 양을 측정하였다. 24시간이 경과한 후 피부는 증 류수로 세척하고 솜으로 닦아낸 후 Transpore®
테이프 (3M, Saint Paul, MN, USA)를
이용하여 처음 1회 strip은 버리고 10회 연속 tape stripping한 것을 scintillation vial 에 넣고. 나머지 skin은 시험물질 도포부위를 잘라서 역시 scintillation vial에 넣은 후 각각의 vial에 scintillation cocktail 2.5 ml을 가한 후 충분히 vortexing하고 LSC로 측정하여 각질층과 피부에 잔류한 FDP의 양을 측정하였다.
10. In vivo동물시험동물시험동물시험동물시험
시험에 사용한 동물은 female albino hairless mice (Skh:hr-1)으로 Charles River
laboratories(Wilmington, MA, USA)로 부터 구입하여 사용하였다. 사육실의 사육조
건은 온도 23±3℃, 습도 50±10%, 환기회수 15 회/hr, 조도 150-300 Lux, 명암주기 12시간 (08:00~20:00)로 유지되도록 컨트롤 하였다. 시험은 6-8주령의 hairless mouse에 100 mJ/cm2 의 UVB를 1일 1회, 총 4 일간 조사하였다. 시험 물질은 UVB 조사 하루 전에 1회 도포하고 그 이후 UVB 조사 한 직후에 1일 1회씩 도포하였다. 시험군은 UVB를 조사하지 않고 vehicle을 도포 한 군, 자외선을 조사하지 않고 1%의 FDP를 도포한 군, 자외선을 조사하면서
vehicle을 도포한 군, 자외선을 조사하면서 1% FDP를 도포한 군으로 나누어 한
군당 6마리의 mouse를 시험에 사용하였다. 일정 시간이 경과한 후 hairless mouse 의 등 부위 피부를 도려내어 0.1 mM EDTA를 포함한 50 mM potassium phosphate
buffer (pH 7.0)에서 homogenize하여 균질액을 얻었다 (at 4℃). 얻어진 균질액을 18,000 X g에서 20분 동안 원심분리하고 상층액을 4겹의 cheese cloth를 사용하여
여과한 다음 얻어진 추출물을 분석에 사용하였다. 단백질 정량은 BCA protein
assay 방법으로 하였으며 모든 marker의 측정값은 단백질 농도로 보정하여 주었
다.
11. 항산화항산화항산화 효소항산화 효소효소 활성측정효소 활성측정활성측정활성측정
(1) Superoxide dismutase (SOD) assay
SOD 활성의 측정은 McCord and Fridovich의 방법 (McCord J 와 Fridovich I, 1969) 에 준하여 superoxide anion (O2-)을 scavenge하는 activity를 남은 O2-가
ferricytochrome C를 reduction시키는 속도로 측정 (O2 -
source : xanthine/ xanthine oxidase system) 하였다.
시험방법은 870 µl의 solution A (5 µM xanthine in 0.001N NaOH, 2 µM cytochrome C in 50 mM phosphate buffer(pH 7.8) containing 0.1 mM EDTA) 에 20 µg의 sample을
넣고 solution B (0.2 U/ml xanthine oxidase in 0.1 mM EDTA )을 20 µl를 첨가하여 1분
간 흡광도의 변화를 관찰하였다. SOD 활성의 1 unit는 xanthine/xanthine oxidase에 의한 O2
-의 발생에 -의해 550 nm에서-의 cytochrome
C의 환원이 50% 저해되는 활
(2) GSH assay
GSH의 측정은 Akerboom and Sies의 방법 (Akerboom TP 와 Sies H, 1981)으로 GSH가 DTNB와 반응하여 TNB를 형성하는데 사용되는 시약은 Ellman’s reagent (1.5 mg DTNB(5,5’-dithio-bis(2-nitrobenzoic acid))와 0.1 M Tris buffer (pH 8.0) containing 1mM EDTA)로 1 ml의 buffer에 30 µg의 sample을 넣고 20 µl의 Ellman’s reagent를 넣어 412 nm에서 흡광도의 증가를 측정하였다.
(3) Catalase assay
Catalase의 활성은 Baudhuin의 방법에 의거하여 (Baudhuin P 등, 1964) catalase
가 H2O2를 분해했을 때 유발되는 흡광도의 감소를 측정하였다. 사용되는 시약은
0.015 M H2O2 in 0.01M phosphate buffer (pH 7.0)에 50 µg의 sample을 넣어 240 nm에서
흡광도의 변화를 측정하였다.
12. Protein oxidation assay
단백질 산화의 정도는 Levine의 방법에 따라 (Levine RL 등, 1994) 단백질의
carbonyl group이 화학적으로 dinitrophenylhydrazone (DNP)로 바뀌는 성질을 이용하
여 Western blot을 통해, membrane의 단백질 band를 chemiluminescence로 검출하는 방법을 사용하였다. 방법을 간략하게 기술하면 OxyBlot Protein Oxidation Detection
Kit (Intergen, Purchase, NY, USA)을 이용하여 20 µg의 sample에 12% SDS와 2,4-dinitrophenylhydrazine (DNPH)을 넣어 2,4-dinitrophenylhydrazone (DNP-hydrazone)로
로 시행하였다. 10% SDS-polyacrylamide gel에 전기영동하여 polyvinylidene difluoride
(PVDF) membrane에 transfer하였다. 0.1% Tween과 5% non-fat dried milk로 block시키
고 anti-DNP antibody와 anti-rabbit IgG horseradish peroxidase을 차례로 반응시킨 후
chemiluminescence (Luminol)로 develop 하여 관찰하였다.
13. 통계처리통계처리통계처리통계처리
모든 자료는 mean ± S.E.로 나타내었고 Student’s t test로 통계 처리하여 p<0.05
III. 결과
결과
결과
결과
A. UVB에에에 의한에 의한의한의한 HaCaT keratinocyte 손상손상손상손상 보호효과보호효과보호효과 보호효과
1. UVB에 의한 세포손상 억제효과
자외선에 의한 cell death는 세포배양액으로 유리되는 젖산탈수소화효소
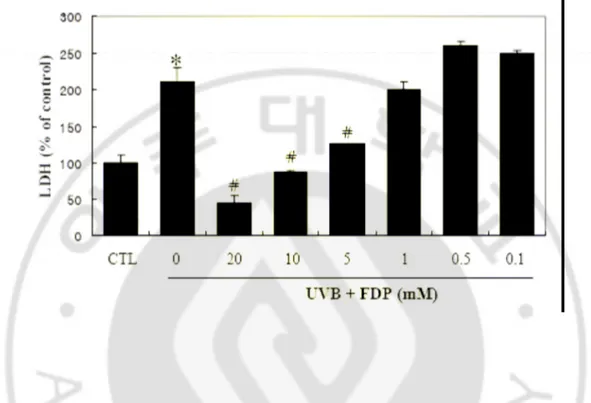
(lactate dehydrogenase, LDH)를 정량하는 방법으로 측정하였다. 배양한 HaCaT keratinocyte에 UVB 30 mJ/cm2 로 조사한 후 FDP를 20 mM부터 0.1 mM까지의 농도 로 처리한 결과 20, 10, 5 mM의 농도에서는 세포배양액으로 유리되는 LDH를 통 계적으로 유의한 수준으로 억제하였다 (Fig. 2).
2. Glycolytic metabolites의 UVB에 의한 세포손상 보호효과
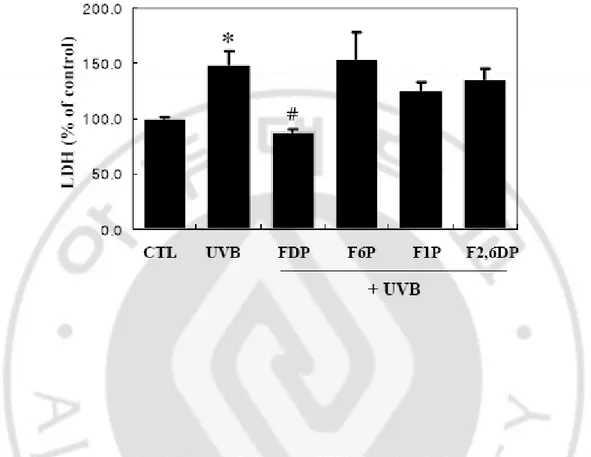
UVB에 의한 세포 배양액으로의 LDH유리가 FDP고유의 효과인지 여부를 검
증하기 위하여 동일한 조건 하에서 FDP, F6P (Fructose 6-phosphate), F1P (Fructose
1-phosphate), F2,6DP (Fructose 2,6-diphosphate)의 영향을 비교실험 하였다. 시험결과
배양한 HaCaT keratinocyte에 UVB 30 mJ/cm2
로 조사한 후 FDP를10 mM로 처리한 경우에는 통계적으로 유의한 수준으로 세포배양액으로 유리되는 LDH를 억제하 였으나, F6P, F1P, F2,6DP의 경우에는 자외선에 의해 유도되는 LDH 유리를 억제하 지 못하였다 (Fig. 3).
Fig. 2. Effects of FDP on UV-induced cell death. Cells were UVB-irradiated (30 mJ/cm2)
and further incubated with FDP for 24 h in DMEM containing 1% serum. The activity of LDH released in media was measured. The results are expressed as mean ± S.E. in four different experiments. * p<0.05 vs control; # p<0.05 vs UV treated.
Fig. 3. Effects of glycolytic metabolites on UV-induced cell death. Cells were
UVB-irradiated (30 mJ/cm2) and further incubated with FDP metabolites (10 mM) for 24 h in DMEM containing 1% serum. The activity of LDH released in media was measured. The results are expressed as mean ± S.E. in four different experiments. * p<0.05 vs control; #
3. UVB에 의해 유도되는 COX-2 발현에 미치는 영향
자외선에 의해 COX-2 단백질의 발현증가를 Western Blot으로 확인하였다. 배 양한 HaCaT keratinocyte에 UVB 30 mJ/cm2
로 조사한 후 FDP를 20 mM, 10 mM의 농도로 처리한 결과 자외선에 의한 COX-2 단백질 발현을 농도 의존적으로 억제 하는 경향을 나타내었다. 항산화물질중 하나인 NAC 10 mM을 처리한 경우에도 자외선에 의한 COX-2 단백질의 증가가 효과적으로 감소되는 것을 확인할 수 있 었다 (Fig. 4).
Fig. 4. FDP prevents the UV-induced COX-2 expression in cultured HaCaT keratinocytes. Cells were UVB-irradiated (30 mJ/cm2) and further incubated with FDP and NAC (10 mM) for 24 h in DMEM containing serum 1%. Total protein was extracted and 20
µg of proteins was subjected to SDS-acrylamide gel electrophoresis, and analyzed by Western blotting using specific antibody. UVB irradiation significantly increased COX-2 protein compared with unirradiated control. FDP and NAC, a precursor of glutathione, prevented this alteration.
4. UVB에 의해 유도되는 MMP-2활성 및 발현에 미치는 영향
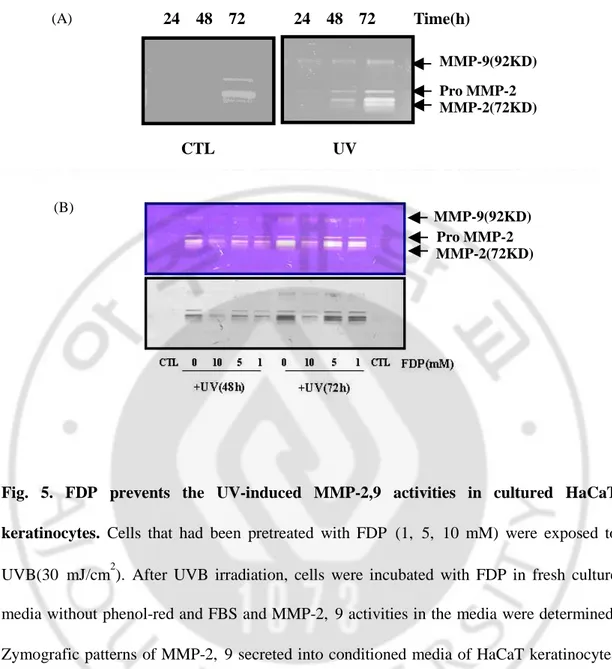
자외선 조사에 의해서 피부에서 MMP의 활성 및 발현이 증가한다는 것은 잘 알려진 사실이다. 표피유래 Keratinocyte에서 발현된다고 알려진 MMP-2,9의 활성 을 Zymograpy를 이용하여 확인하였다. 배양한 HaCaT keratinocyte에 UVB 30
mJ/cm2 로 조사한 후 세포 배양액으로 유리되는 MMP-2, 9의 활성이 시간에 따라 증가하는 것을 확인할 수 있었으며, 자외선 조사 후 48, 72 시간째 MMP-2, 9의 활성이 확연히 증가하는 것을 Zymograph를 통해 확인할 수 있었다 (Fig. 5A).
UVB조사 후 FDP를 10, 5, 1 mM의 농도로 처리한 결과 농도 의존적으로 자외선에 의한 MMP-2,9의 활성이 억제되는 것을 확인할 수 있었다 (Fig. 5B). 자외선에 의 해 증가된 MMP-2, 9의 활성이 발현의 증가에 의한 것인지를 검증하기 위하여 RT-PCR을 통해 mRNA의 발현을 확인하였다. 시험결과 UVB 조사에 의해 MMP-2의 발현이 증가되는 것을 확인할 수 있었으며, FDP 10 mM을 처리한 경우 자외 선에 의한 MMP-2 발현이 억제되는 경향을 나타내었다 (Fig. 6). 그러나 MMP-9의 경우는 자외선에 의한 mRNA 의 발현증가 경향이 나타나지 않았다.
Fig. 5. FDP prevents the UV-induced MMP-2,9 activities in cultured HaCaT keratinocytes. Cells that had been pretreated with FDP (1, 5, 10 mM) were exposed to
UVB(30 mJ/cm2). After UVB irradiation, cells were incubated with FDP in fresh culture media without phenol-red and FBS and MMP-2, 9 activities in the media were determined. Zymografic patterns of MMP-2, 9 secreted into conditioned media of HaCaT keratinocytes after UVB irradiation(A). UVB irradiation significantly increased MMP-2, 9 activites compared with unirradiated control. FDP prevented this alteration(B).
Time(h) UV CTL 24 48 72 24 48 72 (A) MMP-9(92KD) Pro MMP-2 MMP-2(72KD) MMP-9(92KD) Pro MMP-2 MMP-2(72KD) (B)
Fig. 6. FDP prevents the UV-induced MMP-2 expression in cultured HaCaT keratinocytes. Cells that had been pretreated with FDP (10 mM) were exposed to UVB (30
mJ/cm2). After UVB irradiation, cells were incubated with FDP in fresh culture media for indicated time until 8 h and mRNA levels of MMP-2 was determined by RT-PCR. The graph was depicted with arbitrary unit of MMP-2 mRNA/GAPDH ratio.
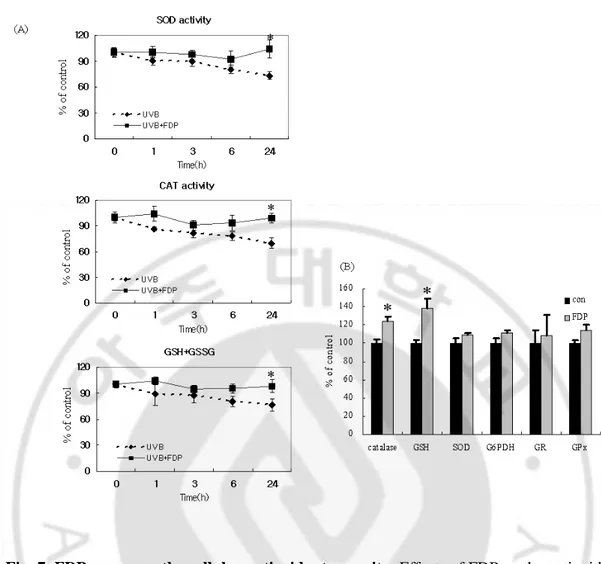
5. UVB 조사에 의한 세포 항산화 시스템변화에 미치는 영향
기존 연구결과에 의하면 FDP는 산화적 스트레스에 대항해 세포내 GSH를 보 존함으로써 세포를 보호한다는 보고가 있으며 (Vexler ZS 등, 2003), HaCaT
keratinocyte에서 UVB에 의해 생성되는 세포내 H2O2를 억제한다는 보고도 있었다
(Ahn SM 등, 2002). 자외선에 의한 세포내 항산화 시스템의 변화에 FDP가 미치는
영향을 보기 위하여 배양한 HaCaT keratinocyte에 UVB 30mJ/cm2 로 조사한 후 시
간대별로 항산화 효소인 SOD, CAT 활성의 변화와 GSH의 변화를 측정하였다. 또 한 UVB를 조사하고 FDP를 처리한 후 SOD, CAT 활성의 변화와 GSH의 변화를 측정하였다. 실험결과 HaCaT keratinoyte에 UVB 조사 후 24시간까지 SOD, CAT의 활성 및 GSH가 감소함을 확인할 수 있었고, UVB 조사 24 시간 후 변화정도는 대조군 대비 SOD의 활성은 74.97±5.8%, CAT의 활성은 72.62± 4.5%로 감소하였으
며, GSH의 양은 대조군 대비 76±7.1%로 감소되었다 (Fig. 7A). 그러나, UVB를 조
사하고 FDP 10 mM을 처리한 경우는 UVB를 조사하지 않은 대조군 수준으로
SOD, CAT, GSH의 활성이 유지되는 것을 확인할 수 있었다 (Fig. 7A). 한편, UVB
를 조사하지 않은 상태에서 FDP를 처리한 경우 대조군에 비해 catalase의 활성과
GSH의 양이 증가하는 것을 확인할 수 있었다 (Fig. 7B).
UVB에 의해 야기되는 산화적 스트레스를 현저히 감소시키는 효능을 보이는 FDP가 자체적으로 radical scavenging 효능이 있는지를 DPPH법으로 검증한 결과 radical scavenging에 의해 항산화 효능이 있다고 알려진 vitamin C의 IC50 값이 약
50 µM인데 반면, FDP는 500 µM의 농도까지 전혀 radical scavenging 효과를 나타내
Fig. 7. FDP preserves the cellular antioxidant capacity. Effects of FDP on the antioxidant
capacity of HaCaT keratinocytes with (A) or without (B) exposures to UVB were examined. HaCaT keratinocytes that had been exposed to UV irradiation (30 mJ/cm2) were incubated with FDP (10 mM) in fresh culture media containing 10% FBS for 24 h. Cells were harvested by scraping and antioxidative parameters were measured. The results are expressed as mean ± S.E. of four different experiments. * p<0.05
Fig. 8. DPPH radical-scavenging activity of the FDP. The reaction mixture contained 0.1
ml of 1 mM DPPH radical solution, 0.8 ml of 99% ethanol, and 0.1 ml of test compounds The solution was rapidly mixed and scavenging capacity was measured spectrophoto- metrically by monitoring the decrease in absorbance at 515 nm.
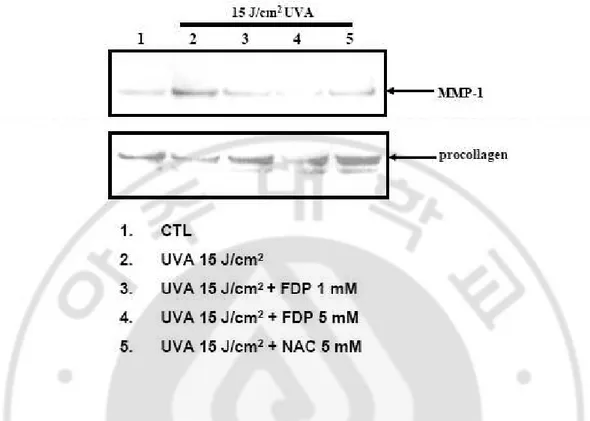
B. UVA에에에 의한에 의한의한의한 Fibroblast 손상손상손상손상 보호효과보호효과보호효과 보호효과 피부의 진피층을 구성하는 세포는 대부분 fibroblast이며, 자외선 중에서도 파 장이 긴 UVA는 피부 진피층까지 영향을 미친다고 알려져 있다. 앞서 연구결과 를 바탕으로 자외선에 의한 피부손상에 있어서 FDP의 영향을 알아 보기 위하여 UVA에 의해 발현이 감소한다고 알려진 procollagen 및 콜라겐 분해에 가장 중요 한 역할을 하며 UVA에 의해 발현이 증가한다고 알려진 MMP-1에 미치는 영향에 대해 실험을 진행하였다. 또한 UVA에 의한 항산화 시스템의 손상에 대한 효과 를 보기 위하여 세포내 GSH의 감소에 대한 FDP의 보호효과에 대한 실험을 진행 하였다. 1. UVA에 의한 procollagen의 발현에 미치는 영향 배양한 fibroblst에 UVA를 15 J/cm2 로 조사한 후 세포배양액으로 유리되는
procollagen의 양을 Western blot으로 측정하였다. 결과 UVA 15 J/cm2 로 조사한 경 우 세포배양액으로 유리되는 procollagen이 현저하게 감소하는 것을 관찰할 수 있 었으며, FDP 1, 5 mM을 처리한 경우에는 procollagen의 발현 감소가 관찰되지 않았 다 (Fig. 9). 항산화제로 알려진 NAC 5 mM을 처리한 경우에도 같은 경향을 나타 내었다. 2. UVA에 의한 MMP-1발현에 미치는 영향 배양한 fibroblst에 UVA 를 15 J/cm2 로 조사한 후 세포배양액으로 유리되는
MMP-1의 양을 Western blot으로 측정하였다. 결과 UVA 15 J/cm2 로 조사한 경우 세포배양액으로 유리되는 MMP-1이 현저하게 증가하는 것을 관찰할 수 있었으며,
FDP 1, 5 mM을 처리한 경우에는 UVA에 의한 MMP-1의 발현이 억제되는 것을 확 인할 수 있었다. 항산화제로 알려진 NAC 5 mM을 처리한 경우에도 같은 경향을 나타내었다 (Fig. 9). 3. UVA에 의한 GSH 감소에 미치는 영향 Fibroblast에 UVA 15 J/cm2로 조사한 후 시간대별로 GSH의 변화를 측정하고, 동시에 FDP를 처리한 후 UVA를 조사하고 GSH의 변화를 측정하였다. 실험결과 fibroblast에 UVA 조사 후 8시간대에 GSH가 현저하게 감소함을 확인 할 수 있었 고, 이러한 현상은 72시간까지 지속되었다. 그러나 UVA와 동시에FDP를 처리한 군의 경우는 UVA를 조사하지 않은 대조군과 유사한 정도로 GSH 양의 변화가 관찰되지 않았다 (Fig. 10).
Fig. 9. FDP prevents the UV-induced MMP-1 expression and procollagen depression in cultured skin fibroblast. Normal human fibroblast that had been exposed to UVA
irradiation (15 J/cm2) were incubated with FDP (1, 5 mM) and NAC (5 mM) in fresh culture media containing 10% FBS for 48 h. The media containing MMP-1 and procollagen were subjected to SDS-acrylamide gel electrophoresis, and analyzed by Western blotting using specific antibody. UVA irradiation significantly increased MMP-1 protein and decreased procollagne level compared with unirradiated control. FDP and NAC, a precursor of glutathione, prevented these alteration.
Fig. 10. FDP preserves the GSH in cultured skin fibroblast after UVA irradiation.
Normal human fibroblasts that had been exposed to UVA irradiation (15 J/cm2) were incubated with FDP (1 mM) in fresh culture media. UVA-irradiation decreased total glutathione level compared with unirradiated control. The results are expressed as mean ± S.E. of three different experiments. * p<0.05
C. 자외선에자외선에자외선에 의해자외선에 의해의해의해 유도되는유도되는유도되는유도되는 세포내세포내 신호전달계에세포내세포내 신호전달계에신호전달계에신호전달계에 미치는미치는미치는미치는 영향영향영향영향 전술한 바와 같이 FDP는 UVB에 의해 야기되는 염증인자, 즉 COX-2, MMP-2,9의 활성 및 발현을 유의적으로 억제하며, UVA에 의해 야기되는 procollagen의 감소 및 MMP-1의 발현을 효과적으로 억제 하였다. 또한 자외선에 의한 세포내 산화적 스트레스를 유의적으로 감소시키는 효능도 있음이 밝혀졌다. 따라서 FDP 는 자외선에 의해 발생할 수 있는 다양한 피부세포 기능을 조절할 수 있을 것이 라 기대된다. 이러한 FDP의 효능이 어떠한 작용기전에 의해 일어나는 현상인지 좀 더 세밀히 검토해 보기 위하여 HaCaT keratinocyte에서 UVB에 의해 유도되는
COX-2, MMP-2의 발현과 관련된 세포내 신호전달체계를 중심으로 FDP의 영향을
검토하였다.
1. 자외선에 의해 유도되는 MAPK 활성에 미치는 영향
자외선에 의해 유도되는 MAPK의 활성화에 미치는 FDP의 영향을 보기 위하 여 배양한 HaCaT keratinocyte에 자외선 조사 전 FDP 10 mM을 처리하고 UVB (30
mJ/cm2)를 조사한 후 다시 FDP를 동일 농도로 가한 뒤 시간별로 MAPK의 인산 화에 미치는 영향을 검토하였다. 결과에서 보듯이 UVB조사 10분 후부터 ERK/JNK/p38가 인산화되는 것을 확인할 수 있었으며, 이후 감소하기 시작하여 4 시간대에는 대조군 수준으로 떨어지는 것을 관찰할 수 있었다 (Fig. 11A). FDP는 이러한 ERK/JNK의 인산화를 억제하였으나, p38 MAPK는 FDP의 처리에 의해서 인산화가 억제되는 현상이 관찰되지 않았다 (Fig. 11A). UVB에 의한 ERK/JNK 인산화는 10 mM의FDP를 처리한 경우 강하게 억제되 었으며, 1 mM FDP을 처리하였을 경우에는 인산화가 억제되는 현상을 관찰하지
못하였다. 또한 UVB에 의한 p38의 인산화를 FDP가 억제하지 못했던 결과와 달 리 항산화제로 알려진 NAC에 의해서는 UVB에 의해 인산화 된 ERK/JNK/p38 모 두 강하게 억제되는 현상이 관찰되었다 (Fig. 11B).
2. 자외선에 의해 유도되는 PI3K/Akt 활성에 미치는 영향
MAPK외에도 cell survival에 주로 관여하는 PI3K/Akt 경로 또한 UV에 의해
유도되는 중요한 세포내 신호전달 경로이다. 특히 최근에는 UV에 의한 HaCaT
keratinocyte 에서의 COX-2 발현에 Akt및 GSK3β의 관련성이 중요하게 대두된 바
있다. 따라서 UVB에 의한 Akt/GSK3β의 인산화에 대한 FDP의 영향을 검토하였
다. 실험결과 UVB조사 10분 후부터 MAPK와 마찬가지로 Akt/GSK3β 가 인산화
되는 것을 확인할 수 있었으며, 이후 인산화가 유지되다가 4시간 대에는 대조군 수준으로 떨어지는 것을 관찰할 수 있었다 (Fig. 12A). UVB에 의한 Akt 및
GSK3β의 인산화는 10 mM의FDP를 처리한 경우 억제되었으며, 또한 항산화제로
알려진 NAC에 의해서도 UVB에 의해 인산화된 Akt가 억제되는 현상을 관찰할 수 있었다 (Fig. 12B).
Fig. 11. FDP inhibits UVB-induced ERK and JNK phosphorylation in HaCaT keratinocyte. HaCaT keratinocytes were starved by replacing the medium with serum free
DMEM and culturing for 24 h. The cells were then pretreated with FDP (10 mM) for 30 min. The cells were irradiated with UVB (30 mJ/cm2) and subsequently cultured for indicated time (A). HaCaT keratinocytes were pretreated with FDP and NAC (10 mM). The cells irradiated with UVB and subsequently cultured for 10 min (B). The cells were lysed, and the phosphorylation levels were estimated by immunoblotting.
Fig. 12. FDP inhibits UVB-induced Akt and GSK3ββββ phosphorylation in HaCaT keratinocyte. HaCaT keratinocytes were starved by replacing the medium with serum free
DMEM and culturing for 24 h. The cells were then pretreated with FDP (10 mM) for 30 min. The cells were irradiated with UVB (30 mJ/cm2) and subsequently cultured for indicated time (A). HaCaT keratinocytes were pretreated with FDP and NAC (10 mM). The cells irradiated with UVB and subsequently cultured for 10 min (B). The cells were lysed, and the phosphorylation levels were estimated by immunoblotting.
3. 자외선에 의해 유도되는 transcription factor활성에 미치는 영향
다음은 FDP가 COX-2, MMP-2관련 transcription factor의 활성에 미치는 영향을 검토하였다. FDP는 UVB에 의해 유도되는 NF-κB, AP-1, CREB등, transcription factor
의 활성을 억제하였다 (Fig. 13). 또한 UVB에 의해AP-1의 구성성분 중 하나인
Jun의 활성화에 미치는 FDP의 영향을 검토한 결과, UVB조사 후 10 분 후부터 c-Jun의 인산화가 관찰되었으며 (ser 73), 자외선 조사 후 4시간까지도 인산화가 지
속되는 현상을 관찰할 수 있었다 (ser63) (Fig. 14A). UVB에 의한 c-Jun의 인산화는
FDP 10 mM 처리에 의해 강하게 억제되었으며, 항산화제인 NAC에 의해서도 억제
Fig. 13. FDP attenuates UVB-induced transcription factors activities. HaCaT were
pretreated with FDP (10 mM) for 30 min. The cells were then irradiated with UVB (30 mJ/cm2) and subsequently cultured for indicated time. And DNA binding activity of transcription factors were determined by EMSA as described in materials and methods.
Fig. 14. FDP inhibits UVB-induced c-Jun phosphorylation in HaCaT keratinocyte.
HaCaT keratinocytes were starved by replacing the medium with serum free DMEM and culturing for 24 h. The cells were then pretreated with FDP (10 mM) for 30 min. The cells were irradiated with UVB (30 mJ/cm2) and subsequently cultured for indicated time (A). HaCaT keratinocytes were pretreated with FDP and NAC (10 mM). The cells irradiated with UVB and subsequently cultured for 1 h (B). The cells were lysed, and the phosphorylation levels were estimated by immunoblotting.
4. 자외선에 의한 MMP-2발현에 영향을 미치는 세포내 신호전달계에 대한 FDP의
영향
UVB에 의해 증가되는 MMP-2의 발현 조절에 영향을 미치는 세포내 신호전
달계에 대해 검토하였다. UVB 조사 한 경우 MMP-2의 발현이 증가하였으며, FDP 와 NAC 10 mM 을 처리한 경우 대조군 수준으로 발현이 억제되었다. MAPK
inhibitor중 SP600125 (5 µM, JNK inhibitor)와 wortmannin (100 nM, PI3K inhibitor)을
처리한 경우 MMP-2의 발현이 강하게 억제되었으며, SB202190 (5 µM, p38 inhibitor)
에 의해서도 발현이 억제되는 경향을 나타내었다. 그러나 PD98059 (10 µM, ERK inhibitor)을 처리한 경우에는 UVB에 의한 MMP-2의 발현을 억제하지 못하였다 (Fig. 15). Fig. 11 결과에서 FDP는 UVB에 의해 유도되는 p38의 활성화를 억제하지
못하였으므로 이상의 결과를 볼 때, FDP에 의해 조절되는 UVB 유도 MMP-2 발 현은 JNK/PI3K을 경유하는 것으로 유추할 수 있다.
Fig. 15. Effects of MAPK and PI3K inhibitor on UVB-induced MMP-2 expression in HaCaT keratinocyte. The cells were pretreated with FDP (10 mM), NAC (10 mM),
PD98059 (10 µM), SB202190 (5 µM), SP600125 (5 µM), wortmannin (100 nM) for 30 min. The cells were irradiated with UVB (30 mJ/cm2) and subsequently cultured for 24 h and protein levels of MMP-2 was determined by immunoblotting. The graph was densitometric analysis for pro-MMP-2 and active MMP-2.
5. 자외선에 의한 COX-2발현에 영향을 미치는 세포내 신호전달계에 대한 FDP의
영향
UVB에 의해 증가되는 COX-2의 발현에 조절에 영향을 미치는 세포내 신호
전달계에 대해 검토하였다. UVB 조사 한 경우 COX-2의 발현이 증가하였으며,
FDP와 NAC 10 mM 을 처리한 경우 대조군 수준으로 발현이 억제되었다. MAPK inhibitor중 SB202190 (5 µM, p38 inhibitor) 와 wortmannin (100 nM, PI3k inhibitor)을
처리한 경우 MMP-2의 발현이 강하게 억제되었으며, PD98059 (10 µM, ERK
inhibitor)에 의해서도 발현이 억제되었다. 그러나 SP600125 (5 µM, JNK inhibitor)을
처리한 경우에는 UVB에 의한 COX-2의 발현을 억제하지 못하였다 (Fig. 16). 이상 의 결과를 볼 때, FDP에 의해 조절되는 UVB에 유도 COX-2 발현은 ERK/PI3K을 경유하는 것으로 유추할 수 있다.