저작자표시-비영리-변경금지 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 비영리. 귀하는 이 저작물을 영리 목적으로 이용할 수 없습니다. 변경금지. 귀하는 이 저작물을 개작, 변형 또는 가공할 수 없습니다.
이학 석사학위 논문
이독성 난청에 의한 세포사멸 지도 분석:
세포자살, 자가포식, 그리고 네크로토시스
아 주 대 학 교 대 학 원
의 생 명 과 학 과
최 미 진
이독성 난청에 의한 세포사멸 지도 분석:
세포자살, 자가포식, 그리고 네크로토시스
Cell death map in drug-induced ototoxicity:
apoptosis, autophagy, and necroptosis
지도교수 정 연 훈
이 논문을 이학 석사학위 논문으로 제출함.
2019 년 2 월
아 주 대 학 교 대 학 원
의 생 명 과 학 과
최 미 진
-국문요약-
이독성 난청에 의한 세포사멸 지도 분석:
세포자살, 자가포식, 그리고 네크로토시스
감각신경성 난청 (sensorineural hearing loss)은 우리 일상에서 가장 흔한 만성질환 및 장애 중에 하나이다. 발병 원인에 따라 이독성, 노인성, 선천성, 돌발성, 음향 외상 및 소음성 난청 등 다양한 요인에 따라 분류된다. 난청은 언어습득 및 발달 장애를 초래하고 이는 인간의 최대 장점인 언어를 활용한 의사소통에 중대한 지장을 주므로 삶의 질에 막대한 영향을 미치게 된다. 이독성 난청의 명확한 발병기전이나 세포사멸 경로가 밝혀지지 않았기 때문에 이를 극복하기 위한 치료제는 세계적인 연구 노력에도 불구하고 미개발 상태이며, 신경 자극 장치 (neural prosthesis)인 인공 와우 이식기(cochlear implant)와 청성 뇌간 이식 장치 (auditory brainstem implant)에 의존하고 있다. 따라서 이독성 난청의 세포사멸 기전을 밝히는 것이 치료 약제 개발에 중요한 시발점이 될 수 있다. 본 연구의 목적은 아미노글리코사이드계 (aminoglycosides) 항생물질인 젠타마이신 (gentamicin)과 항암제의 일종인 시스플라틴 (cisplatin)에 의해 야기되는 이독성 난청의 세포사멸 기전을 밝히는데 초점을 맞추어, 프로그램 된 세포자살기전인 아포토시스 (apoptosis), 자가소화작용 오토파지 (autophagy), 세포 괴사 네크로토시스 (necroptosis)와 같이 대표적인 3 가지 세포사멸 기전을 조사하고자 하였다. 본 연구를 위한 이독성 난청 모델을 확립하기 위해 젠타마이신 (200 mg/kg)과 시스플라틴 (16 mg/kg)을 SD 렛트에 각각 근육 주사와 복강내 주사로 주입하여 약물에 따른 청력변화 여부를 청성 뇌간 반응 검사 (Auditory Brainstem Response,
ABR)를 통해 측정한 결과 두 약물 모두 유의하게 청력 역치 값이 8, 16, 32 킬로 헤르츠 (kHz)에서 각각 평균 20dB 이상 공히 증가하여 약물에 의한 청력감소 현상을 보이는 실험 동물 모델을 확립하였다. 청력이 감소된 렛트를 희생시켜 와우를 분리, 채취한 후 조직 절편화 샘플을 사용하여 헤마톡실린 (hematoxylin)-에오신 (eosin) 염색을 통한 형태학적 분석을 실시하였다. 그 결과 가장 두드러지게 관찰된 특징으로는 나선 신경절 (spiral ganglion neuron) 핵에서의 절편화와 응축화와 같은 형태학적 변형과 세포 수의 감소였다. 그 후 두 약물에 의한 세포사멸 기전을 조사하고자 면역조직화학 (immunohistochemistry) 염색을 실시하여 본 바, 젠타마이신 실험 군에서 아포토시스 마커인 cleaved caspase-3 와 오토파지 마커인 LC3B 단백질이 증가하는 것을 관찰하였으며, 네크로토시스 마커인 RIP3 와 MLKL 그리고 일부 LC3B 단백질이 시스플라틴에 의해 증가되는 것으로 관찰하였다. 더불어 와우 조직 및 청각 유모세포 (HEI-OC1)를 이용한 세포 실험에서도 유사한 결과를 관찰하였다. 해당 세포사멸 기전 억제제 사용 시 유의하게 세포사멸을 억제하는 것으로 관찰하였다. 위 결과들로 미루어 보아 젠타마이신에 의해 아포토시스와 오토파지 세포사멸 기전이 유발되며 시스플라틴에 의해서는 네크로토시스와 일부 오토파지가 유도되는 것으로 판단된다. 따라서 젠타마이신과 시스플라틴 두 약물에 의한 세포사멸 기전은 서로 다르며, 세 가지 기전이 각각 독립되어 발생하는 것이 아니라 2 가지 이상의 세포사멸 기전이 서로 cross-link 되어 세포사멸을 야기하는 것으로 사료된다. 또한 생체 외 실험을 통해 해당 기전 억제제를 사용 시 통계적으로 유효하게 세포사멸이 억제되는 것을 관찰한 바 본 연구 결과를 바탕으로 해당 세포사멸 기전을 제어하는 생체 내 후속 연구를 통해 향후 이독성 난청 억제 및 치료제 개발에 중요한 단서를 제공할 것으로 기대한다.
핵심어 Keyword: 난청 (hearing loss), 젠타마이신 (gentamicin), 시스플라틴 (cisplatin), 청성 뇌간 반응 (ABR), 아포토시스 (apoptosis), 네크로토시스 (necroptosis), 오토파지 (autophagy)
차 례
국문 요약 ... i 차례 ... iii 그림 차례 ... v 표 차례 ... vi Ⅰ. 서론 ... 1 Ⅱ. 실험 재료 및 방법 I. 생체 내 실험 (In vivo study) A. 실험동물 ... 17B. 이독성 난청 모델 제작 ... 17
C. 청성 뇌간 반응 (Auditory Brainstem Response, ABR) 검사 ... 19
D. 헤마톡실린-에오신 (hematoxylin-eosin, H&E) 염색 ... 19
E. 면역조직화학염색 (immunohistochemistry) ... 20
F. 조직 균질화 (tissue homogenization) ... 20
II. 생체 외 실험 (In vitro study) A. 세포 배양 ... 21
B. 세포 생존율 측정 ... 21
C. 웨스턴 블롯 분석 (western blot analysis) ... 22
D. 항체와 시약 (antibody & reagent) ... 23
Ⅲ. 결과
A. 젠타마이신과 시스플라틴 투여에 의한 이독성 난청 유발 ... 25
B. 이독성 난청 모델 와우 조직의 형태학적 분석 ... 27
C. 이독성 난청 모델 와우 조직 내 세포사멸 기전 분석 a. 아포토시스 마커 분석: Cleaved caspase-3 분석 ... 29
b. 오토파지 마커 분석: 경연쇄 (microtubule-associated protein light chain) 3B 분석 ... 31
c. 네크로토시스 마커 분석: Receptor-interacting protein 1 (RIP1)과 Mixed lineage kinase domain-like protein (MLKL) 분석 ... 33
D. 이독성 난청 모델 와우 조직의 세포사멸 마커 단백질 분석 ... 36
E. House Ear Institute-Organ of Corti 1 (HEI-OC1) 세포주를 이용한 세포사멸 기전 조사 ... 38 F. 세포사멸 기전 특이 억제제를 통한 젠타마이신과 시스플라틴의 이독성 제어 여부에 대한 조사 ... 42 Ⅳ. 고찰 ... 47 Ⅴ. 결론 ... 54 참고 문헌 ... 55 ABSTRACT ... 60
그림 차례
Fig. 1. Apoptosis can take place either through the extrinsic (receptor-mediated) or the
intrinsic (mitochondrial) pathway. ... 10
Fig. 2. The receptor-mediated activation pathway of apoptosis and necroptosis or NF-κB by TNF-α treatment. ... 12
Fig. 3. The process of autophagic flux. ... 14
Fig. 4. Study designs of gentamycin and cisplatin-induced hearing loss. ... 18
Fig. 5. Analysis of ABR threshold shift. ... 26
Fig. 6. Histological analysis of drug-induced ototoxicity animal model. ... 28
Fig. 7. Immunohistochemistry analysis. ... 30
Fig. 8. Immunohistochemistry analysis. ... 32
Fig. 9. Immunohistochemistry analysis. ... 34
Fig. 10. Immunohistochemistry analysis. ... 35
Fig. 11. Protein expression of cell death marker in whole cochlear fractions. ... 37
Fig. 12. Dose-dependent cell viability (WST-1 assay) of HEI-OC1 cells treated with gentamicin or cisplatin in HEI- OC1 cells. ... 40
Fig. 13. Protein expression of cell death marker in HEI-OC1 cells. ... 41
Fig. 14. The effect of cell death inhibitors for the viability of HEI-OC1 cells under treatment with gentamicin or cisplatin. ... 44
표 차례
Table 1. Classification of hearing loss. ... 4 Table 2. Ototoxic drugs and related ear diseases. ... 6
I. 서론
난청 (hearing loss) 이란 음파의 전달이 정상적으로 이루어지지 않아 소리를 잘 듣지 못하는 질환으로 언어 습득 및 발달장애를 초래하고 언어를 통한 의사소통에 막대한 지장을 주어 삶의 질에 크게 영향을 미친다. 난청은 전 인구의 약 10% (경도~심도 난청)가 가지고 있는 흔한 질환으로 알려져 있으나 현재까지 보청기와 인공 와우 이식술 외에 특별히 개발된 명확한 치료제가 없다. 또한 복합적 발병기전으로 연구에도 제약이 아주 크다. 난청 예방과 치료는 ‘삶의 질 제고’ 및 의료 경제, 사회적 부담을 완화시킬 수 있는 중요한 요소로써 인식이 높아지고 있다 (Cruickshanks et al., 1998). 현재 인구의 고령화로 난청의 인구도 급속한 증가 현상을 보이며 더불어 삶의 질 향상에 대한 관심도가 높아지고 있다. 최근 치매율이 난청과 매우 밀접한 연관성이 있으며 난청 환자의 인지기능 저하가 중요한 치매 발병 원인들 중 하나로 보고되고 있다 (Lin and Albert, 2014). 또한 2015 년 보고된 내용에 따르면 약물치료 기여도 및 만족도를 보면 치매(알츠하이머) 다음으로 치료 만족도 및 약물치료 기여도가 낮은 것으로 보고되어 치료제 개발을 위한 노력이 더욱 필요한 실정이다. 난청은 음파 전달 과정이 비정상적으로 이루어지는 것을 말하며 외이, 고막, 중이 이외 소리 전달 기관의 기능이상으로 인해 발생하는 전음성 난청과 달팽 이관의 소리를 감지 기능에 문제가 생기거나 소리 자극의 뇌 부위로의 전달 역 할을 하는 청신경 혹은 중추신경계의 문제로 발생되는 감각신경성 난청으로 나 뉜다. 미국에서는 감각신경성 난청이 장애의 가장 큰 원인으로 알려져 있으며 (Talbott et al., 1990). 2001년부터 2008년까지 조사된 연구보고 내용에 따르면 12세 이상전체 인구의 20.3%, 4800만 명 정도가 난청을 가지고 있는 것으로 추정하며, 연령의 증가 에 따른 유병률이 비례하여 나타나 40대 에서 12.9%, 50대 에서는 28%, 60대는 45%로 증 가하는 것으로 보고하고 있다 (Franklin et al., 2011; Heyer et al., 2011). 또한 우리나라의 경 우 2009년 국민건강통계 보고에 따르면, 순음 청력검사에서 0.5, 1, 2, 3 kHz의 순 음 청력 평균치인 40 dB를 기준으로 편측성 난청 유병률은 5.7%, 양측성 난청 유병률은 4.5%로 보고되고 있다. 이와 같이 높은 난청 유병률로 미루어 볼 때, 많은 사람들이 난청을 유발시키는 환경에 노출되어 있는 것으로 추측할 수 있 다. 난청에 영향을 미치는 요소 중 성별, 교육수준, 근무환경, 흡연과 같은 인자 에 의한 위험도가 높으며, 난청의 유병률은, 나이, 성별, 인종에 따라 차이가 있 는 것으로 알려져 있다 (Muhr et al., 2006). 최근 산업화와 고령화로 인한 난청 인구는 급격히 증가하고 있다. 특히 스마트폰, 이어폰의 사용(115dB)과 사업장 소음으로 난청 위험성이 증가하고, 70세 이상에서 3명당 1명의 비율로 난청이 발생함으로써 난청 인구는 더욱 폭증하고 있는 실정이다. 특히 군대에서의 총, 포 소음의 노출로 미통계 잠정 난청 인구수는 제대로 파악되지 못하는 실정이 다 (Henderson et al., 2006). 전음성 난청을 야기하는 요인으로는 만성 중이염, 소아에서 흔한 삼출성 중 이염, 중이에서 소리의 전달 역할을 하는 이소골 연쇄 파괴, 외상성 고막천공, 중이 출혈로 인한 혈성 고실, 귀지로 인한 외이도 폐쇄 등이 있다. 감각신경성 난청의 주 요인으로는 미로염, 뇌수막염 등 염증 관련 질환, 소음, 이독성 약물, 측두골 골절 등의 외상, 노화, 메니에르병, 돌발성 감각신경성 난청, 갑상선 기능 저하와 같은 대사이상, 허혈성 뇌 질환, 백혈병 등의 혈액 질환, 다발성 경화증과 같은 신경학적 이상, 면역 이상, 종양성 질환, 골 질환 등 다양한 원인이 밝혀져 있다 (Tang et al., 2006), (Table 1). 난청 발생시, 전음성 난청의 경우는 수술적 치료가 가능하나, 감각신경성 난청은 전체 난청의 약 60-90%를 차지하고 있음에도 불구하고, 청각 세포 및
청신경이 재생되지 않아 약물 및 수술 치료로 가능하지 않으며, 대부분 보청기 착용과 인공 와우 이식술에 의존하는 실정이다.
감각신경성 난청 치료를 위한 내이 유모 세포 (inner ear hair cell) 재생, 유모세 포의 증식과 분화에 관여하는 신호 경로에 대한 많은 기전들이 밝혀졌으며 유 전자 치료 (gene editing) 혹은 세포 이식 (cell transplantation)을 할 수 있는 기술 들이 개발되어 최근 몇년간 유모세포재생 영역 연구에 큰 진전을 이루어 내고 있으나, 아직까지 명확한 난청 억제 및 예방에 관한 기전이나 예방 및 치료제 개발은 미미한 실정이다. 그 이유는 난청의 원인이 다양하고 복합적이며 병리 기전이 명확하지 않은 질병이기 때문이다 (Henderson et al., 2006). 현재까지 난청 을 극복하기 위한 방법으로 인공 와우 이식기와 청성 뇌간 이식 장치 등으로 이전 다양한 방법으로도 듣지 못하던 전농 환자들의 청각 재활에 도움을 줄 수 있다.
Table 1. Classification of hearing loss.
Noise-induced hearing loss Infections of the labyrinth
Ototoxic drug Age-related hearing loss
Trauma
Idiopathic sudden sensorineural hearing loss Autoimmune inner ear disease Genetic sensorineural hearing loss
Tumor
이독성 난청은 현재까지 효과적인 치료 방법은 없으며, 유일한 방법은 예방 법이다. 이독성 약물에 의한 내이 손상은 개개인의 감수성과 더불어 여러 요소 들의 상호작용으로 인해 약물의 위험성 예측에는 한계가 있다. 순음 청력검사, 고주파 청력검사 및 이음향 방사 검사를 활용한 지속적인 청력 감시를 통해 이 독성 초기 상태를 감지하여 추가적인 청력 손상을 예방하고자 하나 실제 그 효 용성을 따지자면 아직 미흡한 실정이다. 현재 약물에 의한 이독성 난청을 예방 하는 방법은 혈청 내 약물 농도를 관찰하면서 적절한 최적의 농도를 유지하는 방법이다. 혈청 내 약물의 농도를 측정할 수 있는 방법은 radioenzymatic assay, radioimmunoassay, volume of distribution 등이 있으나 고 비용과 이독성 약물을 투 여하고 있는 모든 환자에게 적용하여 관찰하기는 현실적으로 많은 어려움이 있 다 (Rybak and Ramkumar, 2007).
내이 손상을 야기할 수 있는 대표적인 이독성 약물에는 streptomycin, gentamycin과 같은 아미노글리코사이드 계열의 항생제와 cisplatin, carboplatin과 같은 플래티넘 기반 항암제가 있으며 두 약물 계열은 외유모세포의 손상에 의 한 감각신경성 난청을 유발하는 것으로 알려져 있다 (Table 2).
Table 2. Ototoxic drugs and related ear diseases.
CLASS EXAMPLES OF MEDICATIONS SIGNS AND SYMPTOMS OF TOXICITY
Aminoglycoside
antibiotics Streptomycin, gentamicin, kanamycin
Visual disturbances, imbalance, tinnitus, hearing loss
Macrolide antibiotics Erythromycin, azithromycin,
clarithromycin Hearing loss
Glycopeptide
antibiotics Vancomycin Tinnitus
Loop diuretics Furosemide, bumetanide Tinnitus, permanent hearing loss,
disequilibrium
Antineoplastic agents Cisplatin, carboplatin Tinnitus, hearing loss that is bilateral,
progressive and irreversible
Salicylates Aspirin
Tinnitus, hearing loss, headache, nausea/ vomiting, tachycardia, tachypnea,
altered mental status
Quinine Qualaquin Tinnitus, hearing loss, vertigo,
아미노글리코사이드는 Streptomyces griseus 에서 동정 되어 결핵의 치료 및 그람 음성 박테리아 감염 치료에 매우 유용하고 효과적인 항생제로 지금까지 널리 사용되어 왔다 (Schatz et al., 2005). 현재 streptomycin, neomycin, tobramycin, kanamycin, paromomycin, spectinomycin, gentamicin, netilmicin, amikacin 의 9 종의 아미노글리코사이드가 미 Food and Drug Administration 승인을 받아 실제 임상에 널리 사용되고 있다. 아미노글리코사이드는 효과 좋은 항생제이지만 신장과 내이 그리고 신경계 등 치명적인 부작용을 보이는 것으로 잘 알려져 있으며 상당부분의 경우 신독성 (nephrotoxicity)은 가역적이나 이독성 (ototoxicity)의 경우 비가역적으로 나타난다 (Matz, 1993). 이러한 부작용에도 불구하고 아미노글리코사이드는 현재까지 가장 많이 사용되는 항생제 중 하나이며 선진국에서 약제 내성을 나타내는 결핵과 같은 경우 제한적으로 사용되지만 개발도상국에서는 낮은 비용과 높은 항균력으로 인해 아직까지 가장 많이 처방되고 있는 실정이며 심지어 중이염이나 기관지염과 같은 1 차선택 항생제로도 처방되고 있는 실정이다. 아미노글리코사이드 이독성 부작용은 계속해서 증가할 가능성이 내재되어 있어 이비인후과 영역에서는 치료, 예방 및 연구에 큰 이슈가 되어왔고 현재 까지 보고된 많은 연구 보고들로 폭넓은 이해가 이루어지고 있다 (Schacht, 1993). 시스플라틴은 두경부 및 다양한 악성종양 치료를 위하여 사용되는 아주 효과적인 항암제이다. 그러나, 이 역시 마찬가지 신독성, 이독성, 신경염 등 지금까지 널리 알려진 부작용으로 용량과 비례하여 나타나는 치료 효과에도 불구하고 사용이 제한되어 왔다. 시스플라틴에 의한 급, 만성 이독성에서 달팽이관 와우의 다양한 세포 변형이 관찰, 보고되고 있다. 이독성 부작용으로 인해 달팽이관 와우 내 코르티기관과 혈관조에 형태학적, 기능적 변성을 야기한다 (Stadnicki et al., 1975). 이는 독성으로 인해 코르티기관의 외유모세포가 가장 먼저 손상을 받으며, 내유모세포, 지주 세포, Dieter 세포와 같은 지지세포, Hensen 세포, Claudius 세포, 혈관조 그리고 나선 신경절에서의 세포 손상이
보고된 바 있다 (Kohn et al., 1988). 시스플라틴에 의한 이독성 반응에서 생화학적으로 먼저 일어나는 반응은 단백질합성 억제이다. 그 외 세포막의 과산화, 미토콘드리아의 기능 장애 및 DNA 손상 등의 기전이 보고되었다. 또한, 항산화 효소의 활성도 변화, malondialdehyde의 증가, 와우 세포 내 glutathione 감소 등은 시스플라틴 이독성에서 활성산소의 역할을 시사한다 (Sugiyama et al., 1989; Brady et al., 1990; Kharbanda et al., 1995; Rybak et al., 1995).
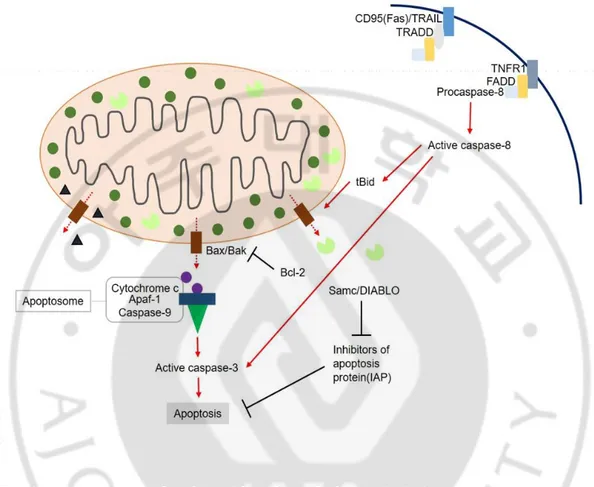
두 약물 모두 내이에서 Reactive Oxygen Species (ROS)를 생성하고 ROS는 JNK와 MAPK와 같은 스트레스 반응 효소들의 세포사멸 신호 경로를 활성화하고 hair cell의 아포토시스를 유발한다고 보고되고 있으나 아직까지 이독성 난청의 명확한 발병기전과 세포사멸 경로는 명확히 알려지지 않고 있으며, 더 많은 연구가 필요하다 (Henderson et al., 2006). 현재까지 난청을 극복하기 위한 방법으로 인공 와우 이식기와 청성 뇌간 이식 장치 등 이전에 다양한 방법으로도 들을 수 없었던 전농 환자들의 청각 재활에 도움을 줄 수 있으나 이독성 난청을 포함한 모든 난청에 대한 치료제는 아직까지 개발되지 못하고 있는 실정이다. 세포사멸은 조직을 구성하는 세포들 중 손상 혹은 노화된 세포들이 자가 수복을 실패하여 암과 같은 비정상적인 세포 변형을 억제하기 위해 스스로 사멸함으로써 전체적인 항상성을 유지하게 해 주는 메커니즘을 말한다. 이러한 세포사멸은 세포 내 정교한 프로그램에 의해 실행된다. 세포사멸 경로 중 가장 잘 알려진 세포자살 즉, 아포토시스는 조직 내 세포 수를 유지하기 위한 항상성 관련 기전 중 한가지로 이해되고 있으며 노화와 발달 과정에서 일반적으로 발생하는 현상이다. 아포토시스는 내, 외인성 경로를 통해 활성화된다 (Fig. 1). 내인성 경로는 세포 내부에서 미토콘드리아 막 투과성에 의한 사이토크롬 c의 방출로 아폽토좀을 형성 시 caspase-9을 활성화시키는 하부 연쇄 반응을 말하며, 외인성 경로는 세포 외부 리간드 (ligand) 결합으로 세포사멸 수용체 (death receptor)가 활성화되고 이에 따라 caspase-8 활성에 의해 야기되는 세포사멸 현상을 말한다. 형태학적 측면에서
아포토시스의 특징은 세포막 외부의 기포 (blebbing) 발생과 핵 염색체의 농축 (pyknosis), 핵파괴 (karyorrhexis), 세포의 수축 그리고 핵이 조각난 파편들이나 세포 소기관들이 단단히 싸인 세포질 내 apoptotic bodies 들의 출현 등이다. 아포토시스는 외인성 경로와 내인성 경로가 서로 연결되어 상호 영향을 줄 수 있다. 이 두 가지 아포토시스 경로는 공통적으로 caspase라는 단백질 분해효소의 활성과 연관되어 있는데 caspase-3의 활성에 의한 핵 내 DNA, 단백질절단이나 세포질 내 단백질의 분해, 단백질의 교차결합, apoptotic body의 형성을 통해 세포가 사멸하게 된다 (Igney and Krammer, 2002; Elmore, 2007).
Fig. 1. Apoptosis can take place either through the extrinsic (receptor-mediated) or the intrinsic (mitochondrial) pathway.
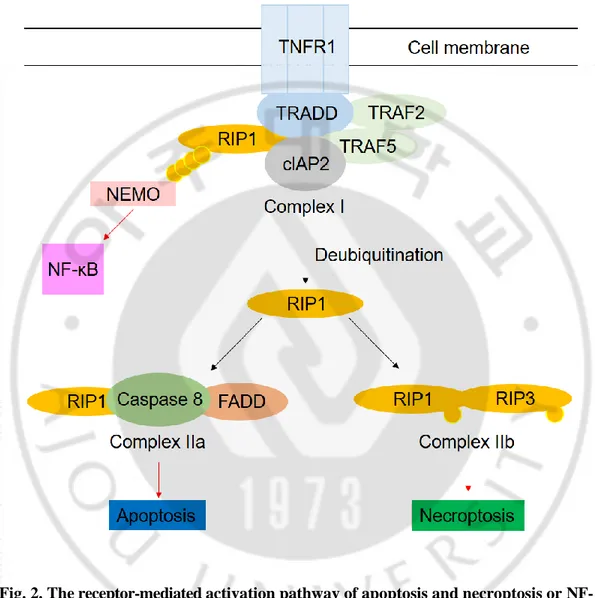
최근 많이 보고되고 있는 또 다른 프로그램 된 세포사멸 기전인 네크로토시스는 TNF-α, FasL, TRAIL 과 같은 agonist 와 세포사멸 수용체를 자극함으로써 유도되는 세포 죽음의 한 형태를 일컬으며, 기존에 단순한 물리적 충격에 의한 세포 괴사 (necrosis)와 차별화되는 특정 신호전달 기전에 의해 발생하는 능동적인 반응을 의미한다. 네크로토시스는 TNFR1, TNFR2, Fas 같은 세포사멸 수용체에 의해 유도되며 agonist 가 결합 시 주변 환경에 따라 세포를 죽음 혹은 생존으로 유도하게 된다 (Fig. 2). 아포토시스 유도 인자로 알려진 TNF-α 를 포함한 다수의 Toll-like receptor (TLR) agonist 들 역시 네크로토시스를 유도하는데 관여한다. NF-κB 활성화 과정에서 잘 알려져 있는 serine/threonine kinase 역할을 하는 receptor interacting protein 1 (RIP1)이나 RIP3 및 MLKL 이 중요한 역할을 수행한다. 특히 RIP1 의 유비퀴틴화 상태가 세포의 생존이나 죽음을 결정짓게 되는데 TRAF2/5, cIAP1, cIAP2 에 의한 RIP1 의 유비퀴틴화는 IKK complex 와 NEMO 의 활성을 가져와 NF-κB 의 활성을 촉발시키며 세포 생존에 기여한다. 반대로 RIP1 의 탈 유비퀴틴화는 RIP1 이 complex II 에 결합하여 NF-κB 활성 경로를 막아 세포를 사멸로 유도하게 되는데 RIP1 의 탈 유비퀴틴화가 네크로토시스로 이행되는 과정에서 중요한 요소이다. 아포토시스 경로가 막혔을 때 RIP1 과 RIP3 가 결합되어 Mixed lineage kinase domain-like (MLKL)와 결합하여 인산화 시켜 necrosome 이 형성되면 네크로토시스가 촉진되며 (Mahoney et al., 2008; Wu et al., 2012; Vanden Berghe et al., 2014) 위 과정의 하위 단계에서 발생하는 활성 산소, 미토콘드리아 막의 과다 분극, 리소좀 막 투과성이나 세포막 투과성 변화 등에 의해 세포사멸을 초래한다 (Fiers et al., 1995; Holler et al., 2000; Hetz et al., 2005; Zong and Thompson, 2006).
Fig. 2. The receptor-mediated activation pathway of apoptosis and necroptosis or NF-κB by TNF-α treatment.
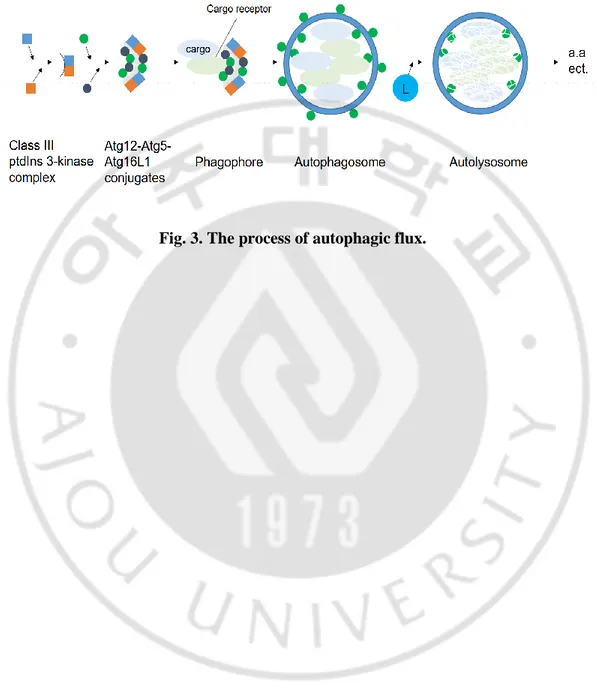
세포 자가 포식으로 알려진 오토파지는 가수분해 효소를 가진 리소좀 (lysosome)으로 세포 내 감염원과 손상된 단백질 및 소기관과 같은 물질을 운반해 분해시키는 복잡한 세포내 과정이다. 대부분의 조직에서 오토파지는 세포내 구성요소의 지속적인 대사 회전을 위해 기본적으로 일정 수준에서 항상 일어나고 있지만, 스트레스 관련 신호들과 같은 세포 생존에 불리한 환경에 처하게 되면 오토파지가 활성화되어 세포 생존에 필요한 에너지를 만들고 영양분을 재활용 한다 (Mizushima and Komatsu, 2011). 그러나 세포 생존과는 별개로 과도한 오토파지 활성은 세포자살, 세포 괴사와는 다른 독특한 형태를 가진 오토시스 (autosis) 혹은 오토파지에 의한 세포사멸 (autophagic cell death)이라 불리는 세포사멸 (cell death)을 유발한다 (Kroemer and Levine, 2008; Clarke and Puyal, 2012; Liu et al., 2013). Autophagy 활성 과정은 이들이 만들어내는 단백질들에 의해 정교하게 조절되는데 크게 4 가지 단계 1) 개시 (initiation)와 2) 소포 핵 형성 (vesicle nucleation), 3) 소포 신장과 융합 그리고 분해 (vesicle elongation, fusion and degradation), 4) 종료 (termination)로 나눌 수 있다 (Fig. 3). 개시 단계는 ULK1 단백질이 조절하며, ULK1 을 포함 (ULK1-Atg13-Atg101-FIP200) 복합체가 mTORC1 으로부터 해리된다. 그 후 Beclin1/Vps34 복합체 활성으로 PI3P (phosphatidylinositol-3-phosphate)가 증가하여 모여든 DFCP1 과 WIPI 단백질에 의해 이중 막 구조의 소포 핵 형성이 일어나게 된다. 이후 두
가지 ubiquitin-like conjugation
system[Atg12-Atg5-Atg16-LC3-phosphatidylethanolamine(PE)] 단백질들에 의해 소포 신장으로 자가포식소체 (autophagosome)가 생성된다. 그 후 성숙한 자가포식소체는 리소좀과 융합되어 자가포식소체와 용해소체 (autolysosome)를 형성하게 되고 이 과정에서 격리된 세포내 물질이나 소기관들은 리소좀 가수분해효소 (lysosomal hydrolytic enzymes)에 의해 분해되며, 이 과정은 p62/SQSTM1 과 같은 선택적 자가 포식 수용체를 통해서 매개된다. 이들은 자가포식 될 표적을 인식하고 작은 유비퀴틴 유사 단백질 (ubiquitin-like modifiers, UBLs)에 결합함으로써 선택적 자가포식소체의 형성을 매개한다.
최근 활성산소는 다양한 질환과 노화 등 병태생리적으로 중요한 요인으로 알려져 있다 (Ischiropoulos and Beckman, 2003). 이독성 약물에 의한 청각신경세포 손상 과정에 세포사멸이 발생하며, 이때 활성산소가 관여한다는 내용이 보고되고 있다 (Pierson and Moller, 1981; Sha and Schacht, 1999a, b). 산소를 소비하는 정상 세포에서는 미토콘드리아 에너지 생성과정 경로인 산화적
인산화 과정에서 필연적으로 O2.-, H2O2등 활성산소가 발생한다. 그러나
미토콘드리아 손상은 막전위를 유발하게 되고 그에 따라 과도한 활성산소가 세포 내에 축적되어 세포손상을 야기한다 (Boveris and Chance, 1973).
젠타마이신에 의한 이독성 난청 세포사멸 기전은 전통적으로 미토콘드리아 손상으로 발생하는 활성산소를 통한 내인성 아포토시스가 잘 알려져 있다 (Garetz et al., 1994). 그 기전 중 하나는 손상된 미토콘드리아의 막 전위 변화 및 이에 따른 사이토크롬 c 등의 세포내 유입을 통하여 세포사멸을 야기하는 것으로 알려지고 있다 (Green and Reed, 1998). 세포질로 분비된 사이토크롬 c 는 아폽토좀을 만들고 카스파제를 활성화 시키게 된다 (Thornberry and Lazebnik, 1998). 그러나 최근 보고에 따르면 젠타마이신에 의한 세포사멸을 억제하기 위해 오토파지가 활성화 되나, 자가 포식체를 해소하는 최종단계로 이행되지 못해 자가 포식체의 과축적이 발생하여 세포 스트레스를 극대화하여 결국 세포사멸이 발생하며 (Kim et al., 2017), 젠타마이신에 의해 야기되는 신장독성의 활성산소에 의한 산화적 스트레스, 아포토시스, 오토파지를 억제하는 약물을 통해 신장 독성을 완화시킨다는 보고를 통해 젠타마이신은 아포토시스와 오토파지 기전이 복합적으로 발생하는 것을 알 수 있다. 특히 p53과 같은 종양억제 유전자는 아포토시스와 오토파지의 공통 조절자로 알려져 있어 (Marino et al., 2014) 젠타마이신에 의한 이독성 난청 기전에서 아포토시스와 오토파지의 복합적 작용 가능성을 시사한다. 그러나 미국 의학 도서관 데이터베이스 (PubMed)에 확인한 바, 젠타마이신에 의해 야기되는 이독성 연구에서 네크로토시스 세포사멸 기전에 관한 내용은 아직까지 보고된 바 없다.
시스플라틴에 의해 야기되는 세포사멸 기전 역시 주로 지금까지 활성산소에 의한 손상을 통해 내인성 매개 아포토시스가 발생한다고 보고되고 있다 (Alam et al., 2000). 올 해 보고된 논문에 따르면 마우스 와우와 타원낭 (cochleae and utricles) 체외이식 편 생체 내, 외 실험의 경우 시스플라틴 처리 시 생체 외 실험 결과에서는 아포토시스가 발생하는 반면 생체 내 실험에서는 caspase-8의 활성 여부에 따라 아포토시스와 네크로토시스 두 가지 세포사멸 기전이 복합적으로 발생하며, 이는 기존에 보고된 바 caspase-8의 활성도에 따라 두 가지 세포사멸이 조절되며 서로 밀접하게 연결되는 것으로 보고하고 있다 (Ofengeim and Yuan, 2013). 그러나 시스플라틴에 의해 야기되는 이독성 관련 세포사멸 기전들 중 오토파지에 관한 보고는 PubMed 검색 결과 아직 보고된 바 없다. 그럼에도 불구하고 다양한 암세포 사멸을 촉진하는 항암제 용도로 사용시 암세포 사멸을 야기하는 기전들 중 오토파지가 관여한다는 보고들이 있다 (Kim et al., 2018; Liu et al., 2018).
난청은 이독성 약물 및 소음과 노화 등 여러 가지 종류의 자극들에 의해 발생하고 있으나 이를 극복하기 위한 예방 및 치료법은 없으며, 보청기나 인공 와우 수술을 통한 재활 치료법이 있지만, 아직까지 난청에 대한 명확한 치료제 개발은 이루어지지 않고 있다. 그 원인은 난청 발병기전과 세포사멸 경로가 명확히 밝혀지지 않았기 때문이고 단일 기전에 대한 연구는 많으나 복합 기전에 관한 연구는 극히 미미하기 때문이다. 이독성 난청의 세포사멸 기전을 밝히는 것은 치료제 개발에 중요한 시발점이 될 수 있다. 본 연구는 이독성 난청 유발 약물인 젠타마이신과 시스플라틴을 사용하여 세 가지 대표적인 프로그램 된 세포사멸 기전인 아포토시스와 네크로토시스 그리고 오토파지를 각각 조사하고 비교, 분석 후 통합적으로 조망하여, 세 가지 세포사멸 기전을 조절함으로써 이독성 난청 제어를 최종 연구 목표로 한다.
II. 실험 재료 및 방법
1. 생체 내 실험 (In vivo study)
A. 실험동물아주대학교 의료원 내 동물실험윤리위원회 (Ajou University Medical Center -Institutional Animal Care and Use Committee: AUMC - IACUC)의 허가를 받아 지침에 따라 실험에 임하였다. Sprague Dawley, Inc. 로부터 유래된 특정 병원체 부재 동물 (Specific Pathogen Free, SPF) 인 wild type의 Sprague-Dawley (SD) Rat 수컷을 대한바이오링크 (DBL Co., 충북 음성군) 에서 분양 받아 아주대학교 실험동물센터에서 표준적인 사육조건으로 명암 주기가 조절되는 환경에서 사육하였고, 실험 동물 용 고형 사료와 식수를 제한 없이 공급하였다.
B. 이독성 난청 모델 제작
본 연구실에서 보고한 젠타마이신 매개 이독성 난청 모델 확립 방법을 변형하여 (Kim et al., 2017), (Fig. 4 A)와 같이 6 주 령 rat에 젠타마이신 (200 mg/kg)을 1 일 1 회, 10 일간 근육 주사로 투여 후 6 주 동안 난청을 유도하였다. 또한 시스플라틴 유도 이독성 난청 모델은 기존에 보고된 방법을 변형하여 (Giordano et al., 2006), (Fig. 4 B)와 같이 8 주 령 rat에 복강 내 주사로 pre-hydration 후, 시스플라틴 (16 mg/kg)을 1 회 투여 후 3 일 동안 난청을 유도하였다. 두 약물은 작용하는 부위가 다르고 투여 방법과 농도 또한 다르므로 각 세포사멸 기전을 비교하기 위한 기준으로 청성 뇌간 반응 검사 결과 청력 역치 값이 평균 약 40~50 (dB)을
설정하여 이독성 난청 모델을 판정 및 확립하였다. 두 그룹 모두 청력이 유의하게 저하된 개체를 희생하여 달팽이관을 추출 후 실험에 사용하였다.
C. 청성 뇌간 반응 (Auditory Brainstem Response, ABR) 검사
The auditory brainstem response (ABR)은 졸레틸 50 (0.1 cc/100 g; Virbac Laboratoire)과 럼푼 2% (0.02 cc/100 g; Bayer Korea)를 혼합하여 근육 주사를 통해 마취 후 BioSig 32 system (Tucker-Davis Technologies, Gainesville, FL, USA)를 기반으로 측정하였다. 검사 환경은 외부 소음과 차단되는 방음 부스에서 진행하였다. 두정부 (vertex)에 활성 전극 (active electrode), 양쪽 귀 아래 쪽에 각각 기준 전극 (reference electrode)과 접지 전극 (ground electrode)을 꽂고, tube 삽입 형 스피커를 사용하여 측정하고자 하는 귀에 삽입하여 측정하였다. Tone burst sound 자극 음을 이용하여 90 부터 10 데시벨 (dB)까지 5 데시벨 간격으로 순차적으로 감소시키면서 측정하여 파형을 얻었으며 8, 16, 32 킬로 헤르츠 (kHz)의 주파수를 측정하였다. 각각의 자극 음은 1,000 번 들려주었으며 평균값을 구해서 유의한 반응을 보이는 최소 자극음 강도를 청각 역치 (threshold)로 결정하였다. 마취된 동물 체온은 heating pad 를 사용하여 유지하였다. D. 헤마톡실린-에오신 (hematoxylin-eosin, H&E) 염색 쥐를 근육주사를 통하여 전신 마취시킨 후 양측 측두골을 채취하였다. 해부 현미경 하에서 와우를 채취하여 4% 포름알데히드 (4% paraformaldehyde)를 이용하여 4 °C 에서 24 시간 동안 고정하였다. 고정액 제거 후 인산 염 완충 식염수 (Phosphate buffer saline, PBS)로 세척을 실시하였고 Calci-Clear Rapid solution (National Diagnostics, HS-105) 용액을 사용하여 4 °C 에서 3 일간 골질(骨質) 석회를 제거하였다. 탈 석회 내이 조직은 광학 현미경 하에서 코르티기관과 주변 조직들을 조심스럽게 제거한 후 에탄올 (ethanol)을 사용하여 수세 과정을 거치고 크실렌 (xylene)을 통한 투명 과정을 거쳐 파라핀 (paraffin)에 포매하였다. 파라핀 조직은 절편기를 사용하여 5 μm 간격으로 박절 후 염색을 하였다.
E. 면역조직화학염색 (immunohistochemistry) 파라핀 블록에 포매시킨 와우 조직에서 면역형광염색 방법을 통하여 세포사멸 마커로 알려진 항체들의 발현을 관찰하였다. 면역형광염색을 위하여 파라핀 블록을 젤라틴 코팅된 슬라이드에 5 μm 두께로 박절하고 슬라이드 보온기를 통하여 가온 후 파라핀이 녹게 되면 크실렌과 100, 90, 80, 70 % 에탄올을 통하여 탈 파라핀화 시키고 수세하였다. 내인성 과산화효소의 비정상적인 반응을 막기 위해 3 % 과산화수소hydrogen
peroxide, H2O2)와 반응시킨 후 항원 복구를 위해 10 mM Sodium citrate, 0.05%
Tween 20, pH 6.0의 구연산 염 완충액 (citrate Buffer) 또는 10 mM Tris base, 1 mM EDTA solution, 0.05% Tween 20, pH 9.0의 트리스-이디티에이 완충액 (Tris-EDTA Buffer)를 사용하여 98 °C로 20 분간 가열 후 상온에서 20 분간 식혀준다. 0.25 % 트리톤 (triton) X-100과 인산 염 완충 식염수 (PBS)를 섞어 세척액을 만들어 세척 후, 1 % 소 혈청 알부민 (Bovine serum albumin, BSA)과 0.5 % 트리톤 X-100의 비율로 인산 염 완충 식염수에 섞어 블로킹 용액을 만들고 상온에서 1 시간 동안 블로킹 시켜준다. 그 후 1 차 항체를 블로킹 용액에 항체 마다 알맞은 비율로 섞어 사용하여 4 °C에서 24 시간 동안 조직에 부착시켜준다. 그 후 세척 용액으로 세척 후 2 차 항체를 블로킹 용액에 섞어 상온에서 1 시간 동안 반응시켜 주고 발색제로는 0.02% 3,3 – diaminobenzidine tetrahydrochloride (DAB, Abcam, CA, USA)가 혼합된 용액을 사용하여 상온에서 10분간 반응시킨 후 광학 현미경으로 관찰하였다.
F. 조직 균질화 (tissue homogenization)
렛트를 희생하여 채취한 와우 조직을 용해 버퍼인 RIPA (50mM Tris, pH7.5), 150mM NaCl, 1% Nonidet P-40, 0.5% Sodium deoxycholate, 0.1% SDS)에 단백질 분해 효소 억제제 (100mM PMSF, 100mM Leupeptin, 1M Pepstatin
A)와 포스파타아제 억제제 (Phosphatase inhibitor, Biovision, CA)를 혼합하여 10% 용해물을 만든다. 만든 용해물을 균질기 (homogenizer)를 사용하여 얼음 위에서 유리관을 위 아래로 3 번씩 10 회 반복하여 파쇄한다. 파쇄 한 용해물을 초음파 분해기를 사용하여 Amp 25~30% 5 초간 3 번 초음파 처리 후 원심 분리기를 이용하여 13,000rpm 으로 4℃ 에서 20 분간 원심 분리를 시행하였다. 그 후 브래드포드 단백질 정량 (Bradford assay)법으로 단백질을 정량 하였다. 동량의 샘플을 4X 샘플 버퍼 (β-mercapto ethanol, 1.2mg Bromo phenol blue, Glycerol, 10% SDS)와 섞은 후 10 분간 100℃로 heating 하여 샘플링 하였다.
2. 생체 외 실험 (In vitro study)
A. 세포 배양마우스 와우 내의 코르티기관 (organ of corti)에서 유래된 청감각 유모세포주인 HEI-OC1 (House Ear Institute-Organ of Corti)을 사용하였다. 이 세포주는 인터페론-감마 (IFN-γ) 유도성 프로모터 요소 (promoter element)가 통제하는 SV40 바이러스의 large T-antigen (Tag)의 열 민감성 돌연변이를 포함시키고 있기 때문에 Tag를 발현시키기 위하여 유전자 재조합형 마우스 (recombinant mouse)의 인터페론-감마가 50 U/ml의 비율로
섞인 고농도의 포도당이 포함된 Dulbecco’s modified Eagle’s medium
(DMEM)에 10% FBS를 첨가한 세포 배양액으로 33℃, 5% CO2 세포 배양기에서 배양하여 실험 목적에 따라 사용하였다.
B. 세포 생존율 측정
세포내의 미토콘드리아 탈 수소 효소에 의해 살아있는 세포와 반응하여
water-soluble Tetrazolium Salts (WST-1)에서 오렌지색 수용성의
formazan이라는 발색 물질이 생성되는 것을 ELISA로 측정하였다. 대사적으로 활발한 활동을 하는 세포 내 미토콘드리아 전자 전달계에 존재하는 WST를 이용한 방법은 세포내의 탈 수소효소 (dehydrogenase)인 succinate-tetrazolium reductase와의 반응에 의한 것으로 살아있는 세포에만 유효하게 작용하며 발색 강도가 세포 수와 직선 상관관계를 나타낸다. 10% FBS를 첨가한 배양액으로 33℃, 5% CO2 세포 배양기에서 96 well의 세포 배양 판에 1×104개 세포를 100 μl/well 용량의 배지에 안착시키고 하루간
배양하여 각각 시스플라틴 (cis-Diammineplatinum(II) dichloride, Sigma)은 1, 5, 10, 20 μM의 농도로 세포에 처리하였고, 젠타마이신 (gentamicin sulfate salt, Sigma)은 1, 3, 7, 9, 18 mM의 농도로 세포에 처리하여 각각 24 시간 후 Premix WST-1 용액 (Premix WST-1 Cell Proliferation Assay System, Takara)을 각각의 well 에 10 μl씩을 처리하고 2, 4 시간 후 ELISA reader를 이용하여 450, 490 nM에서 흡광도를 측정하였다.
C. 웨스턴 블롯 분석 (western blot analysis)
조직 균질화를 통해 준비된 샘플 또는 세포 생존율 측정 결과를 바탕으로 준비된 세포주에 각각 시스플라틴 10 μM 농도로 처리하였고, 젠타마이신 7 mM 의 농도로 처리하여 각각 6, 12, 24 시간 후 채취하여 RIPA 버퍼 (25 mM Tris·HCl pH 8, 150 mM NaCl, 1% NP-40, 0.5% sodium deoxycholate, 0.1% sodium dodecyl sulfate, SDS)를 protease inhibitor cocktail (GenDEPOT, P3100)과 함께 사용하여 용해시켜 단백질을 추출하여 13,000 rpm 에서 약 20 분간 원심 분리하여 침전시킨 후 상층액을 추출하였다. 상층액을 Bradford (Bio-Rad, Hercules, CA, U.S.A)로 정량화 하여 단백질 20 μg 을 10-15% SDS-폴리 아크릴 아마이드 겔을 80~140 v, 220 mA 로 전기
영동 하여 분리 후 0.45 μm 이소불화비닐 (PVDF; Millipore, IPVH00010)에 30 v, 220 mA 로 전이시켰다. 나이트로 섬유소 막을 5%의 탈지유에 1 시간 블로킹 후 4℃에서 1 차 항체를 하룻밤 동안 반응시키고, PBST (PBS with 0.05% tween20)로 3 회 세척 후 상온에서 1 시간 2 차 항체 반응 후 다시 3 회 PBST 로 세척하고 ECL (enhanced chemiluminescence, Amersham biosciences, England) 반응을 1 분간 시행하여 목적 단백질을 검출하였다.
D. 항체와 시약 (Antibody & Reagent)
SDS-PAGE-Resolving gel: 30% acrylamide mix, H2O, 1.5M Tris-pH8.8, 10%
SDS, 10% ammonium persulfate, TEMED, Stacking gel: H2O, 30% acrylamide mix,
1M Tris-pH 6.8, 10% SDS, 10% APS (ammonium persulfate), TEMED, Running Buffer (250mM Tris, 1.92M Glycine, 10% SDS), Transfer Buffer (250mM Tris,
1.92M Glycine), PBST (137 mM NaCl, 2.7mM KCl, 10m M Na2HPO4, 2 mM
KH2PO4, Tween 20%), 5% 탈지 분유를 사용하였으며, 항체는 다음과 같이
사용하였다. Anti-Caspase-8 antibody: ab25901 (Abcam), Anti-Cleaved PARP antibody [E51]: ab32064 (Abcam), Anti-LAMP1 antibody [H4A3]: ab25630 (Abcam), Anti-LC3B: L7543 (Sigma), Anti-MLKL (phospho S345) antibody [EPR9515 (2)]: ab196436 (Abcam), Anti-MLKL antibody - N-terminal: ab194699 (Abcam), NF-kB p65 (phospho S536) antibody: ab86299 (Abcam), Anti-SQSTM1 / p62 antibody: ab56416 (Abcam), Bax (D3R2M) Rabbit mAb (Rodent Preferred): #14796 (Cell Signaling Technology), Beclin 1/ATG6 Antibody: NB500-249SS (Novus), Caspase-3 Antibody: #9662 (Cell Signaling Technology), Chloroquine diphosphate salt: C6628 (Sigma), cis-Diammineplatinum (II) dichloride: P4394 (Sigma), Cleaved Caspase-3 (Asp175) Antibody: #9661 (Cell Signaling Technology), GAPDH (D16H11) XP® Rabbit mAb: #5174 (Cell Signaling Technology), Gentamicin sulfate salt: G1264 (Sigma), Myosin-VIIa: #25-679 0 (Proteus Biosciences), Necrostatin-1 - CAS 4311-88-0 – Calbiochem : 480065-5MGCN (Merck), NF-κB p65 (D14E12) XP® Rabbit mAb: #8242 (Cell Signaling Technology), PARP Antibody: #9542 (Cell Signaling Technology), RIP (D94C12)
XP® Rabbit mAb: #3493 (Cell Signaling Technology), RIP3 polyclonal antibody: ADI-905-242 (Enzo), Z-VAD-FMK (Ready-to-Use): ALX-260-138 (Enzo), β-Actin (8H10D10) Mouse mAb: #3700 (Cell Signaling Technology)
E. 통계적 분석
그래프는 평균 값 ± 표준 편차로 나타냈다. 그리고 여러 그룹 간의 유의성을 확인하기 위해 SPSS 프로그램을 이용하여 Student’s t-test 및 One-way ANOVA test 와 Tukey’s and Bonferroni’s 사후분석법으로 검증하였으며, P 값이 0.05 이하 일 때 통계적으로 유의한 것으로 간주하였다.
III. 결과
A. 젠타마이신과 시스플라틴 투여에 의한 이독성 난청 유발
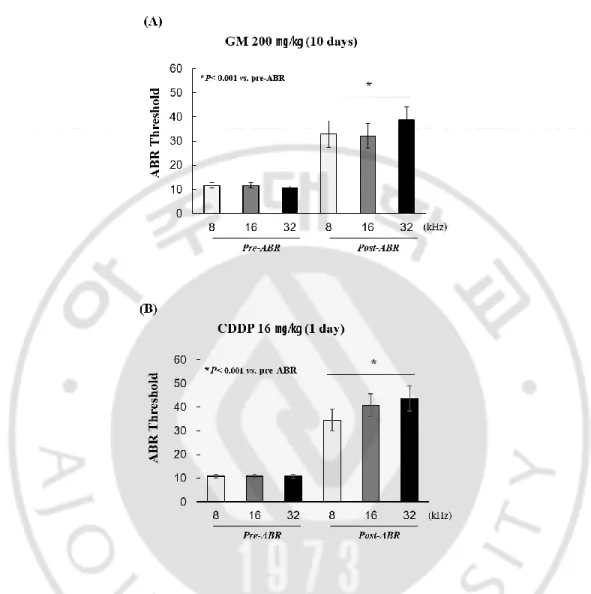
청성 뇌간 반응 검사는 소리자극 후 5 msec 에서 약 10~15 msec 까지의 반응이다 (Sininger, 1993). 청력 역치를 측정하기 위해 BioSig 32 system 을 이용하여 Tone burst sound 자극음을 90 데시벨 (dB)부터 10 데시벨까지 5 dB 간격으로 순차적으로 감소시키면서 파형을 얻었으며 8, 16, 32 킬로 헤르츠 (kHz) 주파수 별로 측정하여 최소 자극 음 강도를 청각 역치 (threshold)로 결정하였다. 젠타마이신을 처리한 실험 군에서는 대조 군에 비해 8, 16, 32 킬로 헤르츠에서 청각 역치 값이 평균 20 dB 증가하였으며 통계적 유의성을 나타냈다. 특히 약물에 대해 상대적으로 손상을 많이 받는 것으로 알려진 (Chen et al., 2013) 와우 기저회전부 (base-turn) 32 킬로헤르츠 영역의 청각 역치 값이 8, 16 킬로헤르츠의 청각 역치 값 보다 더 높게 나타나지만 통계적인 유의성은 없었다 (Fig. 5 A). 시스플라틴을 처리한 실험군 역시 대조군에 비해 청각 역치 값이 8, 16, 32 킬로 헤르츠에서 각각 통계적으로 유의하게 평균 20 dB 이상 증가하여 청력의 감소를 관찰하였으며, 젠타마이신과 같이 기저 및 중앙 회전부 (base, mid-turn) 부위의 청각 역치 값이 더 높게 나타나는 경향을 보였으나 마찬가지로 통계적 유의성은 없었다 (Fig. 5 B). 따라서 앞서 기술한 결과와 같이 젠타마이신과 시스플라틴을 처리하여 각 실험방법에 따라 청력 역치 값이 약 35~45 dB 로 유사한 이독성 약물에 의한 청력감소 모델을 확립하여 두 약물에 의한 청력 감소가 어떠한 세포사멸 기전에 의해 야기되는지 알아보고자 하였다.
Fig. 5. Analysis of ABR threshold shift. (A) Hearing threshold shifts after GM treatment were 32.9 ± 19.1dB, 32.0 ± 17.6dB and 38.7 ± 18.3dB at 8, 16 and 32 kHz, respectively. (B) Hearing threshold shifts after CDDP treatment were 34.5 ± 16.1 dB, 40.8 ± 16.7 dB and 43.7 ± 18.2 dB at 8, 16 and 32 kHz, respectively. Statistical analysis was performed using the Student´s t-test pre vs. post-ABR.
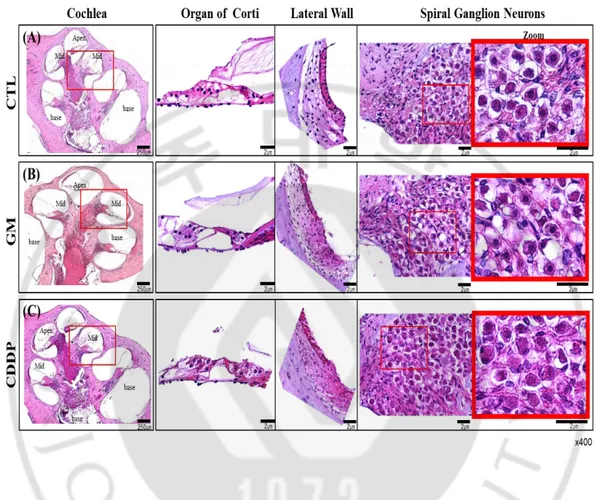
B. 이독성 난청 모델 와우 조직의 형태학적 분석
이독성 약물에 의해 발생하는 난청은 주로 코르티기관 손상을 야기하여 발생하며 특히 와우 기저의 외유모세포의 소실로 특징 지워진다. 또한 위 손상은 약물에 지속적으로 노출될 때 유모세포에만 국한되지 않고 혈관대까지 진행되고 또한 회전 신경절까지 확대되어 파괴되는 것으로 알려져 있다 (Hawkins, 1973; Johnsson et al., 1981; Rybak, 2007). 따라서 본 연구에서 사용한 젠타마이신과 시스플라틴 같은 이독성 약물에 의한 난청 유도 시 와우의 손상 여부를 관찰하고자 헤마톡실린-에오신 염색으로 조직학적 분석을 실시하였다. 젠타마이신을 처리한 실험군에서는 대조군과 비교 분석 시 코르티기관의 내, 외 유모세포와 지지세포 등 세포 감소, 변형 및 손상은 관찰되지 않았다. 그러나 혈관조에서는 약물에 의한 팽윤 (swelling) 현상이 관찰되었으며, 특히 나선신경절 신경세포의 감소와 붕괴 (breakdown) 그리고 응축된 (shrinkage) 핵 형태를 관찰할 수 있었다 (Fig. 6 A, B). 시스플라틴을 처리한 실험군에서도 마찬가지로 대조군과 비교 시 코르티기관의 내, 외 유모 세포와 지지세포 감소는 관찰되지 않았으나, 세포핵이 커져 있으며, 젠타마이신과 유사하게 혈관조의 팽윤 현상과 나선상 신경절 신경세포 감소, 붕괴 그리고 응축된 핵 형태가 관찰되었다. 젠타마이신과 시스플라틴의 이독성 난청은 위와 같은 형태학적 변형과 그 원인에 의해 발생하는 것으로 추정하였다 (Fig. 6 A, C).
Fig. 6. Histological analysis of drug-induced ototoxicity animal model. Hematoxylin and Eosin (H&E) staining of cochlea sections from (A) Control, (B) GM, and (C) CDDP injected SD-rat. Morphological analysis of organ of Corti, spiral ganglions, and lateral ligaments showed dominantly change of nuclear morphology, such as breakdown and shrinkage, and the decreased number of spiral ganglion cells. Also, a partial change of nuclear swelling in the organ of Corti and abnormal shape of cytoplasm in lateral ligaments (Magnification x400).
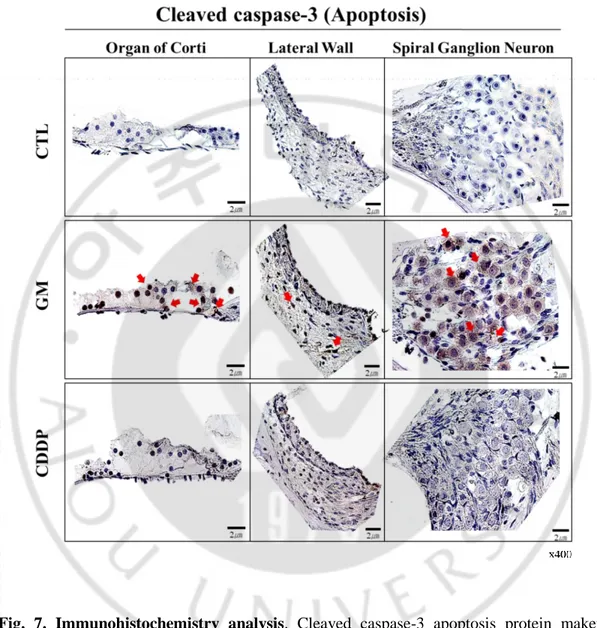
C. 이독성 난청 모델 와우 조직 내 세포사멸 기전 분석 a. 아포토시스 마커 분석: Cleaved caspase-3 분석 앞선 보고에 따르면 젠타마이신에 의한 이독성 난청은 와우 기관의 아포토시스 (Muyderman et al., 2012) 와 오토파지 최종 과정인 자가분해의 억제 (Kim et al., 2017) 등 연구 조건에 따라 다양한 세포사멸 기전이 매개된다고 알려져 있으며, 시스플라틴 역시 활성산소 (ROS) 발생을 통해 아포토시스 (Sheth et al., 2017) 와 Tumor necrosis factor-alpha (TNF-α) 염증 매개 물질로 인한 세포 손상과 사멸 등이 보고되고 있으나 (Chirtes and Albu, 2014), 각각의 세포사멸은 복합적으로 발생하며 아직까지 자세한 세포사멸 기전이 정립되어 있지 않고 있다. 따라서 본 연구의 앞선 결과와 같이 젠타마이신과 시스플라틴 두 종류의 이독성 약물에 의해 코르티기관 조직 손상을 헤마톡실린-에오신 염색을 통한 조직학적 분석으로 관찰하였으며 (Fig. 6), 조직 손상에 따른 대표적인 3 가지 세포사멸 기전 a) 아포토시스, b) 오토파지, c) 네크로토시스를 조사하여 두 약물에 의한 세포사멸 기전을 비교 조사하고자 하였다. 우선 두 약물에 의한 아포토시스 기전을 조사하기 위해 대표적인 마커인 활성 caspase-3 단백질 면역조직화학 염색 (immunohistochemistry)을 실시하였다. 젠타마이신을 처리한 실험군에서 대조군과 시스플라틴 처리 군을 비교 관찰한 결과 코르티기관의 내, 외 유모세포를 포함하여 지지세포에서 활성 caspase-3 가 두드러지게 염색되었으며, 더불어 혈관조와 나선상 신경절 신경세포에서도 코르티기관과 같이 염색됨을 관찰하였다 (Fig. 7, 붉은 화살표).
Fig. 7. Immunohistochemistry analysis. Cleaved caspase-3 apoptosis protein maker staining was much more highly expressed in the organ of Corti, spiral ganglions and lateral ligaments in GM-induced ototoxicity (red arrow) compared with Control and CDDP groups.
b. 오토파지 마커 분석: 경연쇄 (microtubule-associated protein light chain) 3B 분석
오토파지의 “Vesicle elongation” 단계에서 2 가지 유비퀴틴 유사 시스템 (ubiquitin-like conjugation system)을 가진다. 첫 번째 system 은 Atg12-Atg5 의 공유 결합에 의한 것으로 E1 유사효소인 Atg7 과 E2 유사 효소인 Atg10 을 필요로 한다. 또 다른 시스템은 PE (phosphatidylethanolamine)이 순차적으로 Atg4, Atg7 그리고 Atg3 에 의하여 LC3/Atg8 과 결합하는 것이다. 이러한 lipid 의 결합으로 수용성 LC3 (LC3-I)의 변화를 일으켜 LC3-II (autophagic vesicle-associated form)을 형성한다 (Barth et al., 2010). 이러한 LC3-II 는 앞서 기술한 오토파지 4 가지 단계 중 세 번째 단계인 소포 신장과 융합 과정까지의 활성을 대변한다. 학계에서는 이러한 LC3-II 를 오토파지의 대표 마커로써 사용하며 단백질의 증가와 감소를 통해 오토파지의 활성과 완료를 통해 세포내 부족한 에너지를 공급하는 것으로 이해하고 있다. 따라서 본 연구에서도 오토파지의 대표 마커인 LC3B 항체를 사용하여 젠타마이신과 시스플라틴을 처리한 실험군과 대조군을 면역조직화학 염색을 실시하였다. LC3-I 단백질은 항시 발현되어 있는 단백질이며 LC3B 항체는 오토파지의 활성의 유무와 상관없이 LC3-I 을 검출할 수 있다. 또한 과 오토파지 활성 시 LC3-I 과 II 형태의 단백질을 모두 검출할 수 있다. 따라서 면역조직화학 염색 결과 약물을 처리하지 않은 대조 군에서도 기본적인 염색 강도가 높게 나오는 것을 알 수 있으며, 젠타마이신을 처리한 실험군에서는 시스플라틴 및 대조군과 비교하여 내, 외 유모세포의 세포질 부위 및 혈관조 그리고 나선상 신경절 신경세포들의 세포질에서 더욱 두드러지게 염색되며, 특히 자가포식소체의 형성과 같은 작은 소포들이 염색되는 것을 관찰할 수가 있었다 (Fig. 8 붉은 화살표).
Fig. 8. Immunohistochemistry analysis. LC3B autophagy protein maker staining was much more highly expressed and show autophagic punctate formation in the organ of Corti, spiral ganglions (partial lateral ligaments) in GM-induced ototoxicity (red arrow) compared with Control and CDDP groups.
c. 네크로토시스 마커 분석: Receptor-interacting protein 1 (RIP1)과 Mixed lineage kinase domain-like protein (MLKL) 분석
RIP3 는 RIP1 동종 효소의 일종으로 네크로토시스에 중요한 역할을 담당한다. RIP3 가 발현되지 않는 세포에 RIP3 유전자를 과 발현시키면 네크로토시스가 일어나지만 RIP3 인산화 활성 돌연변이인 K50A 유전자 과 발현 세포주에서는 네크로토시스가 일어나지 않는 것으로 보아 RIP3 인산화가 네크로토시스에 중요한 마커임을 알 수 있다 (Cho et al., 2007). 또한 네크로토시스를 야기하는 핵심 결합분자 RIP1 과 MLKL 단백질 역시 RIP3 와 함께 결합하여 네크로토시스를 촉진하는 중요한 마커로 잘 알려져 있으며 (Vanden Berghe et al., 2014), 네크로토시스 유도 시 RIP3 와 MLKL 단백질이 증가한다는 보고에 따라 (Cui et al., 2016), 본 연구에서 네크로토시스 활성을 알아보기 위해 RIP3 와 MLKL 항체를 사용하여 면역조직화학 염색을 실시하였다. 우선 RIP3 단백질 염색 결과 젠타마이신을 처리한 실험군에서는 시스플라틴 비교하여 염색 강도가 상대적으로 낮은 것으로 보이나 대조군에 비해 코르티기관과 나선상 신경절 신경세포 부위에서 발현이 높게 나타났다. 반면, 시스플라틴 군에서는 내유모세포와 혈관조에서 젠타마이신과 대조군에 비해 염색 강도가 높게 증가되며, 특히 나선상 신경절 신경 세포 들에서 가장 큰 차이를 관찰할 수 있었다 (Fig. 9). 또한 MLKL 염색 시 젠타마이신과 시스플라틴 실험군 공히 대조군에 비해 전체 부위의 염색 강도가 증가되어 있었으며, 특히 시스플라틴 군의 내, 외 유모세포 및 지지세포 그리고 혈관조와 나선상 신경절 신경세포 부위에서 대조군과 젠타마이신에 비해 상대적으로 더욱 강하게 염색되는 것을 관찰하였다 (Fig. 10). 이는 RIP3 와는 다소 다른 패턴을 보이며, 또 다른 조절 기전이 존재하거나 혹은 항체 간 특이에 기인한 것으로 종합적으로 네크로토시스 마커인 RIP3 와 MLKL 단백질은 젠타마이신을 처리한 실험 군에 비해 시스플라틴을 처리한 실험 군에서 단백질 발현이 더욱 높은 것으로 관찰되었다 (Fig. 10).
Fig. 9. Immunohistochemistry analysis. RIP3 necroptosis protein maker staining was much more highly expressed in spiral ganglions, the organ of Corti, (partial) and lateral ligaments with stria vascularis in CDDP-induced ototoxicity compared with control and GM groups.
Fig. 10. Immunohistochemistry analysis. MLKL necroptosis protein maker staining was much more highly expressed in the organ of Corti, spiral ganglions, spiral ligaments and stria vascularis in CDDP-induced ototoxicity (red arrow) compared with control and GM groups.
D. 이독성 난청 모델 와우 조직의 세포사멸 마커 단백질 분석 앞서 면역조직화학 염색을 통해 관찰한 3 가지 세포사멸 기전 아포토시스, 오토파지, 네크로토시스 (Fig. 7-10)와 해당 마커 단백질의 발현을 다시 한번 검증하고자 와우 조직을 균질화 하여 추출한 단백질을 사용하여 웨스턴 블롯을 실시하였다. 항체 특성상 면역조직화학 염색과 웨스턴 블롯에 공통적으로 사용할 수 없는 경우 해당 세포사멸 기전의 다른 대표 마커를 사용하였다. 웨스턴 블롯 결과에서 볼 수 있듯이 젠타마이신을 처리한 실험군에서는 아포토시스 마커인 활성화 cleaved caspase-3 와 아포토시스 유도 단백질인 BAX 의 단백질 양과 더불어 오토파지 마커인 p62, Beclin-1 그리고 LC3B 단백질 역시 시스플라틴 실험군과 대조군과 비교하여 두드러지게 증가되는 것을 관찰할 수 있었다. 반면, 시스플라틴 처리 실험군에서는 네크로토시스 마커인 RIP1 과 RIP3 단백질이 아주 높게 발현되어 젠타마이신 실험군과 대조군과 확연한 차이를 보였으며, 시스플라틴 실험군 역시 오토파지 마커인 p62 와 LC3B 가 젠타마이신 실험군에 비해 발현이 적으나 대조군에 비해 확연한 차이를 보이는 것으로 관찰하였다 (Fig. 11). 따라서 면역조직화학 염색 그리고 웨스턴 블롯 결과를 종합해 보았을 때, 젠타마이신 투여로 인해 발생하는 이독성 난청은 주로 아포토시스와 오토파지 세포사멸 기전이 활성화되며 시스플라틴은 주로 네크로토시스 그리고 일부 오토파지 세포사멸 기전이 활성화되어 결과적으로 코르티기관의 내, 외 유모세포 및 지지세포를 포함한 혈관조 그리고 나선상 신경절 신경세포들의 세포사멸을 유도하여 이독성 난청이 유발되는 것으로 판단된다.
Fig. 11. Protein expression of cell death marker in whole cochlear fractions. The protein band intensity of autophagy markers; Beclin-1, p62, LC3 and apoptosis markers; BAX and cleaved caspase-3 were increased in GM-induced ototoxicity compared with Control. On the other hands, necroptosis markers; RIP1 and RIP3 were significantly increased under the CDDP group. Moreover, the band intensity of autophagy markers; p62 and LC3B were partially increased in CDDP-induced ototoxicity.
E. House Ear Institute-Organ of Corti 1 (HEI-OC1) 세포주를 이용한 세포사멸 기전 조사
와우 조직에서 젠타마이신에 의해 아포토시스와 오토파지 기전이 활성화되며 시스플라틴은 주로 네크로토시스 그리고 일부 오토파지 기전이 활성화되는 것을 관찰하였다 (Fig. 11). 본 연구자는 생체 내 (In vivo)에서 관찰된 현상을 생체 외 (In vitro) 세포 수준에서 조사하기 위해 청각 유모세포주로 확립된 HEI-OC1 세포를 사용하였다. 청각 유모세포는 주로 생체 외 독성 실험에 많이 사용되는 세포로 잘 알려져 있다 (Kalinec et al., 2016). 우선 세포사멸 기전 조사에 앞서 젠타마이신과 시스플라틴 두 약물이 세포 생존능에 미치는 영향과 최적 실험농도를 조사하기 위해 세포 생존능 (WST-1) 실험을 실시하였다. 젠타마이신은 1, 3, 7, 9, 18 mM, 시스플라틴은 1, 5, 10, 20 µM 의 농도 별로 각각 처리하고 24 시간 후 세포 생존능을 측정한 결과 두 약물 모두 농도별로 세포독성을 나타내며 세포사멸을 초래하였다. 본 연구자는 두 약물의 반수치사농도 (LC50)를 확인한 바 각각 젠타마이신 7-9 mM, 시스플라틴은 5-10 µM 로 관찰되었다 (Fig. 12). 따라서 각 세포사멸 기전 조사를 위해 젠타마이신은 7 mM 그리고 시스플라틴은 10 µM 농도로 선택 후 3 가지 세포사멸 기전의 활성을 24 시간 동안 시간 별로 관찰하고자 하였다. 각각의 약물을 해당 농도로 처리하고 6, 12, 24 시간 후 세포를 회수하여 파쇄 후 단백질 정량을 통해 동일한 단백질량으로 웨스턴 블롯을 실시하였다. 아포토시스 마커는 cleaved caspase-3 와 Bax, 오토파지 마커로는 LC3B 그리고 네크로토시스 마커는 인산화 MLKL 항체를 사용하여 동일한 멤브레인에서 동일한 ECL 발현 그리고 동일한 필름 노출시간으로 각각의 밴드를 비교 조사한 결과 조직 실험과 마찬가지로 세포 실험에서도 젠타마이신을 처리한 군에서는 cleaved caspase-3 와 Bax 그리고 LC3B 단백질 발현이 두드러지게 증가한 반면 pMLKL 마커는 6 시간에 잠시 증가되고 그 후 단백질 발현이 감소되어 아포토시스와 오토파지 매개 세포사멸이 활성화되는 것으로 관찰되었고, 시스플라틴을 처리한 군에서는 아포토시스
마커는 관찰되지 않은 반면 오토파지 마커가 12 시간에 약하게 증가되며, 인산화 MLKL 이 24 시간 동안 지속적으로 증가되는 것으로 관찰되어 네크로토시스 매개 세포사멸이 활성화되는 것으로 관찰하였다 (Fig. 13).
Fig. 12. Dose-dependent cell viability (WST-1 assay) of HEI-OC1 cells treated with gentamicin or cisplatin in HEI-OC1 cells. The number of viable cells was significantly decreased compared to control by gentamicin (1, 3, 7, 9, 18 mM) or cisplatin (1, 5, 10, 20 µM) for 24 h. *p < 0.01, vs. vehicle (ANOVA followed by Tukey and Bonferroni’s
post-hoc analysis). n = 3 independent experiments at all three time points. Values represent the
Fig. 13. Protein expression of cell death marker in HEI-OC1 cells. (A) In GM-induced ototoxicity, the intensity of cleaved caspase-3, Bax and LC3B under GM treatment were increased, but the intensity of pMLKL was increased at 6 h single point. (B) In CDDP-induced ototoxicity, increased the intensity of pMLKL time-dependent manner. Moreover, LC3B was partially increased under CDDP treatment.
F. 세포사멸 기전 특이 억제제를 통한 젠타마이신과 시스플라틴의 이독성 제어 여부에 대한 조사
반수치사농도의 젠타마이신 (7 mM)과 시스플라틴 (10 µM)을 처리 시 젠타마이신을 처리한 군에서는 cleaved caspase-3 와 Bax 그리고 LC3B 단백질 발현이 두드러지게 증가하여 아포토시스와 오토파지 매개 세포사멸이 주가 되는 반면에, 시스플라틴 군에서는 인산화 MLKL 가 주도적으로 발현되며 오토파지 마커 LC3B 가 약하게 증가하여 네크로토시스가 주된 세포사멸 기전으로 관찰하였다. 이에 각각의 세포사멸 기전을 억제하는 특이적 세포사멸 억제제를 사용하여 HEI-OC1 세포의 생존 여부를 관찰하고자 하였다. 본 실험을 위해 아포토시스 핵심 단백질인 caspase 억제제인 Z-VAD-FMK (Z-VAD), 오토파지 과정 중 자가포식소체와 리소좀의 결합을 막아 자가포식소체와 용해소체 형성을 막는 억제제인 chloroquine (CQ), 네크로토시스 신호전달 과정에서 MLKL 의 인산화(활성)을 담당하는 RIP3 단백질 억제제 즉, 네크로토시스의 대표적인 억제제로 널리 알려진 necrostatin-1 (Nec-1) 각 3 종의 특이 억제제를 사용하였으며, 해당 세포사멸 기전을 제어하여 젠타마이신과 시스플라틴에 의해 야기되는 세포사멸을 억제하고 세포생존 여부를 관찰하고자 우선 3 종의 억제제의 농도 별 세포 독성을 세포 생존능 (WST-1) 실험을 실시하여 조사하였다. 3 종의 억제제를 각각 CQ (5, 10, 20, 40 µM), Nec-1 (5, 10, 20, 40 µM), Z-VAD (0.05, 0.1, 0.15, 0.2 µM) 각각의 농도 별로 처리하여 24 시간 경과 후 세포 생존능을 측정한 결과 CQ (10 µM), Nec-1 (10 µM), Z-VAD (0.05 µM)로 각각 세포독성이 야기되지 않는 농도를 선별하였다 (Fig. 14 A). 그 후 젠타마이신과 시스플라틴에 의해 야기되는 세포사멸 억제 여부를 관찰하고자 CQ (10 µM), Nec-1 (10 µM), Z-VAD (0.05 µM)의 농도로 단일 억제제 처리하였으며, 또한 아포토시스와 오토파지 그리고 네크로토시스와 오토파지 복합 기전 억제를 위해 해당 억제제를 복합하여 1 시간 동안 전 처리하고 젠타마이신과 시스플라틴을 후