저작자표시-동일조건변경허락 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. l 이차적 저작물을 작성할 수 있습니다. l 이 저작물을 영리 목적으로 이용할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 동일조건변경허락. 귀하가 이 저작물을 개작, 변형 또는 가공했을 경우 에는, 이 저작물과 동일한 이용허락조건하에서만 배포할 수 있습니다.
이학 석사학위 논문
HeLa에서 K-Ras과발현시 활성산소
발생에 의한 핵모양의 이상의 발생과
이중핵/
다핵 세포 증가 현상 연구.
아 주 대 학 교
대 학 원
의생명과학과/
분자의학전공
HeLa에서 K-Ras과발현시 활성산소
발생에 의한 핵모양의 이상의 발생과
이중핵/
다핵 세포 증가 현상 연구.
지도교수
이
재
호
이 논문을 이학 석사학위 논문으로 제출함.
2014년
7월
아 주 대 학 교
대 학 원
의생명과학과/
분자의학전공
최 희
송
심사위원장
이 재
호
인
심 사 위 원
조 혜
성
인
심 사 위 원
윤 계
순
인
최희송의 이학 석사학위 논문을 인준함.
- 국문요약 -
HeLa에서 K-Ras 과발현시 활성산소 발생에 의한
핵
모양의 이상의 발생과 이중핵/다핵 세포의 증가 현상 연구
암세포에서는 염색체의 수가 비정상적인 배수성을 나타내며, 핵막의 구조적 이상이 종종 관찰 된다. 또한 여러 암세포에서 Ras 의 돌연변이가 관찰되는데, Ras 의 과발현은 세포 내 활성산소(reactive oxygen species, ROS)를 증가시킨다고 알려져 있다. 우리는 최근에 HeLa 세포의 활성산소를 증가 시켰을 때 이중핵/다핵 세포가 증가 되는 것과 핵막의 구조 이상이 증가 되는 것을 관찰 하였다. 따라서 HeLa 에 Ras 돌연변이 유전자를 형질 주입 시키면, Ras 에 의해 발생한 활성산소에 의해 HeLa 세포에서 이중핵/다핵 세포가 되는 것과 핵막의 구조적 이상이 증가 할 것이라고 가정하였다. 실제로 레트로바이러스를 이용하여 Ras 돌연변이 중 하나인 K-RasV12 를 HeLa 세포에서 과발현 시켰을 때
활성산소가 증가하는 것을 확인 했고, 이중핵/다핵 세포가 증가하는 것과 핵 모양이 비정상적인 세포가 대조군에 비해 증가해 있었다. 위 두 가지 현상은
감소하였다. 따라서 K-Ras 에 의해 이중핵/다핵 세포와 핵 모양의 이상이 증가하는 데에는 활성산소의 증가가 관여함을 알 수 있었다. 나아가 활성산소의 증가만으로 위 현상들이 유도 되는지 확인하기 위해 glucose oxidase (GOx)를 배양액에 넣었을 때 역시 두 현상이 증가함을 확인 할 수 있었다. 이 실험 결과는 K-Ras 에 의해 발생한 세포 내의 활성산소가 세포의 이중핵/다핵 세포의 형성을 유도하고 핵막의 구조적 이상을 일으킴으로써 아마도 암의 유발과 상관성이 있을 가능성을 제시한다.
핵심어: ROS, K-Ras, bi/Multi-nucleated, abnormal nuclear shape, cytokinesis failure, aneuploidy, genomic instability
차
례
국문요약 ··· ⅰ 차례 ··· ⅲ 그림 차례 ··· ⅵ 표 차례 ··· ⅶ Ⅰ. 서론 ··· 1 A. K-Ras 유전자와 암 ··· 1 1.발암유전자 K-Ras ··· 1 2. K-Ras 의 구조··· 2 B. K-Ras 와 활성산소 ··· 41. K-Ras 의 과발현시 Nox1 과 Nox4 에 의한 활성산소의 발생 ··· 5
2. K-Ras 의 과발현시 미토콘드리아의 기능 저하에 의한 활성산소 발생 ·· ··· 5 C. K-Ras 과발현에 의해 증가된 활성산소에 의한 핵막의 구조 이상 유발과 이중핵/다핵 세포의 증가 ··· 6 1.핵막의 구조 이상과 암과의 관계 ··· 6 2.이중핵/다핵 세포의 증가와 암과의 관계 ··· 7
A. 세포 배양 ··· 9 B. 항체와 시약 ··· 9 C. 단백질 전기 영동 ··· 9 D. 세포 내 활성산소 농도 측정 ··· 10 E. 활성화 형태의 K-Ras (K-rasV12) 를 가진 레트로바이러스 생산 ··· 10 F. 레트로바이러스 (K-rasV12) infection ··· 11 G. 활성산소 억제제 ··· 11 H. Immunocytochemistry (ICC) ··· 11 I. 통계학적 분석 ··· 12 Ⅲ. 결과 ··· 13 A. K-Ras 과발현시 발생한 활성산소가 핵 모양과 이중핵/다핵 세포 형성에 미치는 영향 ··· 13 B. K-Ras 과발현에 의해 증가 했던 핵 모양의 이상과 이중핵/다핵 세포의 증가가 활성산소 억제제에 의해 억제 ··· 17 C.활성산소 억제제에 의한 핵 모양의 변화와 이중핵/다핵 세포의 형성 억제 ··· 23
참고문헌 ··· 35 ABSTRACT ··· 39
그림
차례
그림1. K-Ras 의 도메인 구조 ··· 3
그림2. K-Ras 의 분자 구조 ··· 4
그림3. K-Ras 의 NOX1 과 NOX4 를 통한 활성산소 농도 조절 기작 ··· 5
그림4. HeLa 세포 내의 활성산소의 증가에 의한 핵 모양의 변화와 이중핵/다핵 세포의 형성 ··· 16 그림5. K-Ras 과발현에 의해 증가 했던 핵 모양과 이중핵/다핵 세포의 증가가 활성산소에 의해 억제 ··· 22 그림6.활성산소 억제제에 의한 세포 내의 핵 모양의 이상과 이중핵/다핵 세포의 형성 억제 ··· 26 그림7.핵 모양의 이상과 이중핵/다핵 세포의 형성 원인 ··· 30
표
차례
표 1. 다양한 암세포에서 발견되는 K-Ras 유전자 돌연변이의 빈도 ··· 2
I. 서론
A. K-Ras 유전자와 암
(1) 발암유전자 K-Ras
Ras 유전자는 small GTPase transducer 단백질을 발현하는 발암유전자 이다 (Chetty 등, 2013). RAS 단백질은 세포 외부의 신호를 받으면 활성 상태가 되어 세포 내부로 신호를 전달하게 된다. Ras 는 세포 분열, 세포 성장, 세포 사멸, 단백질 합성, RNA 전사, 활성산소의 증가 그리고 세포의 이동성을 조절 하는 등 다양한 기능을 하는 유전자이며 여기에는 H-Ras, N-Ras, 그리고 K-Ras 가 있다 (Bollag 등, 1992; Rozkis-Adcock 등, 1993; Quilliam 등, 1995; Schlesinger 등, 1998; Song 등, 2005). Ras 중에서도 K-Ras 유전자의 돌연변이는 다양한 종류의 암에서 발견되고 있고, 전체의 암 중에서는 돌연변이 발생 빈도가 여섯 번째로 많은 유전자이다. 표 1 에 K-Ras 유전자의 돌연변이 비율이 높은 암들을 나타내었다 (Eberhard 등, 2005; Chetty 등, 2013).
Cancer type
K-RAS mutations (%)
Gastrointestinal tract
61
Pancreas
57-90
Biliary tract
28
Lung
16
Endometrium
15
Ovary
14
Prostate
8
Uterine cervix
7
Liver
6
Thyroid
2
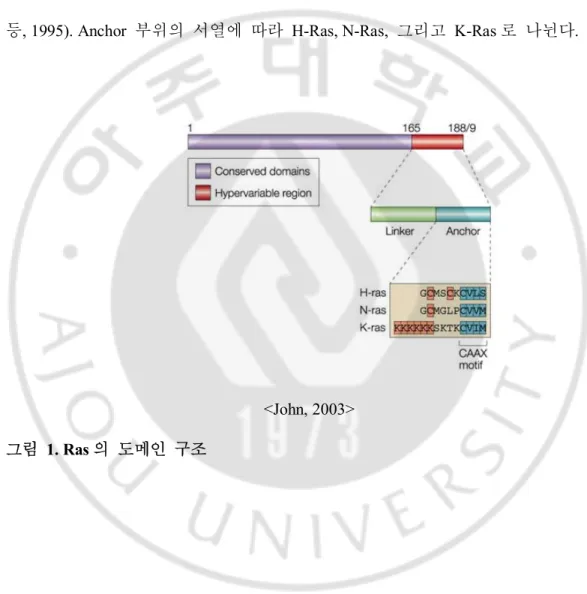
<Chetty 등, 2013> 표 1. 다양한 암세포에서 발견되는 K-Ras 유전자 돌연변이의 빈도 (2) K- Ras 의 구조 Ras 단백질은 그림 1 과 같이 N-말단을 포함한 보존적 도메인 (Conserved domain)과 가변적 C-말단으로 이루어져 있다 (John, 2003). 보존적 도메인에는 guanosine triphosphate (GTP) binding pocket, effector binding 그리고 Switch1 과 Switch2 로 되어 있다. 그림 2 의 Switch1 과 Switch2 는 Ras 가 활성화 되면구조가 변함으로써 GTPase activating protein (GAP)과 guanosine nucleotide exchange factor (GEF)를 조절 할 수 있다 (Chen 등, 2013). 가변적 부위는 양전하를 띄는 아미노산과 소수성 아미노산으로 구성 되어 있어 세포막 부착과 번역 후 변형에 영향을 주는 부위이다 (Bollag 등, 1992; Rozkis-Adcock 등, 1993; Quiliam 등, 1995). Anchor 부위의 서열에 따라 H-Ras, N-Ras, 그리고 K-Ras 로 나뉜다.
<John, 2003>
<Chen 등, 2013> 그림 2. K-Ras 의 분자 구조 B. K-Ras 와 활성산소 K-Ras 단백질은 small GTP 결합 도메인을 가지고 있는데, 활성돌연변이가 일어난 K-Ras 돌연변이는 GTP 결합 상태를 유지하며 하위 전달자에 계속 신호를 전달하게 된다 (Downward, 1996). K-RasV12 단백질 과발현시 활성산소 발생과의 상관 관계는 현재까지 알려진 바로는, 아래의 두 가지가 있다.
(1) K-Ras 의 과발현시 Nox1 과 Nox4 에 의한 활성산소의 발생
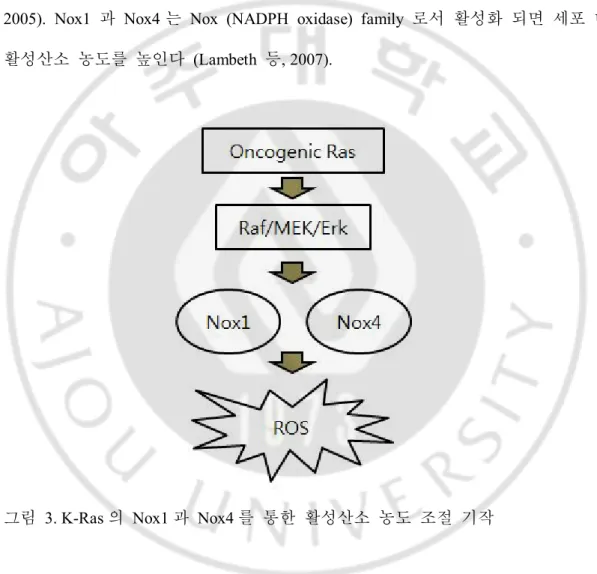
K-Ras 단백질이 활성화 되면 그림 3 처럼 Raf/MEK/ERK pathway 를 통해 Nox1 과 Nox4 의 발현을 증가 시킨다 (Lin 등, 1998; Wang 등, 2002; Collado 등, 2005). Nox1 과 Nox4 는 Nox (NADPH oxidase) family 로서 활성화 되면 세포 내 활성산소 농도를 높인다 (Lambeth 등, 2007).
그림 3. K-Ras 의 Nox1 과 Nox4 를 통한 활성산소 농도 조절 기작
최근 연구 결과에 따르면 HIF-1α, c-Myc, 그리고 Akt 는 metabolic reprogramming 을 일으켜 해당과정을 촉진시키는데 중요한 역할을 한다 (Vafa 등, 2002; Kim 등, 2006). K-RasV12 역시 과발현시키면 미토콘드리아의 기능이
저하되고 해당과정이 증가한다 (Ramanathan 등, 2005). 아직 자세한 메커니즘은 밝혀지지 않았지만 K-RasV12 단백질이 미토콘드리아의 complex I 과 작용하여
기능을 저하 시키고 cyclosporin-sensitive permeability transition pore 에 영향을 주어 막 전위차를 완화 시켜 미토콘드리아의 기능에 손상을 준 것으로 생각된다 (Biaglow 등, 1997; Vizan 등, 2005). 그리고 손상된 미토콘드리아는 세포 내 활성산소 농도를 높인다 (Gregory 등, 2013). C. K-Ras 과발현에 의해 증가된 활성산소에 의한 핵막의 구조 이상 유발과 이중핵/다핵 세포의 증가 (1) 핵막의 구조 이상과 암과의 관계 오래 전부터 핵의 크기나 핵막의 구조 변화를 통해 암세포를 판별 하기도 하였다 (Beale LS, 1860). 핵막의 기능은 초기에 단순히 핵을 보호하는 것으로 알려졌었지만, 점점 밝혀지고 있는 기능들은 암과 연관성이 있다. 표 2 (Jose I 등, 2012)에서 핵막 단백질의 이상으로 나타날 수 있는 암의 특징들을 나타내었다. 하지만 핵막의 구조 이상으로 인한 핵막 자체의 기능과 잠재적인 기능 변화가 암의 발생에 기여 하는지에 대해서는 아직 알아가는 단계이다 (Jose I 등, 2012).
Cancer cell defects
Nuclear envelope link
Nuclear architecture
Nuclear shape Lamins
Nuclear volume NUP210, LAP2β Nuclear rupture Lamins, NETs
<Aurelia 등, 2012> 표 2. 핵막 단백질과 연관 있는 암의 특징 (2) 이중핵/다핵 세포와 암과의 관계 Aneuploidy 는 과거부터 암의 유발 원인으로 제시되어 왔다 (Boveri, 2008). Aneuploidy 는 polyploidy/tetraploidy 와 같은 상태를 거쳐 생긴 다고 생각되는데 이유는 염색체의 양과 중심체 (centrosome)의 개수가 증가함에 따라 비정상 적인 염색체 분열이 일어날 확률이 크기 때문이다 (Fujiwara 등, 2005). 이때 암세포의 polyploid 세포들은 세포 내 활성산소 농도가 높았다 (Roh 등, 2012). 우리 실험실에서는 polyploid 세포들의 활성산소가 높다는 점에 착안하여 polyploidy 와 활성산소와의 관계를 연구 하던 중 활성산소가 이중핵/다핵 세포를 증가시키는 현상을 발견하였다. 특히 활성산소가 mitosis 단계에 영향을 주어 이중핵/다핵 세포가 증가되는 것을 보고 K-RasV12 를 과발현시켜 발생한
실험에서는 발암 유전자인 K-RasV12를 과발현 시켜 증가한 활성산소에 의해서도
Ⅱ
. 실험 재료 및 방법
A. 세포 배양
HeLa 세포는 10% fetal bovine serum (FBS, GibcoBRL, Carlsbad, CA) 와 1% antibiotics (GibcoBRL)가 첨가된 DMEM/F-12 (GibcoBRL) 배지를 이용하여 37oC, 5%
이산화탄소 조건에서 배양하였다.
B. 항체와 시약
1 차 항체로 K-Ras 와
α
-tubulin 은 Calbiochem 에서 구입하였고, GAPDH 는 Cell signaling 에서 구입하였고, catalase 는 AbFrontier 에서 구입하였고, Lamin B 는 Abcam 에서 구입하였다. Glucose Oxidase (GOx)는 Sigma 에서 구입하였다.C. 단백질 전기 영동
세포를 얻어 PBS 로 세척한 뒤 RIPA cell lysis buffer (10mM Tris-Cl, pH 7.4, 150mM NaCl, 1% Triton X-100, 1 ㎍/ml aprotinin, 1 ㎍/ml leupeptin, 1mM NaF, 5mM Na3VO4)로
단백질 전기 영동을 이용하여 분리 하였다. Nitrocellulose membrane (S&S Inc., NH, Germany) 에 전기 이동 (electrotransfer) 하고 5% nonfat dry milk 가 들어있는 PBST 로 상온에서 1 시간 동안 blocking 후 4℃에서 1 차 항체로 하루 동안 반응 시켰다. 반응 후 PBST 로 15 분씩 4 번 세척하고 HRP 가 붙어 있는 2 차 항체로 상온에서 40 분간 반응 시켰다. PBST 로 10 분씩 4 번 세척해주고 단백질의 확인은 제조업체의 프로토콜대로 enhanced chemiluminescence (ECL, Amersham Biosciences)로 확인하였다.
D. 세포 내 활성산소 농도 측정
HeLa 세포에 37℃에서 15 분간 2,7-dichlorodihydrofluorescein diacetate (DCFH-DA)를 처리 후 PBS 로 3 번 세척한다. DCFH-DA 의 세기는 flow cytometery (BD Biosciences)로 측정하였다.
E. 활성화 형태의 K-ras (K-rasV12)를 가진 레트로바이러스 생산
K-RasV12 레트로바이러스는 이수재 교수 (한양대학교)가 Dr. P. Kirshmeier
(Schering-Plough Research Institute)가 제공한 pSPORT-Ki-RasV12 를 이용하여 만든
레트로바이러스를 이용하였다. 레트로바이러스의 생산을 위해서 Dulbecco's modified Eagle's medium (DMEM; GIBCO, 31600-034) 10% FBS, 2 mM GlutaMAX (Invitrogen, 35050-06), 50 U/ml Penicillin-Streptomycin, 1 µg/ml Tetracyclin, 2 µg/ml Puromycin, 0.3 mg/ml G418 sulfate (Calbiochem, 345810)를 첨가하여 배양하는
modified 293T cell line 에 K-RasV12 plasmid 를 Lipofectamine Plus Reagent (Invitrogen,
10964-021)를 이용하여 형질전환 하였다. 바이러스가 있는 배지 (상층액)은 4 일간 매일 수확하였다. 수확한 바이러스 상층액은 0.45 µm filter unit (Milipore corp. UFC 920008)으로 filtering 후 -80℃에 보관하였다.
F. 레트로바이러스 (K-rasV12) infection
6-well 에 HeLa 세포 1x105을 seeding 하고 16h 후 K-RasV12 레트로바이러스를 100
㎕ 와 FBS 와 antibiotics 를 넣지 않은 DMEM/F-12 (Gibco BRL) 400 ㎕를 넣고 4 시간 동안 30 분에 한번씩 흔들어 준다. 24 시간 후 10% FBS (Invitrogen), 1% antibiotics (GIBCO) 을 넣은 DMEM/F-12 (Gibco BRL) 을 1mL 넣어 준다.
G. 활성산소 억제제
NAC (5mM) 은 HeLa 세포에 레트로바이러스 K-Ras infection 4 시간 후 배양액 1mL 을 추가로 넣어 줄 때 처리 하였다. Catalase (2 ㎍) 는 6well HeLa 세포에 레트로바이러스 K-Ras infection 24 시간 후 Lipofectamine Plus Reagent (Invitrogen)을 이용하여 형질주입 (transfection) 하였다.
표본(sample)을 PBS 로 한번 세척 후 100% methanol (MERCK)-20℃에서 10 분간 fixation 한 후 PBS 로 두 번 세척한다. 0.25% triton X-100 (Sigma)이 들어 있는 PBS 로 상온에서 10 분간 permeabilization 한 후 PBS 로 두 번 세척한다. 3% BSA 가 들어 있는 PBS 로 상온에서 1 시간 동안 blocking 한 후 4℃에서 1 차 항체로 하루 동안 반응 시켰다. 반응 후 PBS 로 5 분씩 3 번 세척하고 상온에서 3% BSA 가 들어 있는 2 차 항체로 어두운 곳에서 1 시간 동안 반응 시켰다. 어두운 곳에서 PBS 로 5 분씩 3 번 세척 후 DAPI 염색을 하고 형광 현미경 (ZEISS, Axio Imager M1)으로 관찰 하였다.
I. 통계적 분석
그래프는 평균 값에 표준 편차를 ±하여 나타내었다. 그리고 여러 그룹간의 유의성 확인을 위해 Student's t-test 로 검증하였다. 확률 값이 0.05 이하일 때 통계적으로 유의 하다고 간주하였다.
Ⅲ
. 결과
A. K-Ras 과발현시 발생한 활성산소가 핵 모양과 이중핵/다핵 세포 형성에 미치는 영향 발암 유전자에 의한 세포 내 활성산소 증가에 의해서도 핵 모양의 변화와 이중핵/다핵 세포의 증가 현상이 나타나는지 확인해 보았다. K-RasV12 레트로바이러스를 infection 후 날짜 별로 K-Ras의 발현 정도를 나타내었다. 1일째에는 K-Ras가 거의 없지만 3일, 5일에서는 높은 농도로 발현되어 있었다 (그림 4A). K-RasV12 레트로바이러스를 농도별로 infection 시킨 후 3일째에K-Ras의 발현량을 확인 해본 결과 농도 의존적으로 발현하고 있음을 알 수 있었다(그림 4B). 이를 기준으로 HeLa 세포에 K-RasV12를 과발현 시킨 후 5일간
세포 내 활성산소 농도를 측정해 보았다. K-RasV12를 과발현 시킨 후 1일, 3일, 5일
된 HeLa 세포를 DCFH-DA 염색 후 FACS로 intensity를 측정하였다. 1일째에는 활성산소의 농도 증가가 나타나진 않았지만, 3일째에는 대조군의 1.5배, 5일째에는 2.1배까지 증가하였다(그림 4C). K-Ras 레트로바이러스 infection 후 5일째에 ICC를 통하여 핵 모양의 변화와 이중핵/다핵 세포들을 관찰하였다. 대조군에 비해 K-RasV12를 과발현 시킨 세포들의 경우 한 세포 안에 두 개의 핵이 보이는 이중핵
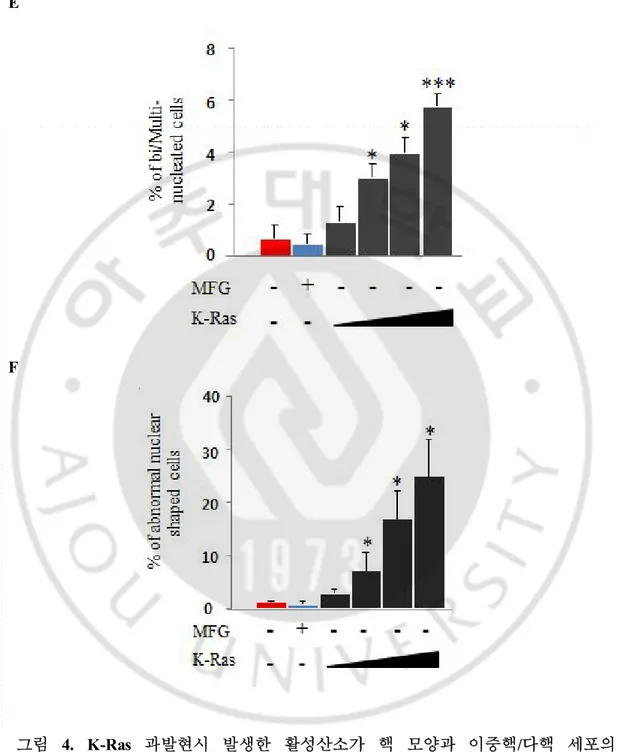
진해져 있는 세포들을 핵 모양의 이상으로 보았다. 나아가 K-Ras를 농도 별로 과발현 시킨후 Lamin 염색을 통하여 이중핵/다핵 세포와 핵 모양의 이상을 관찰 하였다 (그림 4D). 이중핵/다핵 세포는 대조군에서 1% 정도 인데 반해 K-RasV12 레트로바이러스를 infection 한 경우 30㎕ - 4%, 50㎕ – 6%, 100㎕ – 10% 로 농도 의존적으로 증가 하는 것을 알 수 있었다 (그림 4E). 핵 모양의 이상은 대조군에서 1% 정도가 관찰 되었다. K-Ras 레트로바이러스 infection시 30㎕ - 7%, 50㎕ – 15%, 100㎕ – 23% 로 농도 의존적으로 증가 하는 것을 알 수 있었다 (그림 4F). A B
C
E
F
그림 4. K-Ras 과발현시 발생한 활성산소가 핵 모양과 이중핵/다핵 세포의
(A) HeLa cells were infected with retrovirus K-RasV12 (100 ㎕) and harvested at 1d, 3d, and
5d. (B) HeLa cells were infected with retrovirus K-RasV12 10, 30, 50, and 100 ㎕ and
harvested at 3days after infection. (C) HeLa cells were infected with K-Ras V12 (100 ㎕) and
ROS level was measured by FACS after DCFH-DA staining. HeLa cells were treated H2O2
(100μM) for 20min as positive control. (D) At 5day after K-RasV12 (100 ㎕) infection,
abnormal nuclear shapes and bi/multi-nucleated cells were observed by ICC. (E) Bi/multi-nucleated cells were counted after K-RasV12 (100 ㎕) or control vector MFG (100 ㎕)
infection (n>300). (F) Abnormal nuclear shapes were counted after K-RasV12 (100 ㎕) or
control vector MFG (100 ㎕) infection (n>300). *P<0.05, **P<0.01, ***P <0.001, compared to control B. K-Ras 과발현에 의해 증가 했던 핵 모양의 이상과 이중핵/다핵 세포의 형성이 활성산소 억제제에 의해 억제됨 그렇다면 K-RasV12 과발현에 의한 핵 모양의 변화와 이중핵/다핵 세포의 증가 현상이 활성산소 증가에 의해 유도 되었다는 것을 검증 하기 위해 HeLa 세포에 K-RasV12 레트로바이러스를 infection 후 활성산소 억제제를 사용하였다.
알아 보았다. K-Ras의 발현은 활성산소 억제제 NAC에 의한 차이는 거의 없는 것으로 보인다 (그림 5A). Catalase는 HeLa 세포에 K-RasV12 레트로바이러스 infection 24시간 후 lipofectamin을 이용하여 넣어 주었다. HeLa에 K-RasV12를
과발현 시킨 후 5일째에 단백질 전기 영동으로 catalase가 K-Ras의 발현에 영향을 주는지 확인해 보았다. 그 결과 catalase에 의한 K-RasV12의 발현에는 차이가
없었다 (그림 5B). 활성산소 억제제 (NAC, catalase) 가 K-Ras에 의해 발생한 활성산소를 효과적으로 억제 하는지 확인하기 위해 HeLa 세포에 K-Ras를 과발현 시키고 NAC과 catalase를 처리한 후. DCFH-DA로 염색하여 FACS로 intensity를 비교해 보았다. K-RasV12 레트로바이러스를 infection 하고 3일, 5일째에도
활성산소가 양성 대조군과 비슷한 농도로 유지 되고 있는 것을 확인 할 수 있었다. K-Ras에 의해 발생한 활성산소는 활성산소 억제제에 의해 산소가 다소 억제 되고 있었다 (그림 5C). Bi/multi nucleated cell의 형성에 활성산소가 필요한 것인지 확인 해보기 위해 HeLa 세포에 K-Ras를 과발현 시킨 후 NAC을
처리하였다. 그 결과 K-RasV12 레트로바이러스 infection 후 5일째에 K-Ras 50㎕ 를
친 경우에는 4% 정도의 이중핵/다핵 세포가 관찰 되었는데 NAC에 의해 2% 정도로 유의하게 감소 하였다. K-RasV12 레트로바이러스를 100㎕을 친 경우에도 역시 NAC을 처리 한 경우 4%로 유의하게 감소하였다 (그림 5D). Catalase를 처리한 경우에는 K-RasV12 레트로바이러스를 100㎕ infection 만 한 경우 6% 정도의 이중핵/다핵 세포가 관찰 되었는데 catalase를 처리 한 경우 3% 정로 유의하게 감소 하였다 (그림 5E). 이중핵/다핵 세포는 DNA양의 증가가 2n, 4n 등으로 나타날 것을 예상 하여 세포 내 DNA를 PI로 염색 후 FACS로 확인해 보았다. 예상 했던 2n, 4n과 같은 peak의 확인은 어려웠지만 K-Ras에 의해 세포
내 DNA 양이 늘어난 것이 활성산소 억제제에 의해 감소하는 것은 알 수 있었다 (그림 5F). K-RasV12 레트로바이러스 infection 후 5일째에 핵막의 모양 변화가
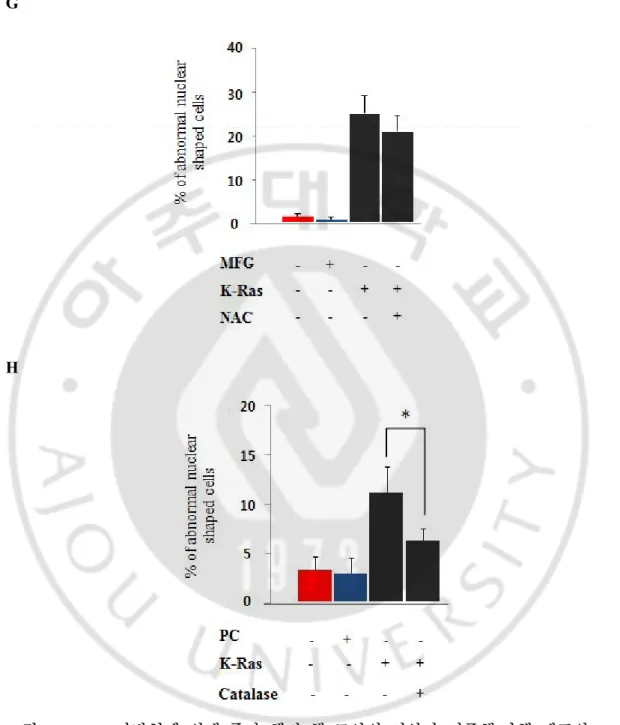
생긴 세포는 25% 였는데 활성 억제제 NAC을 처리 한 경우 20% 로 핵막의 모양이 변한 세포는 약간 감소 하였으나 유의한 결과는 아니었다 (그림 5G). 핵막의 모양은 catalase를 처리한 경우는 K-RasV12 레트로바이러스 50㎕ infection
후 5일째에 핵막의 모양 변화가 생긴 세포는 11% 였는데 catalas 처리시 6% 정도로 핵막 모양의 변화를 유의하게 감소되었다 (그림 5H).
A
C
E
G
H
그림 5. K-Ras 과발현에 의해 증가 했던 핵 모양의 이상과 이중핵/다핵 세포의
형성이 활성산소 억제제에 의해 억제됨
(100㎕) and expression levels were checked between NAC(5mM) treated or not by western blot assay. (B) 24H after retroviral K-RasV12 infection, catalase(2㎍) or PC DNA(2㎍) was
transfected into HeLa and harvested at 5day after retroviral K-RasV12 infection. (C) HeLa
cells were infected by retroviral K-RasV12 (100㎕) and antioxidant (NAC 5mM or
catalase2㎍) was treated. H2O2 (100μM) was treated for 20min as positive control. (D)
Increased number of bi/multi-nucleated cells by retroviral K-RasV12 infection was down
regulated by antioxidant NAC and (E) catalase (n>300). (F) DNA contents were measured by FACS after PI staining. (G) Alteration of nuclear shapes by retroviral K-RasV12 infection
were down regulated by antioxidant NAC and (H) catalase (n>300). *P<0.05, compared to K-RasV12 infection
C. 활성산소 억제제에 의한 핵 모양의 변화와 이중핵/다핵 세포의 형성 억제
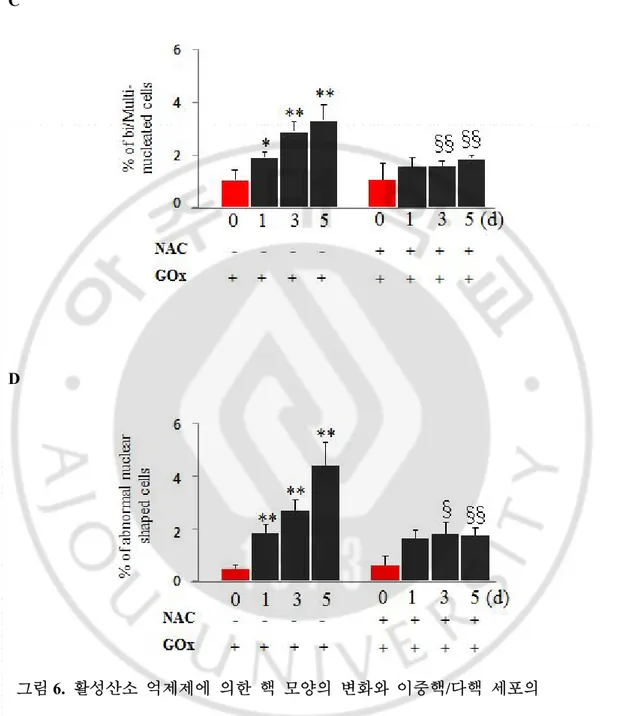
K-Ras 와는 무관하게 세포 내 활성산소의 증가만에 의해서도 핵 모양의 변화와 이중핵/다핵 세포의 증가가 발생 하는지 알아보았다. HeLa 세포 내의 활성산소의 증가를 유도할 때 발암 유전자에 의해 계속해서 활성산소가 발생 하는 환경과 유사한 환경을 만들기 위해 GOx 를 사용하였다. HeLa 세포에 GOx
핵 모양의 변화와 이중핵/다핵 세포들을 나타내었다. GOx 에 의해 발생한 활성산소 만으로도 K-Ras infection 후 관찰 되었던 이중핵/다핵 세포들과 abnormal nuclear shape 의 증가를 관찰 할 수 있었다 (그림 6B). HeLa 세포에 GOx 를 넣고 시간 경과에 따른 핵 모양의 변화를 관찰 하였다. 그 결과 1 일째에는 대조군 0.5%에서 2%로 증가 하였고, 3 일째에는 2.5%, 5 일째에는 4%로 점점 늘어나는 것을 알 수 있었다. 그리고 NAC 에 의해 유의하게 감소 되고 있었다 (그림 6C). GOx 는 이중핵/다핵 세포 역시 증가 1 일째에는 대조군 1%에서 2%로 증가시켰고, 3 일째에는 3%, 5 일째에는 3.5%로 증가 하였다. 이 현상 역시 NAC 에 의해 유의하게 감소 되었다 (그림 6D). 따라서 HeLa 내의 활성산소 농도를 증가시키는 것만으로 핵 모양의 변화와 이중핵/다핵 세포의 형성을 유발한다는 것을 알 수 있었다. A
C
D
그림6. 활성산소 억제제에 의한 핵 모양의 변화와 이중핵/다핵 세포의
형성 억제
(A) HeLa cells were incubated GOx (1mU/mL) containing media for 0.5, 1, 12 and 24h and ROS level was measured by FACS. H2O2 (100μM) was treated for 20min as positive control.
(B) HeLa cells were incubated in GOx (1mU/mL) containing media for 5d. (C) Increased number of bi/multi-nucleated cells by GOx treatment was down regulated by antioxidant NAC (5mM) and (D) catalase (2㎍) (n>300). *P<0.05, **P<0.01, compared to control, §P<0.05, §§P<0.01, compared to GOx treated cells
D. 핵 모양의 이상과 이중핵/다핵 세포의 형성 원인
이중핵/다핵 세포의 형성 가능한 기전으로는 세포 융합 (cell fusion)과 세포질 분열 이상이 있다. 이중핵/다핵 세포의 형성 원인을 세포질 분열 실패 현상에 의한 것인지 time lapse 현미경으로 확인 해 보았다. K-RasV12 레트로바이러스를
infection 후 3일째에서 5일째까지 10분 간격으로 세포 분열 과정을 찍은 후 관찰 하였다. K-RasV12 를 과발현 시킨 세포에서 생성된 이중핵/다핵 세포 (n=24)은
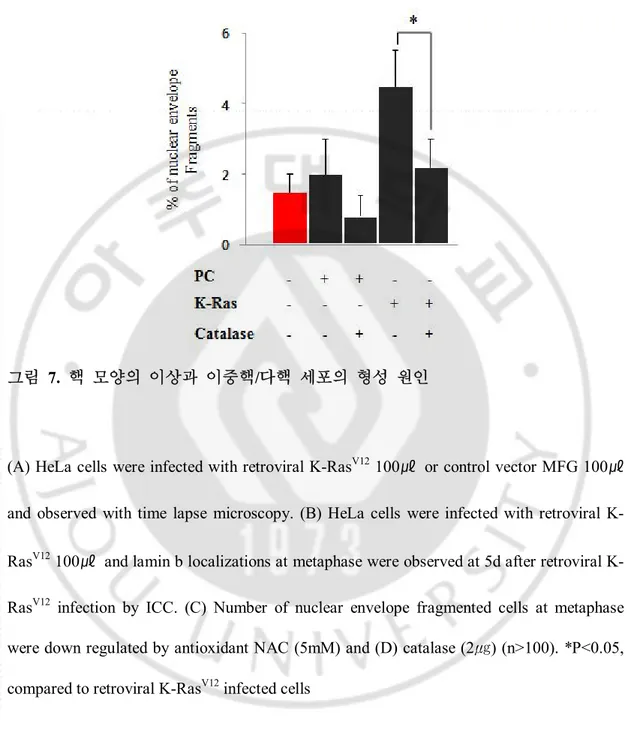
모두 세포질 분열 실패에 의한 것임을 확인 할 수 있었다 (그림 7A). 활성산소가 핵막의 모양 변화에 주는 원인을 알아보기 위해 핵막을 관찰 하던 중 세포 내 활성산소가 높은 경우 metaphase 전후로 lamin 덩어리들을 발견하였다 (그림 7 B). HeLa 세포에 K-RasV12 레트로바이러스를 infection 하고 5일 후에 22% 정도의
B
D
그림 7. 핵 모양의 이상과 이중핵/다핵 세포의 형성 원인
(A) HeLa cells were infected with retroviral K-RasV12 100㎕ or control vector MFG 100㎕
and observed with time lapse microscopy. (B) HeLa cells were infected with retroviral K-RasV12 100㎕ and lamin b localizations at metaphase were observed at 5d after retroviral
K-RasV12 infection by ICC. (C) Number of nuclear envelope fragmented cells at metaphase
were down regulated by antioxidant NAC (5mM) and (D) catalase (2㎍) (n>100). *P<0.05, compared to retroviral K-RasV12 infected cells
Ⅳ
. 고찰
NOX 1, NOX 4 그리고 K-Ras 단백질들은 세포 내 활성산소
를 높여준다고 알려져 있다. 세포 내 활성산소 농도를 높이기 위해 HeLa 세포에 NOX 1, NOX 4, 그리고 K-Ras 를 과발현 시켜 보았다. Nox1 과 Nox4 를 과발현 시킨 경우에는 우리 실험실에서는 HeLa 세포의 활성산소 농도 증가가 관찰 되지 않았다. 이는 단잭질의 발현 자체가 원활하지 않았기 때문이었다 (data not shown). 하지만 K-Ras 를 과발현 시킨 경우에는 HeLa 세포의 활성산소 농도가 증가하여 본 실험에 사용하였다.
활성산소의 증가가 어떻게 세포질 분열 실패 현상을 유발 했을 것인가? 활성산소는 mitosis 단계에 DNA damage 를 주어 DNA bridge 를 형성 한다 (Acilan C 등, 2007; Woodbine L 등, 2011). 활성산소의 또 다른 역할로는 아직 발간된 논문은 없지만 본 연구실의 조민국 (아주대학교 박사 과정) 대학원생의 연구 결과에 의하면 DNA bridge 를 해소 시켜 주는 것으로 보이는 단백질의 기능과도 연관이 있어 보인다. 생성된 DNA bridge 가 충분히 해결되지 못하면 cytokinesis failure 가 진행될 때 DNA bridge 때문에 더 이상 cleavage furrow 가 진행되지 못하여 결국 cytokinesis failure 를 유발하는 것으로 보인다 (personal communication).
활성산소의 증가가 어떻게 nuclear shape 의 변화를 유발 했을 것인가? 하나의 가능성으로는 활성산소에 의해 p38 활성화가 일어나고 그에 따라 lamin B1 의 증가가 일어남으로써 핵 모양이 바뀔 가능성이 있다 (Aurelia B, 2012). 또 다른 가능성으로는 chromatin 과 핵막을 이어 주는 BAF 라는 단백질은 telophase 때 핵막이 재생 되는 과정에서 PP2a 에 의해 탈 인산화 된다 (Claudio A, 2012). 그런데 이 PP2A 의 활성은 활성산소에 의해 저해를 받는 것으로 알려져 있다 (Qinghang Liu, 2003). 본 연구실의 안주현 (아주대학교 박사 과정) 대학원생의 연구 결과에 의하면 mitosis 단계에서 활성산소 농도가 증가하면 이 PP2A 의 활성이 떨어져 핵막의 변형이 일어나는 것으로 보인다 (personal communication). 위에서 언급 했듯이 이중핵/다핵 세포의 생성과 핵막의 모양 변화 기전은 주로 mitosis 에 집중되어 있다. 본 실험에 있어서는 K-RasV12 레트로바이러스 infection 후 5 일 이라는 장시간에 걸쳐 실험을 진행하였으므로 각 세포마다 중간에 수 차례의 mitosis 를 거치게 되며 이때 특히 활성산소에 의한 상기 현상들이 발생하였을 것으로 추정된다.
Ⅴ
. 결론
본 연구는 활성산소에 의한 핵 모양의 변화와 세포질 분열 실패가 일어나 이중핵/다핵 세포가 되는 두 가지 현상을 보고 실제 암세포에서 이 두 가지의 암세포 특이적 형질의 획득도 활성산소에 의해 일어나는지 알아보고자 하였다. 활성산소를 증가 시킨다고 알려진 K-Ras 를 이용하여 실험한 결과 HeLa 세포에서 핵 모양의 이상과 이중핵/다핵 세포의 증가를 확인 할 수 있었다. K-Ras 과발현시 첫 번째 현상인 핵 모양의 이상은 활성산소 억제제인 NAC 처리하였을 때 핵 모양의 변화가 감소 되긴 하였지만 유의하게 감소 되지는 않았다. 하지만 catalase 를 처리 한 경우 핵 모양의 이상이 유의하게 감소 되는 것을 알 수 있었다. 따라서 K-Ras 를 과발현 시켜 발생한 활성산소가 핵 모양의 이상을 유발하는 데 기여 했을 것으로 생각된다. K-Ras 과발현시 두 번째 현상인 이중핵/다핵 세포의 증가는 활성산소에 의한 이중핵/다핵 세포로 생각된다. HeLa 세포에서 K-Ras 과발현시 이중핵/다핵 세포가 증가 했던 반면, K-Ras 과발현 후 활성산소 억제제를 처리한 경우 이중핵/다핵 세포형성이 유의 하게 감소 하였기 때문이다. 그리고 이중핵/다핵 세포의 형성은 세포질 실해 현상에 의해 생긴 것으로 보인다. 이중핵/다핵세포질 분열 실패 현상은 관찰 할 수 있었지만 세포 융합 과정은 관찰 할 수 없었다.
참고
문헌
1. Acilan C, Potter DM, Saunders WS: DNA repair pathways involved in anaphase bridge formation, Genes Chromosomes Cancer, 46, 522-31, 2007
2. Aurelia Barascu, Le Chalony C, Pennarun G, Genet D, Zaarour N, Bertrand P: Oxidative stress alters nuclear shape through Lamins dysregulation, Nucleus, 3, 411-417, 2012
3. Beale LS: Examination of sputum from a case of cancer of the pharynx and the adjacent parts, Arch Med Lond 2, p44, 1860
4. Bellot GL. Liu D, Pervaiz S: ROS, autophagy, mitochondria and cancer: Ras, the hidden master? Mitochondion 13, 155-162, 2013
5. Biaglow JE, Cerniglia G, Tuttle S, Bakanauskas V, Stevens C, McKenna G: Effect of oncogene transformation of rat embryo cells on cellular oxygen consumption and glycolysis,
Biochem Biophys Res Commun, 235, 739-742, 1997
6. Bollag G, McCormick F: GTPase activating proteins, Semin Cancer Biol 3, 199-208, 1992
7. Chen C, Er TK, Liu YY, Hwang JK, Barrio MJ, Rodrigo M, Garcia-Toro E, Herreros-Villanueva M: computational analysis of KRas mutations: implications for different effects on the KRas p.G12D and p.G13D mutations, PLos ONE, 8, 2, 2013
9. Chiaradonna F, Sacco E, Manzoni R, Giorgio M, Vanoni M, Alberghina L.: Ras-dependent carbon metabolism and transformation in mouse fibroblasts, Oncogene, 25, 539ㄴ1-5404, 2006
10. Claudio Asencio, Iain F. Davidson, Rachel Santarella-Mellwig, Thi Bach Nga Ly-Hartig, Moritz Mall, Matthew R. Wallenfang, Iain W. Mattaj, Matyas Gorjanacz: Coordination of kinase and phosphatase activities by Lem4 enables nuclear envelope reassembly during mitosis, Cell, 150, 122-135, 2012
11. Collado M, Gil J, Efeyan A, Guerra C, Schuhmacher AJ, Barradas M, Benguria A, Zaballos A, Flores JM, Barbacid M, Beach D, Serrano M: Tumour biology: Senescence in premalignant tumours, Nature 436, 642, 2005
12. Downward J: Control of ras activation, Cancer Surv. 27, 87-100, 1996
13. Eberhard D, Johnson B, Amler L, Goddard AD, Heldens SL, Herbst RS, Ince Wl, Janne PA, Januario T, Johnson DH, Klein p, Miller VA, Ostland MA, Ramies DA, Sebisanovic D, Stinson JA, Zhang YR, Seshagiri S, Hillan KJ: Mutations in the epidermal growth factor receptor and in KRAS are predictive and prognostic indicators in patients with non-small-cell lung cancer treated with chemotherapy alone and in combination with erlotinib, J Clin
Oncol 23, 5900-9, 2005
14. Fujiwara T, Bandi M, Nitta M, Ivanova EV, Bronson RT, Pellman D: Cytokinesis failure generating tetraploids promotes tumorigenesis in p53-null cells, Nature, 437, 1043-7, 2005
15. John F. Hancock: Ras proteins: different signals from different locations, Nature Reviews
Molecular Cell Biology, 4, 373-385, 2003
envelope: A convoluted relationship, Seminars in Cancer Biology, 23, 125-37, 2013
17. Kim JW, Dang CV: Cancer’s molecular sweet tooth and the Warburg effect, Cancer Res. 66, 8927-8930, 2006
18. Kira M. Holmstro, Toren Finkel: Cellular mechanisms and physiological consequences of redox-dependent signaling, Nature Reviews Molecular Signaling, 15, 411-421, 2014
19. Lambeth JD, Kawahara T, Diebold B: Regulation of NOX AND Duox enzymatic activity and expression, Free Radic. Biol. Med. 43, 319-331, 2007
20. Lin AW, Barradas M, Stone JC, Aelst L, Serrano M, Lowe SW: Premature senescence involving p53 and p16 is activated in response to constitutive MEK/MAPK mitogenic signaling, Genes Dev. 12, 3008-3019, 1998
21. Qinghang Liu, Polly A. Hofmann: Protein phosphatase 2A-mediated cross-talk between p38 MAPK and ERK in apoptosis of cardiac myocyes, American Journal of Physiology, 286, 2204-2212, 2003
22. Quilliam L, Khosravi-Far R, Huff SY, Der CJ: Guanine nucleotide exchange factors: activators of the Ras superfamily of proteins, Bioessays 17, 395-404, 1995
23. Ramanathan A, Wang C, Schreiber SL: Perturbational profiling of a cell-line model of tumorigenesis by using metabolic measurements, Proc Natl Acad Sci USA, 102, 5992-5997, 2005
25. Rozkis-Adcock M, Fernley R, Wade J, Pawson T, Bowtell D: The SH2 and SH3 domains of mammalian Grb2 couple the EGF receptor to the Ras activator mSos1, Nature 363, 83-85, 1993
26. Schlesinger T, Fanger G, Yujiri T, Johnson GL: The TAO of MEKK, Front Biosci 3, 1181-D6, 1998
27. Song G, Ouyang G, Bao S: The activation of Akt/PKB signaling pathway and cell survival, J
Cell Mol Med 9, 59-71, 2005
28. Woodbine L, Brunton H, Goodarzi AA, Shibata A, Jeggo PA: Endogenously induced DNA double strand breaks arise in heterochromatic DNA regions and require ataxia telangiectasia mutated and Artemis for their repair, Nucleic Acids Res, 39, 6986-97, 2011
29. Vafa O, Wade M, Kern S, Beeche M, Pandita TK, Hampton GM, Wahl GM: c-Myc can induce DNA damage, increase reactive oxygen species, and mitigate p53 function: a mechanism for oncogene-induced genetic instability, Mol Cell. 9, 1031-1044, 2002
30. Vizan P, Boros LG, Figueras A, Capella G, Mangues R, Bassilian S, Lim S, Lee WN, Cascante M: K-ras codon-specific mutations produce distinctive metabolic phenotypes in NIH3T3 mice [corrected] fibroblasts, Cancer Res. 65, 5512-5515, 2005
31. Wang W, Chen JX, Liao R, Deng Q, Zhou JJ, Huang S, Sun P: Sequential activation of the MEK-extracellular signal-regulated kinase and MKK3/6-p38 mitogen-activated protein kinase pathways mediates oncogenic ras-induced premature senescence, Mol. Cell. Biol. 22, 3389-3403, 2002
ABSTRACT
Polyploidy and abnormal nuclear shapes are well known characteristics of cancer cells. K-Ras is frequently mutated in many cancers. One of the oncogene mutants, K-RasV12 has been reported to generate reactive oxygen species (ROS). We recently observed that increased ROS generates polyploidy and abnormal nuclear shape in HeLa cells. We hypothesized that ROS generated by K-RasV12 may also generate polyploidy and abnormal nuclear shape in HeLa. We transiently infect K-RasV12 retrovirus to HeLa cells. K-RasV12 infection led to ROS increase as well as generation of polyploidy and abnormal nuclear shaped cells. Antioxidants NAC and catalase down regulates both phenomenon as well as ROS level. Our data suggest that high level of ROS can cause polyploidy and abnormal nuclear shape, which may contribute to cancer generation.