저작자표시-동일조건변경허락 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. l 이차적 저작물을 작성할 수 있습니다. l 이 저작물을 영리 목적으로 이용할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 동일조건변경허락. 귀하가 이 저작물을 개작, 변형 또는 가공했을 경우 에는, 이 저작물과 동일한 이용허락조건하에서만 배포할 수 있습니다.
이학 석사학위 논문
유전자 적중법을 이용한 조건적
LDHB 유전자 삭제 마우스 제작
아 주 대 학 교
대 학 원
의생명과학과
김
소
현
유전자 적중법을 이용한 조건적
LDHB 유전자 삭제 마우스 제작
지도교수
박
찬
배
이 논문을 이학 석사학위 논문으로 제출함.
2011년
2월
아 주 대 학 교
대 학 원
의생명과학과
김
소
현
김소현의 이학 석사학위 논문을 인준함.
심사위원장
박
찬
배
인
심 사 위 원
윤
계
순
인
심 사 위 원
정
선
용
인
아 주 대 학 교
대 학 원
2010년 12월 23일
i - 국문요약 -
유전자 적중법을 이용한
조건적 LDHB 유전자 삭제 마우스 제작
포도당은 세포의 에너지 생산에 이용되는 주 에너지원으로, 세포 내로 흡수된 후 대사 과정을 통하여 에너지 즉 ATP 생산에 사용된다. 정상세포의 경우 세포 내부로 흡수된 포도당은 세포질(cytoplasm)에서 해당작용(glycolysis)을 통하여 2 개의 ATP 를 생산하며 pyruvate 로 분해되고, 다음으로 생성된 pyruvate 는 미토콘드리아 내로 이동하여 산화적 인산화 반응(oxidative phosphorylation)을 통하여 완전히 대사되며 36 개의 ATP 를 생산한다. 그러나 많은 종류의 암세포들(특히 전이성 암세포들)에서는 이러한 당대사에 변형이 생겨, 해당작용을 통하여 생성된 pyruvate 가 미토콘드리아에서 대사되지 못하고 대부분 lactate 로 변환되며 NAD+를 생산하여 지속적으로 해당작용이 작동될 수 있게 된다. 이 때 생성된 lactate 는 세포 외부로 배출된다. 변형 당대사의 원인으로는 생체 내에서 비대해진 종양조직 내부로 산소의 이동이 어려워 미토콘드리아에 의한 ATP 생산이 제한되므로, 종양조직 내부의 세포들은 glycolysis 를 주로 이용하여 ATP 를 생산하기 때문인 것으로 알려져 있다. 암세포는 ATP 생산에 비효율적인 glycolysis 로 에너지를 생산하기 때문에 정상세포에 비하여 훨씬 많은 양의 포도당을 흡수하며, glycolysis 에 의하여 축적되는 pyruvate 는 미토콘드리아에서 이용되지 못하고 lactate 의 형태로 세포ii 외부로 배출한다. 암세포에서는 glycolysis 를 활성화시키기 위하여 관련 유전자들과 lactate 생성 유전자들의 발현이 크게 증가되어 있다. 최근 암세포에서 발견되는 변형 당대사가 암세포 주위의 환경변화에 의한 수동적인 변형이 아니라 오히려 정상세포의 암세포 전환에 중요한 역할을 한다는 주장들이 제기되고 있다. 본 연구에서는 증진된 해당작용이 발암기전에 미치는 영향을 연구하기 위하여 pyruvate 로부터 lactate 를 생산하는 lactate dehydrogenase 의 활성을 증진시킨 유전자 조작 마우스를 제작하고자 하였다.
Lactate dehydrogenase 는 네 개의 단위체가 모여 활성을 발휘하는 복합체 효소로 lactate dehydrogenase A(LDHA)와 lactate dehydrogenase B(LDHB) 두 단위체의 조합에 의하여 활성에 차이가 있다. 즉 LDHA 로만 구성된 복합체의 경우 lactate 를 생성하는 활성이 가장 강하고 LDHB 의 수가 많아 질수록 lactate 를 다시 pyruvate 로 전환하는 활성이 강해진다. 그러므로 본 연구에서는 마우스에서 LDHB 를 제거함으로써 세포내의 모든 lactate dehydrogenase 가 LDHA 로 구성되도록 즉, lactate 생성의 활성이 항상 증가되도록 조작하고자 하였다. 본 연구에서는 마우스의 LDHB 게놈을 이용하여 LDHB 유전자 적중용 벡터를 제작하였으며, 이를 이용하여 LDHB 유전자를 마우스의 줄기배아세포 (embryonic stem cell)에서 적중하였다. 다음으로 LDHB 가 적중된 마우스 줄기배아세포를 대리모 마우스의 blastocyste 에 주입하여 chimera 마우스를 생산하였고, 이 chimera 마우스로부터 LDHB 유전자가 적중된 마우스를 얻을 수 있었다. 현재 LDHB 가 적중된 마우스를 Cre 제한효소 발현 마우스와 교배하여 LDHB 유전자가 제거된 마우스를 얻는데 성공하였다.
iii
앞으로 LDHB 유전자가 제거된 마우스는 발암기전 연구를 위한 동물 모델 및 미토콘드리아 활성저하 동물 모델로 유용하게 사용될 것으로 기대된다.
핵심어: 해당작용, 인산화 반응, Lactate dehydrogenase(LDH), 유전자 적중법
iv
차
례
국문요약 ··· i 차례 ···iv 그림 차례 ··· vi 표 차례 ···vii . Ⅰ 서론 ··· 1 A. Cell metabolism··· 1B. Cancer cell metabolism – Warburg effect··· 3
C. Lactate dehydrogenase, LDH ··· 7 D. LDHB conditional knockout ··· 10 . Ⅱ 재료 및 방법··· 13 A. LDH assay ··· 13 1. LDH tissue distribution··· 13
B. Generation of LDHB conditional knockout mice ··· 13
1. Construction of targeting vector··· 13
2. ES cell transfection··· 15
3. ES cell screening ··· 15
4. Injection of ES cells into blastocysts ··· 16
5. Birth and breeding of mosaic mice··· 16
v
.
Ⅲ 결과 ··· 18
A. ES cell screening ··· 18
B. Germ-line transmission (LDHB+/neo-loxP) ··· 20
C. Genotyping of LDHB+/neo-loxP, FLP··· 21
D. Genotyping of LDHB+/loxP ··· 22
E. Genotyping of LDHB knockout mice ··· 23
. Ⅳ 고찰 ··· 24 . Ⅴ 결론 ··· 25 참고문헌 ··· 26 ABSTRACT ··· 31
vi
그림
차례
Fig. 1. Differences between oxidative phosphorylation, anaerobic glycolysos,
and aerobic glycolysis(Warburg effect) ··· 5
Fig. 2. Electrophoretic patterns of LDH isozymes of tissue extracts and plasma of Microtus arvalis Pallas(L) and C57BL/6J mouse(R) ··· 9
Fig.3. Construction of targeting vector ··· 14
Fig. 4. ES cell screening by southern blotting ··· 19
Fig. 5. Genotyping of LDHB+/neo-loxP mice ··· 20
Fig. 6. Genotyping of LDHB+/neo-loxP, FLP mice ··· 21
Fig. 7. Genotyping of LDHB+/ loxP ··· 22
vii
표
차례
Table 1. The relationship between lactate dehydrogenase(LDH) monomer frequency, isozyme generation, lactate production and associated
- 1 -
I. 서 론
A. Cell metabolism
세포는 대사에 필요한 에너지를 생산하기 위하여 다양한 대사 작용을 거친다. 세포 내로 들어온 포도당은 Hexokinase, Phosphofructokinase 와 같은 여러 효소들의 작용을 통해 pyruvate 로 전환되게 된다. 해당작용(glycolysis)이라고 알려진 이 과정은 세포질에서 일어나며 최종 산물 pyruvate 는 미토콘드리아 외막(Mitochondrial outer membrane)에 있는 수송 단백질(transport protein)의 도움을 받아 미토콘드리아 내부로 들어가게 된다. 그 후 pyruvate 는 acetyl-CoA 로 전환되며, 이로써 미토콘드리아 내에서 일어나는 TCA cycle(tricarboxylic acid cycle)로 이어지게 된다. TCA cycle 은 여러 단계로 나뉘며 각 단계는 특정 효소들에 의하여 촉매 된다. 세포는 TCA cycle 후 결과적으로 얻어진 NADH 와 FADH₂를 이용하여 전자를 전자전달계(electron transport chain)로 전달한다. 이 전자 전달계는 미토콘드리아 내막(mitochondrial inner membrane)에 단백질 복합체(protein complex)형태로 끼어 있으며, glycolysis 로 부터 받은 전자를 받아 전달함으로써 산화적 인산화(oxidative phosphorylation)를 시작하게 된다. 이동형 운반자(mobile carrier)인 Ubiquinone(Q)과 cytochrome C(Cyt c)가 미토콘드리아 내막을 따라 전자 전달계의 4 가지 complex 사이로 전자를 운반한다. ComplexⅠ, Ⅲ, Ⅳ는 전자를 받았다가 내주면서 mitochondria matrix 에서 inter-membrane space 로 H⁺(양성자)를 이동시킨다. 이렇게 H⁺가 mitochondrial inner membrane 을- 2 -
가로 지르면서 화학에너지는 proton-motive force 로 변형되며, 이 힘은 화학 삼투(chemiosmosis)동안 ATP synthase(ATP 합성효소)가 ADP 를 인산화(phosphorylation)과정을 거치는 동안 ATP 를 합성할 때 쓰이게 된다. 세포는 이런 방법을 통해 세포 내로 들어온 glucose 한 분자는 glycolysis 를 통하여 2 개의 ATP 를 합성하게 되고, 이에 이어서 산화적 인산화를 통하여 36 개 ATP 를 합성하게 된다. 미토콘드리아를 통하여 생성된 대부분의 ATP 는 산화적 인산화 작용으로 만들어지기 때문에 세포에 공급되는 산소의 양은 매우 중요하다. 그러나 세포는 산소가 없는 상태일 때에도 pyruvate 를 젖산(lactate)으로 전환시켜 NAD+를
재생산함으로써 전자전달계를 이용하지 않고 해당과정만 지속적으로 순환시키면서 ATP 를 합성할 수 있다.
- 3 -
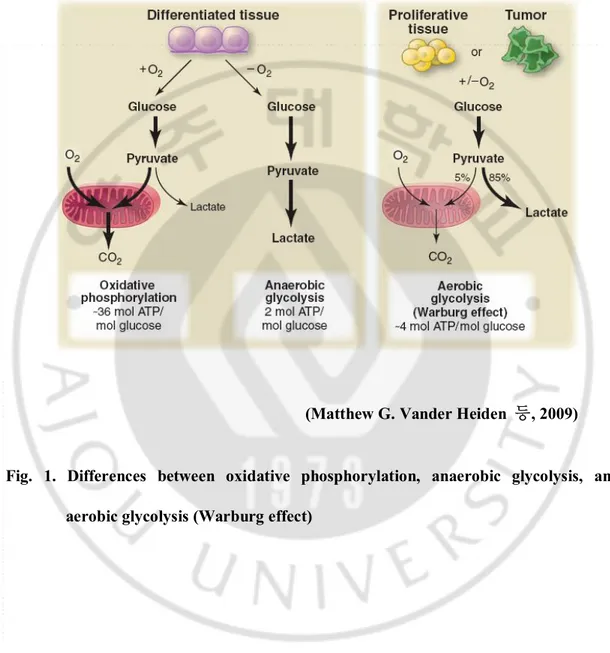
B. Cancer cell metabolism – Warburg effect
에너지를 생산하기 위해 포도당을 pyruvate 로 전환하여 산화적 인산화 반응에 의존하는 일반 정상세포와는 달리, 많은 종류의 암세포들은 산화적 인산화 과정 대신 lactate 로 전환하는 과정, 즉 glycolysis 를 이용하여 에너지를 합성하게 된다(Fig. 1). 정상세포가 산소 공급이 제한된 상태에서 에너지를 생산하는 방법인 anaerobic glycolysis 와는 달리, aerobic glycolysis 는 암세포가 산소 공급이 원활 때에도 lactate 를 합성하고 이 과정에서 얻어진 NAD+를 생산함으로써
전자전달계를 이용하지 않고 ATP 를 합성할 수 있다. 암세포가 정상세포에 비하여 훨씬 많은 양의 포도당을 흡수 하여 aerobic glycolysis 를 이용한 대사를 통해 에너지원을 얻는다는 것은 Otto- Warburg (Warburg O.,1930; Warburg O., 1956)에 의해 밝혀졌고, 이 후 Warburg effect 라는 이론으로 현재까지도 많은 연구들을 통하여 반복적으로 증명되고 있다.
Warburg effect 는 암세포가 tumor microenvironment 에서 생존하고 증식하기 위한 selective advantage 라고도 할 수 있다. 혈관으로부터 멀리 떨어진 곳에서 암 발생과 이것이 급속도로 성장한다면 산소가 제한되어 hypoxic condition 으로 이르기 때문에 미토콘드리아를 이용한 에너지 합성이 제한되며, 이 동시에 hypoxia-inducible transcription factor(HIF)도 안정화된다. 이렇게 HIF-1α protein 이 안정화되면 당 대사 경로에 관여하는 대부분의 효소가 증가 된다고 알려져 있다. pyruvate 를 lactate 로 전환시키는데 촉매작용을 하는 NADH-dependent enzyme 의 한 종류인 lactate dehydrogenase(LDH) 역시 증가 되고(Dang, C.V.과 Semenza, G.L.,1999), Glucose transpoters GLUT-1 과 GLUT-3 역시 증가한 것(Semenza, G.L.등,
- 4 -
2001)으로 보아 빠른 속도로 증식하기 위한 암세포의 selective advantage 인 것이다.
- 5 -
(Matthew G. Vander Heiden 등, 2009)
Fig. 1. Differences between oxidative phosphorylation, anaerobic glycolysis, and aerobic glycolysis (Warburg effect)
- 6 - 암세포는 포도당 한 분자당 합성되는 ATP 생성 효율이 낮은 방법인 glycolysis 로 에너지를 얻기 때문에 정상세포에 비하여 훨씬 많은 양의 포도당을 흡수하며, 이 포도당은 해당작용을 통하여 생성된 pyruvate 가 미토콘드리아에서 대사되지 못하고 대부분 lactate 로 변환되며 이 과정에서 NAD+를 생산하여 지속적으로 해당작용이 작동될 수 있게 된다. 또한 암세포에서는 glycolysis 를 활성화시키기 위하여 관련된 유전자들과 lactate dehydrogenase 와 같은 lactate 생성 관련 유전자의 발현이 크게 증가되어 있다(George A.Brooks 등, 1999). 이 뿐만 아니라 암세포에서는 여러 가지의 tumor suppressor gene 과 oncogene 이 다양한 signaling pathway 에 관여하여 포도당 대사뿐만 아니라 amino acid synthesis, glutaminolysis, pentose phosphate shunt 와 같은 대사 경로의 활성을 직접적으로 조절한다는 점에서 일반 정상세포와 크게 차이를 가진다(Matthew G. Vander Heiden 등, 2009).
아쉽게도 현재까지는 이러한 당대사의 변형이 어떠한 경로로 발암 기작에 관여하는지에 대하여 명확히 밝혀지지 않았으며, 또한 당대사 변형이 정상세포의 발암을 유도하는지의 여부에 대하여도 알려진 바가 없다. 이러한 관점에서 최근 변형 당대사와 발암기전에 관한 흥미로운 연구결과들이 발표되고 있다. 최근 한 보고에서 전이성을 가진 암세포에서 특이적으로 발현되는 pyruvate kinase(PK)의 M2 isozyme 을 정상세포의 M1 isozyme 으로 치환한 결과 암세포가 정상세포와 된다는 것을 밝혔다 Christofk HR 등, 2008). 암세포에서는 에너지의 생성과 세포 증식에 필요한 세포구성 물질의 생산을 위한 glycolysis 관련 효소들의 활성이 크게 증진되어 있다. 그 중에서도 암세포는 정상세포와 비교하여 훨씬 많은 양의 lactate 를 생성한다고 알려져 있다.
- 7 -
C. Lactate dehydrogenase, LDH
암세포들은 에너지 합성을 위한 기작을 통하여 lactate 를 생성하게 되는데, 이렇게 계속되는 증식으로 인하여 lactate 가 세포 외 기질 (extracellular matrix)에 쌓이게 되고 결국 산성화를 초래한다. 암세포가 낮은 pH 에 노출되게 되면 침투성(invasive phenotype)과 전이성(metastatic phenotype)을 보인다는 보고가 있다(Rozhin J 등,1994 ; Martinez-Zaguilan R 등, 1996; Zabel DD 등, 1996).
본 연구에서는 암세포의 lactate 생성에 대하여 흥미를 가지게 되었고, lactate 생성을 담당하는 효소인 Lactate dehydrogenase 에 주목하게 되었다.
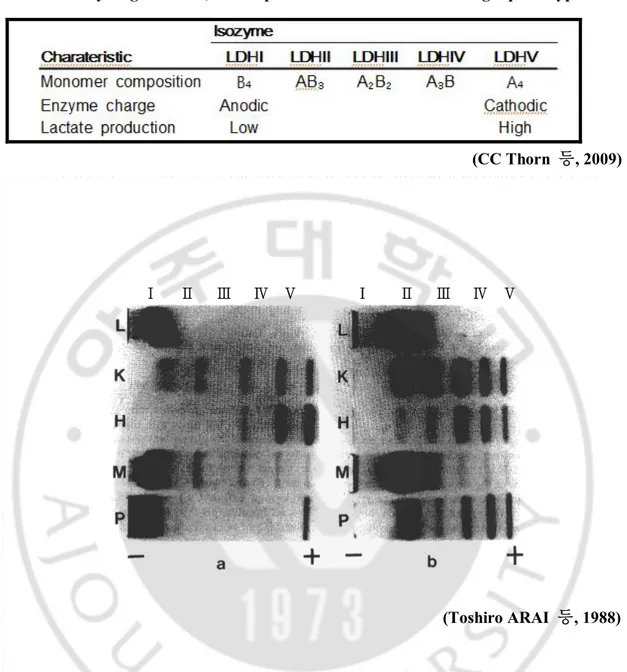
LDH 는 A,B 두 단위체로 이루어진 사량 복합체를 이루어 존재하며 A,B 단위체의 조성에 따라 LDH-Ⅰ,LDH-Ⅱ,LDH-Ⅲ,LDH-Ⅳ 그리고 LDH-Ⅴ의 5 가지 isozyme 형태로 존재한다. LDHA, LDHB 는 분자량은 같지만 각각 다른 PI 값을 가진다(Clement L. Markert, 1963; R.D.Ellender 등, 1977). 또한 각각의 효소는 조직마다 다른 비율로 분포한다고 알려져 있다(Fig. 2)(George A. Brooks 등, 1999).
또한 LDH 와 암의 관련성에 관한 보고가 꾸준히 발표되고 있다. 한 보고에서 암 환자들을 대상으로 혈청을 추출하여 LDH 를 확인한 결과 LDH 발현량이 높다는 사실을 알게 되었으며, 이러한 LDH 발현량은 전이성을 보여주는 척도가 되어 환자들의 예후와 연관이 있다고 밝혔다(Argiris A 와 Murren JR, 2001; Brizel DM 등, 2001; Kemeny N 등, 1989).
그 중에서도 LDHA 가 암세포의 대사 경로에서 중요한 인자일 것이라고 최근 보고들에서 주장되고 있다. LDHA subunit 으로만 이루어진 LDH-Ⅴ isozyme 이
- 8 - 대부분의 암세포에서 높은 발현량을 보이며, 반면에 LDHB subunit 으로만 이루어진 LDH-Ⅰ은 일반 조직과 비교했을 때 적은 발현량을 보인다는 보고가 있었다(Koukourakis MI 등, 2003). 또한 LDHA 의 발현이 증가되어 있는 몇 가지의 유방암세포에서 LDHA 의 발현을 억제시켰을 때, 세포의 대사 경로가 변화하였다고 보고되었다. 즉 LDHA 가 제한된 상태일 때에는 세포의 산화적 인산화(OXPHOS)가 자극을 받게 되어 세포가 lactate 를 합성하는 방법이 아닌 OXPHOS-based metabolism 으로 다시 전환되는 양상을 보인다는 것이다(Valeria R. Fantin 등, 2006). 또한 유방암 세포 중에서 LDHA 의 발현이 상대적으로 적은 세포들은 LDHA activity 가 높은 세포들보다 미토콘드리아 막 전위(mitochondrial membrane potential)이 증가 되어 있으므로 LDHA 가 암세포의 대사경로에서 유지 및 성장에 관련된 중요 인자일 것이라고 보고되었다(Valeria R. Fantin 등, 2006). LDH 는 암세포의 대사뿐만 아니라 종양 조직의 margin phenotype 과 연관이 있다고 알려져 있다(C C Thorn 등, 2009). 이 역시도 암 환자에서 LDH level 에 따른 prognosis 차이와도 연관이 있다는 보고가 있었다(Brizel DM 등, 2001).
- 9 -
Table. 1. The relationship between lactate dehydrogenase(LDH) monomer frequency, isozyme generation, lactate production and associated margin phenotype
(CC Thorn 등, 2009)
(Toshiro ARAI 등, 1988)
Fig. 2. Electrophoretic patterns of LDH isozymes of tissue extracts and plasma of
Microtus arvalis Pallas(a) and C57BL/6J mouse(b), L:liver, K:kidney, H:heart,
M:skeletal muscle, P:plasma
- 10 -
D. LDH-B Conditional Knockout
그러나 현재까지의 연구는 in vitro 상에서 진행되었기 때문에 in vivo 실험이 우선적으로 이루어져야만 했다. 세포를 이용한 in vitro 실험은 실제 생체 내 조건과는 많은 부분에서 차이가 있기 때문에 정확한 연구 수행을 위해서는 동물 모델 설계․제작은 필수적이라 생각되었다. 본 연구에서는 증진된 해당작용이 발암기전에 미치는 영향을 연구하기 위하여 pyruvate 로부터 lactate 를 생산하는 lactate dehydrogenase 의 활성을 증진시킨 유전자 조작 마우스를 제작하고자 하였다. LDHA 로만 구성된 복합체의 경우 lactate 를 생성하는 활성이 가장 강하고 LDHB 의 수가 많아 질수록 lactate 를 다시 pyruvate 로 전환하는 활성이 강해지므로 본 연구에서는 마우스에서 LDHB 를 제거함으로써 세포내의 모든 lactate dehydrogenase 가 LDHA 로 구성되도록 즉, lactate 생성의 활성이 항상 증가되도록 조작하고자 하였다. LDHB 유전자를 유전자 적중법(gene targeting)으로 제거하였으며, 또한 조건적 유전자 삭제 (conditional knockout)방법을 이용하여 조직 특이적으로 LDHB 가 많이 함유되어 있는 심장에 유전자 삭제 마우스를 제작하게 되었다. 마우스의 유전자를 조작하여 정상 마우스에서 glycolysis 관련 효소인 LDHB 를 억제하여 결론적으로 LDHA 의 발현만 유지시킴으로써 당대사 변형을 마우스 내에서 유발하고, 이것이 정상세포를 암세포화 되는 것을 기대해 본다. 유전자 삭제 마우스를 만드는 방법은 조건적 유전자 삭제 방법으로 주로 사용되는 유전자 적중법중 하나이다. 이 방법은 특정 유전자가 생체의 모든 부분에서 제거되는 기존의 유전자 삭제 방법과는 달리 계획에 따라 특정한 조직 또는 기관에서 특정 유전자만을 제거하는 방법이다(Aoki K 와 Taketo mm, 2008).- 11 -
만약 제거를 원하는 특정 유전자가 embryo 발생에 중요한 인자라면 기존의 유전자 삭제 방법으로는 마우스를 만들 수 없다 (Chan Bae Park 등, 2007). 그러나 조건적 유전자 삭제 방법으로 마우스를 제작한다면 특정 기관 또는 조직에서만 특정 유전자가 제거되기 때문에 마우스를 얻을 수 있게 된다.
조건적 유전자 삭제 마우스는 여러 과정을 거침으로써 탄생한다. (Fig.3) 마우스의 제작은 targeting vector 의 설계로부터 시작된다(Pentao Liu 등, 2003). 이 targeting vector 는 host cell 에 homologous recombination 방법으로 삽입될 수 있도록 설계하며(Liu P 등, 2003), 또한 targeting vector 가 들어간 세포를 선택할 수 있는 positive selection marker 와 negative selection marker 를 포함한다. 조건적 유전자 삭제 마우스 방법의 큰 특징은 LoxP site 를 가지는 것인데, 이 site 는 Cre 라고 하는 제한효소(recombinase)가 이곳을 인식하여 삭제된다(Kaartinen V 와 Nagy A, 2001). 즉 Cre 가 존재 하지 않는다면 LoxP 는 제거 되지 않고, Cre 가 있다면 LoxP site 를 인식하여 제거하기 때문에 안쪽에 위치하는 exon 들의 발현이 일어나지 않는다. 그렇기 때문에 특정 어느 시점부터 유전자 삭제가 가능하다는 것이 conditional knockout mice 의 큰 특징이자 장점이다(Xiangdong Xu 와 Xiang-Dong Fu, 2005; Brian Sauer, 1998).
조건적 유전자 삭제 마우스는 기존의 유전자 삭제 마우스와 비교 했을 때 긴 시간이 필요하지만 생체 내 여러 기관이나 조직에서 특정 유전자의 기능을 연구할 수 있다는 이점이 있다.
이렇게 하여 태어난 마우스를 이용하여 마우스들에서의 glycolysis 를 측정하고, 변형된 glycolysis 가 발암을 유도하는 지를 연구할 계획이다. 또 그러하다면
- 12 -
발암을 유도하는 정확한 기작을 밝혀내고, 변형된 glycolysis 가 암세포의 전이성에 미치는 영향에 대하여 연구하게 될 것이다.
앞으로 생체 내 연구를 통해 생리현상에 근접한 결과를 얻을 수 있으리라 생각하고 발암기전 연구에 보다 더 정밀한 연구 수행이 가능할 것이라 생각한다.
- 13 -
Ⅱ
. 재료 및 방법
A. LDH assay
1. LDH isoform analysis
정상 mouse 에서 총 10 가지의 tissue 를 적출하여 액체질소와 함께 mortar 를 이용해 분쇄한다. protein extration buffer (50mM Tris-HCL buffer pH7.4, 1mM EDTA, 5mM 2-mercaptoethanol, proteinase inhibitor) 1ml 넣어준 후 Homogenizer 를 이용하여 분쇄한 뒤 12,000 rpm 4℃에서 20 분간 원심분리 하여 상등액만 분리한다. 상등액을 1% agarose gel 에 loading 한 후 80V 에서 1 시간 running 한다. Gel 을 LDH staining solution(1M Tris, tetrazolium-blue, phenazine-methosulphate, NAD)에 담구어 37℃에서 30 분간 staining 시킨 뒤 acetic acid 로 fixing 한다.
B. Generation of LDHB conditional knockout mice
1. Construction of targeting vector
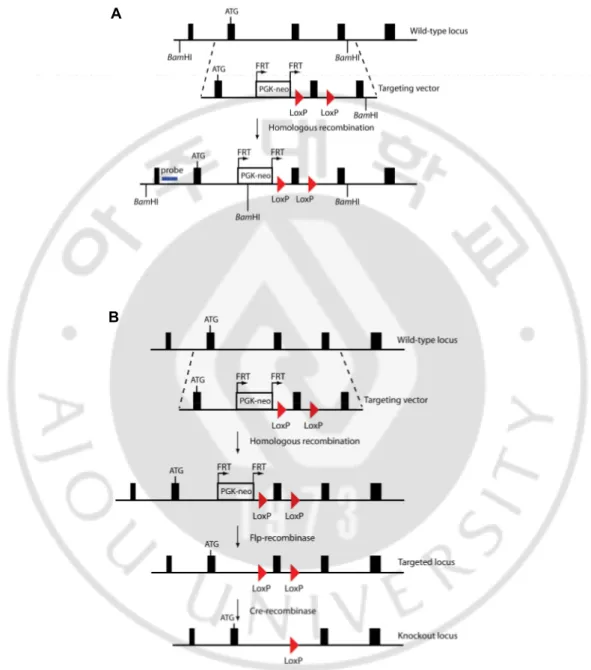
Conditional knockout mice 를 제작하는 과정 중 첫 번째 단계인 targeting vector design 은 매우 중요하다. 우선적으로 고려해야 하는 것은 targeting vector 가 host cell 에 homologous recombination 방법으로 mutation 될 수 있도록 해야 하며, 또한 선택을 위한 positive selection marker 와 negative selection marker 를 포함해야 한다(Fig. 3A). positive selection marker 인 neo-cassette 는 FRT 로 flanking 되어 있어서 나중에 Flp-recombinase 에 의해 제거되어야 한다. 제거를 원하는 특정 유전자의 위치는 LoxP site 의 사이가 되어야 하며 이 LoxP site 는 Cre 라고 하는
- 14 -
recombinase 가 인식하여 제거되므로(Fig. 3B) targeting vector 를 설계할 때에 고려해야 한다.
Fig. 3. Construction of targeting vector A
- 15 -
2. ES cell transfection
다양한 transfection 방법 중에서 ES cell 을 host cell 로 transfection 을 할 때에는 electroporation 을 주로 이용한다. Electroporation 을 이용해 trasnfection 한 이후에 선택배지에서 자란 ES cell 을 pipette 으로 집어내어 각 well 에서 독립적으로 culture 한다.
3. ES cell screening
a. Genomic DNA isolation by phenol-chloroform extraction
Transfection 된 ES cell(24well plate from 마크로젠)에 DNA lysis buffer( + proteinase K) 로 55℃에서 5-6 시간 동안 lysis 한다. Phenol-chloroform extraction 방법으로 ES cell 의 genomic DNA 를 추출한다.
b. Southern blot analysis
Phenol-chloroform extraction 을 통하여 얻어진 genomic DNA 를 BamH1(NEB)으로 overnight enzyme digestion 한다. 0.6% agarose gel 을 이용하여 electrophoresis 한 뒤 transfer 한다. transfer 가 끝난 membrane 은 2000J 로 cross-link(UV STRATALINKER® 1800)시킨다. LDHB N probe 를 사용하였으며 α-P32를 이용하여
- 16 -
4. Injection of ES cells into blastocysts
ES cell screening 을 통해 targeting vector 가 들어간 positive ES cell 을 선별하여 C57/BL6 mouse 의 blastocyst 에 microinjection 방법으로 injection 한다.
5. Birth and breeding of mosaic mice
전 단계에서 시행된 microinjection 이 후 태어난 chimera mouse 를 germ-line transmission 된 mouse 를 얻기 위하여 wild-type mouse 와 mating 시킨다. 그 후 태어난 mouse 들의 tail 을 tail lysis buffer(0.5% SDS, 50mM Tris, 2.5mM EDTA, 0.1M NaCl)와 ProteinaseK 로 55℃에서 lysis 시킨 후 phenol-chloroform extraction 방법으로 genomic DNA 를 추출하였다. 이 gDNA 를 LDHB_geno_35 와 LDHB_geno_33 primer 를 이용하여 genotyping 하였다. 이 중 germ line transmission 된 LDHB+neo/loxP 인 것을 선별하여 Flp mouse 와 mating 시켰다(Lois C 등, 2002). 이 사이에서 태어난 mouse 들 역시 LDHB_geno_35 와 LDHB_geno_33 primer 를 이용하여 LDHB genotyping 을 거치고 Flp primer 를 이용하여 genotyping 한다. 두 가지 모두 positive 인 mouse(LDHB+neo/loxP, FLP)를 선별하여 wild-type 과 mating 시키면 selection marker 인 neomycin 이 제거 된 mouse(LDHB+/loxP)가 탄생하는데 Flp 가 제거가 되었는지 확인하기 위하여 LDHB genotyping 을 거친 후 Flp genotyping 을 이용하여 확인한다(Mario R. Capecchi, 2005). 또한 마지막으로 LDHB 와 Flp 모두 positive 인 mouse 를 Cre mouse 와 mating 시키면 knockout mouse(LDHB+/-,Cre)가 태어난다.
- 17 -
6. Confirmation of LDHB knockout mice
마지막으로 Cre mouse 와 mating 으로 얻어진 knockout mouse 들은 PCR genotyping 과 southern blot analysis 를 통해 확인한다. Genotyping 은 LDHB , Flp, 그리고 Cre 에 관하여 진행하였으며 southern blot analysis 는 BamHⅠ으로 digestion 하여 LDHB N probe 로 labeling 하였다.
- 18 -
Ⅲ
. 결 과
A. ES cell screening
Southern blot analysis 를 통해 targeting vector 가 들어간 positive ES cell 은 genomic DNA 를 BamHⅠ으로 digestion 하여 LDHB N probe 를 이용해 선별하였다. WT allele 은 12.2kb , targeting vector 는 7.5kb 에서 각각 확인 할 수 있었다(Fig. 4A). Second confirmation 에서는 BamHⅠdigestion 수행하였으며 BamHⅠ은 LDHB N probe 를 이용하여 screening 하여 positive clone 을 얻었다(Fig. 4B).
- 19 -
Fig. 4. ES cell screening by southern blotting (A)Analysis of control[C] and
targeted[T]ES cells. Digestion of ES cell DNA with BamHⅠ generates a novel fragment of kb in LDHB+/neo-loxP clones. (B) Second confirmation of control and targeted ES cells. Digestion of ES cell DNA with BamHⅠ(B). Southern blot analysis of control and targeted ES cells with LDHB N probe(B).
C T - 12.2 kb - 7.5 kb - 7.5 kb - 12.2 kb ES cell A B ES cell C T T T T T T T
- 20 -
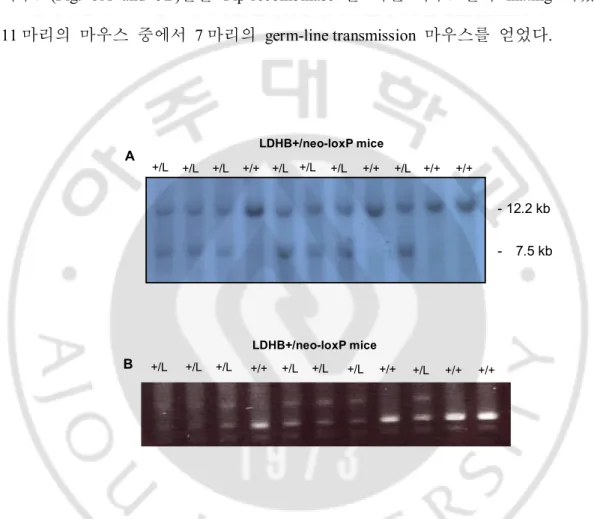
B. Germ-line transmission (LDHB+/neo-loxP)
ES cell screening 후 58 번 clone 을 injection 하여 chimera mouse 가 탄생하였다. Chimera 와 wild-type 을 mating 하여 얻어진 mouse 를 southern blot analysis 와 PCR 을 이용해 genotyping 하였다. Genotyping 을 거쳐 선별된 Germ-line 마우스(Fig. 5A and 5B)들을 Flp-recombinase 를 지닌 마우스들과 mating 시켰다. 11 마리의 마우스 중에서 7 마리의 germ-line transmission 마우스를 얻었다.
Fig. 5. Genotyping of LDHB+/neo-loxP mice (A and B) Analysis of wild-type(+/+) and
LDHB+/neo-loxP mice(+/L) with chimera mice. Genotyping of WT mice by southern blot analysis (A) and PCR(B).
LDHB+/neo-loxP mice A B +/L +/L +/L +/+ +/L +/L +/L +/+ +/L +/+ +/+ +/L +/L +/L +/+ +/L +/L +/L +/+ +/L +/+ +/+ LDHB+/neo-loxP mice - 12.2 kb - 7.5 kb
- 21 -
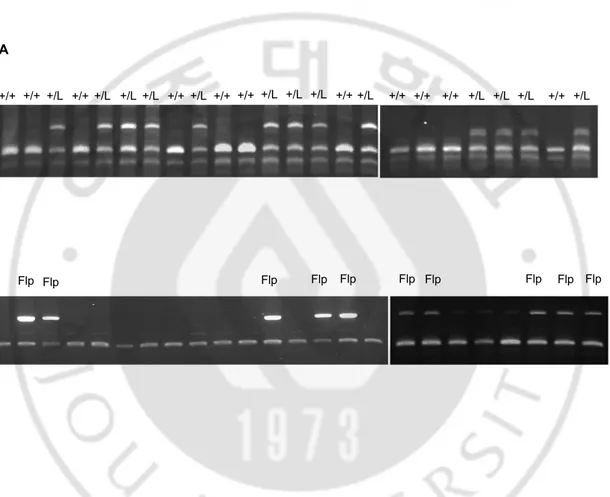
C. Genotyping of LDHB+/neo-loxP, FLP
Germ-line transmission 된 마우스와 Flp 를 지닌 마우스의 교배를 통해 태어난 마우스 중에서 Flp 를 포함하는 mouse (LDHB+/neo-loxP, FLP)를 LDHB primer 와 Flp primer 를 이용하여 PCR 을 통해 선별하였다. (Fig. 6A and 6B)
Fig. 6. Genotyping of LDHB+/neo-loxP, FLP mice (A) Analysis of wild-type(+/+) and
LDHB+/neo-loxP mice(+/L) with LDHB primer. (B) Genotyping of LDHB+/neo-loxP, FLP mice with Flp primer
A B +/L +/L +/L +/L +/L +/L +/L +/L +/L +/L +/L +/L +/L +/+ +/+ Flp +/+ +/+ +/+ +/+ +/+ +/+ +/+ +/+ +/+ Flp Flp Flp Flp Flp Flp Flp Flp Flp
- 22 -
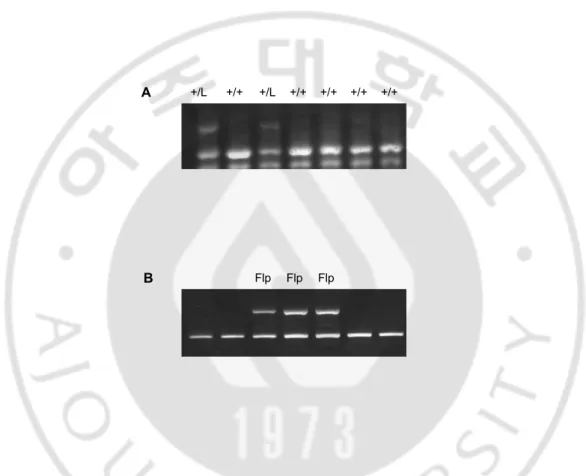
D. Genotyping of LDHB+/loxP mice
결과(C)에서 FLP 를 가지고 있는 마우스를 선별한 뒤 wild type 마우스와 mating 시켰다. FRT site 에 flanking 되어 있던 positive selection marker 인 neo-cassette 가 Fig. 7 과 같이 Flp 에 의해 제거 된 마우스를 얻었다.
Fig. 7. Genotyping of LDHB+/ loxP mice (A) Analysis of wild-type(+/+) and
LDHB+/neo-loxP mice(+/L) with LDHB primer. (B) Genotyping of LDHB+/neo-LDHB+/neo-loxP, FLP mice with Flp primer. A B +/L +/L Flp Flp Flp +/+ +/+ +/+ +/+ +/+
- 23 -
E. Genotyping of LDHB knockout mice(LDHB+/loxP mice, Cre)
(D)와 마찬가지로 결과(C)에서 FLP 를 가지고 있는 마우스를 선별한 뒤 wild-type 마우스가 아닌 Cre-recombinase 를 가진 마우스를 mating 시킨다. 이 사이에서 태어난 마우스 중에서 Cre 를 가지고 있는 마우스를 선별하여 결과적으로 LDHB+/- 마우스를 얻었다.
Figure 8. Genotyping of LDHB+/ loxP, Cre mice (A) Analysis of wild-type(+/+) and
LDHB+/neo-loxP mice(+/L) with LDHB primer. (B) Genotyping of LDHB+/neo-loxP, FLP mice with Flp primer. (C) Genotyping of Cre with Cre primer
A
B
C
+/L +/L +/L +/L +/L +/L
Cre Cre Cre Cre Cre Cre
Flp Flp Flp Flp
- 24 -
Ⅳ
. 고 찰
현재까지 암세포의 대사경로에 대하여 수 많이 연구되어 왔으나 정확한 기전에 대하여 명확히 규명되지 못하고 있는 현실이다. 가장 먼저 암 연구에 있어서 생체 내 조건과 동일한 조건으로 실험해야 한다는 것이 본연구진의 생각이었으며, 이를 위해 동물모델을 제작하였다. 앞서 기술한 바와 같이 암세포에 있어서 lactate 합성은 중요한 역할을 하는 것이 분명하다. 또한 이전 보고에서 보듯, 암 환자를 대상으로 이루어진 연구 역시 환자의 serum 에서 LDH level 이 예후 정도를 예측할 수 있는 척도라 할만큼 LDH 가 암세포의 대사에서 매우 중요한 인자라 할 수 있겠다. 정상 마우스에서 LDHB 를 knockout 시킴으로써 마우스의 phenotype 에 대한 연구를 계획 중이다. 우선적으로 정상 마우스와 비교하였을 때 에너지 생산에 관한 차이를 연구 하기 위해 glycolysis 를 측정할 것이고, 변형된 glycolysis 가 발암을 유도하는 지를 연구할 계획이다. 또 그러하다면 발암을 유도하는 정확한 기작을 밝혀내고, 변형된 glycolysis 가 암세포의 전이성에 미치는 영향에 대하여 연구하게 될 것이다. 본 연구를 통해 생체 내 연구를 통해 생리현상에 근접한 결과를 얻을 수 있으리라 생각하고 암세포 내에서 LDHB 를 삭제함으로써 cancer cell metabolism research 와 더불어 LDH 의 기능연구에 보다 더 정밀한 연구 수행이 가능할 것이라 생각한다.- 25 -
Ⅴ
. 결 론
본 연구에서는 마우스에서 LDHB 를 제거함으로써 세포내의 모든 lactate dehydrogenase 가 LDHA 로 구성되도록 즉, lactate dehydrogenase 의 활성이 항상 증가되도록 조작하고자 하였다.
본 연구에서는 마우스의 LDHB 게놈을 이용하여 LDHB 유전자 적중용 벡터를 제작하였으며, 이를 이용하여 LDHB 유전자를 마우스의 줄기배아세포 (embryonic stem cell)에서 적중하였다. 다음으로 LDHB 가 적중된 마우스 줄기배아세포를 대리모 마우스의 blastocyst 에 주입하여 chimera 마우스를 생산하였고, 이 chimera 마우스로부터 LDHB+/- 마우스를 얻었다.
현재 LDHB+/- 마우스가 태어나 homozygous 마우스를 만들기 위하여 교배 중이며, LDHB 가 적중된 마우스와 heart-specific 하게 Cre recombinase 가 발현되는 마우스를 교배하여 심장에서 LDHB 가 제거된 마우스를 제작하고 있다.
앞으로 LDHB knockout 마우스는 발암기전 연구를 위한 동물 모델 및 미토콘드리아 활성저하 동물 모델로 유용하게 사용될 것으로 기대된다.
- 26 -
참고
문헌
1. Aoki K, Taketo MM : Tissue-specific transgenic, conditional knockout and knock-in mice of genes in the canonical Wnt signaling pathway. Methods Mol Biol 468:307-331, 2008 2. Argiris A, Murren JR : Staging and clinical prognostic factors for small-cell lung cancer.
Cancer J 7:437-447, 2001
3. Brian Sauer : Inducible Gene Targeting in Mice Using the Cre/loxP system. Methods 14: 381-392, 1998
4. Brizel DM, Schroeder T, Scher RL, Walenta S, Clough RW, Dewhirst MW, Mueller Klieser W : Elevated tumor lactate concenturations predict for an increased risk of metastases in head-and-neck cancer. Int J Radiat Oncol Biol Phys 51:349-353, 2001 5. Thorn C C, Freeman T C, Scott N, Guillou P J and Jayne D G: Laser microdissection
expression profiling of marginal edges of colorectal tumours reveals evidence of increased lactate metabolism in the aggressive phenotype. Gut 58: 404-412, 2009
6. Chan Bae Park, Jorge Asin-Cayuela, Yolanda Camara, et al.: MTERF3 Is a Negative Regulator of Mammalian mtDNA Transcription. Cell 130: 273-285, 2007
7. Christofk HR, Vander Heiden MG, Harris MH, Ramanathan A, Gerszten RE, Wei R, Fleming MD, Schreiber SL, Cantley LC : The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth. Nature 452: 230-233, 2008
- 27 -
8. Clement L. Markert : Lactate Dehydrogenase Isozymes. Dissociation and Recombination of Subunits. SCIENCE 40:1329-1330, 1963
9.Dang, C.V., and Semenza, G. L. : Oncogenic alterations of metabolism. Trends Biochem. Sci. 24: 68-72,1999
10. Gatenby RA, and Gillies RJ : Why do cancers have aerobic glycolysis? Nature Rev.
Cancer 4: 891-899, 2004
11. George A.Brooks, Gerve Dubouchaud, Marcia Brown, James P. Sicurello, and C.Eric Butz : Role of mitochondrial lactate dehydrogenase and lactate oxidation in the intracellular lactate shuttle.PNAS 96: 1129-1134, 1999
12. Kaartinen V, Nagy A : Removal of the floxed neo gene from a conditional knockout allele by the adenoviral Cre recombinase in vivo. Dev. Gen. 31: 126-129, 2001
13. Kemeny N, Niedzwieckd D, Shurgot B, Oderman P : Prognostic variables in patients with hepatic metastases from colorectal cancer. Importance of medical assessment of liver involvement. Cancer 63: 742-747, 1989
14. Koukourakis MI, Giatromanolaki A, Sivridis E : Lactate dehydrogenase isoenzymes 1 and 5: differential expression by neoplastic and stromal cells in non-small cell lung cancer and other epitherial malignant tumors. Tumour Biol. 24:199-202, 2003
15. Liu P, Jenkins N, Copeland N : A highly efficient recombineering-based method for generating conditional knockout mutations. Genome Res. 13: 476-484, 2003
- 28 -
16. Lois C, et al.: Germline transmission and tissue-specific expression of transgenic delivered by lentiviral vectors. SCIENCE 295: 868-872, 2002
17. Majumder PK, Febbo PG, Bikoff R, Berger R, Xue Q, McMahon LM, Manola J, Brugarolas J, McDonnell TJ, Golub TR, Loda M, Lane HA, Sellers WR.: mTOR inhibition reverses Akt-dependent prostate intraepithelial neoplasia through regulation of apoptotic and HIF-1-dependent pathways. Nature Med. 10:594-601, 2004
18. Mario R. Capecchi : Gene targeting in mice. Functional analysis of the mammalian genome for the twenty-first century. Nature Rev. 6:507-512, 2005
19.Martinez-Zaguilan R, Seftor EA, Seftor RE, Chu YW, Gillies RJ, Hendrix MJ : Acidic pH enhances the invasive behavior of human melanoma cells. Clin Exp Metastasis 14:17-186
20. Matthew G. Vander Heiden, Lewis C. Cantley, Craig B. Thompson : Understanding the Warburg Effect, The Metabolic Requirements of Cell Proliferation. SCIENCE 324: 1029-1033, 2009
21. Michael I. Koukourakis, Emmanuel Kontomanolis, Alexandra Giatromanolaki, Efthimios Sivridis, Vassilios Liberis : Serum and Tissue LDH levels in Patients with Breast/Gynaecological Cancer and Benign Diseases. Gynecol Obstet Invest 67: 162-168, 2009
22. Peggy P. Hsu, and David M. Sabatini : Cancer cell metabolism, Warburg and Beyond.
- 29 -
23. Pentao Liu, Nancy A.Jenkins, and Neal G. Copeland : A Highly Efficient Recombineering-Based Method for Generating Conditional Knockout Mutations. Genome
research 13: 476-484, 2003
24. R.D. Ellender, B.L.Middlebrooks and P.M.Toom : Simple isoelectric focusing method to quantitate LDH isoenzymes in cultured cells for cell characterization. TCA manual 3:593-596, 1977
25. Rozhin J, Sameni M, Ziegler G, Sloane BF : Pericellular pH affects distribution and secretion of cathesin B in malignant cells. Cancer Res. 54: 6517-6525, 1994
26. Russell G. Jones,and Craig B. Thompson : Tumor suppressors and cell metabolism. A recipe for cancer growth. Genes Dev 23:537-548, 2009
27. Sekine, N., Cirulli, V., et al.: Low lactate dehydrogenase and high mitochondrial glycerol phosphate dehydrogenase in pancreatic beta cells. Potential role in nutrient sensing.
J.Biol.Chem. 269:4895-4902, 1994
28. Toshiro ARAI, Masashi SASAKI, Juichi TANAKA, and Yoshio OKI : Characteristics of Lactate Dehydrogenase Isozymes in Tissue Extracts of Herbivorous Vole, Microtus arvalis Pallas. Jpn. J. Vet. Sci. 50:287-290, 1988
29. Valeria R.Fantin, Julie St-Pierre, and Philip Leder : Attenuation of LDH-A expression uncovers a link between glycolysis, mitochondrial physiology, and tumor maintenance.
- 30 -
30. V Fritz , L Fajas : Metabolism and proliferation share common regulatory pathways in cancer cells. Oncogene 29:4369-4377, 2010
31. Warburg O. : Metabolism of Tumors. Arnold Constable: London, 1930 32. Warburg O. : On the origin of cancer cells. SCIENCE 123:309-314,1956
33. Warburg O. : On respiratory impairment in cancer cells. SCIENCE 124:269-270, 1956 34. Xiangdong Xu, Xiang-Dong Fu : Conditional knockout mice to study alternative splicing
in vivo.Methods 37: 387-392, 2005
35. Zabel DD, Feng JJ, Scheuenstuhl H, Hunt TK, Hussain MZ : Lactate stimulation of macrophage-derived angiogenic activity is associated with inhibition of poly(ADP-ribose) synthesis. Lab Invest 74: 644-649, 1996
- 31 -
-ABSTRACT-
Generation of Conditional LDHB Knockout Mice
So hyun Kim
Department of medical science The Graduated Scool, Ajou University (Supervised by Assistant Professor Chan Bae Park)
In general, differentiated cells produce most of the ATP to growth from glucose through metabolism. Normal cells produce 2 ATP by glycolysis in the cytoplasm and convert to 2 pyruvates. Next, this pyruvate produces about 36 ATP by oxidative phosphorylation in the mitochondria.
On the other hand, many metastatic cancer cells have altered glycolytic(glucose) metabolism. The lactate released by this altered glycolytic metabolism exported out of cancer cells. Because the tumor environment is highly hypoxic so that cancer cells produce of ATP by glycolysis. Cancer cells uptake glucose much more than normal cells. Because, they use inefficient glycolysis for producing ATP. In cancer cell, expression of gene associated with glycolysis and enzyme about lactate production are increased for activating glycolysis.
- 32 -
Recently, Many report presented about that discovered altered glucose metabolism in cancer cells is not passive alteration by change in environment, but important role in normal cells.
Lactate dehydrogenase(LDH) is a major enzyme involved in conversion of lactate in glycolysis. There are five LDH isozymes as a result of the five differenct combination that are produced by two subunit(A and B gene). Also, they have different enzymatic activity. The LDH-1 that consist of 4 LDHA complex is most active in LDH activity. But LDH activity is inverse amounts of LDHB. So we want make the condition of increased LDHA activity without LDHB in the cell.
In this study, we designed a targeting vector about LDHB gene used by LDHB genome(mouse). And then, this targeting vector insert into the ES cell. Then targeted ES cell inject into blastocyst. As a result, we have got the chimera, LDHB targeted mouse. And now, we have gained the LDHB knockout mouse that generated by mating LDHB targeted mouse and Cre-expressed mouse.
We expect that LDHB knockout mouse is used to animal model of research for cancer research and mitochondrial function that involved in cancer cell metabolism.
Key words : Glycolysis , Oxidative phosphorylation , Lactate dehydrogenase , Conditional

![Fig. 4. ES cell screening by southern blotting (A)Analysis of control[C] and](https://thumb-ap.123doks.com/thumbv2/123dokinfo/4689577.3733/30.892.150.754.252.858/fig-es-cell-screening-southern-blotting-analysis-control.webp)