의학 석사학위 논문
소뇌발생과정에서 r
eel
i
n수용체인
VLDLR 및 ApoER2의 발현 조사
아 주 대 학 교
대 학 원
의 학 과
김 유 미
소뇌발생과정에서 r
eel
i
n수용체인
VLDLR 및 ApoER2의 발현 조사
지도교수
이 영 돈
이 논문을 의학 석사학위 논문으로 제출함.
2006년
2월
아 주 대 학 교
대 학 원
의 학 과
김 유 미
김유미의 의학 석사학위 논문을 인준함.
심사위원장
이
영
돈
인
심 사 위 원
서
해
영
인
심 사 위 원
김
성
환
인
아 주 대 학 교
대 학 원
2005년 12월 22일
국문요약
-소뇌발생과정에서 r
eel
i
n 수용체인 VLDLR 및 ApoER2의
발현 조사
세포외 (extracellular)단백질 reelin은 뇌의 발생과정에서 대뇌의 피질과 해마 그리고 소뇌 등에서 층을 형성하고 신경세포의 이동을 조절하는 중요한 역 할을 한다.이 과정은 reelin이 lipoprotein receptor 계열에 속하는 very low density lipoprotein receptor (VLDLR) 또는 apolipoprotein E receptor 2 (ApoER2)에 결합하여 이들의 cytoplasmic domain에 결합하고 있는 disabled1(dab1)의 tyrosine에 인산화를 유도함으로써 일어나는 과정으로 알려져 있다. Reelin,dab1또는 VLDLR와 ApoER2두 유전자가 모두 결여된 마우스에서 나타 나는 대뇌 피질층은 정상과 다르게 역위되어 있고 소뇌의 경우 크기가 작고 foliation이 적게 나타나며 특히 조롱박세포 (Purkinjecell)가 군집하여 과립층의 깊은 곳에 전위되어 나타나는 것으로 관찰된다. 본 연구에서는 마우스와 래트를 이용하여 출생 후 충분한 성장이 관찰되 는 소뇌를 통해 reelin과 VLDLR 또는 ApoER2의 발현에 따른 상관관계에 대해
조사하였다.그 결과 VLDLR는 발생중인 분자층 (molecularlayer)과 조롱박세포
의 근위 가지돌기에서 높게 발현되었고, 반면에 ApoER2는 조롱박세포체 (Purkinjecellbody)에서 제한적으로 발현하고 있음이 관찰되었다.이 두 수용체 의 발현은 생후 7일에서 현저히 증가하며 그 이후 감소하는 것으로 나타났다.또 한 VLDLR의 발현은 정상의 mouse에 비해 reelin유전자가 결여된 reelermouse 에서 높게 나타났다.하지만 ApoER2의 발현에는 차이를 보이지 않았다.이상의 결과를 통해 소뇌피질의 형성에 중요한 reelin-dab1 신호전달과정은 VLDLR를 중심으로 매개되며,이 수용체 발현은 reelin에 의해 조절될 가능성을 제시한다. 핵심어 :Reelin,VLDLR,ApoER2,Dab1,소뇌발생,reeler
차
례
국문요약 ···ⅰ 차례 ···ⅱ 그림차례 ···ⅲ 표차례 ···ⅳ Ⅰ.서론 ···1 Ⅱ.재료 및 방법 ···6 A.실험재료 ···6 B.실험방법 ···7 1.실험동물 ···72.PCR (Polymerase chain reaction)forgenotyping ···7
3.면역조직화학염색법 (Immunohistochemistry)···7
4.RT-PCR (Reversetranscriptionpolymerasechain reaction)···9
Ⅲ.결과 ···11 A.뇌발생과정에서 reelin의 발현 ···11 B.소뇌피질형성에 따른 VLDLR의 발현 ···13 C.소뇌피질형성에 따른 ApoER2의 발현 ···15 D.VLDLR와 ApoER2의 동시발현 ···17 E.Reelin의 발현과 reelin수용체와의 동시발현 ···19 F.Reeler에서 VLDLR와 ApoER2의 발현 ···21 Ⅳ.고찰 ···24 Ⅴ.결론 ···28 참고문헌 ···29 영문요약 ···34
LI
ST OF FI
GURES
Fig.1.Reelin signaling pathway ···2 Fig.2.Abnormaldevelopmentofcerebellum in rln-/- (reeler)and Dab1-/
-(yotari) mice ··· 4 Fig.3.Cajal-retziuscellsincerebralcortexofrat(P7)···12
Fig.4.Expression ofVLDLR during developmentofratand mouse
cerebellum ···14 Fig.5.Expression ofApoER2 during developmentofratand mouse
cerebellum ···16 Fig.6.Thecolocalization ofVLDLR and ApoER2in postnatal7ofrat
cerebellum ···18 Fig.7.Coexpressionofreelinandbothreceptorsintheratcerebellum ····20 Fig.8.ExpressionofVLDLR,ApoER2andDab1inreelercerebellum ···22
LI
ST OF TABLES
Ⅰ.서
론
Reelin-Disabled-1(Dab1)signaling pathway는 뇌의 구조 형성에서 세포 의 이동과 위치를 조절한다.세포외 (extracellular)단백질 reelin은 대뇌 피질의 marginalzone에 위치한 Cajal-Retzius cell과 소뇌의 바깥과립세포 (external granular cell)에서 분비된다 (D'Arcangelo et al., 1995, 1997; Lambert de Rouvroit& Goffinet,1998;Meyer& Goffinet,1998).Reelin은 대뇌의 피질 형 성과 해마 그리고 소뇌 등에서 층을 형성하고 신경세포의 이동을 조절하는 중요 한 역할을 한다.이 과정은 reelin이 lipoproteinreceptor계열에 속하는 verylow density lipoprotein receptor (VLDLR) 또는 apolipoprotein E receptor 2
(ApoER2)에 결합하여 이들의 cytoplasmic domain에 결합하고 있는 dab1의
tyrosine에 인산화를 유도함으로써 일어난다 (Howelletal.,1999).Reelin에 의한 dab1의 인산화는 Src family kinase (SFK)를 통해서 일어난다 (Arnaud etal.,
2003; Jossin et al., 2003). 그 이후에 reelin 신호의 하위경로에는
phosphatidylinositol 3 (PI3)-kinase/Akt (Bock et al., 2003)와 Nckβ (Pramatarovaetal.,2003)그리고 CrkL/C3G/Rap1(Ballifetal.,2004)pathway 가 포함되어 있다.
Reelin 유전자가 결여된 마우스인 reeler는 운동실조 (ataxia), 진전 (tremor),불균형 (imbalance),동요 보행 (reeling gait)등의 행동적인 특징이 야 기되며 신경세포의 이동이 원활하지 못해 대뇌의 피질층이 역위되어 나타나고
소뇌와 해마 또한 비정상적으로 나타난다.Dab1유전자가 결여된 yotari마우스
는 reeler마우스와 동일한 특징이 나타나며 출생 3주 후에 치명적인 죽음이 야
기된다 (GabriellaD'Arcangeloetal.,1998).
래트의 소뇌발생은 배아 14일을 시작으로 생후 15일 이후까지 일어난다.
소뇌 의 피질 층을 형성하 는 세포 는 과 립세포 (granule cell)와 조 롱박세 포
(Purkinjecell)로 이루어져 있으며 이들의 층은 뚜렷하게 구별된다.조롱박세포는
(Purkinjecelllayer)이 형성된다.이에 반해 과립세포는 출생 후 관찰되기 시작
하여 생후 직후에 바깥과립층 (externalgranule layer)을 형성하고,내과립층
(internalgranulelayer)은 생후 7-15일 사이에 바깥과립층에 분포하고 있는 세
포가 내부로 이동하여 형성된다.바구니세포 (basketcell)는 출생 후 6-7일,별세
포 (stellatecell)는 출생 후 10-11일에 형성되어 분자층 (molecularlayer)을 이
룬다 (F.Fonnum etal.,2000).마우스의 소뇌발생과정은 래트와 동일하나 생성
시기에 있어 차이가 나타난다.마우스는 배아 11일을 시작으로 생후 14일 이후까 지 소뇌의 발생이 일어난다.배아 13일에 조롱박세포가 관찰되며 출생 이후에 바
깥과립층,분자층,조롱박세포층,내과립층이 형성된다 (GabriellaD'Arcangeloet
al.,1998).소뇌는 뇌의 여러 기관 중 유일하게 출생 이후에 발생하므로 연구에
용이하여 신경발생과정을 연구하는데 좋은 모델로 사용된다.
이러한 소뇌 피질층의 형성은 reelin-dab1신호전달경로를 통해 신경세포
의 이동을 조절하고 세포의 위치를 결정하는 것으로 알려져 있다 (D'Arcangelo
etal.,1995,1997;LambertdeRouvroit& Goffinet,1998;Meyer& Goffinet,
1998).소뇌의 발생과정에서 reelin은 소뇌 피질층의 pialsurface에 위치한 과립
세포에서 발현된다.Reeler,yotari마우스의 경우 소뇌의 과립세포는 reelin을 분
비하지 못하므로 과립세포층의 깊은 곳에 조롱박세포가 군집하여 나타나고 세포 의 수 또한 감소되어 있다.하지만 과립세포는 층이 정상적으로 형성되지만 그
세포의 수는 감소되어 있다 (Dan Goldowitzetal.,1997).또한 소뇌의 크기는
정상에 비해 작으며 foliation이 적게 나타나는 특징을 보인다 (Marianietal.,
1977;Goffinet,1983,1984).따라서 소뇌의 비정상적인 발생이 운동실조,진전, 불균형,동요보행과 같은 행동학적 특징을 나타낸다. Reelin의 receptor인 VLDLR와 ApoER2가 결여된 마우스는 reeler마우스 의 뇌에서 나타나는 현상과 매우 유사한 특징을 나타낸다. VLDLR 또는 ApoER2유전자가 각각 결여된 마우스에서 대뇌 피질 층의 형성과 소뇌 피질 층 의 형성을 보면 ApoER2가 결여된 마우스는 대뇌 피질 층이 부분적으로 역위되 어 나타나고 VLDLR가 결여된 마우스에서는 소뇌 조롱박세포의 위치 전위가 일
Fig. 2. Abnormal development of cerebellum in rln-/- (reeler) and Dab1-/- (yotari)mice.
어난다.이처럼 ApoER2는 대뇌 피질 층의 발생에서,VLDLR는 소뇌 피질 층의
발생에서 중요한 역할을 하고 있음을 제시하고 있다 (Sweet et al., 1996;
Goldowitzetal.,1997;Gonzalezetal.,1997;Howelletal.,1997;Sheldon et
al.,1997;Wareetal.,1997).
본 연구에서는 reelin-dab1signaling pathway 중에서 VLDLR와 ApoER2 를 중심으로 소뇌발생에서 두 수용체의 역할을 알아보기 위해 소뇌의 발생과정
에서 reelin과 그 수용체 발현,그리고 이들의 결합력에 대한 상관관계에 관해 연
구하였다.이미 reelin수용체의 발현부위에 대해 ApoER2는 전뇌에서,VLDLR는
후뇌에서 높게 발현된다고 보고된 바 있으나 (Goldowitzetal.,1997),본 연구에
서는 소뇌의 발생과정동안 나타나는 수용체의 발현변화를 시기별로 조사하였다. 그 결과 수용체의 발현은 생후 7일에서 높게 발현되고 그 이후 시기에 다시 감 소하는 경향을 보였다.또한 reelin이 결여된 reeler마우스와 정상 마우스에서 VLDLR의 발현은 reeler마우스에서 증가한 것을 관찰하였으며 ApoER2는 정상 과 차이를 보이지 않았다.이상의 결과를 통해 소뇌의 발생에 있어 reelinsignal 은 VLDLR와 더 친화적으로 매개되며 이러한 VLDLR의 발현은 reelin에 의해 조절될 것으로 생각된다.
Ⅱ.재료 및 방법
A.실험재료
본 실험에서는 면역조직화학염색법을 위해 사용한 일차 항체로
mouse-anti-reelin은 Chemicon (CA, USA)에서, mouse-anti-VLDLR와 rabbit-anti-ApoER2는 Santa Cruz (CA, USA)에서, rabbit-anti-Dab1은
Abcam(MA, USA)에서 구입하여 사용하였다. 이차 항체는 biotinylated
anti-mouseIgG,biotinylatedanti-rabbitIgG를 Vector(Burlingame,CA,USA) 에서 Alexa488 goat anti-mouse IgG, Alexa594 goat anti-rabbit IgG를 Molecular probes (Willow, OR, USA)에서 구입하여 사용하였다. ABC kit (Avidin-biotin complex)는 Vector (Burlingame, CA, USA)에서 구입하였고 3,3'-diaminobenzidinetetrahydrochloride는 Sigma(DAB;ST Louis,MO,USA) 에서 구입하였다.Hoechst33258은 Roche (Mannheim,Germany),vectashield는 Vector (Burlingame,CA,USA)에서 구입하여 사용하였다.1ststrand cDNA synthesiskit는 Invitrogen(Carlsbad,CA,USA)에서 구입하여 사용하였다.
B.실험방법
1.실험동물
래트와 BalbC 마우스 그리고 발생 중 신경세포의 이동장애를 보이는 동
물모델로 reelin이 결여된 reeler마우스를 사용하였다.Reeler마우스는 대조군으
로서 같은 어미에서 태어난 wild type 마우스를 사용하였고, 실험군으로서
homozygote마우스를 사용하였다.사육 중인 래트와 마우스는 일반시판용 고형
사료와 물을 자유롭게 섭취토록 하였으며 동물실의 실내온도는 23℃,습도는 60% 그리고 12시간씩의 낮과 밤주기가 항상 유지되도록 하였다.실험동물의 임
신은 오후 7시에 heterozygote인 암컷과 수컷을 합사하고 다음날 오전 9시에
cervicalplug유무를 검사하여 plug이 발견될 경우 임신 0일로 하였다.그 후 생
후 0일,3일,7일,14일,21일의 시기별로 배정하였다.
2.PCR (Polmerasechain reaction)forgenotyping
출생 0일,3일,7일,14일,21일의 reeler 마우스에서 꼬리를 잘라 lysis
buffer에 담근 후 37℃에서 16시간 반응시킨 후 phenol 추출 과정을 거쳐
genomic DNA를 얻어내었다. 다음의 primer를 이용하여 94℃에서 5분간
denaturation시킨 후,94℃ 1분,54℃ 1분,72℃ 1분 30초를 35회 반복하고,마지
막 72℃ 10분간 최종적으로 합성하였다.
Reelinforwardprimer(a);5 -taatctgtcctcactctgcc-3 Reelinreverseprimer(b);5 -cagttgacataccttaat-3 Reelinreverseprimer(c);5 -tgcattaatgtgcagtgt-3
실험동물은 고정액 (4% paraformaldehydein 0.1M phosphatebuffer,pH 7.4)으로 10분 이상 관류시킨 후 뇌를 적출하여 동일한 고정액에 4℃에서 24시 간 후고정 하였다. 소뇌는 정중시상면 (midsagittal plane)으로 잘라 일부는 30-100% ethanol,xylene,파라핀 순으로 탈수과정을 거쳐 파라핀으로 포매하였 다.일부는 sucrose에 담궈 조직이 가라앉으면 dry ice에 냉동하여 -70℃에 보관 하였다. 파라핀으로 포매된 조직은 5 ㎛ 두께로 정중시상면으로 박절하고, silanizedcoating slide(MUTO glass,Japan)에 붙였다.붙여진 조직을 건조기에
서 1시간 동안 말린 후,xylene3회,100% ethanol1회,90% ethanol1회,80%
ethanol1회,70% ethanol1회,60% ethanol1회 순으로 탈파라핀 하였다.
얼려진 조직은 sliding microtome을 이용하여 30 ㎛ 절편을 제작하였고,
silanizedcoatingslide에 붙였다.
파라핀절편 조직은 항원성을 높이기 위해 0.01M sodium citratebuffer에 담궈 95℃에서 끓이고 5분간 식히는 과정을 3회 반복한다.실온에서 20분간 방 치 후,phosphate-buffered saline(PBS,pH 7.4)으로 5분간 3회 씻는다.내인 성 peroxidase의 활성을 억제하기 위해 0.3% Hydrogen peroxydase로 실온에서 30 분간 처리하고,비특이적 반응을 제거하기 위하여 이차 항체를 만든 동물
normal serum으로 실온에서 1 시간 동안 반응시켰다. 이것을 일차 항체
anti-reelin,1:400;anti-VLDLR,1:200;anti-ApoER2,1:100;anti-dab1,1:5000 으로 4℃에서 16시간 동안 그리고 다음날 실온에서 1 시간 동안 반응시킨 후,
biotin이 표지된 2차 항체로 실온에서 1시간 반응시켰다.ABC (Avidin-biotin
complex)용액은 30분간 반응시킨다음 3,3'-diaminobenzidinetetrahydrochloride
(DAB)으로 5분간 발색시켰다.발색반응이 끝난 조직을 PBS로 10분간 3회 세척
하고 증류수로 30분간 3회 씻어낸 뒤 탈수와 투명과정을 거친 후,비수용성 봉 입제로 봉입하였다.
이중면역형광염색법 (Double immunofluorescence staining)은 일차 항체 VLDLR,1:100와 ApoER2,1:100 또는 reelin,1:200과 VLDLR,1:100를 또는
날 실온에서 1시간 반응시킨 후,fluorescencedye가 결합된 이차 항체 Alexa488,
1:1000; Alexa594, 1:1000를 혼합하여 실온에서 1시간 동안 반응시켰다.
Hoechst33258,1:20000을 5분동안 반응시킨 후 vectashield로 봉입한 후 형광현 미경으로 관찰하였다.
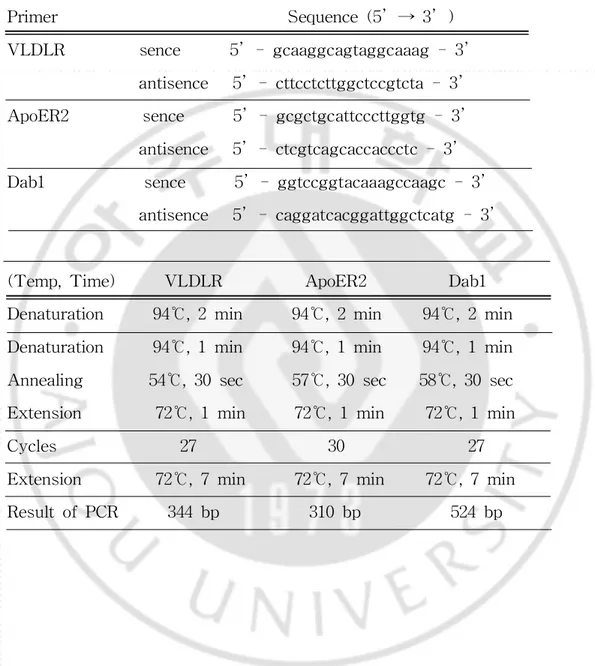
4.RT-PCR (Reversetranscription polymerasechain reaction)
RNAzolTMB로 정상마우스와 reeler마우스의 소뇌에서 RNA를 추출한 후
1ststrand cDNA synthesis kit를 이용하여 cDNA를 합성하고,specific primer
Table1.SequenceofprimerandPCR conditionsin RT-PCR.
Primer Sequence(5 → 3 )
VLDLR sence 5 -gcaaggcagtaggcaaag-3
antisence 5 -cttcctcttggctccgtcta-3 ApoER2 sence 5 -gcgctgcattcccttggtg-3 antisence 5 -ctcgtcagcaccaccctc-3
Dab1 sence 5 -ggtccggtacaaagccaagc-3
antisence 5 -caggatcacggattggctcatg-3
(Temp,Time) VLDLR ApoER2 Dab1
Denaturation 94℃,2min 94℃,2min 94℃,2min
Denaturation 94℃,1min 94℃,1min 94℃,1min
Annealing 54℃,30sec 57℃,30sec 58℃,30sec
Extension 72℃,1min 72℃,1min 72℃,1min
Cycles 27 30 27
Extension 72℃,7min 72℃,7min 72℃,7min
Ⅲ.결
과
A.뇌발생과정에서 reelin의 발현
Reelin은 뇌발생과정에서 대뇌의 피질,해마,소뇌의 형성에 관여한다.생
후 7일의 래트 뇌조직 파라핀절편을 사용하여 대뇌의 피질과 해마에서 reelin의
발현을 살펴보기위해 면역조직화학염색법을 시행하였다.대뇌의 피질에서는 피질 층 가장 바깥쪽의 marginalzone에 위치한 Cajal-Retziuscell에서 reelin이 발현 되는 것을 관찰하였다. 해마에서는 stratum oriens와 subgranular layer, molecularlayer의 Cajal-Retziuslike cell에서 reelin이 발현되는 것을 관찰하였
다 (Fig.3).이와같이 reelin의 발현을 통해 세포의 이동이 원활하게 이루어져 정
Fig. 3. Expression of reelin in developing of rat brain. Reelin is expressed by Cajal-Retzius neurons (CR)in marginalzone ofthe cerebral cortex.In hippocampus,reelin isalsoexpressedby Cajal-Retzius-likecellsin the stratum oriens,subgranularlayeras wellas molecularlayerseparating thedentategyrusfrom thehippocampusproper.CR,Cajal-Retziuscells;Py, pyramidalcells; DG,dentate gyrus Mo,molecular layer; Po,polymorphic layer;So,stratum oriens.
B.소뇌피질형성에 따른 VLDLR의 발현 소뇌의 발생에 관여하는 reelin신호전달을 이해하기 위해 먼저 VLDLR의 발현부위와 발현양상을 시기별로 관찰하였다.이를 위해 래트와 마우스의 뇌를 소뇌가 형성되기 시작하는 생후 0일부터 21일까지 파라핀절편을 제작하여 면역 조직화학 염색법을 시행하였다.소뇌 피질의 발생은 출생 직후 바깥과립층이 가 장 먼저 형성되고 래트의 경우에는 3-4일에 조롱박세포층이,7-15일에 분자층과 내과립층이 형성된다.마우스의 경우에는 래트보다 이른시기에 조롱박세포층,분 자층,내과립층이 형성된다.래트의 소뇌에서 VLDLR는 생후 0일에서 3일까지 서서히 발현을 시작하여 7일에 크게 증가하였다.하지만 생후 7일 이후에는 발현 이 다시 감소하는 것으로 나타났다 (Fig.1A).마우스의 소뇌에서는 생후 3일부 터 7일까지 발현이 높게 나타났으며 이후에는 다시 감소하였다 (Fig.1B).래트 와 마우스에서 VLDLR는 생후 0일과 3일 모두 층을 형성하기 시작하는 조롱박 세포층 (Purkinjecelllayer)에서 발현되며 0일에 비해 3일에서 발현이 증가하였
다 (Fig.1A,a-b;B,a-b).생후 7일에서는 분자층 (molecularlayer)과 조롱박세 포 (Purkinjecell)의 근위 가지돌기에서 발현이 나타났으며 (Fig.1A,c;B,c)조
롱박세포를 확대하여 살펴본 결과 뚜렷하게 관찰할 수 있었다 (Fig.1A,d).생후
14,21일에서도 동일한 부위에서 발현되는 것을 관찰하였다 (Fig.1A,e-f;B,
Fig.4.Expression of VLDLR during development of rat and mouse cerebellum.(A)Expression ofVLDLR is highestatpostnatalday 7 and, thereafter,significantly decreased in theratcerebellum.VLDLR expression is prominentin themolecularlayerand proximaldendritesofPurkinjecells(d) arrowheadsin P7.(B)Expression ofVLDLR isincreased atpostnatalday 3 and, thereafter, significantly decreased at postnatal 14 in the mouse cerebellum. VLDLR expression is prominent in the molecular layer and proximaldendrites ofPurkinje cells.Howeverits expression is observed in theinternalgranularcelllayeratpostnatalday 7.egl,externalgranularcell layer;igl,internalgranularcelllayer;mo,molecularlayer;pu,Purkinje cell layer.
C.소뇌피질형성에 따른 ApoER2의 발현 다음으로 reelin의 다른 수용체의 하나인 ApoER2의 발현을 소뇌에서 알 아보고자 하였다.앞에서 언급한 바와 동일하게 생후 0-21일의 뇌조직을 가지고 면역조직화학 염색법을 시행하였다.래트의 소뇌에서 ApoER2의 발현은 VLDLR 의 발현과 동일하게 생후 0일과 3일에서 발현이 관찰되기 시작하였고 (Fig.2A, a-b),생후 7일에는 현저하게 증가하였다 (Fig.2A,c).그러나 14일과 21일에는
ApoER2의 발현이 크게 감소하였다 (Fig.2A,d-e).마우스의 소뇌에서 ApoER2
의 발현은 생후 14일에 증가하여 이후시기에 감소하였다 (Fig.2B,d-e).래트와
마우스의 소뇌에서 관찰되는 ApoER2의 발현은 VLDLR보다 감소되는 것으로 나
타났다 (Fig.2).ApoER2는 생후 0일에 조롱박세포에서 발현이 시작되고 (Fig.
2A-B,a)생후 3일에서는 층이 형성된 조롱박세포층에서 발현이 나타났다 (Fig.
2A-B,b).생후 7일에는 ApoER2의 발현이 조롱박세포체 (Purkinjecellbody)에
국한되어 나타나는 것을 관찰하였고 (Fig.2A-B,c),생후 14일과 21일에서도 동
일한 곳에서 발현되는 것을 관찰하였다 (Fig.2A-B,d-e).이를 통해 ApoER2는
소뇌의 시기에 따른 발현양상은 VLDLR와 동일하나 소뇌의 전체에서 볼 때 VLDLR에 비해 낮게 나타나는 것을 확인하였다.
Fig.5.Expression of ApoER2 during development of rat and mouse cerebellum. (A) During postnatal development of rat cerebellum, overall expression of ApoER2 is lower than that of VLDLR.However prominent expression ofApoER2 is observed atpostnatalday 7 and its expression is especially confined in cell bodies of Purkinje cells.(B) During postnatal developmentofmousecerebellum,overallexpressionofApoER2islowerthan thatofVLDLR.ApoER2 expression is especially confined in cellbodies of Purkinjecells.egl,externalgranularcelllayer;igl,internalgranularcelllayer; mo,molecularlayer;pu,Purkinjecelllayer.
D.VLDLR와 ApoER2의 동시발현 앞선 결과를 통해 소뇌에 분포하는 reelin 수용체의 발현을 정리하면 VLDLR가 ApoER2에 비해 발현이 월등히 높은 것으로 나타났다 (Fig.1-2).이 러한 결과를 바탕으로 VLDLR과 ApoER2의 발현의 차이는 각각의 수용체를 발 현하고 있는 세포 수의 차이 때문에 나타나는 현상일 것이라는 의문을 가지게 되었다. 따라서 이를 검증하기 위해 이중면역형광염색법 (Double immunofluorescencestaining)으로 두 수용체의 동시발현을 관찰하였다.앞선 결 과에서 두 수용체는 생후 7일에 조롱박세포에서 가장 높게 발현되었으므로 이 시기의 조직을 사용하여 관찰하였다.이 세포층은 생후 7일이 되면 완전하게 형 성되고 동시에 분자층과 내과립층 형성을 위해 세포의 이동이 매우 활발하게 일 어나는 것으로 보고되어있다 (F.Fonnum etal.,2000).따라서 본 연구에서는 생후 7일된 래트의 소뇌를 이용하였다.그 결과 VLDLR와 ApoER2는 조롱박세 포에서 함께 발현되고 있음을 관찰 하였다 (Fig.3C).이것을 통해 두 수용체의 발현에 대한 차이는 세포 수에 따른 차이가 아니라 발현량에 의한 차이임을 알 수 있다.따라서 VLDLR의 발현이 ApoER2의 발현보다 높게 나타나는 것은 소 뇌의 발생에서 VLDLR가 reelin 신호를 전달하는데 있어 더 비중있게 관여하는 것을 의미한다.
Fig.6.Thecolocalization ofVLDLR and ApoER2in postnatal7 ofrat cerebellum. VLDLR is expressed in molecular cell layer, and proximal dendrites ofPurkinje cells,whereas ApoER2 expression is restricted in cell bodies ofPurkinje cells.egl,externalgranular layer;igl,internalgranular layer;mo,molecularlayer;pu,Purkinjecell.
E.Reelin의 발현과 reelin 수용체와의 동시발현
소뇌 발생과정에서 VLDLR가 높게 발현되었다.이것은 reelin과 높은 친
화력으로 세포내로 신호를 전달할 가능성이 있음을 생각해 볼 수 있다.따라서
발현정도가 낮은 ApoER2와 비교하여 reelin과 두 수용체간의 결합력에 대한 차
이를 조사하였다.생후 3일된 래트의 소뇌에서 reelin의 발현은 바깥과립세포층
(externalgranulelayer,egl)의 과립세포 (granularcell)에서 관찰되었고 (Fig.
4A),생후 7일에서는 분자층 (molecularlayer)에서도 발현되고 있음을 확인하였
다 (Fig.4B).그러나 조롱박세포에서는 나타나지 않았다 (Fig.4A-B).그 결과
reelin과 VLDLR은 분자층에서 함께 발현되고 있는 것을 관찰하였다 (Fig.4B).
이상의 결과를 통해 소뇌의 발생과정에서 reelin은 VLDLR와 높은 결합력을 가
지는 것으로 생각되며,이 수용체를 통해 reelin-dab1의 신호가 전달됨을 의미한
A
B
Fig.7.Coexpression ofreelin andboth receptorsin theratcerebellum. (A) During development, immunoreactivity to reelin is found in the postmitotic neurons ofexternalgranular celllayer (egl) atP3 and in the granularcells,including theiraxonsin themolecularlayeratP7.In contrast, Purkinjecellsdonotexpressreelin. (B)Doubleimmunofluorescencestaining of reelin and its receptors at P7.Colocalization of reelin and VLDLR is noticed in the externalgranularcelllayerand molecularlayer.egl,external granularcelllayer;igl,internalgranularcelllayer;mo,molecularlayer;pu, Purkinjecell.
F.Reeler에서 VLDLR와 ApoER2의 발현 이미 보고된 바에 따르면 reelin유전자가 결여된 reeler마우스의 경우 소 뇌 층에서 정상과 매우 다른 형태로 나타난다.정상 마우스의 경우 foliation이 뚜 렷하게 나타나고 바깥과립층,조롱박세포층 그리고 내과립층의 형성은 reelin의 신호 전달을 통해 일어난다. 하지만 reeler 마우스는 소뇌의 크기가 작고 foliation이 적게 나타난다.이것은 reelin의 결여로 인해 신경세포의 이동이 정상 적으로 이루어지지 않아서 조롱박세포는 단일층을 형성하지 못하고 내과립층에 군집하여 전위되어 나타난다.뿐만 아니라 과립세포와 함께 세포의 수가 감소되
어 있다 (DanGoldowitzetal.,1997).본 연구에서는 정상과 reeler마우스에서
VLDLR와 ApoER2의 발현에 대한 차이를 살펴보았다. VLDLR의 발현은 정상의 마우스에 비해 오히려 reeler마우스에서 발현이 우세하였고 뿐만 아니라 조롱박세포의 가지돌기 길이가 짧아졌다.VLDLR를 발 현하고 있는 조롱박세포의 수는 정상에 비해 reeler마우스에서 감소하지만 발현 량은 현저하게 높은 것으로 나타났다 (Fig.5A-B).반면에 ApoER2는 정상 마우 스와 reeler마우스에서 발현의 차이를 관찰할 수 없었으나 reeler마우스에서는 조롱박세포의 가지돌기가 짧아진 것을 관찰하였다 (Fig.5A).그리고 reeler마우 스의 소뇌에서도 VLDLR의 발현이 ApoER2 보다 높게 나타났다. 수용체의 mRNA 발현 또한 reeler 마우스에서 VLDLR와 dab1의 발현이 증가하였으며 ApoER2는 정상마우스와 reeler 마우스 사이의 발현차이가 나타나지 않았다 (Fig.5B).이를 통해 소뇌발생과정에서 reelin의 신호전달은 VLDLR를 중심으로 일어나며 이것은 reelin에 의해 발현이 조절되고 있음을 의미한다.
Fig.8.Expression ofVLDLR,ApoER2andDab1in reelercerebellum. (A,a-b)In reelin-deficientreelermice,expression ofVLDLR and Dab1 is greatly increased comparing to wild type. However significant increasein expression ofApoER2cannotbeobserved in reelermice.(B)In reelermice, also mRNA expression ofVLDLR and Dab1 is increased comparing to wild type.egl,externalgranularlayer;pu,Purkinjecell.
Ⅳ.고
찰
Reelin 유전자는 뇌의 발생과정에서 세포의 이동과 위치 결정에 중요한
역할을 하는 것으로 알려져 있다 (D'Arcangelo etal.,1995,1997;Lambertde Rouvroit& Goffinet,1998;Meyer& Goffinet,1998).이러한 reelin은 VLDLR 또는 ApoER2와 결합하여 세포내로 신호를 전달하고 수용체와 결합하고 있는 adaptor protein인 dab1의 tyrosine 인산화를 유도한다 (Howelletal.,1999). Dab1의 tyrosine 인산화는 Srcfamily kinase에 의해 일어난다 (Arnaud etal.,
2003; Jossin et al., 2003). 그 이후에 Reelin 신호의 하위경로인
phosphatidylinositol3(PI3)-kinase(Bocketal.,2003)와 Nckβ (Pramatarovaet
al.,2003)가 활성화 된다.이 과정을 통해 소뇌에서 세포의 이동이 일어나 정상 적으로 소뇌가 형성된다.소뇌는 뇌의 여러 기관 중 유일하게 출생 이후에 발생 하므로 연구에 용이하여 신경발생과정을 연구하는데 좋은 모델로 사용된다. 본 연구에서는 래트와 마우스의 소뇌 발생과정 동안에 reelin의 신호를 전 달하는 수용체인 VLDLR와 ApoER2의 발현을 생후 시기별로 관찰하고 reelin과 수용체와의 상관관계에 대해 알아보았다. 보고된 바에 의하면 마우스에서 VLDLR는 배아 18일에 조롱박세포에서 처음 관찰되고 생후 4일에 가장 높은 발 현을 나타내며,반면에 ApoER2는 VLDLR의 발현보다 감소되어 나타나고 소뇌 의 깊은 층에서 관찰되며 조롱박세포에서는 관찰되지 않는 것으로 알려져 있다 (Perez-Garciaetal.,2004).본 연구에서는 생후 0-21일까지 래트와 마우스의 소 뇌에서 수용체의 발현을 살펴본 결과 VLDLR의 발현이 ApoER2에 비해 높게 나 타났다.래트의 소뇌에서는 두 수용체 모두 생후 7일에 발현이 증가하였으며 그 이후에 다시 감소하는 것으로 관찰되었다.또한 VLDLR는 분자층과 조롱박세포 의 근위 가지돌기에서 현저히 발현되고 있으며 ApoER2는 조롱박세포의 세포전 체에 국한되어 발현되고 있었다.마우스의 소뇌에서 VLDLR는 생후 3일에 발현 이 증가하여 7일 이후에 감소하였고,ApoER2는 생후 14일에 발현이 증가하여 그 이후에 감소하였다.래트에서 관찰된 것과 유사하게 VLDLR의 발현은 분자층
과 조롱박세포에서 발현되었고 ApoER2는 조롱박세포체에 제한적으로 발현되었 다.보고된 바에 의하면 마우스와 달리 사람에서는 VLDLR의 발현이 바깥과립 층,조롱박세포,내과립층에서 모두 관찰되었고,ApoER2의 발현은 조롱박세포에
서 나타나는 것으로 알려져 있다 (Perez-Garciaetal.,2004).따라서 래트와 마
우스에서 수용체 발현 부위의 차이를 보이는 것은 종간의 차이로 생각되어진다. 이와 같이 소뇌발생과정에서 두 수용체는 각각 다른 부위에서 발현되고 있으며 시기에 따라 발현의 차이가 나타나는 것을 관찰하였다.래트와 마우스에서 두 수 용체의 발현시기 차이는 소뇌가 형성되기 위한 세포의 이동시기에 따른 차이로 생각된다.소뇌형성과정을 살펴보면 마우스는 배아 11일을 시작으로 생후 14일까 지 형성되고,래트는 배아 14일을 시작으로 15일까지 형성된다.마우스는 래트와 비교하여 소뇌형성시기가 3-4일 빠르게 나타난다.수용체는 세포의 이동에 필요 하므로 세포의 이동시기에 따라 수용체의 발현시기 또한 다르게 나타날 것으로 생각된다.특정한 시기에 수용체의 발현이 증가하는 것은 세포가 활발히 이동하 는 시기에 나타나는 현상으로 볼 수 있다. 래트와 마우스의 소뇌에서 ApoER2의 발현보다 VLDLR의 발현이 높게 나타나는 현상이 각 수용체를 발현하는 세포의 수적인 차이인지 세포의 양적인 차이인지 살펴보기 위해 두 수용체의 동시발현을 관찰하였다.그 결과 두 수용체 는 하나의 세포에서 함께 발현하고 있음을 확인할 수 있었다.이 결과를 통해 두 수용체의 발현차이는 한 세포에서 각각의 수용체의 발현량적인 차이임을 증명하 였다.또한 보고된 바에 의하면 ApoER2와 VLDLR 각각의 돌연변이 마우스를 통해 ApoER2의 돌연변이 마우스는 대뇌피질이 비정상적으로 형성되었고, VLDLR의 돌연변이 마우스는 소뇌의 형성이 비정상적으로 나타난다.그러므로 ApoER2는 대뇌의 피질층 형성에 관여하므로 전뇌에서 높게 발현되며 VLDLR는 소뇌의 피질층 형성에 관여하므로 후뇌에서 높게 발현된다 (Sweetetal.,1996;
Goldowitzetal.,1997;Gonzalez,etal.,1997;Howelletal.,1997;Sheldon et
al.,1997;Wareetal.,1997).이를 통해 두 수용체는 서로 다른 작용을 하고 있
소뇌발생과정에서 reelin은 배아시기에 과립세포에서 발현이 시작된다.래 트의 소뇌에서 reelin의 발현은 생후 3일에서는 바깥과립세포에서 관찰되며 생후 7일에는 분자층에서도 관찰된다.소뇌에서 분자층은 조롱박세포의 근위 가지돌기 와 과립세포의 축삭으로 구성되어진다.VLDLR는 조롱박세포의 근위 가지돌기에 서 발현되므로 분자층에서도 또한 발현되며 reelin과 함께 발현된다.VLDLR는 조롱박세포의 전체에서 발현되고 있으나 근위 가지돌기에서 현저하게 발현되고 있다.이것은 소뇌에서 synapse를 이루는데 요구되어지는 조롱박세포의 가지돌 기에서 VLDLR가 발현되고 있는 것은 소뇌에서 reelin의 신호를 전달하는데 중 요한 역할을 하는 것으로 예상 할 수 있다. Reelin이 결여된 reeler 마우스에서 수용체와 결합하고 있는 adaptor
protein인 dab1의 발현이 증가한다 (Riceetal.,1998;Howelletal.,1999).이것
은 reelin에 의해 유도되는 dab1의 tyrosine인산화가 dab1의 분해에 관여하기 때
문에 reelin이 결여된 경우 dab1의 분해가 늦어져 발현이 증가하는 것으로 알려
져 있다 (LionelArnaud etal.,2003).또한 대뇌피질에서는 ApoER2가 reelin에
의해서 유도되는 dab1의 분해에 중요한 역할을 하는 것으로 알려져 있다 (Hans H.Bock etal.,2004).본 연구에서는 수용체의 발현 또한 reelin에 의해 조절되 는지 알아보기 위해 reeler마우스를 사용하여 조사하였다.생후 3일,7일,21일된 reeler마우스를 사용하여 소뇌에서 수용체의 발현을 정상 마우스와 비교하여 살 펴보았다.그 결과 VLDLR는 reeler마우스의 소뇌에서 정상마우스에 비해 발현 이 증가하였으나 ApoER2는 정상마우스와 reeler마우스에서 별다른 차이를 관찰 할 수 없었다.또한 mRNA 발현에서도 dab1과 VLDLR의 발현은 정상마우스에 비해 증가하였으나 ApoER2의 발현은 정상마우스와 차이를 보이지 않았다.두 수용체 중 VLDLR의 발현이 reeler 마우스에서 증가한 것을 통해 VLDLR는 reelin에 의해 조절됨을 알 수 있다.반면에 ApoER2의 발현은 정상과 reeler마 우스에서 동일하게 나타나는 것을 통해 소뇌에서 ApoER2는 reelin에 의한 영향 이 없는 것으로 생각되어진다.이상의 결과를 통해 소뇌의 발생에서 reelin의 신 호전달에는 주로 VLDLR이 관여할 가능성이 높다.소뇌에서 VLDLR의 발현이
정상마우스에 비해 reeler마우스에서 증가하는 현상은 소뇌형성을 위해 reelin의 신호를 전달하는 VLDLR가 신호를 받기 위해 정상보다 과발현 되는 것으로 생
각된다.이러한 현상은 ligand가 없는 경우 수용체의 발현이 증가하는 경우와 비
교하여 볼 수 있다 (DouglasS.Kim etal.,2000).
그러나 VLDLR가 소뇌에서 높게 발현되는 현상이 어떠한 메카니즘에 의
해 나타나는지는 아직 분명치 않다.이에 관해서는 앞으로 reelin,dab1이 각각
Ⅴ.결
론
본 연구에서는 소뇌의 발생과정에서 신경세포의 이동과 위치를 조절하는 reelin과 VLDLR 또는 ApoER2의 상관관계에 대해 조사하고자 하였다.래트와 마우스의 소뇌에서 VLDLR와 ApoER2의 발현을 살펴 본 결과 VLDLR의 발현이 ApoER2에 비해 높게 나타났다.래트에서는 VLDLR,ApoER2가 생후 7일에 발 현이 증가하였고 이후시기에 감소하였다.마우스에서 VLDLR는 생후 3일부터 발 현이 증가하여 생후 7일 이후에 감소하는 것으로 관찰되었고,ApoER2의 발현은 생후 14일에 증가하여 이후시기에 감소하였다.VLDLR는 소뇌에서 분자층과 조 롱박세포의 근위 가지돌기에서 주로 발현되고,ApoER2는 조롱박세포체에 국한 되어 발현되는 것을 관찰하였다. 또한 reelin이 결여된 reeler 마우스에서는 VLDLR의 발현이 정상 마우스에 비해 뚜렷이 증가한 것을 관찰하였으나 ApoER2는 정상과 차이를 보이지 않았다.이상의 결과를 통해 소뇌의 발생에 있 어 reelin 신호전달은 ApoER2보다는 VLDLR를 통해 주로 일어나며 이러한 VLDLR의 발현은 reelin에 의해 조절될 것으로 생각된다.참 고 문 헌
1.MarionTrommsdorff,MichaelGotthardt,ThomasHiesberger,JohnShelton, WalterStockinger,JohannesNimpf,RobertE.Hammer,JamesA.
Richardson,andJoachim Herz:Reeler/Disabled-likedisruptionofneuronal migrationinknockoutmicelackingtheVLDL receptorandApoE receptor 2.Cell,97:689-701,1999.
2.HansH.Bock,YvesJossinPetraMay,OliverBergner,andJoachim Herz: ApolipoproteinE ReceptorsAreRequiredforReelin-inducedProteasomal DegradationoftheNeuronalAdaptorProteinDisabled-1.JBiolChem,279:
33471-33479,2004
3.DanGoldowitz,RichardC.Cushing,EricLaywell,GabriellaD'Arcangelo, MichaelSheldon,HopeO.Sweet,MurielDavisson,DennisSteindlerand Tom Curran:CerebellarDisorganizationCharacteristicofReelerin ScramblerMutantMiceDespitePresenceofReelin.JNeurosci.
15;17(22):8767-77,1997.
4.Gabriella D'Arcangelo,Tom Curran :Reeler:new taleson an old mutant mouse.Bioessays.20(3):235-44,1998.
5. Howell BW, Herrick TM, Cooper JA : Reelin-induced tryosine phosphorylation of disabled 1 during neuronal positioning. Genes Dev. 15;13(6):643-8,1999.
and Purkinje cellmigration in the cerebellarcortex:analysis ofscrambler chimericmice.JNeurosci.15;22(2):464-70,2002.
7.C.G.Perez-Garcia,F.Tissir,A.M GoffinetandG.MeyerReelinreceptors in developing laminated brain structures of mouse and human.Eur J
Neurosci.20(10):2827-32,2004.
8.Curran,T.,and D'Arcangelo,G.:Role ofreelin in the controlofbrain development.BrainRes.Rev.26,285-294,1998.
9.D'Arcangelo,G.,Miao,G.G.,Chen,S.C.,Soares,H.D.,Morgan,J.I.,and Curran,T.:A proteinrelatedtoextracellularmatrix proteinsdeletedinthe mousemutantreeler.Nature374,719-723,1995.
10.Gallagher,E.,Howell,B.W.,Soriano,P.,Cooper,J.A.,and Hawkes,R.: Cerebellarabnormalitiesinthedisabled(mdab1-1)mouse.J.Comp.Neurol.
402,238-251,1998.
11.Howell,B.W.,Hawkes,R.,Soriano,P.,and Cooper,J.A.:.Neuronal position in the developing brain is regulated by mouse disabled-1.Nature
389,733-737,1997.
12.Rice,D.S.,Sheldon,M.,D'Arcangelo,G.,Nakajima,K.,Goldowitz,D.,and Curran,T.:Disabled-1actsdownstream ofReelin in a signaling pathway thatcontrols laminarorganization in themam- malian brain.Development
13.Sheldon,M.,Rice,D.S.,D'Arcangelo,G.,Yoneshima,H.,Nakajima,K., Mikoshiba,K.,Howell,B.W.,Cooper,J.A.,Goldowitz,D.,and Curran,T. Scramblerand yotaridisruptthe disabled gene and produce a reeler-like phenotypeinmice.Nature389,730-733,1997.
14.D’Arcangelo,G.,Homayouni,R.,Keshvara,L.,Rice,D.S.,Sheldon,M. Curran, T. : Reelin is a ligand for lipoprotein receptors. Neuron, 24,
471-479,1999.
15.Hiesberger,T.,Trommsdorff,M.,Howell,B.W.,Goffinet,A.,Mumby, M.C.,Cooper,J.A.& Herz,J.:Directbinding ofReelin toVLDL receptor and ApoE receptor 2 induces tyrosine phosphorylation ofdisabled-1 and modulatestauphosphorylation.Neuron,24,481-489,1999.
16.Jossin,Y.,Ignatova,N.,Hiesberger,T.,Herz,J.,LambertdeRouvroit,C. & Goffinet,A.M.:ThecentralfragmentofReelin,generatedby proteolytic processing in vivo, is critical to its function during cortical plate development.J.Neurosci.,24,514-521,2004.
17.Luque,J.M.,Morante-Oria,J.& Fairen,A.:Localization of ApoER2, VLDLR and Dab1 in radialglia:groundwork for a new modelofreelin action during cortical development. Brain Res. Dev. Brain Res., 140, 195-203,2003.
18.LionelArnaud,Bryan A.Ballif,and Jonathan A.Cooper: Regulation of Protein Tyrosine Kinase Signaling by Substrate Degradation during Brain Development.MolCellBio.,23,9293-9302,2003.
19. Keshvara, L., S. Magdaleno,D. Benhayon, and T. Curran. : Cyclin dependent kinase 5 phosphorylates disabled 1 independently of Reelin signaling.J.Neurosci.22:4869-4877,2002.
20.Koch,S.V.Strasser,C.Hauser,D.Fasching,C.Brandes,T.M.Bajari, W.J.Schneider,andJ.Nimpf.:A secreted solubleform ofApoE receptor 2 acts as a dominant-negative receptor and inhibits Reelin signaling.
EMBO J.21:5996-6004,2002.
21.Rice,D.S.,and T.Curran.:Role ofthe reelin signaling pathway in centralnervous system development.Annu.Rev.Neurosci.24:1005-1039, 2001.
22.LambertdeRouvroitC,GoffinetAM.:Thereelermouseasamodelof braindevelopment.AdvAnatEmbryolCellBiol. 150:1-106,1998
23.MeyerG,GoffinetAM.:Prenataldevelopmentofreelin-immunoreactive neuronsinthehumanneocortex.JCompNeurol.20;397(1):29-40,1998
24.Jossin Y,OgawaM,Metin C,TissirF,GoffinetAM.:Inhibition ofSRC family kinases and non-classicalprotein kinases C induce a reeler-like malformation of corticalplate development.J Neurosci.29;23(30):9953-9, 2003
25.Bock HH,Jossin Y,Liu P,ForsterE,May P,GoffinetAM,Herz J.: Phosphatidylinositol3-kinase interacts with the adaptor protein Dab1 in responsetoReelinsignalingandisrequiredfornormalcorticallamination.J
BiolChem.3;278(40):38772-9,2003
26.Pramatarova A,OchalskiPG,Chen K,Gropman A,Myers S,Min KT, HowellBW.:Nck beta interacts with tyrosine-phosphorylated disabled 1 and redistributes in Reelin-stimulated neurons. Mol Cell Biol.
23(20):7210-21,2003
27.BallifBA,Arnaud L,Arthur WT,Guris D,Imamoto A,Cooper JA.: Activation ofaDab1/CrkL/C3G/Rap1pathway in Reelin-stimulatedneurons.
CurrBiol.6;14(7):606-10,2004
28.Fonnum F,Lock EA.:Cerebellum as a target for toxic substances.
ToxicolLett.15;112-113:9-16,2000
29.MarianiJ,CrepelF,Mikoshiba K,Changeux JP,Sotelo C.:Anatomical, physiologicaland biochemicalstudiesofthecerebellum from Reelermutant mouse.PhilosTransR SocLondB BiolSci.2;281(978):1-28,1977