REVIEW ARTICLE
염증과 간섬유화, 그리고 간세포암
권오상, 최성한, 김주현
가천대학교 의과대학 가천대 길병원 내과학교실
Inflammation and Hepatic Fibrosis, Then Hepatocellular Carcinoma
Oh Sang Kwon, Seong Han Choi, and Ju Hyun Kim
Department of Internal Medicine, Gachon University Gil Medical Center, Gachon University School of Medicine, Incheon, Korea
Inflammation is one of the most prominent characteristic features of chronic liver disease, liver fibrosis, cirrhosis, and hep- atocellular carcinoma (HCC). Most of HCC cases develop in patients with cirrhosis and cirrhosis develops in patients with chronic liver inflammation. Therefore, there is no doubt that there exist some strong connection among inflammation, fibrosis, and cancer. In fact, chronic unresolved inflammation is associated with persistent hepatic injury and concurrent regeneration, leading to sequential development of fibrosis, cirrhosis, and eventually HCC. This review will discuss the common mechanism of inflammation and fibrosis in chronic liver diseases, and then demonstrate why HCC develops in inflammatory and fibrotic conditions. (Korean J Gastroenterol 2015;66:320-324)
Key Words: Inflammation; Fibrosis; Cirrhosis; Hepatocellular carcinoma
CC This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/
by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Copyright © 2015. Korean Society of Gastroenterology.
교신저자: 김주현, 21565, 인천시 남동구 남동대로 774번길 21, 가천대 길병원 내과
Correspondence to: Ju Hyun Kim, Department of Internal Medicine, Gachon University Gil Medical Center, 21 Namdong-daero 774beon-gil, Namdong-gu, Incheon 21565, Korea. Tel: +82-32-460-3778, Fax: +82-32-460-3408, E-mail: jhkim@gilhospital.com
Financial support: None. Conflict of interest: None.
서 론
염증은 바이러스 간질환, 알코올 간질환, 비알코올 지방간 질환, 자가면역 간염 등 여러 간질환의 특징적인 소견이며 간 섬유화, 간경변증, 그리고 간암 등 다양한 간질환의 스펙트럼 에 중추적인 역할을 한다. 간세포암은 대부분 간경변에서 발 생하므로 간경변증은 간암 발생의 전암 단계라 할 수 있다.
따라서 만성염증에서 시작되어 간섬유화, 그리고 간경변증으 로 이어지는 병리학적 기전을 이해해야만 간암 발생의 기전을 이해할 수 있다. 여기서는 우선 염증과 간섬유화의 관계를 중 점적으로 기술한 뒤 염증, 섬유화, 그리고 간암으로 이어지는 기전 및 신호체계에 대해 기술하도록 하겠다.
본 론
1. 염증과 간섬유화
1) 염증과 섬유화에 관여하는 세포
간 성상세포(hepatic stellate cell, HSC)는 간섬유화의 중 추 역할을 하는 세포로 간세포를 비롯한 많은 세포들로부터 신호를 받아 섬유화를 진행시킨다. HSC는 간 내 염증을 만드 는 데 신호를 만들기도 하지만 주로 염증 신호를 받아 섬유화 의 진행 또는 해소 등에 영향을 미친다.1
간세포도 염증과 간섬유화에 관여하고 있는데, 간세포의 사멸은 만성염증과 섬유화의 주 동력원으로 apoptotic hep- atocyte body는 대식세포의 염증 및 섬유화 사이토카인의 생 성을 촉진시킨다.1 또한 죽은 간세포로부터 분비된 dam- age-associated molecular patterns (DAMPs)은 섬유화를 직접적으로 혹은 간접적으로 촉진시킨다.2
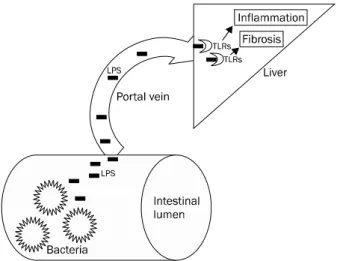
Fig. 1. LPS-TLRs signaling induce liver injury and fibrogenesis. In chronic liver disease, gut permeability is increased. This situation increases the likelihood of bacterial translocation and permeability of LPS. PAMPs including LPS freely travel through portal vein and arrive at the liver. LPS attach to TLRs and then activate hepatic stellate cell and Kupffer cell, which induce inflammation and fibrosis.
LPS, lipopolysccharide; TLRs, toll-like receptors, PAMPs; pathogen- associated molecular patterns.
간 내 대식세포(macrophage)는 쿠퍼 세포(Kupffer cell) 외에도 골수에서 기원하는 대식세포가 합류해 섬유화 사이토 카인을 분비하고 활성화된 HSC의 생존을 유지시켜 섬유화를 촉진시킨다.3 이러한 대식세포는 조직 내에서 항상 콜라겐 (collagen)을 형성하는 HSC 근처에 존재하는데 이는 이 두 세포 간의 관계가 아주 밀접하다는 것을 의미한다.4 활성화된 HSC은 여러 케모카인(chemokine)으로 대식세포를 자극한 다. 이어 대식세포는 transforming growth factor (TGF)-1 을 분비하여 HSC로 하여금 콜라겐을 비롯한 세포외 기질 (matrix protein)을 합성하게 하고,5 platelet derived growth factor (PDGF)를 분비하여 HSC의 증식을 유발한다.6 그러나 대식세포의 역할이 항상 profibrogenic한 것은 아니고 경우에 따라서는 탐식작용(engulf and then digest)에 의해 자멸세 포(apoptotic cell)들을 제거하여 염증 반응을 억제하거나 너 무 많은 콜라겐을 제거하기도 하고 matrix metalloprotei- nase (MMP)를 분비하여 콜라겐을 분해하여 섬유화를 억제 하기도 한다.
간 내 자연 살해 세포(natural killer cell)은 항 섬유 작용을 갖고 있는데 interferon-와 tumor necrosis factor (TNF)- related apoptosis-inducing ligand (TRAIL)과 Fas ligand를 통해 활성화된 HSC를 제거하여 섬유화가 진행되는 것을 억 제한다.7,8
2) 염증과 섬유화에 관여하는 중심 경로 및 기전
(1) 세균 전이(bacterial translocation), 지질다당류(lipo- polysaccharide, LPS), toll-like receptor (TLR) 경로: 장내 세균의 전이는 만성 간질환에서 각종 감염의 원인이 될 뿐만 아니라 염증 반응을 일으켜 섬유화를 촉진시키기도 한다. 이 러한 세균에서 분비된 물질인 pathogen-associated molec- ular patterns (PAMPs)가 TLRs를 활성화시키는데, 그 중에 서도 TLR4 ligand인 지질다당류는 쿠퍼 세포뿐만 아니라 HSC 를 활성화시켜 간 내 염증과 섬유화를 촉진시킨다(Fig. 1).9
PAMPs는 LPS 외에도 지질 단백(lipopeptides), un- methylated DNA, 이중나선 RNA 등이 있는데 이들은 주로 TLR를 통해서 염증반응을 일으킨다.10 TLRs는 쿠퍼 세포, 간 세포, HSC 등에 많이 분포되어 있어 간염증, 손상, 섬유화에 중요한 역할을 하고 있다.10
TLRs는 숙주로 하여금 병균의 존재를 인식하게 하고 이어 면역 반응을 일으키게 하는데, 현재 10여 개의 TLRs가 알려 져 있으며 그 중에서도 TLR4에 대한 연구가 많이 이루어져 있다.10 지질다당류는 그람 음성 세균의 외막 구성물질로 내독 소(endotoxin)로도 알려져 있는 TRLs의 ligand이다. LPS는 lipid A라 알려진 지방친화성 물질로 이루어진 열 안정 양친 매성 분자(amphiphilic molecule)로 이 lipid A 부분이 TLR4 를 활성화시킨다.10 TLRs는 LPS뿐만 아니라 DAMPs에 의해
서도 활성화된다고 알려져 있다. 내부에서 생성된 DAMPs (high mobility group protein b-1 [HMGB1], S100 protein, heat shock proteins, hyaluronan, fibronectin 등)는11 염증 이나 세포사에 의해 생성되는데, 몇 단계의 수정을 거쳐 TLRs를 활성화시키게 된다.12,13
쿠퍼 세포는 TLR4를 갖고 있으며 LPS에 활발히 반응한 다.14 간세포도 TLR4를 갖고 있지만 LPS에 대한 반응은 극히 제한적이고 약하다.15 HSC은 활성화되면 TLR4를 다량 표현 하는데 심지어 quiescent HSC도 TLR4를 다량 표현하고 있 다.9 이는 HSC이 LPS에 민감하다는 것을 의미하며 실제로 LPS에 의해 nuclear factor (NF)-B와 c-Jun N-terminal kinase (JNK) pathway의 활성화가 일어난다. 또한 LPS는 염 증 신호를 증폭시켜 HSC이 TGF-에 반응을 일으키도록 하 여 섬유화를 촉진시킨다.10
정상적 상황에서는 세균이나 세균이 합성한 물질들이 장을 통과해 간문맥으로 가기란 쉽지 않다. 장에서는 뮤신, IgA, antimicrobial factors, 장내 상피 세포간 단단한 결합, 림프 조직 등에 의해 이러한 이동을 억제한다.16 또한 담즙산이나 장내 세균 등이 해로운 세균의 번식을 방해함으로써 이러한 이동을 막고 있다.17 따라서 정상 설치류나 사람에서 간문맥이 나 혈액에서 LPS의 양은 극히 적다. 그러나 만성 간질환의 정도에 따라 LPS의 양은 증가하는데, 예를 들어 정상인에서 는 3 pg/mL 이하이지만 Child-Pugh class A는 4.9 pg/mL, B는 7.9 pg/mL, C는 10.2 pg/mL로 증가한다.18 만성 간질환
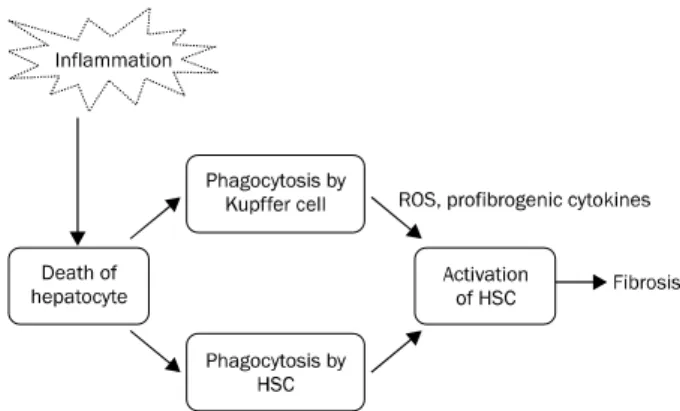
Fig. 2. Cell death by inflammation induces fibrosis. Cell death molecules including apoptotic bodies are engulfed and digested by HSC and Kupffer cell. This situation activated HSC and then produce excessive extracellular matrix including collagen. HSC, hepatic stellate cell; ROS, reactive oxygen species.
에서 이와 같이 혈액 내에 LPS가 증가하는 이유는 세균성 전 이가 증가하기 때문으로, 첫째로는 장내 상피 세포간의 치밀 연결(tight junction)의 소실로 세포간의 간격이 넓어지고 혈 액순환이 정체되어서, 둘째로는 상피세포의 점막의 방어인자 들이 소실되어서, 셋째로는 장 점막을 잘 투과할 수 있는 병적 장내 세균층이 변화해서 세균 전이가 증가한다.16 이렇게 장점 막을 잘 투과하는 세균들은 주로 그람 음성 세균들로, 대표적 인 것이 Escherichia coli, Klebsiella pneumoniae, entero- cocci, streptococci이다. 이들은 이미 간경변 환자에서 감염 증을 일으키는 것으로 잘 알려진 균주이다.19 이러한 균주의 세포외피는 LPS를 포함하고 있고 이 LPS가 결국 TLR4를 활 성화시킨다.
알코올 간질환 역시 간경변증의 중요 원인인데 그 병리기 전에 LPS와 TLR4가 깊숙이 관여하고 있다. 그 증거로는 첫 째, 알코올 섭취가 장내 상피세포의 방어막을 손상시켜 투과 성을 증가시키고 결국 세균전이를 증가시켜 간문맥 내에 내독 소를 증가시키고,20,21 둘째, 항생제나 Lactobacillus에 의해 장내 그람 음성세균이 억제되면 간손상이 완화되며,22,23 셋째, 마우스의 비기능적 TLR4는 내독소의 증가에도 불구하고 염 증 사이토카인의 감소와 간손상을 억제하고,24 마지막으로 렛 트에게 오랜 기간의 알코올을 투여하면 LPS와 종양괴사인자 (TNF-)를 증가시켜 간손상을 유발한다는 데이터들이다.25
비알코올 지방간에서도 LPS와 TLR4의 연관성이 알려져 있는데, 고지방식이는 장내 상피세포의 tight junction에 손 상을 주고 장내 세균층의 변화를 유발하여 세균전이를 일으켜 간에 염증과 손상을 유발한다.4,26 이와 같이 알코올 간질환 및 비알코올 간질환에서도 TLRs의 활성화를 통해 염증과 간 섬유화가 유도된다.
(2) 세포사(cell death): 염증으로 인한 세포사는 간섬유화 의 시발점이자 가장 중요한 최상위 신호이다. 세포가 사멸하 면서 남기는 DAMPs나 apoptotic body는 대식세포뿐만 아니 라 HSC에 의해 탐식되어 섬유화를 촉진시키게 된다(Fig. 2).2 Apoptotic bodies는 대식세포에 의해 탐식되어 TGF-를 상 향조절(upregulation)시키고, HSC에 탐식되어 TGF-뿐만 아니라 collagen-1(I) mRNA를 상향조절시킨다.27 죽은 세포 에서 분비되는 이러한 DAMPs는 현재 25개 이상의 후보물질 이 있으며 그 중의 하나가 DNA이다.11 이 DNA는 TLR-9을 통해 HSC을 활성화시킨다. DNA 외에 또 다른 DAMPs 중의 하나는 inflammasome이라 불리는 cytosolic protein com- plex로,28 HSC로 하여금 세포가 죽었다는 것을 인지하게 하 는 기능을 한다.29
(3) 저산소증: 간세포는 많은 에너지를 써야 하는 세포이기 때문에 저산소증에 취약하다.30 따라서 저산소증은 간에서 세 포손상의 중요한 인자로, 만성 간질환에서는 혈관구조가 변형
되고 또한 염증으로 인해 저산소증이 쉽게 유발된다.31 면역 반응 조절자인 NF-B는 저산소증에 의해 활성화되는데 hypo- xia inducible factor (HIF)-1이 여기에 관여하고 있다. HIF-1는 산소민감성 전사인자(oxygen-sensitive transcription factor)로
와 의 subunit로 구성되어 있으며(HIF-1와 HIF-1), vascular endothelial growth factor (VEGF), 적혈구 생성, 당대사, 세포의 분열과 생존을 촉진시킨다.31
일반적으로 간경변증에서는 간세포로의 산소공급이 저하 되어 있는데 그 이유로는 혈관 내 혈액 흐름에 대한 저항성의 증가, 간 내 단락의 형성, 혈관폐쇄 혈전의 형성, sinusoidal area의 감소, sinusoidal capillarization 등이 있다. 따라서 간경변 상태에서 이러한 저산소증으로 인해 혈관생성 인자들 이(VEGF 등) 상승되어 있고 실제로 신생 혈관들이 생성되는 데, 이는 간섬유화의 진행에 중요한 역할을 한다.31 이렇게 생 성된 VEGF는 혈관생성뿐만 아니라 HSC을 증식시키고 활성 화시키며, HSC을 끌어 모으는 역할을 하여 섬유화를 유발한
다.32,33 HSC도 저산소증에 의해 유발된 HIF-1을 통해 혈관생
성 인자인 VEGF 및 angiopoietin 1과 그들의 수용체를 발현 시킨다고 알려져 있다.33
2. 염증과 간세포암 1) HSC와 간세포암
염증 반응에 의해 활성화된 NF-kB는 HSC를 활성화시키 고, 간에 손상, 염증, 섬유화, 간세포암 생성에 관여하는 것으 로 알려져 있다.34 활성화된 HSC는 간섬유화뿐만 아니라 간 세포암의 발생과 진행에도 영향을 미친다.35 HSC는 간세포암 의 성장과 증식에 관여하는 간세포 성장인자(hepatocyte growth factor), interleukin-6 등을 분비하고,36 laminin-5 같 은 세포외기질(extracellular matrix component)에 의해 간
암세포의 이동과 증식을 돕는다.37 또한 세균 전이에 의한 LPS에 자극 받은 HSC는 epiregulin이라는 간세포의 분열 요 소(mitogenic factor)를 생산하는데, 이로 인해 간세포암이 발생하기도 한다.38
HSC와 간암 세포 간에 상호 crosstalk가 많이 있다고 보고 되고 있는데 이런 crosstalk의 결과로 HSC가 VEGF를 만들 어 혈관 형성(angiogenesis)을 유발하기도 하고, 암세포를 자 동력이 있는(motile) 표현형으로 변화시켜 전이를 유발하기도 하며, HSC에서 분비되는 TGF-는 간세포를 변형시켜 종양 세포로 분화하게 하기도 한다.39-41
2) 저산소증과 HIF
종양은 크기가 증가하고 대사가 활발해져 당 분해도 증가 하면서 저산소증에 빠진다. 이러한 저산소증으로 말미암아 HIF-1 및 HIF-1가 종양에서는 증가되는데 HIF-1의 기능 은 다음과 같다. 첫째, 당 분해를 증가시켜 종양이 필요로 하 는 에너지원인 adenosine triphosphate (ATP)를 공급한다.
둘째, DNA 복구를 억제한다. 셋째, TGF-나 insulin-like growth factor (IGF)-2같은 성장인자를 분비시켜 암세포의 성장과 전이를 촉진시킨다. 마지막으로, HIF-1를 통해 혈관 생성인자인 VEGF, fibroblast growth factor (FGF)-2, IGF-1 등을 생성하여 암세포로의 영양 공급을 증대시킨다.31
결 론
지속적 염증은 간섬유화를 일으키고 이로 인해 간경변이 발생하게 되면 섬유화에 기여한 몇 가지 기전들이 계속 작용 해 결국 간세포암을 발생시키고 암세포의 성장을 촉진시킨다.
현재 바이러스성 간염에서는 간에 지속적 염증을 유발하는 바 이러스를 항바이러스제로 치료하여 간경변의 발생을 억제하 기도 하고 심지어 간경변증의 역전(reversal)을 가져오기도 한 다.42 또한 간경변 환자에서도 항바이러스제는 염증을 억제하 여 간세포암의 발생을 억제한다고 알려져 있다.43,44 그러나 염 증을 직접 억제하거나 간섬유화의 진행에 직접 관여하여 간경 변을 억제하는 약제는 아직 개발되어 있지 않은데, 그 이유는 이러한 기전 및 신호전달체제가 정상 항상성(homeostasis)에 도 필요하기 때문이다. 향후 정상 항상성을 방해하지 않고 병 적인 염증이나 섬유화에만 선택적으로 작용할 수 있는 약물이 개발된다면 염증에서 시작된 여러 문제들을 해결할 수 있는 길이 열릴 것이다.
REFERENCES
1. Seki E, Schwabe RF. Hepatic inflammation and fibrosis: func- tional links and key pathways. Hepatology 2015;61:1066-1079.
2. Luedde T, Kaplowitz N, Schwabe RF. Cell death and cell death re-
sponses in liver disease: mechanisms and clinical relevance.
Gastroenterology 2014;147:765-783.e764.
3. Pradere JP, Kluwe J, De Minicis S, et al. Hepatic macrophages but not dendritic cells contribute to liver fibrosis by promoting the survival of activated hepatic stellate cells in mice. Hepatology 2013;58:1461-1473.
4. Wynn TA, Barron L. Macrophages: master regulators of in- flammation and fibrosis. Semin Liver Dis 2010;30:245-257.
5. Bataller R, Brenner DA. Liver fibrosis. J Clin Invest 2005;115:
209-218.
6. Friedman SL, Arthur MJ. Activation of cultured rat hepatic lip- ocytes by Kupffer cell conditioned medium. Direct enhancement of matrix synthesis and stimulation of cell proliferation via in- duction of platelet-derived growth factor receptors. J Clin Invest 1989;84:1780-1785.
7. Melhem A, Muhanna N, Bishara A, et al. Anti-fibrotic activity of NK cells in experimental liver injury through killing of activated HSC. J Hepatol 2006;45:60-71.
8. Jeong WI, Park O, Suh YG, et al. Suppression of innate immunity (natural killer cell/interferon-) in the advanced stages of liver fibrosis in mice. Hepatology 2011;53:1342-1351.
9. Seki E, De Minicis S, Osterreicher CH, et al. TLR4 enhances TGF-beta signaling and hepatic fibrosis. Nat Med 2007;13:
1324-1332.
10. Pradere JP, Troeger JS, Dapito DH, Mencin AA, Schwabe RF.
Toll-like receptor 4 and hepatic fibrogenesis. Semin Liver Dis 2010;30:232-244.
11. Kono H, Rock KL. How dying cells alert the immune system to danger. Nat Rev Immunol 2008;8:279-289.
12. Beutler B. Neo-ligands for innate immune receptors and the eti- ology of sterile inflammatory disease. Immunol Rev 2007;220:
113-128.
13. Lotze MT, Zeh HJ, Rubartelli A, et al. The grateful dead: damage- associated molecular pattern molecules and reduction/oxida- tion regulate immunity. Immunol Rev 2007;220:60-81.
14. Su GL, Klein RD, Aminlari A, et al. Kupffer cell activation by lip- opolysaccharide in rats: role for lipopolysaccharide binding pro- tein and toll-like receptor 4. Hepatology 2000;31:932-936.
15. Matsumura T, Degawa T, Takii T, et al. TRAF6-NF-kappaB path- way is essential for interleukin-1-induced TLR2 expression and its functional response to TLR2 ligand in murine hepatocytes.
Immunology 2003;109:127-136.
16. Wiest R, Garcia-Tsao G. Bacterial translocation (BT) in cirrhosis.
Hepatology 2005;41:422-433.
17. Wells CL, Maddaus MA, Reynolds CM, Jechorek RP, Simmons RL.
Role of anaerobic flora in the translocation of aerobic and facul- tatively anaerobic intestinal bacteria. Infect Immun 1987;55:
2689-2694.
18. Lin RS, Lee FY, Lee SD, et al. Endotoxemia in patients with chronic liver diseases: relationship to severity of liver diseases, presence of esophageal varices, and hyperdynamic circulation. J Hepatol 1995;22:165-172.
19. Tandon P, Garcia-Tsao G. Bacterial infections, sepsis, and multi- organ failure in cirrhosis. Semin Liver Dis 2008;28:26-42.
20. Bjarnason I, Peters TJ, Wise RJ. The leaky gut of alcoholism: pos- sible route of entry for toxic compounds. Lancet 1984;1:179-
182.
21. Draper LR, Gyure LA, Hall JG, Robertson D. Effect of alcohol on the integrity of the intestinal epithelium. Gut 1983;24:399-404.
22. Nanji AA, Tahan SR, Wei Y, Sadrzadeh SM. Hepatic sinusoidal en- dothelial cell G1/S arrest correlates with severity of alcoholic liv- er injury in the rat. Gastroenterology 1994;107:818-823.
23. Adachi Y, Moore LE, Bradford BU, Gao W, Thurman RG.
Antibiotics prevent liver injury in rats following long-term ex- posure to ethanol. Gastroenterology 1995;108:218-224.
24. Uesugi T, Froh M, Arteel GE, Bradford BU, Thurman RG. Toll-like receptor 4 is involved in the mechanism of early alcohol-induced liver injury in mice. Hepatology 2001;34:101-108.
25. Hansen J, Cherwitz DL, Allen JI. The role of tumor necrosis fac- tor-alpha in acute endotoxin-induced hepatotoxicity in etha- nol-fed rats. Hepatology 1994;20:461-474.
26. Cani PD, Bibiloni R, Knauf C, et al. Changes in gut microbiota con- trol metabolic endotoxemia-induced inflammation in high-fat di- et-induced obesity and diabetes in mice. Diabetes 2008;57:
1470-1481.
27. Canbay A, Taimr P, Torok N, Higuchi H, Friedman S, Gores GJ.
Apoptotic body engulfment by a human stellate cell line is profibrogenic. Lab Invest 2003;83:655-663.
28. Martinon F, Mayor A, Tschopp J. The inflammasomes: guardians of the body. Annu Rev Immunol 2009;27:229-265.
29. Watanabe A, Sohail MA, Gomes DA, et al. Inflammasome-medi- ated regulation of hepatic stellate cells. Am J Physiol Gastrointest Liver Physiol 2009;296:G1248-G1257.
30. Martin H, Sarsat JP, Lerche-Langrand C, et al. Morphological and biochemical integrity of human liver slices in long-term culture:
effects of oxygen tension. Cell Biol Toxicol 2002;18:73-85.
31. Rosmorduc O, Housset C. Hypoxia: a link between fibrogenesis, angiogenesis, and carcinogenesis in liver disease. Semin Liver Dis 2010;30:258-270.
32. Yoshiji H, Kuriyama S, Yoshii J, et al. Vascular endothelial growth factor and receptor interaction is a prerequisite for murine hep- atic fibrogenesis. Gut 2003;52:1347-1354.
33. Novo E, Cannito S, Zamara E, et al. Proangiogenic cytokines as hypoxia-dependent factors stimulating migration of human hep-
atic stellate cells. Am J Pathol 2007;170:1942-1953.
34. Luedde T, Schwabe RF. NF-κB in the liver--linking injury, fibrosis and hepatocellular carcinoma. Nat Rev Gastroenterol Hepatol 2011;8:108-118.
35. Friedman SL. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiol Rev 2008;88:125-172.
36. Kang N, Gores GJ, Shah VH. Hepatic stellate cells: partners in crime for liver metastases? Hepatology 2011;54:707-713.
37. Santamato A, Fransvea E, Dituri F, et al. Hepatic stellate cells stimulate HCC cell migration via laminin-5 production. Clin Sci (Lond) 2011;121:159-168.
38. Dapito DH, Mencin A, Gwak GY, et al. Promotion of hepatocellular carcinoma by the intestinal microbiota and TLR4. Cancer Cell 2012;21:504-516.
39. Coulouarn C, Clément B. Stellate cells and the development of liver cancer: therapeutic potential of targeting the stroma. J Hepatol 2014;60:1306-1309.
40. Coulouarn C, Corlu A, Glaise D, Guénon I, Thorgeirsson SS, Clément B. Hepatocyte-stellate cell cross-talk in the liver en- genders a permissive inflammatory microenvironment that drives progression in hepatocellular carcinoma. Cancer Res 2012;72:2533-2542.
41. Mikula M, Proell V, Fischer AN, Mikulits W. Activated hepatic stel- late cells induce tumor progression of neoplastic hepatocytes in a TGF-beta dependent fashion. J Cell Physiol 2006;209:560- 567.
42. Shin SK, Kim JH, Park H, et al. Improvement of liver function and non-invasive fibrosis markers in hepatitis B virus-associated cir- rhosis: 2 years of entecavir treatment. J Gastroenterol Hepatol 2015. doi: 10.1111/jgh.13020. [Epub ahead of print]
43. Hosaka T, Suzuki F, Kobayashi M, et al. Long-term entecavir treat- ment reduces hepatocellular carcinoma incidence in patients with hepatitis B virus infection. Hepatology 2013;58:98-107.
44. Singal AK, Salameh H, Kuo YF, Fontana RJ. Meta-analysis: the im- pact of oral anti-viral agents on the incidence of hepatocellular carcinoma in chronic hepatitis B. Aliment Pharmacol Ther 2013;
38:98-106.