한국컴퓨터정보학회 동계학술대회 논문집 제22권 제1호 (2014. 1)
429
국제표준 기반의 임상정보 관리체계 구축에 관한 연구
최용정○
○한미아이티 파란연구센터 기획팀 e-mail : cyj740@hanmi.co.kr○
A Study on System for International Standard(IS) based Clinical Information Management
Yongjung Choi○
○Planning team, Blue R&D Center, HanmiIT
●
요 약●
국내 제약산업의 경쟁력을 제고시키기 위해서는 신약의 심사/허가 기간을 단축시켜 급변하게 변하는 글로벌 제약시장에서 경쟁 우위적 위치를 선점할 수 있도록 기회를 제공할 수 있도록 체계 개선이 시급하다. 신약허가를 위해서는 임상시험 결과에 대한 안전성과 유효성 등에 대한 심사가 수행되게 된다. 하지만 현재 신약허가를 위해서 제약사와 임상시험수탁기관(Contract Research Organization, CRO)에서 데이터 정보체계인 Domain, Variable 및 Parameter 등의 표준을 따르지 않고 다양한 유형 의 임상정보데이터를 심사기관에 제출하고 있어 이로 인한 심사기간 증가와 심사업무 비효율성을 야기시키고 있다. 따라서 본 연구에서는 국제민간기구인 CDISC (Clinical Data Interchange Standards Consortium)에서 제정한 글로벌 임상데이터 표준 인 CDISC 표준을 준용한 국내 임상시험정보관리 체계 (eCTD 시스템)및 의약품 전주기적 관리체계를 제시하고자 하며, 본 연 구를 통한 기대효과로는 국제표준의 임상정보관리 인프라 구축으로 인한 국내 신약개발 및 해외 진출 환경을 마련하여 글로벌 시장선점의 기회를 제공할 수 있고, 규제기관 차원에서는 의약품 허가, 심사업무의 효율성 증가는 물론 전주기적 의약품 안전관 리체계를 마련할 수 있을 것으로 사료된다.
키워드: 임상시험 정보관리(Clinical trial Information Management), CDISC표준(CDISC Standards), eCTD시스템 (electronic Common Technical Document system), MedDRA (Medical Dictionary for Regulatory Activities), WHO-ART (World Health Organization Adverse Reaction Terminology)
I. 서 론
신약허가를 받기 위해서는 비임상시험을 거쳐 임상시험에서 안전 성과 유효성을 인정받아야 하는데 임상시험을 통한 신약발굴시간이 길어질 수 있고, 경제적 이익 축소가 우려되어 신속한 신약판매를 위하여 다국적 제약회사는 임상시험 참여국가의 다각화를 통한 전 세계 동시 판매를 위해 노력하고 있는 중이다. 신약(New drug)의 평균개발기간은 10년에서 15년 사이로 소요되며 개발비용은 1억달 러에서 6억달러(약 1,200억원~7,200억원) 정도로 추정하고 있고,
의 성공확률을 가지고 있을 정도로 리스크(Risk)가 크지 만 신약개발 성공으로 인한 ‘1개품목당 연간매출액’은 8억달러~10 억달러(약 9,600억원~12,000억원) 및 ‘1개품목당 연간순이익’은 1.6억달러~3억달러(약1,600억원~3,600억원) 정도로 고부가가치를 창출하고 있는 신약개발을 위한 최적한 체계를 마련해야 할 것이다.
이와 같이, 신약개발을 통한 국가 제약산업 및 의약품 안전관리체 계에 대한 경쟁력을 제고시키기 위해서는 신약허가 기간을 단축하 여 신약개발기간을 단축시키는 것이며 첫째, 신속(Fast-track) 심사
를 위해서는 허가대상 신약의 안전성과 유효성을 검증하기 위한 데이터의 표준화가 필요하고, 둘째, 신약 허가 전 임상데이터 체계관 리 뿐만 아니라 허가 후 판매를 통해 사용되는 의약품에 대한 사후관 리체계도 일원화된 통합관리시스템으로 연계하여 관리해 나가야할 것이다. 따라서 본 연구에서는 제약산업의 국제경쟁력 제고 및 국민 들의 안전성을 보장하기 위한 규제기관의 의약품 전주기적 관리체 계 구축 방안을 제시하고자 한다.
II. 임상관련 표준
2.1 CDISC 표준
CDISC (Clinical Data Interchange Standards Consortium)는 제약회사(Sponsor), CRO (Contract Research Organization), 의 료정보처리기업, 연구소, 대학 등을 회원으로 하는 비영리단체로서 임상시험에 관련된 데이터 표준을 제공하는 것을 목적으로 조직되
한국컴퓨터정보학회 동계학술대회 논문집 제22권 제1호 (2014. 1)
430
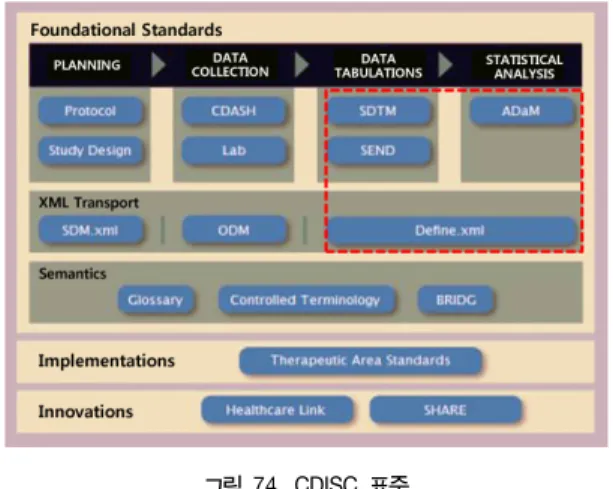
었다. 2004년 미국 식약청(FDA)이 임상시험데이터의 출원 포맷으 로 CDISC SDTM (Study Data Tabulation Model) 규격을 허용한 이후 임상시험센터 (CRC), CRO, 다국적 제약회사 등에서 CDISC 표준에 대한 많은 관심을 가지고 오고 있고, CDISC 표준들은 크게 임상데이터의 표준인 SDTM (Study Data Tabulation Model), 동 물임상시험데이터 즉 비임상데이터의 표준인 SEND (Standard for the Exchange of Nonclinical Data), 임상시험 분석데이터셋 표준 인 ADaM (Analysis Data Model) 및 임상시험 데이터 구조 일람 표준인 Define.xml 등으로 구분된다[6].
그림 74. CDISC 표준 Fig. 1. CDISC Standards
SDTM 표준은 임상데이터 전송을 위한 표준데이터 모델로 정의 되며 사람에 대한 임상시험 원시 데이터셋(data set)을 허가기관으 로 제출하기 위한 테이블 포맷의 구조 및 형식에 대한 표준이다.
SEND (Standard for the Exchange of Nonclinical Data) 표준은 비임상(동물) 시험의 데이터를 허가기관에 전자적으로 제출하기 위 한 표준으로서 SDTM의 비임상버전으로 정의할 수 있고 비임상 데이터 모델의 표준 변환방식은 허가기관에 제출되는 연구를 구조 화하고 동물독성시험으로부터의 비임상 데이터를 규격화한 것이다.
ADaM (Analysis Data Model) 표준은 임상시험의 분석 데이터 셋과 메타데이터의 표준형으로 분석 데이터셋은 분석 보고서 작성 을 위해 사용할 임상시험 데이터셋으로 정의되며 메타데이터는 분 석 데이터셋과 분석결과 정의 정보를 말하며, Define.xml 표준은 SDTM, SEND, ADaM 등을 허가기관에 제출 시에 요구되는 부속 문서이고 실체는 XML 파일이며 이 파일에는 제출 데이터셋의 내용 즉 데이터셋 일람, 데이터셋 내의 변수 일람, 코드리스 일람 등에 관한 설명이 기술되어 있다.
2.2 eCTD 시스템
ICH M4 전문가실무그룹(Expert Working Group, EWG)에서 공통기술문서(Common Technical Document, CTD)를 정의하였 고 ICH M2 EWG는 현재 문서에서 전자공통기술문서 (electronic Common Technical Document, eCTD)에 대한 사양을 정의하였 다. eCTD는 의약품 허가와 관련된 사업(제약, 벤처 등)에서 감독기 관(미국의 FDA, 유럽의 EMA, 일본의 PMDA)으로의 정보 전송에 대한 인터페이스로 정의되며 동시에 작성, 검토, 라이프사이클 관리,
보관을 고려하도록 설계되어져야 한다[1,2,3,7,9].
그림 75. eCTD 구조 Fig. 2. The Structure of eCTD System
eCTD는 총 다섯 가지의 모듈로 이뤄진 시스템으로서 'Module 1'은 M2-M5와는 달리 공통성보다는 각 국가마다의 상이한 행정서 류들로 정의되어 있다. eCTD 모듈별 내용을 살펴보면, 'Module1' 은 각 지역에 따라 요구되는 행정적인 내용, 현행 지역 규정에서 요구되는 심사자료 중 개발경위, 유사제품과의 비교, 외국의 사용현 황, CPP(의약품 제조판매증명서) 등의 내용이 포함되며, ‘Module2' 는 개요 및 요약으로 목차, 품질평가 요약, 비임상자료 개요 및 요약, 임상자료 개요 및 요약정보가 포함된다. 'Module3'는 품질평가보고 서가 포함되며 기준 및 시험방법과 안전성 시험자료가 이에 해당되 고 ’Module4'는 비임상보고서가 포함되며 안전성/유효성 심사자료 중 독성과 약리작용에 관한 자료가 포함되며 ‘Module5'에서는 임상 보고서가 포함되며 안전성/유효성 심사자료 중 임상시험성적에 관 한 자료가 포함되도록 구현되어야 한다.
2.3 MedDRA와 WHO-ART
의학적 코딩(Medical coding)은 임상시험을 진행하면서 수집되 는 이상반응, 병력, 약물의 자료를 분류하고 범주화하는 과정이며 이 과정에서 이상반응에는 MedDRA (Medical Dictionary for Regulatory Activities), WHO-ART (World Health Organization Adverse Reaction Terminology) 등이 사용되고, 병력에는 MedDRA, 질병분류체계 (International Classification of Disease, ICD) 등, 약물에는 ATC코드, KIMS 분류, 보건복지부 분류 등의 표준용어분류체계가 사용될 수 있다[5,8,10].
그림 76. MedDRA (v14.0) 및 WHO-ART 구조 (2011/2) Fig. 3. The Structure of MedDRA (v14.0) and WHO-ART
(2011/2)
한국컴퓨터정보학회 동계학술대회 논문집 제22권 제1호 (2014. 1)
431
III. 임상정보 관리체계 구축방안
제약사와 CRO의 임상데이터 관리프로세스는 <그림 4>와 같다.
먼저 데이터 관리계획을 수립하고 DB설계 후 DB를 검증한다. DB 검증 후 데이터를 입력하고 쿼리생성, 데이터 수정 및 불일치율을 파악 후 DB품질을 점검한다. 받아들일 수 있는 에러율 이하이면 DB 잠금(Locking) 후 임상정보 심사 및 신약허가를 수행하는 규제 기관(식약처)으로 데이터셋(dataset)을 전송하는 임상데이터 관리프 로세스를 가지고 있다.
그림 77. 임상데이터 관리프로세스 Fig. 4. Process of Clinical Data Management
신약개발의 심사 및 허가기간을 단축시키고 심사자의 심사업무의 효율성을 제고시키기 위해서는 <그림 5>와 같은 CDISC 기반의 eCTD 시스템을 허가기관에서 구축하여 의약품의 전주기적 안전관 리체계를 마련하여 제약사의 경쟁력 제고는 물론 소비자들의 안전 성을 제고시켜 나가야 한다.
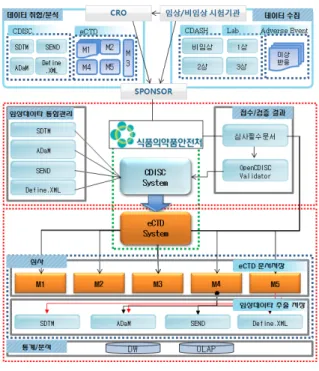
그림 78. 임상정보관리 목표시스템
Fig. 5. The Goal System for Clinical Information Management
구체적으로 살펴보면, CDISC 표준을 준용하여 제약사 또는 CRO업체에서는 표준화된 임상정보 데이터를 신약 허가기관인 식 약처의 CDISC 시스템에 제출하여야 한다. 제출된 임상정보 데이터 는 CDISC 임상정보 밸리데이터 (validator)에서 에러 유무를 파악 하게 된다. 여기서 에러의 유형은 Error, Warning, Notice 등 세 가지로 분류되어지며 Error가 발생했을 시에는 해당 제약사 또는 CRO업체에게 재검토를 요청해야 하며, Warning과 Notice는 심사 자들이 받아들여질 수 있는 수준인지의 여부로 판단되어진다. Error 가 발생하지 않은 임상정보 데이터는 eCTD 시스템의 임상정보 데 이터 저장 모듈인 Module 5에 저장되고, 비임상정보 데이터는 Module 4에 저장된다. 임상정보 데이터 외에 행정서류 및 연구결과 보고서 등은 Module 1에서 Module 5에 저장된다. eCTD 시스템에 저장된 데이터 및 문서들도 eCTD 밸리데이터(validator)를 통해서 문서의 유형이 PDF인가, 문서의 구조에 문제가 없는지 등을 검증받 게 된다. 심사자는 신약허가를 위해서 eCTD 시스템에 저장된 임상 정보 데이터, 결과보고서 및 행정서류 등을 검토한 후 신약에 대한 허가유무를 결정하게 된다.
이와 같이, 신약허가를 위해서 저장된 임상정보 데이터를 관리할 수 있게 됨에 따라 의약품 전주기적 안전관리체계를 마련할 수 있는 초석을 제공해준다. 즉 의약품의 시판 전 임상 정보데이터와 시판 후 이상반응 데이터를 관리할 수 있어 문제발생 시 실시간 대응이 가능할 수 있도록 철저한 의약품관리체계가 마련될 수 있다. 향후 국내 임상정보관리체계의 경쟁력을 제고시키기 위한 단계별 구축방 안은 <그림 6>과 같다.
한국컴퓨터정보학회 동계학술대회 논문집 제22권 제1호 (2014. 1)
432
그림 79. 국내 임상정보관리체계 단계별 구축방안 Fig. 6. The Scheme of Clinical Information Management
System by step
IV. 결 론
국내의 신약심사/허가를 위한 임상정보 데이터의 비표준화 및 심사 전과정에서 요구되는 심사서류들에 대한 시스템 미구축으로 인하여 신약시장에서의 국내 제약사들의 경쟁우위적 위치 선점이 힘들어 지고 있다. 따라서 본 연구에서는 국제민간기구인 CDISC (Clinical Data Interchange Standards Consortium)에서 제정한 글로벌 임상데이터 표준인 CDISC 표준을 준용한 국내 임상시험정 보관리 체계 (eCTD 시스템)및 의약품 전주기적 관리체계 구축을
위한 방안을 제시하였다. 본 연구를 통한 기대효과로는 국제표준의 임상정보관리 인프라 구축으로 인한 국내 신약개발 및 해외 진출 환경을 마련하여 글로벌 시장선점의 기회를 제공할 수 있고 규제기 관 차원에서는 의약품 허가 및 심사업무의 효율성 증가는 물론 전주 기적 의약품 안전관리체계를 마련할 수 있을 것이다.
참고문헌
[1] European Union(EU), "EU Region eCTD Validation Criteria version 3.4," February 2012
[2] Health Canada, "Guidance For Industry: Preparation of Drug Submissions in Electronic Common Technical Document (eCTD) Format," 2009.
[3] Health Canada, "Health Canada eCTD Validation Rules,"
2013.
[4] Jurgen Kubler et al., "Adverse Event Analysis and MedDRA:
Business as Usual or Challenge?." Drug Information Journal, Vol. 39, pp.63-72, 2005.
[5] MedDRA, http://www.meddramsso.com [6] OpenCDISC, http://www.opencdisc.org
[7] Therapeutic Goods Administration(TGA)/Australian Government Department of Health and Ageing, "Guidance for Industry on Providing Regulatory Submissions for Prescription Medicines in Electronic Format (eCTD) in Australia," 2009.
[8] UMC report, "The WHO Adverse Reaction Terminology - WHO-ART, Terminology for coding clinical information in relation to drug therapy," 2005.
[9] US Food and Drug Adminstration, "Specification for eCTD Validation Criteria," 2011.
[10] World Health Organization (WHO), MedDRA introductory Guide Version 14.0, 2011.