香砂平胃散 藥鍼液의 자유기 소거활성 및 혈관내피세포의 산화적 손상에 대한 보호효과
임선희1⋅이효승1⋅문진영1
1동국대학교 한의과대학 경혈학교실
Free radical scavenging activity of hyangsapyungwisan extract for herbal-acupuncture and protective effects against oxidative damage of
HUVECs
Sun-Hee Lim1, Hyo-Seung Yi1, Jin-Young Moon1
1Department of Meridian & Acupoint, College of Oriental Medicine, Dongguk University Abstract
Objectives : Hyangsapyungwisan (HPS) has been used for treatment of cardiovascular diseases including of arthralgia, myalgia in traditional Korean medicine. However, the medical actions of HPS have not been clearly investigated. The aim of this study was to elucidate the antiradical and antioxidant activity of the extract for herb-acupuncture (HPS-HA) obtained from HPS.
Methods & Results : HPS-HA exhibited a stronger inhibition rate (55.5%) on lipid peroxidation of rat liver homogenate induced by FeCl2-ascorbic acid. In addition, HPS-HA markedly interfered with hydroxyl radical generation through iron ions chelating action. While pro-oxidant effect of HPS-HA was nearly undetectable at concentrations of 0.5-10㎎/mL.
Moerover, HPS-HA revealed a potent antiradical activities on 2,2-diphenyl-1-picryl-hydrazyl (DPPH) radicals, superoxide anions, nitric oxide and peroxynitrite. Furthermore, HPS-HA inhibited copper‐ and AAPH‐mediated oxidation of human low‐density lipoprotein (LDL), and also suppressed the relative electrophoretic mobility of LDL. HPS-HA showed strong protective activity against oxidative damage of HUVECs induced by SIN-1.
Conclusions : These results suggest that HPS-HA may be effective in protecting against oxidative diseases.
Key words : Hyangsapyungwisan, antioxidant, lipid peroxidation, HUVECs
Ⅰ. 서 론
생체내에서 superoxide anion (O2․-
), hydrogen peroxide (H2O2), hydroxyl radical (․OH) 등의 활성산소종 (reactive oxygen species : ROS)과 nitric oxide (․NO), peroxynitrite
⋅교신저자 : 문진영, 경상북도 경주시 석장동 707번지 동국대학교 한의과대학 경혈학교실, Tel. 054-770-2665, Fax.
054-770-2649, E-mail: ampmoon@dongguk.ac.kr
⋅ 이 논문은 동국대학교 학술지원 사업비 및 2005년도 정부 (과학기 술부)의 재원으로 한국과학재단의 지원으로 수행되었음 (No.
R13-2005-013-01000-0).
⋅투고 : 2008/02/04 심사 : 2008/03/07 채택 : 2008/03/21
(ONOO-) 등과 같은 활성질소종 (reactive nitrogen species : RNS)의 과다한 생성은 지질의 과산화, 특히 low-density lipoprotein (LDL)의 산화적 변형을 유발함으로써 동맥 경화와 같은 심혈관계 질환의 초기 발병과 진행에 중요한 역할을 한다고 알려져 있다
1). 이와 관련한 세포 및 동물 모델을 이용 한 연구결과, 과산화지질 및 산화 LDL은 혈관내피세포의 손상을 야기하며, 세포간부 착인자의 유도와 포말세포(foam cell)의 형 성 등을 통하여 동맥경화를 일으키는 핵심 적 요인이라고 인식되고 있다2-4). 한편, 이러 한 산화적 손상으로 인한 동맥경화 및 심장 발작의 위험성을 최소화 하는데 있어서 항 산화제는 유용한 기능을 한다고 알려져 있 다. 따라서 동맥경화의 치료를 위하여 천연 물로부터 유효한 항산화제의 탐색에 많은 관심이 집중되고 있으며5) 최근의 연구에 의 하면 vitamin E가 실험적 동맥경화의 진행 억제에 유효하다고 보고된바 있다6).
본 연구에 활용된 香砂平胃散은 平胃散을 基本方으로 하여 香附子, 木香, 砂仁을 비롯 한 다섯 가지 藥物을 加味한 處方으로 萬病 回春7)에 최초로 수록되어, 傷食, 食鬱證, 食 積泄, 停食嘔吐, 呑酸吐酸, 嘈雜, 瘀血 및 食 積으로 인한 腹痛, 食積 脇痛 등의 치료에 사용된다 하였다. 또한 韓方 臨床에서는 平 胃散, 香砂養胃湯과 더불어 心痛의 치료에도 활용되고 있다. 한편 香砂平胃散은 ICR계 생쥐에 이식된 sarcoma-180 종양세포의 성 장을 억제하고 자연살해세포(NK cell)와 림 프구의 활성을 높임으로써 항암 및 면역증 강 효능을 나타낸다고 보고된 바 있다8). 그
러나, 현재까지 香砂平胃散 藥鍼液의 자유기 소거능, 지질과산화 억제능 및 동맥경화의 주된 발병 기전인 혈관내피세포의 산화적 손상에 대한 보호 효능에 대한 연구는 미흡 한 실정이다. 따라서 본 연구에서는 香砂平 胃散 藥鍼液의 항산화 및 항동맥경화 효과 를 검토하기 위하여, 지질과산화, 활성산소 종 및 활성질소종, LDL의 산화적 변형 및 혈관내피세포의 산화적 손상에 대한 효과를 관찰하여 유의한 결과를 얻었기에 보고하는 바이다.
Ⅱ. 실험재료 및 방법 1. 시약
Deoxyribose, L-ascorbic acid, 1,1-diphenyl-2- picrylhydrazyl (DPPH), EDTA, hydrochloride, hydrogen peroxide (H2O2), hypoxanthine, linoleic acid, nitro blue tetrazolium (NBT), trichloroacetic acid (TCA), 2-thiobarbituric acid (TBA), tris[hydroxymethyl] aminomethane, xanthine oxidase, 3-morpholinosydnonimine (SIN-1), 4,5-diaminofluorecein (DAF-2)는 Sigma사 (St. Louis, Mo, USA)에서 구입하 였다. Agarose, ethidium bromide (EtBr)과 6X orange-blue dye는 Promega사 (Promega, Madison, WI) 제품을 이용하였으며, 그 외 에 사용한 시약들은 모두 Merck (Merck KGaA, Germany)사 및 Junsei사(Japan)의 특급 제품을 구입하여 사용하였다.
2. 실험동물 및 세포배양
본 실험에 간조직 균질액의 조제를 위해 4주령의 수컷 Sprague Dawley계 흰쥐(체중 140±20g)를 Orient Bio.(성남시, 한국)로부터 구입하여 동물사육 항온항습기 (LS-2105, LS TECH, 한국)에서 일정한 조건 (온도 : 24±2℃, 습도 : 60±5%)에 7일간 적응시켰고 물과 사료는 자유롭게 섭취하도록 하였다. 한 편 혈관내피세포인 human umbilical vein endothelial cell line (HUVEC)은 MCTT (MC1133, Seoul, Korea)로부터 구입하였으며, Cambrex (Walkersville, MD)로부터 구입한 endothelial cell basal medium-2 (EBM-2) 배지를 사용하여 5% CO2, 37℃의 조건에서 배양하여 실험에 사용하였다.
3. 약재 및 처방조성
약재는 동국대학교 한방병원에서 구입한 것을 사용하였고, 香砂平胃散 (Hyangsapyungwisan) 의 처방구성은 『方藥合編』9)에 준하였으며, 약재의 조성 및 1첩의 용량은 다음과 같다 (Scheme 1).
Scheme 1. Component of Hyangsapyungwisan Herbal Composition Unit (g) 蒼 朮 Atractylodis rhizoma 8.0 陳 皮 Aurantii nobilis Pericarpium 4.0
香附子 Cyperi Rhizoma 4.0
枳 實 Ponciri Fructus 3.2 藿 香 Agastachis Herba 3.2 厚 朴 Machili cortex 2.8 砂 仁 Amomi Semen 2.8 木 香 Helenii Radix 2.0 甘 草 Glycyrrhizae radix 2.0 Total Amount 32.0
4. 약침액 조제
향사평위산 약침액은 水提-알콜 沈法10)에 따라 조제하였다. 먼저 향사평위산 4첩 분량 (128g)을 조말하여 환류냉각관이 부착된 원 저 플라스크에 넣고, 증류수 1000mL을 가한 후, 3시간 전탕하여 추출하고 여과하였다.
여과액 중의 미량 침전물을 제거하기 위해 3,000rpm에서 10분간 원심분리하여 상층액 을 수거하였다. 상층액을 다시 감압 농축하 여 전량을 200mL로 조절한 다음, 이 농축액 에 99.9% ethanol을 가하여 75%, 85%, 95%
ethanol 용액이 되도록 하여 각각의 농도 단 계별로 침전물을 여별하였다. 최종 여별액의 산도를 pH 7.4로 조절한 후 저온에서 24시 간 방치한 다음, membrane filter (0.22㎛, Whatman, Germany)로 여과하였으며, 이를 동결건조 하여 최종 7.0g의 분말을 회수(회 수율 w/w : 5.47%)하여 향사평위산 약침액 (HPS-HA)으로 사용하였다.
5. Hydroxyl radical에 의한 간조직의 지 질과산화 억제효과 측정
1) 간조직 균질액 조제
간조직 균질액을 만들기 위하여 흰쥐를 diethyl ether로 가볍게 마취한 다음, 복피를 절개하여 0.15M KCl 완충용액을 간문맥으 로 관류시켜 간조직의 혈액을 제거하였다.
흡습지에서 수분을 제거한 간조직은 즉시 빙냉상태에서 조직균질기(Teflon Plotter Elvehiem Homogenizer, Glas-Col, USA)를 사용하여 완전히 균질화시켰으며 이를 12000rpm에서 20분간 원심분리하여 침전물
을 분리하였다. 간조직 균질액은 실험에 사 용할 때까지 -70℃에서 보관하였다.
2) 과산화지질 함량 측정
지질과산화물의 함량은 Ohkawa의 TBA 법11)으로 측정하였다. 먼저 지질과산화 반응 을 유도하기 위하여 0.5mL의 간조직 균질액 에 50mM Tris-HCl (pH7.2) 0.1mL, 0.1 mM ascorbic acid 0.05mL, 4mM FeCl2 0.05 mL과 다양한 농도의 시료를 가한 다음, 3 7℃에서 1시간 배양하였다. 이 혼합액에 증 류수 0.9mL과 0.6% TBA 2mL을 가하여 잘 혼합하였다. 혼합물을 100℃ 항온수조에서 30분 동안 가열한 후, 냉각시키고, 즉시 5 mL의 n-butanol을 첨가하여 강하게 흔들어 주었다. 그리고 1000×g에서 10 분간 원심분 리하여 n-butanol 층을 얻었다. 분리된 상층 액의 흡광도를 532nm에서 측정하였으며 실 험에 사용된 간조직 균질액내의 단백질 함 량 측정은 bicinchoninic acid protein kit을 사용하여 분석 하였다.
6. Deoxyribose assay
Hydroxyl radical에 대한 향사평위산 약침 액의 소거효능은 Halliwell의 방법12)에 따라 측정하였다. 즉 hydroxyl radical에 대한 직접 적인 소거효과는 non-site-specific scavenging assay로 검토하였으며, 철 이온에 대한 킬레 이팅 효과는 site-specific scavenging assay로 관찰하였다. 따라 실험하였으며, 한편 향사 평위산 약침액의 전산화 유도효과 (pro- oxidant effect) 측정은 위의 방법을 일부 수
정하여 실험하였다.
1) Non-site-specific scavenging assay
먼저 0.1mM FeCl2, 0.1mM EDTA, 1.5mM H2O2, 2.5mM deoxyribose 및 0.1mM ascorbic acid (pH7.4)로 조성된 reaction buffer 1mL에 50μL의 시료를 가한 후, 3 7℃에서 1시간 동안 반응시켰다. 그리고 0.025M NaOH를 사용하여 조제한 0.5%
TBA 1mL과 2.8% TCA 1mL을 첨가한 후, 80℃ 항온수조에서 30분간 정치하였다. 이 혼합물을 4℃에서 정치함으로써 반응을 정 지시킨 다음, 파장 532nm에서 흡광도를 측 정하였다.
2) Site-specific scavenging assay
향사평위산 약침액이 철이온을 chelating 함으로써 hydroxyl radical의 생성을 저해하 는 정도를 측정하는 실험은 non-site-specific scavenging assay에서 사용된 reaction buffer 에서 EDTA를 제거시킨 후, 나머지는 동일 한 방법으로 실험하였다.
3) 전산화 유도 억제효과
Fe3+-EDTA complex가 Fe2+-EDTA complex 로 활성화됨으로써 산화가 진행되는 것에 대한 향사평위산 약침액의 영향을 확인하기 위하여, non-site-specific assay에 사용된 혼 합물에 ascorbic acid를 제외하고 나머지는 동일한 방법으로 실험하였다.
7. DPPH radical 소거능 측정
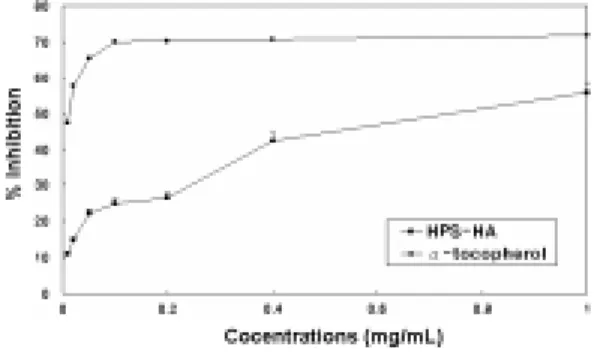
DPPH radical에 대한 소거능은 Gyamfi 등의 방법13)에 따라 측정하였다. 먼저 농도 별 시료 및 양성대조물질 50μL에 0.1mM DPPH ethanol 용액 1mL과 50mM Tris-HCl buffer (pH7.4) 450μL를 가하여 잘 혼합하였다. 혼합물을 실온에서 30분간 정치한 다음, spectrophotometer (UltroSpec 6300 Pro, Amersham, UK)를 이용하여 파 장 517nm에서 흡광도를 측정하였다. 본 실 험에서는 양성대조군으로 ascorbic acid와 tocopherol을 사용하였으며, DPPH radical의 소거효과를 % inhibition로 환산하여 표기하 였다.
8. Superoxide radical 소거능 측정
Superoxide radical 소거활성은 Gotoh와 Niki의 방법14)을 일부 수정하여 측정하였다.
먼저 농도별 시료와 양성대조물질인 caffeic acid에 EDTA (30mM, pH7.4) 100μL를 가 한 다음, 50mM NaOH와 1.42mM NBT에 용해된 30mM hypoxanthine 10μL를 첨가하 였다. 반응용액을 실온에서 3분간 정치한 다 음, 0.5U/mL xanthine oxidase l00μL를 가한 후, 실온에서 20분간 반응을 유도하였다. 이 반응용액의 흡광도를 560nm 파장에서 측정 하였고, 결과는 superoxide radical에 의한 NBT reduction의 % inhibition 수치로 환산 하여 표시하였다.
9. Nitric oxide 소거활성 측정
Nitric oxide의 소거능은 Sutherland 등의 방법15)에 의거하여 측정하였다. 먼저 DAF-2
용액을 제조하기 위하여, 1mg의 DAF-2를 0.55mL의 DMSO에 용해시키고, 이를 다시 50mM phosphate buffer를 사용하여 400배 (v/v)로 희석하였다. 농도별 시료 및 양성 대조물질인 ascorbic acid 10μL를 50mM phosphate buffer (pH7.4) 130μL와 각각 혼 합한 다음, 40mM SIN-1 10μL 및 DAF-2 용 액 50μL를 첨가하였다. 반응용액을 실온에서 10분간 배양한 다음, DAF-2와 NO의 반응에 의해 생성되는 triazolofluorescein의 형광강도 를 excitation 파장 (495nm) 및 emission 파 장(515nm)에서 측정하였다.
10. Peroxynitrite 소거활성 측정
Peroxynitrite의 소거능은 Crow의 방법16) 을 일부 수정하여 측정하였다. 즉 96-well microplate에 농도별 시료 10μL와 양성대조 군인 penicillamine을 가하였다. 여기에 50 mM sodium phosphate dibasic, 50mM sodium phosphate monobasic, 90mM sodium chloride 및 5mM potassium chloride 를 함유하는 rhodamine buffer (pH7.4) 175.8μL를 첨가한 다음, 5mM DTPA 4μL와 5mM DHR 123 0.2μL를 가한 후, peroxynitrite의 직접적 생성을 유발하기 위 하여 10μM ONOO-를 첨가하였다. 이 반응 액을 실온에서 10분간 정치시킨 다음, excitation (485nm)과 emission (530nm)의 파 장에서 형광강도를 측정하였으며, peroxynitrite 에 의한 DHR 123의 산화 정도를 % inhibition으로 환산하여 표기하였다.
11. LDL의 산화억제효과 측정
LDL 산화에 대한 향사평위산 약침액의 효능은 Xu 등의 방법17)에 의거하여 측정하 였다. 먼저 copper ion에 의한 LDL 산화 실 험을 위해, LDL (100μg protein/mL in PBS)을 다양한 농도의 향사평위산 약침액 과 양성대조군인 ascorbic acid와 혼합한 다 음, 10μM CuSO4를 가하여 산화를 유도하였 다. 37℃에서 4시간 동안 배양한 다음, LDL 의 산화 정도를 TBARS assay로 측정하였 다. 한편 AAPH로 유도된 LDL 산화 실험 을 위하여 LDL (100μg protein/mL in PBS)을 농도별 향사평위산 약침액과 양성 대조군인 accorbic acid와 혼합한 다음, 4mM AAPH를 첨가하여 산화를 유도하였 다. 이 반응액을 37℃에서 4시간 동안 배양 한 다음, 1mM EDTA를 가하여 반응을 정 지시킨 후, LDL의 산화 정도를 TBARS assay를 이용하여 측정하였다.
12. REM assay
본 실험에서는 copper ion으로 유도된 LDL 산화에 대한 향사평위산 약침액의 효 능을 보다 심도있게 검토하기 위하여 relative electrophoretic mobility (REM)를 Yoon 등의 방법18)에 따라 측정하였다. 먼저 LDL(120μg protein/mL in PBS)를 10μM CuSO4와 혼합하고, 여기에 농도별 향사평위 산 약침액과 양성대조군으로 0.01mM EDTA를 가하였다. 37℃에서 12시간 동안 배양한 다음, 3μg LDL protein을 TAE buffer (40mM Tris, 40mM acetic acid and
1mM EDTA)를 사용하여 0.7% agarose gel 상에서 1시간, 85V의 조건으로 loading하였 다. 전기영동 종료 후, gel을 Coomassie brilliant blue R-250을 사용하여 염색하였다.
13. MTT assay
향사평위산 약침액이 HUVEC 세포에 대 한 독성을 평가하기 위하여, MTT assay를 실시하였다. 먼저 96 well plate에 5 × 103 cells/well으로 세포를 seeding 하고 24 시간 동안 배양한 뒤 상등액인 배지를 제거하였 으며, 농도별 향사평위산 약침액을 배지에 희석하여 첨가하였다. 5% CO2, 37℃에서 다 시 24 시간 배양하고, 혈청이 첨가되지 않은 배지 180㎕에 phosphate buffered saline (PBS)으로 녹인 5㎎의 MTT를 20㎕ 더하 여 4시간 동안 배양함으로써 생존 세포내에 서의 crystal 형성을 유도하였다. 그 후, 96 well plate를 1,000rpm에서 10분간 원심분리 하였으며, 상등액인 MTT solution을 제거하 고 1:1 비율로 조성된 absolute ethanol과 dimethyl sulfoxide (DMSO) 150㎕를 처리하 고 20분 동안 교반하여 crystal을 용해 시켰 다. 흡광도는 micro plate reader (VersaMax, Molecular Devices社, USA)를 사용하여 파 장 570nm에서 측정하였다.
14. Dichlorofluorescein (DCF) assay
향사평위산 약침액이 HUVEC 세포의 산 화적 손상에 대한 보호효과를 검토하기 위 하여 본 실험에서는 Wang과 Joseph19), 그리 고 Rong 등의 방법20)을 일부 수정한 DCF
assay를 실시하였다. 먼저 HUVEC 세포를 96-well culture plates에 1×104 cells/well로 분주하고, 24시간 EGM-2 배지를 사용하여 배양한 다음, 배지를 제거하였다. EGM-2 배지(serum free)에 향사평위산 약침액을 농 도별로 0.1mg/mL, 0.5mg/mL, 1mg/mL 및 2mg/mL씩 가하고 37℃, 5% CO2의 조건에 서 12시간 동안 배양하였다. 배지를 제거한 다음, PBS buffer로 희석된 10μM DCFH-DA를 가한 다음, 45분간 배양하였 다. PBS buffer로 2회 washing한 다음, free radical generator 인 50μM SIN-1을 가하고, fluorescence microplate reader를 사용하여, excitation 파장 485nm와 emission 파장 535nm에서 형광강도를 10분 간격으로 총 90 분 동안 측정하였다.
15. 통계적 처리
실험결과의 통계처리는 SPSS (version 14.0 for Windows, SPSS Inc.) 프로그램을 사용하여 분석하였다. Student's t-test 법에 의해 구한 실험결과를 평균과 표준편차 (mean±standard deviation)로 표기하였으며, p-value가 0.05이하인 경우에 통계적 유의성 을 인정하였다.
Ⅲ. 실험결과
1. 지질과산화 억제 효과
HPS-HA의 항산화 효능을 검토하기 위하 여 흰쥐 간조직 균질액에 ascorbic acid와 FeCl2를 처리함으로써 hydroxyl radical에 의
한 지질과산화 반응을 유도하고, 농도별 (0-1mg/ml) HPS-HA의 지질과산화물 생성에 대한 억제 효과를 양성대조군인 tocopherol과 동일한 농도에서 비교 관찰하였다. 그 결과, HPS-HA는 농도 의존적인 지질과산화 억제 효과를 나타내었으며, 최소 10.99%에서 최 고 55.53%의 억제효능을 나타내었다. 반면, 동일한 농도 범위내에서 양성대조군인 tocopherol은 최소 47.13%에서 최고 71.78%
의 높은 억제능을 나타내었다. 이 실험의 결 과에서, HPS-HA에서의 지질과산화 억제효 과가 tocopherol에 비하여 다소 낮게 나타났 으나, 동일한 농도 조건에서 단일성분과 복 합처방의 비교 실험임을 감안하면 향사평위 산 약침액은 비교적 강한 항산화능이 있음 을 알 수 있었다(Fig. 1).
Fig. 1. Inhibitory effects of HPS-HA and tocopherol on MDA production in rat liver homogenate induced by FeCl2-ascorbic acid in vitro.
MDA data are presented as mean ± S.D. (n=3).
2. Hydroxyl radical 생성 억제능 및 소거능
본 실험에서는 hydroxyl radical에 대한 HPS-HA의 생성 억제능을 검토하기 위하여 site-specific assay를 통해 관찰하였다. 농도 별 (0-10 mg/ml) HPS-HA를 처리한 결과,
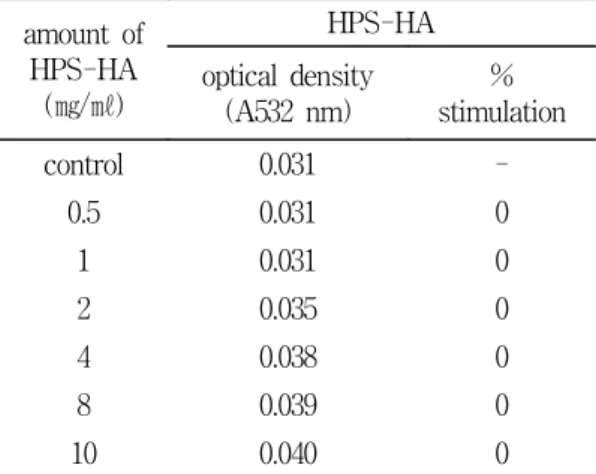
최소 7.1%에서 최고 70.4%의 생성 억제능 을 나타내었다(Fig. 2). 한편, hydroxyl radical에 대한 HPS-HA의 직접적인 소거능 을 알아보기 위하여, non-site-specific assay 를 통하여 관찰한 결과, 농도별 (0.5-10 mg/ml) HPS-HA는 최소 21.4%서 최고 35.9%의 소거능을 나타내었다(Fig. 2). 이 실험의 결과에서, HPS-HA는 hydroxyl radical을 직접적으로 소거하는 능력보다, 철 이온을 chelating함으로써 hydroxyl radical의 생성을 저해하는 효과가 상대적으로 강함을 알 수 있었다. 반면, HPS-HA가 자체적으로 산화를 유도하는지에 대한 여부를 전산화 실험( pro-oxidant assay)을 통하여 검토하 였다. 그 결과, 농도별 HPS-HA에서 유의할 만한 산화 유도 효과는 관찰되지 않았다 (Table 1).
Fig. 2. Inhibitory activity on hydroxyl radical- mediated deoxyribose degradation.
Hydroxyl radicals were generated by Fenton's reaction using a deoxyribose assay system, and the non-site- specific ( ) and site-specific ( ) scavenging activities of hydroxyl radicals by HPS-HA were expressed as the inhibition % . The concentrations of HPS-HA tested ranged from 0.5 to 10㎎/㎖. The results are the means of three separate experiments.
Table 1. Pro-oxidant activity of HPS-HA on iron-dependent hydroxyl radical generation.
amount of HPS-HA
(㎎/㎖)
HPS-HA optical density
(A532 nm)
% stimulation
control 0.031 -
0.5 0.031 0
1 0.031 0
2 0.035 0
4 0.038 0
8 0.039 0
10 0.040 0
Experiments were conducted essentially as described by Materials and Methods, except that ascorbic acid was omitted. The results are the mean values of three separate experiments.
3. DPPH free radical 소거 활성
본 실험에서는 HPS-HA의 전자 공여능을 규명하기 위하여, DPPH radical에 대한 소 거능 측정을 통해 관찰하였으며, 양성대조군 으로 tocopherol 및 ascorbic acid를 사용하 여 비교 검토하였다. 본 실험의 결과, HPS-HA는 농도 의존적인 DPPH radical 소거능을 나타내었다. 특히 HPS-HA를 농 도별 (0-0.5mg/ml)로 처리하였을 때, 최소 10.76%에서 최고 79.37%의 강한 소거활성이 관찰되었다. 한편, 동일한 농도조건에서 양 성대조군인 tocopherol은 최소 14.04%에서 최고 80.23%의 소거능이 관찰되었으며, ascorbic acid에서는 최소 15.70%에서 최고 85.28%의 높은 소거활성이 관찰되었다. 이 실험의 결과에서, HPS-HA는 단일성분으로 구성된 양성대조군에 비해 다소 낮은 소거 능을 보였으나, HPS-HA가 복합 처방임을
감안한다면 매우 높은 전자 공여능을 지닌 것으로 판단된다 (Fig. 3).
Fig. 3. DPPH radical scavenging activity of HPS-HA.
The direct scavenging activities of HPS-HA (■), tocopherol (▲) and ascorbic acid(●) on DPPH radicals is expressed as % inhibition. The results are the means of three separate experiments.
4. Superoxide radical 소거 활성
본 실험에서는 생체내의 동맥경화 초기 발병 과정에서 혈관세포의 산화적 손상을 야기하는 가장 주된 free radical로 알려진 superoxide radical에 대한 HPS-HA의 소거 능을 검토하기 위하여, xanthine oxidase와 hypoxanthine로 구성된 반응계에서 superoxide radical 생성을 유도하였다. HPS-HA를 농 도별 (0-1mg/ml)로 처리하였을 때, 최소 1.94%에서 최고 63.37%의 높은 소거활성이 관찰되었다. 반면, 양성대조군으로 동일한 농도의 caffeic acid를 처리할 경우, 최소 7.91%에서 최고 83.23%의 소거능을 나타내 었다(Fig. 4).
Fig. 4. Inhibitory activity of superoxide anion on HPS-HA.
The inhibitory effect of HPS-HA was tested by monitoring NBT reduction caused by superoxide anions using the hypoxanthine-xanthine oxidase system, as described in the Materials and Methods section. The results are expressed as the mean values of triplicate experiments.
5. Nitric oxide 소거 활성
본 실험에서는 활성질소종, 특히 NO에 대한 HPS-HA의 소거효과를 관찰하기 위하 여, SIN-1을 사용하여 NO의 생성을 유도 하고, 이로 인해 생성되는 DAF-2의 형광강 도를 측정하였다. HPS-HA를 농도별 (0-0.2mg/ml)로 처리하였을 때, 최소 8.00%
에서 최고 98.85%의 강한 소거활성이 관찰 되었다. 반면, 양성대조군으로 동일한 농도 의 ascorbic acid를 처리할 경우, 최소 54.70%%에서 최고 99.95%의 보다 높은 NO 소거능이 관찰되었다. 이 실험의 결과에서 0.05mg/ml의 저농도에서 90%를 상회하는 소거능을 보임에 따라 HPS-HA는 강력한 NO의 scavenger임을 알 수 있었다(Fig. 5).
Fig. 5. Nitric Oxide scavenging activity of HPS-HA.
The concentrations tested from 0 to 0.2mg/ml. The results are expressed as the mean values of triplicate experiments.
6. Peroxynitrite 소거 활성
활성질소종에 대한 HPS-HA의 소거효과 를 보다 다각적으로 검토하기 위하여 본 실 험에서는 ONOO-에 대한 소거능을 관찰하였 다. 농도별 HPS-HA에 ONOO-를 직접 처리 함으로써 소거능을 검토한 결과, HPS-HA를 농도별 (0-4mg/ml)로 처리하였을 때, 최소 2.5%에서 최고 96.4%의 강한 소거활성이 관찰되었다. 반면, 양성대조군으로 동일한 농도의 penicillamine을 처리하였을 때, 최소 47.8%에서 최고 99.5%의 소거능이 관찰되 었다. 본 실험의 결과, 0.005-0.5mg/ml의 저 농도에서는 ONOO-의 scavenger로 이미 잘 알려져 있는 penicillamine이 HPS-HA에 비 하여 강한 소거능을 보였으나, 그 이상의 농 도에서는 거의 유사한 소거능을 보임에 따 라 HPS-HA가 ONOO- scavenger로 작용할 수 있음을 알 수 있었다(Fig. 6).
Fig. 6. Peroxynitrite scavenging activity of HPS-HA.
The concentrations tested from 0 to 4mg/ml. The results are expressed as the mean values of triplicate experiments.
7. LDL 산화억제 효과
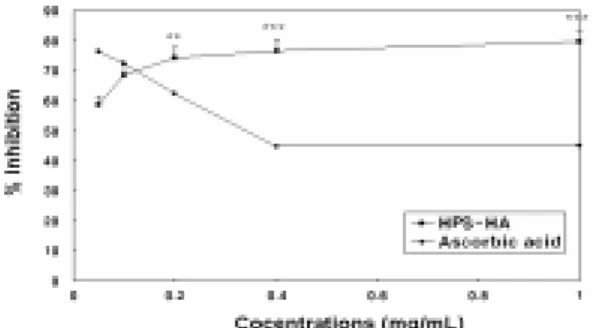
앞의 실험에서 HPS-HA는 자유기 소거능 및 지질과산화 억제효과를 보였다. 본 실험 에서는 HPS-HA가 동맥경화의 발병 과정에 필수적으로 수반되는 LDL의 산화에 대한 효과를 검토하고자, copper ion과 AAPH를 사용하여 각각 LDL의 산화를 유도하였다.
먼저 copper ion에 의한 LDL 산화계에서, HPS-HA를 농도별 (0.05-1mg/ml)로 처리한 결과, 최고 76.56%의 억제 효능을 나타내었 다. 한편 양성대조군으로 ascorbic acid를 동 일한 농도로 처리하였을 때, 저농도에서 최 고 76.19%의 억제능을 보였으나, 농도가 높 아질수록 산화 억제능은 오히려 감소하는 경향을 보였으며, 이는 ascorbic acid 자체에 의한 전산화 효과에 의한 것으로 판단된다 (Fig. 7). 한편 AAPH를 LDL에 처리함으로 써 산화를 유도한 실험에서, HPS-HA는 농 도 의존적인 효능을 나타내었으며, 최고 52.87%의 높은 산화 억제능이 관찰되었다.
한편 한편 양성대조군인 ascorbic acid 처리
군에서는 최고 55.84%의 억제능이 관찰되었 다 (Fig. 8).
Fig. 7. Inhibitory effects on LDL oxidation induced by copper ions.
The level of LDL oxidation was measured by TBARS assay and the results are expressed as mean ± SD of three separate experiments. Ascorbic acid(•) used as a positive control. Different letters above the line indicate significant difference **p < 0.01, ***p < 0.001, HPS-HA vs. ascorbic acid.
Fig. 8. Inhibitory effects on LDL oxidation induced by AAPH.
The level of LDL oxidation was measured by TBARS assay and the results are expressed as mean±SD of three separate experiments. Ascorbic acid(•) used as a positive control.
8. REM assay를 이용한 LDL 산화억제 효과
본 실험에서는 LDL 산화의 지표 모델로 흔히 사용되어지는 REM assy를 이용하여 HPS-HA의 항산화효과를 agarose gel 상에
서 검증하였다. 그 결과, 정상군인 native LDL(lane 1)에서는 아무런 변화가 없었으 나, CuSO4를 처리한 oxidized LDL(lane 2) 에서는 (+)극으로의 움직임이 현저하게 관 찰되었다. 한편, CuSO4와 농도별 HPS-HA를 처리한 실험군에서는 (+)극으로의 이동이 강하게 저해되었다. 이 결과에서, HPS-HA는 CuSO4에 의해 유도되는 LDL의 산화를 현 저하게 억제함을 알 수 있었다. 또한 양성대 조군으로 사용한 0.01 mM EDTA 처리군 (lane 6)에서도 매우 강한 산화 억제효과를 관찰할 수 있었다(Fig. 9).
Fig. 9. Effectof on the relative electrophoretic mobility of LDL.
Human LDL (120 μg protein/mL) was added to HPS-HA and EDTA. The LDL oxidation was initiated by adding 10 μM CuSO4. After incubation for 12 h at 37 ℃ about 3 μg of LDL protein was loaded on 0.7%
agarose gel for 1 h, and the gel was stained with Coomassie brilliant blue R-250. Lane 1, native LDL;
lane 2, oxidized LDL; lanes 3-5, HPS-HA (0.1, 0.4 and 1.0 mg/mL, respectively); lane 6, 0.01 mM EDTA.
9. 세포독성에 미치는 영향
혈관내피세포주인 HUVEC 세포에 대한 HPS-HA의 독성을 MTT assy를 통해 관찰 하였다. 농도별로 HPS-HA를 0.01mg에서 4mg의 용량으로 처리한 결과, 0.01-2mg의 농도에서는 거의 100%의 세포생존률을 나
타내었으므로, 2mg이하의 농도에서는 유의 할 만한 세포독성을 관찰할 수 없었다. 한편 4mg의 고용량으로 처리한 결과, 세포생존률 이 약 80% (p < 0.001)로 대조군에 비하여 현저하게 감소하였다. 이 실험의 결과, HPS-HA는 HUVEC 세포에 대하여 독성이 낮은 것으로 관찰되었다(Fig. 10).
Fig. 10. Viability of HUVEC cells after treatment with different dose of HPS-HA.
Cell viability was assayed by MTT. Values are mean±SD (n=3). Different letters above bar graphs indicate significant difference. *** p〈 0.001 ; compared with the control group.
10. HUVEC 세포의 산화적 손상에 대한 보호효과
HUVEC 세포의 산화적 손상에 대한 HPS-HA의 보호효과를 DCF assay를 통하 여 검토하였다. 먼저 HPS-HA를 HUVEC 세포에 독성을 나타내지 않는 농도로 0.01mg/ml, 0.5mg/ml, 1mg/ml 및 2mg/ml의 용량으로 전처리한 다음, 세포의 산화적 손 상을 유도하기 위하여 SIN-1을 처리한 후, 형광강도의 변화를 시간별로 관찰하였다. 그 결과, 아무런 처리도 하지 않은 대조군에 비 하여, SIN-1을 단독 처리한 실험군에서 시 간의 경과에 따라 유의성있는 형광강도의
증가를 보였다. 이 실험의 결과에서 SIN-1 의 처리에 의하여 HUVEC 세포의 산화적 손상이 효과적으로 유도되었음을 알 수 있 었다. 반면, HPS-HA를 처리한 실험군에서 는 SIN-1에 의해 유도된 세포의 산화적 손 상을 농도 의존적으로 억제하였다(Fig. 11).
Fig. 11. Effect of HPS-HA on intracellular oxidation in HUVECs induced by SIN-1, a peroxynitrite generator.
HUVECs were preincubated with 0.1, 0.5, 1, 2 mg/mL of HPS-HA for 12 h at 37℃ in 5% CO2. Following removal of HPS-HA, DCFH-DA and SIN-1 were added. The percentage increase of DCF fluorescence was measured for 100 min at 10 min intervals. Each data point represents the mean of data from ten wells and experiments were performed in triplicate. a)Significant difference from the not-treated SIN-1. b)Significant difference from the SIN-1 treated group. (* : p <0.05,
** : p < 0.01, *** : p < 0.005).
Ⅳ. 고 찰
생체에 산화적 손상을 일으키는 활성산소 종의 하나인 hydroxyl radical은 활성이 가 장 강하여 지질에 산화적으로 작용할 경우 peroxy radical을 형성함으로써 세포의 산화 적 손상을 야기하는데 결정적인 역할을 한 다고 알려져 있다21,22). HPS-HA가 hydroxyl radical에 의한 지질과산화 반응에 대한 영
향을 살펴보기 위하여, 본 실험에서는 FeCl2
와 ascorbic acid로 구성된 반응계를 사용하 였다. 이 반응계에서 ascorbic acid는 철이온 과 반응하여 전산화(pro-oxidant) 작용을 일 으키는데, 이 과정에서 hydroxyl radical이 생성됨으로써 지질과산화 반응이 개시된다 고 알려져 있다23).
본 실험의 결과, FeCl2와 ascorbic acid에 의 한 흰쥐의 간조직 균질액의 지질과산화 반응이 HPS-HA의 처리에 의해 강하게 억제되었다 (Fig. 1). 이 실험결과를 바탕으로, hydroxyl radical에 대한 HPS-HA의 영향에 대한 보다 심도있는 규명을 위해 deoxyribose assay를 이용하였다. 그 결과, HPS-HA는 non-site‐
specific assay의 결과에 비교하여 site specific assay에서 보다 강한 활성을 나타내었다. 이 실험결과는 HPS-HA가 hydroxyl radical을 직 접적으로 소거하기 보다는 철이온을 chelating 함으로써 hydroxyl radical에 의해 유도된 deoxyribose degradation을 억제하는 효능이 상대적으로 강함을 시사하고 있다 (Fig. 2).
이와 같은 HPS-HA의 현저한 항산화능에도 불구하고 약물자체가 산화를 유도할 가능 성을 검토하기 위하여 pro- oxidant assay를 행하였다. 그 결과, 실험에 사용된 모든 농 도에서 전산화 효과는 관찰되지 않았다 (Table 1). 이 실험의 결과에 따라 HPS-HA 의 전자 공여능을 DPPH radical을 이용하 여 관찰하였다. 일반적으로 항산화제는 보 랏빛의 DPPH radical (DPPH·)을 무색의 (DPPH-H) 형태로 전환시킨다. DPPH radical scavenging assay에서 HPS-HA는 농도 의존 적인 소거능을 보였다(Fig. 3). 이 결과는
HPS-HA가 자유기에 대한 전자 공여능을 통하여 유용한 산화 억제제로 작용할 수 있 음을 나타낸다. 한편 superoxide radical은 산 소를 이용하는 생체내의 정상적인 대사과정 에서 생성될 뿐만 아니라, organic compound 들의 자동산화(autoxidation), 외부로부터 침 입한 이물질에 대한 대식세포의 탐식작용 (phagocytosis) 및 효소반응에 의하여 생성 될 수 있다. 게다가, superoxide anion은 hydrogen peroxide의 생성 전구물질이며, 특 히 Fenton계 반응을 통해 보다 강한 활성을 지닌 hydroxyl radical이 생성된다24).
최근, 혈관세포를 이용한 연구들의 결과에 서 superoxide radical는 주로 생체내에서 NAD(P)H oxidase와 xanthine oxidase의 반응 에 의해 생성되며, 이는 동맥경화 발병의 초 기에 결정적인 역할을 하는 것으로 밝혀졌다
25,26)
. 본 실험에서 사용한 superoxide radical 생성계에서 xanthine oxidase가 hypoxanthine 과 반응하면 superoxide radical가 생성되며, superoxide radical은 hypoxanthine을 uric acid로, 또한 NBT를 환원형 diformazan으로 변환시킨다27). 본 실험에서 NBT reduction assay를 통해 관찰한 결과, HPS-HA의 처리 에 의해 superoxide radical이 강하게 소거됨 을 관찰할 수 있었다(Fig. 4). 이상의 결과 에서 HPS-HA는 지질과산화 억제효과 및 활성산소종에 대한 강한 소거효과를 확인할 수 있었다. 따라서 보다 HPS-HA의 항산화 효능을 더욱 다각적으로 검토하기 위하여, 활성질소종에 대한 소거능을 관찰하였다. 생 체내 혈관내피세포에서는 superoxide와 nitric oxide가 생성될 수 있으며, 이들의 상호반응
에 의하여 혈관세포벽내에서 peroxynitrite가 생성되는데 이러한 일련의 반응 과정에서 LDL의 산화적 변형과 혈관내피세포의 산화 적 손상이 야기될 수 있다고 알려져 있다
28,29)
.
특히 peroxynitrite에 의해 변형된 산화 LDL은 대식세포의 scavenger receptor를 통 하여 탐식되어 포말세포(foam cells)의 형성 을 초래함으로써 결국 동맥경화의 발병과 진행에 밀접하게 연관되는 것으로 인식된다
30-32)
. 특히 peroxynitrite는 그 반응성이 superoxide와 hydrogen peroxide 보다도 강 력하지만 peroxynitrite에 대한 생체내 방어 기구는 아직까지 알려진 바 없으므로 천연 물에서의 peroxynitrite 소거제의 탐색에 많 은 관심이 집중되고 있는 실정이다. 본 실험 에서 HPS-HA의 nitric oxide에 대한 소거능 을 평가하기 위하여 DAF-2와 nitric oxide 생성물질인 SIN-1의 반응에 의하여 생성되 는 형광물질의 형광강도를 측정하였다. 그 결과, HPS-HA는 양성대조군으로 사용된 ascorbic acid와 비교할 만한 소거효능을 나 타내었다(Fig. 5). 또한 peroxynitrite에 대한 효과를 관찰하기 위하여 직접 peroxynitrite 를 시료와 반응시켰다. 그 결과, HPS-HA를 농도별로 처리할 때, peroxynitrite scavenger 로 잘 알려진 penicillamine과 비교할 만한 소거능을 보였다(Fig. 6). 이상의 결과에서 HPS-HA는 활성산조종 뿐만 아니라, 활성 질소종에 대한 강한 소거능을 확인할 수 있 었다. 따라서 이러한 결과들을 바탕으로, 본 약물이 동맥경화의 발병과 진행 과정에서 중요한 역할을 하는 LDL의 산화 단계에 어
떠한 영향을 미치는가를 살펴보기 위하여, copper 및 AAPH에 의한 LDL 산화모델 시 스템을 각각 이용하였다. 먼저 사람혈액으로 부터 분리정제된 LDL에 copper 이온을 처 리함으로써 LDL의 산화를 유도하고 농도별 HPS-HA를 처리한 결과, 농도 의존적인 산 화억제 효능이 관찰되었다. 반면 양성대조군 로 사용된 ascorbic acid에서는 처리 농도가 높아짐에 따라 산화억제 효과는 오히려 감 소하는 경향을 나타내었다(Fig. 7). 이 결과 는 ascorbic acid가 copper와 반응하여 오히 려 전산화 작용을 초래한 결과라고 판단된 다. 한편 자유기 생성물질인 AAPH의 처리 에 의한 LDL 산화모델 시스템에서도 HPS -HA는 농도 의존적인 산화억제 효과를 보 였으나, 억제효과는 copper 반응계의 결과와 비교하였을 때 다소 저조하였다 (Fig. 8).
따라서 LDL 산화계를 이용한 두 종류의 실 험에서, HPS-HA는 직접적인 자유기 소거 활성 보다는 copper을 chelating하는 작용을 통하여 LDL 산화를 보다 강하게 억제함을 알 수 있었으며, 이 결과는 deoxyribose assay에서의 실험결과(Fig. 2)와도 일치하는 경향이 있다고 판단된다. 따라서 본 실험에 서는 chelating 작용을 통한 HPS-HA의 LDL 산화억제 효과를 REM assay를 이용 하여 재확인하였다. REM assay는 천연물의 LDL 산화억제 효과를 탐색하는데 유용하게 사용되는 특이적인 모델 시스템으로서18) LDL의 산화 정도를 전기영동에 의해 관찰 할 수 있으며, LDL의 산화가 진행됨에 따 라, (-)에서 (+)극으로의 이동이 agarose gel 상에서 나타난다. 본 실험의 결과, 농도
별 HPS-HA의 처리에 의하여 LDL의 산화 가 강하게 저해됨을 재확인 할 수 있었다 (Fig. 9). 이상의 항산화 결과를 바탕으로 세포수준에서 HPS-HA의 항산화 기전을 통 한 항동맥경화 활성을 보다 더 구체적으로 규명하기 위하여, 혈관내피세포주인 HUVEC 세포에 SIN-1을 처리함으로써 산화적 손상 을 유도하고, 이에 대한 보호효과를 DCF assay를 통해 관찰하였다. 먼저 HUVEC 세 포에 독성을 나타내지 않는 농도로 HPS- HA를 2mg/ml 이하의 용량으로 전처리하고 (Fig. 10), SIN-1을 처리하여 산화적 손상을 유도한 다음, 시간대별로 세포내 형광물질의 형광강도의 변화를 관찰한 결과, HPS-HA 를 처리군에서 농도 의존적이고 유의성있는 산화 억제효과를 나타내었다(Fig. 11).
이상의 결과, HPS-HA는 지질과산화, LDL 산화 및 혈관내피세포의 산화적 손상을 모 두 효과적으로 방어하였으므로, 동맥경화의 발병초기 및 진행단계에서 유용한 약물로 작용할 수 있을 것으로 사료된다.
Ⅴ. 결 론
향사평위산 약침액의 항산화효능을 검토 하기 위하여 지질과산화 억제효과, 활성산소 종과 활성질소종에 대한 소거효과 및 LDL 산화 억제효과를 중심으로 관찰한 결과 다 음과 같은 결론을 얻었다.
1. HPS-HA는 ascorbic acid와 FeCl2에 의해 유도된 흰쥐 간조직의 지질과산화 반응을 농도 의존적으로 억제하였다.
2. HPS-HA는 hydroxyl radical의 생성을 현 저하게 억제하였다. 반면 pro-oxidant 실 험결과, 약물 자체에 의한 산화 유도는 관찰되지 않았다.
3. HPS-HA의 자유기 소거능을 관찰한 결 과, 농도 의존적으로 DPPH radical, superoxide anion, NO, ONOO-에 대한 직 접적인 소거 활성을 보였다.
4. HPS-HA는 copper ion과 AAPH에 의해 유도된 LDL의 산화를 강하게 억제하였 다. 또한 REM assay법으로 agarose gel 상에서 관찰한 결과에서도, HPS-HA는 CuSO4 처리에 의한 LDL의 산화를 강하 게 억제하였다.
5. HPS-HA는 HUVEC 세포에 대해 독성을 나타내지 않는 농도범위내에서, SIN-1 으 로 유도된 HUVEC 세포의 산화적 손상 을 효과적으로 방어하였다.
참고문헌
1. Madamanchi NR, Vendrov A, Runge MS. Oxidative stress and vascular Disease. Arterioscler Thromb Vasc Biol.
2005 ; 25 : 29-38.
2. de Vries HE, Buchner B, van Berkel TJ. Kuiper, J. Specific interaction of oxidized low‐density lipoprotein with macrophage‐derived foam cells isolated from rabbit atherosclerotic lesions.
Arterioscler Thromb Vasc Biol. 1999 ; 19 : 638-45.
3. Tabata T, Mine S, Kawahara C, Okada
Y, Tanaka Y. Monocyte chemoattractant protein‐1 induces scavenger receptor expression and monocyte differentiation into foam cells. Biochem Biophys Res Commun. 2003 ; 305 : 380-5.
4. Asmis R, Begley JG, Jelk J, Everson WV. Lipoprotein aggregation protects human monocyte‐derived macrophages from OxLDL‐induced cytotoxicity. J Lipid Res. 2005 ; 46 : 1124-32.
5. Lee JH, Lee BW, Kim JH, Jeong TS, Kim MJ, Lee WS et al. LDL‐
antioxidant pterocarpans from roots of Glycine max (L.) Merr. J Agric Food Chem. 2006 ; 54 : 2057-63.
6. Suarna C, Wu BJ, Choy K, Mori T, Croft K, Cynshi O et al. Protective effect of vitamin E supplements on experimental atherosclerosis is modest and depends on preexisting vitamin E deficiency. Free Radic Biol Med. 2006 ; 41 : 722-30.
7. 龔信. 萬病回春. 서울 : 법인문화사. 2007 : 242-714.
8. 하지용, 조영호, 이지숙. 항암단을 투여한 대장암 환자 83예에 대한 임상 보고. 대 한한방종양학회지. 2000 ; 6(1) : 47-65.
9. 黃道淵. 方藥合編. 서울 : 남산당. 1987 : 145.
10. 錢百炎. 中草藥主射劑. 上海 : 上海科學 技術出版社. 1981 : 71-132.
11. Ohkawa H, Ohishi N, Yagi K. Assay for lipid peroxides animal tissues by
thiobarbituric acid reaction. Analytical Biochem. 1978 ; 95 : 351-8.
12. Halliwell B, Gutteridge JMC, Aruoma OI. The deoxyribose method: simple
"test-tube" assay for determination of rate constants for reaction of hydroxyl radicals. Anal Biochem. 1987 ; 165 : 215-9.
13. Gyamfi MA, Yonamine M, Aniya Y.
Free-radical scavenging action of medicinal herbs from Ghana. Gen Pharmacol. 1999 ; 32 : 661-7.
14. Gotoh N, Niki E. Rates of interactions of superoxide with vitamin E, vitamin C and related compounds as measured by chemiluminescence. Biochim Biophys Acta. 1992 ; 1115 : 201-7.
15. Sutherland H, Khundkar R, Zolle O, McArdle A, Simpson AW, Jarvis JC et al. A fluorescence-based method for measuring nitric oxide in extracts of skeletal muscle. Nitric Oxide. 2001 ; 5 : 475-81.
16. Crow JP. Dichlorodihydrofluorescein and dihydrorhodamine 123 are sensitive indicators of peroxynitrite in vitro:
implications for intracellular measurement of reactive nitrogen and oxygen species.
Nitric Oxide. 1997 ; 1 : 145-57.
17. Xu MZ, Lee WS, Han JM, Oh HW, Park DS, Tian GR et al. Antioxidant and anti-inflammatory activities of N- acetyldopamine dimers from Periostracum
Cicadae. Bioorg Med Chem. 2006 ; 14 : 7826-34.
18. Yoon MA, Jeong TS, Park DS, Xu MZ, Oh HW, Song KB et al.
Antioxidant effects of quinoline alkaloids and 2,4-di-tert-butylphenol isolated from Scolopendra subspinipes. Biol Pharm Bull. 2006 ; 29 : 735-9.
19. Wang H, Joseph JA. Quantifying cellular oxidative stress by dichlorofluorescein assay using microplate reader. Free Radic Biol Med. 1999 ; 27 : 612-6.
20. Rong Y, Geng Z, Lau BH. Ginko biloba attenuates oxidative stress in macrophages and endothelial cells. Free Radic Biol Med. 1996 ; 20 : 121-7.
21. Lee JC, Kim HR, Kim J, Jang YS.
Antioxidant property of an ethanol extract of the stem of Opuntia ficus‐ indica var. Saboten. J Agric Food Chem. 2002 ; 50 : 6490-6.
22. Patro BS, Bauri AK, Mishra S, Chattopadhyay S. Antioxidant activity of Myristica malabarica extracts and their constituents. J Agric Food Chem.
2005 ; 53 : 6912-8.
23. Kweon MH, Hwang HJ, Sung HC.
Identification and antioxidant activity of novel chlorogenic acid derivatives from bamboo (Phyllostachys edulis). J Agric Food Chem. 2001 ; 49 : 4646-55.
24. Kujala TS, Loponen JM, Klika KD,
Pihlaja K. Phenolics and betacyanins in red beetroot (Beta vulgaris) root:
distribution and effect of cold storage on the content of total phenolics and three individual compound. J Agric Food Chem. 2000 ; 48 : 5338-42.
25. Warnholtz A, Nickenig G, Schulz E, Macharzina R, Brasen JH, Skatchkov M et al. Increased NADH‐oxidase‐
mediated superoxide production in the early stages of atherosclerosis: evidence for involvement of the renin‐
angiotensin system. Circulation. 1999 ; 99 : 2027-33.
26. Wassmann S, Wassmann K, Nickenig G. Modulation of oxidant and antioxidant enzyme expression and function in vascular cells. Hypertension.
2004 ; 44 : 381-6.
27. Madamanchi NR, Hakim ZS, Runge MS. Oxidative stress in atherogenesis and arterial thrombosis: the disconnect between cellular studies and clinical outcomes. Thrombosis and Haemostasis.
2004 ; 3 : 254-67.
28. Hogg N, Darley‐Usmar VM, Wilson MT, Moncada S. Production of hydroxyl radicals from the simultaneous generation of superoxide and nitric oxide. Biochem J. 1992 ; 281 : 419-24.
29. Steinbrecher UP, Parthasarathy S, Leake DS, Witztum JL, Steinberg D.
Modification of low density lipoprotein
by endothelial cells involves lipid peroxidation and degradation of low density lipoprotein phospholipids. Proc Natl Acad Sci USA. 1984 ; 81 : 3883-7.
30. Goldstein JL, Ho YK, Basu SK, Brown MS. Binding site on macrophages mediated uptake and degradation of acetylated low density lipoprotein, producing massive cholesterol deposition.
Proc Natl Acad Sci USA. 1979 ; 26 : 333-7.
31. Liu SX, Zhou M, Chen Y, Wen WY,
Sun MJ. Lipoperoxidative injury to macrophages by oxidatively modified low density lipoprotein may play an important role in foam cell formation.
Atherosclerosis. 1996 ; 121 : 55-61.
32. Holvoet P, Collen D. beta‐VLDL hypercholesterolemia relative to LDL hypercholesterolemia is associated with higher levels of oxidized lipoproteins and a more rapid progression of coronary atherosclerosis in rabbits.
Arterioscler Thromb Vasc Biol. 1997 ; 17 : 2376-82.