니켈촉매 상에서 천연가스와 메탄의 수증기 개질 반응에 관한 Kinetics 연구
성민준⋅이영철*⋅박영권**⋅전종기
†
공주대학교 화학공학부, *한국가스공사 연구개발원, **서울시립대학교 환경공학부 (2013년 2월 14일 접수, 2013년 4월 4일 심사, 2013년 4월 11일 채택)
A Study on Reaction Kinetics in Steam Reforming of Natural Gas and Methane over Nickel Catalyst
Minjun Seong, Young-Chul Lee
*, Young-Kwon Park
**, and Jong-Ki Jeon † Department of Chemical Engineering, Kongju National University, Cheonan 330-717, Korea
*
Korea Gas Co. R&D Division, Ansan 426-860, Korea
**
School of Environmental Engineering, University of Seoul, Seoul 130-743, Korea (Received February 14, 2013; Revised April 4, 2013; Accepted April 11, 2013)
상업용 니켈 촉매를 사용하여 메탄과 천연가스의 수증기 개질 반응을 각각 수행하였다. 수증기 개질 반응의 변수는 반응 온도와 반응물의 분압이었다. Kinetic data로부터 Power law rate model과 Langmuir-Hinshelwood model의 매개변수 를 구하였다. 순수한 메탄을 수증기 개질 반응 실험의 원료로 사용한 경우에는 Langmuir-Hinshelwood model 식은 물론 이고 Power law rate model을 사용하여 반응 속도를 적절하게 표현할 수 있었다. 그러나 천연가스 중의 메탄의 수증기 개질 반응 속도를 표현하는데 있어서는 Power law rate model보다 Langmuir-Hinshelwood model이 훨씬 더 적합한 것을 확인하였다. 이러한 거동은 천연가스 중에 포함되어있는 메탄, 에탄, 프로판 및 부탄이 동일한 촉매 활성점에 경쟁적 으로 흡착하기 때문으로 해석할 수 있었다.
Kinetics data were obtained for steam reforming of methane and natural gas over the commercial nickel catalyst. Variables for the steam reforming were the reaction temperature and partial pressure of reactants. Parameters for the Power law rate model and the Langmuir-Hinshelwood model were obtained from the kinetic data. As a result of the reforming reaction using pure methane as a reactant, the reaction rate could be determined by the Power law rate model as well as the Langmuir-Hinshelwood model. In the case of methane in natural gas, however, the Langmuir-Hinshelwood model is much more suitable than the Power law rate model in terms of explaining methane reforming reaction. This behavior can be attrib- uted to the competitive adsorption of methane, ethane, propane and butane in natural gas over the same catalyst sites.
Keywords: steam reforming, natural gas, Ni catalyst, Langmuir-Hinshelwood model
1. 서 론
1)
수소는 무공해 청정 대체연료로 사용할 수 있을 뿐만 아니라 풍부한 자원으로부터 얻을 수 있으며 연소하면 공기 중의 산소와 반응하여 물이 되므로 공해가 없다. 환경 친화적인 수소를 생산하는 기술이 최근에 상당히 주목받고 있다[1]. 이러한 수소생산기술 중에서 천연가스를 사용하여 수소를 생산하는 기술이 가장 널리 사용된다[2]. 천연가스로 부터 수소를 생산하는 대부분의 공정에는 수증기 개질법, 부분산화법, 자열 개질법, 건 개질법 등이 사용되고 있는데 수증기 개질법이 가장 높은 수율을 보인다[1,3-6]. 개질 반응기는 수소제조설비, 연료전지 발전
† Corresponding Author: Kongju National University Department of Chemical Engineering
1223-24 Cheonan-daero, Seobuk-gu, Cheonan 330-717, Korea Tel: +82-41-521-9363 e-mail: jkjeon@kongju.ac.kr
pISSN: 1225-0112 @ 2013 The Korean Society of Industrial and Engineering Chemistry.
All rights reserved.
시스템 등에서 천연가스로부터 수소를 얻기 위한 개질기, DME 합성 및 제조를 위한 공정 등에서 광범위하게 사용된다[7-9].
수증기 개질 공정은 촉매의 종류, 운전 조건 및 반응기 특징 등에 영향 받는 문제가 있다. 최근 메탄, 에탄, 프로판, 부탄 등 순수한 가스 성분을 사용한 수증기 개질반응 연구 결과를 어렵지 않게 찾아볼 수 있다[14-20]. 그러나 혼합가스인 천연가스에 대한 kinetic model 선정에 관한 연구결과는 보고된 바가 드물기 때문에 이를 구하는 것이 요구 된다.
Kinetic data 확보의 일차적인 목적은 상업 운전에 필요한 크기의 반응기를 설계하기 위하여 화학전환반응을 반응속도식으로 적절하게 표현해야하기 때문이다. 즉, 엔지니어가 반응기 설계, 최적화 및 운전을 하기 위해서 반응속도식은 매우 유용한 도구가 된다.
본 연구의 목적은 천연가스의 수증기 개질 반응에 사용되는 반응기
설계 작업을 수행하기 위한 사전 연구의 일환으로서 상업용 Ni 촉매를
이용하여 한국가스공사의 천연가스의 수증기 개질 반응에 적절한 반응
속도식을 산출해내고 이를 순수한 메탄의 수증기 개질 반응속도식과
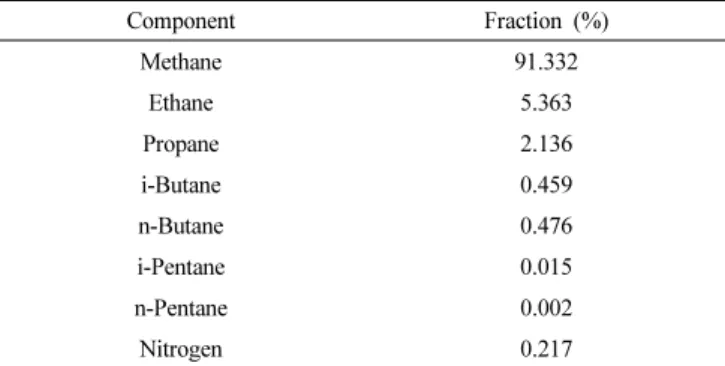
Table 1. Composition of Natural Gas
Component Fraction (%)
Methane 91.332 Ethane 5.363
Propane 2.136
i-Butane 0.459 n-Butane 0.476 i-Pentane 0.015 n-Pentane 0.002 Nitrogen 0.217
0.0013 0.0014 0.0015 0.0016 0.0017 0.0018 -18
-17 -16 -15 -14 -13 -12 -11
N
2
/CH4
= 8:2 N2
/CH4
= 9:1 Regression1/T (1/K)
ln (- r')
(a)
0.0013 0.0014 0.0015 0.0016 0.0017 0.0018
-18-17 -16 -15 -14 -13 -12 -11
S/C = 1.5/1 S/C = 2.0/1 S/C = 2.6/1 Regression
1/T (1/K)
ln( -r ')
(b)
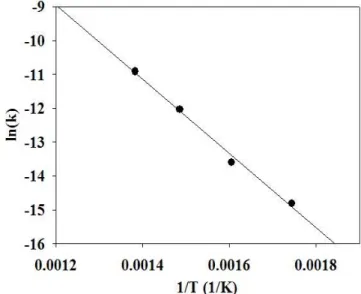
Figure 1. Arrhenius plot of methane steam reforming ((a) : constant partial pressure of steam, (b) constant partial pressure of methane).
비교하고자 하는 것이다. 이를 위해 상업용 니켈 촉매를 사용하여 반응 온도, 공간 속도, steam/carbon 몰 비 등의 반응 조건을 변화시키면서 천연가스와 메탄의 수증기 개질 반응을 각각 수행하고, 그 결과로부터 kinetic model 을 선정하였다. Kinetic model은 Power law rate (P-R) model 과 Langmuir-Hinshelwood (L-H) model을 비교하여 kinetic data를 표현 하는데 적합한 모델을 선정하였다.
2. 실 험
2.1. 촉매
상업용 Ni 촉매(FCR-4 : Süd-chemie Catalysts Inc., 12 wt% Ni/α-Al 2 O 3 , BET surface area : 12.3 m 2 /g cat. ) 를 사용하여 천연가스와 순수한 메탄에 대한 수증기 개질 반응을 수행하였다[21]. 반응 실험을 수행하기 전에 촉매를 반응기에 장착한 상태에서 질소에 희석된 수소(H 2 10%) 를 흘리 면서 500 ℃에서 2 h 동안 환원시켰다.
반응 실험에 사용된 촉매의 크기는 75∼100 µm이고 0.1 g을 장착 하여 실험하였다. 사전 연구를 통해서 반응 속도 데이터를 얻기에 적 당한 촉매의 크기를 결정하기 위한 실험을 수행하였다[22]. 촉매 알갱 이의 크기를 38∼75 µm, 75∼100 µm, 100∼125 µm로 나누어 접촉 시간의 변화에 따른 수증기 개질 반응 실험을 수행하고, 촉매 크기에 따라서 전환율 변화가 거의 없었기 때문에 내부확산저항(internal diffusion limitation) 이 거의 없다고 판단할 수 있었다. 따라서 본 연구에서 반응 속도 실험에 가장 적합한 촉매 크기를 75∼100 µm 범위로 결정하였다.
2.2. 반응물과 반응 장치
본 실험에서 수증기 개질 반응의 원료로 천연가스와 메탄을 각각 사용하였다. 천연가스는 한국가스공사로부터 제공받았으며, methane, ethane, propane, 및 butane이 각각 91.3, 5.4, 2.1, 0.9% 포함되어 있고, 황(sulphur) 화합물은 포함되지 않았다(Table 1). 메탄의 수증기 개질 반응에는 순도 99.5%의 메탄가스를 구입하여 사용하였다. 반응기는 석 영으로 제작한 고정층 반응기이며 크기는 내경 10 mm 및 길이 5 cm이 다. 반응물의 유량을 조절하기 위하여 질량유량조절기(BROOKS 5850E series)와 시린지 펌프를 사용하였다. 반응 생성물은 냉각기와 수분트랩에서 수분을 제거한 후, 메탄화장치가 장착된 기체크로마토그 래피 (모델명 : Younglin, YL 6100 TOGA System)를 on-line으로 연결 하여 분석하였다.
2.3. 반응 변수
수증기 개질 반응 실험 온도는 300∼700 ℃이고, 압력은 상압, 그리고 전환율을 5% 이하로 유지하기 위하여 메탄과 천연가스의 공간속도
(gas hourly space velocity, GHSV)는 각각 30600 h -1 과 474200 h -1 인 조건에서 실험하였다. 수증기 개질 반응의 반응물은 천연가스 또는 메탄가스와 수증기이기 때문에 kinetic data를 얻기 위해서는 한 가지 물질의 농도를 일정하게 하고 나머지 물질의 농도를 변화시키면서 실험하였다. 천연가스 또는 메탄의 농도가 일정할 때, 물의 농도를 변화시키면서 실험하는 조건은 S/C ratio 1.5/1∼2.6/1으로 하였다. 또한 물의 농도가 일정할 때에 실험 조건은 질소와 천연가스 또는 메탄의 비율을 7/3∼9/1로 변화시키면서 실험하였다.
3. 결과 및 고찰
3.1. 순수한 메탄의 수증기 개질반응 속도식 도출
P-R model에 대한 반응 속도식 (1)에 Ln값을 취하면 식 (2)를 얻을 수 있다.
r = k o EXP(-E a /RT)[P CnHm ] α [P H2O ] β (1)
Ln(r) = Ln(k o [P CnHm ] α [P H2O ] β ) - (E a /R)(1/T) (2)
ln(PCH4)
-2.6 -2.4 -2.2 -2.0 -1.8 -1.6
ln(-r ')
-14.0 -13.6 -13.2 -12.8 -12.4 -12.0 -11.6
400oC
450oC
(a)ln(PH2O)
-2.0 -1.9 -1.8 -1.7 -1.6 -1.5 -1.4 -1.3
ln(- r')
-15 -14 -13 -12 -11 -10 -9
400oC 450oC
(b)
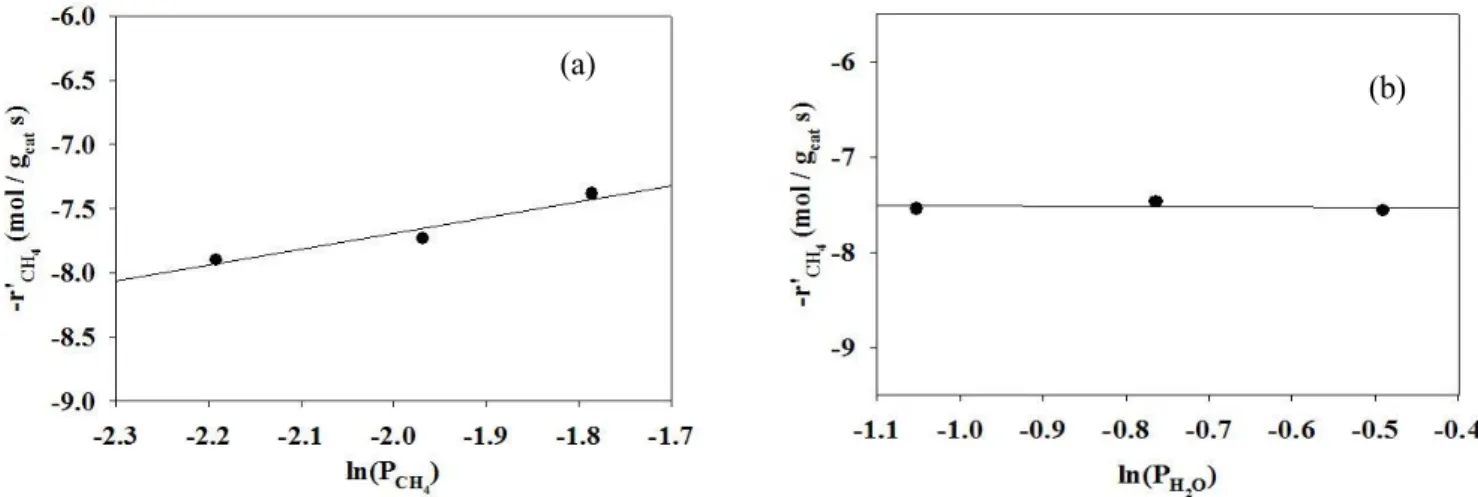
Figure 2. Plots for reaction order of reactants in methane steam reforming ((a) reaction order of methane, (b) reaction order of steam).
Figure 3. Plot for pre-exponential factor of methane steam reforming.
반응물인 수증기/메탄의 비는 2.0으로 일정하게 유지시키고, 질소와 메탄의 비를 8/2과 9/1으로 변화시키면서 반응 온도를 300∼450 ℃로 변화시키면서 수증기개질 반응을 수행하였다. 메탄의 수증기개질 반 응 실험 결과로부터 반응 속도를 구하고, x축을 (1/T)로 하고 y축을 ln(-r ')로 하면 선형 그래프를 얻을 수 있고, 이때 그래프의 기울기 (-(Ea/R)) 로부터 활성화 에너지를 구할 수 있다(Figure 1 (a)). 동일한 온도 범위에서 질소/메탄의 비를 9/1로 일정하게 유지시키고 수증기/
메탄의 비를 1.5/1∼2.6/1로 변화시키면서 수증기개질 반응을 수행하 였다. 이 실험 결과를 (Figure 1 (b))에 나타낸 후, 기울기로부터 활성화 에너지를 구할 수 있다. Figure 1 (a)에 나타낸 바와 같이 메탄의 분압 을 변화시키면서 구한 활성화에너지의 평균값은 90.5 kJ/mol이었고, Figure 1(b) 에 나타낸 바와 같이 수증기의 분압을 변화시키면서 구한 활성화에너지의 평균값은 87.7 kJ/mol이어서 큰 차이가 없었고, 메탄 의 수증기 개질반응의 활성화 에너지 값으로 이 두 값의 평균인 89.1 kJ/mol 로 산정하였다.
식 (2)를 풀어서 정리하면 식 (3)과 같은 형태가 된다.
Ln(r) = Ln(k 0 ) - (E a /R)(1/T) + αLn(P CnHm ) + βLn(P H2O ) (3) 이때, α값을 구하기 위해서 반응온도가 400 ℃ 및 450 ℃인 조건 에서, 수증기의 분압은 0.19로 일정하게 유지시킨 상태에서 메탄의 분압을 변화시키면서 수증기개질 반응실험을 수행하였다. Figure 2(a) 에 α값을 구하기 위한 실험 결과를 나타냈으며, 400 ℃ 및 450 ℃인 조건에서의 기울기의 평균값인 -0.6을 메탄에 대한 반응차수로 결정 하였다. β값을 구하기 위해서 반응온도가 400 ℃ 및 450 ℃인 조건 에서, 메탄의 분압은 0.09로 일정하게 유지시킨 상태에서 수증기의 분압을 변화시키면서 수증기개질 반응실험을 수행하였다. Figure 2(b) 에 β값을 구하기 위한 실험 결과를 나타냈으며, 400 ℃ 및 450 ℃인 조건에서의 기울기의 평균값인 1.3을 수증기에 대한 반응차수로 결정 하였다.
반응속도 상수(k)는 식 (4)으로 표현할 수 있다. 이 식 (4)에 Ln 값을 취하면 식 (5)와 같은 형태가 된다.
k = k 0 exp(-E a /RT) (4) Ln(k) = Ln(k 0 ) - (E a /R)(1/T) (5) 메탄의 수증기개질 반응실험으로부터 구한 데이터를 x축은 (1/T)로 하고 y축은 Ln(k)로 하여 그래프를 그리면 Figure 3과 같으며, y절편 으로부터 구한 k o 값은 67.6이었다. 따라서 순수한 메탄의 수증기 개질 반응을 수행하였을 때, P-R model에 근거하여 얻은 반응 속도식은 식 (6)과 같다.
-r CH4 = 67.6 × EXP(-89.1x10 3 /(8.314 × T)) × [C CH4 ] -0.6
× [C H2O ] 1.3 (6)
메탄의 수증기개질 반응을 위한 L-H model 식은 식 (7)과 같다.
-r' CH4
(7)
Table 2. Parameters for L-H Model in Steam Reforming of Pure Methane
Temperature (℃) k
1K
CH4K
H2O350 4.66E-06 102.0 60.0 400 1.20E-05 102.0 71.6 450 5.44E-05 102.0 66.4
P(CH 4 )
0.05 0.10 0.15 0.20 0.25
-r ' CH4 ( mol / g ca t s) 0 5e-6 1e-5 2e-5 2e-5
L-H model P-R model Eq'n (8)
Experimental results
(a)
P(H2O)
0.05 0.10 0.15 0.20 0.25 0.30
-r' CH4 (m ol / g cat s) 0 5e-6 1e-5 2e-5 2e-5
L-H model P-R model Eq'n (8)
Experimental results
(b)
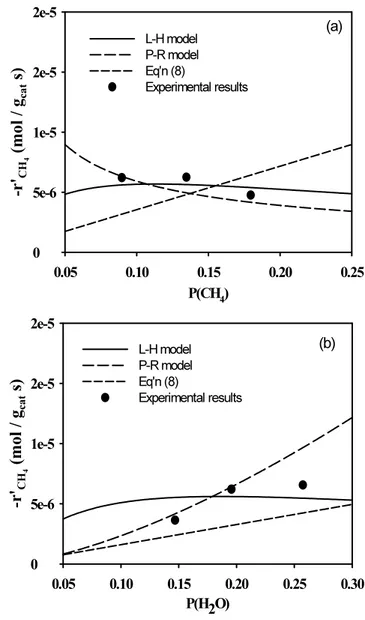
Figure 4. Comparison of the kinetic model evaluation for methane steam reforming ((a) constant partial pressure of steam, (b) constant partial pressure of methane).
Table 3. Reaction Order for P-R Model in Steam Reforming of Natural Gas
Component α β
Methane 1.3 -0.7
Ethane 1.2 -0.6
Propane 1.2 -0.8
Butane 1.3 -0.7
질소/메탄의 비가 8/2∼9/1이고 수증기/메탄의 비가 1.5/1∼2.6/1 일 때, 반응 온도를 350∼450 ℃로 변화시킨 반응 조건에서 메탄의 수증기개질 반응으로부터 얻은 데이터를 이용하여 구한 L-H model의 반응속도식 parameter를 정리하면 Table 2와 같다.
메탄의 수증기 개질 반응으로부터 얻은 kinetics data에 적합한 kinetic model 식을 찾기 위하여, 기존의 문헌에 메탄 수증기 개질 반응에 대한 kinetic model 로 식 (8)이 보고된 바 있다[23].
-r' CH4
(8)
450 ℃에서의 메탄의 수증기 개질 반응실험 결과를 식 (8)에 도입하 면 k값과 K 5 값이 각각 1.87 × 10 -4 와 0.143으로 나타났다. 본 연구에서 구한 P-R model, L-H model 및 식 (8)의 kinetic model을 질소/메탄의 비가 8/2∼9/1일이고, 수증기/메탄의 비가 1.5/1∼2.6/1일 때, 반응 온도가 450 ℃인 반응 조건에서 수행한 메탄의 수증기 개질 반응 실험 결과와 비교하였다. Figure 4에 그 결과를 나타냈으며, 본 연구의 상업용 Ni 촉매를 사용하여 순수한 메탄의 수증기 개질 반응의 kinetic data는 P-R model 과 L-H model 둘 다 적합한 것으로 판단하였다. 그러나 식 (8) 의 model 식과 본 연구의 실험 결과는 잘 일치하지 않았다.
3.2. 천연가스의 수증기 개질 반응 속도식 도출
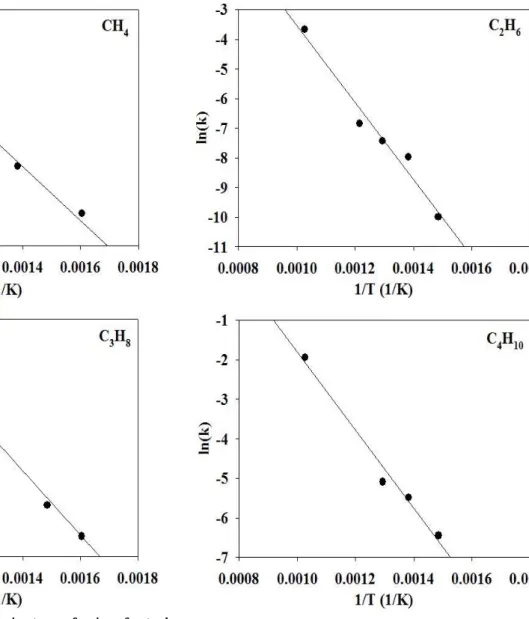
천연가스의 수증기 개질반응 속도식을 P-R model로 표현하기 위하여 수증기/탄화수소의 비를 2.0/1.0, 질소/천연가스의 비를 7/3인 조건에서 반응 온도를 300∼700 ℃로 변화시키면서 수증기개질 반응을 수행하 였다. 천연가스의 수증기 개질 반응 실험 결과로부터 메탄, 에탄, 프로판 및 부탄의 활성화에너지를 구하기 위한 그래프를 Figure 5에 도시하 였다. 천연가스의 수증기 개질 반응으로 얻은 메탄, 에탄, 프로판 및 부탄의 수증기 개질 반응의 활성화 에너지는 각각 114.2, 90.6, 134.6 및 77.5 kJ/mol이었다.
식 (1)의 α값을 구하기 위해서 반응온도와 수증기의 분압은 일정 하게 유지시킨 상태에서 천연가스의 분압을 변화시키면서 수증기 개질 반응실험을 수행하였다. β값을 구하기 위해서는 반응온도와 천연 가스의 분압은 일정하게 유지시킨 상태에서 수증기의 분압을 변화 시키면서 수증기 개질 반응실험을 수행하였다. 천연가스 중의 메탄의 수증기 개질 반응에 대한 반응차수를 구하기 위한 실험 결과를 Figure 6 에 나타냈으며, α와 β는 각각 1.3과 -0.7로 나타났다. 이와 동일한 방법으로 천연가스 중의 에탄, 프로판 및 부탄의 수증기 개질 반응에 대한 반응차수를 구하여 그 결과를 Table 3에 나타냈다. 천연가스의 수증기 개질 반응 실험 결과를 식 (5)에 적용하여 x축은 (1/T)로 하고 y 축은 Ln(k)로 하여 도시한 결과를 Figure 7에 도시하였으며, 기울기 로부터 구한 메탄, 에탄, 프로판 및 부탄의 k o 값은 각각 10413.5, 13027.8, 445717.2 그리고 3172.6 mol/g cat. ⋅s이었다.
결과적으로 상업용 Ni 촉매를 사용하여 천연가스의 수증기 개질
반응을 수행하였을 때, P-R model에 근거하여 얻은 각 성분의 반응 속도식을 식 (9)∼(12)에 정리하였다.
-r CH4 = 1.041x10 4 × EXP(-114.2x10 3 /(8.314 × T))
× [C CH4 ] 1.3 × [C H2O ] -0.7 (9) -r C2H6 = 1.303x10 4 × EXP(-90.6x10 3 /(8.314 × T))
× [C C2H6 ] 1.2 × [C H2O ] -0.6 (10)
Figure 5. Arrhenius plot for steam reforming of natural gas (steam/carbon = 7/3, N 2 /carbon = 2/1).
(a)
(b)
Figure 6. Plots for reaction order of reactants in steam reforming of natural gas ((a) reaction order of methane, (b) reaction order of steam).
-r C3H8 = 4.57x10 5 × EXP(-134.6x10 3 /(8.314 × T))
× [C C3H8 ] 1.2 × [C H2O ] -0.8 (11) -r C4H10 = 3.173x10 3 × EXP(-77.5x10 3 /(8.314 × T))
× [C C4H10 ] 1.3 × [C H2O ] -0.7 (12)
Figure 7. Plot for pre-exponential factor in steam reforming of natural gas.
천연가스 중의 메탄의 수증기 개질반응을 위한 L-H model 식은 다 음과 같다.
-r' CH4
(13)
이 식 중에서 에탄, 프로판 및 부탄의 농도가 메탄에 비해서 매우 작으므로 분모 중에서
,
,
항을 무시 하면 다음 식과 같이 단순화시킬 수 있다.
-r' CH4
(14)
천연가스 중의 메탄의 수증기 개질 반응으로부터 얻은 데이터를 이용 하여 L-H model의 반응속도식 parameter를 구하면 k 1 , K CH4 및 K H2O 는 각각 6.18 × 10 -5 , 2.22 및 4.74로 나타났다.
천연가스의 수증기 개질 반응 실험으로부터 얻은 메탄의 kinetic
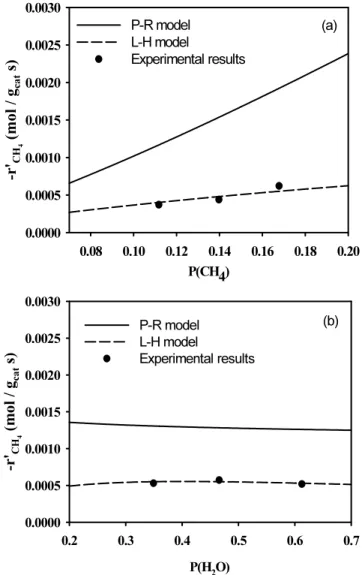
data 에 적합한 model을 판정하기 위하여 P-R model 및 L-H model을 비교하였다. 반응 온도 700 ℃에서 두 모델식과 실험 data를 Figure 8에 나타냈다. 그 결과, P-R model은 메탄의 분압을 변화시킨 반응 실험 결과와 수증기의 분압을 변화시킨 반응 실험 결과를 모두 만족시키기 위한 model로는 적절하지 않은 것으로 나타났다. 반면에 천연가스 중의 메탄의 수증기 개질 반응에 있어서 L-H model이 더 적합한 model이 라는 것을 알 수 있었다. 이는 순수한 메탄의 수증기 개질 반응에서 P-R model 과 L-H model을 사용하여 반응 실험 결과를 적절하게 표현 할 수 있었던 결과와는 다르게 나타난 것이다. 특정한 촉매에 대해서 반응물이 섞여있는 혼합물의 반응 속도는 동일한 촉매상에서 한 번에 한 성분씩 측정한 속도식의 합으로부터 예측한 반응속도와 종종 다르게 나타난다[24]. 더욱이 개별 종들의 반응성 증가 순서가 각각 분리하여 측정되었을 때와 크게 다를 수 있다. 이러한 거동은 동일한 활성점에 대하여 다른 반응물들이 경쟁 흡착한다는 측면에서 이해될 수 있다.
일반적으로 유사한 구조를 가진 기상 화합물 중에서 분자량이 큰 분
자가 더 강하게 화학 흡착하는 것으로 알려져 있다[24]. 천연가스 중
에 포함되어 있는 에탄, 프로판 및 부탄이 메탄보다 더 강하게 화학
흡착하며, 메탄은 이 성분들과의 경쟁흡착을 해야 한다. 따라서 순수
P(CH4)
0.08 0.10 0.12 0.14 0.16 0.18 0.20
-r ' CH4 (mol / g ca t s)
0.0000 0.0005 0.0010 0.0015 0.0020 0.0025 0.0030
P-R model L-H model
Experimental results
(a)
0.2 0.3 0.4 0.5 0.6 0.7
-r ' CH4 ( mol / g ca t s) 0.0000 0.0005 0.0010 0.0015 0.0020 0.0025 0.0030
P(H 2 O) P-R model L-H model
Experimental results
(b)
Figure 8. Comparison of experimental data, P-R model and L-H model for steam reforming of methane in natural gas ((a) constant partial pressure of steam, (b) constant partial pressure of natural gas).
한 메탄만의 수증기 개질 반응에서는 P-R model로도 반응 결과의 표 현이 가능하였으나, 천연가스 중에 포함되어 있는 메탄의 수증기 개질 반응에서는 경쟁 흡착을 반영한 L-H model이 더 적절하게 나타난 것 으로 해석할 수 있다.
4. 결 론
본 연구에서는 상업용 Ni 촉매를 사용하여 천연가스 및 순수한 메탄 의 수증기 개질 반응을 수행하여 kinetic data를 얻었다. Kinetic data를 사용하여 P-R model과 L-H model 식을 도출하였다. 순수한 메탄의 수증기 개질 반응 실험 결과는 P-R model과 L-H model 식을 통해서 적절하게 표현할 수 있었으나, 천연가스 중의 메탄의 수증기 개질 반응 실험 결과는 P-R model로 표현하기에 적절하지 못했으며 L-H model 이 훨씬 더 적합한 것을 확인하였다. 천연가스 중에 포함되어있는 에탄, 프로판 및 부탄이 메탄과 경쟁적으로 흡착하기 때문에 경쟁흡착을 반영한 L-H model이 더 적합한 것으로 해석할 수 있다.
감 사
본 논문은 한국가스공사 대학협력과제로 수행되었으며 이에 감사 드립니다.
참 고 문 헌