약학회지 제36권 제1호 26*^36(1992) Yakhak Hoeji Vol. 36, No. 1
흰쥐에서의 트러프로러딘의 대사
정병화 • 엄기동 ■ 유 영 숙 • 정 봉 철 ** • 박종세
한국과학기술연구원 도평콘트롤센터
(Received January 3. 1992)
Metabolism of Triprolidine in Rat
Byung Hwa Jung, Khee Dong Eom, Young Sook Yoo, Bong Chul Chung화 and Jongsei Park
Doping Control Center, Korea Institute of Science and Technology, P.O.Box 131, Cheongryang, Seoul 130-650, Korea
Abstract—The metabolic profile of triprolidine, 2-[l-(4-methylphenyl)-3-(l-pyrrolidinyl-l-prope- nyl)] pyridine, was determined in rat urine and bile. The free fractions of urinary and biliary extracts were obtained without hydrolysis, and the conjugated fractions of extracts were obtained with enzyme hydrolysis using p-glucuronidase from Escherichia coli. The mixture of N-methyl-N- trimethylsilyitrifluoroacetamide/trimethylsilyl chloride (100 : 1, v/v) was used to derivatize the ext
racts and then analyzed by gas chromatography/mass spectrometry. Hydroxymethyltriprolidine, hydroxytriprolidine, triprolidine carboxylic acid, dihydroxytriprolidine 1, dihydroxytriprolidine 2, oxotriprolidine carboxylic acid and unchanged triprolidine were detected in rat urine and bile, which were obtained after oral treatment with triprolidine hydrochloride. The maximum urinary excretion rate of triprolidine and hydroxymethyltriprolidine which were extracted from free fraction was at 1 to 2 hours after drug administration. Hydroxymethyltriprolidine was detected in conjugated fraction, and the maximum urinary excretion rate of that metabolite was at 2 to 3 hours in rat.
In rat bile analysis, triprolidine was detected only in free fraction and its biliary excretion rate showed the maximum within 30 minutes after drug administration and decreased continuously thereafter. The excretion percentage of triprolidine and hydroxymethyltriprolidine to the initial dose of the parent drug in bile and urine of rats were all low.
Keywords □ Triprolidine, metabolism, excretion, urine, bile, gas chromatography-mass spectrometry (GC-MS)
Hi 형태의 항 히스타민제는 대부분 평활근을 이 완시키며 모세혈관을 확장시키고, 과민성반응과 알레 르기 현상에 antagonist로 사용되며, 중추신경계에도 억제 또는 자극을 준다. 또한 다른 수용체에도 작용 하여 anticholinergic 성질을 가지는 경우도 있다. 대 부분의 Hi 형태외 항 히스타민제제는 위장관에서 흡 수가 잘되며, 경구투여 후 30분 이내에 효과가 나타 나고 1시간에서 2시간 안에 최대외 효과를 나타내며, 3시 간에 서 6시 간 동안 그 효과가 지속된다. Hi 형 태외
«본 논문에 관한 문외는 이 저자에게로.
항 히스타민제 제는 유형에 따라 ethanolamine류, eth- ylcnediaminc류, alkylaminc류, piperazine류, pheno- thiazine류 등 5가지 종류로 나눌 수 있다.오^
Alkylamine류에 포함되는 propylamine derivative Hi-receptor antagonist 인 triprolidine은 정제 또는 시럽제로 널러 사용되고 있는 over the counter drug 이다.2^ 그러나 1980년도에 ethylenediamine antihis
tam ine^ mcthapyrilcnc 이 rat hcpatocnrcinogcn 이라 는 보고가 발표되면서 이런 유형의 약물들에 대한 득성 및 발암성 연구가 한층 더 활발해져 왔다. ^ tri
prolidine hydrochloride-^ Hi-receptor antagonist^
26
힌쥐에서의 토러프로러딘외 대사 27
서 동물^'■탄^}" 사람^아에 대해 antihistamine activity가 있다고 보고되었으며 그 구조에 따른 항 허스타민 효과는 Ison 등 *에 외하여 연구되어 졌다. triproli- dine에 대 한 대 사체 및 약동학에 대 한 보고로는 Find- lay 등나버 발표한 rabbit과 human blood 에서외 trip- rolidine외 disposition파 bioavailability 연구와 Kutz- man 등^^이 guniea pig liver외 microsomes와 NADP generating system을 이용하여 triprolidine의 meta- bolitc 인 triprolidine carboxylic acid와 hydroxymeth- yltriproiidine을 확인한 연구 등이 있으나, 직접 실 험동물이나 사람에 triprolidine 을 투여한 후의 urine이나 기타 biological fluid에 대한 대사체 및 약동학 연구는 미비한 상태이다. 따라서 본 연구에 서는 rat에 triprolidine을 경구투여한 후 urine과 bile로 배설되는 대사체를 질량 spectrum 분석에 외해 검출 확인하여 에상되어지는 대사경로를 제시하였으 며, 시간에 따른 excretion rate profile을 살펴보고자 시도하였다.
실험방법
시 약
Triprolidine HC1 과 internal standard 인 tripelen- namine은 Sigma Chemical Company에서 구입하였 으며 hydroxymethyltriprolidine은 NCTR(National Center for Toxicological Research, U.S.A.) 에서 합 성하여 제공하여 준 것을 사용하였다. Phosphate buf
fer 제조시에 필요한 K2HPO4와 KH2PO4는 Junsei Chemical Company에서 구입한 E.P. grade의 시약을 사용하였고, enzyme hydrolysis를 위하여 Boehringer Mannheim에서 구입한 p-glucuronidase(activity-200 U/m/. from E. co/O를 사용하였다. acid hydrolysis 에 서 사용한 HCI은 J.T. Baker에 서 구입 한 A.R. grade 시약을 사용하였고, 유도체 화 시약으로는 Sigma Che
mical Company에서 구입한 MSTFA(N-methyl-N- trimethylsilyl-trifluoroacetamide) 와 TMSCKtrime- thylsilylchloride) 을 1 0 0 :1 로 흔합하여 사용하였다.
urine으로부터 triprolidine과 그 대사체를 분티하기 위하여 ambeiiite XAD-2 resin (100--200 microns) 을 Serva Company에서 구임하여 사용하였고 동물 설험에 필요한 NaCl과 mannitd은 Sigma Chemical Company에서 구입하여 사용하였다. 그 외 추출용매
인 ether와 ethanol 동은 J.T. Baker외 G.R. grade 시약을 사용하였다.
실험기기
본 실험에서 사용한 분석기기로는 Hewlett-Packard (HP) 5890A Gas Chromatograph(GC)에 direct in- terface로 연결된 5970B Series Mass Selective Dete- ctor(MSD)를 사용하였고, 모든 시료는 HP 7673A Auto Sampler를 사용하여 GC에 주업하였다. data analyzing system으로는 HP 7946 disc drive 가 연 결된 HP 5970 MS Chemstation을 사용하였고, chro- matogram과 mass spectrum은 HP 2934A Printer로 부터 얻었다. 시료의 추출과정에서 사용한 장처로는 rotary vacuum evaporator(Buchi, Swiss), Buhler 7400 Tubingen Shaker(Edmond, Germany) Vari- fuge-F Centrifuge(Heraeus, Germany), Heating block(Gebr. Liebisch, Germany) 동이 있다. rat 실 험시에는 3% mannitol-saline 용액의 등속주업을 위 하여 Infusion withdrawal pump(Harvard apparatus, U.S.A.)룔 사용하였다.
시료채취
1) Metabolite 확인용 24시간 Urine 채취방법 Sprague Dawley계 웅성 흰쥐 1마리에 triprolidine hydrochloride 1 0 mg을 증류수에 녹여 경구로 투여 하고 metabolic cage 안에 서 24시 간 동안 배설된 뇨를 수접하여 분석 전까지 ~2(TC 냉동고에 보관하였다.
실험 전까지 흰쥐에게 정상적인 덕이와 움료를 공급 하였다. blank urine은 약물투여 하루 전에 채취하였 다.
2) 시간별 Rat Urine 채취방법
Triprolidine과 그 metabolite들외 시간에 따른 rat urine으로외 배설경향을 알아보기 위하여 triproli- dine을 흰쥐에 경구투여한 후 시간별로 urine을 채 취하였다. 그 자세한 실험방법은 다옴과 같다.
(D 약물투여 一 Sprague Dawley계 응성 흰쥐 3마러 에 (240~260g)에 triprolidine hydrochloride을 증류 수에 녹여 80 mg/m/로 만든 수용액을 40 mg/kg 용 량으로 경구투여하였다. 약물투여 전 24시간 동안 실험에 사용할 흰쥐을 절식시켰으며 움료수는 자유 로이 섭취할 수 있게 하였다.
C2) Rat 수술파정 및 Urine 채취계획 ~ 흰쥐를 ether 로 가볍게 마취시킨 후 좌측대퇴부 정맥에 등속주입 기로 연결된 polyethylene tube(PE-50, CLEA, Japan)
Vol. 36, No. 1, 1992
28 정병화• 엄기 동• 유 영 숙 • 정봉철• 박종세
를 cannulation하였다. 마취가 완전히 맨후 3% man- nitol-saline 용액 을 L2 m//hr외 속도로 1시 간 30분 동안 등속주입하였다.
3% Mannitol-saline 용액을 등속주업하는 동안 rat의 요도에 plastic tube를 삼입하고 blank urine을 채취하였다. 흰쥐의 urine이 나오는 속도가 거의 일 정해졌용을 확인하고 약물을 1 파 같이 투여하였다.
약물투여 후 0~1, 1-2, 2-3, 3-4, 4-5, 5-6. 6-7 시간 간격으로 뇨를 채취하였다. 채취한 뇨는 분석 전까지 ~2 0t 냉동고에 보관하였다.
3) 시간별 Rat Bile 채취방법
Triprolidine과 그 metabolite들의 시 간에 따른 rat bile로의 배설경향을 알아보기 위하여 triprolidine을 경구투여한 후 시 간별로 bile을 채 취 하였다. 그 자세한 실험방범은 다움과 같다.
0) 약물투여 一 흰쥐의 시간별 urine 채취실험파 동 일하게 하였다.
rD Rat의 수술과정 및 Bile 채 취 계 획 一 흰쥐를 ether로 마취시키고 복부의 정중선을 따라 개복한 후 담관을 찾아 polyethylene tube(PE-10, CLEA, Japan) 를 담관에 삼입하고 흑색 수술실로 묶어 고정하였다.
담관에 PE-10 tube 의 삼입이 끝난 후 개복부의 근 육부분과 모피부분을 따로 흑색 수술실로 봉함하였다.
흰쥐가 마취에 서 완전히 깨 면 약물을 40 mg/kg 용량으로 경구투여하였으며 약물투여 후 0^0.5, 0.5-1. 1-2, 2-3, 3-4, 4-5, 5 - 7 시간 동안 담즙을
채취하였다.
Urine 시료 분석방법
내경이 0.5cm언 disposable glass pasteur pipette 에 glass bead룔 넣어서 아래 부분을 막은 다움, 충 분히 세척된 XAD-2 resin을 높이 2 cm 정도로 채워서 만든 후 rat urine 시료 0.3 m/(metabolite의 검출 및 확인을 위하여는 24시간 동안 채취한 urine 5 m/를 사용하였다)를 plastic syringe로 뽑아서 XAD-2 co- lumn에 홀려주면서 내부표준물질(internal standard
: I.S.)로 tripelennamine 6 |ig을 넣어준다. 홀려준 urine은 동량외 중류수로 XAD-2 column을 씻어주고, free와 conjugated compound들을 흡착하고 있는 XAD-2 column에 methan이을 Im / 썩 3번 홀려서 sto- pper가 었는 원심분리 tube에 받는다. 그러고 metha- nol 용액은 vacuum rotary evaporator로 건조시컨다.
residue에 1 m/의 phosphate buffer(pH 7.0) 를 넣고
diethyl ether 5 m/를 사용하여 5분간 shaker에서 흔 들어 추출한다. 혼합된 용액을 2500 rpm에 서 5분간 원심분리하고 freezer에 넣어 buffer층을 얼린 다옴 ether층을 다른 원심분리 tube에 옮긴다. 이 ether층 은 evaporator에서 건조시킨다. buffer층은 다시 녹여 ether로 추출하여 위와 같은 조작을 총 3번 반복한다.
이렇게 하여 모은 residue는 유도체화 반응을 시키기 전에 수분을 제거하기 위하여 vacuum desiccator(P2O5
/KOH) 에 30분간 넣어둔다.
Free form을 추출하고 남은 buffer층은 60t: heating block에 잠시 방처하여 수층위에 남아있는 ether충을 날려보낸다. 수층을 잠시 상온에 방치하여 식히고, co
njugated form을 가수분해를 시키기 위해 P-glucuro- nidase(from E. coli) 25 ^ 를 넣고, 50t 에 서 1시 간 동안 반응시킨다. 가수분해 시킨 후 enzyme의 활동을 정지시키기 위해 potassium carbonate 1 0mg와 free form 분리시와 마찬가지로 tripelennamineO.S.) 6
Mg을 넣고 diethyl ether 5 m/를 사용하여 5분간 sha- ker에 서 흔들어 추출한다. 혼합된 용액 을 2500 rpm 에서 5분간 원심분리하고 一3 0 t의 freezer에 넣어 buffer층을 얼린 다용 ether충은 다른 원섬분리 tube에 옮긴다. 이 ether층은 vaccum evaporator에서 건조시키고 free form외 추출과정파 마찬가지로 총 3번 추출조작을 반복한다. 이렇게 하여 모은 resi- due는 유도체화 반응을 시키기 전에 수분을 제거하기 위하여 vacuum desiccator (P2O5/KOH) 에 30분간 넣어둔다. triprolidine파 그 대사체를 유도체화 반웅 시키기 위해 MSTFA : TMSCK100 : 1) 혼함용액 50
|i/를 추출조작 후 건조시킨 tube에 넣고 6 0 t에서 15 분간 반응시켰다. 반응 후 약간 식힌 다음 반응액을 auto sampler용 vial에 옮기고 GC/MSD에 injection 하였다. urine외 전체적언 analytical procedure를 Scheme 1에 나타내었다.
Bile 시료분석 방법
Rat bile 0.3 m/에 내부표준물질로 tripelennamine
6 |ig 을 넣고 phosphate buffer (pH 7.0) 를 1 m/가한다.
주출용매로 ether를 사용하고 urine의 free form의 추출방범과 같은 방법으로 조작하였다. free form을 주줄하고 남은 buffer층을 60°C heating block에 잠시 방처하여 수층위에 남아있는 ether층을 날려보낸다.
수증의 모든 conjugated form의 parent drug과 meta- bolite들을 가수분해 시키기 위하여 acid hydrolysis로
J. Pharm. Korea
흰쥐에서외 토러프로리딘외 대사 29
(cojiected lo r every hour)
X AD colum n
Trip elennam ine(l S.), 6ug w ash w ith w ater e iu te w iih 3 m l M eO H dry by vacuum evaporator
add 1 mt phosphale b u ife i(p H 7 0) e xtra cl w ith 5 ml clh e r(3 times) shaking lo r 5 min.
co n tfilu g e at 2500rpm , 5 min.
I Free fraction C onjugated iracik>n
(ethereal layor)
evap o ra io {b y va cu u m evaporator) dry at desiccator
d e rlva llz a lio n at 6 0 t . 15 min, (M S TFA TTM S C l-100 1. 50ut)
GC/M SO
(aqueous layer)
add 25 u l of P -glucuronidase Irom E. C oli
hydrolysis a l 50t2 lo r 1 hr.
coolK,CO^ 10mg
Trip elennam ine(I.S .), 6ug extract w ith 5 mt eth e r (3 tim es) shaking lo r 5 min.
centrHuge al 2500rpm , 5 min.
transfer the e lh ereal layer evaporate(by va cu u m evaporaior) dry at desicca to r
derivatization at 6 0 t i , 15 min.
(M S T F /V T M S C U 100;1, 50ul)
Scheme -Sample extraction procedure of urine rat
6N HCl을 150fi/ 넣고 105t:에서 30분간 반응시켰다.
가수분해 시킨 후 urine의 conjugated form외 추출 방범*과 같은 방법으로 조작하였다. rat urine과 마찬 가지로 유도체화 반응을 위하여 M STFA:TMSC1 (100 : 1) 흔함용액 50 m/를 추출조작 후 건조시 킨 tube에 넣고 6 0 t에서 15분간 반응시켰다. 반웅 후 약간 식힌 다옴 반응액을 auto sampler용 vial 에 옮 기고 GC/MSD에 injection 하였다.
rat bile 의 전체적인 analytical procedure 룔 Scheme 2에 나타내었다.
GC-MSD 작동조건
Column은 SE 30(길이 17 m, 내경 0.2 mm, film thickness 0.11 |jm)capillary column을 사용하였고, carrier gas로 H2 gas(1.4 m//min) 를 사용하였다. in
jector temperature는 280t: 였고 split mode (ratio 10
• 1) 로 injection하였으며 분리관의 온도는 150t: 에서 5분간 머무르고 lo t /min 으로 300t 까지 상승시킨 후 300°C에서 3분간 머물도록 하였다.
결과 및 고찰
Metabolite의 검출 및 확인 一 흰쥐에 triprolidine HCl 10 mg을 투여한 후 24시간 동안 채취한 urine을 enz-
T rip e le n n a m in e (I.S ). 6 ug a d d 1 m i p h sophato b utfer(pH 7.0) e xtra ct w ith 5 m l e lh e r(3 lim es) sh a kin g fo r S m in.
c e n tritu g e at 25 0 0 rpm , 5 min.
Froe Ira ciio n
(ethereal layer)
e v a p o ra le (b y vacu u m evaporaior) dry at d e s ic c a lo r
de riva tiza tio n at 6 0 C , 15 min.
(M S T F A /T M S C I-1 0 0 ;1 , SOul)
G C /M S D
I C on)ugaled fraction | (aqueous layer)
add 6N H C l
h yd rolysis a l 1 0 5 t fo r 3 0 min.
cool K jC O j, 10 mg T rip e le n n a m in e (I.S .), 6ug extract w ith 5 m i e th e r (3 tim e s) shaking lo r 5 m in.
c e n trilu g e a l 2 5 0 0 rp m . 5 m in.
tra n sfe r the e th e re a l layer e va p o ra le (b y v a cu u m e va p o ra to r) dry a l d e sicca to r
d e riv a iiz a lio n a l 6 0 1:. 15 m in.
(M S T F A /T M S C I= 1 00:1. 50ul)
Scheme 2 — Sample extraction procedure of bile in rat
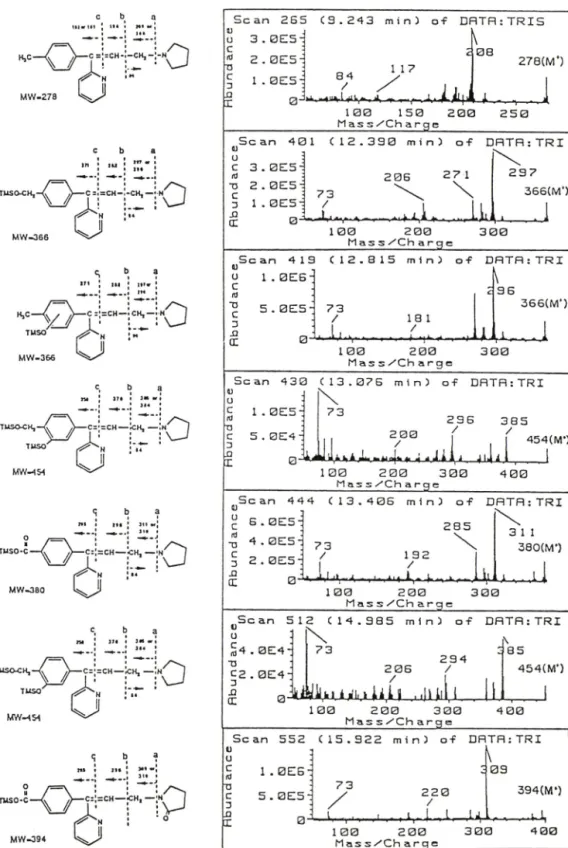
yme hydrolysis 시키지 않은 free fraction만 얻어 유도체화 시키고 GC-MSD외 scan mode를 이용하여 분석한 결과 blank urine에서 나타나지 않는 peak 7 개를 관찰할 수 었었다(Fig. 1). 그 mass spectrum을 Fig. 2에 나타내 었다. peak I은 parent drug인 triproli- dine으로 확인되었으며 peak II는 분자량이 366으로 서 peak I보다 질량이 88이 큰 것으로 보아 수산화 기를 가지고 있어 hydroxymethyltriprolidine으로 생 각되었으며 NCTR에서 합성하여 준 standard로 확 인하였다. peak III는 peak II와 분자량이 366으로 같았으며 mass spectrum도 동일하여 peak II의 이 성체로 생각되었다. peak IV와 peak VI는 분자량이 454이고 peak II, III보다는 분자량이 88이 더 큰 mass spectrum이 관찰되었다. 따라서 peak IV와 VI는 두 개의 수산화기를 가지는 것으로 생각되어 dihydroxy- triprolidine이라 명명하였으며 이 두 peak는 서로 이성질체인 것으로 생각된다. peak V는 분자량이 380 이며 peak II. III 보다 질량이 14가 더 커서 hydroxy- methyltriprolidine에서 더 산화가 일어나 m ethyl기 가 carboxyl기로 전환된 형태일 것으로 추정되어 trip- rolidine carboxylic acid외 peak인 것으로 생각되었다.
Peak VII은 분자량이 394로서, peak V보다 분자 량이 14가 더 큰 것으로 보아 peak V외 대사체에 산화반응이 더 진행된 대사체임을 짐작할 수 있다.
질량스펙트럼을 보면 분자량에서 85, 84가 떨어진 309, 310이 크게 나타났으며 309이온이 base 이온으로
Vol. 36. No. 1. 1992
30 정 병 화• 엄 기 동• 유 영 숙 • 정 봉 철• 박종세
Fig. I — Total ion chromatogram of triprolidine and its metabolites in free fraction of urine. A : blank urine, B : 24 hr urine.
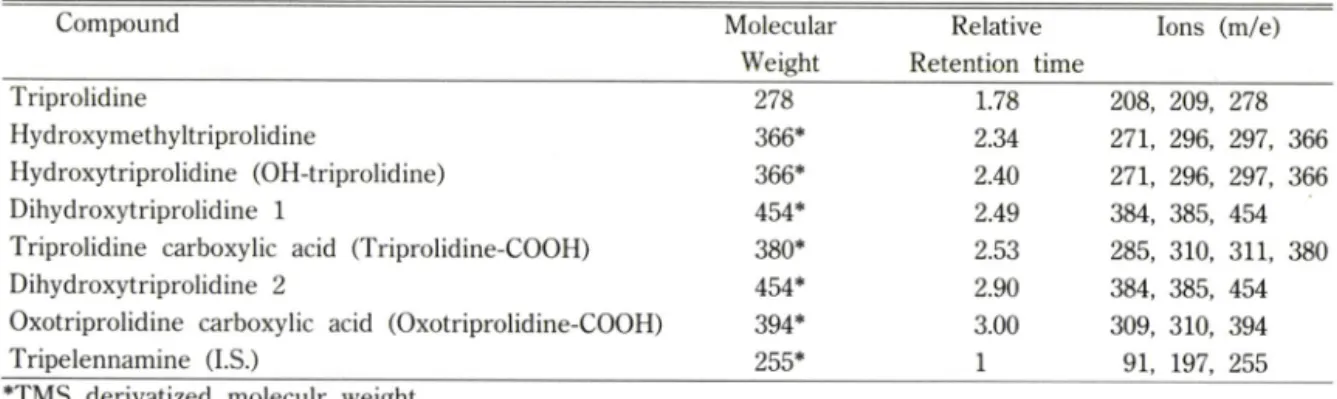
Table I —The relative retention time and characteristic ions of triprolidine and its metabolites
Compound Molecular
Weight
Relative Retention time
Ions (m/e)
Triprolidine 278 1.78 208, 209, 278
Hydroxymethyltriprolidine 366* 2.34 271, 296, 297, 366
Hydroxytriprolidine (OH-triproIidine) 366* 2.40 271, 296, 297, 366
Dihydroxytriprolidine 1 454* 2.49 384, 385, 454
Triprolidine carboxylic acid (Triprolidine-COOH) 380* 2.53 285, 310, 311, 380
Dihydroxytriprolidine 2 454* 2.90 384, 385, 454
Oxotriprolidine carboxylic add (Oxotriprolidine-COOH) 394* 3.00 309, 310, 394
Tripelennamine (I.S.) 255* 1 91. 197, 255
*TMS derivatized moleculr weight
나타났다. 그런네 pyrrobutamine의 대사체인 oxopyr- robutamine외 질량스펙트럼미을 보면 분자량에서 85 이온이 떨어진 이온이 크게 나타난 것으로 보아 peak VII은 triprolidine carboxylic acid 의 pyrrolidine ring에 oxidation이 일어난 것으로 생각되었으며 ni
cotine 및 tremorine효신Ml 서 pyrrolidine ring에 oxida
tion 위처는 질소 옆자리인 2번 위처에서 일어난 것
•으■로 보아 이 대사체도 2번 위처에 oxidation이 일 어났을 것으로 생각되었다. triprolidine으로부터 이돌 대사체로의 대사경로를 추정하여 Fig. 3에 나타내었다.
Rat에서의 Triprolidine과 그 대사체둘의 시간에 따른 Urine으로의 배설경향一 triprolidine과 그 meta
bolite "i! hydroxymethyltriprolidine의 stock solution 을 blank rat urine에 spike하여 urine내외 농도가 각각 5, 10, 25, lOOfig/m/가 되게한 후 urine sample 추출시와 동일한 방범으로 조작하여 검량선을 만들어 rat urine내의 triprolidine과 hydroxymethyltriproli- dine을 정량하였다. 이 때 검량선의 r값은 각각 0.998, 0.997이었다. 정량에 사용한 각 compound의 relative retention time과 characteristic ion을 Table I 에 나 타내었다. 각 시간별로 배설된 urine내외 triproli- dinc과 hydroxymethyltriprolidinc외 urinary excre
tion rate를 구한 결과(Fig. 4) free fraction에서는 tri- prolidine, hydroxymethyltriprolidine 모두 maximum
J. Pharm. Soc. Korea
흰쥐에서의 토리프로러딘의 대사 31
=CH-.-CH,*
i r ■ O MW-278
TUSO-CH,
-
0-1
•CH,-o
IV
-•CHl-
o
:CH — ICKj -
o
VII TMSO-C
< y \
- • C H , -P
U 3 . 0EI5-
^ T3 2 . 0£:5
% 1 . 0 E 5
SIr
S c a n 2 6 5 C 3 . 2 4 3 m i n; D R T R : T R I S
\
C 0 8
0-
8^4 ^ 나
i녀411^ 고, itii ■ ^1^ v^fi. JU u X
278(M')
hL
1 0 0 15 0
Massz-^Charge 200 2 5 0
S c a n 4 0 1 < 12 . 3 3 0
uL)
C 3 . 0E5 p3
75 2 . 0E:5 1 . 0E 5 ccf? 0
2 0 ^
n ) o f D R T R : T R I
2 7 1
i ll
2 3 7 366(M*)
100 20 0
hl a s s ^ ^ Ch a r q e 3 0 0
Rn an 4 1 u0 1 . c
■0c 5 . 0E 5
•Q3
a: 0
)-F D R T R : T R I
\
f 9 6
7 3/ 18 ;
366(M*)
J J U
10 0 2 0 0
M a s s / C h a r g e 3 0 0 S c a n 4 3 0 < 1 3 . 0 ? B
7 3
»i n ! o f D R T R : T R I
1 . 0 E 5 5 . 0E:4
0'
2 3 6 3 0 5
•j 2^0 0 r
•느념 » »,i» A ■괴L■겨■Mjijfc 1, i ,_jiiljLX-
454(M0
_ 1
100
Ma 2 0 0 3 0 0
? /-^Ch a r q e______ 4 0 0 S c an 4 4 4 ( 1 3 . 4 0 5 m i n :) o f D R Tf l : T R I
S . 0E:5- 2 8 5
TJ 다 • 0EI5 ^ 3 5 2 . 0 E 5 J ,
■Q - i i
[92
스고!■< ^ iA I 4i I i-V* ^
38O(M0
1 0 0
M e
200
: x^Ch a r g t 3 0 0 S c a n 5 1 2 C 1 4 . 3 0 5
.
- I. 4
4
0 E
E
00
4
2 u uct i
pMjrwqy
D f l T R : T R I
? 3
2 0 G 2 3 4
i i
8 5 454(M*)
1 0 0 2 0 0 3 0 0
M a s s X C h a r g e 4 0 0 S c a n 5 5 2 < 15 . 9 2 2 mi l 3f D R T R : T R I
uu j \
c 1. 0 E B i 09
■D
C■J 5 . 0E5-j 73
/
2 2 0/ 394(M*)QT 0-^- I마,
100 200
Mas sy Q ha r g e
3 0 0 4 0 0
Fig. 2—Mass spectrum of triprolidine and its metabolites. I. triprolidine. II. hydroxymethyltriprolidine, III. hydrox- ytriprolidine, IV. dihydroxytriprolidine 1, V. triprolidine carboxylic acid, VI. dihydroxytriprolidine 2, VII.
oxotriprolidine carboxylic acid.
Vol. 36, 1992
32 정병 화 • 엄기 동 • 유 영 숙 • 정봉철• 박중세
TrtproMdIn* ( I Hjrdrosym 출 thylirlprelldlna
(Urin*) DlhyttrpKyirlpfolMln* 1 (Urlna.Blla]
TrlproHdin*-COOH { (UrInc.Blla)
hP
O r C P
Oiolrlprolldln*>COOH (
Fig. 3 — Proposed metabolic pathway of triprolidine in rats.
Table II —Maximum excretion rate of triprolidine and its metabolites in rat urine
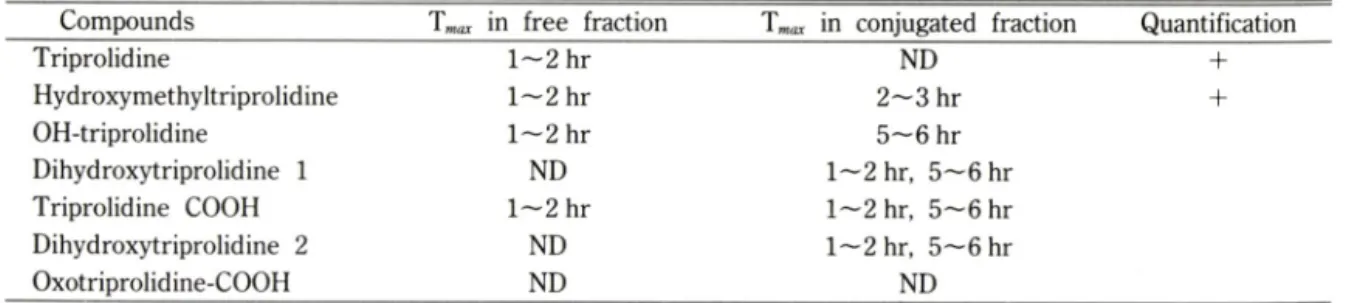
Compounds Tmax in free fraction Tmax in conjugated fraction Quantification
Triprolidine 1 - 2 hr ND +
Hydroxymethyltriprolidine 1 - 2 hr 2-3 hr +
OH-triprolidine 1 - 2 hr 5 ^ 6 hr
Dihydroxytriprolidine 1 ND 1 ^ 2 hr, 5 ^ 6 hr Triprolidine COOH 1 - 2 hr 1—2 hr, 5 ^ 6 hr Dihydroxytriprolidine 2 ND 1 ^ 2 hr, 5 ^ 6 hr
Oxotriprolidine-COOH ND ND
*T„^ : Time interval when maximum excretion rate was observed
*ND : not detected
excretion rate가 약물투여 후 1~ 2 hr에 나타났으며, conjugated fraction에서는 hydroxymethyltriproli- dine의 maximum excretion rate가 약물투여 후 2사3 hr에 나타나, free fraction에 비해 조금 늦어졌다. co
njugated fraction에서는 triprolidine외 peak가 관찰 되지 않았다. rat urine의 free와 conjugated frac- tion 에서 triprolidine 과 hydroxymethyltriprolidine 이외에 다른 metabolite들이 검출되었으나, 다른 me-
tabolite들외 표준물질을 보유하지 못한 관계로 정확한 정량을 할 수 없었다. 그러나 각 시간대의 urine내외 각 metabolite 양을 각 compound 외 height/I.S. hei- ght의 height ratio를 기본으로 하여 계산하여 시간에 따른 urine내의 배설경향만을 살펴볼 수 있었으며, 이 때 각 fraction 에서 관찰된 metabolite들과 그들의 maximum excretion rate의 시간대를 Table II에 나 타내었다.
Pharm. Soc. Korea
T im e (hr)
Fig. 4—Excretion rate of triprolidine and its metabolites.
Ttm « (hr)
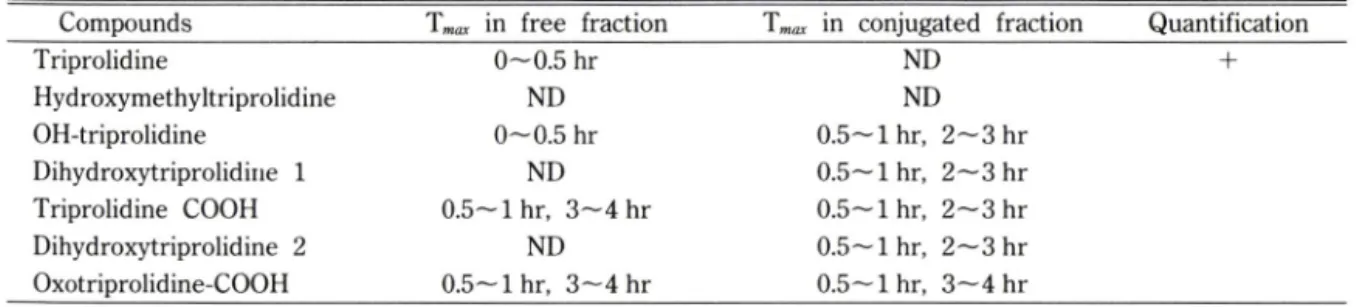
Table III —Maximum excretion rate of triprolidine and its metabolites in rat bile
s o
4 0
3 0
2 0
1 0
0
S' I 5t ic
Tim e (hr) Tim # (hr)
Compounds T„ax in free fraction in conjugated fraction Quantification Triprolidine
Hydroxymethyltriprolidine OH-triprolidine
Dihydroxytriprolidine 1 Triprolidine COOH Dihydroxytriprolidine 2 Oxotriprolidine-COOH
0^0.5 hr ND 0^0.5 hr
ND 0.5^1 hr, 3 ^ 4 hr
ND 0.5—1 hr, 3"^4 hr
ND ND 0.5^1 hr, 2 ^ 3 hr 0.5~1 hr, 2~3 hr 0.5-1 hr, 2 - 3 hr 0.5-1 hr. 2- 3 hr 0.5'-l hr, 3—4 hr
*J„ax: Time interval when maximum excretion rate was
*ND : not detected
observed
Rat에서의 Triprolidine과 그 대사체둘의 시간에 따른 Bile로의 배설경향■채취한 rat bile을 분석한 걸과 free fraction에서 triprolidine의 peak이외에 OH-triprolidine, triprolidine carboxylic acid와 oxot
riprolidine carboxylic add외 peak가 관찰되었으며 rat urine 에서 나타났던 hydroxymethyltriprolidine외 peak는 관찰되지 않았다. conjugated fraction에서는 OH-triprolidine, dihydroxytriprolidine 1, 2, triproli
dine carboxylic acid, oxotriprolidine carboxylic acid 외 peak 가 관찰되었다. triprolidine 외 양은 urine분석시와 마찬가지로 검량선을 작성하여 정량
하였다. 검량선의 농도범위는 이었으며
검량선의 r값은 0.997이었다. rat bile내의 triproli
dine 외 amount를 bile을 채취한 시간간격으로 나누어 excretion rate룔 구한 결과(Fig. 4) triprolidine은 약 물투여 후 30분 이내에 bile로 배설되어 최고 excre- tion rate에 이른 후 bile을 채취한 7시간까지 계속 감소함을 관찰할 수 있었다. bile 분석시에서도 urine의 분석시와 마찬가지로 표준물질이 없어 정량 하지 못한 metabolite들에 대하여는 height ratio를 기초로 하여 계산한 excretion rate로서 시간에 따른 bile로외 배설경향을 살펴보았다.
Vol. 36, No. 1, 1992
흰쥐에서외 트러프로리딘의 대사 55
i c
U0A8X3
34 정병화• 엄 기 동 • 유 영 숙 • 정봉철• 박종세
이 때 각 fraction에서 관찰된 metabolite들과 그 들의 maximum excretion rate의 시간대를 Table III 에 나타내었다.
Triprolidine 과 Hydroxymethyltriprolidine 의 층 Dose에 대한 배설 량의 Percentage —투여된 triproli- dine이 대사되지 않은 parent drug외 형태나 hydrox- ymethyltriprolidine 외 형태로 약물투여 후부터 urine을 채취한 7시간 까지 얼마외 양으로 배설되는지 알아보기 위하여 평균배설량을 총 dose로 나누어 dose에 대한 평균배설량외 percentage를 계산해 보 았다. 그 결과 triprolidine은 free fraction에서 총 dose외 0.85%만이 urine으로 배설되었으며 hydroxy- methyltriprolidine은 free fraction에서 총 dose외 0.
48%, conjugated fraction에서 0.61%만이 urine으로 배설되었다. 7시간 까지 bile로 배설된 triprolidine의 평균배설량은 총 dose외 0.06%로 urine분석시와 마 찬가지로 triprolidine의 매우 적은 양만이 bile로 배 설됨을 알 수 있었는데 triprolidine외 bioavailability 가 4% 정도로 워낙 낮고나그 hydroxymethyltriproli- dine외의 다른 metabolite를 정량하지 못해, 위의 결 과와 같은 낮은 excreted percentage를 얻었다고 생 각된다.
결 론
1. 흰쥐의 urine과 bile에서 triprolidine 및 그 대 사체들을 검출 확인한 결과 rat urine에서는 triproli- dine 및 hydroxymethyltriprolidine, OH-triprolidine, triprolidine-COOH, dihydroxytriprolidine 1, dihyd
roxytriprolidine 2, oxotriprolidine-COOH가 관찰되 었으며, rat bile에서는 triprolidine 및 oxotriproli- dine-COOH, OH-triprolidine, triprolidine-COOH, dihydroxytriprolidine 1, dihydroxytriprolidine 27}
관찰되었다.
2. Rat urine의 free fraction에서외 triprolidine과 hydroxymethyltriprolidine외 최고 excretion rate는 약물투여 후 l"""2hr에서 관찰되었고 conjugated fra- ction에서 hydroxymethyltriprolidine의 최고 excre- tion rate는 약물투여 후 2~3 hr에 관찰되 었다. rat bile에서의 triprolidine의 최고 excretion rate는 약 물투여 후 30분 이내에 최대에 도달하였다가 계속 감소하였다.
3. 정량이 가능하였던 triprolidine과 hydroxymeth- yltriprolidine외 rat urine과 bile로 7시간 까지 배 설된 양을, 투여한 triprolidine dose에 대한 percentage로 계산한 결과, urine에서 triprolidine과 hydroxymeth- yltriprolidine 모두 1% 이하, bile에서는 triprolidine 이 0.1% 이하외 소량만이 배설되었다.
문 헌
1) Gilman, A.G., Goodman, L.S., Rail, T.W. and Murad, F .; The Pharmacological Basis of Therapeutics, Ma
cmillan Pub., New York, pp. 606 (1985).
2) Hansen jr, E.B., Heflich, R.H., Korfmacher, W.A., Miller, D.W. and Cerniglia, C.E.: Microbial transfo
rmation of the antihistaminic drug, triprolidine hy
drochloride, / Pharm. Sci, 77, 259-264 (1988).
3) Haley, T J.: Physical and biological properties of pyrilamine, J. Pharm. Sci, 72, 3 (1983).
4) Lijinsky, W., Renber, M.D. and Blackwell. B.N.: Li
ver tumors induced in rats by oral adminit흰쥐ion of the antihistaminic methapyrilene hydrochloride, Science, 209(15), 817-819 (1980).
5) Green, A.F.: Br. J. Pharmacol, 8, 171 (1953).
6) Becker, E.L, Mota, I. and Wang, D .: Br. J. Pharma
col, 34. 330 (1968),
7) Glassow, F .: Br. Med. / , 1, 217 (1970).
8) Wasserman, H.P.: Dermatologica, 130, 201 (1965).
9) Fowle, A.S.E., Hughes, D.T.D. and Knight, S J .:
Eur. J. Clin. Pharmacol, 3, 215 (1971).
10) Ison, R.R. and Casy, A.F.: Structural influences upon antihistamine activity: 3-amino-l-aryl-l-(2-py- ridyOpropens and related compounds. J. Pharm.
Pharmacol, 23, 848-856 (1971).
11) Findlay, J.W.A., Butz, R.F., Coker, G.G., Deangelic, R.L. and Welch, R.M.: Triprolidine radioimmunoa
ssay : Disposition in Animals and Humans. J.
Pharm. Sci, 73(10), 1339 (1984).
12) Kutzman, R., Sernatinger. E., Tsai, I. and Klutch, A .: An Importance of Fundamental Principles in Drug Evaluation. D. Tedeschi, R. Tedeschi, eds., Raven, New York, pp. 87-103 (1968).
13) Maurer, H. and Pfleger, K .: Identification and dif
ferentiation of alkylamine antihistamines and their metabolites in urine by computerized gas chroma-
/ Pharm. Soc. Korea
흰쥐에서외 트리프로리딘외 대사 55
tography-mass spectrometry, J. Chromatogr., 430, pp. 31-41 (1988).
14) Testa, B. and Jenner, P .: Drug Metabolism; Chemi
cal and Biochemical Aspects., reel Dekker Inc., pp. 25-34
J. Swabrich, eds., Ma- (1976).
Vol. 36, No. I 1992