59
돼지 위축성 비염 단위 백신 개발을 위한 재조합 파스튜렐라 독소 단백질의 면역원성 검정
이 정 민*
성균관대학교 생명공학연구소 (게제승인: 2006년 10월 10일)
Immunogenicity of the recombinant Pasteurella multocida toxin for development of subunit vaccine against swine atrophic rhinitis
Jeongmin Lee*
Institute of Life Science and Technology, Sungkyunkwan University, Suwon 440-746, Korea (Accepted: October 10, 2006)
Abstract :Pasteurella multocida D:4 producing Pasteurella multocida toxin (PMT) is a causal pathogen in atrophic rhinitis in pigs. To investigate the protective immunity and vaccination effect of recombinant PMT, the gene for PMT was isolated from the infective P. multocida D:4. The 2.3 kb XhoI/PstI fragment (PMT2.3) of PMT gene was expressed in E. coli BL21 (DE3) using the induced expression vector system.
The recombinant protein of PMT2.3 having molecular weight of 84 kDa was purified by Ni-affinity column chromatography. The PMT2.3 raised slightly less anti-PMT antibody titer than formalin-killed whole cell, however, it showed more protective immunity against P. multocida D:4 infection in vaccination and challenge.
Key words :atrophic rhinitis, immunogenicity, Pasteurella multocida toxin, subunit vaccine
서 론
Pasteurella multocida는그람음성의토양미생물로서 백여년전 Louis Pasteur가면역화(immunization)에관 한연구재료로 사용한후그이름이명명된병원성미 생물이다. 오랜기간동안이병원균에대한면역화, 균 주의다양성, 감염성및병원성기작등에대해연구되 어져왔지만, 실제로분자수준에서의탐구는최근에이
루어지고있으며, 안전하고효과적인백신의개발은P.
multocida의연구에있어서아직까지가장큰연구영역
이되고있다 [2, 7]. P. multocida는돼지에서위축성비 염(atrophic rhinitis), 토끼에서코막힘(snuffling), 소, 양,
염소등에서폐렴(pneumonia), 닭에서가금콜레라(fowl
cholera)를일으키며, 닭, 칠면조등의가금류에치명적
인조류파스튜렐라병(avian pasteurellosis)을일으키는
것으로알려져있다 [7].
1881년이병원균이처음분리된이후, P. multocida의 검출, 동정, 특성등은형태적특성, 에너지대사특면에 서의탄수화물발효경향, 혈청학적특성등과같은표 현형적특성에따라분리되고있다. 현재P. multocida는
somatic lipopolysaccharide(LPS) 항원성에따라 serotype 1부터 serotype 16의 16가지로, capsular antigen에따라
5가지(serogroup A, B, D, E, F)로분리되고있으며, 각
serotype 또는 serogroup에따라서로다른 기주생물에
서로다른병원성을나타내는데, 가금콜레라의경우에 는 serotype 1, 3, 4가, 위축성비염의경우에는 serogroup
D, serotype 4가주로병원성을나타내는것으로보고되
고있다 [4, 6, 15].
파스튜렐라병을예방하기위해서이미오래전부터
백신접종(vaccination)에의한예방법이시행되어져왔
*Corresponding author:Jeongmin Lee
Institute of Life Science and Technology, Sungkyunkwan University, Suwon 440-746, Korea [Tel: +82-31-290-5269, Fax: +82-31-290-5270, E-mail: jlee@skku.edu]
다. 일반적으로널리이용되는 사독균주인 whole-cell
bacterin의 경우에는 포르말린으로 고정하거나 heat
inactivation의과정을거쳐서사용되는세균백신으로서,
특정한혈청형에대한방어, 즉 serotype-specific protection
을보이므로다양한종류의P. multocida에대한저항성 을부여하기에는어려움이있다. 반면에 attenuated strains
을이용한생균백신(live vaccine)은서로다른혈청형
의균주에대한방어효과는높일수있으나, 변이에의 한병원성획득이라는위험성으로인해완벽한백신접
종에의한예방에는어려움이있다 [2, 7].
돼지의위축성비염은Bordetella bronchiseptica와P.
multocida의복합감염에의해비염과비갑개의위축병
변을특징으로하는돼지의만성호흡기질병으로, 주
로 1개월령이하의어린돼지에감염된다. 폐사율은아 주낮지만감염율은매우높은돼지질병으로, 양돈장 에만연하면발육저하, 사료효율저하로경영에큰문
제를 야기한다 [1, 17]. 주 원인균의 하나인 B.
bronchiseptica는비강점막상피에자극을줌으로써, P.
multocida D형균의정착을허용케하는 정도의역할
을한다. 주요한 병원성은 P. multocida D형의독소에 의해발현되는데이파스튜렐라독소(P. multocida toxin;
PMT)는 dermonecrotic toxin으로서, 비염과더불어간장
과신장에병변을일으킨다 [2, 7, 16]. 그러므로위축성
비염의원인이되는P. multocida D형독소를정제하여
불활화한톡소이드(toxoid) 백신으로제작하여근래에위
축성비염에대한백신으로사용하고있다 [7, 11, 12].
본연구에서는돼지의 위축성비염에대하여 효과적 으로 방제할수있는백신을개발하고자, 위축성비염
에감염된 돼지에서분리한 P. multocida의야외주가
나타내는파스튜렐라독소단백질의유전자를분리, 대 장균내에서과발현을유도하고재조합단백질을정제 하고, 이재조합 파스튜렐라독소의항원성및면역원 성을검정하여, 이를백신개발의재료로사용가능성
에 대해 고찰하고자 하였다. 본연구의 결과는 돼지
의위축성비염을예방하는백신개발에필수적인항 원의 대량 생산을위한 기초 자료로사용될 수있을 것이다.
재료 및 방법
공시 재료 및 균주 배양
연구에사용할 P. multocida균주는서울대학교수의
과대학면역학교실로부터분양받아계대배양하여사 용하였다. 균주의배양은 Bacto brain-heart infusion(BHI) (Difco, USA) agar plate, 또는 5% sheep blood가첨가된 blood agar plate에서 37oC에서배양하였으며, genomic
DNA의추출을위하여균주를 BHI 배지에접종한후
37oC에서 12시간동안현탁배양하였다 [9]. P. multocida
는 통성 혐기성 균으로 분리되며, 액체 배지하에서
aeration이되는현탁배양시에도좋은생장을보이나, 고
체배지(agar plate) 하에서의생장에서는 혐기성 미생
물의특성을 나타내어액체배지에서보다낮은 생존 율을나타내었다. 이러한특성을고려하여균주의분리
시에는고체배지를사용하였으나, 유전자의클로닝을 위한배양시에는액체배지에서현탁배양하여사용하 였다.
파스튜렐라 독소 유전자의 분리
P. multocida의 genomic DNA는 G-DEXTM(Intron Co.,
Korea)를이용하여분리하였으며제조사의방법을따라
수행하였다. 먼저 12시간현탁배양한균주배양액 5 ml
을원심분리(10,000×g, 2분, 4oC)하여세포를모은후, 600µl의 lysis buffer에현탁시켰다. 이를 65oC에서 10
분간 배양한 후 20µg의 RNaseA를 37oC에서 20분간 처리하였다. 200µl의 protein precipitation buffer를넣고 1분간교반한후 4oC에서 10분간반응하였다. 이를원 심분리(10,000×g, 5분, 상온) 한후상층액을 취하여
600µl의 isopropanol과혼합한뒤상온에 10분간방치
하였다. 원심분리(10,000×g, 10분, 4oC)하여 genomic DNA를침전시키고건조후 100µl의증류수에용해하
였으며 0.8% agarose gel에서전기영동하여확인하였
다 [8, 9].
기존의 보고된파스튜렐라 독소 유전자는 National Center for Biotechnology Information(NCBI, National Library of Medicine, National Institutes of Health, Bethesda, MD)에서제공하는 Genbank database에서검
색하여염기서열정보를확인하였고, 이중 X51512로
등록된염기서열을분석하여 PMT 유전자를클로닝할
수있는 PCR primers인 PMT-F(5'-CCCAAACACTGCG AATGTTTGGGG-3')와 PMT-R(5'-TTCCACTGCATCC ACAGCCCTTCT-3')을제작하였다 [3, 14].
PCR은반복수행을통하여조건을확립하고수행하
였다. PCR의총반응액은 50µl로하여 4µl(0.5µg)의
genomic DNA, 2.5µl의 10×Reaction buffer I, 2.5µl의
10×Reaction buffer II, 1 mM dNTPs, 각 20 pmole의 PMT-F 및 PMT-R primers을혼합한후, SuperTaq DNA polymerase(Super-Bio. Co., 한국) 2.5 U을첨가하였다. 먼 저 95oC에서 5분간주형 DNA를변성시킨후 95oC 1
분, 60oC 1분, 72oC 2분 40초의반응사이클을 32회반 복시행하였으며, 마지막에 72oC에서 10분간반응하였
다. 이 PCR 절편을 pGERM-T 벡터에클로닝하고염기
서열을결정하였다.
파스튜렐라 독소 유전자의 발현
3,858 nts에해당하는파스튜렐라독소유전자중에서
5'쪽 1.5 kb가제거된 XhoI/PstI 2.3 kb 절편(PMT2.3)을
pRSET 발현벡터에클로닝하였다(Fig. 1). 이들재조합
유전자발현벡터를대장균 BL21(DE3)에도입하고 IPTG
induction을통하여유전자의발현을유도하였다. 먼저 5
ml의 LB 배지에하룻밤동안배양한재조합균주(PMT-
A, PMT-B, PMT-C, PMT2.3 각각을 포함하는 대장균
BL21(DE3)) 세포를접종한다음 OD600값이 0.5가될때 까지 37oC에서현탁배양하였다. 최종농도가 0.8 mM이
되도록 Isopropyl-β-D-thiogalacto-pyranoside(IPTG)를첨 가하고다시 37oC에서 12시간동안현탁배양하여유전 자의발현을유도하였다. 원심분리로세포를수거하고
전체단백질을 추출하여 10% sodium dodecyl sulfate- polyacrylamide gel에서전기영동(SDS-PAGE)을수행하 였다. 재조합벡터를포함하지않는대장균세포, 발현
벡터(pRSET)만을포함하는균주도동일한방법으로배
양하여재조합파스튜렐라독소유전자발현의대조구 로서사용하였다.
재조합 파스튜렐라 독소의 정제
재조합발현 벡터를 50µg/ml ampicillin이포함된 5
ml의 LB broth에서하룻밤동안배양한 후, 이를다시
50µg/ml ampicillin을함유한 500 ml LB broth에접종하 여 37oC에서 OD590= 0.7 될때까지현탁배양했다. 최
종농도가 0.8 mM이되도록 IPTG를첨가하고, 이를 37oC
에서 12시간 동안배양하였다. 이렇게배양한세포를 4oC에서 5,000×g로 20분간원심분리하여수거한 뒤, pellet을다시 lysis buffer(100 mM NaH2PO4, 10 mM Tris,
8 M urea, pH 8.0)에현탁시키고상온에서 1시간 동안
용해시켰다. 이를 4oC에서 10,000×g로 20분간원심분
리한후상층액을취하여재조합균주로부터 전체단 백질을분리하였으며, 이를시료로하여 Ni-NTA affinity column chromatography (QIAGEN, Germany)를수행하 였다. 시료(10 ml)를 2 ml 부피의 Ni-resin column에적 하한후, 20 ml의 wash buffer (100 mM NaH2PO4, 10 mM Tris, 8 M urea, pH 6.4)로세번반복하여세척하였다. elution은 10 ml의 elution buffer (100 mM NaH2PO4, 10 mM Tris, 8 M urea, pH 4.5)로 2번반복하여수행하
였다. 이상과같이하여분리한단백질의농도는 Bradford
method를이용하여측정하였다 [9].
항원성 검정
대장균에서발현, 정제한재조합파스튜렐라독소단 백질의항원성과저항면역성을알아보기위하여실험
동물인생쥐(CD-1)를이용한면역접종실험을수행하
였으며, 각실험구당 10마리를이용하였다. 음성대조 구로 PBS를사용하였으며(그룹 1), 양성대조구은상업
적으로사용되고있는호흡기질병혼합백신(B. bron-
chiseptica, P. multocida, 그리고Actinobacillus pleuro- pneumoniae의 inactivated whole cell 백신; Daesung microbiological lab. Co., LTD, 한국)을그룹 2로, 연구에 사용한 P. multocida D:4의 formalin-killed whole cell (inactivated bacterin)을그룹3으로사용하였다. 실험구로
는정제한재조합파스튜렐라독소(PMT2.3)를 PBS에 희석하여사용하였다. 먼저각실험군의생쥐에서혈액 을채취한후면역전혈청으로사용하였다. 면역은 각
실험군의항원 100µg을 100µl의 PBS에녹인후, 실험 동물면역시피하주사하였다. 상업용백신의경우, 제
조사의방법에따라수행하되실험동물의중량을감안 하여 1/20 분량의백신(100µg)을접종하였다. 첫번째 면역을수행한후 2주후에 2차면역을수행하였으며, 2차면역후 10일째되는날에실험동물로부터혈액을 채혈하였다. 채혈한혈액은 4oC에서하룻밤동안응고 를시킨후, 원심분리(2,000×g, 20 min, 4oC)하여항혈
청을수거하였다.
항체의 역가를측정하기위하여 ELISA를실시하였
다. 먼저파스튜렐라균주의전체단백질을 10 ug/ml가
되도록 carbonate buffer로희석후 96-well plate에 50 ul/
well로 분주하고 4oC에서 하루 동안 보관하여 항원
coating을 실시하였다. 0.05% Tween 20가 포함된
PBS(PBS-T)로 3번세척한후, 3% BSA가첨가된 PBS- Fig. 1. Physical map of Pasteurella multocida toxin gene
and expression vector. A. PMT (3.9 kb full length of BamHI-PstI fragment), PMT-A (1.5 kb BamHI-HindIII fragment), PMT-B (1.5 kb HindIII-HindIII fragment), PMT-C (0.9 kb HindIII-PstI fragment), and PMT2.3 (2.3 kb XhoI-PstI fragment) were ligated into pRSET expression vectors, respectively. B. Schematic diagram of vector for hyperexpression of the gene in E. coli. under the control of T7 promoter.
T를 200µl씩분주하여실온에서 3시간동안 blocking을
실시하였다. 이를다시 3번세척한후, 각항혈청을 PBS
로 1000배희석하여 1차항체로사용하여 100µl씩분 주한후상온에서 2시간동안반응시켰다. 이를 PBS-T
로 3번세척한후, 2차항체로 anti-mouse IgG peroxidase conjugated(Sigma, USA)를 3% BSA가첨가된 PBS-T로
4,000배희석하여 100µl씩분주한후 37oC에서 1시간
동안 반응시켰다. PBS-T로 3번세척 후, 반응 기질로
dimethyl sulfoxide(DMSO)에녹아있는 3,3',5,5'-tetrame- thylbenzidine(TMB) 시약을 phosphate-citrate buffer와 1 : 10 비율로혼합한뒤, 각 well 당 10µl씩분주하고, 빛 을차단한후 20분간반응시켰다. 발색반응후 650 nm
의필터가있는 ELISA 측정기로흡광도를측정하였다.
Western blot의경우, 재조합 PM2.3 단백질을 10% SDS- polyacrylamide gel에서 전기영동 한 후, nitrocellulose membrane에 100V로 3시간동안전이하였으며, 이후의
항체와의반응과정은 ELISA와동일하게수행하였다.
항체에 의한단백질의검출은 암실에서 chemilumine-
scence reagent(Bio-Rad, USA)를이용하여발색반응으
로확인하였다.
방어적 면역성 검정
면역과채혈이끝난후, 실험동물의방어적면역성
(protective immunity)을알아보기위하여, 본연구에서 사용한위축성비염병원균인P. multocida D:4를 LD50 (5×104 cfu)의 10배양으로 복강내공격접종하였다.
공격접종후 72시간동안실험동물의생존을측정하여
백신으로서의효과, 즉저항성면역을확인하였다.
결 과
파스튜렐라 독소 유전자의 분리, 발현 및 재조합 단백질의 정제
파스튜렐라독소단백질은 1,285개의아미노산으로구
성되어있으며 3,858 nt의 toxA 유전자가암호화하고있
다. 본연구에서는이중 N-말단의약 500여아미노산
부위를제거하고, 중앙 domain부터 C-말단까지 potent
mitogen으로서의독성에관련된부위인아미노산 581
부터아미노산 1,285까지를포함하는파스튜렐라독소
단백질 PMT2.3의발현 벡터를제작하였다(Fig. 1). 이
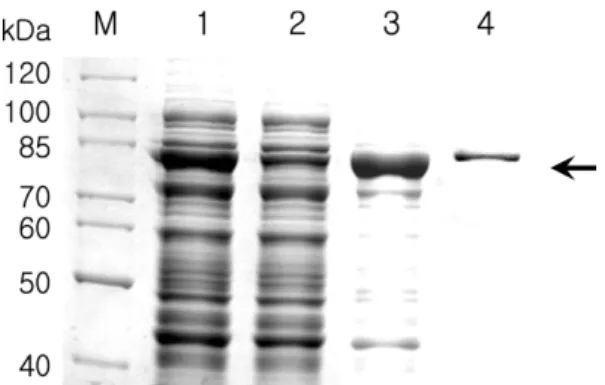
PMT2.3은대장균내에서 IPTG 유도를통하여약 84 kDa
의재조합단백질로서 발현됨을확인할수있었다(Fig.
2). 재조합파스튜렐라독소단백질 PMT2.3는 N-말단
부위에발현벡터에서제공하는 6개의 Histidine을가지
고있으므로, Ni-affinity column chromatography를통하
여정제할수있었다.
항원성 검정
대장균을이용하여발현, 정제된 재조합파스튜렐라
독소단백질 PMT2.3의항원성을알아보기위하여실험
동물(생쥐)를이용한면역실험을수행하였다. 음성대 조구로 PBS를사용하였으며, 양성대조구로는일반적으
로사용되고 있는호흡기 질병혼합백신(inactivated
whole cell)과 본연구에 이용된 P. multocida D:4의 formalin-killed whole cell(inactivated bacterin)을이용하
였다. 실험구는정제한재조합파스튜렐라독소단백질
PMT2.3를 PBS에희석하여사용하였다. 2차에걸친면
역화를수행한후얻어진혈액에서혈청을분리하고재
조합 PMT2.3을항원으로하여 Western blot을수행한
결과, 대조구인 PBS를항원으로면역한 항혈청에서는
PMT2.3에대한항체가검출되지않았으나, 상업용호흡
기질병혼합백신, 불활화한파스튜렐라사균, PMT2.3
을면역한항혈청에서는 PMT2.3에대한항체가검출되
었으며, 특히재조합 PMT2.3을면역한항혈청에서가
장높게검출된것으로보아, 재조합 PMT2.3에의하여
항체생성이효과적으로유도됨을알수있었다(Fig 3).
또한파스튜렐라전체단백질을항원으로하여각항혈
청에대한 ELISA를수행하여항원성을검정하였다. Fig.
4의결과와같이, 음성대조구로서 PBS만을접종한경
우에는 2차에걸친면역후에도항체역가가거의나타 나지않았으나, 상업용호흡기질병혼합백신, 불활화 한P. multocida D:4, 재조합파스튜렐라 독소단백질
PMT2.3을항원으로면역한경우, 모두항원성을가지
며, 항체를유도하는것으로나타났다. 항체역가는호 흡기질병혼합 백신의경우가 비교적낮게 나타났으 며, 불활화한 P. multocida D:4의항체의역가가재조합
Fig. 2. Expression and purification of recombinant PMT2.3 protein. 2.3 kb XhoI/PstI fragment of PMT gene was expressed in E. coli BL21 (DE3) using pRSET B vector.
M, protein molecular weight marker; lane 1, total proteins extracted from E. coli BL21 (DE3) having recombinant expression vector for PMT2.3; lane 2, flow-through of the loaded samples; lane 3, first elution; lane 4, second elution.
파스튜렐라 독소단백질 PMT2.3에비해다소높은것 으로나타났다.
방어적 면역성 검정
재조합파스튜렐라독소단백질 PMT2.3의항원성검
정후, 이재조합단백질에의해유도된항체에의하여 방어적면역성이생성되는지확인하기위하여, 위에서 면역화한실험동물을대상으로, 본연구에서사용한위
축성비염병원균인P. multocida D:4를복강내접종한 후, 72시간동안실험동물의생존을측정하였다. 그결과 를요약하면 Table 1과같다.
PBS로면역화한음성대조구의경우에는모든실험
동물이폐사하여생존율이 0이었으며, 상업적으로이용
되는호흡기질병혼합백신을사용한경우에는 5마리
의실험동물이폐사하여생존율이 50%, 불활화한P.
multocida D:4를면역화한경우에는 2마리가폐사하여 생존율 80%를나타냈다. 재조합파스튜렐라독소단백
질 PMT2.3을단독면역화한실험동물은 1마리만폐사
하여생존율 90%를나타냈다.
고 찰
P. multocida중 serogroup D는위축성비염을일으키 는파스튜렐라독소를생산하는데, 이독소의유전자 (toxA)는 146.5 kDa의단백질을생산한다[12]. 본연구에 서는이유전자를분리하여 N-말단이제거된형태의재 조합파스튜렐라독소유전자를대장균에서과발현을 유도하였다.
재조합 파스튜렐라독소유전자의발현을유도한 결 과, 다양한유전자발현조건실험에도불구하고재조합
파스튜렐라독소유전자의크기가 4 kb 내외의비교적
큰크기로인하여발현율이매우낮으며, 130 kDa 가까
운큰분자량으로인하여분리효율또한매우떨어지 는것을확인하였다(data not shown). 단백질에있어서 항원성을나타내는단백질의부위는비교적작은부위 가항원결정기(antigenic determinant)로서작용하게되 는것이므로, 전제단백질을항원으로사용하는것보다
는 epitope으로서작용하여높은항체가및방어적면역
원성을유도하는하는부위만을선별적으로사용하는 것이백신의제작및정제, 백신효과를높일수있을
것으로사료된다[7]. 본연구에서제작된 PMT2.3은파
스튜렐라독소단백질중 N-말단의 1.5 kb 부위를제거
한 2.3 kb의절단된 파스튜렐라독소유전자의형태로,
대장균내에서 84 kDa의재조합파스튜렐라독소단백
질을생산하며, 이는대장균내에서도높은수준으로안
정적으로발현됨을확인할수있었다(Fig. 2).
면역원성을확인하기 위한항원성검정에서호흡기 질병혼합백신, 불활화한P. multocida D:4와재조합파
스튜렐라독소단백질 PMT2.3 모두항원성을가지며, 항
체를유도하는것으로나타났다. 그러나항체의역가는
호흡기질병혼합백신의경우다소낮게나타났는데, Table 1. Evaluation of protective immunity of the recom- binant PMT vaccinated mice against P. multocida challenge
Immunization
group Number of
dead mice / total mice Survival rate (%)
PBS 10 / 10 0
Commercial vaccine 5 / 10 50
Formalin-killed whole cell 2 / 10 80
Recombinant PMT2.3 1 / 10 90
Fig. 3. Immunoblot analysis of the PMT2.3. Antigenicity of the recombinant PMT2.3 was tested by western blot analysis using anti-PMT2.3 antisera. The PMT2.3 (0.1µg) was loaded on the 10% polyacrylamide gel. The proteins were detected by antisera from mice vaccinated with PBS (lane 1), commercial vaccine (lane 2), formalin-killed whole cell (lane 3), and recombinant PM2.3 (lane 4), respectively.
Fig. 4. Antibody titers in vaccinated mice sera.
Immunizations were performed twice in two-week intervals.
The antisera were collected ten days after second immunization. Titrations of antibody were measured by ELISA using total proteins of P. multocida as a antigen.
이는이혼합백신이 3종의호흡기질환병원균에대한
혼합백신이기때문에, 항원으로사용한파스튜렐라단
일균주에대해서는다소낮은항체역가를나타낸것 으로추정된다. 불활화한P. multocida D:4의항체의역
가의경우, 재조합파스튜렐라독소단백질 PMT2.3의
항혈청의항체역가에 비해다소높은 것으로나타났 다. 항원으로파스튜렐라단백질을사용하였으며, 단일
재조합단백질보다불활화한병원균이더많은항원성 을나타내는분자들을가지므로, 보다많은항체를유도 해내는것으로여겨진다. 또한다양한항원에의해유
도된항혈청은다양한항체를포함하게되므로항원-항 체의교차반응(cross reactivity)에의하여단일항원에의 해유도된항혈청보다높은항체역가를나타내는것 으로사료된다 [7, 18].
방어적 면역성검정을통하여백신으로서의효과를 확인하기위한실험에서는결과적으로재조합파스튜렐
라독소 PMT2.3를백신으로사용한경우, 불활화한병
원균을사용한것과동일이상의백신효과를 볼수있 었으며, 오히려상업용호흡기질병혼합백신의경우는
항원의간섭현상으로인해P. multocida D:4에대한면 역저항성은다소떨어지는것으로확인되었다(Table 1).
PMT2.3은항체의역가가불활하한사균백신보다낮음
에도불구하고동일이상의저항성면역을유도하였다.
이는파스튜렐라의병원성유발의주요원인인 PMT에 대한높은항체역가로인해공격접종시높은방어력을 나타낸것으로여겨진다. 이상의결과를종합하면재조 합파스튜렐라독소단백질 PMT2.3은P. multocida D:4
에대한저항을나타내는항원으로서효과적인백신소 재가될수있다고사료된다. 항체역가와방어적면역성
은일치하는경우도있으나, Gatto 등의연구 [5]에서와
같이병원균에널리존재하는항원으로서높은항원성 을가지나방어적면역성은낮은경우도있다.
단위백신(subunit vaccine)은한가지또는그이상의
순수하거나일부정제된항원으로제조된백신으로정 의할수있으며, 본연구에서사용된재조합파스튜렐라
독소단백질 PMT2.3도단위백신의 일종이다. 이러한
단위백신을사용하면안전성이향상되며, 불필요한단 백질에기인되는항원경쟁성이적어져서면역이요구 되는부위에백신을적용할 수있고, 또한감염동물과
백신접종동물을구별할수있는등여러가지장점이있
다 [10, 13]. 후자의감별진단이가능한백신의장점은
동물체내에서장기간지속감염을할수있는특정질 병을박멸하고자하는국가에서는매우중요하다. 그러 나아직까지단위백신을이용하여상품화된동물백신 은극히드물고대부분병원균을불활화한백신을사용 하고있으므로, 높은항체유도에도불구하고낮은면역
저항성을보이게된다 [7, 14, 18].
위축성비염은P. multocida의감염에의해서돼지에서 발생하는질병으로서국내일반농장에서약 74.9%, 종
돈농장에서약 66%의감염율을나타내고있으며 2001
년기준으로위축성비염에의한경제적손실은약 500
억원수준이상으로추산되고있다 [1]. 또한P. multocida
에대한백신은수입제품이전체시장의 70% 가량을차
지하고있으며, 그나마병원균을멸균하여백신으로사 용하는사균백신또는병원균으로부터직접독소를분 리하고독성을제거하여백신으로사용하는톡소이드 백신이주종을이루고있다. 따라서P. multocida의감염 에의한위축성비염의방역에있어서대장균으로부터 대량생산이가능한재조합파스튜렐라독소단백질의 활용은, 순수정제항원을이용함으로서다른여러항원 의간섭현상없이체액성면역반응을유도할수있기 때문에모체이행항체에의존할수밖에없는자돈의질 병예방에큰도움이될것으로기대되며, 불필요한단 백질로인한항원경쟁성을줄이고, 감염동물과백신동 물을구분할수있는단위백신개발을위한연구로서 중요하다고사료된다.
결 론
P. multocida D:4는파스튜렐라독소를생산하여돼지 의위축성비염을야기하는병원균이다. 본연구에서는
재조합파스튜렐라독소단백질의방어적면역성과백 신으로서의 가능성을검정하고자하였다. P. multocida D:4로부터파스튜렐라독소단백질유전자를분리하고
2.3 kb의절단된 형태의유전자를대장균 내에서발현,
84 kDa에해당하는 재조합 파스튜렐라독소 단백질
PMT2.3을분리하였다. 생쥐를이용한면역실험에서상
업용호흡기질병혼합백신보다불활화한사균백신과
PMT2.3이보다높은항체역가를나타냈으며, 공격접종
을통한방어적면역실험에서 PMT2.3은불활화한사
균백신에비해서항체의역가는낮았으나, 보다높은 백신효과를나타내었다.
참고문헌
1. 지영철, 로승, 한정희, 한태욱.돼지위축성비염백
신의효과에 관한연구. 대한수의학회지 2000, 40, 707-717.
2. Adler B, Bulach D, Chung J, Doughty S, Hunt M, Rajakumar K, Serrano M, van Zanden A, Zhang Y, Ruffolo C. Candidate vaccine antigens and genes in Pasteurella multocida. J Biotechnol 1999, 73, 83-90.
3. Busch C, Orth J, Nabil D, Klaus A. Biological
activity of a C-terminal fragment of Pasteurella multocida toxin. Infect Immun 2001, 69, 3628-3634.
4.Carter GR. Pasteurellosis: Pasteurella multocida and Pasteurella hemolytica. Adv Vet Sci Comp Med 1967, 11, 321-379.
5.Gatto NT, Dabo SM, Hancock RE, Confer AW.
Characterization of, and immune responses of mice to, the purified OmpA-equivalent outer membrane protein of Pasteurella multocida serotype A : 3 (Omp28). Vet Microbiol 2002, 87, 221-235.
6.Heddleston KH, Gallagher JE, Rebers PA. Fowl cholera: gel diffusion precipitin test for serotyping Pasteurella multocida from avian species. Avian Dis 1972, 16, 925-936.
7.Hunt ML, Adler B, Townsend KM. The molecular biology of Pasteurella multocida. Vet Microbiol 2000, 72, 3-25.
8.Kim H, Hwang H, Lee S, Park ES, Yoo SD, Lee J, Yang JS, Kwon M. Molecular cloning and expression of a gene for outer membrane protein H in Pasteurella multocida (A : 3): production of antisera against the OmpH. Kor J Microbiol Biotechnol 2005, 33, 274-280.
9.Lee J, Kang S, Park SI, Woo HJ, Kwon M.
Molecular cloning and characterization of the gene for outer memebrane protein H in a Pasteurella multocida (D : 4) isolate from pigs with atrophic rhinitis symptomes in Korea. J Microbiol Biotechnol 2004, 14, 1343-1349.
10. Liao CM, Huangb C, Hsuan SL, Chenb ZW, Lee WC, Liu CI, Winton JR, Chien MS. Immunogenicity and efficacy of three recombinant subunit Pasteurella multocida toxin vaccines against progressive atrophic rhinitis in pigs. Vaccine 2006, 24, 27-35.
11. Nielsen JP, Foged NT, Sorensen V, Barfod K, Bording A, Petersen SK. Vaccination against progressive atrophic rhinitis with a recombinant Pasteurella multocida toxin derivative. Can J Vet Res 1991, 55, 128-138.
12. Petersen SK, Foged NT. Cloning and expression of the Pasteurella multocida toxin gene, toxA in Escherichia coli. Infect Immun 1989, 57, 3907-3913.
13. Petersen SK, Foged NT, Bording A, Nielsen JP, Riemann HK, Frandsen PL. Recombinant derivatives of Pasteurella multocida toxin: candidates for a vaccine against progressive atrophic rhinitis. Infect Immun 1991, 59, 1387-1393.
14. Rajeev S, Nair RV, Kania SA, Bemis DA. Expression of a truncated Pasteurella multocida toxin antigen in Bordetella bronchiseptica. Vet Microbiol 2003, 94, 313-323.
15. Rhoades KR, Rimler RB. Capsular groups of Pasteurella multocida isolated from avian hosts. Avian Dis 1987, 31, 895-898.
16. Rutter JM. Virulence of Pasteurella multocida in atrophic rhinitis of gnobiotic pigs infected with Bordetella bronchiseptica. Res Vet Sci 1983, 34, 287- 17. 295.Rutter JM, Rojas X. Atrohpic rhinitis in gnobiotic piglets: differences in the pathogenicity of Pasteurella multocida in combined infections with Bordetella bronchiseptica. Vet Res 1982, 110, 531-535.
18. To H, Someno S, Nagai S. Development of a genetically modified nontoxigenic Pasteurella multocida toxin as a candidate for use in vaccines against progressive atrophic rhinitis in pigs. Am J Vet Res 2005, 66, 113-120.