일반현황
우리나라 제약업계 현황을 살펴보면 2013년 기준 총 550개 회사에 이르고, 이 중 320여 개사가 건강보험 청구실적이 있으며, 수입사보다는 제조사가 조금 더 많은 부분을 차지한다.
개별 의약품 품목수는 건강보험심사평가원 (이하 심 평원) 의약품관리종합정보센터에 신고된 2013년 유통 품목수 기준으로 23,705품목 (전문의약품 15,425개, 일반의약품 8,290개)에 이르고, 이 중 건강보험 등재 품목수는 15,734품목 (전문의약품 14,230개, 일반의 약품 1,504개)으로 유통 품목 중 약 67% 정도가 등재 되어 있다.
보험의약품 연도별 등재현황은 선별등재방식 도입이 후 많은 변화가 있었는데, 특히 2007년부터 2년간 미 생산∙미청구된 품목을 약제급여목록에서 삭제함에 따라 20,000여 품목이상에서 15,000품목 수준으로 감 소하였다 (Table 1).
건강보험 총 약품비는 2013년 13조 2천억 원으로 2002년 이후 연평균 약 8.5% 수준으로 증가하였으나, 최고점인 2011년 13조 4천억 원에 비해서는 1.5% 감소 하였다. 또한 총 요양급여비용 대비 약품비 비중은 2008년 29.64%를 기점으로 매년 점차 감소하다가, 2012년 4월 약가재평가 이후 27.11%로 감소하고 2013년에는 26.1% 수준이다 (Fig. 1).
신약 등의 경제성평가 활용과 약가제도 변화
유미영 건강보험심사평가원
특집
약물명 ’ 07.1.1 ’ 08.1.1 ’ 09.1.1 ’ 10.1.1 ’ 11.1.1 ’ 12.1.1 ’ 13.1.1 ’ 14.1.1 Table 1. Number of drugs listed in formulary
등재 품목 수 20,775 15,223 14,900 14,883 14,410 13,814 14,576 15,734 (단위 : 품목)
연간 13조 2천억 원의 약품비 처방 규모는 원내 33.4%, 원외 66.6% 수준이며, 요양기관 종별 청구현 황은 상급종합병원이 13.7%, 종합병원이 9.6% 정도이 다 (Table 2).
제도의 변천
국내 약가제도는 1977년부터 역사가 시작되었는데, 보험등재 제도를 살펴보면, 정부에서 조사한 공장도 출 하가를 기준으로 고시하고, 제조업자의 신고가를 기준 으로 고시를 진행하다 1999년 2월 실무검토 업무가 한 국제약협회에서 심평원 (구 의료보험연합회)으로 이관 되었고, 1999년 8월 국내 제조품목 뿐 아니라 수입의 약품까지 일괄 고시되어 보험등재 목록이 완성되었다 고 볼 수 있다. 1999년 11월에는 실거래가상환제도가 도입되었으며, 2000년 7월 의약분업이 시작되면서, 건 강보험법이 제정되었다.
2006년 5월 전체 의료비 중 약품비의 비중을 줄이고 건강보험재정 안정화에 기여하고자 보건복지부에서는 약가 관리와 함께 적정 사용을 유도하기 위한‘약제비 적정화 방안’ 을 발표하였고, 2006년 12월부터 신약의 등재방식을 네거티브 시스템에서 치료적∙경제적 가치
가 우수한 약제만 선별하여 급여하는 선별등재방식 (positive list system)으로 변경하여 신약의 급여 여 부 및 가격을 경제성평가와 약가협상에 의하여 결정하 게 되었다.
의약품 상환제도에 있어서는 실거래가 상환제의 문 제점을 보완하고자 2010년 시장형 실거래가 제도를 도 입하였고, 2011년 8월에는‘약가제도 개편 및 제약산 업 선진화 방안’ 을 발표하면서 2012년 1월부터 복제약 의 약가산정기준을 전면 개정하여 등재순서에 따라 가 격이 결정되던 계단형 결정방식을 폐지하고 동일성분 동일함량 제품은 동일가로 산정하게 되었으며, 새로운 기준에 따라 기등재 품목에 대하여도 일괄 인하를 시행 하게 되었다 (Table 3).
약제 등재 관리
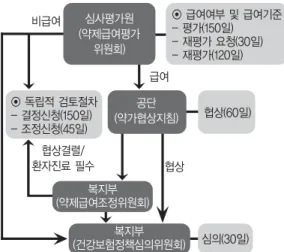
등재 업무 흐름은 크게 두 가지로 구분된다.
우선 평가 절차를 살펴보면 신규성분의 협상대상 신 약의 평가와 개량신약이나 복제약에 해당하는 산정기 준 대상으로 나누어진다.
협상대상 신약의 경우 심평원의 약제급여평가위원회 (이하 위원회)에서 급여적정성 여부를 평가하고, 급여 Fig 1. Medical and drug expenditures, 2002-2013
구분 계 상급
종합병원 종합
병원 병원 요양
병원 의원 치과 병원
치과
의원 약국 한방
병원 한의원 기타 Table 2. Drug expenditures by type of health care institutions
금액 132,413 18,189 12,651 4,538 3,676 4,703 14 73 88,210 20 264 75 비율 100% 13.7% 9.6% 3.4% 2.8% 3.6% 0.0% 0.1% 66.6% 0.0% 0.2% 0.1%
(단위 : 억원)
로 평가된 경우 국민건강보험공단 (이하 공단)에서 제 약사와 약가협상을 진행하여 타결된 경우 최종 보건복 지부에서 약제급여목록을 고시하게 된다. 그러나 산정 기준 대상 약제의 경우 복지부고시에 따라 공단의 협상 절차 없이 심평원에서 약가를 산정한 후 최종 고시하게 된다 (Fig. 2, 3).
1)평가방법은 선별등재 방식으로 운영되므로 보험등재 목록에 등재를 원하는 제약사 등이 결정 신청을 해야 절차가 진행되며, 급여적정성 및 가격 결정 관련 약제 정보, 치료개관, 교과서, 의약품집, 학술지 수재내역,
대체가능 약제와의 비교 경제성 평가자료, 재정 영향 검토, 제외국 등재현황 등 약제의 유용성 및 비용효과 성 자료 등을 제출하고, 그 내용을 평가하게 된다.
약제에 대한 요양급여의 적정성 등을 효율적으로 평 가하기 위해 심평원장의 자문기구 성격을 가진 위원회 가 구성
2)되어 있으며, 52명의 인원 풀을 가지고 매번 회의 개최시 19~21명의 위원이 선정되어 참여하고 있 다. 위원회의 주된 기능은 신약의 요양급여대상 여부, 신약의 요양급여기준, 산정기준 (복제약, 개량신약 등) 약제의 상한 금액 등을 평가하며, 경제성평가소위원회,
연도 주요 내용
Table 3. History of pharmaceutical price regulation
1977. 7 약가기준 제정 - 고시가 (생산가격과 유통거래폭) 1982. 2 약가제도 전면 개정- 고시가 (공장도 출하가와 유통거래폭) 1999. 2 의약품 등재 및 약가산정 업무 이관 (제약협회 → 의료보험연합회) 2000. 7 의약분업 실시, 건강보험법 제정, Negative list 방식 도입 2006.12 선별등재방식 도입(Positive list)
2010.10 시장형 실거래가 상환제 실시 2011. 8 약가제도 개편 및 제약산업 선진화 방안
2012. 1 약가산정기준 전면개정 및 기등재품목 일괄인하 시행(2012.4) - 등재순서에 따라 가격이 결정되는 계단형 방식 폐지 2014. 9 처방∙조제 약품비 절감 장려금 제도 시행
Fig. 2 Flow chart for listing new drug Fig. 3 Flow chart for listing generic drug and
incrementally modified drug
위험분담제 소위원회, 신약 급여기준 자문위원회 등의 소위원회를 구성하여 보다 전문적 검토를 지원하고 있 다.
그간 평가현황은 협상대상 신약의 경우 연간 평균 60~80품목을 평가하였고, 개량신약이나 복제약 등의 산정기준대상은 평균 1,000품목 정도가 평가되었으나, 2012년 이후 약가제도 변경으로 복제약의 가격이 동일 가로 결정됨에 따라 복제약 신청이 급격히 증가하고 있 는 추세이다.
의약품 선별등재 제도는 평가를 통하여 치료적∙경 제적 가치가 우수한 의약품을 선별하여 보험급여 대상 으로 등재시키고 있으며, 신약의 급여적정성 여부 평가 요소로는 대체가능성, 질병의 위중도, 치료적 이익 등 임상적 유용성과 투약비용, 임상효과의 개선 정도, 경 제성평가 결과 등 비용효과성, 대상 환자 수, 예상 사용 량, 기존 약제나 치료법의 대체효과 등 보험재정에 미 치는 영향, 제외국의 등재여부, 등재가격, 급여기준 등 과 기타 보건의료에 미치는 영향 등을 고려하도록 되어 있다.
3)신약의 보험급여 결정은 심평원에서는 경제성과 급 여의 적정성을 고려하여 평가하고 있다,
경제성평가의 경우는 비용효용분석, 비용효과분석, 비용최소화 분석 등의 방법을 이용하여 비용효과성을 입증하고 있으며, 통상 점증적 비용효과비 (ICER : Incremental Cost Effectiveness Ratio)로 결과를 제 출하고 있다.
심평원에서 급여로 평가된 경우 공단에서 제약사와 함께 협상을 진행하게 되는데, 제약사 제출 예상 사용 량을 기초로 신약의 예상사용량을 정하고, 협상 참고사
항 및 참고가격을 기초로 최종 신약의 상한금액을 협상 하여 결정한다. 공단에서는 위원회 평가자료, 협상 약 제가 보험재정에 미치는 영향, 협상 약제의 제외국 가 격, 의약품 공급 능력, 특허 현황, 국내 연구개발 투자 비용 등과 기타 약가협상에 영향을 줄 수 있는 사항 등 을 참고하여 협상한다.
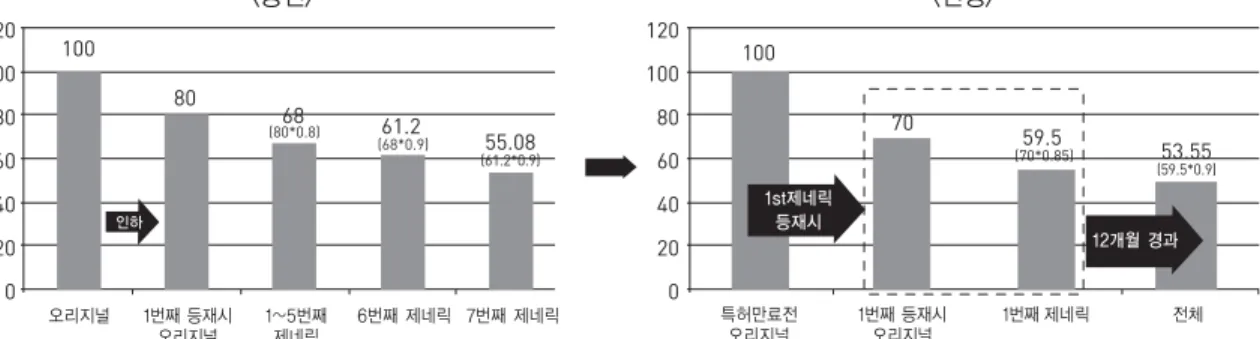
4)특허만료 신약 및 복제약 등의 가격 결정은 복지부장 관이 정하여 고시한『약제 상한금액의 산정 및 조정기 준』 에 의거 2012년 1월부터 산정 및 조정기준을 동일 가 원칙에 따라 변경하고, 가산기준을 신설하였다.
5)산정은 새로이 등재되는 약제 가격을 기존 등재 제품 가격에 비추어 결정하는 것이고, 조정은 이미 등재되어 있는 약제 가격을 사후적으로 변경하는 것이며, 가산은 산정, 또는 조정된 가격에 일정기간 일정 비율을 부가 하는 것을 의미한다.
산정 및 조정기준은 등재순서에 따라 가격이 결정되 는 계단형 결정방식을 폐지하고, 동일제제는 동일가 제 도를 도입한 것이다.
최초 복제약이 등재되는 경우 특허만료 신약의 53.55% 가격으로 복제약과 동시에 인하되는 것을 원 칙으로 하되, 가산 기준을 신설하여 특허만료로 인한 복제약 진입 최초 1년 동안은 특허만료 신약은 70%, 복제약은 59.5% 가격을 유지하는 것으로 고시하였다.
추가적으로 복제약 시장 진입 촉진 및 기술개발에 대한 우대조치로 혁신형 제약기업 또는 원료합성 복제약은 68% 수준으로 가산한다. 다만, 의약품의 공급회사가 3 개 이하인 경우 1년 경과 후에도 가산된 수준의 높은 가격을 유지한다 (Fig. 4).
그러나, 기술개발의 인센티브 부여나 안정적 공급의
Fig. 4 Regulation of patent-off drug price adjustment and generic drug price calculation
<종전> <현행>
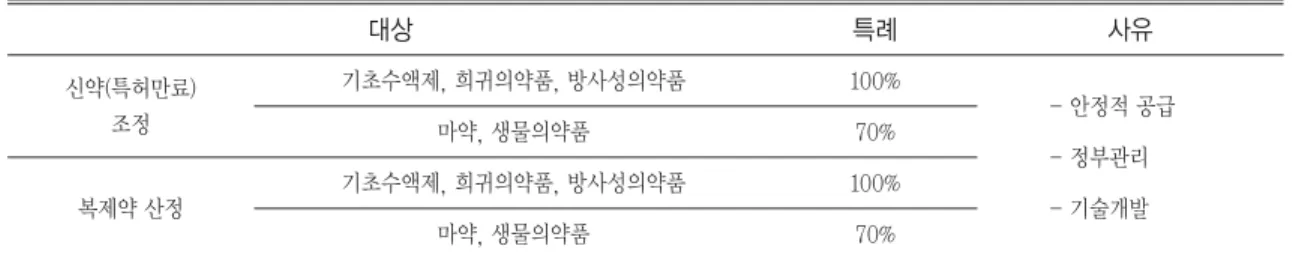
필요성이 있는 기초수액제, 희귀의약품, 마약 등 일부 약제에 대하여는 산정 및 조정특례가 적용되고 있다 (Table 4).
또한 개량신약으로 일컬어지는 자료제출의약품의 경 우 별도의 산정기준이 적용되고 있다. 염변경 또는 이성 체로 개발된 약제나 새로운 제형으로 허가받은 약제와 용법∙용량이 개선된 의약품으로 구분된다 (Table 5).
의약품 경제성평가 및 활용
의약품 경제성평가의 목적은 기존 치료제에 비해 임
상적∙경제적 가치가 우수한 의약품을 선별하여 급여 함으로써 한정된 보험재정의 효율적 관리를 하고자 신 약이 사회적으로 지불할 가치가 있는지 즉 신약 도입에 따른 비용 증가를 사회가 수용할 수 있는지에 대한 판 단 근거로 이용한다. 이러한 경제성평가는 선택 대안들 중 효율적인 대안을 선택함으로써 한정된 자원 하에서 건강 효용은 극대화하고 기회비용을 최소화하고자 하 는데 의의가 있으며, 한정된 자원 할당 시 근거에 따른 의사결정에 중요한 요소로 인식되고 있다.
일반적으로 경제성평가 자료는 비교약제 (치료법)에 비해 효과가 개선되었으나 투약비용이 고가인 경우가
대상 특례 사유
Table 4. Regulation of drug price calculation and adjustment exceptions
신약(특허만료) 조정
기초수액제, 희귀의약품, 방사성의약품 마약, 생물의약품
100%
70%
복제약 산정
기초수액제, 희귀의약품, 방사성의약품 마약, 생물의약품
100%
70%
- 안정적 공급 - 정부관리 - 기술개발
구분 개발목표제품 단독등재 개발목표제품과 그에 대한 동일제제 등재 (특허만료 등) Table 5. Regulation of price calculation for incrementally modified drug
염변경, 이성체, 새로운 제형 개발목표제품의 90% 개발목표제품의 100% (53.33%)
용법∙용량 개선 개발목표제품의 100% 개발목표제품의 110% (58.9%)
제출자료 경제성평가 제출자료
- 약제정보 ∙허가승인내용(국내, 미국, 유럽 등) - 질환정보 ∙역학, 병태생리학 등
∙현재의 치료법
- 임상적 근거자료 ∙교과서, 임상 가이드라인, 임상 논문 등 - 대체가능약제와의 비교자료 ∙적응증, 효과, 비용 등 - 경제성평가자료(PE; pharmacoeconomics) - 보험재정 영향 검토
- 제외국 등재현황
- 관점 : 사회적 /보험자
- 분석기간 : 주요임상결과를 확인가능한 충분한 기간 - 분석대상 인구집단 - 분석기법(CUA, CEA, CMA) - 분석결과 : QALY(Quality Adjusted Life Years) 선호 - 비교대상 : 가장 많이 사용되는 것
- 자료원 : RCT(Randomized Clinical Trial, Randomised Cont- rolled Trial) or SR(Systematic Review) 선호 - 비용 : 직접과 간접 - 결과 : 최종 / 중간 - 효용 : preference based method, 국내자료 선호 - 할인율 : 5% - 불확실성 : 민감도분석 - 일반화, 형평성, 재정영향
Fig. 5 Submission dossier for new drug reimbursement review
* 경제성평가자료 (PE)는 기존 치료법보다 신약이 개선된 경우에 한해 제출
제출 대상이 된다 (Fig. 5).
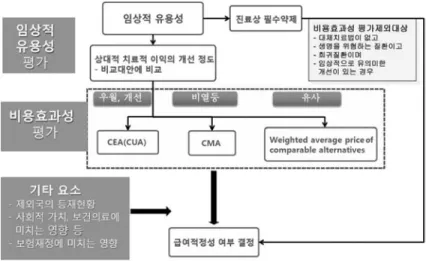
신약의 평가 원칙에 의거 상대적인 임상적 유용성 및 비용효과성이 있는 의약품에 한하여 보험급여가 되고, 환자에게 필요해도 비용효과성을 입증 못하거나, 제약 사∙공단 간 재정 영향 합의 등이 이루어지지 않아 협 상이 결렬되는 경우에는 비급여이다.
신약 보험급여 업무 흐름도에 따라 평가가 이루어지 며, 심평원 위원회에서 제약사에서 제출된 자료를 토대 로 검토된 결과를 평가하여 급여 또는 비급여를 결정한 다.
위원회는 임상적 유용성, 비용효과성 등 급여적정성 평가 요소를 종합적으로 고려하여 임상적으로 유용하 면서 비용효과적인 약제로서 제외국의 등재여부, 등재 가격 및 보험급여 원리, 보험재정 등을 고려할 때 수용 가능하다고 평가하는 경우 요양급여대상약제로 선별할 수 있으며, 대체가능한 치료방법이 없거나 질병의 위중 도가 상당히 심각한 경우로 평가하는 경우 등 환자 진 료에 반드시 필요하다고 판단되는 경우에는 예외규정 이 있다.
3)대체가능한 다른 치료법 (약제포함)이 없는 경우, 생 존을 위협할 정도의 심각한 질환에 사용되는 경우, 희 귀질환 등 소수의 환자집단을 대상으로 사용되는 경우, 생존기간의 상당기간 연장 등 임상적으로 의미 있는 개 선이 입증된 경우의 네가지 조건을 모두 만족시키는 경 우 진료상 반드시 필요한 약제라고 평가하여 비용효과
성 입증 없이도 요양급여대상으로 선별할 수 있다 (Fig. 6).
3)비교대안에 비해 상대적 치료적 이익의 개선 정도에 따라 평가하며, 임상적으로 우월 또는 개선이 입증된 경우 제출된 비용효과성 평가 결과로 점증적 비용효과 비 (ICER, Incremental Cost Effectiveness Ratio) 를 고려하고 있다. 그러나, 명시적인 임계값을 사용하 지는 않으며, 1인당 GDP를 참고범위로 하여, 질병의 위중도, 사회적 질병부담, 삶의 질에 미치는 영향, 혁신 성 등을 고려해서 탄력적으로 평가하고 있기 때문에 결 과 수치에 비례하여 의사결정이 이루어지는 것은 아니 다.
또한 대체약제와 비교 시 임상적 유용성이 비열등한 경우나 경제성평가 자료 제출대상으로 임상적 유용성 및 보험급여 원리 등에 적합하나, 비교약제 대비 비용 효과성을 입증하지 못하여 대체약제 가중평균가를 제 약사에서 수용한 경우는 소요비용 비교대상으로, 이 경 우 분석기간 당 소요비용으로 해당 투약비용 및 허가사 항 상 병용약제, 추가 검사 등이 제시된 경우 해당 비용 (필요시) 등을 포함하여 산출하며, 대체약제 가중평균 가와 비교하여 평가한다.
약제 관련 정책 및 제도
약제비 상환제도는 1977년 고시가 상환제를 시작으
Fig. 6 Reimbursement review process for new drug application
로 1999년 실거래가 상환제를 거쳐 2010년 10월부터 2012년 1월까지 16개월 간 시장형 실거래가 상환 제도 가 시행되었다. 시장형 실거래가 제도는 요양기관이 상 한금액 이하로 약제 구입 시 요양기관과 환자가 혜택을 공유하도록 상한금액과의 차액에 대해 인센티브를 지 급하여 음성적 리베이트, 상한금액으로의 거래 등 기존 실거래가 상환제의 문제점을 해결하고자 도입되었다.
이 제도의 시행으로 시장 경쟁 원리에 의한 투명한 시 장가격 형성, R&D 투자전환 유도로 제약산업 경쟁력 강화, 상한금액 조정으로 보험재정 절감 등의 효과를 기대하였다.
그러나, 대형병원으로 인센티브 쏠림 현상, 의원과 약국의 참여율 저조, 요양기관의 과도한 저가납품 요구 로 유통질서 문란 등의 문제점이 도출됨에 따라 2014 년 1월부터 정부에서는 보험약가 제도 개선 협의체를 운영하여 지속적인 방안 모색의 결과로 2014년 9월부 터 처방∙조제 약품비 절감 장려금 제도가 시행되었다.
이는 기존의 외래처방 인센티브 사업을 확대하여 병∙
의원 및 약국의 전체 처방∙조제 약품비에 대하여 사용 량 감소 뿐만 아니라 저가구매 노력까지 반영한 적극적 장려금 지급으로 총 약품비의 적정관리를 하고자 의료 기관의 입원 및 외래, 약국 약품비까지 확대하여 저가 구매와 함께 처방약 품목수 절감, 저가약 처방 등 의약 품 사용량 감소 실적을 고려하여 장려금을 지급함으로 써 공정하고 투명한 의약품 유통 질서 확립 및 시장 가
격 형성, 실거래가 파악을 통한 상한금액 조정으로 보 험재정 절감 등의 효과를 기대하고 있다 (Fig. 7).
장려금 산정방법은 저가구매 장려금과 사용량 감소 장려금을 합하여 지급 가능하며, 저가구매액 또는 약품 비 절감액에 지급율을 고려하여 산출한 후 반기별로 지 급한다. 지급율은 사용량 감소 정도에 따라 차등지급하 며, 사용량 감소가 상대적으로 낮은 (약품비고가도 지 표 PCI; Prescribing Costliness Index가 2.0 이상) 기관은 장려금 지급대상에서 제외된다. 2015년 상반기 에 요양기관별 처방조제 장려금 산출 및 첫 지급이 시 행될 예정이며, 제도 취지에 적합한 바람직한 결과가 나타나기를 기대한다.
유통질서 문란약제의 제재는 리베이트 제공 등으로 불공정한 의약품 거래행위가 확인되는 경우 약제의 상 한금액을 직권으로 조정하는 제도로 시작되었다. 검찰, 경찰, 식약처, 공정거래위원회 등에서 리베이트 조사결 과가 보건복지부에 통보되면 심평원에서 실무검토를 진행 한 후 그 결과를 반영하여 복지부에서 상한금액 조정 고시를 시행하였다. 상한금액 인하율은‘산출기 간’동안 상한금액 20% 이내에서 요양기관의‘결정금 액’총액 대비‘부당금액’총액비율로 산출하고, 상한 금액 인하 시행일 이후 2년 이내에 유통질서 문란행위 가 다시 발생한 때에는 직전 인하율의 100/100을 가중 하여 인하할 수 있도록 되어 있었다.
그러나 이런 규정에도 불구하고 끊임없이 리베이트
Fig. 7 Project model of incentive for drug expenditure reduction in prescribing and dispensing
사건이 발생함에 따라 리베이트 관행을 근절하고 공정 한 거래질서를 확립하기 위해 2014년 7월 2일 이후부 터 리베이트와 관련된 약제에 대해 상한금액 조정이 아 닌 요양급여의 정지 및 제외 등 리베이트 제재수단을 강화하였다. 리베이트 제공 약제에 대해 1년의 범위에 서 요양급여의 적용을 정지하고, 5년 이내에 다시 동일 한 약제에 대해 리베이트를 제공한 경우 부당금액 1억 원 이상인 경우 요양급여에서 적용 제외까지 하게 되었 다. 조만간 새로운 규정에 따른 적용 사례가 발생할 것 이라는 보도자료가 나오고 있는 상황이다.
기등재 목록정비는 2006년 12월 선별등재 제도 시행 이전 등재된 약제를 대상으로 선별등재 시행에 따른 임 상적 유용성과 비용효과성을 평가하여 급여제외 및 상 한금액 인하 등을 시행한 사업으로 2007년 4월 보건복 지부에서 5년 간 시행계획을 공고하면서 시작되었고, 편두통 치료제와 고지혈증 치료제 2개 효능군에 대하 여 시범평가를 시행하였으며, 그 결과를 바탕으로 2010년 10월 신속정비 방식으로 전환하여 최종 2014 년 1월까지 결과 시행을 완료하였다.
기등재 13,844품목의 전반적인 평가결과는 563품목 급여제외, 3,812품목 약가인하 등으로 7,611억 원의 약 품비 절감 효과를 거두었다. 이러한 정비 과정에서 임 상적 유용성 평가결과가 미흡한 일부 품목에 대하여 일 정기간 급여를 유지하되, 2013년 12월까지 임상적 유 용성 입증을 조건으로 약가를 20% 인하하는 조건부 급 여를 시행하여 2014년 7월까지 임상시험 결과 게재논 문의 적절성을 평가하였다. 입증을 못한 경우 약품비의 10%를 상환토록 하였으나, 공고된 기한 내에 자료 제
출이 되지 않은 일부 품목에 대한 급여 삭제 관련 논란 이 되고 있다.
추가적으로 2012년 1월『약제상한금액의 산정 및 조 정기준』 개정에 따라‘재평가대상 약제 상한금액 조정 기준’ 을 전문 제정하여 동일제제는 동일한 약가로 산 정한다는 취지로 기등재된 품목에 대해 동일제제 상한 금액 중 최고가의 53.55%로 일괄인하 조치함에 따라 6,506 품목에 대해 22% 수준이 인하되어 연간 1조 7천 억 원에 해당하는 금액이 절감되었다.
이 외 약가조정 기전으로 퇴장방지의약품 제도가 운 영되고 있는데, 이는 유일하게 의약품 가격을 인상해주 는 기전으로 환자 진료에 필수적인 의약품에 대하여 생 산원가를 보전해줌으로써 생산차질 없이 사용을 장려 하는 목적으로 시행되고 있다.
저가약 대체조제 인센티브 제도는 의사가 처방한 의 약품보다 저가인 생물학적동등성 인정품목으로 약사가 대체 조제한 경우 처방의약품 상한금액과 조제의약품 의 실구입가 간 차액의 30%를 약사에게 인센티브로 지 급하는 제도로 2014년 9월 기준 대체가능한 의약품 수 는 7,525품목에 달하나, 동일제제 동일가 등의 제도 변 화까지 작용하여 2013년 시행 현황은 인센티브 지급액 이 1억 8천만 원 정도에 불과하여 활성화되기는 어려 운 실정이다.
끝으로 사용량∙약가 연동제도는 크게 두 가지 방향 으로 운영된다.
우선 사용범위 (급여기준) 확대로 사용량 증가가 예상 되는 약제에 대하여 복지부장관이 고시한 사용량을 초 과한 약제를 대상으로 사용범위 확대에 따라 예상되는
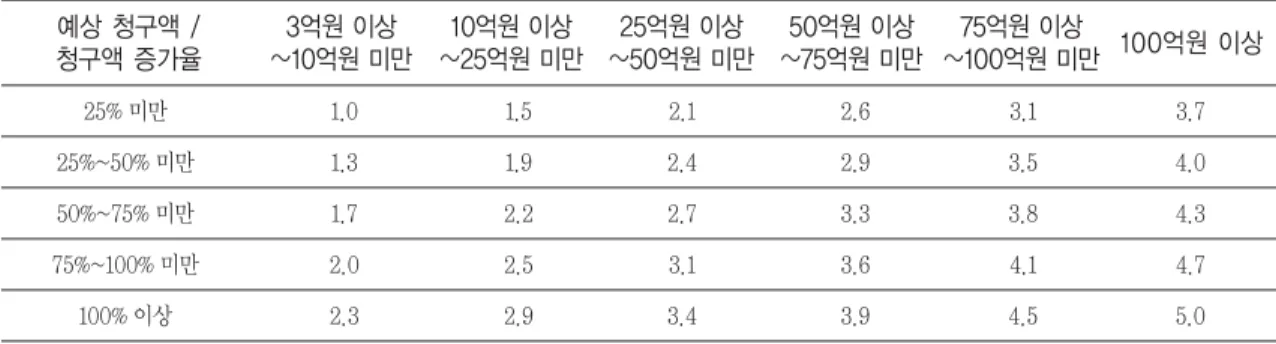
예상 청구액 /
청구액 증가율 75억원 이상 100억원 이상
~100억원 미만 50억원 이상
~75억원 미만 25억원 이상
~50억원 미만 10억원 이상
~25억원 미만 3억원 이상
~10억원 미만
Table 6. Price adjustment regulation in drug with indication expansion
25% 미만 1.0 1.5 2.1 2.6 3.1 3.7
25%~50% 미만 1.3 1.9 2.4 2.9 3.5 4.0
50%~75% 미만 1.7 2.2 2.7 3.3 3.8 4.3
75%~100% 미만 2.0 2.5 3.1 3.6 4.1 4.7
100% 이상 2.3 2.9 3.4 3.9 4.5 5.0
(단위 : %)
* 청구액 증가율 : 전년도 청구액 대비 예상 추가청구액의 증가율