1)
Submitted 7 July 2008, Accepted 8 August 2008 Corresponding : Moon-Hyun Chung, M.D.
Department of Internal Medicine, Inha University Hospital Shinheung-dong, Jung-gu, Inchon 400-712, Korea Tel : +82-32-890-2202, Fax : +82-32-882-6578 E-mail : mhchungid@paran.com
서 론
쯔쯔가무시병에서 사망률은 치료제가 개발되기 전에는 높았지만(1, 2) 항균제가 도입되면서 2% 이하가 되었다. 현 원 저
유세포분석법으로 조사한 Orientia tsutusgamushi Boryong주의 항균제 감수성
대성병원 내과1, 인하대학교 의과대학 임상의학연구실2, 내과학교실3, 미생물학교실4 김은실1·김미경2·이혜명2·정문현3·이진수3·박재은3·강재승4
In Vitro Antibiotic Susceptibility of Orientia tsutsugamushi strain Boryong Measured by Flow Cytometry
Eun Sil Kim1, Mee Kyung Kim2, Hye Myung Lee2, Moon-Hyun Chung3, Jin-Soo Lee3, Jae Eun Park3, and Jae-Seung Kang4
1Department of Internal Medicine, DaeSung General Hospital, Buchon,2Clinical Research Center, 3Department of Internal Medicine,
4Department of Microbiology, Inha University College of Medicine, Inchon, Korea
Background : Scrub typhus, an infectious disease caused byOrientia tsutsugamushi, is endemic in Korea. With the introduction of tetracycline and chloramphenicol in clinical practice, the mortality due to scrub typhus has markedly decreased. In 1995, scrub typhus poorly responsive to doxy- cycline was reported in Thailand; the need for safe antibiotics for the treatment of scrub typhus acquired during pregnancy or for children is emerging; also, broader spectrum antibiotics having anti-Orientia activity may be preferred for empirical therapy of enteric fever syndrome and for complicated scrub typhus. The anti-Orientia activities of various antibiotics, including recently licensed antibiotics, were investigated by flow cytometry.
Materials and Methods :O. tsutsugamushi strain Boryong was inoculated into the ECV304 cell line.
The infected cells were stained with FS15, a monoclonal antibody reacting against a linear epitope on 56-kDa major outer membrane protein of O. tsutsugamushi. Then the antimicrobial suscep- tibilities were measured by flow cytometry and expressed as a growth index (total mass of Orientia). A concentration at which no further decrease in growth index occurred was defined as the minimal inhibitory concentration (MIC). Microbial susceptibilities to the following antibiotics were measured: quinupristin-dalfopristin (Synercid), levofloxacin, ciprofloxacin, moxifloxacin, metronidazole, linezolid, clindamycin, chloramphenicol, doxycycline, azithromycin, and rifampin.
Results : Considering the usual serum concentrations of rifampin (MIC=0.025-0.05 µg/mL), azithromycin (MIC=0.05-0.5 µg/mL) and doxycycline (MIC=0.05-0.1 µg/mL), these antibiotics exhibited very low MICs. Synercid (MIC=0.2-1.0 µg/mL), clindamycin (MIC=1.0 µg/mL) and chloramphenicol (MIC=1-2 µg/mL) exhibited moderately low MICs; moxifloxacin (MIC=8 µg/mL), ciprofloxacin (MIC=25.6 µg/mL or more) and levofloxacin (MIC=30 µg/mL) exhibited relatively high MICs; and cefotaxime (MIC>50 µg/mL), metronidazole (MIC>30 µg/mL) and linezolid (>30 µg/mL) exhibited high MICs.
Conclusions : Among the new antibiotics, none was superior to doxycycline, azithromycin or rifampin with respect to anti-Orientia activity. Synercid, clindamycin, and moxifloxacin may show moderate therapeutic efficacies in human.
Key Words :Orientia tsutsugamushi, Scrub typhus, Antimicrobial susceptibility, Flow cytometry DOI : 10.3947/ic.2008.40.4.212
재 doxycycline, chloramphenicol, azithromycin이 사용되 고 있고, 다른 항균제의 치료 효과에 대해서는 연구가 적 다.
타일랜드에서 doxycycline에 대한 저감수성 O. tsutsu- gamushi 감염이 보고되고(3, 4), doxycycline의 부작용이 문제가 될 수 있는 임신부나 어린이에서 발생한 쯔쯔가무 시병에 대한 언급이 늘어 이들에게도 안전하게 투여할 수 있는 약제도 연구가 더 필요하다. 또한 임상적으로 진단이 불분명하거나 쯔쯔가무시병에 합병증이 생겼을 때에는 광 범위한 항균제가 적절할 것으로 생각되나 doxycycline, chloramphenicol, azithromycin, rifampin은 항균력이 좁다.
현재 사용하는 항균제 이후로 새로 개발된 항균제들이 있 으며 이들이 쯔쯔가무시병에도 항균력이 있다면, 광범위 항 균력이 필요한 경우에 doxycycline이나 azithromycin 대신 사용할 수 있으리라 예상한다. 항균력을 알기 위한 임상 연 구가 이루어지기 위해서는 실험실 결과에서 우수한 항균력 이 증명되어야 하지만, 아직까지 쯔쯔가무시병 치료에서 새 로이 개발된 항균제들의 실험실 연구 결과가 없다. 이에 기 존에 검사가 된 적이 없는 항균제를 중심으로 O. tsutsu- gamushi에 대한 항균력을 검사하였다.
재료 및 방법
실험의 개요는 O. tsutsugamushi Boryong주를 사람 배 꼽정맥 유래 내피세포주(human umbilical vein-derived endothelial cell line)인 ECV304 세포에 감염시킨 후, 이를 단클론항체인 FS15로 염색을 하여 유세포 분석법(flow cytometric assay)으로 최소억제농도를 측정하는 것이다 (5).
이번 실험에서 사용한 O. tsutsugamushi Boryong주는 1990년 환자의 뇌척수액을 쥐에 접종하여 분리한 후 L929 세포 주에서 유지한 혈청형으로 단클론항체에 대한 반응이 기존의 혈청형인 Gilliam, Karp, Kato와 달라 새로운 혈청 형으로 인정받고 있고, 국내에서 발생하는 가장 흔한 혈청 형이며(6), doxycycline에는 감수성이라고 생각한다.
6-well plate에 ECV304 세포를 배양한 후 10% fetal bovine serum이 포함된 M199 medium (pH 7.2)으로 유지 하다가, O. tsutsugamushi 균주를 접종하였다. 감염시킨 양 은 접종 전에 정량화를 했음에도 매번 같게 할 수는 없었 고, 경험적으로 감염되고 3일된 ECV304 monolayer를 떼어 낸 후 glass bead로 2번 갈아 얻은 상청액 9-10 mL 중에서 1mL씩 접종하였다. 접종을 시키고 3시간 후, 항균제가 포 함된 새로운 배지로 교환하였다. 각 항균제마다 저농도에
서 2배씩 증가시켜 항균제 감수성을 검사하였고, 37℃에서 5% CO2 조건에서 3-5일간 배양하였다.
사용한 항균제는 한국 Sigma-Aldrich사에서 Sigma사의 doxycycline hyclate (BioChemika; 순도 98% 이상), chlor- amphenicol (BioChemika; 순도 99%), metronidazole, ri- fampicin (BioChemika; 순도 97%), cefotaxime을 사용하였 고, Fluka사의 azithromycin (BioChemika; 순도 95%), levofloxacin (BioChemika; 순도 98% 이상), ciprofloxacin (BioChemika; 순도 98%)을 구입하였다. Linezolid (Phar- macia & Upjohn Co.), Synercid (Monarch Pharmaceu- ticals), moxifloxacin (Bayer Vital GmbH), clindamycin (Samjin Pharmaceutical Co.)은 실험실 용 항균제를 구할 수 없어 임상에서 사용하는 약제를 사용하였다. Telithro- mycin은 검사용 항균제를 구할 수 없었고, 임상에서 사용하 는 주사용 항균제가 없어 검사를 할 수 없었다.
유세포 분석법은 유세포분석법은, 감염된 ECV304 세포 주 단층을 trypsin으로 처리한 후, PBS로 세척하고 300×g 에서 5분간 원심분리하였다. 얼음 위에서 70% ethanol로 1 시간 고정한 후, flow cytometry 전까지 -20℃에서 보관하 였다. 유세포분석 시, PBS로 세척 후 FITC-conjugated FS15로 반응시킨 후 flow cytometer (Becton Dickinson, Mansfield, MA, U.S.A.)로 분석하였다.
FS15는 O. tsutsugamushi 외막의 56-kDa 단백에 반응 하는 단클론항체로, Boryong, Karp, Kato, Kawasaki, Kuroki, AFSC-4 등에 반응하고 Gilliam, TA678, TA716 혈청형과는 반응을 하지 않는 항체이다(5). Boryong주에 대해 검사했을 때 다른 단클론 항체에 비해 형광이 강하여 유세포분석에 사용하였다.
감염된 전체 균 수를 계산하기 위해 형광이 양성인 세포 수(infected cell, %)에 평균 형광 정도(mean fluorescence intensity)를 곱하여, 성장 지수(growth index)로 표현하였 다. 항균제가 포함되지 않은 배지에서 키운 경우의 성장 지 수를 100으로 하여 항균제 처리를 한 배지에서 보인 성장 지수를 비율로 환산하여 백분율(%)로 나타냈다. 성장 지수 가 더 이상 낮아지지 않는 농도(3)를 최소억제농도로 하였 고, 이 기준을 적용시키기 어려울 경우에는 10% 이하로 된 항균제 농도(MIC90)를 최소억제농도로 정의하였다.
결 과
유세포분석법으로 검사한 항균제 중에서 대표적인 5개 항균제의 Boryong 주에 대한 항균제의 농도별 성장지수 (growth index)를 표시하였다(Fig. 1-5). 항균제 농도가 증
가함에 따라 감염된 세포수와 성장 지수가 점차 감소를 하 다가, 농도가 더 높아져도 성장 지수가 더 감소를 하지는 않고 오히려 약간 증가하거나 같은 성장 지수를 보였다 (Fig. 1, 2). 이런 경우에는 최저를 보인 농도를 최소억제농 도로 정할 수 있었다.
Doxycycline은 2번 실험했으며, 최소억제농도는 0.05 µg/mL와 0.1 µg/mL으로 나왔다(Table 1). 자료 표현의 편 의를 위해 항균제 농도별로 성장 지수의 평균을 구했으며 0.1 µg/mL에서 2.1%의 성장 지수를 보인 후, 0.2 µg/mL에 서 3.0%로 증가하여 0.1 µg/mL을 최소억제농도로 정하였 다(Fig. 1). 그러나 처음 검사의 성장 지수가 값이 작고 두 번째 검사에서 성장지수가 커서 평균을 구하니 두 번째 결 과만을 반영하게 되어, 최소억제농도가 0.1 µg/mL이 되었 다. 평균보다는 각개 결과가 최소억제농도를 이해하는데 더 좋을 것으로 생각하였다.
Synercid에 대해서는 3번 실험을 반복했으며 최소억제 농도는 0.2-1.0 µg/mL였다(Table 1). 측정치의 평균은 구 하였으나, doxycycline과 같이, 큰 값을 보이는 결과만을 반영하게 되어 평균 값은 1.0 µg/mL이 되었다(Fig. 2).
유세포분석법으로 처음 검사를 한 항균제의 경우에는
최소억제농도를 추정하기가 어려워, 임의로 정한 농도를 정해 2배씩 희석해서 검사를 했고, azithromycin (Fig. 3)이 나 quinolone계열 항균제(Fig. 4)는 검사한 항균제 농도를 벗어나는 경우들이 있어 최저로 낮아지는 농도를 정할 수 없었다. 이런 경우에는 MIC90를 최소억제농도로 하였다.
Azithromycin은 실험을 5번 했는데, 검사한 항균제 농도가 각기 달라 합산을 할 수 없었다. 각 실험을 한 농도별로 성 장 지수를 표시하였고, 최저로 감소한 농도를 정할 수 없 어, 10%이하로 된 농도를 최소억제농도로 했을 때, 한번은 0.05 µg/mL, 또 한번은 0.1 µg/mL이 나왔다. 고농도로 실 Figure 2. Growth index of O. tsutsugamushi strain Boryong at
increasing concentrations of synercid (quinupristin-dalfopristin).
The minimal inhibitory concentration of synercid was 1 µg/mL.
Bars represent means±SD (n=3).
Figure 3. Pooled data on growth indices of O. tsutsugamushi strain Boryong at increasing concentrations of azithromycin.
The minimal inhibitory concentration of azithromycin, which is defined as the growth index less than 10%, is 0.05 or 0.1 µg/mL.
Figure 1. Growth index of O. tsutsugamushi strain Boryong at increasing concentrations of doxycycline. Growth index was calculated by multiplying the number of infected cells with mean fluorescence intensity of these cells. 100% represents the per- centage of infected cells without doxycycline. The minimal inhi- bitory concentration of doxycycline was 0.1 µg/mL. Bars represent means±SD (n=2).
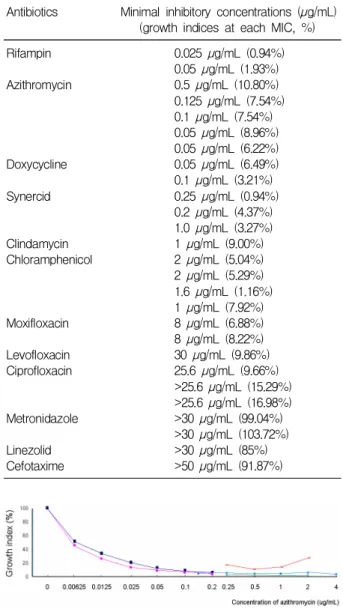
Table 1. Minimal Inhibitory Concentrations ofO. tsutsu- gamushi Strain Boryong to Various Antibiotics
Antibiotics Minimal inhibitory concentrations (µg/mL) (growth indices at each MIC, %)
Rifampin 0.025 µg/mL (0.94%)
0.05 µg/mL (1.93%) Azithromycin 0.5 µg/mL (10.80%) 0.125 µg/mL (7.54%) 0.1 µg/mL (7.54%) 0.05 µg/mL (8.96%) 0.05 µg/mL (6.22%) Doxycycline 0.05 µg/mL (6.49%) 0.1 µg/mL (3.21%)
Synercid 0.25 µg/mL (0.94%)
0.2 µg/mL (4.37%) 1.0 µg/mL (3.27%)
Clindamycin 1 µg/mL (9.00%)
Chloramphenicol 2 µg/mL (5.04%) 2 µg/mL (5.29%) 1.6 µg/mL (1.16%) 1 µg/mL (7.92%) Moxifloxacin 8 µg/mL (6.88%) 8 µg/mL (8.22%) Levofloxacin 30 µg/mL (9.86%) Ciprofloxacin 25.6 µg/mL (9.66%)
>25.6 µg/mL (15.29%)
>25.6 µg/mL (16.98%) Metronidazole >30 µg/mL (99.04%)
>30 µg/mL (103.72%) Linezolid >30 µg/mL (85%) Cefotaxime >50 µg/mL (91.87%)
험한 3번에서는 처음 농도부터 억제가 되어 검사한 가장 낮은 농도를 최소억제농도를 하였지만 더 낮은 농도에서도 억제될 가능성이 있으므로 신뢰도가 낮다(Fig. 3). Levo- floxacin은 1번 검사했으며 30 µg/mL에서 9.9%를 보여 이 농도를 최소억제농도로 하였다(Fig. 4). Ciprofloxacin은 25.6 µg/mL에서 성장지수가 9.66%를 보인 경우에는 최소 억제농도로 하였고, 15.29%와 16.98%를 보인 경우에는 최 소억제농도가 25.6 µg/mL 보다 조금 높을 것이라고 판단 하였다.
Linezolid (Fig. 5), metronidazole, cefotaxime은 30 µg/
mL이나 50 µg/mL까지 검사를 했으나 억제를 관찰할 수 없었으며, 이 농도는 사람에서 얻을 수 있는 농도 이상이어 서 더 높은 농도는 검사를 하지 않았다.
위와 같이 정한 최소억제농도를 항균제 별로 정리하였 다(Table).
고 찰
Orientia와 같은 세포내 미생물의 항균제 감수성 검사는 일반 박테리아에 비해 어렵다. 배양세포를 유지해야 하는 어려움 외에도, 세포내 미생물 중 대표적인 chlamydia의 경 우, 감수성 검사에 사용한 세포주에 따른 변수가 있고(7) 항
균제의 세포내 축적률도 고려해야 한다. 또한 리케차에서 항균제 감수성 검사는 많이 시행하는 검사가 아니므로 표 준화도 되어 있지 않고, 검사실 결과와 임상 효과가 일치하 는지도 불분명하다. Orientia에서는 전통적으로 embryo- nated egg model (8)이나 동물 실험(mouse protection assay) (9)을 사용하였으며, Orientia를 접종하여 병을 일으 킨 후 항균제를 투여하여 치유 반응을 보는 것으로 시간이 많이 걸리고 비용과 노동력도 문제가 된다. 생체에서 항균 제 효과를 볼 수 있다는 장점이 있다.
동물 대신 배양세포를 이용하여 검사를 간편하게 한 방법 으로 plaque assay (10)나 microplaque colorimetric assay (11)가 있고, 최근에는 Giemsa염색을 하여 감염된 Orientia 수를 세는 방법(direct microscopic counts of Giemsa- stained cells) (3)을 많이 사용한다. 그러나 Giemsa 측정법 도 감염된 세포 안의 Orientia를 하나하나 세는 것이 많은 노동력을 요구하며 검사자 간 차이가 많은 검사법이어서, 좀 더 객관적인 방법으로 검사할 수 있는 방법에 대한 필요성 이 있었다.
유세포분석법을 이용한 측정은, 세포내 존재하는 병원균 에 대해 면역형광 염색을 하여, 감염된 세포와 감염되지 않 은 세포를 형광에 따라 기계적으로 분리한 후 감염된 세포 를 측정하여 항균제 감수성 검사를 하는 방법으로, O.
tsutsugamushi에서는 Kelly 등(12)이 처음으로 사용하였 다. 간편하므로 다량의 검체를 검사할 수 있고, 자료를 객 관적으로 표현할 수 있는 장점이 있다. 다클론항체를 사용 한 유세포분석법의 민감도는 Orientia에 감염된 세포의 83%, 세포 당 평균 37개의 Orientia까지, 다량 감염된 세포 의 40%까지 검색이 가능하였다(12). 항체를 단클론항체로 바꾸어 검사했을 때, 감염된 세포의 99%까지 검출할 수 있 었다(5). 민감도가 향상되기는 했지만, 최저억제농도에서도 이번 실험에서와 같이 10%정도 이하이지만 약간이나마 성 장 지수를 보여, 박테리아에서 최소억제농도를 측정하는 것과는 다른 양상을 보였다. 잔존하는 Orientia 때문에 어 느 정도 억제를 최소억제농도로 할 것인가에 대해 정하기 가 어려웠다. 일단 더 이상 성장 지수가 감소하지 않는 농 도를 최소억제농도로 정의하였고(3), 절대 수치로는 이전 보고에서 사용한 10% (5)을 기준으로 하였다. 이런 기준의 타당성은 환자에서 반응과 비교해야 하며 환자 수가 적고 관련된 변수가 많아, 이번 연구에서는 조사할 수 없었다.
유세포분석법의 단점으로 검사를 할 때마다 성장지수가 조금씩 다르게 나왔다. 표준화가 되지 않은 방법이기에 당 연한 것이라고 할 수 있으며, 특히 접종량을 항상 일정하게 하지 못함에 따라 감염률이 다양했다. 또 다른 단점은 어떤 Figure 5. Growth indices of O. tsutsugamushi strain Boryong
at increasing concentrations of linezolid. The minimal inhibitory concentration of linezolid was greater than 30.0 µg/mL.
Figure 4. Growth indices of O. tsutsugamushi strain Boryong at increasing concentrations of levofloxacin. The minimal inhibitory concentration of levofloxacin was 30 µg/mL.
항체를 사용하는가에 따라 반응 정도가 달라지는 것으로 FS15는 특이도가 높고 형광이 강한 장점이 있으나, Gilliam, TA678, TA716 혈청형과는 반응을 하지 않으므로 (5), 모든 분리 주에 대해 감수성 검사를 할 수 없다. 또한 이 방법은 형광이 강한 단클론항체를 개발해야 하는 문제 가 선행되어야 하므로, 다른 세포내 미생물에 적용하기가 어렵다. 따라서 단클론항체 개발이라는 중간 과정이 필요 없는 방법을 개발하는 것이 필요하며, 중합효소연쇄반응으 로 미생물의 양을 측정하는 방법(quantitative polymerase chain reaction)을 예로 들 수 있다(13).
이런 단점에도 불구하고, 유세포분석법은 여러 번 실험 을 하더라도 노동력이 덜 필요한 장점이 있으므로 다량의 검체를 검사할 수 있고, Giemsa염색에서 나타나는 봉입체 를 세는 데서 오는 검사자 오류를 피할 수 있고, 자료가 객 관적이라는 장점이 있어, 여러 항균제의 O. tsutsugamushi 에 대한 최소억제농도를 측정하여 비교할 수 있다. 항균제 하나에 대한 최소억제농도 값은 약간의 변동이 있겠지만 여러 항균제에 대해 같은 조건에서 실험을 하므로 최소억 제농도의 비교가 가능하다. 이들 항균제의 혈중농도를 고 려하여 치료 지수(therapeutic index: 혈중농도/최소억제농 도의 비)를 계산하면 사람에서 효과를 추정하는데 도움이 될 수 있으리라 생각한다.
이번 결과는 상당수 항균제에 대해서는 이전의 연구 (14-16)와 일치하였으며, azithromycin에서는 차이가 있었 다. Chloramphenicol에 대한 최소억제농도는 1-2 µg/mL로 기존에 보고된 1.25-2.5 µg/mL와 유사하였고, rifampin은 기존 보고는 0.04-0.005 µg/mL이었고 이번 실험에서는 0.05-0.025 µg/mL으로 유사한 결과를 보였다. Doxycycline 은 기존 보고에서 주에 따라 차이가 있으며 0.01-0.09 µg/mL을 보이는데 이번 실험결과에서는 0.05-0.1 µg/mL 을 보여 어느 정도 일치함을 보였다. Cefotaxime에 대한 최소억제농도는 보고가 없지만 penicillin과 비슷하다고 가 정한다면 이번 실험에서 50 µg/mL에서도 억제가 전혀 되 지 않는 것은 이전 보고 결과와 비슷하다고 생각한다. 또한 이들 항균제들은 임상적으로도 증명이 된 약제들이므로, 실험실 결과와 임상 효과와도 일치한다고 할 수 있다.
Ciprofloxacin에 대한 최소억제농도는, 혈청형에 따라 차 이가 크지만 기존 보고에서 6.25-25 µg/mL로 이번 실험결 과인 25.6 µg/mL내외보다 조금 낮았다. 혈청형에 따른 차 이일 수도 있고, 퀴놀론 제제는 세포내 침투가 우수한 약제 이기에 사용한 세포주 차이에 따라 세포내 농도가 달라졌 을 가능성도 있다. Ciprofloxacin은 평균 혈중농도가 2-4 µg/mL이므로 혈중농도/최소억제농도 비로 보면 퀴놀론 제
제는 쯔쯔가무시병의 치료에는 그리 우수한 약제가 아니라 고 할 수 있다. 세포내 농도는 더 높기에 임상적으로 반응 을 보였을 것으로 생각되며, 이전 임상 보고가 경우에 따라 효과가 있기도 하고(17) 없기도 한(18-20) 이유로 생각된 다. 국내 연구에서는 70%의 효과를 보고하고 있어(21), 전 체적으로 보면 이 정도에서 효과를 보일 것으로 생각하며, 초기에 치료를 한 환자들에서는 반응을 하는 반면 후기 환 자에서는 반응이 없을 것으로 생각된다. Moxifloxacin의 최소억제농도가 ciprofloxacin보다 낮지만 임상에서 투여양 이 ciprofloxacin보다 적으므로 임상적으로 크게 차이가 있 지는 않으리라 생각하지만, 2번 검사에서 같은 결과가 나 와 임상적으로도 어느 정도 일정한 효과를 보이리라 생각 한다.
Clindamycin에 대한 최소억제농도는 이전 보고에서는 다른 단클론항체(M686-13)를 사용하여 면역형광법으로 측 정하여 최소억제농도가 1 µg/mL로 보고하여(22), 이번 조 사 결과인 1 µg/mL와 같은 결과를 보였다. Clindamycin 600 mg 투여 시 평균 혈중농도가 6-14 µg/mL인 것을 고 려하면, 환자에 따라 혈중농도가 낮은 사람에서는 반응이 늦고 혈중농도가 높은 사람에서는 적절한 치료 반응이 나 올 것으로 생각된다. 혈중농도가 낮은 사람이 있으므로, 용 량은 600 mg 보다는 900 mg 정도를 사용해야 사람별 혈중 농도의 차이를 극복하고 일정한 효과가 나타날 것으로 예 상한다.
반면 차이를 보이는 결과도 보이는데 azithromycin은 기 존의 결과에서는 최소억제농도가 0.01 µg/mL정도였지만 (3) 이번 연구에서는 0.05-0.5 µg/mL로 5-10배 차이가 있 다. Azithromycin은 세포내 농도가 높은 항균제로 세포 종 류에 따라 세포내 농도 차이가 크므로, 당시 사용했던 세포 주와 이번 연구에 사용한 세포의 차이일 가능성이 있고, macrolide는 pH에 따라 실험실 항균력 차이가 많이 나므로 pH 차이에 의해서일 수도 있다.
이전에 검사된 적이 없는 항균제인 synercid (quinu- pristin과 dalfopristin의 30%:70% 조합)가 Orientia에 항균 력을 보인다는 것은 이번 연구에서 처음으로 밝혀진 것이 며, 통상 용량을 사용할 때 quinupristin의 최고혈중농도가 2.5 µg/mL이고, Boryong주의 최소억제농도가 0.25-1.0 µg/
mL이므로, 임상적으로 중등도의 효과가 예상된다.
정리하면, 방법에서 장점과 단점을 고려해야 하지만, 기 존에 사용하던 doxycycline, chloramphenicol, azithromy- cin, rifampin은 최소억제농도가 낮아 효과가 우수할 것으 로 생각되며, 새로운 항균제 중에서는 synercid, clindamy- cin, moxifloxacin이 비교적 최소억제농도가 낮아 임상적으
로도 어느 정도 치료 효과를 보일 것으로 생각된다.
참 고 문 헌
1) Machella TE, Forrester JS. Mite or scrub typhus: a clinical and laboratory study of 64 cases. Am J Med Sci 38:38-61, 1945
2) Sayen J, Pond H, Forrester J. Scrub typhus in Assam and Burma: a clinical study of 616 cases.
Medicine 25:155-214, 1946
3) Strickman D, Sheer T, Salata K, Hershey J, Dasch G, Kelly D, Kuschner R. In vitro effectiveness of azi- thromycin against doxycycline-resistant and -sus- ceptible strains of Rickettsia tsutsugamushi, etiologic agent of scrub typhus. Antimicrob Agents Chemother 39:2406-10, 1995
4) Watt G, Chouriyagune C, Ruangweerayud R, Watchara- pichat P, Phulsuksombati D, Jongsakul K, Teja- Isavadharm P, Bhodhidatta D, Corcoran KD, Dasch GA, Strickman D. Scrub typhus infections poorly responsive to antibiotics in northern Thailand. Lancet 348:86-9, 1996 5) Kim MJ, Kim MK, Kang JS. Improved antibiotic susceptibility test of Orientia tsutsugamushi by flow cytometry using monoclonal antibody. J Korean Med Sci 22:1-6, 2007
6) Chang WH, Kang JS, Lee WK, Choi MS, Lee JH.
Serological classification by monoclonal antibodies of Rickettsia tsutsugamushi isolated in Korea. J Clin Microbiol 28:685-8, 1990
7) Suchland RJ, Geisler WM, Stamm WE. Methodologies and cell lines used for antimicrobial susceptibility testing of Chlamydia spp. Antimicrob Agents Che- mother 47:636-42, 2003
8) Smadel JE, Jackson EB, Cruise AB. Chloromycetin in experimental rickettsial infections. J Immunol 62:49- 65, 1949
9) Wong SC, Cox HR. Action of aureomycin against experimental rickettsial and viral infections. Ann NY Acad Sci 51:290-305, 1948
10) McDade JE. Determination of antibiotic susceptibility of Rickettsia by the plaque assay technique. Appl Microbiol 18:133-5, 1969
11) Raoult D, Roussellier P, Vestris G, Tamalet J. In vitro antibiotic susceptibility of Rickettsia rickettsii
and Rickettsia conorii: plaque assay and microplaque colorimetric assay. J Infect Dis 155:1059-62, 1987 12) Kelly DJ, Salata KF, Strickman D, Hershey JN.
Rickettsia tsutsugamushi infection in cell culture:
antibiotic susceptibility determined by flow cyto- metry. Am J Trop Med Hyg 53:602-6, 1995 13) Branger S, Rolain JM, Raoult D. Evaluation of
antibiotic susceptibilities of Ehrlichia canis, Ehrlichia chaffeensis, and Anaplasma phagocytophilum by real-time PCR. Antimicrob Agents Chemother 48:
4822-8, 2004
14) Miyamura S, Sato N, Tamura A. In vitro suscepti- bility of recent clinical isolates of Rickettsia tsutsu- gamushi to chemotherapeutic agents. Kansenshogaku Zasshi 59:486-8, 1985
15) Miyamura S, Ohta T, Tamura A. Comparison of in vitro susceptibilities of Rickettsia prowazekii, R.
rickettsii, R. sibirica and R. tsutsugamushi to antimi- crobial agents. Nippon Saikingaku Zasshi 44:717-21, 1989
16) Raoult D, Drancourt M. Antimicrobial therapy of rickettsial diseases. Antimicrob Agents Chemother 35:2457-62, 1991
17) Eaton M, Cohen MT, Shlim DR, Innes B. Cipro- floxacin treatment of typhus. JAMA 262:772-3, 1989 18) Jee HG, Chung MH, Lee SG, Kim IS, Chang WH.
Transmission of scrub typhus by needlestick from a patient receiving pefloxacin. Scand J Infect Dis 28:
411-2, 1996
19) Jensenius M, Montelius R, Berild D, Vene S. Scrub typhus imported to Scandinavia. Scand J Infect Dis 38:200-2, 2006
20) Mathai E, Rolain JM, Verghese L, Mathai M, Jasper P, Verghese G, Raoult D. Case reports: scrub typhus during pregnancy in India. Trans R Soc Trop Med Hyg 97:570-2, 2003
21) Oh SY, Chung MH, Oh SJ, Son MS, Ahn SW. An open clinical trial to compare the efficacy of cipro- floxacin, pefloxacin, and doxycycline in the treatment of scrub typhus. Korean J Infect Dis 27:193-8, 1995 22) Kim MK, Odgerel Z, Kim MJ, Chung MH, Lim BU, Kang JS. Application of monoclonal antibody, specific for intracellular Orientia tsutsugamushi, to immuno- fluorescent antibody test for determining antibiotic susceptibility. Microbiol Immunol 48:655-60, 2004